| 1 | АлкоМед на Осеннем бульваре Специализированная клиника | 12.16 0.00 | отзывы | не определено | |
| 2 | Бест Клиник в Спартаковском переулке Многопрофильный медицинский центр | 12.04 0.00 | отзывы | высокие | |
| 3 | Бест Клиник на Новочерёмушкинской Многопрофильный медицинский центр | 11.56 0.00 | отзывы | высокие | |
| 4 | К+31 на Лобачевского Многопрофильный медицинский центр | 11. 0.00 | отзывы | очень высокие | |
| 5 | Поликлиника №6 Лечебно-диагностический центр | 11.04 0.00 | отзывы | высокие | |
| 6 | КБ МГМУ им. Сеченова Многопрофильный медицинский центр | 10.98 0.00 | отзывы | очень высокие | |
| 7 | МЕДСИ в Марьино Многопрофильный медицинский центр | 10.71 0.00 | отзывы | высокие | |
| 8 | Бест Клиник на Ленинградском шоссе Многопрофильный медицинский центр | 10. 0.00 | отзывы | высокие | |
| 9 | МЕДСИ в Бутово Многопрофильный медицинский центр | 10.58 0.00 | отзывы | высокие | |
| 10 | GMS Clinic на 2-й Ямской Многопрофильный медицинский центр | 10.43 0.00 | отзывы | очень высокие | |
| 11 | МЕДСИ на Дубининской | 10.43 0.00 | отзывы | высокие | |
| 12 | ЦЭЛТ на шоссе Энтузиастов Многопрофильный медицинский центр | 10. 0.00 | отзывы | высокие | |
| 13 | НМХЦ им. Пирогова на Нижней Первомайской 70 Многопрофильный медицинский центр | 10.28 0.00 | отзывы | низкие | |
| 14 | МедЦентрСервис на Земляном Валу Лечебно-диагностический центр | 10.25 0.00 | отзывы | средние | |
| 15 | МЕДСИ на Солянке Многопрофильный медицинский центр | 10.24 0.00 | отзывы | высокие | |
| 16 | МЕДСИ на Полянке Многопрофильный медицинский центр | 10. 0.00 | отзывы | высокие | |
| 17 | МЕДСИ в Хорошевском проезде Лечебно-диагностический центр | 10.21 0.00 | отзывы | ||
| 18 | Клинический госпиталь на Яузе Многопрофильный медицинский центр | 10.19 0.00 | отзывы | очень высокие | |
| 19 | Детская клиника МЕДСИ в Благовещенском переулке Детский медицинский центр | 10.16 0.00 | отзывы | высокие | |
| 20 | ФМБЦ им. А.И. Бурназяна на Маршала Новикова А.И. Бурназяна на Маршала НовиковаМногопрофильный медицинский центр | 10.15 0.00 | отзывы | низкие | |
| 21 | Клиника №1 в Люблино Многопрофильный медицинский центр | 10.14 0.00 | отзывы | высокие | |
| 22 | Клиника Столица на Арбате Многопрофильный медицинский центр | 10.11 +0.01 | отзывы | высокие | |
| 23 | Клиника Столица на Летчика Бабушкина Многопрофильный медицинский центр | 10.09 0.00 | отзывы | высокие | |
| 24 | МедикСити на Полтавской Многопрофильный медицинский центр | 10. 0.00 | отзывы | высокие | |
| 25 | МЕДСИ на Ленинградском проспекте Многопрофильный медицинский центр | 10.04 0.00 | отзывы | высокие | |
| 26 | КДС Клиник на Белозерской Многопрофильный медицинский центр | 10.02 0.00 | отзывы | средние | |
| 27 | СМ-Клиника на Клары Цеткин Многопрофильный медицинский центр | 10.00 0.00 | отзывы | высокие | |
| 28 | Клиника Столица на Ленинском проспекте Многопрофильный медицинский центр | 9. 0.00 | отзывы | высокие | |
| 29 | Медицина на Академика Анохина Лечебно-диагностический центр | 9.94 0.00 | отзывы | низкие | |
| 30 | Юсуповская больница на Нагорной Специализированная клиника | 9.93 0.00 | отзывы | высокие |
Каковы перспективы регенеративной медицины | Rusbase
Что такое регенеративная медицина
Регенеративная медицина — это не просто новая технология, а принципиально другое направление медицины. Это направление, которое дает возможность использовать регенеративные свойства и способности нашего организма для восстановления структуры и функций поврежденного органа или ткани.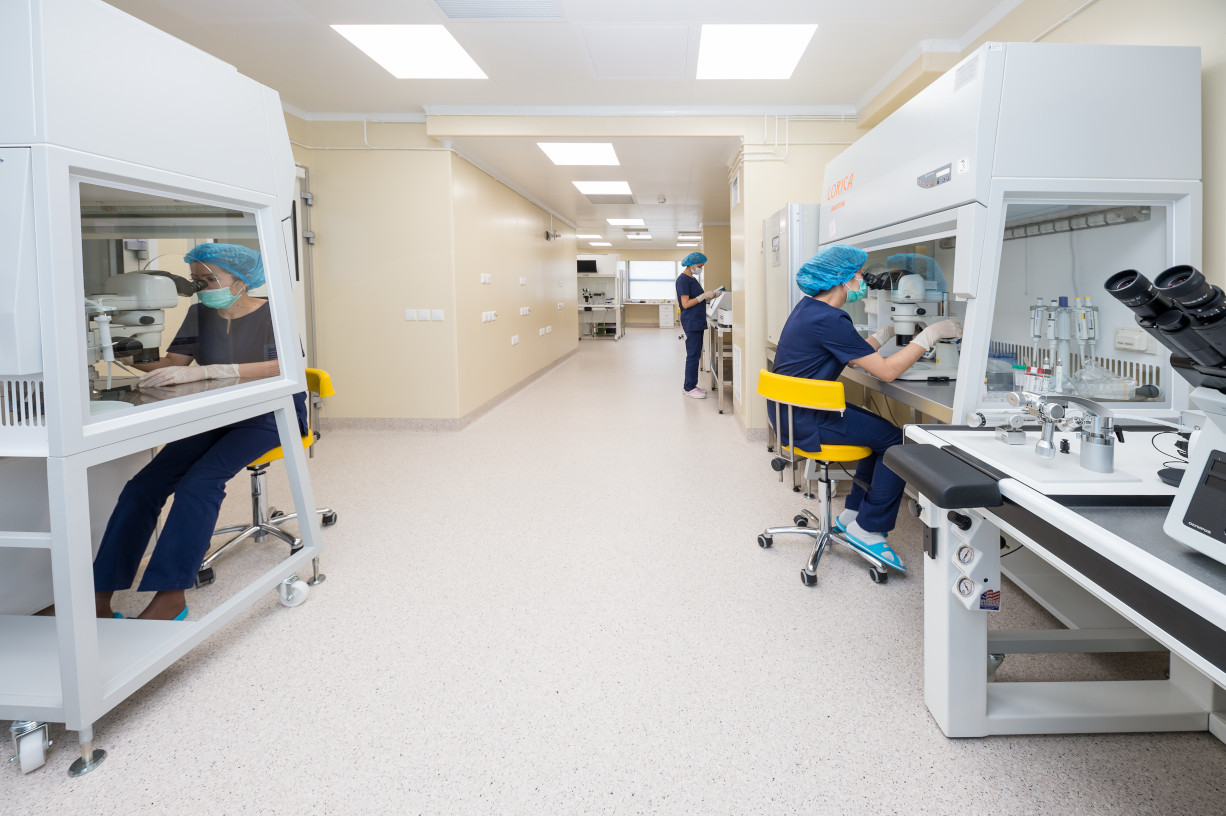
И этот рынок, несомненно, будет бурно развиваться по всему миру. Согласно данным аналитических исследований, в 2018 году общий объем рынка регенеративной медицины составлял $28 млрд и к 2023 году достигнет уровня в $81 млрд. Понимая уникальные перспективы этой области, лучшие ученые всего мира работают над развитием регенеративной медицины. Но не все знают, что начало этого направления во многом было заложено советскими учеными.
Ключевое событие произошло в конце 60-х годов, когда Александр Яковлевич Фриденштейн впервые в мире открыл мезенхимальные стволовые клетки (МСК). МСК — это определенный тип клеток, которые присутствуют в организмах людей и животных и способны не только превращаться в жировые, костные, хрящевые, мышечные и нервные клетки, но также руководить регенеративными процессами тела.
Люди не сразу поняли потенциал этого открытия, но 15 лет спустя Александр Яковлевич стал одним из самых цитируемых ученых Советского Союза. В 1972 году, когда я была молодой аспиранткой, у меня появилась уникальная возможность работать в лаборатории Александра Яковлевича и изучать принципы регенеративной медицины вместе с ним.
Теперь мы знаем, что мезенхимальные клетки руководят регенеративными процессами с помощью особых белков, так называемых цитокинов, или факторов роста. Уже охарактеризовано более чем 300 видов разных белков-цитокинов, что дает нам возможность расшифровывать «язык», на котором клетки разговаривают друг с другом.
Цитокины можно представить как «межклеточные SMS», с помощью которых клетки передают друг другу сообщения, связанные с процессом излечения. Одни белки-цитокины помогают регулировать воспалительный процесс, другие обеспечивают восстановление поврежденной ткани.
Понимая функции конкретных цитокинов, возможно стимулировать лечебный процесс естественным способом. В качестве примера можно рассмотреть продукты на основе белков VEGF, которые вызывают рост сосудов и капилляров. Эти функции крайне важны для лечения трофических язв, особенно у тех, кто страдает диабетом. Нужно отметить, что регенеративный процесс требует комплексной цепочки инструкций, можно сказать, правильного «коктейля» цитокинов.
В качестве примера можно рассмотреть продукты на основе белков VEGF, которые вызывают рост сосудов и капилляров. Эти функции крайне важны для лечения трофических язв, особенно у тех, кто страдает диабетом. Нужно отметить, что регенеративный процесс требует комплексной цепочки инструкций, можно сказать, правильного «коктейля» цитокинов.
Что уже доступно на рынке регенеративной медицины
В специально оборудованных лабораториях уже сейчас возможно произвести такие «коктейли» цитокинов. Десятки компаний на зарубежном и отечественном рынках работают над регенеративными препаратами на основе наших идей с 70-х годов.
Фармкомпании всего мира используют цитокины для производства биолекарств, которые помогают ускорить естественный процесс лечения. К примеру, в Австрии компания Aposcience производит препараты на основе белков-цитокинов для лечения ран, язв, глубоких повреждений кожи, при ожогах и т.д. Международная компания Fresenius Medical Carе ведет программу разработки лекарств на основе цитокинов для пациентов с хронической почечной недостаточностью.
В России компания «Т-Хелпер Клеточные Технологии» за последние семь лет создала уникальную технологическую платформу для производства регенеративных продуктов на основе натуральных белков-цитокинов. Первый такой продукт, «Репарин-Хелпер®» уже вышел в продажу на ветеринарном рынке. Он представляет собой набор определенных цитокинов и зарегистрирован для лечения травм глаз, ран и воспалений у животных.
Компания уже получила патенты на этот препарат в России и в США и ожидает дополнительные патенты в ключевых странах мира. Запатентованная технология производства востребованных цитокинов открывает широкие возможности для сотрудничества с российскими и зарубежными компаниями и разработки новых продуктов «регенеративного» класса.
Функции цитокинов интересны не только фармкомпаниям. Крупные косметические компании составляют коктейли цитокинов для эффективного омоложения и торможения процессов старения кожи. Бренды, которые уже используют такую технологию, включают «TNS Essential Serum®» от американской компании Allergan (недавно поглощена Abbvie), «CellPro GF3» от компании Le Mieux Clinical и другие.
Такие гиганты косметической индустрии, как японская компания Shiseido, вкладывают серьезные ресурсы, чтобы вывести продукты регенеративного класса на рынок. Несмотря на разразившийся кризис, вызванный пандемией Covid-19, глобальный рынок anti-age продуктов продолжает расти и оценивается в $52,5 млрд в 2020 году.
Каково будущее регенеративной медицины
Рынок регенеративной медицины обладает огромным потенциалом. Но, конечно, для его развития, необходимо создание понятной и четкой законодательной базы, технологической инфраструктуры, условий для обучения специалистов в этой области.
В России ведется работа в этом направлении. Еще в 2011 году клеточную технологию официально признали «критической технологией Российской Федерации». В 2016 году был основан институт регенеративной медицины на территории МГУ имени М.В. Ломоносова. В тот же год был принят Федеральный закон «О биомедицинских клеточных продуктах», позволяющий обеспечивать безопасность их применения.
В ноябре 2019 года в Москве прошел IV Национальный Конгресс по регенеративной медицине, где более 1300 специалистов разных стран обсудили самые актуальные вопросы данного направления: от перспектив полноценного восстановления структуры и функций тканей до воссоздания утраченных органов с помощью биоинженерии. Подобные инициативы со стороны государства, науки и индустрии помогут скорейшему становлению и динамичному развитию регенеративной медицины в нашей стране.
Регенеративная медицина будет продолжать бурно развиваться во всем мире. Уже сегодня благодаря достижениям в этой области мы можем лечить то, что казалось невозможным 20 лет назад. Но, несомненно, главные открытия в этой области еще впереди: предстоит победить такие сложнейшие патологии, как склероз, нейродегенеративные и аутоиммунные заболевания, болезнь Паркинсона, болезнь Альцгеймера и многие другие.
В будущем с помощью регенеративной медицины человек сможет обновлять свой организм, именно тогда фантастика станет наконец реальностью.
Фото на обложке: IgorVetushko/depositphotos.com
Москва | Дискуссионный клуб Института регенеративной медицины
21 июня 2018 года прошло очередное заседание Дискуссионного клуба Института регенеративной медицины (ИРМ). В заседании приняли участие студенты Российско-Британской Летней Школы по инновационной хирургии, которая соединила студентов Кембриджа, Оксфорда, Королевского колледжа Лондона, Сеченовского университета, МГУ им. М.В. Ломоносова, а также учащиеся Санкт-Петербургского государственного педиатрического медицинского университета и Тюменского государственного медицинского университета.
Дискуссионный клуб ИРМ Сеченовского университета был создан 27 февраля 2018 года. В состав клуба вошли студенты, которые прошли конкурс в студенческое сообщество ИРМ. Научным направлением этого года выбраны материалы курса «Основы регенеративной медицины 2017» (Wake Forest Institute for Regenerative Medicine), подготовленные участниками дискуссионного клуба.
Все материалы курса переведены на русский язык и дополнены актуальной информацией из современных научных отечественных и зарубежных источников. Формат доклада — это презентация длительностью 20-30 минут, с последующим 30-минутным обсуждением. Всего по курсу регенеративной медицины будет представлено 11 докладов по всем актуальным направлениям в регенеративной медицине.
Цели докладов:
1. Представление материала курса сотрудникам, аспирантам и студентам ИРМ, что позволяет делиться самой актуальной информацией и следить за основными трендами в регенеративной медицине.
2. Обсуждение представленной информации при активном участии профессорско-преподавательского состава ИРМ.
3. Планирование дальнейшей работы студентов по изученной тематике с учетом всех полученных замечаний, с целью опубликования научной статьи по данной работе.
Заседание прошло полностью на английском языке. Стоит отметить, что членам Дискуссионного клуба ИРМ это не составило никаких трудностей: для того, чтобы пройти конкурс в студенческое сообщество, экзаменуемые должны были продемонстрировать свои знания английского языка не ниже upper-intermediate. Это позволило им свободно представить материалы доклада своими иностранными коллегами и провести интересную дискуссию.
Это позволило им свободно представить материалы доклада своими иностранными коллегами и провести интересную дискуссию.
На заседании с докладами выступили студенты Дискуссионного клуба ИРМ: Алина Капитанникова и Александр Конопатов. Тема заседания: «Applications of Perinatal Stem Cells. Cord-Blood Derived Stem Cells». Студенты обсудили основные источники перинатальных клеток, способы их получения, а также возможности их применения в регенеративной медицине. Тема вызвала бурное обсуждение среди участников клуба, и каждый смог высказать свое мнение по поводу аспектов использования такого типа клеток для научных исследований. Один из самых острых вопросов касался этических моментов использования перинатальных стволовых клеток, вместе с которым обсуждалось использование эмбриональных стволовых клеток, а также их преимущества и недостатки по сравнению с индуцированными плюрипотентными стволовыми клетками. Без сомнений, что перинатальные стволовые клетки являются уникальным и перспективными источником стволовых клеток, однако остаются недостаточно изученным, и до возможности их клинического применения необходимо провести еще много доклинических и клинических испытаний.
Студент 5 курса лечебного факультета, председатель Сеченовского Биомедицинского клуба Артем Антошин отметил важность подобных мероприятий, поскольку они способствуют укреплению студенческого взаимодействия на международном уровне, а также создают основу для будущего взаимодействия между молодыми специалистами. Такие международные обсуждения становятся возможными благодаря администрации Сеченовского университета, которая поддерживает международный характер взаимодействия своих студентов и специалистов на самых разных уровнях, и с каждым годом их тесное сотрудничество становится все более активным.
Данный материал опубликован на сайте BezFormata 11 января 2019 года,ниже указана дата, когда материал был опубликован на сайте первоисточника!
В вашем браузере отключен JavaScript.
| ||||
Институт стволовых клеток человека
ПАО «Институт стволовых клеток человека» (ИСКЧ) — российская публичная биотехнологическая компания, основанная в 2003 году.
ИСКЧ занимается разработкой лекарств, исследованиями и разработками, а также маркетингом инновационных патентованных продуктов и услуг в области регенеративной медицины, биострахования, медицинской генетики, включая репродуктивную генетику, генную терапию и биофармацевтику.
Компания стремится формировать новую культуру медицинского обслуживания — развивать новые возможности здравоохранения в таких областях, как персонализированная и профилактическая медицина.
ИСКЧ принадлежит крупнейший семейный банк стволовых клеток пуповинной крови в России и СНГ — Гемабанк ® , а также банк репродуктивных клеток и тканей Репробанк ® (личное хранение и донорство).
Компания выпустила Neovasculgen ® , первый в своем классе генный терапевтический препарат для лечения заболеваний периферических артерий, включая критическую ишемию конечностей, а также представила инновационную клеточную технологию SPRS-терапия ® , , который предполагает использование аутологичных дермальных фибробластов для восстановления повреждений кожи, вызванных старением и другими структурными изменениями.
ИСКЧ реализует социально значимый проект Genetico ® по развитию собственного Медицинского генетического центра и лаборатории для предоставления широкого спектра услуг по генетическому тестированию и консультированию с целью раннего выявления, прогнозирования и профилактики лечение генетических нарушений, в том числе заболеваний репродуктивной системы (например,грамм. PGS / PGD , NIPT , Oncogenetics, Bioinformatics, диагностические панели для конкретных категорий и случаев заболеваний) .
PGS / PGD , NIPT , Oncogenetics, Bioinformatics, диагностические панели для конкретных категорий и случаев заболеваний) .
Компания активно продвигает свою продукцию на российский рынок и намерена открывать новые рынки по всему миру.
ИСКЧкотируется на Рынке инноваций и инвестиций Московской биржи (тикер ISKJ ). Компания провела IPO в декабре 2009 года, став первой российской биотехнологической компанией, которая стала публичной.
Обзор Авторский указатель
А
А. Альрашуди, Абдуллах, Лаборатория наномедицины, Отдел биологических и экологических наук и инженерии, Король Абдулла Университет науки и технологий, Тувал 23955-6900, Саудовская Аравия (Саудовская Аравия)A. Basilia, Blessie, Школа последипломного образования, Университет Мапуа, Манила 1002, Филиппины (Филиппины)
А. Семон, Джули, Департамент биологических наук, Университет науки и технологий Миссури, Ролла, Миссури, США (США)
Абдулмаджид, Мохаммед, факультет электротехники и вычислительной техники, инженерный колледж, Университет Эффат, Джидда, Саудовская Аравия (Саудовская Аравия)
Abedalthagafi, Malak, King Abdulaziz City for Science and Technology, Эр-Рияд, Саудовская Аравия (Саудовская Аравия)
Абрам, Томас Н.
 , Инженерно-технический факультет, Ланкастерский университет, Ланкастер, Соединенное Королевство (Соединенное Королевство)
, Инженерно-технический факультет, Ланкастерский университет, Ланкастер, Соединенное Королевство (Соединенное Королевство) Абубакиров, Айдар, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. Академика В.И. Кулакова Минздрава России, Москва, 117513, Россия (Российская Федерация)
Acar, Anil A., Орханлы-Тузла, Стамбул, Турция (Турция)
Агабабян Т.А., Цыб А.М. МРНЦ — филиал Национального медицинского исследовательского радиологического центра Минздрава России Федерация, Обнинск, Россия (Российская Федерация)
Agarwala, Shweta, Наньянский технологический университет (Сингапур)
Агарвала, Светлана, Технический департамент, Орхусский университет, Дания (Дания)
Агравал, Анимеш, Школа материаловедения и инженерии, Технологический университет Наньян
Агунг, Натанаэль Парнинготан, отделение урологии больницы общего профиля Cipto Mangunkusumo — медицинский факультет, Universitas Indonesia (Индонезия)
Ахмад Мир, Танвир, Университет Тойомы (Япония)
Ахатов, Искандер, Центр дизайна, производства и материалов, Сколковский институт науки и технологий, Москва (Российская Федерация)
Акинджи, Ибрагим, отдел.
 сельскохозяйственной техники и технологий, Фак. сельского хозяйства, Университет Акдениз, Анталия, Турция (Турция)
сельскохозяйственной техники и технологий, Фак. сельского хозяйства, Университет Акдениз, Анталия, Турция (Турция) Аль-Харби, Охуд
Аль-Тамими, А.А., Департамент промышленной инженерии, Инженерный колледж, Университет короля Сауда, Эр-Рияд 11421 Саудовская Аравия (Саудовская Аравия)
Али, Фахим
Альхавтани, Ахмед Юсеф Ф., Ключевая лаборатория передовых технологий обработки материалов Министерства образования, биопроизводства и технологий быстрого формования Ключевая лаборатория Пекина, Департамент машиностроения, Университет Цинхуа, Пекин, 100084, Народная Республика (Китай)
Alrashoudi, Abdulelah, Лаборатория наномедицины, Отдел биологических и экологических наук и инженерии, Король Абдулла Университет науки и технологий, Тувал 23955-6900, Саудовская Аравия (Саудовская Аравия)
Alvarez, Mario Moisés, Centro de Biotecnología-FEMSA, Tecnológico de Monterrey, CP 64849, Monterrey, Nuevo León, México.(Мексика)
Alvarez, Mario Moisés, Centro de Biotecnología-FEMSA, Tecnologico de Monterrey, Monterrey 64849, NL, México.
 Departamento de Bioingeniería, Escuela de Ingeniería y Ciencias, Tecnologico de Monterrey, Monterrey 64849, NL, México. (Мексика)
Departamento de Bioingeniería, Escuela de Ingeniería y Ciencias, Tecnologico de Monterrey, Monterrey 64849, NL, México. (Мексика) Ан, Цзя
Ань, Цзя, Наньянский технологический университет (Сингапур)
1-25 из 891 Товаров 1 2 3 4 5 6 7 8 9 10> >>
Границы | Факторы роста в регенеративной и регенеративной медицине: «лекарство и причина»
Введение
Одна из парадигм регенеративной биологии и медицины состоит в том, что взрослые стволовые клетки (СК) являются краеугольным камнем обновления и регенерации тканей.Его функции регулируются нервной системой, обеспечивая быстрый ответ, а также эндокринными стимулами, передаваемыми гормонами, факторами роста и цитокинами, действующими через определенные рецепторы. Эти системы обеспечивают набор сигналов, необходимых для поддержания гомеостаза тканей и восстановления после повреждения. Следовательно, SC сам по себе не является оптимальным объектом для применения в регенеративной медицине, поскольку он зависит от регуляторных цепей ткани (во многом связанных с термином «ниша») и не имеет функциональной автономии. Таким образом, вероятно, единственной известной на сегодняшний день эффективной «терапией стволовыми клетками», способной восстановить функциональный орган взрослого SC, является трансплантация костного мозга (1).
Таким образом, вероятно, единственной известной на сегодняшний день эффективной «терапией стволовыми клетками», способной восстановить функциональный орган взрослого SC, является трансплантация костного мозга (1).
Человеческое тело обладает впечатляющей способностью к обновлению в течение жизни, способствуя замене клеток в большинстве тканей и органов после их уничтожения посредством запрограммированной гибели клеток. В то же время, когда для восстановления структуры и функции требуется репаративная регенерация (в ее классическом определении), Homo sapiens не входит в число лучших видов, способных справиться с этим.После незначительного повреждения ткани человека с эпителиальным компонентом (кожа, кишечник, кровеносные сосуды, поджелудочная железа и др.) Успешно проходят эпиморфную регенерацию. Однако после того, как происходит серьезное повреждение, наше тело имеет значительную склонность к фиброзу и гиперплазии оставшейся ткани (2). Некоторые исключения из этого правила существуют в человеческом теле, предлагая подходящие объекты для изучения и поддерживая концепцию о том, что эпиморфная регенерация в наших телах не ограничена полностью (Таблица 1).
Таблица 1 .Психологические примеры регенерационной способности человека.
Процессы регенерации опосредуются резидентными СК, идентифицированными в большинстве тканей взрослого организма. Эти клетки, такие как мезенхимные клетки жировой ткани (11), дентальные (12) или нервные СК (13) и другие, играют ключевую регулирующую роль как в обновлении ткани, так и в регенерации после травмы. С одной стороны, они обладают способностью размножаться и дифференцироваться в различные тканеспецифичные клетки, а с другой — они продуцируют тканеспецифический матрикс и высвобождают растворимые факторы, которые организуют обновление и восстановление тканей (14, 15).Глубокое участие в поддержании гомеостаза тканей делает эти клетки привлекательным объектом для изучения и потенциального применения в регенеративной медицине (16, 17). Тем не менее, нам еще многое предстоит узнать о факторах и молекулярном механизме, регулирующем функции этих клеток (18).
На молекулярном уровне обновление и регенерация контролируется многими классами растворимых биоактивных веществ. Они варьируются от нейротрансмиттеров, коротких пептидов и хемокинов до факторов роста (GF) — больших белков со сложным процессом биогенеза и активации после секреции (19, 20).
Они варьируются от нейротрансмиттеров, коротких пептидов и хемокинов до факторов роста (GF) — больших белков со сложным процессом биогенеза и активации после секреции (19, 20).
Одна особенность заключается в том, что после повреждения одни и те же молекулы могут управлять регенерацией или фиброзом. Напр., У амфибий Urodele GFs играют решающую роль в регенерации конечностей, которая требует дедифференцировки клеток, образования бластемы и последующей повторной дифференцировки клеток, которая приводит к замене конечностей (21). После ампутации трансформирующий фактор роста β (TGF-β), контролирующий ось Smad2 / 3, и эпидермальный фактор роста (EGF), который регулирует фактор транскрипции Yap1 (22), обнаруживаются в большом количестве в месте повреждения.Эти факторы имеют решающее значение для ранней миграции клеток, в то время как ингибирование передачи сигналов Smad2 / 3 или Yap1, как было показано, подавляет регенерацию у аксолотлей (23, 24). Между тем, у млекопитающих, включая человека, TGF-β и EGF являются одними из основных факторов, вызывающих фиброз после острого повреждения или при хроническом заболевании органов (25–27). Это показывает, что у разных видов гомологичные сигнальные оси, управляемые сходными лигандами, могут приводить к различным результатам после повреждения.
Это показывает, что у разных видов гомологичные сигнальные оси, управляемые сходными лигандами, могут приводить к различным результатам после повреждения.
Более того, даже у одного и того же вида GF может быть прорегенеративным или профиброзным, в зависимости от условий и фона повреждения, которое затронуло орган.У человека хорошо известные регуляторы, такие как инсулиноподобный фактор роста (IGF), TGF и факторы роста тромбоцитов (PDGF), управляют регенерацией in utero без шрамов, , даже на поздних стадиях развития. В послеродовой период после травмы аналогичный спектр GF высвобождается посредством дегрануляции тромбоцитов и продуцируется иммунными клетками или миофибробластами, что в конечном итоге приводит к образованию рубцов (28, 29), в отличие от полной регенерации, опосредованной теми же GF у плода человека.
Описанная плейотропия функций GF и ее предполагаемый механизм будут обсуждаться далее в этом мини-обзоре, но для любого, кто занимается трансляционными исследованиями, на первый взгляд, это создает огромную проблему, которую трудно решить или проанализировать в поисках решения.
У видов с выдающимися регенеративными способностями активация GF и их сигнальных путей является основой эпиморфной регенерации, но у человека они становятся основными факторами фиброза и рубцевания. Одно из возможных объяснений состоит в том, что во время эволюции сигнальных систем от примитивных организмов к человеку произошел решающий структурный сдвиг, приведший к потере регенеративных способностей. Однако данные филогенетического анализа показывают, что системы GF и их рецепторные тирозинкиназы (RTK) оставались высококонсервативными у животных (30).Таким образом, виды с высокой и низкой регенеративной способностью используют одинаковый молекулярный «инструментарий» для получения разных результатов.
Эта ситуация может серьезно ограничить нашу способность способствовать регенерации тканей посредством введения GF или клеток, их продуцирующих, включая мезенхимальные мультипотентные стромальные клетки (MSC), которые, как известно, действуют через репертуар растворимых факторов, секретируемых после доставки. Однако эндогенные СК также обладают высокой паракринной активностью, что позволяет им общаться с тканевым окружением.На этом этапе мы можем поднять ряд вопросов, которые имеют решающее значение для нашего понимания этой системы:
Однако эндогенные СК также обладают высокой паракринной активностью, что позволяет им общаться с тканевым окружением.На этом этапе мы можем поднять ряд вопросов, которые имеют решающее значение для нашего понимания этой системы:
• Каков был эволюционный фон, который привел к развитию такого уровня плейотропии функции GF?
• Что послужило причиной перехода от регенерации к фиброзу как способу реагирования на повреждение?
• Учитывая, что у людей GF и их рецепторные системы могут быть обязаны способствовать фиброзу, можем ли мы найти способ обойти эту эволюционно установленную закономерность?
Чтобы более подробно остановиться на этом, мы также призываем читателя переоценить роль GF, выходящую за рамки функции отдельных молекул, и представить их в качестве медиаторов, которые придают многоклеточным организмам особенность многоклеточной структуры и определяют, как эта структура реагирует на повреждение и потерю существующая связь между ее элементами.
Фактор роста / ось RTK у многоклеточных животных — краеугольный камень целостности организма
В ходе естествознания были установлены различные методы межклеточной коммуникации (31). У растений и водорослей переход к многоклеточным формам жизни произошел без новой сигнальной системы, с использованием тех же взаимодействий рецептор-лиганд, которые ранее имели их одноклеточные предки, а именно цитокининов и их рецепторов гистидинкиназы. В то время как эти таксоны полагались на уже существующие сигнальные системы и скорректировали свою функцию, чтобы стать многоклеточными, животные перешли на следующий уровень.Действительно, у животных появление многоклеточных видов сопровождалось резким увеличением количества новых генов, кодирующих белки сигнальной трансдукции, по сравнению с простейшими (32).
У растений и водорослей переход к многоклеточным формам жизни произошел без новой сигнальной системы, с использованием тех же взаимодействий рецептор-лиганд, которые ранее имели их одноклеточные предки, а именно цитокининов и их рецепторов гистидинкиназы. В то время как эти таксоны полагались на уже существующие сигнальные системы и скорректировали свою функцию, чтобы стать многоклеточными, животные перешли на следующий уровень.Действительно, у животных появление многоклеточных видов сопровождалось резким увеличением количества новых генов, кодирующих белки сигнальной трансдукции, по сравнению с простейшими (32).
Многоклеточность многоклеточных животных — это особенность, которую нельзя описать как сумму функций и метаболических потребностей отдельных клеток, находящихся в организме. В многоклеточном организме, несмотря на то, что он «прикреплен» к ткани или ее конкретному микроанатомическому отделению, каждая клетка постоянно получает множественные, иногда «противоречащие» сигналы. Принятие воспроизводимых решений или интерпретация стимулов в таком непонятном «сигнальном шуме» может показаться неразрешимой проблемой. Решение этой проблемы до формирования обязательной многоклеточности требовало установления физиологической регуляции и, в основном, подчинения функций отдельных клеток потребностям несущего организма организма.
Принятие воспроизводимых решений или интерпретация стимулов в таком непонятном «сигнальном шуме» может показаться неразрешимой проблемой. Решение этой проблемы до формирования обязательной многоклеточности требовало установления физиологической регуляции и, в основном, подчинения функций отдельных клеток потребностям несущего организма организма.
Большинство элементов, образующих аппарат RTK, возникли задолго до появления многоклеточных животных (33). Различные классы митоген-активируемых протеинкиназ (MAPK) с активностью Ser / Thr существовали у простейших и служили нижестоящими эффекторами рецепторов, связанных с G-белками (GPCR).Принцип их действия был идеальным для одноклеточных видов, поскольку каждая ось активировалась определенным GPCR и обеспечивала быструю передачу сигнала, вызванного определенным стимулом или изменением состояния (осмос, голодание, феромоны и т. Д.), Что позволяло ему реагировать. быстро, и эти каскады MAPK сформировали эффективную систему для мониторинга окружающей среды и контроля за размножением дрожжей и других простейших, обеспечивая быстрые и однозначные сигналы.
По мере увеличения сложности сигнала растущая неоднозначность была решена с помощью нового класса MAPK — протеинкиназы Ser / Thr + Tyr (MAPKK).Это представило новый механизм активации MAPK посредством двойного последовательного фосфорилирования (34), что позволило всему каскаду приобрести кратковременную «память» (35). В этом случае первый стимул запускает каскад путем фосфорилирования, и на некоторое время клетка становится восприимчивой к второму стимулу. Это создало возможность для интерференции или интеграции различных поступающих стимулов, что позже стало основой для характеристики усиления для передачи сигналов GF (36, 37).
Далее, когда сообщества одноклеточных организмов стали более сложными, эта система эволюционировала, чтобы опосредовать межклеточную коммуникацию с помощью секретируемых факторов, включая предков современных GFs.В какой-то момент произошло последнее изменение, необходимое для перехода к обязательной многоклеточной структуре. Контроль фосфорилирования MAPK был «отвлечен» от GPCR и предоставлен новому классу рецепторов — RTK. Вкратце, многоклеточные организмы сконструировали «завершающий блок» и построили его поверх существующей системы передачи сигнала MAPK, переназначив роль активатора RTK.
Вкратце, многоклеточные организмы сконструировали «завершающий блок» и построили его поверх существующей системы передачи сигнала MAPK, переназначив роль активатора RTK.
В этот момент можно все еще сомневаться в обосновании плейотропии GF и их неоднозначной функции, когда одна молекула может иметь противоположные функции (например,g., быть профибротическим и прорегенеративным) в разных условиях. В отличие от гормонов, где специализация сигналов была достигнута за счет расширения разнообразия молекул с уникальной сигнальной функцией, в осях GF / RTK трансдукция и обработка сигналов стали основой для эффективной коммуникации между клетками у многоклеточных животных.
Действительно, организму с более чем 200 типами тканей требуются универсальные средства связи, которые могут различаться различными специализированными клетками. Наличие 200 клеточно-специфичных GF и каждой другой клетки, экспрессирующей некоторые из 200 GF-специфических рецепторов, определенно было избыточным, неоптимальным решением, также исключающим способность клетки обрабатывать множественные сигналы или усиливать их. Это стало причиной наличия ограниченного числа семейств GF, но создания оборудования для обработки клеток, которое может обрабатывать несколько входящих сигналов. Таким образом, плейотропия GF могла появиться как средство для передачи как можно большего количества информации с использованием ограниченного числа молекул, и RTK используются для расшифровки этих сообщений. Это позволяет фильтровать «шум» и накапливать сумму стимулов, интерпретировать как инструкции и передавать их механизму клетки.
Это стало причиной наличия ограниченного числа семейств GF, но создания оборудования для обработки клеток, которое может обрабатывать несколько входящих сигналов. Таким образом, плейотропия GF могла появиться как средство для передачи как можно большего количества информации с использованием ограниченного числа молекул, и RTK используются для расшифровки этих сообщений. Это позволяет фильтровать «шум» и накапливать сумму стимулов, интерпретировать как инструкции и передавать их механизму клетки.
В регенерации ключевой функцией GF является установление правильных межклеточных коммуникаций.Это не исключает общепризнанных действий: стимулирование успешного приобретения функции / фенотипа отдельными клетками (например, дифференцировка SC) или деления клеток. Это предположение согласуется с другим наблюдением — по мере увеличения сложности организма в ходе эволюции регенерационная способность имела тенденцию к снижению. Это может отражать известный инженерный принцип, согласно которому чем больше сложная система разрушена повреждениями, тем сложнее задача ее восстановления (11).
Рассмотрение процесса восстановления ткани таким образом дает объяснение, почему те же самые GF, которые поддерживают гомеостаз и обновление ткани, являются движущими силами фиброза после травмы.В месте повреждения огромное количество GF (TGF, PDGF, EGF и т. Д.) Высвобождается из тромбоцитов вместе с местной продукцией, создавая очень многогранный сигнал. В большинстве тканей человека после значительного повреждения местные стромальные клетки используют свою RTK для обработки этого изначально непонятного сигнала и запуска фиброза. В описанном случае можно ожидать, что GFs запустят восстановление структуры, но они не могут диктовать программу регенерации, несмотря на их обильное присутствие в месте повреждения. В то же время, эти ранние стадии GF абсолютно необходимы — даже кратковременная задержка или ингибирование активации RTK приводит к серьезным искажениям регенеративного процесса (38).Таким образом, в острой фазе реакция на травму становится «лекарством и причиной» и формирует физиологическую связь, на которую нельзя легко повлиять химическими веществами или другими средствами без последствий для результата.
Эпигенетический ландшафт модулирует влияние фактора роста / оси RTK на регенерацию
Сигнальные пути от RTK, запускаемых GF, хорошо сохраняются в Царстве Животных, что поднимает вопрос о том, что изменилось, изменяя человеческие ткани и паттерны коммуникации и создавая склонность к фиброзу по сравнению с другими видами.Возможный ответ заключается в том, что наш эпигенетический ландшафт отвечает за клеточные эффекты RTK. Последние создают «более медленный» путь передачи сигналов, чем ионные каналы или GPCR, но RTK осуществляют передачу сигналов через ядерный перенос эффекторных протеинкиназ и активацию / репрессию факторов транскрипции. Их способность модулировать экспрессию геномных последовательностей сильно зависит от того, какие участки ДНК открыты для взаимодействия. На этом этапе мы не можем игнорировать эпигенетический ландшафт, который вносит вклад в плейотропию сигнальных эффектов GF / RTK при регенерации.
Например, Sonic hedgehog (Shh) имеет решающее значение как для развития, так и для регенерации. Регуляция экспрессии его гена является хорошим примером связи между эпигенетическим профилем и регенеративной способностью организма. Во время развития или регенерации конечностей Shh экспрессируется в задней области, где он отвечает за переднюю / заднюю полярность и принимает участие в формировании пальцев. Экспрессия гена Shh контролируется специфическим энхансером, MFCS1 (39).У Xenopus этот энхансер демонстрирует низкое метилирование на стадии головастика, которое, как известно, отрастает ампутированные конечности за счет образования бластемы. Однако после превращения в лягушек MFCS1 становится сильно метилированным, что соответствует потере регенеративного потенциала на этой стадии. Лягушки не могут полностью регенерировать конечности, а вместо этого образуют шиповидную структуру хряща. Напротив, у аксолотлей, способных к полной регенерации конечностей в течение всей своей жизни, энхансер MFCS1 остается гипометилированным.Это метилирование тесно связано с экспрессией гена Shh, а высокие уровни метилирования MFCS1 предотвращают экспрессию Shh (40).
Регуляция экспрессии его гена является хорошим примером связи между эпигенетическим профилем и регенеративной способностью организма. Во время развития или регенерации конечностей Shh экспрессируется в задней области, где он отвечает за переднюю / заднюю полярность и принимает участие в формировании пальцев. Экспрессия гена Shh контролируется специфическим энхансером, MFCS1 (39).У Xenopus этот энхансер демонстрирует низкое метилирование на стадии головастика, которое, как известно, отрастает ампутированные конечности за счет образования бластемы. Однако после превращения в лягушек MFCS1 становится сильно метилированным, что соответствует потере регенеративного потенциала на этой стадии. Лягушки не могут полностью регенерировать конечности, а вместо этого образуют шиповидную структуру хряща. Напротив, у аксолотлей, способных к полной регенерации конечностей в течение всей своей жизни, энхансер MFCS1 остается гипометилированным.Это метилирование тесно связано с экспрессией гена Shh, а высокие уровни метилирования MFCS1 предотвращают экспрессию Shh (40). Эти данные связывают регенеративную способность органа с эпигенетическим статусом клеток в нем.
Эти данные связывают регенеративную способность органа с эпигенетическим статусом клеток в нем.
Известно, что во время регенерации у земноводных клетки в месте повреждения подвергаются дедифференцировке с образованием бластемы (41), а затем дифференцируются в новую функциональную ткань (42). Однако многочисленные исследования показали, что в отличие от образования индуцированных плюрипотентных клеток, которые теряют все свои эпигенетические маркеры, специфичные для клеточного клона, клетки бластемы, полученные из костных, мышечных или дермальных клеток, в основном способствуют образованию соответствующего типа клеток во время регенерации ( 43).После дедифференцировки клетки регенерирующих животных сохраняют эпигенетический профиль, специфичный для клонов — так называемую память о клеточных клонах. Например, клетки бластемы, полученные из костей, регенерируют в кости, но не в мышечные или дермальные клетки. Это означает, что дедифференцировка, которая предшествует регенерации, ограничена, и клетки приобретают пластичность для активной пролиферации и образования тканей, а не истинную плюрипотентность (Рис. 1).
1).
Рисунок 1 . Предполагаемая схема эпигенетического ландшафта у видов с высокими и низкими регенерационными способностями и ее влияние на судьбу клеток. (A) Эпигенетический ландшафт у видов с низкой регенерацией. Черные стрелки обозначают дифференциацию, а наклоны указывают на низкую вероятность реверсии фенотипа или дедифференцировки; синей стрелкой отмечен момент, когда после повреждения миофибробласт (MyoFB) «падает со скалы» и принимается необратимое решение о судьбе клетки с последующим рубцеванием. (B) Изображение другого ландшафта, который способствует изменению фенотипа и временной дедифференцировке с ограниченным приобретением стволовости (синяя двухконечная стрелка на плато).Красный крест отмечает потенциальное ограничение как приобретения плюрипотентности, так и фиброза, налагаемое эпигенетическим ландшафтом, снижая вероятность неблагоприятного решения судьбы клетки после повреждения.
Если смотреть с точки зрения потенциала дифференцировки, фиброз — это состояние, противоположное образованию бластемы. За счет чрезмерного отложения матрикса фиброз предотвращает таксис и миграцию терминально дифференцированных клеток и блокирует их потенциальную пролиферацию. Эта реакция может показаться контр-эволюционной — полное восстановление функции тканей после травмы является большим преимуществом.Однако, когда наши предки перебрались из моря на поверхность, они столкнулись с гипероксидантными условиями в этой новой среде (44). Высокий уровень кислорода может мешать регенеративному процессу, связанному с дедифференцировкой клеток, что требует декомпактизации ДНК и приводит к ее повышенной чувствительности к повреждению реактивными формами кислорода (АФК) (45).
За счет чрезмерного отложения матрикса фиброз предотвращает таксис и миграцию терминально дифференцированных клеток и блокирует их потенциальную пролиферацию. Эта реакция может показаться контр-эволюционной — полное восстановление функции тканей после травмы является большим преимуществом.Однако, когда наши предки перебрались из моря на поверхность, они столкнулись с гипероксидантными условиями в этой новой среде (44). Высокий уровень кислорода может мешать регенеративному процессу, связанному с дедифференцировкой клеток, что требует декомпактизации ДНК и приводит к ее повышенной чувствительности к повреждению реактивными формами кислорода (АФК) (45).
Такие организмы имеют более компактный хроматин, чтобы предотвратить дедифференцировку или очень активную пролиферацию и в конечном итоге «залатать» рану соединительной тканью.Таким образом, фиброз может отражать свойства более ограничительной системы, которая поддерживает геномную стабильность клеток.
Момент, когда происходит резкое изменение эпигенетического статуса генома, присутствует у большинства наземных видов, включая человека, а именно момент доставки, когда организм покидает гипоксическую водную среду матки / яйца и подвергается сильному стрессу. атмосферный уровень кислорода (46, 47). Повреждения ДНК, опосредованные АФК, быстро восстанавливаются, но накапливаются эпигенетические модификации, изменяющие экспрессию сотен генов, кодирующих белки и регуляторные РНК разных классов (48, 49).Эти изменения могут чем-то напоминать переход от воды к суше, но у новорожденного есть несколько дней, чтобы адаптироваться к новой среде (49). Мы все еще можем размышлять о том, что было движущей силой и почему фиброз возник у наземных животных. Мы считаем, что после перехода на уровень кислорода в атмосфере виды, которые пытались регенерировать так же, как и в водной среде, предположительно были уничтожены.
атмосферный уровень кислорода (46, 47). Повреждения ДНК, опосредованные АФК, быстро восстанавливаются, но накапливаются эпигенетические модификации, изменяющие экспрессию сотен генов, кодирующих белки и регуляторные РНК разных классов (48, 49).Эти изменения могут чем-то напоминать переход от воды к суше, но у новорожденного есть несколько дней, чтобы адаптироваться к новой среде (49). Мы все еще можем размышлять о том, что было движущей силой и почему фиброз возник у наземных животных. Мы считаем, что после перехода на уровень кислорода в атмосфере виды, которые пытались регенерировать так же, как и в водной среде, предположительно были уничтожены.
Существует гипотеза, что фиброз мог защищать от негативных последствий воздействия АФК и эпигенетических искажений у этих ранних наземных животных, чтобы предотвратить рак (50).К сожалению, рубец также невосприимчив к нормальным тканевым элементам (кровеносным сосудам, стромальным клеткам, нервным окончаниям, SC и паренхимой), что привело к побочному эффекту этой адаптации, а именно огромному снижению способности к регенерации после повреждения. .
.
Заключение
В целом, мы можем заключить, что GFs являются эволюционно установленной уникальной системой, которая обеспечивает формирование ткани в процессе развития, а затем посредством RTKs и их сигнальных осей поддерживает гомеостаз, интеграцию клеток и обновление тканей.Однако после повреждения они могут стать «лекарством и причиной», поскольку положительные и отрицательные результаты опосредуются одними и теми же GF в зависимости от вида или конкретной ткани в организме.
Мы выделили эпигенетический ландшафт как предполагаемую причину, по которой высококонсервативные GF и пути RTK могут не вызывать полномасштабную регенерацию у видов, которые, как известно, подвержены фиброзу (включая людей), и быть движущей силой регенерации у других. Исследование эпигенетической регуляции в связи с регенерацией у людей может открыть новую область и предоставить мишени для терапии, которая будет опираться не на лиганды, а на их конечные цели — геномные последовательности и регуляторные механизмы, которые определяют судьбу клеток при здоровье и болезни.
Авторские взносы
PN написал части рукописи. К.К. написал части рукописи и отредактировал их. ПМ идея рукописи, подготовка рисунков, проверка предварительных версий и одобрение заявки. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Работа поддержана Государственным заданием МГУ им. М. В. Ломоносова, грантом РНФ № 19-75-30007 (плата за публикацию) и грантом РФФИ № 18-315-20053 (подготовка изображений и доступ к библиографии).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
2. Goss RJ. Принципы регенерации . Нью-Йорк, Нью-Йорк: Academic Press (1969).
Google Scholar
9. Rickert CH, Maasjosthusmann U, Probst-Cousin S, August C., Gullotta F. Уникальный случай церебральной селезенки. Am J Surg Pathol . (1998) 22: 894–6. DOI: 10.1097 / 00000478-199807000-00011
Am J Surg Pathol . (1998) 22: 894–6. DOI: 10.1097 / 00000478-199807000-00011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Казинс Флорида, Дориен Ф.О., Гаргетт CE. Стволовые клетки / клетки-предшественники эндометрия и их роль в патогенезе эндометриоза. Лучшая практика клиники акушерства Gynaecol . (2018) 50: 27–38. DOI: 10.1016 / j.bpobgyn.2018.01.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Нимирицкий П.П., Еремичев Р.Ю., Александрушкина Н.А., Ефименко А.Ю., Ткачук В.А., Макаревич П.И.Выявление организующей функции мезенхимальных стромальных клеток при регенерации. Int J Mol Sci . (2019) 20: 823. DOI: 10.3390 / ijms20040823
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Баллини А., Ди Бенедетто А., Де Вито Д., Скарано А., Скакко С., Перилло Л. и др. Экспрессия генов стволовых клеток в наивных стволовых клетках человека по сравнению с остеодифференцированными стволовыми клетками стоматологического происхождения. Eur Rev Med Pharmacol Sci . (2019) 23: 2916–23. DOI: 10.26355 / eurrev_201904_17570
Eur Rev Med Pharmacol Sci . (2019) 23: 2916–23. DOI: 10.26355 / eurrev_201904_17570
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Люгерт С., Басак О., Наклз П., Хаусслер Ю., Фабель К., Готц М. и др. Спящие и активные нейральные стволовые клетки гиппокампа с различными морфологиями избирательно реагируют на физиологические и патологические стимулы и старение. Стволовая клетка . (2010) 6: 445–56. DOI: 10.1016 / j.stem.2010.03.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Баллини А., Боккаччо А., Сайни Р., Ван Фам П., Татулло М. Стволовые клетки стоматологического происхождения и их секретом, а также взаимодействие с биокаффолдами / биоматериалами в регенеративной медицине: от исследований in vitro и до трансляционных приложений. Стволовые клетки Инт . (2017) 2017: 6975251. DOI: 10.1155 / 2017/6975251
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Тюрин-Кузьмин П.А., Калинина Н.И., Кулебякин К.Ю., Балацкий А.В., Сысоева В.Ю., Ткачук В.А. Подтипы рецепторов ангиотензина регулируют обновление и ремоделирование жировой ткани. FEBS J . (2020) 287: 1076–87. DOI: 10.1111 / febs.15200
Тюрин-Кузьмин П.А., Калинина Н.И., Кулебякин К.Ю., Балацкий А.В., Сысоева В.Ю., Ткачук В.А. Подтипы рецепторов ангиотензина регулируют обновление и ремоделирование жировой ткани. FEBS J . (2020) 287: 1076–87. DOI: 10.1111 / febs.15200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Баллини А., Скакко С., Колетти Д., Плучино С., Татулло М.Мезенхимальные стволовые клетки как промоторы, усилители и плеймейкеры трансляционной регенеративной медицины. Стволовые клетки Инт . (2017) 2017: 3292810. DOI: 10.1155 / 2017/3292810
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Сагарадзе Г., Басалова Н., Кирпатовский В., Охоботов Д., Нимирицкий П., Григорьева О. и др. Волшебный удар для регенерации: роль секретома мезенхимальных стромальных клеток в восстановлении ниши сперматогониальных стволовых клеток. Ресурс стволовых клеток .(2019) 10: 342. DOI: 10.1186 / s13287-019-1479-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Макаревич П.И., Ефименко А.Ю., Ткачук В.А. Биохимическая регуляция регенеративных процессов факторами роста и цитокинами: основные механизмы и актуальность для регенеративной медицины. Биохимия . (2020) 85: 11–26. DOI: 10.1134 / S0006297920010022
Макаревич П.И., Ефименко А.Ю., Ткачук В.А. Биохимическая регуляция регенеративных процессов факторами роста и цитокинами: основные механизмы и актуальность для регенеративной медицины. Биохимия . (2020) 85: 11–26. DOI: 10.1134 / S0006297920010022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Барриентос С., Стоядинович О., Голинко М.С., Брем Х., Томич-Канич М.Факторы роста и цитокины в заживлении ран. Регенерация для восстановления ран . (2008) 16: 585–601. DOI: 10.1111 / j.1524-475X.2008.00410.x
CrossRef Полный текст | Google Scholar
22. Донг А., Водзяк Д., Лоу А.В. Рецептор эпидермального фактора роста. (EGFR) передача сигналов требует специфического тиоредоксина эндоплазматического ретикулума для посттрансляционного контроля презентации рецептора на поверхности клетки. Дж Биол Химия . (2015) 290: 8016–27. DOI: 10.1074 / jbc.M114.623207
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Levesque M, Gatien S, Finnson K, Desmeules S, Villiard E, Pilote M и др. Трансформирующий фактор роста: передача сигналов бета необходима для регенерации конечностей у аксолотлей. PLoS ONE. (2007) 2: e1227. DOI: 10.1371 / journal.pone.0001227
Levesque M, Gatien S, Finnson K, Desmeules S, Villiard E, Pilote M и др. Трансформирующий фактор роста: передача сигналов бета необходима для регенерации конечностей у аксолотлей. PLoS ONE. (2007) 2: e1227. DOI: 10.1371 / journal.pone.0001227
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Hayashi S, Tamura K, Yokoyama H. Yap1, регулятор транскрипции в сигнальном пути Hippo, необходим для регенерации зачатка конечности Xenopus. Дев Биол . (2014) 388: 57–67.DOI: 10.1016 / j.ydbio.2014.01.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Шевинг Л.А., Чжан Х, Тредгилл Д.В., Рассел В.Е. ERBB3 и EGFR гепатоцитов необходимы для максимального индуцированного CCl4 фиброза печени. Am J Physiol Gastrointest Liver Physiol . (2016) 311: G807–16. DOI: 10.1152 / ajpgi.00423.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Венкатараман Т, Фриман МБ. Роль рецептора эпидермального фактора роста. (EGFR) при фиброзе легких, вызванном коронавирусом SARS. Противовирусное лечение . (2017) 143: 142–50. DOI: 10.1016 / j.antiviral.2017.03.022
(EGFR) при фиброзе легких, вызванном коронавирусом SARS. Противовирусное лечение . (2017) 143: 142–50. DOI: 10.1016 / j.antiviral.2017.03.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Копп Дж., Прейс Э., Саид Х., Хафеманн Б., Викерт Л., Гресснер А.М. и др. Прекращение передачи сигналов трансформирующего фактора роста-бета с помощью SMAD7 ингибирует сокращение коллагенового геля фибробластов кожи человека. Дж Биол Химия . (2005) 280: 21570–6. DOI: 10.1074 / jbc.M502071200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Вальравен М., Губернатор М., Мидделкоп Э, Билен Р. Х., Ульрих М. М.. Измененная передача сигналов TGF-бета в фибробластах плода: что известно о лежащих в основе механизмах? Регенерация для восстановления ран . (2014) 22: 3–13. DOI: 10.1111 / wrr.12098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Анантараман В., Айер Л.М., Аравинд Л. Сравнительная геномика протистов: новый взгляд на эволюцию эукариотической передачи сигнала и регуляции генов. Анну Рев Микробиол .(2007) 61: 453–75. DOI: 10.1146 / annurev.micro.61.080706.093309
Анну Рев Микробиол .(2007) 61: 453–75. DOI: 10.1146 / annurev.micro.61.080706.093309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Pincus D, Letunic I, Bork P, Lim WA. Эволюция механизма передачи сигналов фосфотирозина в клонах преметазоана. Proc Natl Acad Sci USA . (2008) 105: 9680–4. DOI: 10.1073 / pnas.0803161105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Kocieniewski P, Faeder JR, Lipniacki T. Взаимодействие двойного фосфорилирования и каркаса в путях MAPK. Дж Теор Биол . (2012) 295: 116–24. DOI: 10.1016 / j.jtbi.2011.11.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Мюллер А.К., Мейер М., Вернер С. Роль рецепторных тирозинкиназ и их лигандов в процессе заживления ран. Semin Cell Dev Биол . (2012) 23: 963–70. DOI: 10.1016 / j.semcdb.2012.09.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Сагай Т., Хосоя М., Мизушина Ю., Тамура М., Широиси Т.Устранение дальнодействующего цис-регуляторного модуля вызывает полную потерю специфической для конечностей экспрессии Shh и усечение конечности мыши. Разработка . (2005) 132: 797–803. DOI: 10.1242 / dev.01613
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Якусидзи Н., Судзуки М., Сато А., Сагай Т., Сироиси Т., Кобаяши Н. и др. Корреляция между экспрессией Shh и статусом метилирования ДНК конечности-специфической области энхансера Shh во время регенерации конечностей у земноводных. Дев Биол . (2007) 312: 171–82. DOI: 10.1016 / j.ydbio.2007.09.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Хан MJ, An JY, Kim WS. Паттерны экспрессии Fgf-8 во время развития и регенерации конечностей аксолотля. Dev Dyn. (2001) 220: 40–8. DOI: 10.1002 / 1097-0177 (2000) 9999: 9999 <:: AID-DVDY1085> 3.0.CO; 2-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Kragl M, Knapp D, Nacu E, Khattak S, Maden M, Epperlein HH, et al.Клетки сохраняют память о своем тканевом происхождении во время регенерации конечностей аксолотлей. Природа . (2009) 460: 60–5. DOI: 10.1038 / nature08152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Iismaa SE, Kaidonis X, Nicks AM, Bogush N, Kikuchi K, Naqvi N, et al. Сравнительные механизмы регенерации в различных тканях млекопитающих. NPJ Regen Med . (2018) 3: 6. DOI: 10.1038 / s41536-018-0044-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Пуэнте Б.Н., Кимура В., Муралидхар С.А., Мун Дж., Аматруда Дж. Ф., Фелпс К. Л. и др. Богатая кислородом постнатальная среда вызывает остановку клеточного цикла кардиомиоцитов за счет реакции на повреждение ДНК. Ячейка . (2014) 157: 565–79. DOI: 10.1016 / j.cell.2014.03.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Buonocore G, Perrone S, Tataranno ML. Окислительный стресс у новорожденного. Оксид Мед Ячейки Longev . (2017) 2017: 1094247. DOI: 10.1155 / 2017/1094247
CrossRef Полный текст | Google Scholar
47.Торрес-Куэвас I, Парра-Льорка А., Санчес-Иллана А., Нуньес-Рамиро А., Кулиговски Дж., Чафер-Перикас С. и др. Кислородный и оксидативный стресс в перинатальном периоде. Редокс Биол . (2017) 12: 674–81. DOI: 10.1016 / j.redox.2017.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Nakada Y, Canseco DC, Thet S, Abdisalaam S, Asaithamby A, Santos CX, et al. Гипоксия вызывает регенерацию сердца у взрослых мышей. Природа . (2017) 541: 222–7. DOI: 10.1038 / природа20173
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Cernaro V, Lacquaniti A, Donato V, Fazio MR, Buemi A, Buemi M. Фиброз, регенерация и рак: какая связь? Циферблат нефрола для трансплантации . (2012) 27: 21–7. DOI: 10.1093 / ndt / gfr567
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доктор Кон Ман: взлет и падение известного ученого, обманувшего почти всех | Наука
Научный пионер, суперзвезда хирург, чудотворец — так Паоло Маккиарини был известен на протяжении нескольких лет.Одетый в белый лабораторный халат или хирургические халаты, с широким красивым лицом и легким обаянием он, безусловно, выглядел соответствующим образом. И обманул почти всех.
Маккиарини стал известен еще в 2008 году, когда он создал новую воздушную трассу для Клаудии Кастильо, молодой женщины из Барселоны. Он сделал это путем химического удаления клеток дыхательного горла, взятых у умершего донора; Затем он засеял голый каркас стволовыми клетками, взятыми из собственного костного мозга Кастильо. Кастильо вскоре вернулся домой, преследуя своих детей.По словам Маккиарини и его коллег, ее искусственный орган был на пути к тому, чтобы выглядеть и функционировать, как естественный. А поскольку он был построен из собственных клеток Кастильо, ей не нужно было принимать какие-либо опасные иммунодепрессанты.
Это был первый большой успех Маккиарини. Бесчисленные новости объявили это медицинским прорывом. Спасатель и революционер. Теперь мы знаем, что это неправда. Однако серьезные осложнения, с которыми столкнулся Кастильо, долгое время умалчивались.
Тем временем карьера Маккиарини стремительно росла. К 2011 году он работал в Швеции в одном из самых престижных медицинских университетов мира, Каролинском институте, профессора которого ежегодно выбирают лауреата Нобелевской премии по физиологии и медицине. Там он заново изобрел свою технику. Вместо того чтобы извлекать клетки из донорских дыхательных путей, Маккиарини изготовил пластиковые каркасы на заказ. Первым, кто получил один из них, был Андемариам Бейене, эритрейский докторант геологии Исландского университета.Его выздоровление поместило Маккиарини на первую полосу New York Times.
Macchiarini воплощал мечту о регенеративной медицине в реальность. Вот как выразилась Мередит Виейра из NBC в своем документальном фильме о Маккиарини, получившем соответствующее название «Прыжок веры»: «Только представьте себе мир, в котором любой травмированный или больной орган или часть вашего тела просто заменяется новым искусственным, буквально созданным человеком в мире. лаборатория, только для тебя. » Этот чудесный мир теперь был в пределах досягаемости благодаря Маккиарини.
Однако в прошлом году мечта исполнилась, обнажив уродливую реальность.
Маккиарини дал свои «регенерирующие» трахеи 17 или более пациентам по всему миру. Большинство из них, включая Андемариама Бейене, уже мертвы. Те немногие пациенты, которые еще живы, в том числе Кастильо, выжили, несмотря на искусственное дыхательное горло, которое им сделали.
В январе 2016 года Маккиарини получил необычайно двойную дозу плохой прессы. Первой была статья Vanity Fair о его романе с Бенитой Александер, удостоенным наград продюсером NBC News.Она познакомилась с Маккиарини во время работы над фильмом «Прыжок веры» и вскоре нарушила одно из основных правил журналистики: не влюбляйтесь в предмет своей истории.
К моменту выхода программы в эфир в середине 2014 года пара планировала свой брак. Это будет звездное мероприятие. Маккиарини часто хвастался Александру своими знаменитыми друзьями. Теперь они были в списке свадебных гостей: Обамы, Клинтоны, Владимир Путин, Николя Саркози и другие мировые лидеры. Андреа Бочелли должен был петь на церемонии.Никто иной, как Папа Франциск не будет исполнять обязанности, и его папский дворец в Кастель Гандольфо будет служить местом встречи. Так сказал Маккиарини своей невесте.
Маккиарини за работой. Фото: информационное агентство TT / Press Association ImagesНо с приближением важного дня Александра увидела, что эти планы рушатся, и наконец осознала, что ее возлюбленный лгал почти обо всем. Папа, дворец, мировые лидеры, знаменитый тенор — все это были фантазии.
То же самое и со свадьбой: Маккиарини все еще был женат на своей 30-летней жене.
Обман Маккиарини был настолько диковинным, что Vanity Fair запросила мнение гарвардского профессора Рональда Схоутена, специалиста по психопатам, который дистанционно поставил этот диагноз: «Маккиарини — крайняя форма мошенника. Он явно умен и у него есть достижения, но он не может сдерживаться. В его личности есть пустота, которую он, кажется, хочет заполнить, обманывая все больше и больше людей ».
Это оставило в воздухе большой животрепещущий вопрос: если Маккиарини был патологическим лжецом в вопросах любви, как насчет его медицинских исследований? Обманывает ли он своих пациентов, коллег и научное сообщество?
Ответ пришел только через пару недель, когда шведское телевидение начало транслировать трехсерийное разоблачение Маккиарини и его работ.
Названный Experimenten (Эксперименты), он убедительно доказывал, что искусственные дыхательные пути Маккиарини не были чудом, спасающим жизнь, в который мы все верили. Напротив, казалось, что они приносят больше вреда, чем пользы — то, что Маккиарини в течение многих лет скрывал или преуменьшал в своих научных статьях, пресс-релизах и интервью.
Столкнувшись с этой катастрофой в сфере связей с общественностью, Каролинский институт немедленно пообещал расследовать обвинения, но затем, через несколько дней, внезапно объявил, что контракт Маккиарини не будет продлен.
Падение Маккиарини было быстрым, но остаются тревожные вопросы о том, почему ему было разрешено продолжать свои эксперименты так долго. Некоторые ответы были получены в результате официальных запросов в Каролинский институт и больницу Каролинского университета. Они выявили множество проблем, связанных с тем, как организации-близнецы обращались с ним.
Слава Маккиарини принесла ему хорошую поддержку. Среди них была Харриет Валлберг, которая была проректором Каролинского института в 2010 году, когда был принят на работу Маккиарини.Она настояла на его назначении, несмотря на то, что в его резюме были очень негативные отзывы и сомнительные утверждения.
Это опасный пример. Это показало руководителям отделов и коллегам, что они должны относиться к Маккиарини по-особенному. Он может делать практически все, что ему заблагорассудится. За первые пару лет в Каролинске он наложил пластиковые дыхательные пути трем пациентам. Поскольку это было радикально новым методом, Маккиарини и его коллеги должны были сначала испытать его на животных. Они этого не сделали.
Точно так же они не провели надлежащую оценку риска процедуры, и команда Маккиарини не запрашивала у правительства разрешения на использование пластиковых дыхательных путей, стволовых клеток и химических «факторов роста», которые они использовали. Они даже не добивались одобрения Стокгольмского совета по этике, который базируется в Каролинске.
Хотя Маккиарини был на виду, он смог обойти обычные правила и нормы. Вернее, в этом ему помог его статус знаменитости. Руководство Каролинской ожидало от своей суперзвезды больших вещей, которые принесут институту престиж и финансирование.
Они также указали на лазейку, известную как «использование из сострадания». Они утверждали, что Маккиарини на самом деле не проводил клинических исследований. Нет, он просто заботился о своих пациентах, которые все как один находились на грани верной смерти, без каких-либо других вариантов лечения и не теряя времени. В таких ужасных обстоятельствах новые методы лечения можно использовать как последнее средство.
Этот довод не поддержали те, кто позже расследовал дело. По их мнению, Маккиарини, безусловно, занимался клиническими исследованиями.Кроме того, забота о сострадании не отменяет основных принципов безопасности пациентов и информированного согласия. Между тем Маккиарини заявил, что «не согласен» с выводами дисциплинарной комиссии.
Как оказалось, не все пациенты Маккиарини были на пороге смерти в то время, когда он их лечил. У Андемариама Бейене, например, был рецидив рака дыхательного горла, но, не считая кашля, он оставался здоровым. Но даже если его дни были сочтены, это не обязательно оправдывало то, через что ему пришлось пройти.
Смерть Бейене через два с половиной года после операции, вызванная отказом искусственного дыхательного пути, была изнурительным испытанием. По словам Пьера Делэра, профессора респираторной хирургии в KU Leuven, Бельгия, эксперименты Маккиарини должны были плохо кончиться. Как он сказал в Experimenten: «Если бы у меня был выбор — синтетическая трахея или расстрел, я бы выбрал последний вариант, потому что это была бы наименее болезненная форма казни».
Клаудиа Кастильо с доктором Паоло Маккиарини.Фотография: REX / ShutterstockДелаэр был одним из первых и самых резких критиков искусственных дыхательных путей Маккиарини. Сообщения об их успехе всегда казались ему «горячим воздухом». Он не видел никаких реальных доказательств того, что эшафоты трахеи становились живыми, функционирующими дыхательными путями — в этом случае им суждено было выйти из строя. Вопрос только в том, сколько времени это займет — недели, месяцы или несколько лет.
Ужасающая критика Делэра появилась в крупных медицинских журналах, в том числе в Lancet, но руководство Каролинской не восприняло ее всерьез.Они также не впечатлили совет по этике института, когда Делэр подал официальную жалобу.
Поддержка Маккиарини оставалась сильной, даже когда его пациенты начали умирать. Отчасти это связано с тем, что ремонт трахеи — это нишевая область. Мало кто в Каролинске, особенно среди тех, кто находится у власти, знал об этом достаточно, чтобы оценить утверждения Делэра. Кроме того, в такой жесткой конкурентной среде люди стремятся показать преданность своему начальству и опасаются критиковать их. В официальном сообщении по делу № это названо «эффектом подножки».
Когда подвиги Маккиарини были одобрены руководством и затаив дыхание освещены в средствах массовой информации, было слишком легко вскочить на эту подножку.
И сложно спрыгнуть. В начале 2014 года четыре каролинских врача бросили вызов господствующей культуре молчания, пожаловавшись на Маккиарини. По их мнению, он сильно искажал свои результаты и здоровье своих пациентов. Независимый следователь согласился. Но вице-канцлер Каролинского института Андерс Хамстен не был связан этим приговором.Он официально освободил Маккиарини от нарушений научной дисциплины, допустив лишь, что иногда он действовал «без должной осторожности».
За свои старания информаторы понесли наказание. Когда Маккиарини обвинил одного из них, Карла-Хенрика Гриннемо, в краже его работы в заявке на грант, Хамстен признал его виновным. Как вспоминает Гриннемо, это чуть не разрушило его карьеру: «Я не получал никаких новых грантов. Никто не хотел со мной сотрудничать. Мы проводили хорошее исследование, но это не имело значения … Я думал, что потеряю свою лабораторию, своих сотрудников — все.
Так продолжалось три года, пока совсем недавно Гриннемо не был очищен от всех правонарушений.
Скандал с Маккиарини унес жизни многих из его влиятельных друзей. Вице-канцлер Андерс Хамстен подал в отставку. Так же поступил и декан отдела исследований Каролинской. Как и генеральный секретарь Нобелевского комитета. Совет университета был уволен, и даже Харриет Валлберг, ставшая ректором всех шведских университетов, потеряла работу.
К сожалению, этот скандал гораздо масштабнее, чем у Каролинской, на которую приходится только три пациента, получивших «регенерирующее» дыхательное горло Маккиарини.
Остальные пациенты лечились в больницах Барселоны, Флоренции, Лондона, Москвы, Краснодара, Чикаго и Пеории. Ни одно из этих учреждений не подвергалось такому вниманию общественности. Никого не заставляли проводить полное и независимое расследование. Они должны быть.
Паоло Маккиарини на пресс-конференции в 2008 году. Фотография: REX / ShutterstockЕсли грехи Каролински были совершены где-то еще, то отчасти это связано с тем, что медицинские исследовательские учреждения имеют общую среду, которая таит в себе общие опасности.Одна из них — это ажиотаж вокруг стволовых клеток.
Исследование стволовых клеток — это актуальная область науки и, по статистике, также довольно скандальная. Статьи в этой области отзываются в 2,4 раза чаще, чем в среднем по биомедицине, и более половины этих отзывов связаны с мошенничеством.
Способствует ли «накал» исследований стволовых клеток — высокий уровень финансирования, престижа и освещения в СМИ — как-то мошенничеству? Это то, что заставляет нас подозревать наш опыт медицинских исследований.Хотя данных, чтобы на самом деле это доказать, недостаточно, у нас есть некоторые ключевые индикаторы.
У нас, например, постоянно растет список научных знаменитостей, совершивших крупное мошенничество со стволовыми клетками. Хван Ву Сок из Южной Кореи, который в 2004 году ложно заявил, что создал первые эмбриональные стволовые клетки человека путем клонирования. Несколько лет назад японка Харуко Обоката сделала аналогичный обман, когда объявила миру новый и простой — и фальшивый — метод превращения обычных клеток тела в стволовые.
Хван, Обоката и Маккиарини были привлечены к самым горячим регионам исследований стволовых клеток, где надежды на прорыв в медицине были самыми большими. В случае Маккиарини надежда заключалась в том, что пациентов можно будет лечить стволовыми клетками, взятыми из их собственного костного мозга.
На протяжении многих лет эта возможность вызвала большой интерес и вызвала огромное количество исследований. Тем не менее, для подавляющего большинства таких методов лечения мало убедительных доказательств того, что они работают. (Большим исключением является трансплантация стволовых клеток крови, которая десятилетиями спасала жизни людей с лейкемией и другими видами рака крови.)
Достаточно обеспокоить чиновников из Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Недавно они опубликовали статью в Медицинском журнале Новой Англии, в которой признается, что исследования стволовых клеток по большей части не оправдали своих терапевтических надежд.
Возник тревожно большой разрыв между тем, что мы ожидаем от стволовых клеток, и тем, что они доставляют. Каждое новое научное открытие приносит с собой поток историй о том, как скоро оно произведет революцию в медицине. Но этот день всегда откладывается.
Несчастливый результат этого — рост псевдонаучных методов лечения. Клиники стволовых клеток выросли, как сорняки, предлагая лечить практически любой недуг, который вы можете назвать. Вместо клинических данных есть хлынувшие отзывы. Есть также множество отчаявшихся пациентов, которые верят — потому что им говорили бесчисленное количество раз, — что стволовые клетки — это лекарство, и которые больше не могут ждать появления традиционной медицины. Они и их близкие становятся жертвами ложных надежд.
Ученые тоже могут страдать от ложных надежд.В какой-то степени они поверили Маккиарини, потому что он сказал им то, что они хотели услышать. Это видно по скорости, с которой принимались его «прорывы». Всего через четыре месяца после того, как Маккиарини прооперировал Клаудию Кастильо, его результаты — предварительные, но очень положительные — были опубликованы в Lancet в Интернете. После этого это было во всех новостях.
Популярной прессе тоже есть за что ответить. Его любовь к историям человеческого интереса заставляет его сочувствовать бездоказательным методам лечения. Как показали исследования, средства массовой информации часто освещают туризм стволовыми клетками в позитивном свете, предполагая, что методы лечения эффективны, а риски — низки.То же самое и с заменой дыхательного горла Маккиарини. Хорошим примером является документальный фильм NBC «Прыжок веры». Это увлекательно пересмотреть — как урок о том, как , а не , следует сообщать о медицинской науке.
Вполне логично, что карьера Маккиарини закончилась в Каролинском институте. Поскольку он является домом для Нобелевской премии по физиологии и медицине, одно из его стремлений — создавать научных знаменитостей. Каждый год он превращает науку в шоу-бизнес, выбирая из массы исследователей-медиков тех, кто заслуживает суперзвезды.Идея состоит в том, что научным прогрессом движет гений немногих.
Это проблемная идея с неприятными побочными эффектами. Гений — революционер по определению, склонный к риску и нарушитель закона. Разве эта идея не лежала в основе особого отношения Каролинской к Маккиарини? Конечно, ему так много сошло с рук, потому что он считался исключением из правил, и в нем было что-то большее, чем нобелевская нюанс. Во всяком случае, некоторые из его самых могущественных друзей сами были нобелевскими судьями, пока, с его падением благодати, они тоже не пали.
Если в этой истории есть мораль, так это то, что нам нужно опасаться медицинских мессий с их обещаниями спасения.
Китайские ученые создали стабильные стволовые клетки свиней для редактирования генов
ПЕКИН, 3 декабря (Синьхуа) — Китайские ученые создали стабильные линии стволовых клеток свиней, которые позволяют редактировать несколько генов.
Прорыв открывает новые горизонты для трансплантации органов и животноводства.
Согласно недавнему исследованию, опубликованному в Интернете в журнал Cell Research.
Свиньи имеют больше общего с людьми с точки зрения развития эмбриона, анатомии и физиологии, поэтому их линии стволовых клеток могут использоваться в качестве моделей для трансплантации органов от животного человеку, согласно исследованию.
Однако ранее было получено несколько стабильных линий стволовых клеток свиней, поскольку они имеют тенденцию «идти наперекосяк» во время деления, сообщил «Синьхуа» соавтор статьи Тан Цяньцзы из Сычуаньского сельскохозяйственного университета.
Команда успешно разработала культуральную среду in vitro для поддержания стабильных линий плюрипотентных стволовых клеток из эпибластов свиней, самых внешних слоев растущих эмбрионов, согласно исследованию.
Они обнаружили, что эти стволовые клетки могут размножаться более 240 раз, сохраняя нормальные хромосомные особенности и способность дифференцироваться на три зародышевых листка, согласно исследованию.
Плюрипотентные стволовые клетки — это клетки, которые могут размножаться, давая начало любому другому типу клеток в организме.
Исследование также показало, что эти стволовые клетки, полученные из эпибласта, могут легко переносить по крайней мере три цикла последовательного редактирования генов и, наконец, генерировать клонированных живых генетически отредактированных поросят.
Тан сказал, что на практике ученым приходится редактировать стволовые клетки более одного раза, чтобы достичь своих целей по выращиванию органов свиньи для трансплантации человеку.
Полученные результаты подтвердили долгожданные перспективы плюрипотентных стволовых клеток свиней и открыли новые возможности для биологических исследований, регенеративной биомедицины и животноводства.
Институт регенеративной медицины Макгоуэна
Объединение науки с технологиями для лечения болезней
Регенеративная медицина использует клинические процедуры для восстановления или замены поврежденных или больных тканей и органов, в отличие от некоторых традиционных методов лечения, которые просто лечат симптомы.
Для реализации огромного потенциала тканевой инженерии и других методов, направленных на восстановление поврежденных или больных тканей и органов, Медицинская школа Университета Питтсбурга и UPMC учредили Институт регенеративной медицины Макгоуэна. Институт Макгоуэна служит единой базой для работы ведущих ученых и клинических факультетов Университета, работающих над разработкой тканевой инженерии, клеточной терапии, а также устройств для искусственных и биогибридных органов.
Институт Макгоуэна — самая амбициозная программа регенерации в стране, сочетающая биологию, клиническую науку и инженерию.Успех нашей миссии повлияет на жизнь пациентов, принесет экономическую выгоду, послужит обучению нового поколения исследователей и повысит квалификацию наших преподавателей в области фундаментальных наук, инженерии и клинических наук. Наши усилия основываются на новаторских достижениях Института трансплантологии Томаса Э. Старзла.
Несмотря на то, что в настоящее время в клинической практике используются некоторые избранные методы лечения, основанные на принципах регенеративной медицины, впереди еще много работы, чтобы реализовать потенциал этой развивающейся области.Достижения в фундаментальной науке, инженерные стратегии, использующие эту науку, и успешная коммерческая деятельность — все это необходимо для того, чтобы предложить пациентам новые методы лечения.
Подкасты по регенеративной медицине
Институт Макгоуэна спонсирует серию подкастов по регенеративной медицине. Послушайте, как ведущие мировые исследователи и врачи в области регенеративной медицины рассказывают о своей работе.
Слушайте самые свежие подкасты.
Новости и события
Новая платформа для генной терапии ускоряет поиск способов лечения слепоты
Новая вычислительная платформа, разработанная исследователями из Медицинской школы Университета Питтсбурга, определяет наиболее эффективные вирусные векторы, которые могут обеспечить генную терапию сетчатке глаза с максимальной эффективностью и точностью.Технология, описанная в статье, опубликованной в журнале eLife, упрощает разработку подходов к генной терапии для лечения генетических нарушений слепоты. Такой подход экономит драгоценное время и ресурсы, ускоряя идентификацию подходящих кандидатов-переносчиков генов, способных с поразительной точностью провести терапию пораженной части сетчатки.
Плазма выздоравливающей бесполезна в качестве лечения тяжелобольных пациентов с COVID-19
В первые дни пандемии COVID-19 медицинское сообщество обратилось к вековому лечению: взять кровь у выздоровевших пациентов и передать ее больным.Гипотеза заключалась в том, что компоненты так называемой «плазмы выздоравливающих», которые однажды боролись с болезнью, могут сделать это снова, что сработало при других заболеваниях, таких как Эбола.
Разработка передовых систем доставки лекарств для решения глобальных экологических проблем
На первый взгляд сельское хозяйство кажется простым: растениям для роста нужны вода, солнечный свет и почва. Однако почва, в которой высаживаются сельскохозяйственные культуры, сложна. Для роста растений плодородная почва требует множества элементов, которые со временем могут истощаться, включая азот.Азот перемещается через окружающую среду, меняя формы по мере перехода от атмосферы к почве, к растениям, укорененным в почве, к животным, поедающим растения, и, наконец, обратно в атмосферу. Сельское хозяйство может нарушить этот цикл, известный как круговорот азота, побуждая фермеров вносить больше азота в почву, что сопряжено со своим собственным набором экологических рисков.
Определение терапевтических стратегий для предотвращения или остановки прогрессирования хронических заболеваний печени
Появляется все больше свидетельств того, что клеточное старение играет решающую роль в патогенезе хронических заболеваний печени.Член факультета Института регенеративной медицины Макгоуэна Майкл Эртель, доктор философии, адъюнкт-профессор патологии отделения экспериментальной патологии отделения патологии и член Центра исследования печени Университета Питтсбурга, является одним из главных исследователей проекта. Это проанализирует роль оси активина A / p15INK4b в индукции старения и ее влияние на прогрессирование хронического заболевания печени.


 62
62 34
34 22
22
 94
94 Пожалуйста, включите его, чтобы включить полную функциональность веб-сайта
Пожалуйста, включите его, чтобы включить полную функциональность веб-сайта  Первый Московский государственный медицинский университет им. М. Сеченова
Первый Московский государственный медицинский университет им. М. Сеченова