Грудные импланты «Силимед» («Silimed»)
Грудные импланты «Силимед» («Silimed»)
Крупнейшая бразильская компания «Silimed» является единственным бразильской производителем мягких силиконовых имплантатов. На рынке грудных протезов компания успешно развивается вот уже более 35 лет (основана в 1978-м). Десятилетия опыта, грамотного менеджмента и прицельное внимание, уделяемое постоянному продвижению своих изделий, позволили компании «Silimed» добиться лидерства и постоянно развивать медицинские устройства. Продукция компании всегда соответствует мировым стандартам высшего качества.
На сегодняшний день «Silimed» — одна из ведущих компаний, активно внедряющих силикон в Европе, и единственный немецкий изготовитель протезов из мягкой ткани. Главная специализация компании — грудные имплантаты. Продукты «Silimed» используются в клиниках восстановительной и эстетической пластической хирургии более чем 75 стран мира. Все грудные импланты изготавливаются вручную и соответствуют со мировым стандартам протезирования.
Одними из важнейших приоритетов компании «Silimed» являются диалог и сотрудничество с деловыми партнерами, хирургами и пациентами. Именно это позволяет постоянно повышать качество и всестороннюю безопасность всех продуктов, произведенных компанией.
Особой гордостью компании «Silimed» является программа «Implants of Excellence», которая гарантирует замену имплантатов на протяжении всей жизни пациентки. Название программы отображает суть этой акции – игра слов «Implants of Excellence» означает как «Превосходные импланты», так и «Внедрение Превосходства». Своей целью специалисты компании называют высшее качество и достижение максимальной безопасности для здоровья и тела пациента.
В настоящее время компания «Silimed» предлагает самый большой диапазон имплантатов, используемых для формирования контуров тела. Неважно, речь идет об имплантатах для увеличения груди или мягких эндопротезах – все продукты «Silimed» соответствуют высшим стандартам европейского качества.
Основная продукция – мягкие импланты, заполненные силиконовым гелем. Этот выбор продиктован идеальными свойствами материала, способного успешно заменять мягкие ткани. Силикон биологически инертен и не содержит опасных добавок, таких как, например, пластификаторы. Научные исследования, проводившиеся в разных странах, не сообщают о возникновении аллергических реакций при использовании продукции «Silimed».
Характерная особенность имплантатов «Silimed» — оболочка, разработанная специалистами компании. За годы интенсивных исследований были опробованы различные поверхностные структуры для имплантатов. Две из них («POLYtxt»®, «Microthane»®) отлично проявили себя как материалы, способные к сокращению капсульной контрактуры.
В спектр продукции компании «Silimed» входят:
- Грудные импланты;
- Имплантаты мягких тканей;
- Расширители кожи;
- Мягкие протезы, изготовленные на заказ;
- Другие продукты
Производитель имплантов «SILIMED»
Силиконовые грудные импланты используются в эстетической и реконструктивной хирургии с начала 1960-х годов. С тех пор технология изменилась к лучшему. Работая в тесном сотрудничестве как с врачами, так и с пациентами, специалисты «Silimed» разработали изделия таким образом, чтобы можно было гарантировать не только естественный вид и долгосрочную стабильность размера, но и безопасность использования эндопротезов.
С тех пор технология изменилась к лучшему. Работая в тесном сотрудничестве как с врачами, так и с пациентами, специалисты «Silimed» разработали изделия таким образом, чтобы можно было гарантировать не только естественный вид и долгосрочную стабильность размера, но и безопасность использования эндопротезов.
Кроме того, продукция регулярно и качественно тестируется, чтобы гарантировать высшее качество.
- Все импланты на 100% изготовлены вручную профессионалами из Бразилии согласно требованиям высшего качества.
- Силикон, который используется при изготовлении имплантатов, одобрен органами здравоохранения для длительного употребления.
- После каждого этапа производства каждый эндопротез вручную проверяется на возможные ошибки.
«Silimed» предлагает более чем 1500 разновидностей имплантатов для эстетического увеличения или пластики молочной железы – это разнообразие продуктов на сегодняшний момент просто уникально.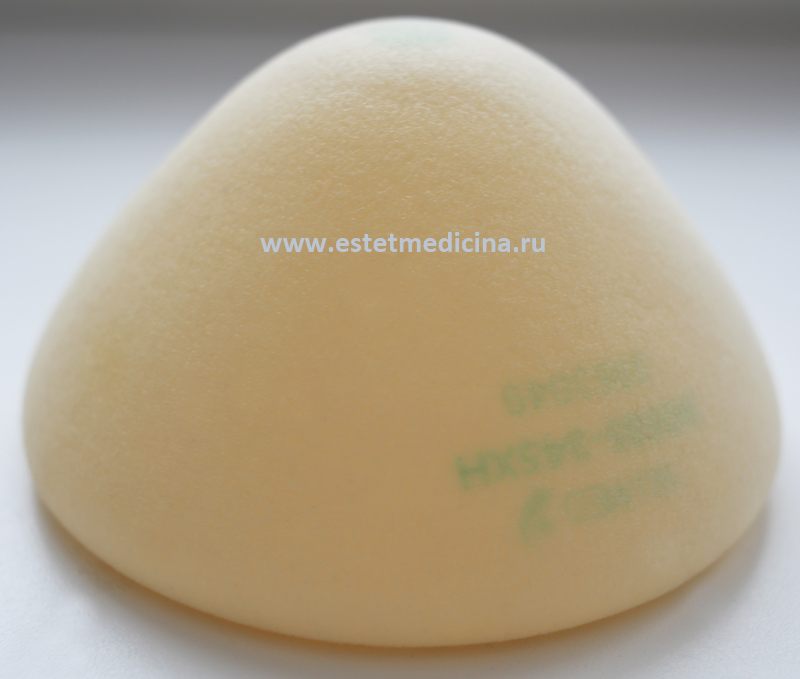
Все импланты, произведенные компанией, характеризуются специальным не жидким гелеобразным силиконом и многослойной, плотной оболочкой. Специально разработанная последовательность слоев геля и силикона позволяет искусственному наполнителю напоминать естественную грудь – как при контакте, так и в движении.
Оболочка имплантов «Силимед»
У всех эндопротезов «Silimed» есть многослойная силиконовая оболочка. Поверхность этой оболочки может иметь разную фактуру:
- гладкую: из материала «POLYsmoooth™»
- текстурированную: из материалов «MESMO®sensitive», «POLYtxt®»
- окутанную пеной микрополиуретана: из фирменного материала «Microthane®»
Текстурированные протезы и импланты, изготовленные из «Microthane®». имеют способность сохранять свое положение, которое невозможно нарушить двигательной активностью. Поверхность «Microthane®» дополнительно предлагает высокую степень защиты от капсульной контрактуры. В целом, такие оболочки чрезвычайно редко приводят к каким-либо осложнениям после имплантации.

Компания «Silimed» является единственным европейским изготовителем грудных имплантатов, покрытых материалом «Microthane®». Выбор поверхности эндопротеза пациентка обсуждает еще до операции со своим лечащим врачом или хирургом.
Типы имплантатов «Silimed»
Оптимальный тип эндопротеза, который будет использоваться при операции по увеличению или реконструкции груди, зависит от физических особенностей пациентки и ее личного предпочтения. Широкий ассортимент изделий позволяет хирургам находить лучшее решение, которое может удовлетворить как врача, так и пациентку.
В основном грудные импланты подразделяются на 2 типа:
- круглые имплантаты, которые создают округлую форму,
- анатомические имплантаты, равномерно распределяющие объем наполнителя.
На создание анатомических имплантатов разработчиков вдохновили естественные формы женской груди, благодаря чему изделия повторяют очертания женского тела.
Кроме того, эндопротезы различаются по типу поверхности и материалу наполнителя.
Все грудные импланты «Silimed» заполнены связным, не жидким силиконовым гелем. «Эффект памяти геля» позволяет практически мгновенно возвращать протез в исходную форму после некоторого давления или деформации. Когезионная способность материала гарантирует, что гель не будет просачиваться, а изделие сохранит свою форму, даже если имплантат подвергается сжатию. Силикон, который используется в этих изделиях, разработан для изготовления эндопротезов длительного ношения.
При производстве имплантатов используются несколько разновидностей силиконовых гелей, которые отличаются по твердости. Наиболее популярны два инновационных ряда грудных имплантатов, в общей сложности насчитывающие приблизительно 800 различных наименований:
Эндопротезы «Sublime Line®» имеют модульную конструкцию и заполнены устойчивым гелем.![]() Общее количество моделей этого ряда насчитывает 716.
Общее количество моделей этого ряда насчитывает 716.
Грудные импланты из ряда «Diagon\Gel® 4Two» заполнены мягким гелем в задней части и устойчивым гелем в передней части. Таких изделий насчитывается 86 моделей.
Зачастую эндопротезирование груди происходит по причине удаления молочной железы. Показаниями к такой масштабной операции являются злокачественные опухолевые процессы. Для женщины это представляет большую психологическую травму. В таком случае эндопротезирование груди может оказаться спасением от депрессии и решением всех проблем, связанных с личной жизнью пациентки.
Однако далеко не всегда возможно производить эндопротезирование непосредственно во время операции по маскэктомии (удаления молочной железы). Иногда протезирование груди приходится отложить на некоторый срок. В таких случаях необходимо подготовить кожу к имплантации протеза. Для этого используются специальные грудные импланты, называемые экспандерами.
Расширители груди (экспандеры)
Расширители груди прежде всего используются при хирургической реконструкции молочной железы после операций по удалению раковой опухоли. Они устанавливаются так же, как и имплантаты, но лишь временно, чтобы последовательно растянуть ткани, где необходимо сформировать кожный карман, обеспечивающий оптимальное пространство для реконструкции груди.
Они устанавливаются так же, как и имплантаты, но лишь временно, чтобы последовательно растянуть ткани, где необходимо сформировать кожный карман, обеспечивающий оптимальное пространство для реконструкции груди.
Изначально расширитель – это просто пустой контейнер со встроенным или удаленным клапаном. Полость постепенно заполняется через клапан соляным раствором. Процедуру наполнения контейнера повторяют до тех пор, пока размер кожного кармана не достигнет достаточных размеров, чтобы можно было имплантировать силиконовый эндопротез для постоянного ношения. Посредством медленного расширения ткани молочных желез пациентки формируется округлость, в которую может быть помещен имплантат.
Например, расширители груди анатомической формы значительно улучшают эстетический результат пластики молочной железы.
«Silimed» — единственная компания, которая производит расширители, точно соответствующие форме последующего долгосрочного эндопротеза.
Эндопротезы мягких тканей
В дополнение к большому выбору грудных имплантатов «Silimed» предлагает различные другие силиконовые изделия собственного производства:
- имплантаты мышц груди;
- ягодичные имплантаты;
- тестикулярные имплантаты;
- икроножные имплантаты.

Эти имплантаты мягких тканей используются для исправления контура тела – например, для коррекции формы мужской груди, голеней или ягодичной области.
Особенности эндопротезов «Силимед»
«Silimed» — единственный изготовитель грудных имплантатов и других эндопротезов мягких тканей в Бразилии. Компания постоянно продвигает развитие своих продуктов. С этой целью научно-исследовательская команда «Politec Silimed Gm b H» сотрудничает с врачами и пациентами.
Чтобы обеспечить максимальную безопасность и соответствие со стандартами высшего качества, сотрудники проверяют каждое изделие вручную после каждого производственного этапа.
Механические тесты под нагрузкой гарантируют, что можно ручаться за качество изделий даже в экстренных случаях. Имплантаты заполнены очень вязким, качественным гелем из силикона медицинского сорта, одобренным для протезов постоянного ношения.
Другая продукция
Кроме эстетического увеличения груди или пластики молочной железы после операций удаления раковой опухоли, есть много других косметических процедур, для которых предназначена следующая продукция. Морщины и лечение шрамов, липосакция и исправление контура тела с использованием имплантатов получают широкое распространение.
Морщины и лечение шрамов, липосакция и исправление контура тела с использованием имплантатов получают широкое распространение.
Специалисты компании используют собственные научные разработки для производства силиконовых изделий. Кроме этого компания «Silimed» производит медицинские устройства и инструменты для различных процедур в области пластической хирургии.
Компрессионное белье
Бюстгальтеры «Silimed» применяются после операций на груди. Они стабилизируют эстетический результат хирургии и имеют легкий лечебный эффект. Чашки удерживают имплантаты и бандажи на месте, облегчают осмотр раны и обработку, а также обеспечивают контакт тканей с имплантатом для лучшего врастания внутренних тканей поверх или вокруг протеза.
Лифчики сделаны из смешанных волокон с высокой долей хлопка для большего комфорта. Они выпускаются в белом и черном вариантах, и чашками или без. Их можно мыть вручную при 30°C . Бюстгальтер имеет регулируемую застежку на липучке.
Маммопластика фото до и после
Маммопластика по Теббетсу, импланты круглые, 360 мл.
Коррекция тубулярной груди, 3 нед. после операции
Маммопластика по Теббетсу. импланты круглые 300 мл.
Вертикальная мастопексия с редукцией — правая молочная железа, устранение тубулярности — левой молочной железы. Импланты 360-390 мл.
Sebbin, 365 мл
Sebbin, круглые, 330
Импланты Sebbin, 330-365 мл
Круглые импланты Sebbin? 260 мл.![]()
Круглые импланты Sebbin, 300 мл.
Коррекция высокого расположения имплантов. Sebbin, 330-365 мл. Пол часа после операции.
Импланты Sebbin, 360 мл. Неделя после операции.
Импланты Sebbin, 330 мл
Импланты Sebbin, 280 мл.
Импланты Sebbin, 330 — 360 мл.
Импланты Sebbin, 280 — 300 мл.
Импланты Sebbin, 300 мл.
Импланты Sebbin, анатомические импланты.
Импланты Sebbin, 610-550 мл. Устранение тубулярности.
Устранение тубулярности.
Импланты Sebbin, 395 мл.
цены, адреса клиник в Санкт-Петербурге, отзывы пациентов, запись онлайн – Spb.meds.ru
Цены на услугу «Пластика груди»:
Реэндопротезирование молочных желез 2 категория сложности
140000 ₽
Уменьшение молочных желез (малая, средняя или большая коррекция)
80000 ₽
Коррекция формы соска (1 сторона)
20000 ₽
Пластика сосково-ареолярного комплекса (1 грудь)
30000 ₽
Пластика молочной железы
45000 ₽
Репротезирование молочных желез 2 категории сложности
184000 ₽
Удаление полимерного геля из молочных желез
90000 ₽
Коррекция формы и объема молочной железы протезом субмускулярно (без стоимости протеза) с одной стороны
40000 ₽
Побережная Алла Викторовна: Увеличивающая маммопластика
Эндопротезы этих фирм на рынке в России уже более 10 лет. За это время они себя зарекомендовали исключительно с положительной стороны. Каждая пациентка после эндопротезирования молочных желез получает паспорт и пожизненную гарантию на установленный имплант. За несколько лет работы с имплантами Arion мы ни разу не наблюдали каких-либо дефектов и явлений производственного брака. Импланты фирмы Arion очень надежные, обладают исключительной мягкостью и пластичностью:
За это время они себя зарекомендовали исключительно с положительной стороны. Каждая пациентка после эндопротезирования молочных желез получает паспорт и пожизненную гарантию на установленный имплант. За несколько лет работы с имплантами Arion мы ни разу не наблюдали каких-либо дефектов и явлений производственного брака. Импланты фирмы Arion очень надежные, обладают исключительной мягкостью и пластичностью:
Эндопротезы по виду делятся на две категории:
1) круглые
2) каплевидные (анатомической формы)
Выбор формы(круглая или анатомическая) определяется исходной формой молочной железы и грудной клетки, а так же личными пожеланиями пациентки.
Покрыт имплант очень прочной силиконовой оболочкой, которая может быть гладкой или шероховатой (текстурированной).
Текстурированная оболочка предотвращает развитие капсулярной контрактуры и, как следствие, деформацию импланта.
Наполнителем имплантов Arion является когезивный силикон. В отличие от жидкого силикона, при повреждении импланта он не растекается в тканях. Благодаря когезивному гелю имплант лучше держит форму груди. Для тех пациенток, которые боятся устанавливать импланты с силиконом, мы можем предложить эндопротезы с нетоксичным гидрогелем( с карбоксиэтилцеллюлозой).
Гидрогель не токсичен и не обладает текучестью. Эти импланты можно устанавливать через небольшой доступ.
Перед операцией проводится тщательное обследование. На консультации мы проводим подробный осмотр и измерения. После подробной беседы, осмотра и измерений мы подбираем эндопротез, который наилучшим образом Вам подходит. Список анализов, необходимых к операции вы можете посмотреть у нас на сайте. Перед операцией необходимо провести маммографию или УЗИ молочных желез, а так же проконсультироваться у маммолога.
Эндопротезирование молочных желез проводится под наркозом.![]() По длительности занимает от 45 минут до 1,5 часов, в зависимости от доступа и уровня сложности.
По длительности занимает от 45 минут до 1,5 часов, в зависимости от доступа и уровня сложности.
Имплант можно установить под большой грудной мышцей (субпекторальная установка) или над большой грудной мышцей (субгландулярная установка). При тонкой коже и тонком слое подкожной жировой клетчатки поверхностное расположение эндопротеза(над большой грудной мышцей) может привести к контурированию импланта, поэтому в большинстве случаем мы устанавливаем эндопротезы субпекторально( под большую грудную мышцу).
Существует несколько доступов для эндоротезирования
инфраареолярный, при котором имплант устанавливается через разрез по нижнему краю ареолы. Чаще всего через несколько месяцев рубчик после подобного разреза практически не заметен.
субмаммарный, при котором эндопротез устанавливается через разрез под грудью(в области субмаммарной складки).
подмышечный, при котором эндопротез устанавливается через разрез в подмышечной области
Качество рубцов у каждого человека зависит не только от хирургической техники, но и от собственных особенностей, свойств кожи и выраженности процесса рубцевания.
Продемонстрируем вам для сравнения, как у разных пациентов выглядит рубец по нижнему краю ареолы:
После операции на раны накладывается стерильная повязка и на пациентку одевается компрессионное белье.
Болевые ощущения максимальны в первые 2-3 дня, затем они в течение недели постепенно проходят.
В послеоперационном периоде мы настоятельно рекомендуем строго следовать предписанию врача: не поднимать руки вверх, не выполнять физические упражнения, не поднимать тяжести. В первый месяц после операции исключается баня, сауна, солярий. Период ограничений и срок ношения компрессионного белья может продолжаться до 3-4 недель.
Грудные имплантаты Silimed, подвешенные MHRA
Silimed — бразильская компания, производящая грудные имплантаты, которые продаются по всему миру. На прошлой неделе органы по маркировке СЕ в Европе приостановили действие маркировки СЕ для этих имплантатов после ежегодной проверки производственного процесса. В результате MHRA в Великобритании рекомендовало прекратить использование этих имплантатов до дальнейшего уведомления.
В результате MHRA в Великобритании рекомендовало прекратить использование этих имплантатов до дальнейшего уведомления.
Почему имплантаты Silimed больше не используются?
Эти грудные имплантаты были изъяты из использования, поскольку соответствующие органы требуют разъяснений относительно производственного процесса после недавней проверки, проведенной в сентябре этого года.Знак СЕ обязателен, так как он означает, что продукт должен соответствовать европейским стандартам. Для поддержания маркировки CE требуется регулярная проверка, а без маркировки CE имплантаты не могут использоваться в Европе. В результате этого MHRA в Великобритании также приостановило использование этих имплантатов в Великобритании. Тем не менее, MHRA заявило, что нет никаких опасений, связанных с безопасностью пациентов.
Какова конкретная проблема, связанная с отзывом знака СЕ?
Органы по маркировке CE подняли вопрос, касающийся небольшого количества частиц, обнаруженных в имплантатах. Точная природа этих частиц еще предстоит выяснить. Silimed утверждает, что все грудные имплантаты содержат очень низкий уровень несиликоновых частиц, но в Европе этот уровень не определен, и это вопрос, требующий уточнения. Silimed утверждает, что они добровольно отозвали имплантаты с рынка и что они находятся в процессе составления технического отчета, который будет представлен европейским властям.
Точная природа этих частиц еще предстоит выяснить. Silimed утверждает, что все грудные имплантаты содержат очень низкий уровень несиликоновых частиц, но в Европе этот уровень не определен, и это вопрос, требующий уточнения. Silimed утверждает, что они добровольно отозвали имплантаты с рынка и что они находятся в процессе составления технического отчета, который будет представлен европейским властям.
Какой тип имплантатов Silimed затронут?
Silimed производит многочисленные типы силиконовых имплантатов, включая грудные имплантаты, грудные имплантаты, ягодичные имплантаты, имплантаты голени и другие силиконовые изделия, используемые в других хирургических дисциплинах.Они особенно известны своими грудными имплантатами, где они производят стандартные текстурированные силиконовые имплантаты, а также грудные имплантаты с полиуретановым покрытием. Последний имеет силиконовый гель, покрытый пенополиуретаном, который уменьшает некоторые осложнения грудных имплантатов, такие как капсулярная контрактура и вращение. Все силиконовые изделия изъяты из употребления.
Все силиконовые изделия изъяты из употребления.
Что неясно, так это то, что производственное предприятие несколько раз проверялось FDA за последние 10 лет, а также в течение последних двух лет Европейскими властями, и, следовательно, любые потенциальные неблагоприятные проблемы, если таковые имеются, связанные с имплантатами, скорее всего, касаются только недавно изготовленные имплантаты.
Эта ситуация похожа на проблемы с имплантатом PIP?
Эта ситуация полностью отличается от проблемы имплантата PIP. С имплантатами PIP компания совершила мошенничество, преднамеренно изменив производственный процесс и скрыв это от властей. Были опасения, что силиконовый гель не соответствует стандартам, а имплантаты имеют более высокую частоту разрывов из-за того, что в некоторых случаях имплантаты имеют слабую оболочку. Нет никаких указаний на то, что силикон силикона в имплантатах Silimed не соответствует стандартам, и нет сообщений о более высокой частоте разрывов. Кроме того, компания PIP была ликвидирована, что означало аннулирование гарантии на грудные имплантаты. В текущей ситуации компания Silimed полностью подчиняется властям и добровольно приостановила продажу имплантатов на европейском рынке. Их заявление можно прочитать ниже.
Кроме того, компания PIP была ликвидирована, что означало аннулирование гарантии на грудные имплантаты. В текущей ситуации компания Silimed полностью подчиняется властям и добровольно приостановила продажу имплантатов на европейском рынке. Их заявление можно прочитать ниже.
Есть опасения, связанные с безопасностью пациента?
MHRA опубликовало заявление, в котором говорится, что в настоящее время нет проблем с безопасностью пациентов. Нет показаний к замене или удалению имплантатов и не требуется медицинской помощи.
Силимед выдал заявление?
Выписку от Silimed можно прочитать так:
17 сентября SILIMED Industria de Implantes Ltda., крупная бразильская компания, специализирующаяся на силиконовых имплантатах, была опрошена европейским агентством по сертификации относительно его критериев для частиц. Компания немедленно ответила европейским санитарным органам и предоставляет техническую документацию, подтверждающую безопасность своей продукции. Наличие минимального уровня частиц является нормальным для всех медицинских изделий, включая другие силиконовые имплантаты, доступные на рынке, и ничто не указывает на риск для здоровья. Наличие частиц не означает, что продукт загрязнен.
Наличие минимального уровня частиц является нормальным для всех медицинских изделий, включая другие силиконовые имплантаты, доступные на рынке, и ничто не указывает на риск для здоровья. Наличие частиц не означает, что продукт загрязнен.
SILIMED добровольно приостановил продажу части продукта на европейском рынке до тех пор, пока местные органы здравоохранения не получат официальный технический документ. Компания подчеркивает, что анализ литературы и критериев наличия частиц не выявил каких-либо данных о рисках и что с 1998 года она поддерживает индекс послепродажного надзора среди стандартов, требуемых действующим законодательством.
SILIMED также уточняет, что опрос связан исключительно с руководящими принципами санитарной политики Европейского сообщества и что он соответствует другим правилам, действующим на других рынках. Компания сообщает, что данная ситуация не указывает на необходимость замены имплантов или дополнительной медицинской помощи.
ПРЕСС-РЕЛИЗ
Что касается пресс-релиза, опубликованного Агентством по регулированию лекарственных средств и товаров медицинского назначения — MHRA — вчера, 23 сентября, SILIMED разъясняет, что:
На сегодняшний день нет технического отчета, показывающего, что продукты SILIMED должны быть удалены с рынка.
Компания добровольно приостановила коммерциализацию продуктов на европейском рынке до тех пор, пока местные органы здравоохранения не получат официальный технический отчет.
Вся продукция SILIMED производится в соответствии с высочайшими стандартами безопасности и подвергается испытаниям для демонстрации ее стерильности во всех партиях. Наличие минимального количества частиц не означает загрязнения.
Наличие минимального уровня частиц характерно для всех медицинских изделий, включая оставшиеся на рынке силиконовые имплантаты.
Обнаруженный уровень частиц чрезвычайно низок и соответствует всем рынкам, на которых существуют заранее определенные критерии, например, Бразилия, где продукты тестируются случайным образом на рынке для аккредитованных органов (Inmetro).
В европейском сообществе нет критериев, определяющих уровни частиц, что может привести к абсолютно субъективному анализу.
Компания выпускает технические отчеты, чтобы доказать полную безопасность своей продукции.
Анализ риска был одобрен доктором Вандой Элизабет, координатором Силиконовой комиссии Бразильского общества пластической хирургии и одним из ведущих экспертов в этой области.
SILIMED — бразильская компания по производству силиконовых имплантатов, на рынке уже 37 лет, одобрена в 75 странах. Это лидер отрасли, третий по величине производитель данного типа продукции в мире и эталон на мировом рынке инноваций и качества.На сегодняшний день у компании нет записей о происшествиях такого рода.
Любая интерпретация темы в прессе может нанести непоправимый ущерб компании SILIMED, которая всегда обеспечивала полную безопасность и качество своей продукции.
SILIMED предоставляет любую необходимую дополнительную информацию через агентство Kreab SA.
Приостановили ли другие страны использование продуктов Silimed?
Продукты Silimed были приостановлены для использования во всех европейских странах, а также в Австралии. Однако они продолжают использоваться в Соединенных Штатах, где фирменный продукт называется Sientra и одобрен FDA. В настоящее время FDA не приостановило использование грудных имплантатов Sientra, и эти имплантаты продолжают использоваться в Соединенных Штатах.
Однако они продолжают использоваться в Соединенных Штатах, где фирменный продукт называется Sientra и одобрен FDA. В настоящее время FDA не приостановило использование грудных имплантатов Sientra, и эти имплантаты продолжают использоваться в Соединенных Штатах.
Какая связь между грудными имплантатами Silimed и грудными имплантатами Sientra в Соединенных Штатах?
Sientra — это бренд грудных имплантатов, продаваемых в США тем же производителем грудных имплантатов Silimed.Поэтому имплантаты Sientra производятся на том же предприятии, что и имплантаты Silimed. Объект был проверен FDA (лицензирующим органом США) несколько раз за последние 10 лет, и никаких проблем обнаружено не было. Фактически Sientra является единственным продуктом, имеющим одобрение FDA для имплантатов анатомической формы в Соединенных Штатах. FDA не прекратило использование грудных имплантатов Sientra в Соединенных Штатах.
Компания Sientra сделала заявление своим пластическим хирургам в США, которое гласит:

Уважаемый уважаемый пластический хирург,
Я хотел прокомментировать некоторые новости отрасли, о которых нам стало известно вчера.Агентство по регулированию лекарственных средств и изделий медицинского назначения (MHRA), исполнительный орган Министерства здравоохранения Соединенного Королевства, объявило о приостановке действия сертификата CE компании Silimed для всех медицинских устройств, производимых Silimed. Примечательно, что MHRA заявило в своем заявлении, что «в настоящее время не было никаких указаний на то, что эти проблемы могут представлять угрозу безопасности пациентов».
Как вы, возможно, знаете, Silimed является одним из наших контрактных производителей. Обратите внимание, что объявление MHRA не распространяется на продукцию Sientra, поскольку оно применимо только к распространению имплантатов Silimed с маркировкой CE в Европе.Наши продукты регулируются FDA и одобрены PMA. Грудные имплантаты Sientra и другие наши продукты по-прежнему продаются и доступны в Соединенных Штатах, и нормативный статус грудных имплантатов Sientra, одобренных FDA, не изменился.
Мы уверены в безопасности нашей продукции, и вы можете при необходимости успокоить своих пациентов, сообщив им, что не было никаких признаков того, что эти проблемы могут представлять угрозу для их безопасности. В свете этой новости мы, конечно же, проведем собственную проверку, чтобы обеспечить постоянное соблюдение наших собственных высоких внутренних стандартов.
Еще несколько важных пунктов, на которые стоит обратить внимание:
Силимед заверил нас, что они работают с MHRA в Европейском союзе для скорейшего решения проблем; и Silimed неоднократно подвергался аудиту FDA, чтобы обеспечить соответствие Регламенту о системах качества, и на сегодняшний день ни разу не получил замечания 483. Silimed также прошел аудит со стороны ANVISA и других регулирующих органов Бразилии.
Наша недавняя публикация наших клинических данных за 8 лет наблюдения подтверждает нашу неизменную репутацию безопасности и эффективности.
Учитывая нашу непоколебимую приверженность вам и вашим пациентам, я буду продолжать держать вас в курсе.
А пока, как всегда, я и моя команда готовы ответить на ваши потребности и запросы. Пожалуйста, не стесняйтесь обращаться к нам через нашу линию запроса информации по адресу [email protected] или по телефону 888.708.0808.
С уважением,
Хани Зейни
Основатель и главный исполнительный директор
Сиентра, Инк
Что будет дальше?
Silimed активно работает над созданием технического отчета, чтобы убедить соответствующие органы в том, что продукция безопасна и соответствует требованиям.Как только это будет подтверждено, и после того, как знак CE будет восстановлен, представители Silimed уверены, что продукты вернутся на рынок. Это текущая ситуация, и MHRA будет предоставлять регулярные обновления.
Информация о грудных имплантатах Silimed
Резюме компании
Silimed, бразильская компания, занимается разработкой и производством косметических продуктов с 1978 года. В настоящее время они работают более чем в 70 странах на пяти континентах.
Они утверждают, что имеют самый широкий ассортимент грудных имплантатов на рынке, которые изготовлены из оболочки из силиконового эластомера с низкой кровоточивостью, заполненной высокоэффективным силиконовым гелем BioDesign, образующим стабильный медицинский силиконовый гель, способный воспроизводить мягкие ткани предполагаемой области.
Грудные имплантаты Silimed распространяются в Великобритании компанией Eurosurigical Ltd с 2002 года.
У Silimed есть программа замены продуктов для всех силиконовых грудных имплантатов, а также пожизненное страхование от разрывов. В случае разрыва оболочки грудного имплантата Silimed в течение жизни пациента хирургу будет предоставлен новый имплантат. Silimed также предлагает замену своих полиуретановых грудных имплантатов на срок до десяти лет после операции в случае капсулярной контрактуры, ротации и смещения имплантата (вниз или в сторону).
На каждом грудном имплантате Silimed выбиты марка и размер, чтобы его можно было легко идентифицировать в любое время. Они также являются первой и единственной компанией, напечатавшей уникальный серийный номер на каждом произведенном грудном имплантате, что гарантирует полную отслеживаемость. (Большинство производителей используют нумерацию партий).
Они также являются первой и единственной компанией, напечатавшей уникальный серийный номер на каждом произведенном грудном имплантате, что гарантирует полную отслеживаемость. (Большинство производителей используют нумерацию партий).
Лицензирование
Завод Silimed в Рио-де-Жанейро, Бразилия, имеет сертификаты ISO 9001-2008 и EN 13485, а их продукция имеет европейскую маркировку CE.Используемый в производстве силиконовый гель медицинского назначения импортируется из США.
В марте 2012 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило грудные имплантаты Silimed круглой и формованной формы из силиконового геля. Silimed стала первой компанией за пределами США, получившей разрешение на силиконовые грудные имплантаты, и первой и единственной компанией, получившей одобрение FDA на формованные (или анатомические) гелевые грудные имплантаты.
В октябре 2012 года в американском журнале PRS было опубликовано 5-летнее многоцентровое проспективное исследование для предварительного одобрения FDA для текстурированных и гладких грудных имплантатов Silimed. Исследование впервые демонстрирует снижение распространенных осложнений в хирургии молочной железы (капсулярная контрактура) при использовании имплантатов Silimed с текстурированной поверхностью по сравнению с имплантатами с гладкой поверхностью – с 10% в течение 5 лет до 3%.
Исследование впервые демонстрирует снижение распространенных осложнений в хирургии молочной железы (капсулярная контрактура) при использовании имплантатов Silimed с текстурированной поверхностью по сравнению с имплантатами с гладкой поверхностью – с 10% в течение 5 лет до 3%.
Типы и размеры имплантатов
Silimed производит силиконовые грудные имплантаты различных типов и размеров, включая три текстуры поверхности, более 31 стиля дизайна, многие из которых являются уникальными для Silimed, и более 600 размеров.
Грудные имплантаты с силиконовым гелем
Компания Silimed разработала формоустойчивый силиконовый гель BioDesign™, который имеет высокую степень поперечной связи и используется благодаря своей устойчивости к изменению формы и повреждению.Этот тип формостабильного геля также связан с уменьшением частоты кровотечений и означает, что имплантаты с меньшей вероятностью будут складываться.
Силиконовые имплантаты груди BioDesign™
Коллекция грудных имплантатов BioDesign™ от Silimed производится в различных формах и профилях, и каждая модель доступна в четырех различных проекциях.
Каждая модель в этой линейке имеет плоское основание, предназначенное для адаптации и прилегания к стенке грудной клетки, что позволяет ей сохранять свой выступ.Поскольку основание плоское, а края сужены, имплантаты могут быть заполнены большим количеством геля, а это означает, что имплантаты с меньшей вероятностью сморщиваются или деформируются после имплантации, сохраняя форму груди очень естественной, говорят производители.
Ассортимент BioDesign производится с использованием уникального геля BioDesign™ от Silimed, обладающего большей эластичностью и памятью, что придает груди естественный вид и ощущение.
Еще одной уникальной особенностью имплантатов является новое измерение D, отмеченное цветной точкой.Это может быть использовано хирургом в качестве ориентира для размещения имплантата в правильном месте по отношению к соску и ареоле.
Грудные имплантаты с полиуретановым покрытием P-URE
Грудные имплантаты BioDesign с пенополиуретановым покрытием имеют очень низкую скорость сокращения капсулы: производители утверждают, что только 1-2% имплантатов сжимаются после 15 лет имплантации.
Более низкая скорость сокращения капсулы в значительной степени связана с текстурой поверхности имплантатов, покрытой вспененным материалом.Вокруг каждой полиуретановой стойки на поверхности имплантатов образуются микрокапсулы, которые нейтрализуют векторы сокращения и минимизируют возникновение капсульного сокращения. Поверхность пены также легко прилипает к окружающим тканям, сводя к минимуму возникновение смещения.
Эти имплантаты доступны с различной высотой и выступами, а гель BioDesign сохраняет внешний вид имплантата естественным.
Грудные имплантаты с гладкой поверхностью
Грудные имплантаты Silimed с гладкой поверхностью, наполненные силиконовым гелем, доступны в круглой и каплевидной формах, с различными высокими и низкими выступами.
Грудные имплантаты с текстурированной поверхностью
Грудные имплантаты Silimed с текстурированной поверхностью, заполненной силиконовым гелем, доступны в круглой, каплевидной, анатомической и малой анатомической форме, в низкой, средней, высокой и сверхвысокой проекциях.
Клинические документы
Грудные имплантаты с силиконовым гелем с полиуретановым покрытием, используемые в течение 18 лет.
Васкес и Пеллон, Aesth Plast Surg, 2007.
Долгосрочная безопасность и эффективность грудных имплантатов, покрытых пенополиуретаном.
Гендель, журнал эстетической хирургии, май-июнь 2006 г.
Медицинские устройства Silimed (все, включая грудные имплантаты)
Обновление 4 – Аннулирование всех устройств
TGA исключило все медицинские устройства, произведенные Silimed (спонсируемым в Австралии компанией Device Technologies), из Австралийского реестра терапевтических товаров 5 ноября 2016 г. срок приостановки истек до того, как приостановка была отменена.
Эта информация была опубликована в то время в разделе «Медицинские устройства и IVD: Отмены с веб-страницы ARTG».
Обновление 3 — Расширение приостановки
6 мая 2016 г.
TGA продлило приостановку действия всех медицинских устройств производства Silimed из Австралийского реестра терапевтических товаров до 4 ноября 2016 года.
Продление приостановки означает, что продукты не могут поставляться в Австралию, пока приостановка остается в силе.
Обновление 2. Продукция ARTG приостановлена до тех пор, пока не будут выполнены стандарты качества
30 ноября 2015 г.
TGA приостановило включение всех медицинских устройств, произведенных Silimed, в Австралийский реестр терапевтических товаров с 20 ноября 2015 г. по 6 мая 2016 г., поскольку в настоящее время спонсор не может продемонстрировать, что устройства соответствуют необходимым требованиям безопасности и качества.
Эти продукты не могут поставляться на австралийский рынок, пока действует приостановка.
Отстранение может быть снято, если спонсор предоставит достаточные доказательства соблюдения требований безопасности и качества.![]() В дополнение к информации, предоставленной спонсором, TGA будет принимать во внимание свои собственные расследования, а также действия органа по сертификации TUV Sud и других регулирующих органов, прежде чем приостановка заявок ARTG будет отменена.
В дополнение к информации, предоставленной спонсором, TGA будет принимать во внимание свои собственные расследования, а также действия органа по сертификации TUV Sud и других регулирующих органов, прежде чем приостановка заявок ARTG будет отменена.
Обновление 1 — частицы, предварительно идентифицированные как кремнезем и хлопок
25 сентября 2015 г.
TGA получила информацию от австралийского спонсора имплантатов Silimed о том, что неизвестные частицы, упомянутые ниже, были идентифицированы как кремнезем и хлопок.
Хотя у нас нет причин сомневаться в этой информации, мы постараемся подтвердить этот вывод путем тестирования и сотрудничества с зарубежными регулирующими органами. Нам также сообщили, что на производственной площадке проводится анализ основных причин.
Пока расследование не будет завершено, распространение имплантатов Silimed будет приостановлено.
Рекомендации по технике безопасности
24 сентября 2015 г.
TGA известно, что органы регулирования здравоохранения Европейского союза (ЕС) приостановили действие утверждения всех устройств, производимых бразильской компанией Silimed, после проверки производственной площадки.
TGA срочно выясняет, какие действия необходимо предпринять в Австралии, и будет тестировать образцы продукции Silimed в своих лабораториях.
Действие сертификата CE компании Silimed было приостановлено после того, как представители органов здравоохранения Германии проинспектировали завод-производитель компании Silimed и обнаружили, что поверхности некоторых устройств были загрязнены неизвестными частицами. Как правило, медицинское устройство не может продаваться в Европе без знака соответствия СЕ.
Бразильский производитель был проверен в марте 2014 года и признан соответствующим всем требованиям.Существующие проблемы были выявлены в ходе ежегодной повторной проверки.
Silimed производит широкий спектр устройств, поставляемых на рынок Австралии, но грудные имплантаты составляют подавляющую долю продукции Silimed, используемой в этой стране. В разделе «Дополнительная информация» ниже приведен список всех затрагиваемых продуктов.
В разделе «Дополнительная информация» ниже приведен список всех затрагиваемых продуктов.
В качестве меры предосторожности и после консультации с TGA австралийский дистрибьютор (Device Technologies) связался с хирургами, которым были поставлены эти имплантаты, чтобы рекомендовать отложить любые запланированные операции по имплантации.Компания Device Technologies прекратила поставки всей продукции Silimed до выяснения ситуации.
У TGA не было отчетов о нежелательных явлениях, связанных с этими продуктами, и не было указаний на то, что эти проблемы могут представлять угрозу безопасности человека, которому имплантировали.
TGA запрашивает дополнительную информацию у производителя и других регулирующих органов и предоставит обновленную информацию, когда она станет доступной. Тем временем TGA работает с профессиональными группами, чтобы предоставить пациентам как можно больше информации.
Информация для потребителей
Если вы получили имплантат Silimed, будьте уверены, что нет никаких признаков того, что эта проблема представляет угрозу для вашей безопасности.
Если у вас есть какие-либо вопросы или опасения по этому поводу, обратитесь к своему терапевту или хирургу для индивидуальной клинической оценки и консультации.
Информация для медицинских работников
Если у вас есть пациент, который получил имплантат Silimed, будьте внимательны к этой проблеме. Убедите их, что нет никаких признаков того, что эта проблема представляет угрозу их безопасности.
Направьте их к хирургу-имплантологу, если у них есть какие-либо опасения.
Информация для хирургов
Хирургам рекомендуется отложить операции с использованием имплантатов Silimed или заменить их альтернативными продуктами до выяснения ситуации.
TGA рекомендует связаться с пациентами, которым были имплантированы эти устройства, чтобы сообщить им об этой проблеме.
Хирургам-имплантологам рекомендуется придерживаться стандартного протокола наблюдения за пациентами, которым были имплантированы устройства Silimed.Необходимость любого дополнительного наблюдения или действий следует определять в каждом конкретном случае после детальной оценки клинических обстоятельств пациента.
Дополнительная информация
| Номер Австралийского реестра терапевтических товаров | Тип устройства |
|---|---|
| 141293 | Расширитель кожи |
| 143151 | Тканевый реконструктивный материал, синтетический, силиконовый, листовой |
| 143152 | Тканевый реконструктивный материал, синтетический, силиконовый, блок |
| 143181 | Протез внутренний ленточный для гастропластики |
| 143651 | Баллон желудочный для подавления аппетита |
| 144004 | Протез внутренний яичка |
| 144268 | Протез внутренний подбородочный |
| 144269 | Протез внутренний ушной |
| 144270 | Протез внутренний мышечный |
| 144271 | Протез внутренний мышечный |
| 144272 | Протез внутренний мышечный |
| 144273 | Протез внутренний носовой |
| 144274 | Протез внутренний скуловой |
| 144275 | Протез внутренний скуловой |
| 144276 | Протез внутренний уретральный сфинктерный |
| 144278 | Протез, внутренний, полового члена, стержневой |
| 144436 | Протез, внутренний, стент, вагинальный |
| 145286 | Повязка, окклюзионная, силиконовая |
| 147758 | Протез внутренний суставной палец |
| 147759 | Внутренний протез сухожильного влагалища |
| 148763 | Имплантат молочной железы — Силиконовый гель — Текстурированная поверхность — Протез, внутренний, молочный, наполненный гелем |
| 148764 | Имплантат молочных желез, силиконовый гель, гладкая поверхность, внутренний протез молочной железы, наполненный гелем |
| 148765 | Имплантат молочных желез с покрытием из силиконового геля и пенополиуретана — Протез, внутренний, молочный, наполненный гелем |
| 149172 | Катетер, урологический, coude |
Сообщение о проблемах
Потребителям и медицинским работникам рекомендуется сообщать о проблемах с медицинскими устройствами. Ваш отчет будет способствовать мониторингу этих продуктов TGA. Для получения дополнительной информации см. Схему отчетности и расследования инцидентов TGA (IRIS).
Ваш отчет будет способствовать мониторингу этих продуктов TGA. Для получения дополнительной информации см. Схему отчетности и расследования инцидентов TGA (IRIS).
TGA не может дать совет о состоянии здоровья человека. Вам настоятельно рекомендуется поговорить с медицинским работником, если вы обеспокоены возможными побочными эффектами, связанными с медицинским устройством.
«Игра имплантатов»: Взгляд на кризисную историю грудных имплантатов | Журнал эстетической хирургии
Аннотация
С момента своего появления на рынке грудные имплантаты стали предметом многочисленных споров.Настало время изучить силы, которые сформировали индустрию грудных имплантатов, чтобы сделать ее такой, какая она есть сегодня. В этом обзоре основное внимание будет уделено использованию имплантатов в эстетической хирургии, а не их использованию при реконструкции молочной железы, но некоторые факторы имеют отношение к обоим показаниям.![]()
«Ты боишься? Хорошо. Вы сейчас в великой игре. И великая игра ужасает».
— Тирион Ланнистер [к Дейенерис Таргариен] Игра престолов (6 сезон, 10 серия)
Бесчисленные силы, сформировавшие индустрию грудных имплантатов, представлены здесь как «игра в имплантаты» (рис. 1). .Настало время рассмотреть влияние каждой из этих сил на отрасль в ее нынешнем виде.
Рисунок 1.
Рисунок 1.
Кронин и Героу разработали первый силиконовый имплантат при участии компании Dow Corning, вдохновившись внешним видом и ощущением пакета с кровью. 1 Это привело к выходу на рынок имплантатов Dow Corning в 1963 году. К 1992 году рынок грудных имплантатов приносил годовой доход примерно в 500 миллионов долларов, и около 80% доходов приходилось на косметическое увеличение. 2 Большую часть доходов составляли гонорары хирургов. Хотя доля Dow Corning на рынке составляла 35%, грудные имплантаты производили еще 4 производителя: Surgitek (дочерняя компания Bristol-Myers Squib), McGhan Medical Corporation (приобретена INAMED), Mentor Corporation и Bioplasty. 2 Промышленность уже отреагировала на ранние заявления о силиконовых кровотечениях и капсулярной контрактуре, изменив внешнюю оболочку имплантатов.
2 Промышленность уже отреагировала на ранние заявления о силиконовых кровотечениях и капсулярной контрактуре, изменив внешнюю оболочку имплантатов.
Первый кризис: Dow Corning
Первое сообщение о том, что силиконовые грудные имплантаты потенциально связаны с аутоиммунным заболеванием, появилось в 1982 г. в виде серии сообщений о 3 пациентах, у которых развилось аутоиммунное заболевание соединительной ткани (системная красная волчанка, смешанное заболевание соединительной ткани и ревматоидный артрит) в течение 3 лет после их рождения. косметическое увеличение груди. 3 Авторы упомянули о риске воздействия парафина или переработанной нефти из-за предыдущих методов увеличения груди и постулировали, что потенциальная иммунологическая активность силикона и его деградация «предполагают, что связь может быть более чем случайной». 3 Растущие сообщения о связи силикона с адъювантной болезнью 4,5 привели к подаче многочисленных судебных исков против ведущего производителя имплантатов того времени, Dow Corning. Управление этим кризисом компанией Dow Corning стало хрестоматийным примером того, как не следует справляться с растущей общественной и юридической угрозой. 6 Короче говоря, компания не проявляла сочувствия и поддержки к женщинам, которые утверждали, что им причинили вред, не спешил быстро сообщать худшие новости и, сталкиваясь с заявлениями, которые не были строго подтверждены научными данными, стремилась запутать правду, а не защищать ее, потенциально вводя в заблуждение регулирующие органы, врачей и потребителей относительно степени неуверенности внутри компании в отношении ее собственных данных о безопасности. 7
Управление этим кризисом компанией Dow Corning стало хрестоматийным примером того, как не следует справляться с растущей общественной и юридической угрозой. 6 Короче говоря, компания не проявляла сочувствия и поддержки к женщинам, которые утверждали, что им причинили вред, не спешил быстро сообщать худшие новости и, сталкиваясь с заявлениями, которые не были строго подтверждены научными данными, стремилась запутать правду, а не защищать ее, потенциально вводя в заблуждение регулирующие органы, врачей и потребителей относительно степени неуверенности внутри компании в отношении ее собственных данных о безопасности. 7
Реагирование регулирующих органов
При первом появлении на рынке грудные имплантаты не подпадали под контроль регулирующих органов, поскольку считались «медицинским устройством», а не лекарством. Соединенные Штаты начали регулировать медицинские устройства с поправками к законодательству в 1976 году, но грудные имплантаты, которые были на рынке в течение 10 лет и в основном по косметическим показаниям, были «дедушкины» и классифицированы как класс II, умеренный риск (таблица 1). ). 8 В то время стандартом было то, что грудные имплантаты должны быть «практически эквивалентны» устройствам, уже представленным на рынке. В 1982 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) под давлением растущих сообщений о нежелательных явлениях, включая капсулярную контрактуру, кровотечение из геля и возможную связь с аутоиммунным заболеванием, реклассифицировало грудные имплантаты как устройства класса III, «при условии демонстрации безопасности и эффективности». ». В 1991 году, после слушаний в Конгрессе и популярного мнения о том, что производители имплантатов скрывают доказательства, FDA обратилось ко всем производителям с призывом предоставить данные о безопасности и эффективности (предпродажное одобрение [PMA]). 9 Примерно в это же время первый текстурированный имплантат, Мем, был удален с рынка в Соединенных Штатах. Это был имплантат с полиуретановым покрытием, который был связан с выделением 2,4-толуолдиамина, канцерогена у животных.
). 8 В то время стандартом было то, что грудные имплантаты должны быть «практически эквивалентны» устройствам, уже представленным на рынке. В 1982 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) под давлением растущих сообщений о нежелательных явлениях, включая капсулярную контрактуру, кровотечение из геля и возможную связь с аутоиммунным заболеванием, реклассифицировало грудные имплантаты как устройства класса III, «при условии демонстрации безопасности и эффективности». ». В 1991 году, после слушаний в Конгрессе и популярного мнения о том, что производители имплантатов скрывают доказательства, FDA обратилось ко всем производителям с призывом предоставить данные о безопасности и эффективности (предпродажное одобрение [PMA]). 9 Примерно в это же время первый текстурированный имплантат, Мем, был удален с рынка в Соединенных Штатах. Это был имплантат с полиуретановым покрытием, который был связан с выделением 2,4-толуолдиамина, канцерогена у животных. 10 Позже выяснилось, что имплантаты были покрыты нестерильным и немедицинским полиуретановым покрытием. Около 1 миллиона таких имплантатов уже были имплантированы женщинам без надлежащего контроля стерильности и производственных стандартов.Когда данные по безопасности и эффективности были наконец получены и рассмотрены FDA, агентство раскритиковало все исследования как слишком маленькие и слишком короткие по времени, чтобы доказать безопасность. В январе 1992 года FDA ввело «добровольный мораторий» на грудные имплантаты. 8 Это потребовало приостановки всех продаж и имплантации устройств до получения новых данных по безопасности. Имплантаты можно было использовать только для реконструкции груди или при замене существующего имплантата и только в контексте текущих проспективных клинических исследований.Было включено много пациентов, но поскольку целью было просто удовлетворить условия участия в исследовании, пациенты быстро выбыли из исследований, что отрицательно сказалось на данных долгосрочного наблюдения.
10 Позже выяснилось, что имплантаты были покрыты нестерильным и немедицинским полиуретановым покрытием. Около 1 миллиона таких имплантатов уже были имплантированы женщинам без надлежащего контроля стерильности и производственных стандартов.Когда данные по безопасности и эффективности были наконец получены и рассмотрены FDA, агентство раскритиковало все исследования как слишком маленькие и слишком короткие по времени, чтобы доказать безопасность. В январе 1992 года FDA ввело «добровольный мораторий» на грудные имплантаты. 8 Это потребовало приостановки всех продаж и имплантации устройств до получения новых данных по безопасности. Имплантаты можно было использовать только для реконструкции груди или при замене существующего имплантата и только в контексте текущих проспективных клинических исследований.Было включено много пациентов, но поскольку целью было просто удовлетворить условия участия в исследовании, пациенты быстро выбыли из исследований, что отрицательно сказалось на данных долгосрочного наблюдения.
9
| Класс . | Описание . |
|---|---|
| I | Те устройства, для которых «общего контроля достаточно, чтобы обеспечить разумную уверенность в безопасности и эффективности устройства» (например, лейкопластыри, зубные щетки, очки и термометры). |
| II | Те устройства, для которых «существует стандарт производительности, обеспечивающий разумную гарантию безопасности и эффективности» (например, кардиомониторы, наркозные аппараты и дефибрилляторы, а также магнитно-резонансные томографы). |
| III | Эти устройства, «предполагаемые или представляемые как предназначенные для поддержки или поддержания жизни человека или для использования, которое имеет существенное значение для предотвращения ухудшения здоровья человека или представляет потенциальный необоснованный риск заболевания или травмы (например, протезы груди из силиконового геля [имплантаты], ВМС, эндолимфатические шунты и костные имплантаты). |
| Класс . | Описание . |
|---|---|
| I | Те устройства, для которых «общего контроля достаточно, чтобы обеспечить разумную уверенность в безопасности и эффективности устройства» (например, лейкопластыри, зубные щетки, очки и термометры). |
| II | Те устройства, для которых «существует стандарт производительности, обеспечивающий разумную гарантию безопасности и эффективности» (например, кардиомониторы, наркозные аппараты и дефибрилляторы, а также магнитно-резонансные томографы). |
| III | Эти устройства, «предполагаемые или представляемые как предназначенные для поддержки или поддержания жизни человека или для использования, которое имеет существенное значение для предотвращения ухудшения здоровья человека или представляет потенциальный необоснованный риск заболевания или травмы (например, протезы груди из силиконового геля [имплантаты], ВМС, эндолимфатические шунты и костные имплантаты). |
9
| Класс . | Описание . |
|---|---|
| I | Те устройства, для которых «общего контроля достаточно, чтобы обеспечить разумную уверенность в безопасности и эффективности устройства» (например, лейкопластыри, зубные щетки, очки и термометры). |
| II | Те устройства, для которых «существует стандарт производительности, обеспечивающий разумную гарантию безопасности и эффективности» (например, кардиомониторы, наркозные аппараты и дефибрилляторы, а также магнитно-резонансные томографы). |
| III | Эти устройства, «предполагаемые или представляемые как предназначенные для поддержки или поддержания жизни человека или для использования, которое имеет существенное значение для предотвращения ухудшения здоровья человека или представляет потенциальный необоснованный риск заболевания или травмы (например, протезы груди из силиконового геля [имплантаты], ВМС, эндолимфатические шунты и костные имплантаты). |
| Класс . | Описание . |
|---|---|
| I | Те устройства, для которых «общего контроля достаточно, чтобы обеспечить разумную уверенность в безопасности и эффективности устройства» (например, лейкопластыри, зубные щетки, очки и термометры). |
| II | Те устройства, для которых «существует стандарт производительности, обеспечивающий разумную гарантию безопасности и эффективности» (например, кардиомониторы, наркозные аппараты и дефибрилляторы, а также магнитно-резонансные томографы). |
| III | Эти устройства, «предполагаемые или представляемые как предназначенные для поддержки или поддержания жизни человека или для использования, которое имеет существенное значение для предотвращения ухудшения здоровья человека или представляет потенциальный необоснованный риск заболевания или травмы (например, протезы груди из силиконового геля [имплантаты], ВМС, эндолимфатические шунты и костные имплантаты). |
Это решение открыло шлюзы для судебных разбирательств, кульминацией которых стала подача заявления о банкротстве по главе 11 компанией Dow Corning, крупнейшим производителем имплантатов того времени.В то время они столкнулись с более чем 20 000 индивидуальных исков, которые затем переросли в коллективный иск. 2 В рамках глобального урегулирования в 1994 году было заключено соглашение на сумму 4,25 миллиарда долларов с участием всех производителей, чтобы предоставить пострадавшим женщинам доступ к платежам, несмотря на отсутствие доказательств причинно-следственной связи их симптомов с грудными имплантатами.
Затем FDA потребовало более мелких и подробных анализов в течение 2–3 лет, что привело к ограниченному разрешению грудных имплантатов с солевым раствором в 2000 году.В 2003 году было дано дополнительное ограниченное разрешение на имплантаты Allergan, заполненные силиконовым гелем. За этим последовало одобрение силиконовых гелевых имплантатов Mentor и Allergan в 2006 году, но из-за сохраняющихся опасений FDA по-прежнему требовало данных послепродажного одобрения, и были запланированы продольные основные исследования для тщательного наблюдения за 100 000 женщин в течение 7–10 лет. 9
9
Неудивительно, что в июне 1993 года европейские и австралийские регулирующие органы последовали примеру США, ограничив доступ к грудным имплантатам из силиконового геля в рамках широкомасштабной кампании по усилению контроля со стороны Европейской комиссии. 11 Они выпустили Директиву о медицинских устройствах, в которой указывается на необходимость регулирования производства, тестирования и продажи устройств на основе уровней риска. Новые устройства также должны были пройти «оценку соответствия» независимым экспертом. Обеспечение выполнения директивы возложено на отдельные страны-члены, двумя такими примерами являются Агентство по регулированию лекарственных средств и товаров медицинского назначения Великобритании (MHRA) и Национальное агентство по безопасности лекарств и товаров медицинского назначения (ANSM).Это не является единым требованием для прохождения клинических испытаний устройств и может быть исключено, если «должным образом обосновано полагаться на существующие клинические данные». Даже если бы клинические испытания были обязательными, они не должны были быть рандомизированными или иметь контрольную группу, и они могли иметь размер выборки всего 100 пациентов. После утверждения им был присвоен знак «Conformite Europeene» или CE, что буквально означает «европейское соответствие».
Даже если бы клинические испытания были обязательными, они не должны были быть рандомизированными или иметь контрольную группу, и они могли иметь размер выборки всего 100 пациентов. После утверждения им был присвоен знак «Conformite Europeene» или CE, что буквально означает «европейское соответствие».
Некоторые ранние неудачи
В Европе было ускорено одобрение грудных имплантатов, что снизило входной барьер в некоторых странах для различных производителей имплантатов и типов имплантатов.В 1995 году грудной имплантат Trilucent получил одобрение CE с доклиническими данными по безопасности, поскольку было заявлено, что материал наполнителя, соевое масло, безопаснее силикона и не мешает маммографии. Клиническое исследование, проведенное в Бельгии, показало утечку соевого масла после 4 лет использования у пациентов. Это побудило MHRA провести дальнейшее расследование, которое обнаружило, что разложение масла было связано с раком и врожденными дефектами. 12 В 2000 году имплантаты Trilucent были сняты с продажи.
12 В 2000 году имплантаты Trilucent были сняты с продажи.
Две компании, PIP (Poly-Implant-Prosthese) и NovaGold, выпустили имплантаты, заполненные гидрогелем, в 1990-х годах, и обе они получили одобрение CE. 13 Эти устройства также были признаны неадекватными по оценке биологической безопасности MHRA и были добровольно отозваны с рынка в декабре 2000 года. .
Второй кризис: PIP
PIP также продавала другие типы грудных имплантатов и сумела получить одобрение своих имплантатов, заполненных физиологическим раствором, в Соединенных Штатах после проверки FDA в 1996 году.Это было основано на доказательствах того, что их устройство было «в значительной степени эквивалентно» другим имплантатам, одобренным FDA. 9 Солевые имплантаты PIP были затем одобрены для продажи в Европе в 1997 году. Когда в 1999 году FDA потребовало представления PMA для всех грудных имплантатов, они отклонили заявку PIP и удалили их с рынка США. В рамках их применения проверка FDA выявила 11 нарушений надлежащей производственной практики. 8
В рамках их применения проверка FDA выявила 11 нарушений надлежащей производственной практики. 8
В период с 2001 по 2002 год MHRA зарегистрировал первый из нескольких сообщений о нежелательных явлениях. 14 Первоначально считалось, что неблагоприятные события были результатом улучшения отчетности о случаях, но стало ясно, что частота отказов имплантатов PIP была вдвое выше, чем у других типов грудных имплантатов. Производитель был уведомлен и начал следить за ситуацией. В марте 2010 года с разницей в несколько дней и ANSM, и MHRA объявили о приостановке экспорта, распространения и продажи силиконовых гелевых грудных имплантатов PIP. 15 Это произошло после инспекции ANSM производственного предприятия в Ла-Сейн-сюр-Мер, Франция.Текущие расследования позже показали, что имплантаты, изготовленные с января 2001 года, содержали дешевый, неутвержденный промышленный силикон того типа, который используется для изготовления чистящих средств, клеев и кухонной посуды, и что барьерный слой был удален, что способствовало хрупкости. Следует отметить параллели с имплантатами Meme. Имплантаты PIP были значительно дешевле, чем другие имплантаты, и благодаря этому они смогли увеличить продажи. Более 300 000 женщин в 65 странах мира получили силиконовые гелевые имплантаты PIP, изготовленные из немедицинского силикона. 15 Скандал был охарактеризован министром здравоохранения Великобритании как «преднамеренное мошенничество» со стороны производителя, который «активно покрывал свой обман и демонстрировал полное пренебрежение к благополучию своих клиентов». 15 Это привело к глобальному совещанию органов общественного здравоохранения, в результате которого некоторые страны рекомендовали пациентам удалить и заменить имплантаты PIP с соответствующим государственным финансированием для поддержки операции. 16 В Австралии кризис побудил сенат провести расследование и провести независимую оценку Ассоциации терапевтического добра Австралии, которая привела к выводу о том, что для женщин нет поддающегося количественной оценке риска, но имплантаты следует контролировать.
Следует отметить параллели с имплантатами Meme. Имплантаты PIP были значительно дешевле, чем другие имплантаты, и благодаря этому они смогли увеличить продажи. Более 300 000 женщин в 65 странах мира получили силиконовые гелевые имплантаты PIP, изготовленные из немедицинского силикона. 15 Скандал был охарактеризован министром здравоохранения Великобритании как «преднамеренное мошенничество» со стороны производителя, который «активно покрывал свой обман и демонстрировал полное пренебрежение к благополучию своих клиентов». 15 Это привело к глобальному совещанию органов общественного здравоохранения, в результате которого некоторые страны рекомендовали пациентам удалить и заменить имплантаты PIP с соответствующим государственным финансированием для поддержки операции. 16 В Австралии кризис побудил сенат провести расследование и провести независимую оценку Ассоциации терапевтического добра Австралии, которая привела к выводу о том, что для женщин нет поддающегося количественной оценке риска, но имплантаты следует контролировать. Интересно, что эти результаты привели к созданию реестра имплантатов для отказа от участия, который в настоящее время достиг высокой пенетрантности с дублированием благодаря тесному международному сотрудничеству. 17,18 За этим последовали неизбежные коллективные иски, которые продолжаются до сих пор.
Интересно, что эти результаты привели к созданию реестра имплантатов для отказа от участия, который в настоящее время достиг высокой пенетрантности с дублированием благодаря тесному международному сотрудничеству. 17,18 За этим последовали неизбежные коллективные иски, которые продолжаются до сих пор.
Силимед
Несмотря на изъятие имплантатов с полиуретановым покрытием в Соединенных Штатах, южноамериканский производитель Silimed обратился в MHRA с просьбой получить разрешение на продажу полиуретановых имплантатов нового поколения.В 2003 году MHRA пришло к выводу, что преимущества не перевешивают риски. Однако, когда Silimed получил одобрение CE в Германии, MHRA разрешило выход на рынок Великобритании при условии, что пациенты имеют надлежащее информированное согласие на риски и преимущества. Затем Silimed пошла еще дальше, чтобы получить одобрение на продажу новых имплантатов с когезионным гелем в Соединенных Штатах через PMA в 2012 году, тем самым нарушив дуополию (Mentor и Allergan) силиконовых гелевых имплантатов. 11 Интересно, что заявка не подвергалась общественному обсуждению, которое было отклонено FDA, в отличие от предыдущих разрешений.За этим последовало одобрение в 2013 году когезионных гелевых имплантатов Allergan и Mentor. 9 Все 3 утверждения были основаны на необходимости проведения пострегистрационных исследований.
11 Интересно, что заявка не подвергалась общественному обсуждению, которое было отклонено FDA, в отличие от предыдущих разрешений.За этим последовало одобрение в 2013 году когезионных гелевых имплантатов Allergan и Mentor. 9 Все 3 утверждения были основаны на необходимости проведения пострегистрационных исследований.
23 сентября 2015 г. MHRA приостановило всю сертификацию CE для медицинских устройств Silimed после того, как немецкие инспекторы обнаружили загрязнение частицами устройств, произведенных в Рио-де-Жанейро. 19 Австралийский регулирующий орган, Therapeutic Goods Association 20 и национальное агентство по надзору за здоровьем Бразилии также провели независимую проверку.9 октября Sientra, заключившая с Silimed контракт на производство собственных имплантатов, в качестве меры предосторожности добровольно приостановила все продажи имплантатов в США. Sientra — американская компания, разработавшая неполиуретановую текстуру, изготовленную с использованием вулканизации карбонатом аммония. 21 Месяц спустя, 23 октября 2015 г., пожар уничтожил один из заводов Silimed в Бразилии. В настоящее время Sientra расторгла свое производственное соглашение с Silimed и открыла американские производственные предприятия в Висконсине для производства своих имплантатов.В 2018 году, после успешной отправки PMA, Sientra получила одобрение FDA на линейку имплантатов Opus, которые теперь доступны для использования в США (рис. 2). 9
21 Месяц спустя, 23 октября 2015 г., пожар уничтожил один из заводов Silimed в Бразилии. В настоящее время Sientra расторгла свое производственное соглашение с Silimed и открыла американские производственные предприятия в Висконсине для производства своих имплантатов.В 2018 году, после успешной отправки PMA, Sientra получила одобрение FDA на линейку имплантатов Opus, которые теперь доступны для использования в США (рис. 2). 9
Рисунок 2.
Историческая хронология грудных имплантатов.
Рисунок 2.
Историческая хронология грудных имплантатов.
Нормативно-правовая база
С точки зрения общественного здравоохранения вызывает недоумение тот факт, что регулирующие органы не проводили более тщательных исследований убедительных доказательств долгосрочной безопасности грудных имплантатов.И это несмотря на более высокий уровень проверки и клинических данных, требуемых всеми производителями до выхода на рынок. Переменный стандарт этих PMA и пострыночных основных исследований может быть результатом несоответствий в операционных методах, послеоперационном наблюдении и отсутствии четкой документации и сообщений о нежелательных явлениях. 22,23 Также непоследовательно, что регулирующие органы сосредоточили свое внимание на грудных имплантатах, но не стремились к долгосрочным клиническим испытаниям ортопедических имплантатов, хирургической сетки и некоторых кардиологических устройств.Послужной список различных стандартов для выхода на рынок и неспособность адекватно осуществлять постмаркетинговый надзор ясно иллюстрирует скандал с имплантатами PIP. 16
Переменный стандарт этих PMA и пострыночных основных исследований может быть результатом несоответствий в операционных методах, послеоперационном наблюдении и отсутствии четкой документации и сообщений о нежелательных явлениях. 22,23 Также непоследовательно, что регулирующие органы сосредоточили свое внимание на грудных имплантатах, но не стремились к долгосрочным клиническим испытаниям ортопедических имплантатов, хирургической сетки и некоторых кардиологических устройств.Послужной список различных стандартов для выхода на рынок и неспособность адекватно осуществлять постмаркетинговый надзор ясно иллюстрирует скандал с имплантатами PIP. 16
Спрос
Спрос на увеличение груди продолжает расти, так как это остается наиболее часто выполняемой эстетической хирургической операцией; только в Соединенных Штатах в 2017 году было выполнено более 300 000 процедур, что примерно на 45% больше по сравнению с оценками десятилетней давности.![]() 24 Приблизительно от 1% до 3% взрослых женщин в западных странах имеют грудные имплантаты in situ как для косметического увеличения, так и для реконструкции после мастэктомии по поводу рака. 25-28 Текущая стоимость рынка грудных имплантатов оценивается в 577 миллионов долларов США в США и около 1,2 миллиарда долларов США во всем мире и, по прогнозам, увеличится до 2,0 миллиардов долларов США к 2025 году. 29 Есть Есть много причин недавнего роста, включая заметное внимание средств массовой информации / социальных сетей, рост маркетинга в медицине и открытие клиник с более низкими ценами, особенно связанных с косметическим туризмом.С этим спросом приходят коммерческие возможности, которые еще больше подпитывают рост маркетинга и рекламы — идеальный цикл положительной обратной связи. Крах недавней крупной косметической сети в Австралии с последующим коллективным иском со стороны женщин, которые заявляют о страданиях и причинении вреда, является хорошим примером того, как цикл бума/спада, основанный на низкозатратных бизнес-моделях с большими объемами, не является устойчивым.
24 Приблизительно от 1% до 3% взрослых женщин в западных странах имеют грудные имплантаты in situ как для косметического увеличения, так и для реконструкции после мастэктомии по поводу рака. 25-28 Текущая стоимость рынка грудных имплантатов оценивается в 577 миллионов долларов США в США и около 1,2 миллиарда долларов США во всем мире и, по прогнозам, увеличится до 2,0 миллиардов долларов США к 2025 году. 29 Есть Есть много причин недавнего роста, включая заметное внимание средств массовой информации / социальных сетей, рост маркетинга в медицине и открытие клиник с более низкими ценами, особенно связанных с косметическим туризмом.С этим спросом приходят коммерческие возможности, которые еще больше подпитывают рост маркетинга и рекламы — идеальный цикл положительной обратной связи. Крах недавней крупной косметической сети в Австралии с последующим коллективным иском со стороны женщин, которые заявляют о страданиях и причинении вреда, является хорошим примером того, как цикл бума/спада, основанный на низкозатратных бизнес-моделях с большими объемами, не является устойчивым. 30 Хирургические риски, связанные с увеличением груди в рамках медицинского туризма, могут значительно перевешивать финансовые выгоды. 31
30 Хирургические риски, связанные с увеличением груди в рамках медицинского туризма, могут значительно перевешивать финансовые выгоды. 31
Конфликт интересов
Растет признание сложного взаимодействия между отраслевыми стимулами, частной практикой, предпочтениями врачей и потенциальным конфликтом интересов. 32,33 В хирургии грудных имплантатов наибольшая прибыль приходится на хирургов, и коммерческие договоренности о снижении цены на имплантаты могут стать мощным стимулом для использования имплантата определенной марки или типа. Рост использования PIP-имплантатов, например, был обусловлен их низкой ценой, что увеличивало размер прибыли хирургов или, наоборот, позволяло им снижать цены для получения конкурентного преимущества. 14
Признание прямых платежей врачам от промышленности привело к принятию в 2010 году Закона о платежах врачам для сбора, отслеживания и отчетности обо всех финансовых операциях в Соединенных Штатах. Доступ к платежам можно получить по адресу https://openpaymentsdata.cms.gov. 34 Подобные системы уже созданы в других странах. Любая презентация, одобрение или исследовательский отчет об устройстве, где автор(ы) получают платежи от акций или лицензий/роялти, являются наиболее очевидными конфликтами. 35 Менее очевидными являются скидки на продукты, субсидии на оплату частной практики, платежи для продвижения или поддержки продукта (особенно если это связано с продажами продукта) и скидки за объем использования. Они могут обеспечить прямую выгоду от прибыли от частной практики и представляют собой менее очевидный или заметный конфликт. На рис. 3 показаны прямые платежи, полученные от представителей отрасли докладчикам на недавней международной встрече, посвященной теме анапластической крупноклеточной лимфомы, связанной с грудными имплантатами (BIA-ALCL).Эти данные показывают большие различия в денежной поддержке и подчеркивают необходимость большей прозрачности и понимания уровней конфликта интересов (КИ) в этой области.
Доступ к платежам можно получить по адресу https://openpaymentsdata.cms.gov. 34 Подобные системы уже созданы в других странах. Любая презентация, одобрение или исследовательский отчет об устройстве, где автор(ы) получают платежи от акций или лицензий/роялти, являются наиболее очевидными конфликтами. 35 Менее очевидными являются скидки на продукты, субсидии на оплату частной практики, платежи для продвижения или поддержки продукта (особенно если это связано с продажами продукта) и скидки за объем использования. Они могут обеспечить прямую выгоду от прибыли от частной практики и представляют собой менее очевидный или заметный конфликт. На рис. 3 показаны прямые платежи, полученные от представителей отрасли докладчикам на недавней международной встрече, посвященной теме анапластической крупноклеточной лимфомы, связанной с грудными имплантатами (BIA-ALCL).Эти данные показывают большие различия в денежной поддержке и подчеркивают необходимость большей прозрачности и понимания уровней конфликта интересов (КИ) в этой области. Поскольку влияние BIA-ALCL в настоящее время становится ощутимым, особенно в отношении безопасности и эффективности текстурированных имплантатов, роли COI в интерпретации данных, публикации исследований/комментариев, презентаций на подиуме, одобрения одного продукта по сравнению с другим и заявления о безопасности должны быть тщательно изучены. Появляется все больше свидетельств того, что отчеты хирургов, активно сотрудничающих с отраслевыми партнерами для составления отчетов о характеристиках продукта, почти всегда приводятся в пользу продукта компании, которую они представляют. 36 Более того, чем больше финансовое вознаграждение, тем выше уровень конфликта. Из всех медицинских связей с промышленностью хирурги получают наибольшую компенсацию и подвергаются большему риску внесения предвзятости в свои отчеты, но перечисление влияния этой предвзятости остается неуловимым из-за различных практик раскрытия информации. 37,38 Недавнее исследование показало значительные расхождения между декларациями COI в журналах по пластической хирургии и фактическими COI, задокументированными по открытым платежам.
Поскольку влияние BIA-ALCL в настоящее время становится ощутимым, особенно в отношении безопасности и эффективности текстурированных имплантатов, роли COI в интерпретации данных, публикации исследований/комментариев, презентаций на подиуме, одобрения одного продукта по сравнению с другим и заявления о безопасности должны быть тщательно изучены. Появляется все больше свидетельств того, что отчеты хирургов, активно сотрудничающих с отраслевыми партнерами для составления отчетов о характеристиках продукта, почти всегда приводятся в пользу продукта компании, которую они представляют. 36 Более того, чем больше финансовое вознаграждение, тем выше уровень конфликта. Из всех медицинских связей с промышленностью хирурги получают наибольшую компенсацию и подвергаются большему риску внесения предвзятости в свои отчеты, но перечисление влияния этой предвзятости остается неуловимым из-за различных практик раскрытия информации. 37,38 Недавнее исследование показало значительные расхождения между декларациями COI в журналах по пластической хирургии и фактическими COI, задокументированными по открытым платежам. 39
39
Рисунок 3.
Открытые отраслевые платежи (долл. США), сделанные с 2013 по 2016 г. 8 преподавателям-докладчикам по анапластической крупноклеточной лимфоме, связанной с грудными имплантатами (BIA-ALCL) на международной конференции в 2018 г. (авторы рассмотрели запрос ASJ назвать конференцию, но предпочел бы оставить имена преподавателей анонимными).
Рисунок 3.
Открытые отраслевые платежи (долл. США), сделанные с 2013 по 2016 год 8 преподавателям по анапластической крупноклеточной лимфоме, связанной с грудными имплантатами (BIA-ALCL) на международной конференции в 2018 г. (авторы рассмотрели запрос ASJ назвать конференцию, но предпочел бы сохранить анонимность имен преподавателей).
Таблица 2 обобщает предлагаемый шаблон для раскрытия информации об исследованиях грудных имплантатов.
Таблица 2.Предлагаемый шаблон конфликта интересов
| 1. Получаете ли вы прямую личную финансовую выгоду от продаж, гонораров за имплантаты и/или любые технологии, связанные с имплантатами? |
2. Вы полагаетесь на увеличение груди как на основной источник дохода? Вы полагаетесь на увеличение груди как на основной источник дохода? |
| 3. Получаете ли вы какие-либо конкурентные преимущества благодаря коммерческим соглашениям с поставщиками/отраслями для поддержки вашей практики за счет снижения затрат, стимулов, взносов в натуральной форме и субсидий? |
| 4.Получали ли вы какие-либо личные отраслевые платежи за продвижение или поддержку любого продукта, связанного с грудными имплантатами или хирургией груди? |
| 5. Доступны ли общедоступные платежи вашей отрасли (например, на openpayments.cms.gov)? |
| 6. Со сколькими компаниями по имплантации груди вы работаете в настоящее время? |
| 7. Каков характер вашей работы? а. Консультации b. Образование c. Консультативные советы d. Исследование 1.Контрактное исследование (финансируется учреждением) 2. Совместное исследование (финансируется учреждением) 3. Грант на рецензирование (совместно с правительством/Национальным координатором) e.  Маркетинг/продажи Маркетинг/продажи f. Подтверждение продукта |
| 8. Выплачиваются ли отраслевые средства лично вам, учреждениям или обоим? |
| 9. Вы работаете или работаете в академическом и/или некоммерческом секторе? |
| 10. Есть ли у вас послужной список публикаций в рецензируемых журналах в этой области исследований? |
| 11.Есть ли у вас опыт получения государственных конкурсных грантов в этой области исследований? |
| 12. Есть ли у вас какие-либо личные случаи BIA-ALCL, связанные с вашей личной практикой? Если да, то сколько? |
| 13. Проводите ли вы в своей практике личный аудит и последующее наблюдение за пациентами с грудными имплантатами? |
| 1. Получаете ли вы прямую личную финансовую выгоду от продаж, гонораров за имплантаты и/или любые технологии, связанные с имплантатами? |
| 2.Вы полагаетесь на первичное увеличение груди как на основной источник дохода? |
3. Получаете ли вы какие-либо конкурентные преимущества благодаря коммерческим соглашениям с поставщиками/отраслями для поддержки вашей практики за счет снижения затрат, стимулов, взносов в натуральной форме и субсидий? Получаете ли вы какие-либо конкурентные преимущества благодаря коммерческим соглашениям с поставщиками/отраслями для поддержки вашей практики за счет снижения затрат, стимулов, взносов в натуральной форме и субсидий? |
| 4. Получали ли вы какие-либо личные отраслевые платежи за продвижение или поддержку любого продукта, связанного с грудными имплантатами или хирургией груди? |
| 5. Платежи вашей отрасли общедоступны (например, на openpayments.cms.gov)? |
| 6. Со сколькими компаниями по имплантации груди вы работаете в настоящее время? |
| 7. Каков характер вашей работы? а. Консультации b. Образование c. Консультативные советы d. Исследование 1. Исследование по контракту (финансируется за счет учреждения) 2. Совместное исследование (финансируется за счет учреждения) 3. Грант на экспертную оценку (согласованный с правительством/Национальным координатором) e.  Маркетинг/продажи Маркетинг/продажи f. Подтверждение продукта |
| 8.Выплачиваются ли отраслевые средства лично вам, учреждению (учреждениям) или обоим? |
| 9. Вы работаете или работаете в академическом и/или некоммерческом секторе? |
| 10. Есть ли у вас послужной список публикаций в рецензируемых журналах в этой области исследований? |
| 11. Есть ли у вас опыт получения государственных конкурсных грантов в этой области исследований? |
| 12. Есть ли у вас какие-либо личные случаи BIA-ALCL, связанные с вашей личной практикой? Если да, то сколько? |
| 13.Проводите ли вы личный аудит и последующее наблюдение пациентов с грудными имплантами в своей практике? |
Предлагаемый шаблон конфликта интересов
| 1. Получаете ли вы прямую личную финансовую выгоду от продаж, гонораров за имплантаты и/или любые технологии, связанные с имплантатами? |
2. Вы полагаетесь на увеличение груди как на основной источник дохода? Вы полагаетесь на увеличение груди как на основной источник дохода? |
| 3. Получаете ли вы какие-либо конкурентные преимущества благодаря коммерческим соглашениям с поставщиками/отраслями для поддержки вашей практики за счет снижения затрат, стимулов, взносов в натуральной форме и субсидий? |
| 4.Получали ли вы какие-либо личные отраслевые платежи за продвижение или поддержку любого продукта, связанного с грудными имплантатами или хирургией груди? |
| 5. Доступны ли общедоступные платежи вашей отрасли (например, на openpayments.cms.gov)? |
| 6. Со сколькими компаниями по имплантации груди вы работаете в настоящее время? |
| 7. Каков характер вашей работы? а. Консультации b. Образование c. Консультативные советы d. Исследование 1.Контрактное исследование (финансируется учреждением) 2. Совместное исследование (финансируется учреждением) 3. Грант на рецензирование (совместно с правительством/Национальным координатором) e.  Маркетинг/продажи Маркетинг/продажи f. Подтверждение продукта |
| 8. Выплачиваются ли отраслевые средства лично вам, учреждениям или обоим? |
| 9. Вы работаете или работаете в академическом и/или некоммерческом секторе? |
| 10. Есть ли у вас послужной список публикаций в рецензируемых журналах в этой области исследований? |
| 11.Есть ли у вас опыт получения государственных конкурсных грантов в этой области исследований? |
| 12. Есть ли у вас какие-либо личные случаи BIA-ALCL, связанные с вашей личной практикой? Если да, то сколько? |
| 13. Проводите ли вы в своей практике личный аудит и последующее наблюдение за пациентами с грудными имплантатами? |
| 1. Получаете ли вы прямую личную финансовую выгоду от продаж, гонораров за имплантаты и/или любые технологии, связанные с имплантатами? |
| 2.Вы полагаетесь на первичное увеличение груди как на основной источник дохода? |
3. Получаете ли вы какие-либо конкурентные преимущества благодаря коммерческим соглашениям с поставщиками/отраслями для поддержки вашей практики за счет снижения затрат, стимулов, взносов в натуральной форме и субсидий? Получаете ли вы какие-либо конкурентные преимущества благодаря коммерческим соглашениям с поставщиками/отраслями для поддержки вашей практики за счет снижения затрат, стимулов, взносов в натуральной форме и субсидий? |
| 4. Получали ли вы какие-либо личные отраслевые платежи за продвижение или поддержку любого продукта, связанного с грудными имплантатами или хирургией груди? |
| 5. Платежи вашей отрасли общедоступны (например, на openpayments.cms.gov)? |
| 6. Со сколькими компаниями по имплантации груди вы работаете в настоящее время? |
| 7. Каков характер вашей работы? а. Консультации b. Образование c. Консультативные советы d. Исследование 1. Исследование по контракту (финансируется за счет учреждения) 2. Совместное исследование (финансируется за счет учреждения) 3. Грант на экспертную оценку (согласованный с правительством/Национальным координатором) e.  Маркетинг/продажи Маркетинг/продажи f. Подтверждение продукта |
| 8.Выплачиваются ли отраслевые средства лично вам, учреждению (учреждениям) или обоим? |
| 9. Вы работаете или работаете в академическом и/или некоммерческом секторе? |
| 10. Есть ли у вас послужной список публикаций в рецензируемых журналах в этой области исследований? |
| 11. Есть ли у вас опыт получения государственных конкурсных грантов в этой области исследований? |
| 12. Есть ли у вас какие-либо личные случаи BIA-ALCL, связанные с вашей личной практикой? Если да, то сколько? |
| 13.Проводите ли вы личный аудит и последующее наблюдение пациентов с грудными имплантами в своей практике? |
Риски для здоровья и доказательства
В Таблице 3 обобщены известные риски для здоровья от грудных имплантатов, о которых сообщается в литературе, а также частота встречаемости по данным Австралийского реестра устройств для груди. 40 Наиболее частой причиной повторной операции является капсулярная контрактура, которая чаще всего возникает из-за субклинической бактериальной инфекции. 41 Многие из этих рисков проявляются спустя годы после первоначальной процедуры, а отсутствие систематического последующего наблюдения затруднило усилия по получению истинных показателей побочных эффектов и безопасности этих устройств.
40 Наиболее частой причиной повторной операции является капсулярная контрактура, которая чаще всего возникает из-за субклинической бактериальной инфекции. 41 Многие из этих рисков проявляются спустя годы после первоначальной процедуры, а отсутствие систематического последующего наблюдения затруднило усилия по получению истинных показателей побочных эффектов и безопасности этих устройств.
Нежелательные явления после установки грудных имплантатов с относительной частотой, согласно Годовому отчету Австралийского реестра грудных имплантатов за 2016 г. 40
| . | Частота в процентах (N = 5290 ревизий грудных имплантатов) . |
|---|---|
| капсульной контрактуры | 38,9% |
| неправильное положение устройства | 22,0% |
| разрыв устройства | 19,0% |
| Устройство дефляция | 9,3% |
| рубцевание кожи рябью | 3,5% |
| Серома/гематома | 2. 5% 5% |
| Глубокая рана инфекция | 1,0% |
| рак молочной железы | 0,5% |
| BIA-ALCL | 0,2% |
| Небожное мероприятие, требующее редакции . | Частота в процентах (N = 5290 ревизий грудных имплантатов) . | |
|---|---|---|
| Капсулярная контрактура | 38,9% | |
| Неправильное расположение устройства | 22.0% | |
| Устройство разрыв | 19,0% | |
| Develation устройств | 9,3% | |
| 2,5% | ||
| Глубокая рана Инфекция | 1,0% | 1,0% |
| Рак молочной железы | 0,5% | |
| BIA-ALCL | 0,2% |

Неблагоприятные события После вставки грудных имплантатов с относительной частотой, как сообщает австралийская грудь Годовой отчет реестра устройств за 2016 г. 40
| Побочное явление, требующее пересмотра . | Частота в процентах (N = 5290 ревизий грудных имплантатов) . |
|---|---|
| капсульной контрактуры | 38,9% |
| неправильное положение устройства | 22,0% |
| разрыв устройства | 19,0% |
| Устройство дефляция | 9,3% |
| рубцевание кожи рябью | 3,5% |
| Серома/гематома | 2.5% |
| Глубокая рана инфекция | 1,0% |
| рак молочной железы | 0,5% |
| BIA-ALCL | 0,2% |
Небожное мероприятие, требующее редакции
. | Частота в процентах (N = 5290 ревизий грудных имплантатов) . | |
|---|---|---|
| Капсулярная контрактура | 38,9% | |
| Неправильное расположение устройства | 22.0% | |
| Устройство разрыв | 19,0% | |
| Develation устройств | 9,3% | |
| 2,5% | ||
| Глубокая рана Инфекция | 1,0% | 1,0% |
| Рак молочной железы | 0,5% | |
| BIA-ALCL | 0,2% |
Систематические обзоры сравнительных клинических исследований, включая основные исследования FDA, получили противоречивые результаты по эффективности конкретных поверхностей и форм имплантатов. 42 В 8 проспективных РКИ достаточного качества, которые были опубликованы по результатам после косметического увеличения груди, только 2 из этих пациентов наблюдались более чем через 12 месяцев после первоначальной процедуры. 42 Это значительно занижает истинную частоту возникновения капсулярной контрактуры; лонгитудинальные исследования показывают рост заболеваемости в период от 2 до 5 лет после первоначального размещения. Недавно была предложена новая общая классификация имплантатов 21 , которая может обеспечить лучшую основу для сравнительного изучения результатов для типов имплантатов.
42 Это значительно занижает истинную частоту возникновения капсулярной контрактуры; лонгитудинальные исследования показывают рост заболеваемости в период от 2 до 5 лет после первоначального размещения. Недавно была предложена новая общая классификация имплантатов 21 , которая может обеспечить лучшую основу для сравнительного изучения результатов для типов имплантатов.
За последние 5 десятилетий операционная процедура значительно эволюционировала и теперь включает точное рассечение кармана, размещение в двух плоскостях или субпекторально, упреждающий гемостаз и высокий уровень хирургической антисептики. Вклад поверхности имплантата, например, может быть не таким важным фактором, определяющим исход, как клиническая оценка хирурга, выбор имплантата и навыки выполнения процедуры. На рис. 4 показана тенденция к снижению частоты развития капсулярной контрактуры при использовании только гладких имплантатов. 42 Необходим дальнейший анализ влияния выбора, навыков и техники хирурга, который может быть сделан с помощью реестров проспективных данных..jpg)
Рисунок 4.
Тенденция к снижению капсулярной контрактуры зарегистрирована только для гладких имплантатов с 1990 по 2000 год.
Война за территорию: загадка хирургической квалификации и хирургического туризма
Пластические хирурги — это только одна группа специалистов, занимающихся установкой грудных имплантатов.Пластические хирурги-неспециалисты, такие как общие хирурги, занимаются хирургией груди и онкопластической хирургией, а врачи, не имеющие специальной хирургической подготовки, проводят косметические операции. Последние, по сути, представляют собой самопровозглашенную группу врачей первичной медико-санитарной помощи с разной степенью подготовки и стандартов, которые также выполняют процедуры по имплантации груди. В последнее время рост косметического туризма с присущим ему отсутствием подотчетности и отчетности еще больше усложнил получение точной картины использования и эффективности имплантатов. 31 Коммодитизация косметического хирургического туризма послужила уменьшению восприятия грудных имплантатов пациентом до концепции «только операции», а не ответственного специализированного хирургического взгляда на операцию, являющуюся частью континуума ухода за этими высокооплачиваемыми пациентами. рискованные устройства с ограниченным сроком службы in vivo. Многие из этих бизнес-моделей также запутывают потребность в минимальном 7-дневном периоде «обдумывания» перед операцией и не обеспечивают необходимый период послеоперационного ухода для обеспечения первичного заживления раны без инфекции.Сокращение прибыльности и сокращение медицинского вознаграждения из-за страховки заставят врачей искать косметическую практику, чтобы обеспечить стабильный поток доходов. Трудно установить совместный подход с обменом данными и результатами, когда в этом пространстве сосуществует множество разрозненных групп.
31 Коммодитизация косметического хирургического туризма послужила уменьшению восприятия грудных имплантатов пациентом до концепции «только операции», а не ответственного специализированного хирургического взгляда на операцию, являющуюся частью континуума ухода за этими высокооплачиваемыми пациентами. рискованные устройства с ограниченным сроком службы in vivo. Многие из этих бизнес-моделей также запутывают потребность в минимальном 7-дневном периоде «обдумывания» перед операцией и не обеспечивают необходимый период послеоперационного ухода для обеспечения первичного заживления раны без инфекции.Сокращение прибыльности и сокращение медицинского вознаграждения из-за страховки заставят врачей искать косметическую практику, чтобы обеспечить стабильный поток доходов. Трудно установить совместный подход с обменом данными и результатами, когда в этом пространстве сосуществует множество разрозненных групп.
Влияние социальных сетей и защитников прав потребителей
Сила защиты интересов потребителей и средств массовой информации была важной движущей силой как в кризисе Dow Corning, так и в кризисе PIP. В обоих случаях «разгневанная общественность требовала ответов, но данных просто не было, а вывод нужно было сделать». 14,15 Это особенно касается грудных имплантатов, поскольку данные о долгосрочной безопасности и эффективности просто недоступны. Кроме того, существует дополнительная проблема с появлением и растущей силой социальных сетей. 43,44 Эти платформы используются в косметической хирургии как в качестве источника информации, так и в качестве маркетингового инструмента. 45-47 Социальные сети также позволяют потребителям и группам защиты интересов быстро обмениваться идеями, информацией и ресурсами. Хотя в этом есть свои преимущества, в том числе возможность доступа пациентов к поддержке, это также может подпитывать неправильные представления и страхи перед заговором.
В обоих случаях «разгневанная общественность требовала ответов, но данных просто не было, а вывод нужно было сделать». 14,15 Это особенно касается грудных имплантатов, поскольку данные о долгосрочной безопасности и эффективности просто недоступны. Кроме того, существует дополнительная проблема с появлением и растущей силой социальных сетей. 43,44 Эти платформы используются в косметической хирургии как в качестве источника информации, так и в качестве маркетингового инструмента. 45-47 Социальные сети также позволяют потребителям и группам защиты интересов быстро обмениваться идеями, информацией и ресурсами. Хотя в этом есть свои преимущества, в том числе возможность доступа пациентов к поддержке, это также может подпитывать неправильные представления и страхи перед заговором.
Являются ли следующими кризисами BIA-ALCL и заболевание грудных имплантатов?
Первые сообщения о необычной анапластической Т-клеточной лимфоме, окружающей грудные имплантаты, первоначально были отклонены как редкие.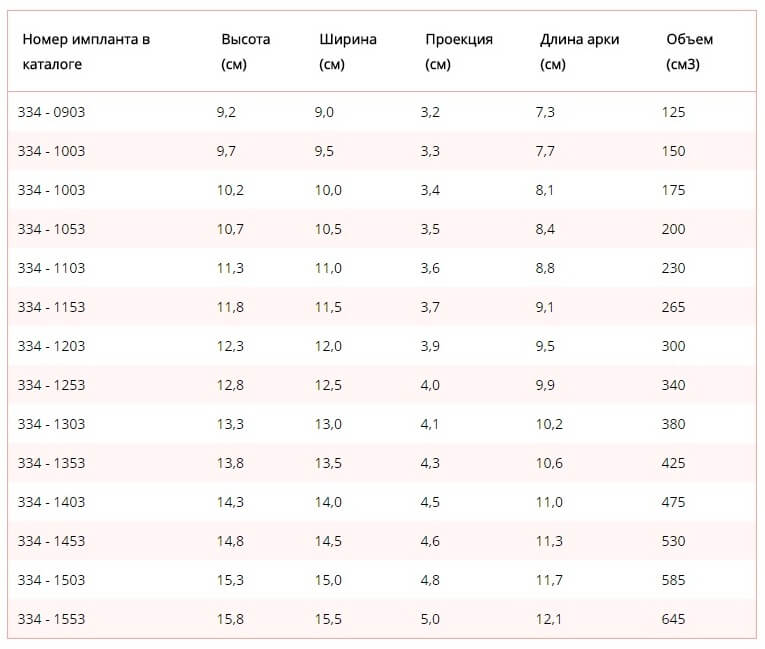 Было неясно, было ли это заболевание просто случайным и не связанным с грудными имплантатами. De Jong et al в 2008 г. были первыми, кто опубликовал отчет, определяющий повышенный риск BIA-ALCL в связи с грудными имплантатами (отношение шансов = 18,2; 95% ДИ = от 2,1 до 156,8). 48 С тех пор несколько исследований показали, что BIA-ALCL относится к текстурированным имплантатам и, в частности, к оболочкам имплантатов с большой площадью поверхности. 27,49 По мере роста внимания средств массовой информации и общественности начинают звучать призывы к запрету текстурированных имплантатов.На сегодняшний день регулирующие органы сопротивляются этому призыву и могут полагаться на достоверные научные данные, которыми они руководствуются при принятии решений.
Было неясно, было ли это заболевание просто случайным и не связанным с грудными имплантатами. De Jong et al в 2008 г. были первыми, кто опубликовал отчет, определяющий повышенный риск BIA-ALCL в связи с грудными имплантатами (отношение шансов = 18,2; 95% ДИ = от 2,1 до 156,8). 48 С тех пор несколько исследований показали, что BIA-ALCL относится к текстурированным имплантатам и, в частности, к оболочкам имплантатов с большой площадью поверхности. 27,49 По мере роста внимания средств массовой информации и общественности начинают звучать призывы к запрету текстурированных имплантатов.На сегодняшний день регулирующие органы сопротивляются этому призыву и могут полагаться на достоверные научные данные, которыми они руководствуются при принятии решений.
Появляется группа женщин, которым требуется эксплантация по поводу ряда симптомов, включая усталость, хронические боли, сыпь, запах тела, нерегулярный сердечный ритм, тревогу, неврологические нарушения, выпадение волос и эндокринную дисфункцию. Эти симптомы объединились, чтобы сформировать «болезнь грудных имплантатов», и на онлайн-форумах сообщалось об исчезновении симптомов после тотальной капсулэктомии и удаления имплантата. 50 В недавних публикациях также сообщалось о потенциальной связи с аутоиммунным/воспалительным синдромом, вызванным адъювантами. 51 Вполне возможно, что у части этих женщин есть заболевание, но необходимы дополнительные исследования и оценка эксплантированных устройств и пациентов с симптомами.
Эти симптомы объединились, чтобы сформировать «болезнь грудных имплантатов», и на онлайн-форумах сообщалось об исчезновении симптомов после тотальной капсулэктомии и удаления имплантата. 50 В недавних публикациях также сообщалось о потенциальной связи с аутоиммунным/воспалительным синдромом, вызванным адъювантами. 51 Вполне возможно, что у части этих женщин есть заболевание, но необходимы дополнительные исследования и оценка эксплантированных устройств и пациентов с симптомами.
Постоянная опасность чрезмерного или неправильного толкования существует с обоими этими возникающими состояниями, и поэтому мы, как врачи и ученые, должны обеспечить строгое и тщательное научное исследование.Без точных данных, позволяющих опровергнуть радикальные утверждения о заболеваниях, связанных с имплантатами, существует значительный риск повторения истории, подобно кризису Dow Corning, когда отсутствие надежных научных данных сделало невозможным опровержение множества утверждений.
Юридические аспекты
Неизбежным результатом этих циклов кризисов являются судебные иски и терпеливые страдания. Соблазн корпоративной казны породил поколение медицинских фирм, занимающихся халатностью, которые быстро устанавливают следующую цель с помощью стимулов «нет выигрыша — нет платы».Юридические иски регулярно запускаются в США, Европе и Австралии. Правовая система, будучи состязательной и быстро возлагающей вину, должна полагаться на беспристрастные доказательства для судебного преследования, а не на страстную, анекдотичную и спекулятивную информацию. Наша защита заключается в том, чтобы клиницисты и исследователи приняли вызов, работая над созданием этих данных об устройствах высокого риска с помощью независимых массивов данных, созданных реестрами клинического качества, такими как Австралийский реестр устройств для груди. 52 Поскольку эти проблемы носят глобальный характер, потребуются еще более убедительные доказательства посредством международного сотрудничества деятельности по регистрации молочной железы в таких организациях, как Международное сотрудничество деятельности по регистрации молочной железы (ICOBRA), которое стремится гармонизировать данные из нескольких регистров, чтобы получить ответы быстрее и достичь лучших результатов в плане безопасности пациентов раньше, чем если бы все регистры действовали независимо друг от друга. 52-54
52-54
Будущее
Как нам избежать следующего кризиса? Мы могли бы продолжить эту игру с имплантатами и позволить растущим потребительским и судебным искам определять будущее грудных имплантатов.Впереди множество испытаний, если мы хотим избежать повторения тех же ошибок; история обычно повторяется, и если ничего не делать, она обязательно повторится.
Во-первых, необходимы более совершенные средства проспективного сбора данных. Это уже началось после кризиса PIP с созданием реестров устройств груди и сети ICOBRA. 54 Задача здесь состоит в том, чтобы все рабочие группы, использующие имплантаты, вносили свой вклад в ввод данных, а отчеты о нежелательных явлениях собирались посредством расширения сотрудничества и прозрачности с целью включения результатов, о которых сообщают пациенты.Должна ли роль правительства и регулятора быть расширена, чтобы обязать использование реестров? Ответ на этот вопрос по-прежнему сопряжен со сложными и разнообразными правилами, положениями и философиями. Проспективный сбор данных займет годы, возможно, даже десятилетие, чтобы полностью созреть и предоставить значимые данные. Подтверждение данных реестра относительно истинного количества установленных и измененных имплантатов будет затруднено в свете того, что многие женщины все еще проходят операцию по увеличению груди, скрытую от средств надлежащего сбора данных.Два австралийских штата (Новый Южный Уэльс и Виктория) недавно приняли законы, согласно которым увеличение груди, среди нескольких других косметических процедур, должно выполняться в лицензированных хирургических учреждениях. 55 Это средство обеспечения качества и стандартов медицинской помощи, а также возможность сбора данных о случаях. Недавняя стандартизация наборов данных в рамках ICOBRA и сбор результатов, о которых сообщают пациенты, также является долгожданным шагом. 56 В то же время, использование суррогатных методов оценки риска, включая использование данных о отраслевых продажах 49 и радиографического наблюдения 27 , позволило лучше понять риск BIA-ALCL.
Проспективный сбор данных займет годы, возможно, даже десятилетие, чтобы полностью созреть и предоставить значимые данные. Подтверждение данных реестра относительно истинного количества установленных и измененных имплантатов будет затруднено в свете того, что многие женщины все еще проходят операцию по увеличению груди, скрытую от средств надлежащего сбора данных.Два австралийских штата (Новый Южный Уэльс и Виктория) недавно приняли законы, согласно которым увеличение груди, среди нескольких других косметических процедур, должно выполняться в лицензированных хирургических учреждениях. 55 Это средство обеспечения качества и стандартов медицинской помощи, а также возможность сбора данных о случаях. Недавняя стандартизация наборов данных в рамках ICOBRA и сбор результатов, о которых сообщают пациенты, также является долгожданным шагом. 56 В то же время, использование суррогатных методов оценки риска, включая использование данных о отраслевых продажах 49 и радиографического наблюдения 27 , позволило лучше понять риск BIA-ALCL.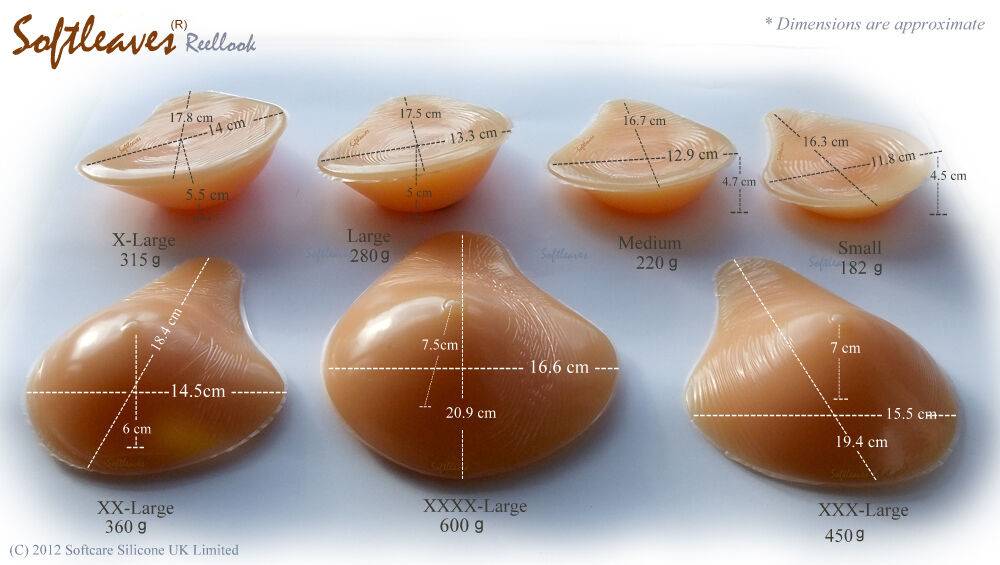
Во-вторых, в срочном порядке необходимо более широкое сотрудничество между клиницистами, исследовательскими группами, регулирующими органами и пациентами. Когда существует прозрачный обмен результатами и данными без страха перед репрессиями, система выиграет. Это требует создания моста доверия между многими конкурирующими группами, стремящимися к преимуществам и авторитету в очень коммерческом пространстве.
В-третьих, нам необходимо полагаться на высококачественные, проверенные и опубликованные научные данные. Многие заявления о грудных имплантатах сделаны на основе отчетов о случаях или серии случаев, часто поддерживаемых отраслевым финансированием.Обмен данными, лабораторными данными, а также интерпретация и обсуждение этих результатов приведут к лучшему рациональному пониманию этиологии, патогенеза, риска и, в конечном счете, того, как лучше всего предотвратить некоторые из этих осложнений, связанных с имплантатами. Например, клинические и научные данные, подтверждающие снижение бактериального загрязнения, являются хорошей иллюстрацией того, как трансляционные исследования могут способствовать улучшению результатов и обеспечивать комфорт для пациентов и коллег.
Наконец, в отношении осложнений, связанных с имплантацией, необходимо улучшить информирование общественности.Средства массовой информации очень внимательно относятся к сообщениям о скандалах и сделают любую находку сенсацией, чтобы максимизировать кликбейт и увеличить аудиторию. Крайне важно последовательно и четко сообщать о рисках, а также о клинических и научных результатах, чтобы избежать паники и неправильного толкования. К счастью, у нас есть хорошая совместная научная работа вокруг BIA-ALCL, которая предоставила клиницистам и регулирующим органам платформу для принятия рациональных решений.
Все эти области требуют клинического руководства, и пластические хирурги имеют хорошие возможности для руководства разработкой и внедрением этих стратегий в будущем.Спир и др. писали в 2009 году после отмены моратория: «Чтобы сохранить доверие общественности, будет крайне важно обеспечить, чтобы пластические хирурги были оснащены точной информацией для эффективного консультирования пациентов, решимость практиковать этично». , дальновидность при сборе данных и скромность при критической оценке собственных результатов для постоянного улучшения результатов лечения и безопасности пациентов». 8
, дальновидность при сборе данных и скромность при критической оценке собственных результатов для постоянного улучшения результатов лечения и безопасности пациентов». 8
Сегодня эти слова актуальны как никогда.
Раскрытие информации
Профессор Дева является консультантом, преподавателем и координатором исследований в Allergan, Mentor (Johnson & Johnson), Sientra и Motiva (Establishment Labs).Адъюнкт-профессор Магнуссон является консультантом и преподавателем Allergan and Mentor. Профессор Кутер и д-р Касс заявили об отсутствии потенциального конфликта интересов в отношении исследования, авторства и публикации этой статьи.
Финансирование
Это дополнение спонсируется Allergan plc (Дублин, Ирландия), Образовательным и исследовательским фондом эстетической хирургии (ASERF) (Гарден-Гроув, Калифорния), Establishment Labs (Алахуэла, Коста-Рика), Mentor Worldwide, LLC (Ирвин, Калифорния), Polytech Health & Aesthetics GmbH (Дибург, Германия) и Sientra, Inc. (Санта-Барбара, Калифорния).
(Санта-Барбара, Калифорния).
ССЫЛКИ
1.Чампанерия
MC
,Вонг
WW
,Хилл
ME
,Гупта
SC
Эволюция реконструкции молочной железы: историческая перспектива
.World J Surg.
2012
;36
(4
):730
—742
.2.Лам
ZSF
,Спешите
Д.
Dow Corning и споры о силиконовых имплантатах.
1992
:17
.Исторические рабочие документы
.3.Ван Нунен
SA
,Гатенби
PA
,Бастен
А
.Заболевания соединительной ткани после маммопластики
.Ревматоидный артрит.
1982
;25
(6
):694
—697
.4.Мосты
AJ
,Conley
C
,Wang
G
,Burns
de
,Vasey
FB
.Клиническая и иммунологическая оценка женщин с силиконовыми имплантатами груди и симптомами ревматического заболевания
.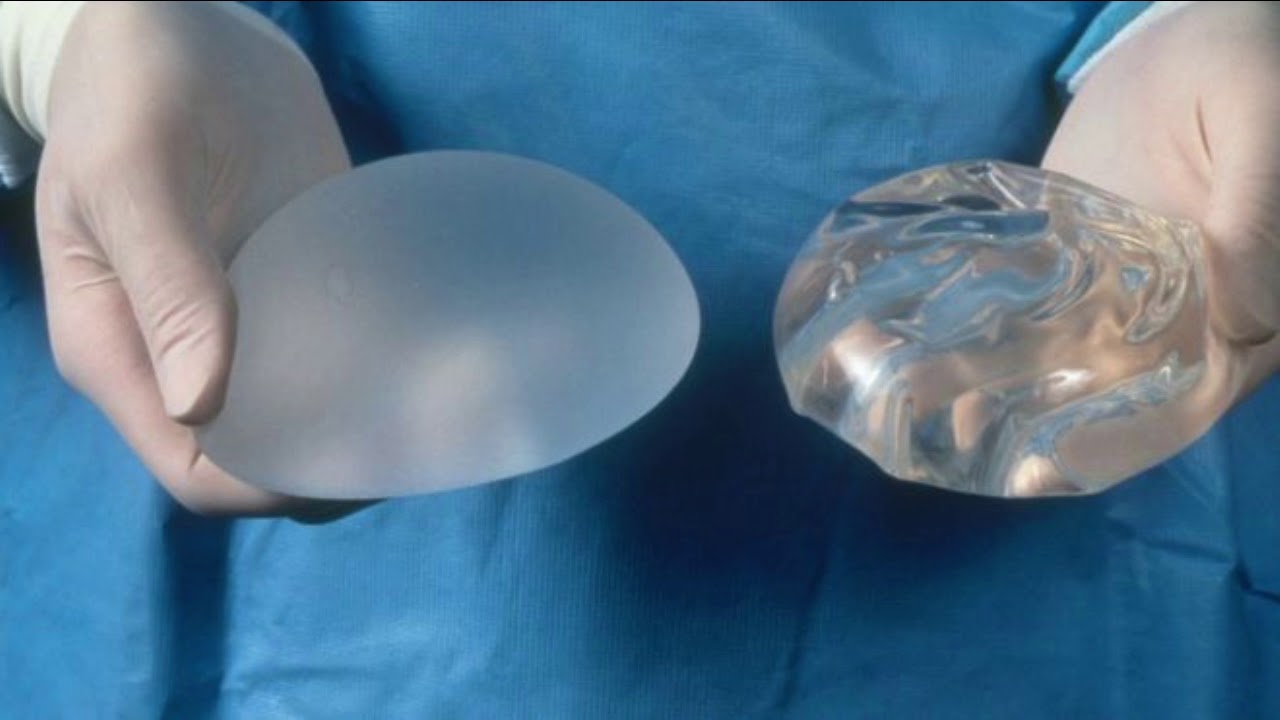
Ann Intern Med.
1993
;118
(12
):929
—936
.5.Claman
HN
,Робертсон
AD
.Антинуклеарные антитела и грудные имплантаты
.West J Med.
1994
;160
(3
):225
—228
.6.Федер
БДЖ
.Неудача Dow Corning в тесте общественного мнения
.Нью-Йорк Таймс
. 29 января1992
; Бизнес: 5.7.Фишер
Дж.К.
Испытание силикона: грудные имплантаты и политика риска
.Нью-Йорк
:Sager Group LLC
;2015
.8.Копье
SL
,Парих
ПМ
,Гольдштейн
JA
.История грудных имплантатов и пищевых продуктов и лекарств
.Clin Plast Surg.
2009
;36
(1
):15
—21
, т.10.Бенуа
FM
.Разложение пенополиуретана, используемого в грудном имплантате Même
.
J Biomed Mater Res.
1993
;27
(10
):1341
—1348
.11.Цукерман
D
,Букер
N
,Нагда
S
.Последствия различий в нормативно-правовой политике США и Европейского союза в отношении грудных имплантатов для общественного здравоохранения
.Reprod Health Matters.
2012
;20
(40
):102
—111
.12.Monstrey
S
,Christophe
A
,Delanghe
J
, и др.Что именно не так с имплантатами груди Trilucent? Объединяющая гипотеза
.Plast Reconstr Surg.
2004
;113
(3
):847
—856
.13.Арион
Н
.Грудные имплантаты, заполненные гидрогелем карбоксиметилцеллюлозы. Наш опыт за 15 лет
.Анн Чир Пласт Эстет.
2001
;46
(1
):55
—59
. 14.
14.Греко
С
.Скандал с полиимплантатами и протезами груди: воплощенный риск и социальные страдания
.Социально-мед.
2015
;147
:150
—157
.15.Spiegelhalter
D
,Knight
S
,Sant
T
.Грудные имплантаты скандал шумиха и оценка рисков
.Значение — Журнал Королевского статистического общества.
2012
;17
—21
.16.Донава
M
,Серый
R
.Скандал с грудными имплантатами и европейским регламентом по медицинскому оборудованию
.Журнал GMP.
2012
;11
(1
):2
—4
.17.Хоппер
I
,Best
RL
,McNeil
JJ
, и др.Пилотный проект Австралийского реестра устройств для грудных вмешательств (ABDR): национальный реестр клинического качества для хирургии устройств для грудных желез
.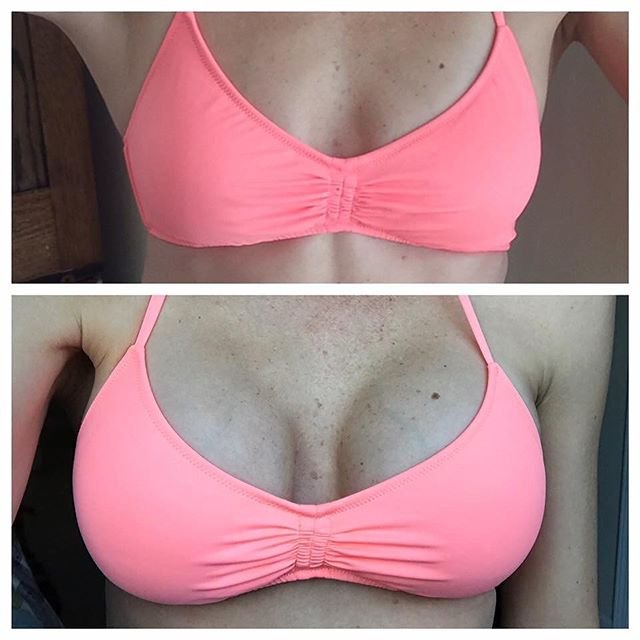
BMJ Открытый.
2017
;7
(12
):e017778
.18.HOPPER
I
,AHERN
S
,S
,BEST
RL
,Mcneil
J
,Cooter
RD
.Австралийский реестр устройств для грудных вскармливаний: изменение безопасности устройств для грудных вскармливаний
.ANZ J Surg.
2017
;87
(1-2
):9
—10
.21.Jones
P
,Mempin
M
,Hu
H
, и др.Функциональное влияние морфологии внешней оболочки грудного имплантата на прикрепление и рост бактерий
.Plast Reconstr Surg.
2018
;142
(4
):837
—849
.22.Копье
SL
,Мерфи
ДК
;Силиконовый грудной имплантат Allergan Основная группа клинических исследований США
.Круглые силиконовые грудные имплантаты Natrelle: основные результаты исследования через 10 лет
.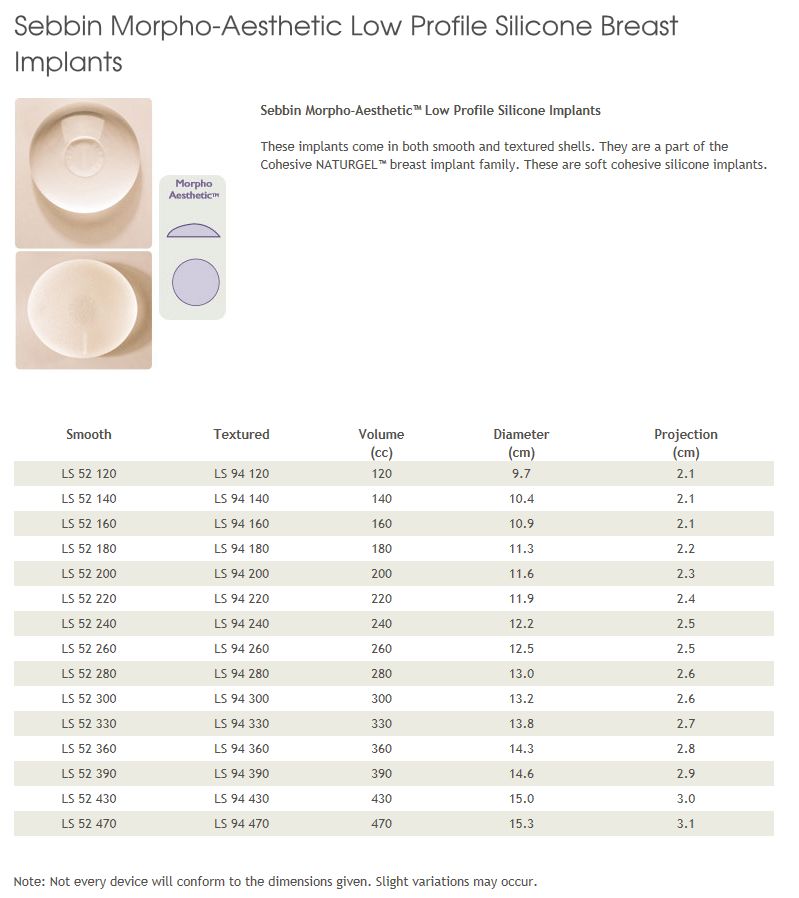
Plast Reconstr Surg.
2014
;133
(6
):1354
—1361
.23.Каннингем
Б
.Наставническое исследование гелевых силиконовых грудных имплантатов MemoryGel контурного профиля
.Plast Reconstr Surg.
2007
;120
(7 Дополнение 1
):33S
—39S
.24.Ballard
TNS
,Hill
S
,Nghiem
BT
, и др.Текущие тенденции в области увеличения груди: анализ данных отслеживания 2011-2015 гг., связанных с поддержанием сертификации (MOC)
.Эстет Сург Дж.
2018
. дои: .25.Cook
RR
,delongchamp
,RR
,RR
,Woodbury
M
,Perkins
LL
,Harrison
MC
.Распространенность женщин с грудными имплантатами в США, 1989 г.
.J Clin Эпидемиол.
1995
;48
(4
):519
—525
. 26.
26.Кук
RR
,Перкинс
LL
.Распространенность грудных имплантатов среди женщин в США
.Curr Top Microbiol Immunol.
1996
;210
:419
—425
.27.де Бур
М
,ван дер Слуис
ВБ
,де Бур
JP
, и др.Анапластическая крупноклеточная лимфома, связанная с грудным имплантатом, у трансгендерной женщины
.Эстет Сург Дж.
2017
;37
(8
):NP83
—NP87
.28.Collett
D
,RAUKORST
H
,LENNOX
P
,COOTER
R
,DEVA
AK
.Текущая оценка риска BIA-ALCL в текстурированных грудных имплантатах
.Plast Reconstr Surg.
2018
; в печати.31.BrightMan
L
,NG
S
,S
,AHERN
S
,Cooter
R
,Бункер
I
.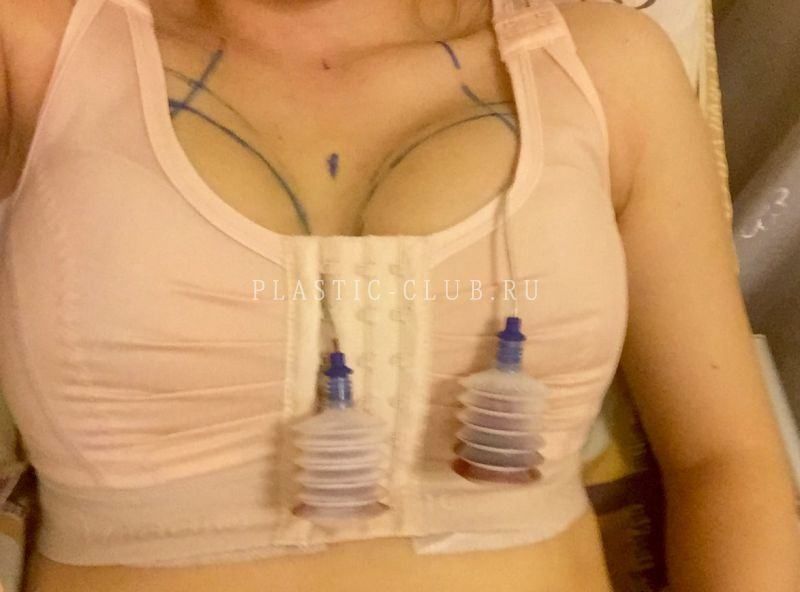
Косметологический туризм для увеличения груди: систематический обзор
.ANZ J Surg.
2018
;88
(9
):842
—847
.32.Дева
АК
.Ответ на «Анапластическая крупноклеточная лимфома, связанная с имплантатом молочной железы (BIA-ALCL): почему поиск инфекционной этиологии может быть неуместным».
Эстет Сург Дж.
2017
;37
(9
):NP122
—NP128
.33.Файнберг
ХВ
.Конфликт интересов: почему это важно
?ЯМА.
2017
;317
(17
):1717
—1718
.34.Орнштейн
С
.Публичное раскрытие информации о платежах врачам в промышленности
.ЯМА.
2017
;317
(17
):1749
—1750
.35.Ло
Б
,Грейди
Д
.Выплаты врачам: имеет ли значение сумма денег
? ЯМА.
2017
;317
(17
):1719
—1720
.36.Лопез
Дж
,Самаха
Г
,Пурвис
ТЕ
, и др.Точность раскрытия информации о конфликте интересов пластическими хирургами и промышленностью
.Plast Reconstr Surg.
2018
;141
(6
):1592
—1599
.37.Лихтер
КАК
.Конфликт интересов и неподкупность медицинской профессии
.ЯМА.
2017
;317
(17
):1725
—1726
.38.Dunn
AG
,Coiera
E
,Mandl
KD
,Буржуа
FT
Раскрытие информации о конфликте интересов в биомедицинских исследованиях: обзор текущей практики, предубеждений и роли государственных реестров в повышении прозрачности
.Res Integr Peer Rev.
2016
;1
:pii:1
.39.Бойлл
P
,Невилл
M
,Бернард
R
,Махабир
RC
Информация, раскрываемая авторами в журналах по пластической хирургии, по сравнению с информацией, представленной в базе данных открытых платежей: насколько мы открыты
? Эстет Сург Дж.
2018
. дои: .40.Хоппер
I
,Parker
E
,Pellegrini
B
, и др.Отчет Австралийского реестра грудных протезов за 2016 г.
Мельбурн, Австралия
:Университет Монаш, кафедра эпидемиологии и профилактической медицины, Университет Монаш
;2018
.41.Дева
АК
,Адамс
WP
Jr,Викери
К
.Роль бактериальных биопленок в инфекции, связанной с устройством
.Plast Reconstr Surg.
2013
;132
(5
):1319
—1328
.42.Tamblyn
djblyn
dj
,parsons
j
,Salinger
K
,Ellery
B
,Merlin
T
.Сравнительная безопасность и эффективность грудных имплантатов с различными поверхностями
.Аделаида, Южная Австралия
:Adelaide Health Technology Assessment, Университет Аделаиды
;2017
. 43.
43.Чандаваркар
АА
,Гулд
DJ
,Грант Стивенс
W
.100 самых влиятельных лиц социальных сетей в области пластической хирургии в Твиттере: на кого следует подписаться
?Эстет Сург Дж.
2018
;38
(8
):913
—917
.44.Рорих
RJ
.Итак, хочешь дружить с Facebook? Как социальные сети навсегда изменили пластическую хирургию и медицину
.Plast Reconstr Surg.
2017
;139
(4
):1021
—1026
.[Epub перед печатью]. дои: 45.Dorfman
RG
,Vaca
EE
,Fine
NA
,Schierle
CF
CF.Этика публикации видеороликов о пластической хирургии в социальных сетях: систематический обзор литературы, этический анализ и предлагаемые рекомендации
.Plast Reconstr Surg.
2017
;140
(4
):825
—836
. 46.
46.Гулд
DJ
,Леланд
HA
,Хо
AL
,Патель
КМ
.Новые тенденции в социальных сетях и пластической хирургии
.Энн Трансл Мед.
2016
;4
(23
):455
.47.Лагерь
SM
,Миллс
DC
2-й.Союз пластической хирургии и социальных сетей: отношения на всю жизнь
.Эстет Сург Дж.
2012
;32
(3
):349
—351
.48.де Йонг
D
,Васмель
WL
,де Бур
JP
, и др.Анапластическая крупноклеточная лимфома у женщин с грудными имплантатами
.ЯМА.
2008
;300
(17
):2030
—2035
.49.Loch-Wilkinson
A
,Beath
KJ
,Knight
RJW
, et al.Анапластическая крупноклеточная лимфома, связанная с грудным имплантатом, в Австралии и Новой Зеландии: текстурированные имплантаты с большой площадью поверхности связаны с повышенным риском
.
Plast Reconstr Surg.
2017
;140
(4
):645
—654
.50.Тан
SY
,Израиль
JS
,Афифи
AM
.Болезнь грудных имплантатов: симптомы, опасения пациентов и сила социальных сетей
.Plast Reconstr Surg.
2017
. [Epub перед печатью]. дои: 51.Nunes E Silva
D
,Gründler
C
,Spengler
MDGMT
, и др.Аутоиммунный синдром, вызванный адъювантами (ASIA) после операции по увеличению груди силиконом
.Plast Reconstr Surg Glob Open.
2017
;5
(9
):e1487
.52.Кутер
RD
,Баркер
S
,Кэрролл
SM
, и др.Международное значение реестров надежных устройств груди
.Plast Reconstr Surg.
2015
;135
(2
):330
—336
.53.Becherer
BE
,Spronk
PER
,Mureau
MAM
и др.
Реестры устройств с высоким уровнем риска: глобальная ценность, затраты и устойчивое финансирование
.J Plast Reconstr Aestet Surg.
2018
;71
(9
):1362
—1380
.54.Кутер
R
,Барнетт
R
,Дева
А
, и др.В защиту международного сотрудничества по регистрации молочной железы (ICOBRA)
.Эстет Сург Дж.
2016
;36
(7
):NP225
—NP227
.56.Хоппер
I
,Ахерн
S
,McNeil
JJ
, и др.Повышение безопасности грудных имплантатов: имплантат-ассоциированная лимфома
.Med J Aust.
2017
;207
(5
):185
—186
.© 2019 Американское общество эстетической пластической хирургии, Inc.Перепечатка и разрешение: [email protected]
Текстурированный, круглый, высокопрофильный силиконовый когезивный гель для груди Silimed.
 ..
.. Фон
Доступность бесклеточного дермального матрикса (ADM) и синтетических сетчатых материалов побудила пластических хирургов вернуться к реконструкции груди с помощью подкожных имплантатов. Однако литература ограничена в отношении данных по отбору пациентов, методам и исходам. Методы
Систематический обзор баз данных Medline и Cochrane был выполнен для оригинальных исследований, в которых сообщалось о реконструкции молочной железы с помощью ADM или сетки, а также о подкожной установке имплантата.Исследования были проанализированы на предмет уровня доказательности, критериев включения/исключения для подкожной реконструкции, характеристик реконструкции и исходов. Результаты
Шесть исследований (186 реконструкций) были выбраны для обзора. Большинство исследований (66,7%) представляли собой серию клинических случаев уровня доказательности IV. Восемьдесят процентов исследований имели противопоказания к подкожной реконструкции, чаще всего предоперационное облучение, высокий индекс массы тела и активное курение. Сорок процентов исследований, посвященных отбору пациентов, оценивали перфузию лоскута мастэктомии для подкожной реконструкции.Сорок пять процентов реконструкций были прямой имплантацией, 33,3% двухэтапными и 21,5% одноэтапными регулируемыми имплантатами, при этом ADM использовался в 60,2% реконструкций по сравнению с сеткой. Общая частота осложнений включала: обширную инфекцию 1,2%, серому 2,9%, гематому 2,3%, полный некроз сосково-ареолярного комплекса 1,1%, частичный некроз сосково-ареолярного комплекса 4,5%, некроз большого лоскута 1,8%, осложнение заживления раны 2,3%, эксплантацию 4,1. % и капсулярная контрактура III/IV степени 1,2%. Выводы
Совокупная частота краткосрочных осложнений при подкожной аллопластической реконструкции молочной железы с помощью ADM или сетки была низкой в предварительных исследованиях с выборочными группами пациентов, хотя методы и результаты различались в разных исследованиях.Для разработки соответствующих показаний к выполнению реконструкции на основе подкожных имплантатов необходимы более крупные сравнительные исследования и более четкие критерии выбора и отчеты о результатах.
Сорок процентов исследований, посвященных отбору пациентов, оценивали перфузию лоскута мастэктомии для подкожной реконструкции.Сорок пять процентов реконструкций были прямой имплантацией, 33,3% двухэтапными и 21,5% одноэтапными регулируемыми имплантатами, при этом ADM использовался в 60,2% реконструкций по сравнению с сеткой. Общая частота осложнений включала: обширную инфекцию 1,2%, серому 2,9%, гематому 2,3%, полный некроз сосково-ареолярного комплекса 1,1%, частичный некроз сосково-ареолярного комплекса 4,5%, некроз большого лоскута 1,8%, осложнение заживления раны 2,3%, эксплантацию 4,1. % и капсулярная контрактура III/IV степени 1,2%. Выводы
Совокупная частота краткосрочных осложнений при подкожной аллопластической реконструкции молочной железы с помощью ADM или сетки была низкой в предварительных исследованиях с выборочными группами пациентов, хотя методы и результаты различались в разных исследованиях.Для разработки соответствующих показаний к выполнению реконструкции на основе подкожных имплантатов необходимы более крупные сравнительные исследования и более четкие критерии выбора и отчеты о результатах.
Всплески риска развития рака при использовании одного типа грудных имплантатов
Но авторы отмечают, что полиуретановые имплантаты были доступны в Австралии в течение более короткого времени, что может преуменьшать их профиль риска.
Все четыре зарегистрированных случая смерти в Австралии и Новой Зеландии были связаны с имплантатами Biocell производства Allergan, говорится в исследовании.
Текстурированные имплантаты — в отличие от гладких — составляют около 90 процентов от примерно 40 000 имплантатов, используемых в Австралии каждый год, сказал автор исследования Ананд Дева.
Профессор Дева, академический и пластический хирург, считает, что имплантаты Biocell и Silimed имели более высокий риск из-за их большей площади поверхности, что добавляет веса теории, что эти виды рака вызываются бактериальным загрязнением поверхности имплантата. .
«Текстурированные имплантаты…. представить бактерии с наиболее идеальным лесом или площадью поверхности, чтобы размножаться до огромного количества, если их не остановить», — сказал он. может снизить риск АККЛ почти до нуля».
может снизить риск АККЛ почти до нуля».
Представитель Allergan сказал, что у всех производителей текстурированных имплантатов были подтвержденные случаи АККЛ, и важно, чтобы они работали с медицинскими работниками и регулирующими органами, чтобы понять и решить эту проблему.
«У пластических хирургов и пациентов есть множество причин для выбора текстурированного имплантата, и пациентам рекомендуется тщательно обсудить со своим пластическим хирургом риски и преимущества каждого типа имплантата, чтобы принять обоснованное решение», — сказал представитель. говорится в заявлении.
Allergan работает над повышением осведомленности о заболевании, ранней диагностикой и методами ограничения бактериального загрязнения, такими как план из 14 пунктов, который отстаивает профессор Дева, сказали они.
Загрузка
TGA не рекомендует женщинам без симптомов удалять грудные имплантаты или проходить регулярный скрининг.
Вместо этого им настоятельно рекомендуется быть внимательными к отекам или шишкам и поговорить со своим врачом.
Обновление BIA-ALCL | Журнал PMFA
Автор обсуждает опасения и новые ограничения на грудные имплантаты в связи со случаями ассоциированной с грудными имплантатами анапластической крупноклеточной лимфомы – следует ли нам беспокоиться?
Грудные имплантаты, впервые представленные в 1960-х годах, продолжают развиваться, несмотря на ряд проблем с безопасностью.В начале 1990-х мораторий Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) против силикона, а позже скандал с имплантатами Poly Implant Prothese (PIP) в 2010 году, а еще позже запрет Silimed в 2015 году, — все это подорвало имидж силиконовых грудных имплантатов. Новейшая проблема связана с анапластической крупноклеточной лимфомой, связанной с грудным имплантатом (BIA-ALCL).
Первый случай был зарегистрирован в 1997 году Кичем и Кричем [1], и за последние 10 лет наблюдался экспоненциальный рост числа случаев, кульминацией которого стала классификация BIA-ALCL в 2016 году как уникального заболевания Всемирной организацией здравоохранения.![]() [2].Предлагаемые теории причин BIA-ALCL включают текстурированные частицы имплантата, хроническое аллергическое воспаление и/или реакцию на биопленку. Исследования во всех этих областях продолжаются. Несмотря на это, увеличение груди силиконовыми имплантатами продолжает оставаться одной из самых распространенных эстетических операций, выполняемых во всем мире [3].
[2].Предлагаемые теории причин BIA-ALCL включают текстурированные частицы имплантата, хроническое аллергическое воспаление и/или реакцию на биопленку. Исследования во всех этих областях продолжаются. Несмотря на это, увеличение груди силиконовыми имплантатами продолжает оставаться одной из самых распространенных эстетических операций, выполняемых во всем мире [3].
BIA-ALCL чаще всего проявляется поздней серомой (определяемой как серома, проявляющаяся > 1 года после имплантации груди), но также может проявляться опухолью молочной железы или подмышечной впадины, а также уплотнением или болью.Презентация происходит в среднем через восемь лет после имплантации (от 2 до 28 лет). Поэтому важно не отбрасывать поздние серомы, а исследовать их посредством дренирования под контролем УЗИ и анализа жидкости. Объем выпота может варьироваться от 50 до 1000 мл и обычно более вязкий, чем доброкачественная серома, из-за высокого содержания белка и клеточности. Жидкость должна быть протестирована на наличие атипичных моноклональных Т-клеток, которые являются положительными по CD30 и отрицательными по киназы анапластической лимфомы (ALK) с помощью иммуногистохимии, и следует провести проточную цитометрию для диагностики BIA-ALCL (примечание: если CD30 положительный, он может или может не быть BIA-ALCL, и для постановки диагноза требуется цитология клеточного блока и проточная цитометрия).
«Кажется, существуют географические различия в показателях BIA-ALCL во всем мире [7]»
Маммограммы бесполезны для постановки диагноза. В подтвержденных случаях может быть выполнено ПЭТ-сканирование, чтобы определить стадию заболевания [4]. Важно отметить, что большинство поздних сером не будут BIA-ALCL. Кроме того, доброкачественные скопления жидкости (CD30-отрицательные с отрицательной цитологией) не являются предшественниками развития BIA-ALCL, и на сегодняшний день не было сообщений о пациентах с рецидивирующими доброкачественными серомами, которые затем преобразовались в CD30-положительный выпот.
Если поставлен диагноз BIA-ALCL, подавляющее большинство пациентов можно вылечить. Рекомендации по лечению включают:
- Большинство случаев излечивается путем удаления имплантата и всей капсулы, окружающей имплантат.
- Большинство пациентов не нуждаются в дополнительном лечении.
- Нечасто пациентам необходимо пройти химиотерапию или лучевую терапию, когда есть экстракапсулярное заболевание, которое невозможно удалить [4].

По состоянию на февраль 2019 года в базу данных FDA о производителях и пользовательских устройствах (MAUDE) поступило 457 случаев ALCL (первоначально сообщалось о 660 случаях, но многие из них были идентифицированы как дубликаты или неполные отчеты) [5].Во всем мире было зарегистрировано 17 подтвержденных смертей, девять из которых произошли в США.
Скорость не отличается между силиконом и физиологическим раствором; это происходит как у косметических, так и у реконструктивных пациентов. Риск связан только с текстурированными имплантатами, а не с гладкими имплантатами. FDA сообщило, что «были сообщения о BIA-ALCL у пациентов с имплантатами с гладкой поверхностью, и многие отчеты не включают текстуру поверхности имплантата на момент постановки диагноза». На момент написания этой публикации известно, что в FDA первоначально было сообщено об одном случае гладкой только BIA-ALCL; однако позже было установлено, что это было неточно, и речь шла о смешанном случае имплантации, и в отчет FDA были внесены поправки (февраль 2019 г.![]() )* [6].
)* [6].
По-видимому, существуют географические различия в показателях BIA-ALCL во всем мире [7]. Это может быть связано с недостаточной осведомленностью и/или различной отчетностью и регистрами, но вполне может быть и генетическая предрасположенность, которая еще не до конца изучена. Например, на данный момент очень мало случаев у азиатских пациентов и очень мало случаев в Германии по сравнению с другими европейскими странами.
FDA сообщает, что риск развития ALCL составляет от 1:3817 до 1:30 000 в их последнем заявлении [8].Эти оценки рисков постоянно меняются, но это самая точная информация, доступная в настоящее время.
На основании текущих данных риск может быть дополнительно объяснен степенью текстуры имплантатов следующим образом:
- Класс 1 (только гладкие) — в глобальных базах данных не было подтвержденных случаев только гладких.
- Grade 2 (например, микротекстура, Siltex и т.п.) – 1:82 000.
- Класс 3 (например, макротекстура, биоцелл и т.
 п.) – 1:3200.
п.) – 1:3200. - Марка 4 (например, полиуретан) – 1:2800**.
** 100% полиуретановые имплантаты Silimed, имевшие производственный брак и в настоящее время снятые с рынка (на основе данных австралийского исследования 2017 г., проведенного Loch-Wilkinson et al. [9]
На фоне этих новых данных регулирующие органы Франции и Канады, а также Голландская ассоциация пластической хирургии приостановили (или рекомендовали приостановить) использование макротекстурированных и полиуретановых имплантатов.Правильно это или нет, но это только вопрос времени, когда больше национальных регулирующих органов и/или национальных ассоциаций, вероятно, последуют их примеру. К счастью, ни один орган не рекомендовал плановую эксплантацию макротекстурированных или полиуретановых имплантатов у пациентов (как это было в случае с интактными имплантатами PIP), поскольку риск этого, несомненно, намного превышает риск развития BIA-ALCL. Когда мы рассматриваем риск для наших пациентов, учтите следующее:
- Средний риск развития рака молочной железы у женщин в течение жизни составляет 12 лет.
 5% (1 из 8) [10].
5% (1 из 8) [10]. - Риск смерти в автокатастрофе в течение жизни составляет 0,14% (1 из 572) [11]
- Риск смерти от осложнений косметической процедуры составляет 0,002% (1 на 50 000) [12].
- Риск развития BIA-ALCL, связанный с грудным имплантатом, составляет 0,003-0,0003% (~1 на 3817-30 000) [13].
- Риск развития прогрессирующей BIA-ALCL с метастазированием в лимфатические узлы составляет примерно 0,0004% (~1 из 250 000) [14].
- Риск развития BIA-ALCL, который не разрешится в течение трех лет, приблизительно равен 0.0002% (~1 из 500 000)[14].
Также рассмотрим вопрос; какой имплантат вы бы порекомендовали члену вашей семьи?
Ссылки
1. Кич Дж. А. Младший, Крич Б. Дж. Анапластическая Т-клеточная лимфома вблизи грудного имплантата, заполненного физиологическим раствором. Plast Reconstr Surg 1997; 100(2) :554-5.
2. Swerdlow SH, Campo E, Pileri SA, et al. Пересмотренная в 2016 г. классификация лимфоидных новообразований Всемирной организации здравоохранения. Кровь 2016; 127(20) :2375-90.
Пересмотренная в 2016 г. классификация лимфоидных новообразований Всемирной организации здравоохранения. Кровь 2016; 127(20) :2375-90.
3. ИСАПС. 2017 Глобальная статистика. Международное общество эстетической пластической хирургии. Доступно по адресу
http://www.isaps.org; 2018.
4. Клеменс М.В., Хорвиц С.М. Согласованные рекомендации NCCN по диагностике и лечению анапластической крупноклеточной лимфомы, связанной с грудными имплантатами. Эстет Сург J 2017; 37(3) :285-9.
5. Отчеты о медицинском оборудовании для анапластической крупноклеточной лимфомы, связанной с грудным имплантатом.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США
https://www.fda.gov/MedicalDevices/
ProductsandMedicalProcedures/
ImplantsandProsthetics/BreastImplants/
ucm481899
.surgery.org/sites/
default/files/BIA-ALCL-
Talking-Points-2-13-19.pdf.
7. Шриниваса Д. Р., Миранда Р.Н., Каура А., и др. Глобальные отчеты о нежелательных явлениях АККЛ, связанных с грудными имплантатами: международный обзор 40 баз данных государственных органов. Plast Reconstr Surg 2017 ; 139(5) :1029-39.
Р., Миранда Р.Н., Каура А., и др. Глобальные отчеты о нежелательных явлениях АККЛ, связанных с грудными имплантатами: международный обзор 40 баз данных государственных органов. Plast Reconstr Surg 2017 ; 139(5) :1029-39.
8. Анапластическая крупноклеточная лимфома, связанная с грудным имплантатом (BIA-ALCL). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США
https://www.fda.gov/MedicalDevices/
ProductsandMedicalProcedures/
ImplantsandProsthetics/BreastImplants/
ucm239995
9. Loch-Wilkinson A, Beath KJ, Knight RJW, et al. Анапластическая крупноклеточная лимфома, связанная с грудными имплантатами, в Австралии и Новой Зеландии: текстурированные имплантаты с большой площадью поверхности связаны с повышенным риском. Plast Reconstr Surg 2017; 140(4) :645-54.
10. Feuer EJ, Wun LM, Boring CC, et al. Пожизненный риск развития рака молочной железы. J Natl Cancer Inst 1993; 85(11) :892-7.
11. Факты + статистика: риск смертности. Институт страховой информации.
https://www.iii.org/fact-statistic/
fact-statistics-mortality-risk
12. Keyes GR, Singer R, Iverson RE, et al. Летальность в амбулаторной хирургии. Plast Reconstr Surg 2008; 122(1) :245-50; обсуждение 51-3.
13. Ресурсы BIA-ALCL. Американское общество пластических хирургов.
https://www.plasticsurgery.org/
for-medical-professionals/health-policy/
bia-alcl-physician-resources/by-the-numbers
14. Clemens MW. Анапластическая крупноклеточная лимфома, связанная с грудным имплантатом (BIA-ALCL): по цифрам и их значению. Американское общество пластических хирургов 2017.
(Последний раз все ссылки открывались в апреле 2019 г.)
Заявление о конкурирующих интересах: Не заявлено.
КОММЕНТАРИИ ПРИВЕТСТВУЮТСЯХотите прокомментировать темы, затронутые в этой статье?
Электронная почта
diana@pinpoint-scotland.


 п.) – 1:3200.
п.) – 1:3200. 5% (1 из 8) [10].
5% (1 из 8) [10].