Ультразвуковая и энзимная эпиляция — особенности, преимущества и недостатки
Это название не совсем точно отражает суть процедуры, так как в основе её заключена депиляция воском. Своим названием методика обязана своей второй части, когда после ваксинга поверхность кожи обрабатывается специальными составами, молекулы которых с помощью ультразвуковых колебаний доставляются в глубокие слои кожи.
В основе метода ультразвуковой эпиляции лежит использование препаратов, включающих ферменты (энзимы). Это папаин, трипсин, хемотрипсин. Считается, что энзимы воздействуют на фолликулярный аппарат волоса, уничтожая его. Процесс идет постепенно, поскольку разрушить структуру фолликула сразу энзимы не в состоянии. Именно поэтому энзимный способ эпиляции также предполагает определенный курс, после которого, как считают распространители метода, результат может быть устойчивым.
Первые качественные изменения наблюдаются обычно примерно через двенадцать месяцев после начала процедур.
Техника энзимной эпиляции
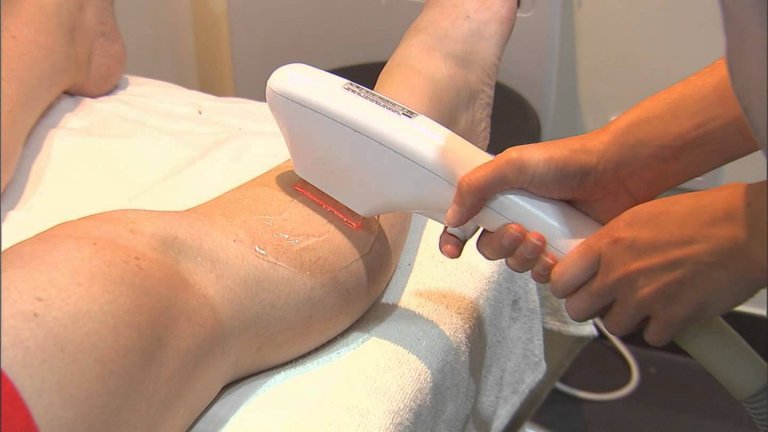
В процессе процедуры насадка ультразвукового прибора должна плотно прилегать к коже, иначе энзимы не попадут по назначению.
Время и интенсивность обработки зависят от места, которое подвергают депиляции. В конце процедуры на кожу наносят успокаивающий крем.
Поскольку после депиляции воском волосяной канал открыт ещё 2-3 дня, проводят энзимно-ультразвуковую процедуру в течение трёх дней подряд. Параллельно энзимный препарат применяется и дома; после его использования следует нанести успокаивающий крем.
Достоинства метода
- Энзимная депиляция совершенно безболезненна, если не считать некоторый дискомфорт во время нанесения воска.

- Способ позволяет обрабатывать сразу большую площадь, поэтому он особенно предпочтителен для тех, у кого нежелательная растительность занимает на теле много места.
- Процедура длится недолго: на обе голени, как правило, уходит около 45 минут.
- Многие специалисты считают энзимную депиляцию достаточно деликатным методом, который подходит даже обладателям чувствительной кожи.
- К недостаткам можно отнести меньшую скорость инволюции волос по сравнению со способами более агрессивного воздействия на фолликулы. Кроме того, использование химических агентов ограничивает круг лиц, которым подходит энзимный метод эпиляции.
Оцените материал:
Средний рейтинг: 4.4 / 5
Романис Ботин-Маевски
Автор статьи: тренинг-менеджер компании АЮНА, член международного комитета по косметологии и эстетике Cidesco, судья международного конкурса по косметологии и эстетике «Невские берега».
Товары, которые упоминаются в статье
Сахарная паста для шугаринга КОСТА-РИКА (АЮНА), средней плотности (3)
1 250 В наличии
Фитосмола АЮНА для ручной работы
1 480 В наличии
Фитосмола АЮНА, 800 г ультрамягкая (для бандажной техники)
1 480 Нет в наличии
Набор для домашнего шугаринга УНИВЕРСАЛЬНЫЙ
Энзимная эпиляция – безболезненная процедура по удалению и замедлению роста волос.
Сегодня от разновидностей и способов эпиляции может закружиться голова. Каждый уважающий себя салон красоты предложит вам как минимум 3-5 разновидностей процедуры по удалению волос с любой зоны тела, но «последним писком моды» сейчас является энзимная эпиляция. Если раньше мы думали — чем больнее, тем эффективнее, то сейчас все изменилось и девушки предпочитают комфорт и безболезненность.
Энзимная эпиляция – что это?
Энзимная эпиляция – это удаление волос с помощью веществ, содержащих в своем составе энзимы (папаин, химотрипсин, трипсин и другие).
Энзимы — это высокомолекулярные белки (ферменты), которые
присутствуют во всех живых клетках. Состоят они из цепочки аминокислот и
являются основой жизни. Они участвуют в процессах обмена веществ, очищения от
продуктов жизнедеятельности, регенерации тканей, размножения, защищают организм
от негативных воздействий извне. Не без помощи энзимов кожа очищается от
омертвевших клеток.
Основная задача энзимов в эпиляции – расщепление волосяных луковиц. Долгосрочного эффекта можно добиться при нескольких процедурах, в ходе которых на эпилируемую область наносят специальный энзимный состав. После этого кожу покрывают сверху осмотической пленкой, поверх которой накладывается термобандаж.
Расщепление энзимов происходит за счет равномерного нагревания кожи термоэпилятором. Высокая температура запускает химические процессы, безвредные для организма, но губительные для волосяных фолликулов. Волосы, при этом, постепенно истончаются, светлеют, становятся ломкими.
Дополнительным бонусом процедуры является приостановка роста
клеток волос, находящихся в зародышевом состоянии. Температура является тем
необходимым фактором, с помощью которого открываются волосяные каналы. Так как
энзимы практически оставляют клетки без доступа кислорода и питательных
веществ, через определенное время происходит процесс атрофии луковиц и
зарастание волосяного мешочка.
5 интересных фактов о депиляции, которые вы могли не знать
Схема проведения энзимной эпиляции
Для начала следует исключить вероятность возникновения аллергических реакций. Необходимо сделать пробу на совместимость клеток кожи с энзимосодержащим коктейлем.
Энзимную эпиляцию можно и нужно сочетать с шугарингом или восковой эпиляцией, т.е. до воздействия энзимов волоски можно легко убрать с помощью воска или карамели. После чего на кожу наносится ферментный состав и происходит разрушающее воздействие.
Если говорить о зонах проведения энзимной эпиляции, то ее
смело можно выполнять на абсолютно любых участках кожи кроме лица. После
проведения процедуры требуется нанести успокаивающий и увлажняющий крем либо
лосьон. А через несколько часов после эпиляции можно смазать кожу средством против врастания волос.
Увидеть ощутимые результаты по уменьшению роста волос вы
сможете после 5-7 процедуры.
Противопоказания
- Беременность и грудное вскармливание.
- Воспалительные и инфекционные процессы в зоне воздействия.
- Хронические заболевания организма.
- Сахарный диабет и другие заболевания эндокринных желез.
- Варикозное расширение вен (в месте удаления волос).
- Менструация и нарушение процесса свертывания крови.
- Индивидуальная повышенная чувствительность и непереносимость ферментов и их компонентов.
- Онкологические заболевания.
- Сердечно-сосудистая патология.
- Аллергические реакции.
Предостережения после энзимной эпиляции
В течение нескольких дней после процедуры избегайте посещения бассейна, принятия солнечных ванн, солярий, другие процедуры по удалению волос и раздражению кожного покрова.
← Прощай, второй подбородок | Плазмолифтинг или мезотерапия? Сравниваем плюсы и минусы обеих процедур →
Epiladerm USA — Энзимная редукция волос EpilaDerm
EpilaDerm — это запатентованный продукт, наносимый непосредственно на кожу после |
EpilaDerm:
|
EpilaDerm просто ЛУЧШЕЕ средство после депиляции!
Функция и преимущества (эффект 3 в 1):
| Преимущества:
|
Функция EpilaDerm Enzyme Care:
Процесс ферментативной деградации инактивирует волосяные фолликулы, где оставшиеся анагенные волосковые клетки протеолитически растворяются под действием ферментов EpilaDerm.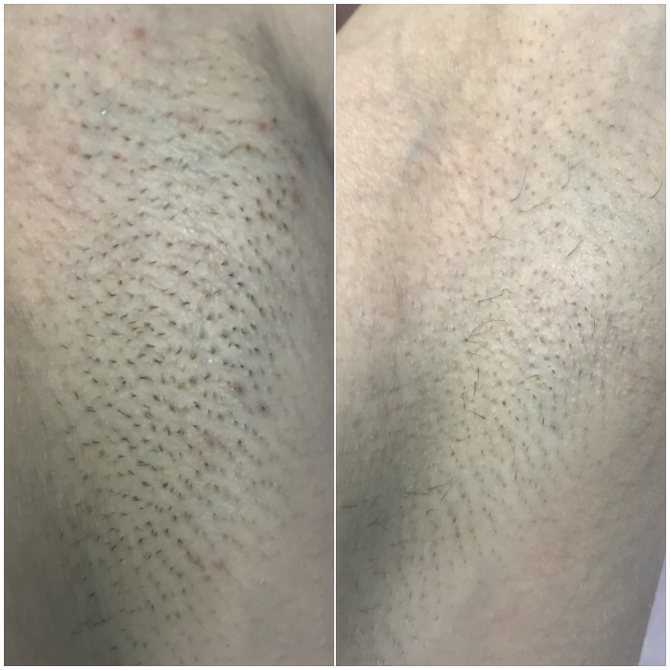 Этот процесс снижает основу для роста волос и со временем уменьшает повторный рост или полностью останавливает регенерацию волос.
Этот процесс снижает основу для роста волос и со временем уменьшает повторный рост или полностью останавливает регенерацию волос.
Ферменты EpilaDerm работают, когда волосы удаляются с помощью глубокого корневого отростка. Это может быть восковая эпиляция, хирургическая операция или пинцет. После глубокой эпиляции корней волосяной фолликул обнажается, а оставшиеся волосковые клетки в фолликуле открываются для применения фермента EpilaDerm.
- Сначала ваши волосы удаляются с помощью процесса глубокого удаления корней. (Восковая эпиляция/Ширинг/Выщипывание)
- Ферментный комплекс (фаза 1) затем наносится на кожу и тщательно массируется в течение одной минуты.
- Затем наносится ускоритель (фаза 2) и также тщательно массируется в течение одной минуты.
- Активная система проникает в нижнюю часть волосяного фолликула и растворяет оставшиеся клетки роста волос примерно за 10 минут.
Вы являетесь домашним пользователем и хотели бы использовать EpilaDerm после эпиляции воском, сахаром или пинцетом в домашних условиях | Вам нужна информация о том, какие салоны предлагают своим клиентам систему уменьшения роста волос |
Ферментативная депиляция шкур животных: идентификация эластазы (LasB) из Pseudomonas aeruginosa MCM B-327 в качестве протеазы для депиляции
1. Germann HP. 1999. Экология кожевенного производства – Современное состояние и тенденции развития; Материалы XXV Конгресса IULTCS: Ченнаи.
Germann HP. 1999. Экология кожевенного производства – Современное состояние и тенденции развития; Материалы XXV Конгресса IULTCS: Ченнаи.
2. Людвик Й. Возможности снижения загрязнения окружающей среды при обработке кожи. Вена: Организация Объединенных Наций по промышленному развитию. США/РАС/92/120/11-51; 2000. [Google Scholar]
3. Marsal A, Cot J, Boza EG, Celma PJ, Manich AM. Окислительный процесс удаления волос с восстановлением волос. Часть I. Эксперименты по предварительной иммунизации волос. J Soc Leather Technol Chem. 1999; 83: 310–315. [Google Scholar]
4. Ramasami T, Rao JR, Chandrababu NK, Parthasarathi K, Rao PG, et al. Beamhouse и дубление: новый взгляд на химию процесса. J Soc Leather Technol Chem. 1999;83:39–45. [Google Scholar]
5. Рамасами Т. Новые стратегии обработки кожи для минимизации отходов. . В: Buljan J, редактор. Справочная информация и более чистые технологии в сохранении сырья и в процессах Beamhouse. ЮНИДО; 1998. С. 183–197. [Google Scholar]
6. Puvanakrishnan R, Dhar SC. Ферменты в обезвоживании. Ченнаи, Индия: публикация NICLAI; 1988. Ферментная технология в лучевой практике, стр. 92–120. [Google Scholar]
Puvanakrishnan R, Dhar SC. Ферменты в обезвоживании. Ченнаи, Индия: публикация NICLAI; 1988. Ферментная технология в лучевой практике, стр. 92–120. [Google Scholar]
7. Йейтс Дж.Р. Исследования по депиляции. II. Структурные изменения шерстяного фолликула при бактериальном разрыхлении шерсти («потливости»). Австралийская J Biol Sci. 1968;21:361–374. [Google Scholar]
8. Йейтс Дж. Р. Исследования по депиляции. часть X. Механизм процесса ферментативной депиляции. J Soc Leather Technol Chem. 1972; 56: 158–175. [Google Scholar]
9. Мукхопадхьяй Р.П., Чандра А.Л. Протеаза кератинолитического стрептомицета для обезвоживания козьей кожи. Ind J of Expt Biol. 1993; 31: 557–558. [PubMed] [Google Scholar]
10. Нилегаонкар С.С., Замбаре В.П., Канекар П.П., Дакепхалкар П.К., Сарнаик С.С. Производство и частичная характеристика обезволашивающей протеазы из Bacillus cereus MCM B-326. Биорес Технол. 2007; 98: 1238–1245. [PubMed] [Google Scholar]
11. Замбаре В. П., Нилегаонкар С.С., Канекар П.П. Производство щелочной протеазы Bacillus cereus MCM B-326 и ее применение в качестве средства для удаления волос. World J Microbiol Biotechnol. 2007; 23:1569–1574. [Google Scholar]
П., Нилегаонкар С.С., Канекар П.П. Производство щелочной протеазы Bacillus cereus MCM B-326 и ее применение в качестве средства для удаления волос. World J Microbiol Biotechnol. 2007; 23:1569–1574. [Google Scholar]
12. Anbu P, Gopinath SCB, Hilda A, Lakshmi Priya T, Annadurai G. Очистка кератиназы из изолята птицефермы — Scopulariopsis brevicaulis и статистической оптимизации активности ферментов. Ферментная микробная технология. 2005; 36: 639–647. [Google Scholar]
13. Фридрих Й, Градишар Х, Врекл М, Погаеник А. In vitro Деструкция эпидермиса свиной кожи грибковой кератиназой Doratomyces microsporus . Ферментная микробная технология. 2005; 36: 455–460. [Google Scholar]
14. Giongo JL, Lucas FS, Casarin F, Heeb P, Brandelli A. Кератинолитические протеазы видов Bacillus , выделенных из бассейна Амазонки, демонстрируют замечательную активность по удалению волос. World J Microbiol Biotechnol. 2007; 23: 375–382. [Академия Google]
[Академия Google]
15. Macedo AJ, da Silva WOB, Gava R, Driemeier D, Henriques JAP, et al. Новая кератиназа из Bacillus subtilis S14, обладающая замечательными способностями к удалению волос. Appl Environ Microbiol. 2005; 71: 594–596. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Wang HY, Liu DM, Liu Y, Cheng CF, Ma QY, et al. Скрининг и мутагенез нового штамма Bacillus pumilus , продуцирующего щелочную протеазу для удаления волос. Lett Appl Microbiol. 2007; 44:1–6. [PubMed] [Академия Google]
17. Замбаре В.П., Нилегаонкар С.С., Канекар П.П. Новая внеклеточная протеаза из Pseudomonas aeruginosa MCM B-327: производство фермента и его частичная характеристика. Новая биотехнология (в печати) 2010 [PubMed] [Google Scholar]
18. Ханахан Д. Исследования трансформации Escherichia coli с помощью плазмид. Дж Мол Биол. 1983; 166: 557–580. [PubMed] [Google Scholar]
19. Моралес В.М., Бэкман А., Багдасарян М. Серия векторов с низким числом копий для широкого круга хозяев, которые позволяют проводить прямой скрининг рекомбинантов. Ген. 1991;97:39–47. [PubMed] [Google Scholar]
Серия векторов с низким числом копий для широкого круга хозяев, которые позволяют проводить прямой скрининг рекомбинантов. Ген. 1991;97:39–47. [PubMed] [Google Scholar]
20. Yanisch-Perron C, Vieira J, Messing J. Улучшенные векторы клонирования фага M13 и штаммы-хозяева: нуклеотидные последовательности векторов M13mp18 и pUC19. Ген. 1985; 33: 103–119. [PubMed] [Google Scholar]
21. Simon R, Priefer U, Puhler A. Система мобилизации широкого круга хозяев для генной инженерии in vivo : мутагенез транспозонов в грамотрицательных бактериях. Био/Технологии. 1983; 1: 784–791. [Google Scholar]
22. Sambrook J, Fritsch EF, Maniatis T. Молекулярное клонирование: лабораторное руководство, 2-е изд. Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор; 1989. [Google Scholar]
23. Куниц М. Кристаллический ингибитор трипсина сои II. Общие свойства. J Gen Physiol. 1947; 30: 291–310. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Lowry OH, Rosebrough NJ, Farr AL, Randall ARJ.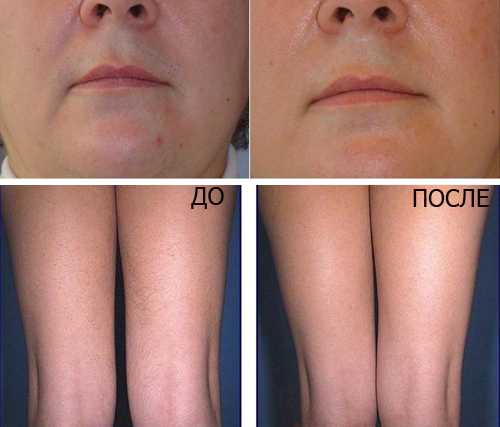 Измерение белка с помощью фолин-фенольного реагента. Дж. Биол. Хим. 1951; 193: 265–275. [PubMed] [Google Scholar]
Измерение белка с помощью фолин-фенольного реагента. Дж. Биол. Хим. 1951; 193: 265–275. [PubMed] [Google Scholar]
25. Канекар П.П., Нилегаонкар С.С., Сарнаик С.С., Келкар А.С. Оптимизация протеазной активности алкалофильных бактерий, выделенных из щелочного озера в Индии. Биорес Технол. 2002; 85: 87–93. [PubMed] [Google Scholar]
26. Schägger H. Нативный электрофорез для выделения митохондриальных белковых комплексов окислительного фосфорилирования. Методы Энзимол. 1995; 260:190–202. [PubMed] [Google Scholar]
27. Laemmli UK. Расщепление структурных белков при сборке головки бактериофага Т 4 . Природа. 1970; 227: 680–685. [PubMed] [Google Scholar]
28. Pandeeti EVP, Chinnaboina MR, Siddavattam D. Опосредованные бензоатом изменения профиля экспрессии растворимых белков в Серратия зр. ДС001. Lett Appl Micobiol. 2009; 48: 566–571. [PubMed] [Google Scholar]
29. Фигурски Д.Х., Хелински Д.Р. Репликация ориджин-содержащего производного плазмиды RK2 зависит от функции плазмиды, представленной в транс. Proc Natl Acad Sci USA. 1979; 76: 1648–1652. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA. 1979; 76: 1648–1652. [Статья бесплатно PMC] [PubMed] [Google Scholar]
30. Pandey JP, Gorla P, Manavathi B, Siddavattam D. Вторичная структура мРНК модулирует трансляцию органофосфатгидролазы (OPH) в E. coli . Мол Биол Реп. 2009; 34:13–31. [PubMed] [Google Scholar]
31. Браун П., Биттер В., Томмассен Дж. Активация эластазы Pseudomonas aeruginosa в Pseudomonas putida путем запуска диссоциации пропептидно-ферментного комплекса. Микробиология. 2000;146:2565–2572. [PubMed] [Google Scholar]
32. Yahr TL, Goranson J, Frank DW. Экзоферменты Pseudomonas aeruginosa секретируются по типу III. Мол микробиол. 1996; 22: 991–1003. [PubMed] [Академия Google]
33. Хаузер А.Р., Флейзиг С., Канг П.Дж., Мостов К., Энгель Дж.Н. Дефекты секреции III типа коррелируют с интернализацией Pseudomonas aeruginosa эпителиальными клетками. Заразить иммун. 1998;66:1413–1420. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Сандквист М. Секреция II типа и патогенез. Заразить иммун. 2001;69:3523–3535. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Сандквист М. Секреция II типа и патогенез. Заразить иммун. 2001;69:3523–3535. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Lewenza S, Gardy JL, Brinkman FSL, Hancock REW. Полногеномная идентификация Pseudomonas aeruginosa экспортировали белки, используя согласованную вычислительную стратегию в сочетании с лабораторным скринингом слияния PhoA. Геном Res. 2005; 15: 321–329. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Nouwens AS, Willcox MDP, Walsh BJ, Cordwell SJ. Протеомное сравнение мембранных и внеклеточных белков из инвазивных (PAO1) и цитотоксических (6206) штаммов Pseudomonas aeruginosa . Протеомика. 2002; 2: 1325–1346. [PubMed] [Академия Google]
37. Braun P, Ockhuijsen C, Eppens E, Koster M, Bitter W, et al. Созревание Pseudomonas aeruginosa эластазы. Образование дисульфидных связей. Дж. Биол. Хим. 2001; 276:26030–26035. [PubMed] [Google Scholar]
38. Холдер И.А., Нили Н.А.
Эластаза Pseudomonas действует как фактор вирулентности у обожженных хозяев за счет зависимой от фактора Хагемана активации кининового каскада хозяина. Заразить иммун. 1989; 57: 3345–3348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун. 1989; 57: 3345–3348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Nouwens AS, Beatson SA, Whitchurch CB, Walsh BJ, Schweizer HP и др. Анализ протеома внеклеточных белков, регулируемых системами определения кворума las и rhl в Pseudomonas aeruginosa PAO1. микробиол. 2003; 149:1311–1322. [PubMed] [Google Scholar]
40. Наджафи М.Ф., Деобагкар Д.Н., Мерварц М., Деобагкар Д.Д. Ферментативные свойства новой высокоактивной и устойчивой к хелаторам протеазы из Pseudomonas aeruginosa PD100. Ферментная микробная технология. 2006;39: 1433–1440. [Google Scholar]
41. Bayoudh AN, Gharsallah M, Chamkha A, Dhouib S, Ammar, et al. Очистка и характеристика щелочной протеазы из Pseudomonas aeruginosa MN1. J Ind Microbiol Biotechnol. 2000; 24: 291–295. [Google Scholar]
42. Lin H, Yin L, Jiang S. Клонирование, экспрессия и очистка кератиназы Pseudomonas aeruginosa в системе экспрессии Escherichia coli AD494 (DE3) pLysS. J Сельскохозяйственная и пищевая химия. 2009 г.;57:3506–3511. [PubMed] [Google Scholar]
J Сельскохозяйственная и пищевая химия. 2009 г.;57:3506–3511. [PubMed] [Google Scholar]
43. Lin H, Yin L, Jiang S. Функциональное выражение и характеристика кератиназы из Pseudomonas aeruginosa в Pichia pastoris . J Сельскохозяйственная и пищевая химия. 2009; 57: 5321–5325. [PubMed] [Google Scholar]
44. Шарма Р., Гупта Р. Внеклеточная экспрессия кератиназы kerP из Pseudomonas aeruginosa в E. coli . Биотехнологическая лат. 2010 DOI 10.1007/s10529-010-0361-2. [PubMed] [Академия Google]
45. Brandelli A. Бактериальные кератиназы: полезные ферменты для биопереработки агропромышленных отходов и не только. Технология пищевых биопроцессов. 2008; 1:105–116. [Google Scholar]
46. Rust L, Pesci EC, Iglewski BH. Анализ регуляторной области Pseudomonas aeruginosa эластазы ( lasB ). J Бактериол. 1996; 179: 557–562. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Anderson RM, Zimprich CA, Rust L.



