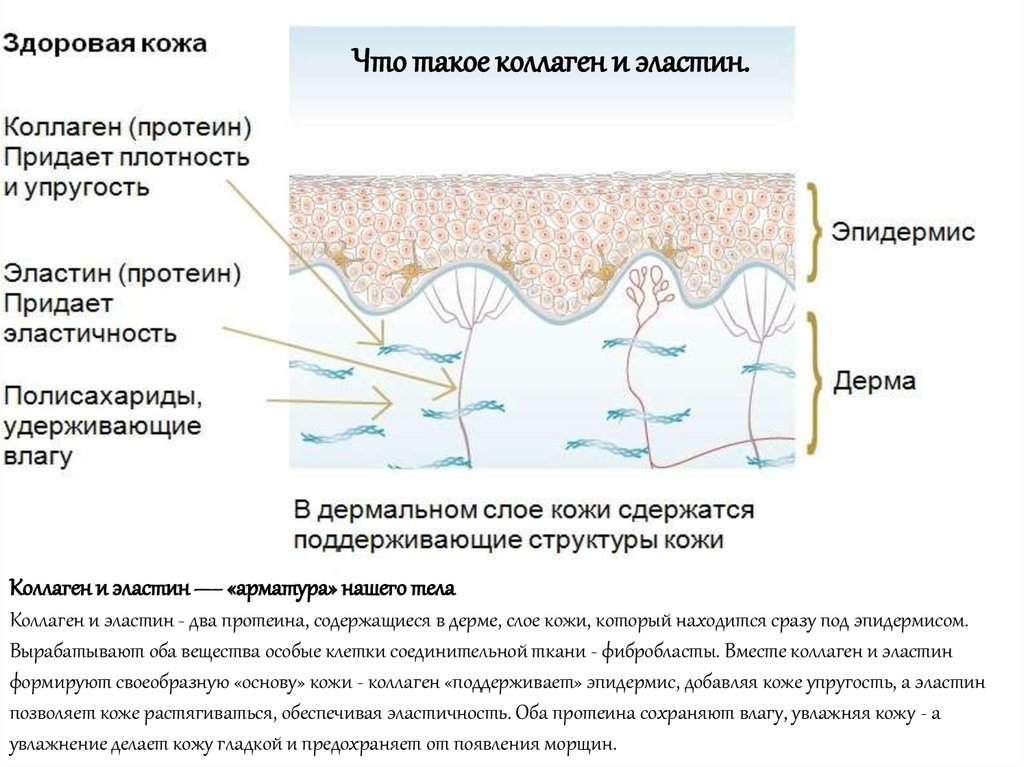
Эластин
Эластин представляет собой разновидность белка, который составляет основу волокон соединительной ткани высших животных, обеспечивая её эластичность, способность к быстрому восстановлению при различных повреждениях. В состав этого белка входит ряд аминокислот — глицин, валин, пролин, другие — созидательную роль которых для человеческого организма трудно переоценить. Содержится в эластине также весьма важная, уникальная, с точки зрения косметологии, аминокислота — десмозин. Наличие этой разновидности структурных химических единиц способствует образованию под кожей живого организма своеобразного прочного каркаса. Он, эффективно предотвращая обвисание кожи, препятствует образованию морщин и растяжек.
Функции эластина в живом организме не ограничиваются выше названным. Этот вид белка лучше прочих веществ способен посредством образования «дышащей» плёнки поддерживать оптимальный уровень увлажнения кожных покровов. При этом поры не закупориваются, что обеспечивает свободный доступ воздуха. А набор неполярных аминокислот, в составе молекулы эластина обеспечивает контроль уровня образования кожного сала, что очень важно для поддержания молодости кожи. Таким образом, в сочетании с другим белком — коллагеном эластин обеспечивает прочность, упругость, эластичность кожных покровов.
А набор неполярных аминокислот, в составе молекулы эластина обеспечивает контроль уровня образования кожного сала, что очень важно для поддержания молодости кожи. Таким образом, в сочетании с другим белком — коллагеном эластин обеспечивает прочность, упругость, эластичность кожных покровов.
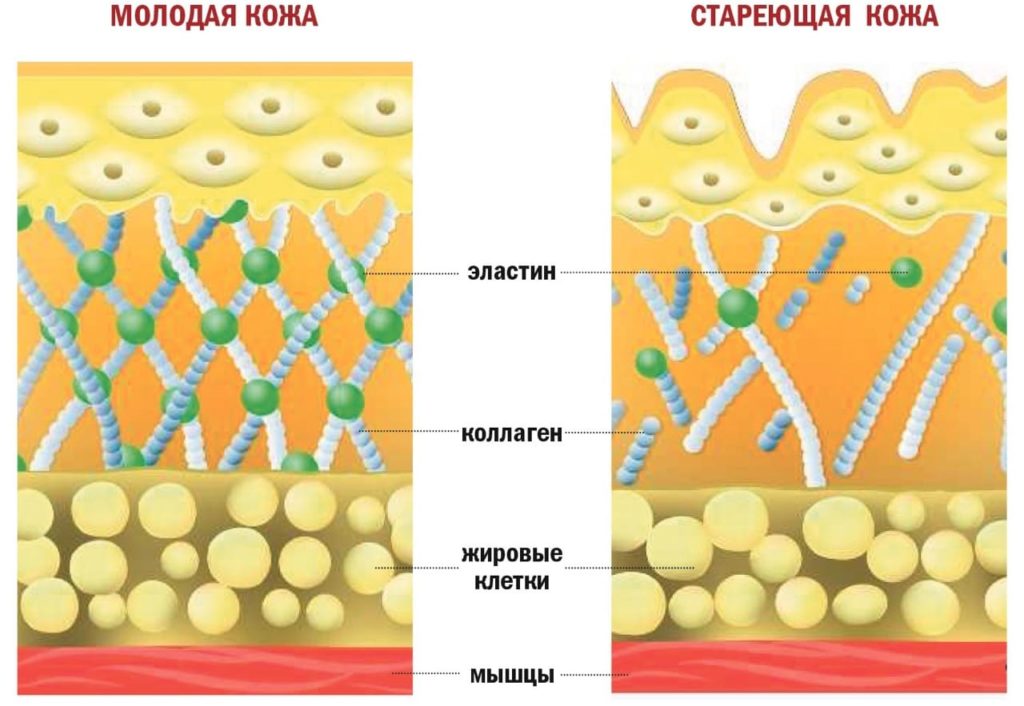
Однако количество вырабатываемого организмом белка одного и другого вида — эластина и коллагена — составляющих основу эластических волокон, непостоянно. Под влиянием различных факторов оно может уменьшаться. Это способствует появлению сначала поверхностных мимических морщин, затем старению, обвисанию кожи, образованию глубоких морщин. Замедляют процесс синтеза столь необходимых нам белков три основных фактора: возраст (после 30 лет количество вырабатываемого эластина неуклонно уменьшается), УФ-излучение и табакокурение (они разрушают структуру как эластина, так и коллагена).
Возможно ли замедлить процесс разрушения структурообразующих белков соединительной ткани? Да, возможно, если следовать некоторым рекомендациям. Перво-наперво не следует увлекаться прогулками под палящим солнцем без предварительного нанесения на кожу защитного крема от УФ-лучей, которым полезно пользоваться также при пасмурной погоде. Оставить привычку «жариться» на пляже, а также в солярии. Второе — отказаться от курения. Больший эффект данные рекомендации будут иметь, если пользоваться косметическими средствами, включающими полезные для кожи ингредиенты,они интенсифицируют синтез коллагена и эластина. Это витамин С, ретиноиды (они, помимо прочего, стимулируют обновление клеток кожи), пептиды, ускоряющие межклеточные обменные процессы. Особой строкой следует отметить необходимость здорового питания во избежание раннего изнашивания организма с последующими его внешними проявлениями. Для этого нужно оптимизировать своё питание, наполнив рацион фруктами, овощами, морепродуктами, нежирными сортами мяса, кисломолочными продуктами, параллельно исключив его вредную составляющую.
Перво-наперво не следует увлекаться прогулками под палящим солнцем без предварительного нанесения на кожу защитного крема от УФ-лучей, которым полезно пользоваться также при пасмурной погоде. Оставить привычку «жариться» на пляже, а также в солярии. Второе — отказаться от курения. Больший эффект данные рекомендации будут иметь, если пользоваться косметическими средствами, включающими полезные для кожи ингредиенты,они интенсифицируют синтез коллагена и эластина. Это витамин С, ретиноиды (они, помимо прочего, стимулируют обновление клеток кожи), пептиды, ускоряющие межклеточные обменные процессы. Особой строкой следует отметить необходимость здорового питания во избежание раннего изнашивания организма с последующими его внешними проявлениями. Для этого нужно оптимизировать своё питание, наполнив рацион фруктами, овощами, морепродуктами, нежирными сортами мяса, кисломолочными продуктами, параллельно исключив его вредную составляющую.
Если говорить об гидролизованном эластине в составе косметических средств, получаемом из кожи рыб, некоторых водорослей, то здесь существует мнение некоторых специалистов о том, что «чудодейственность» кремов с эластином, мягко говоря, преувеличена и является простым рекламным трюком.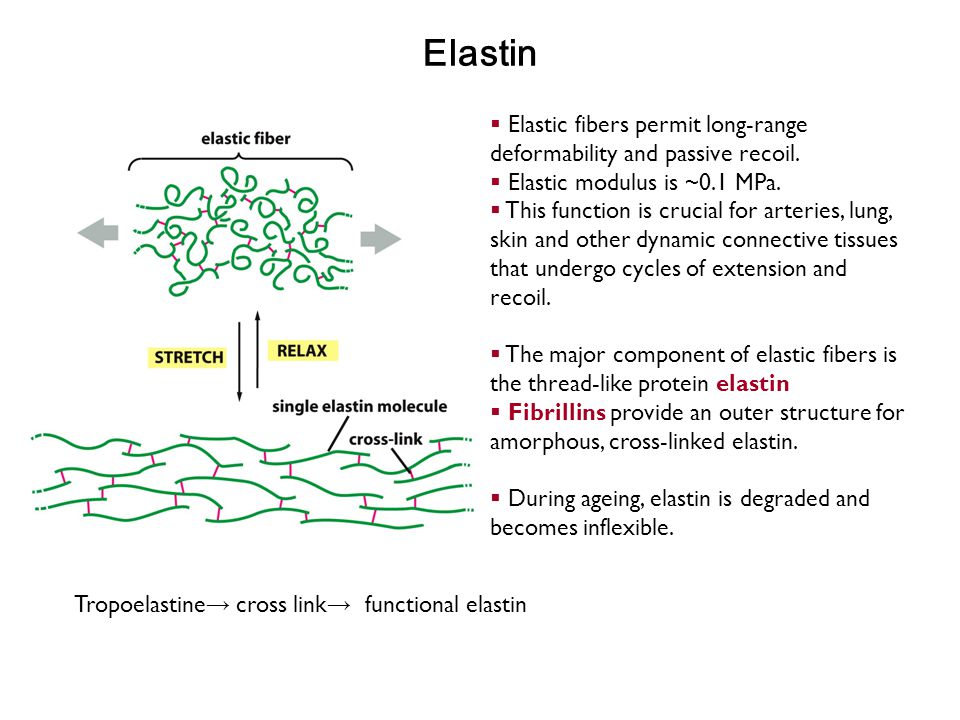 «Дело в том, что молекулы этого искусственного белка велики по размеру, поэтому они не могут проникнуть в толщу дермы и быть ею усвоенными, чтобы выполнять свою стабилизирующую функцию»— говорят нам. Тем не менее сегодня выпускаются целые линии косметических средств с данным ингредиентом — кремов, сывороток, концентратов, прочего — по уходу за кожей лица, тела, защитных масок для волос, кондиционеров, средств для их укладки. Многие из нас всем этим пользуются и утверждают, что косметика с эластином «работает», наблюдается положительная динамика в восстановлении кожи, волос. Какую из двух точек зрения принять для себя — пользоваться средствами с гидролизованным эластином или нет — каждый решает сам.
«Дело в том, что молекулы этого искусственного белка велики по размеру, поэтому они не могут проникнуть в толщу дермы и быть ею усвоенными, чтобы выполнять свою стабилизирующую функцию»— говорят нам. Тем не менее сегодня выпускаются целые линии косметических средств с данным ингредиентом — кремов, сывороток, концентратов, прочего — по уходу за кожей лица, тела, защитных масок для волос, кондиционеров, средств для их укладки. Многие из нас всем этим пользуются и утверждают, что косметика с эластином «работает», наблюдается положительная динамика в восстановлении кожи, волос. Какую из двух точек зрения принять для себя — пользоваться средствами с гидролизованным эластином или нет — каждый решает сам.
Коллаген и эластин в косметике — Бьюти блог о косметике и красоте
Главная / Блог / Коллаген и эластин в косметике
13 августа 2018 г.
Всем привет! Наверное, вы часто встречали в составах косметики коллаген и эластин. Это довольно спорные компоненты, и я хочу, чтобы вы понимали, что они из себя представляют и как работают:
1) Коллаген – один из важнейших белков нашего организма, а в коже его аж 70%! Этот белок отвечает за прочность всех животных клеток. Его вырабатывают особые клетки – фибропласты. Фибробласты — клетки подневольные и зависят от гормонов. Чем старше мы становимся, тем меньше эстрогена вырабатывается в организме. Меньше эстрогена — меньше производство коллагена, и мы начинаем замечать снижение кожного тонуса и морщины. Также коллагеновая сетка разрушается под воздействием УФ и от курения и чрезмерного употребления сахара. В довершение (как будто нам и без того недостаточно), в нашем организме заложен механизм саморазрушения, и с возрастом наши собственные ферменты начинают все активнее разрушать коллаген.
Его вырабатывают особые клетки – фибропласты. Фибробласты — клетки подневольные и зависят от гормонов. Чем старше мы становимся, тем меньше эстрогена вырабатывается в организме. Меньше эстрогена — меньше производство коллагена, и мы начинаем замечать снижение кожного тонуса и морщины. Также коллагеновая сетка разрушается под воздействием УФ и от курения и чрезмерного употребления сахара. В довершение (как будто нам и без того недостаточно), в нашем организме заложен механизм саморазрушения, и с возрастом наши собственные ферменты начинают все активнее разрушать коллаген.
В косметике встречаются несколько видов коллагена: животный (получаемый из кожи, хрящей, сухожилий и костей крупного рогатого скота), морской (более дорогой, полученный из кожи и плавательного пузыря рыб), и растительный (протеины пшеницы. Это не совсем коллаген, но часто так называется).
Что важно понимать о коллагене? А то, что его молекулы настолько большие, что при нанесении на поверхность кожи он в нее не проникает, поэтому на морщины никак не влияет.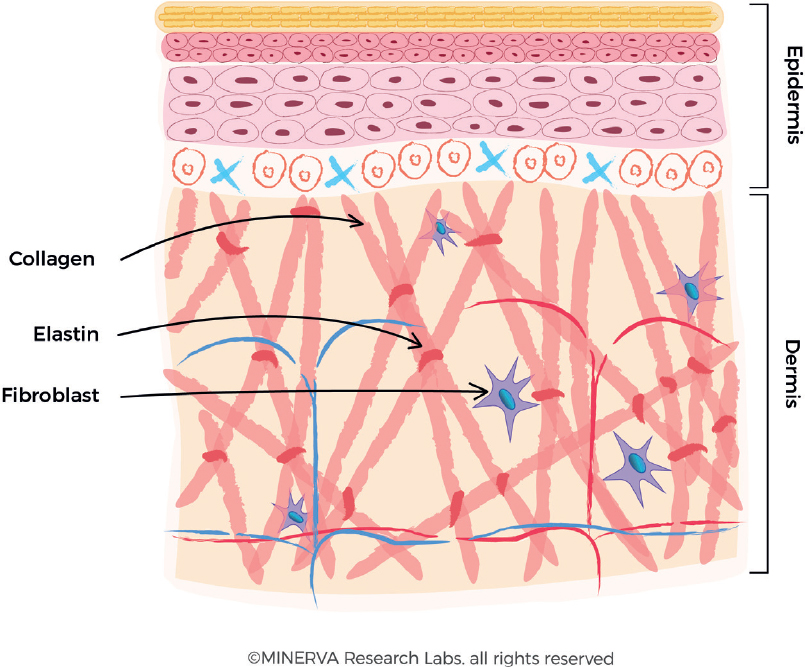 В креме коллаген работает только как влагоудерживающий компонент, то есть он обеспечивает увлажнение кожи. А с морщинами можно бороться только при введении коллагена в виде инъекций в дерму. Но! Это нужно делать регулярно, это – дорого, и это – не панацея.
В креме коллаген работает только как влагоудерживающий компонент, то есть он обеспечивает увлажнение кожи. А с морщинами можно бороться только при введении коллагена в виде инъекций в дерму. Но! Это нужно делать регулярно, это – дорого, и это – не панацея.
Также существует гидролизованный коллаген (INCI – Hydrolyzed Collagen). Это коллаген, расщепленный на отдельные цепочки аминокислот. Такой коллаген уже способен проникнуть в кожу, но он все равно не обладает свойствами «живого» коллагена и не стимулирует наши фибропласты на его выработку. (Кстати, желатин – это тоже гидролизованный коллаген).
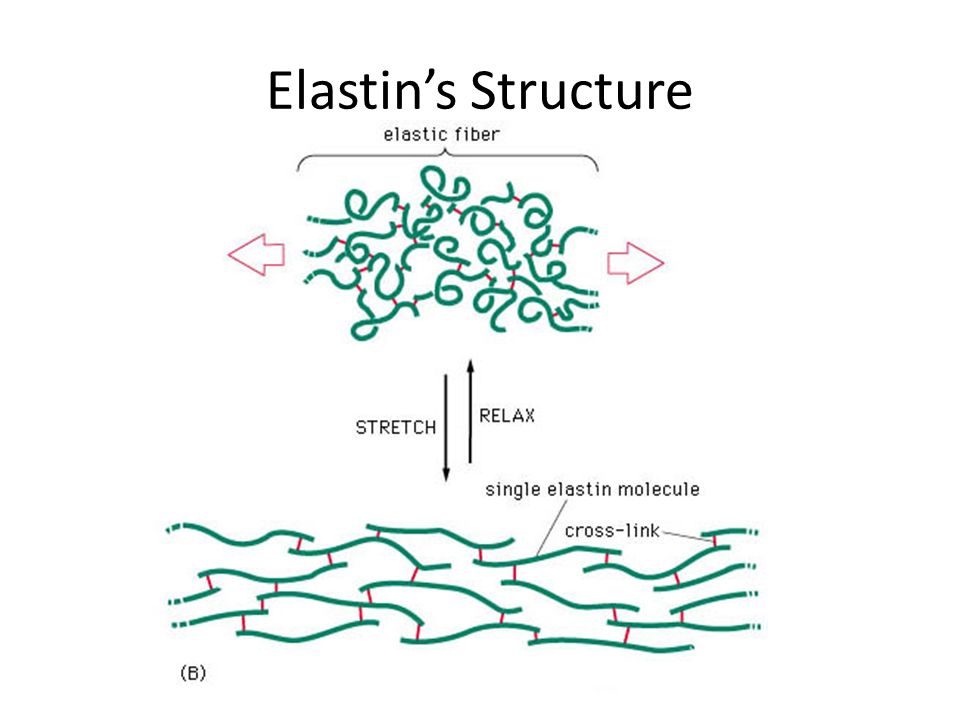
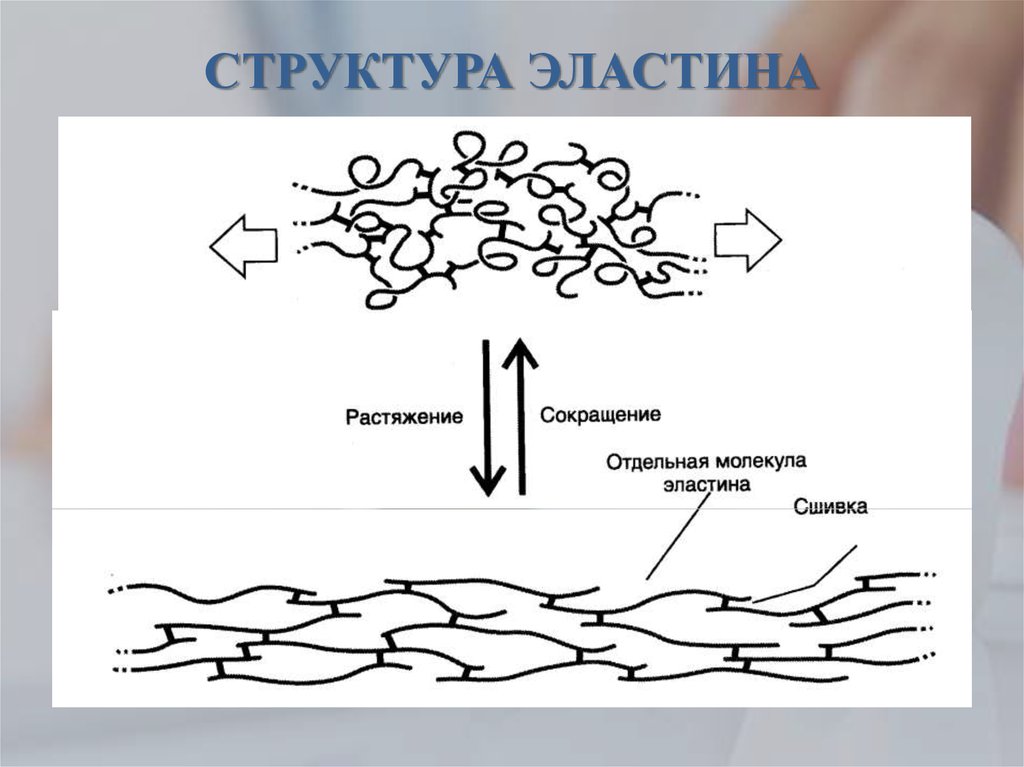
2) Эластин — это нитеобразный белок. Он содержится в соединительной ткани человека и животных — коже, стенках кровеносных сосудов, лёгких, хрящах, сухожилиях, связках и костях. Он отвечает за возвращение коже исходной формы после растяжения или давления. Эластин тоже вырабатывается фибропластами.
В косметике используется эластин животного происхождения. Его получают из кожи и кровеносных сосудов крупного рогатого скота, птиц и млекопитающих.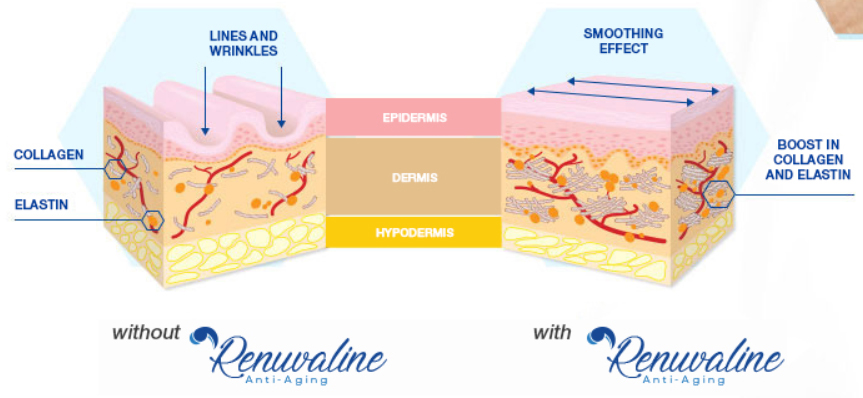
С эластином ровно та же история: молекулы его большие и не проникают в кожу, поэтому его функция в креме – увлажнение: эластин ложится на кожу воздухопроницаемой «пленочкой» и препятствует потере влаги. Гидролизованный эластин может проникнуть глубже, но тоже не будет работать, как наш естественный эластин.
Вывод вот какой: и коллаген, и эластин при добавлении в косметику не обладают выраженным anti-age эффектом. Кроме того, животный, морской и даже человеческий коллаген/эластин даже при введении инъекционно в кожу не будут работать так, как наш собственный уникальный белок. Поэтому правильнее всего – вести здоровый образ жизни здоровый образ жизни, не злоупотреблять загаром и сладеньким, отказаться от курения и следить за своим гормональным фоном.
Вернуться к списку
Клиническая значимость эластина в структуре и функции кожи
1.
Альмин Дж. Ф., Уайз С. Г., Вайс А. С. Передача сигналов эластина при заживлении ран. Врожденные дефекты Res C Embryo Today.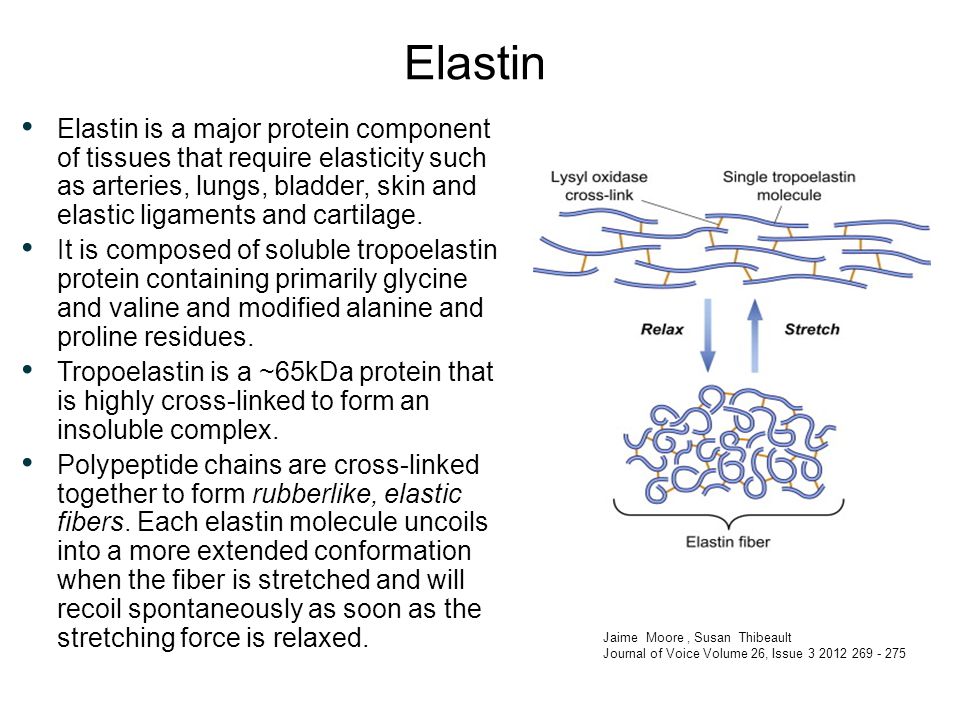 2012;96(3):248-257. [PubMed] [Google Scholar]
2012;96(3):248-257. [PubMed] [Google Scholar]
2. Килти К.М., Шерратт М.Дж., Шаттлворт, Калифорния. Эластичные волокна. Дж. Клеточные науки. 2002; 115 (часть 14): 2817–2828. [PubMed] [Google Scholar]
3. Кристенсен Дж.Х., Карсдал М.А.. Эластин. Биохимия коллагенов, ламининов и эластина. Лондон: Академическая пресса; 2016:197-201. [Google Scholar]
4. Swee MH, Parks WC, Пирс Р.А. Развитие регуляции производства эластина. Экспрессия пре-мРНК тропоэластина сохраняется после подавления стационарных уровней мРНК. Дж. Биол. Хим. 1995;270(25):14899-14906. [PubMed] [Google Scholar]
5. Виндин Х, Митье С.М., Вайс А.С. Эластиновая архитектура. Матрица биол. 2019;84:4-16. [PubMed] [Google Scholar]
6. Вонг Р., Гейер С., Венингер В., Гимберто Дж. К., Вонг Дж. К. Динамическая анатомия и структура кожи. Опыт Дерматол. 2016;25(2):92-98. [PubMed] [Google Scholar]
7.
Каллаган ТМ, Вильгельм КП. Обзор старения и изучение клинических методов оценки старения кожи.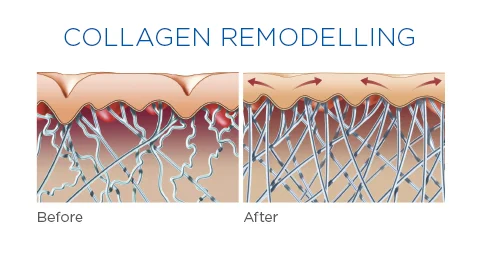 Часть 2: клинические перспективы и клинические методы оценки старения кожи. Int J Cosmet Sci. 2008;30(5):323-332. [PubMed] [Google Scholar]
Часть 2: клинические перспективы и клинические методы оценки старения кожи. Int J Cosmet Sci. 2008;30(5):323-332. [PubMed] [Google Scholar]
8. Троян С., Добос Г., Лихтерфельд А., Блюм-Пейтави У., Коттнер Дж. Характеристика старения кожи лица у людей: отделение внешних биологических явлений от внутренних. Биомед Рез Инт. 2015;2015:318586. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Лэнгтон А.К., Халаи П., Гриффитс К.Е., Шерратт М.Дж., Уотсон Р.Е. Влияние естественного старения на белковый состав дермально-эпидермального соединения. Механическое старение Dev. 2016;156:14-16. [PubMed] [Google Scholar]
10. Ли Д.Х., О Д.Х., Чанг Д.Х. Гликозаминогликаны и протеогликаны при старении кожи. J Дерматол Sci. 2016;83(3):174-181. [PubMed] [Google Scholar]
11.
Уоллер Дж. М., Майбах HI. Возраст и структура и функция кожи, количественный подход (II): содержание и структура белков, гликозаминогликанов, воды и липидов. Технология восстановления кожи. 2006;12(3):145-154. [PubMed] [Академия Google]
[PubMed] [Академия Google]
12. Woo MS, Moon KJ, Jung HY и др.. Сравнение результатов теста на эластичность кожи с помощью баллистометра и кутометра. Технология восстановления кожи. 2014;20(4):422-428. [PubMed] [Google Scholar]
13. Лэнгтон А.К., Шерратт М.Дж., Гриффитс К.Е., Уотсон Р.Э. Новая морщина на старой коже: роль эластических волокон в старении кожи. Int J Cosmet Sci. 2010;32(5):330-339. [PubMed] [Google Scholar]
14. Уитто Дж., Ли К., Урбан З. Сложность биогенеза эластических волокон в коже — взгляд на клиническую неоднородность кожного лакса. Опыт Дерматол. 2013;22(2):88-92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Хуссейн С.Х., Лимтонгкул Б., Хамфрис Т.Р. Биомеханические свойства кожи. Дерматол Хирург. 2013;39(2):193-203. [PubMed] [Google Scholar]
16. Бернштейн Э.Ф., Уитто Дж. Влияние фотоповреждения на кожный внеклеточный матрикс. Клин Дерматол. 1996;14(2):143-151. [PubMed] [Google Scholar]
17.
Дебель Л., Тамбурро А.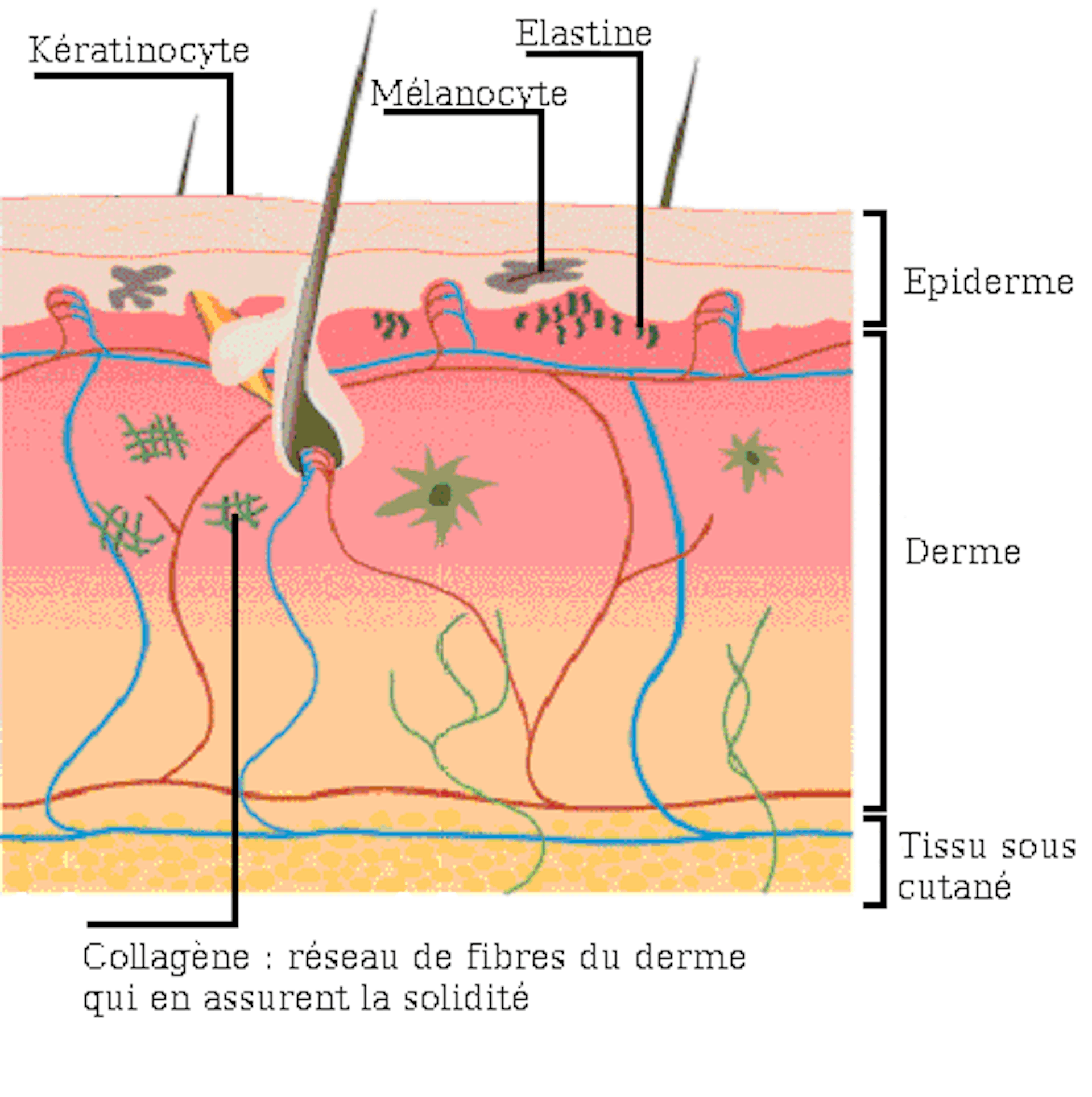 М. Эластин: молекулярное описание и функция. Int J Biochem Cell Biol. 1999;31(2):261-272. [PubMed] [Академия Google]
М. Эластин: молекулярное описание и функция. Int J Biochem Cell Biol. 1999;31(2):261-272. [PubMed] [Академия Google]
18. Мудрый С.Г., Вайс А.С. тропоэластин. Int J Biochem Cell Biol. 2009;41(3):494-497. [PubMed] [Google Scholar]
19. Сиван С.С., Ван Эль Б., Меркхер Ю. и др.. Продолжительность жизни эластина в межпозвонковом диске человека по данным рацемизации аспарагиновой кислоты. Биохим Биофиз Акта. 2012;1820(10):1671-1677. [PubMed] [Google Scholar]
20. Чой Дж., Бергдал А., Чжэн К., Старчер Б., Янагисава Х., Дэвис Э.К. Анализ эластических волокон дермы в отсутствие фибулина-5 показывает потенциальную роль фибулина-5 в сборке эластических волокон. Матрица биол. 2009 г.;28(4):211-220. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Папке С.Л., Янагисава Х. Фибулин-4 и фибулин-5 в эластогенезе и за его пределами: результаты исследований на мышах и людях. Матрица биол. 2014;37:142-149. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Чоудхури Р., Макговерн А., Ридли С. и др..
Дифференциальная регуляция образования эластических волокон фибулином-4 и -5. Дж. Биол. Хим. 2009;284(36):24553-24567. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Чоудхури Р., Макговерн А., Ридли С. и др..
Дифференциальная регуляция образования эластических волокон фибулином-4 и -5. Дж. Биол. Хим. 2009;284(36):24553-24567. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Древес П.Г., Янагисава Х., Старчер Б. и др.. Пролапс тазовых органов у мышей с нокаутом фибулина-5: вызванные беременностью изменения гомеостаза эластических волокон во влагалище мышей. Ам Джей Патол. 2007;170(2):578-589. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Нейлор Э.К., Уотсон Р.Э., Шерратт М.Дж. Молекулярные аспекты старения кожи. Зрелые. 2011;69(3):249-256. [PubMed] [Google Scholar]
25. Шапиро С.Д., Эндикотт С.К., Провинция Массачусетс, Пирс Дж.А., Кэмпбелл Э.Дж. Заметная продолжительность жизни паренхиматозных эластических волокон легких человека обусловлена преобладанием D-аспартата и радиоуглерода, связанного с ядерным оружием. Джей Клин Инвест. 1991;87(5):1828-1834. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Хасэгава К., Йонеда М., Кувабара Х. и др..
Версикан, основной компонент дермы, связывающий гиалуронан, теряет свою способность связывать гиалуронан при солнечном эластозе. Джей Инвест Дерматол. 2007;127(7):1657-1663. [PubMed] [Академия Google]
Хасэгава К., Йонеда М., Кувабара Х. и др..
Версикан, основной компонент дермы, связывающий гиалуронан, теряет свою способность связывать гиалуронан при солнечном эластозе. Джей Инвест Дерматол. 2007;127(7):1657-1663. [PubMed] [Академия Google]
27. Muto J, Kuroda K, Wachi H, Hirose S, Tajima S. Накопление элафина при актиническом эластозе поврежденной солнцем кожи: элафин связывается с эластином и предотвращает эластолитическую деградацию. Джей Инвест Дерматол. 2007;127(6):1358-1366. [PubMed] [Google Scholar]
28. Дуке Ласио М.Л., Козел Б.А. Эластин-зависимые генетические заболевания. Матрица биол. 2018;71-72:144-160. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Hu Q, Reymond JL, Pinel N, Zabot MT, Urban Z. Воспалительная деструкция эластических волокон в приобретенной кожной лаксе связана с миссенс-аллелями в генах эластина и фибулина-5. Джей Инвест Дерматол. 2006;126(2):283-290. [PubMed] [Google Scholar]
30.
Beyens A, Boel A, Symoens S, Callewaert B.
31. Родригес-Кабельо Х.К., Гонсалес де Торре И., Ибаньес-Фонсека А., Алонсо М. Биоактивные каркасы на основе эластиноподобных материалов для заживления ран. Adv Drug Deliv Rev. 2018; 129:118-133. [PubMed] [Google Scholar]
32. Коэн Б.Э., Геронемус Р.Г., Макдэниел Д.Х., Брауэр Дж.А. Роль эластических волокон в формировании и лечении рубцов. Дерматол Хирург. 2017;43(Приложение 1):S19-С24. [PubMed] [Google Scholar]
33. Эриксон Дж. Р., Эчеверри К. Изучение регенерационных исследовательских организмов: окольный путь к заживлению ран без рубцов. Дев биол. 2018;433(2):144-154. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Митье С.М., Вайс А.С. Дизайн шаблона для регенерации дермы со слоями эластина. Акта Биоматер. 2017;52:33-40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35.
Бротон
G, 2-й, Янис Дж. Э., Аттингер К.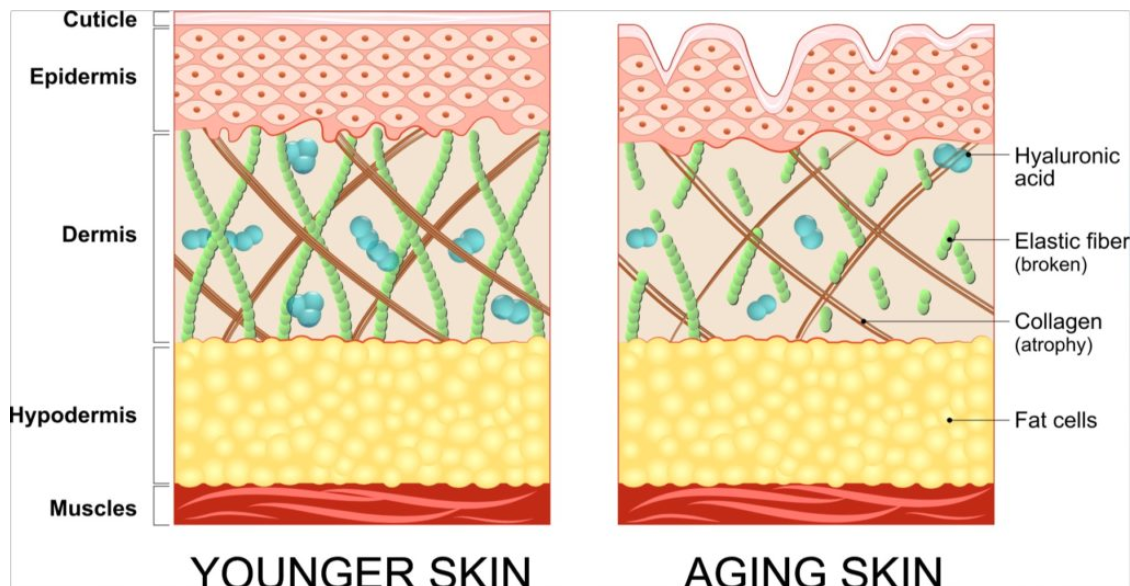 Э. Заживление ран: обзор. Plast Reconstr Surg. 2006; 117 (Приложение 7l): 1e-S-32e-S. [PubMed] [Академия Google]
Э. Заживление ран: обзор. Plast Reconstr Surg. 2006; 117 (Приложение 7l): 1e-S-32e-S. [PubMed] [Академия Google]
36. Mitzmacher MG, Mithieux SM, Weiss AS, Hee CK, Daniels R. Новые имплантаты рекомбинантного тропоэластина восстанавливают внеклеточный матрикс кожи. J Препараты Дерматол. 2020;19(12):1166-1172. [PubMed] [Google Scholar]
37. Wang Y, Zeinali-Davarani S, Davis EC, Zhang Y. Влияние глюкозы на биомеханическую функцию артериального эластина. J Mech Behav Biomed Mater. 2015;49:244-254. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Росс Н.А., Хо Д., Фишер Дж. и др.. Растяжки: профилактические и терапевтические методы улучшения эстетического вида. Дерматол Хирург. 2017;43(5):635-648. [PubMed] [Академия Google]
39.
Бернштейн Э.Ф., Чен Ю.К., Копп Дж.Б. и др..
Длительное пребывание на солнце изменяет коллаген папиллярной дермы. Сравнение защищенной от солнца и фотостареющей кожи с помощью нозерн-анализа, иммуногистохимического окрашивания и конфокальной лазерной сканирующей микроскопии. J Am Acad Дерматол. 1996; 34(2 часть 1):209-218. [PubMed] [Google Scholar]
J Am Acad Дерматол. 1996; 34(2 часть 1):209-218. [PubMed] [Google Scholar]
40. Хибберт С.А., Уотсон Р.Б., Гиббс Н.К. и др.. Потенциальная роль эндогенных белков в качестве жертвенных солнцезащитных экранов и антиоксидантов в тканях человека. Редокс Биол. 2015;5:101-113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Кирчик Л.Х. Гистологическое улучшение фотоповреждений после 12 месяцев лечения кремом-эмолентом с третиноином (0,02%). J Препараты Дерматол. 2012;11(9):1036-1040. [PubMed] [Google Scholar]
42. Widgerow AD, Jiang LI, Calame A. Одноцентровое клиническое исследование для оценки эффективности режима антивозрастной терапии трипептидом/гексапептидом. J Космет Дерматол. 2019;18(1):176-182. [PubMed] [Google Scholar]
43. Gold MH, Sensing W, Biron JA. Местный режим улучшает заживление кожи и эстетические результаты в сочетании с процедурой радиочастотного микронидлинга. J Космет Дерматол. 2019;18(5):1280-1289. [PubMed] [Google Scholar]
44. Бароне Ф., Баши С., Вудин-младший FW. Клинические данные о реструктуризации дермы и эпидермиса сывороткой с биологически активным фактором роста для омоложения кожи. J Препараты Дерматол. 2019;18(3):290-295. [PubMed] [Google Scholar]
Бароне Ф., Баши С., Вудин-младший FW. Клинические данные о реструктуризации дермы и эпидермиса сывороткой с биологически активным фактором роста для омоложения кожи. J Препараты Дерматол. 2019;18(3):290-295. [PubMed] [Google Scholar]
45. Widgerow AD, Cohen SR, Fagien S. Предоперационная подготовка кожи: очистка внеклеточного матрикса и подготовка кожного ложа, новая парадигма. Эстет Сург Дж. 2019; 39 (Приложение 3): S103-S111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Уэллс Дж. М., Гаггар А., Блэлок Дж. Э. Матрикины, сгенерированные MMP. Матрица биол. 2015;44-46:122-129. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Махони М.Г., Бреннан Д., Старчер Б. и др.. Внеклеточный матрикс при старении кожи: влияние крема, содержащего 0,1% малоната меди и цинка, на биосинтез эластина. Опыт Дерматол. 2009;18(3):205-211. [PubMed] [Google Scholar]
48.
Уиджероу А.Д., Напекоски К. Новые подходы к гистологии фотоповреждений кожи – дифференциация «хорошего» и «плохого» эластина.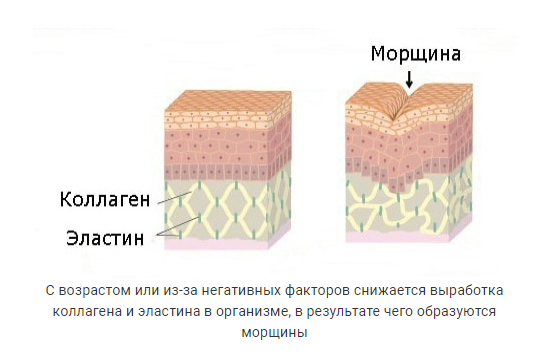 J Космет Дерматол. 2021;20(2):526-531. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Космет Дерматол. 2021;20(2):526-531. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Лефарт ЭД. Экспрессия генов кожи человека не коррелирует с экспрессией белка? Если оба параметра не определены количественно. J Космет Дерматол. 2018;17(2):244-245. [PubMed] [Google Scholar]
50. Avantaggiato A, Girardi A, Palmieri A, Pascali M, Carinci F. Сравнение биоревитализирующих инъекционных продуктов: исследование культур фибробластов кожи. Омоложение Рез. 2015;18(3):270-276. [PubMed] [Google Scholar]
Эластин — PubMed
Обзор
. 2005;70:437-61.
doi: 10.1016/S0065-3233(05)70013-9.
Сюзанна М Митье 1 , Энтони С. Вайс
принадлежность
- 1 Школа молекулярной и микробной биологии Сиднейского университета, Новый Южный Уэльс, 2006 г.
 , Австралия.
, Австралия.
- PMID: 15837523
- DOI: 10.1016/С0065-3233(05)70013-9
Обзор
Suzanne M Mithieux et al. Adv Protein Chem. 2005.
. 2005;70:437-61.
doi: 10.1016/S0065-3233(05)70013-9.
Авторы
Сюзанна М Митье 1 , Энтони С Вайс
принадлежность
- 1 Школа молекулярной и микробной биологии Сиднейского университета, Новый Южный Уэльс, 2006 г.
 , Австралия.
, Австралия.
- PMID: 15837523
- DOI: 10.1016/С0065-3233(05)70013-9
Абстрактный
Эластин является ключевым белком внеклеточного матрикса, который имеет решающее значение для эластичности и устойчивости многих тканей позвоночных, включая крупные артерии, легкие, связки, сухожилия, кожу и эластичный хрящ. Тропоэластин связывается с множественными молекулами тропоэластина во время основной фазы эластогенеза посредством коацервации, где этот процесс направляется точным формированием паттерна в основном чередующихся гидрофобных и гидрофильных последовательностей, которые диктуют межмолекулярное выравнивание. Массивно сшитые массивы тропоэластина (обычно в сочетании с микрофибриллами) способствуют структурной целостности ткани и биомеханике за счет постоянной гибкости, позволяя повторять циклы растяжения и расслабления, которые критически зависят от гидратированной среды. Последовательности эластина взаимодействуют с несколькими белками, находящимися в микрофибриллах или совместно локализованными с ними, и связываются с эластогенными рецепторами клеточной поверхности. Знание основных стадий сборки эластина облегчило построение моделей эластогенеза in vitro, что привело к идентификации точных молекулярных областей, которые имеют решающее значение для взаимодействий белков на основе эластина.
Последовательности эластина взаимодействуют с несколькими белками, находящимися в микрофибриллах или совместно локализованными с ними, и связываются с эластогенными рецепторами клеточной поверхности. Знание основных стадий сборки эластина облегчило построение моделей эластогенеза in vitro, что привело к идентификации точных молекулярных областей, которые имеют решающее значение для взаимодействий белков на основе эластина.
Похожие статьи
Взаимосвязь функции и структуры эластических артерий в эволюции: от микрофибрилл к эластину и эластическим волокнам.
Фори Г. Фори Г. Патол Биол (Париж). 2001 г., май; 49(4):310-25. doi: 10.1016/s0369-8114(01)00147-x. Патол Биол (Париж). 2001. PMID: 11428167 Обзор.
Инженерные биоматериалы на основе тропоэластина и эластина.

Wise SG, Mithieux SM, Weiss AS. Уайз С.Г. и соавт. Adv Protein Chem Struct Biol. 2009;78:1-24. doi: 10.1016/S1876-1623(08)78001-5. Epub 2009 27 ноября. Adv Protein Chem Struct Biol. 2009. PMID: 20663482 Обзор.
[Регуляция синтеза эластина].
Джейкоб М.П., Соваж М., Осборн-Пеллегрин М. Джейкоб М.П. и др. J Soc Biol. 2001;195(2):131-41. J Soc Biol. 2001. PMID: 11723825 Обзор. Французский.
[Поворотный момент в знании отношений структура-функция-активность эластина].
Аликс Эй Джей. Аликс Эй Джей. J Soc Biol. 2001;195(2):181-93. J Soc Biol. 2001. PMID: 11727705 Обзор. Французский.
Эластин: связь структуры белка и гена с болезнью.

Розенблюм Дж. Розенблюм Дж. Лаборатория Инвест. 1984 декабрь; 51 (6): 605-23. Лаборатория Инвест. 1984. PMID: 6150137 Обзор.
Посмотреть все похожие статьи
Цитируется
Повышение проницаемости рака с помощью фотодинамического прайминга: от микроокружения к передаче сигналов механотрансдукции.
Каригга Гутьеррес Н.М., Пухоль-Соле Н., Арифи К., Колл Дж.Л., Ле Клейнш Т., Брукгаарден М. Каригга Гутьеррес Н.М. и соавт. Метастазы рака, ред. 2022 г., 26 сентября. doi: 10.1007/s10555-022-10064-0. Онлайн перед печатью. Метастаз рака, ред. 2022 г. PMID: 36155874 Обзор.
Протеолитическая модуляция сигналов микроокружения опухоли при прогрессировании рака.

Ито Ю. Ито Ю. Фронт Онкол. 2022 5 сент.; 12:935231. doi: 10.3389/fonc.2022.935231. Электронная коллекция 2022. Фронт Онкол. 2022. PMID: 36132127 Бесплатная статья ЧВК. Обзор.
Аурикулярный хрящ взрослого человека, ребенка и микротии содержит прикрепляющиеся к фибронектину клетки-предшественники с регенеративным потенциалом реконструкции уха.
Отто И.А., Бернал П.Н., Риккерс М., ван Райен М.Х.П., Менсинга А., Кон М., Бреугем К.С., Левато Р., Мальда Дж. Отто И.А. и соавт. iНаука. 2022 18 августа; 25 (9): 104979. doi: 10.1016/j.isci.2022.104979. Электронная коллекция 2022 16 сентября. iНаука. 2022. PMID: 36105583 Бесплатная статья ЧВК.
Переход эластиновых конденсатов из жидкого состояния в твердое.


 , Австралия.
, Австралия.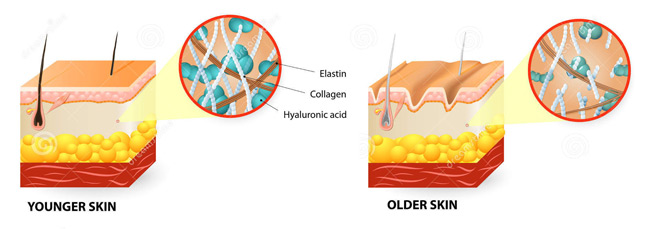 , Австралия.
, Австралия.