5 шагов для стимулирования производства коллагена и эластина
Молодость и здоровье кожи поддерживается двумя жизненно важными белками: эластином и коллагеном. С возрастом выработка этих белков понижается, кожа теряет эластичность и, как следствие, появляются первые морщинки. К счастью существуют безопасные и эффективные методы, которые помогают стимулировать синтез коллагена и эластина.
Шаг 1. Обновление
Используйте деликатный пиллинг для отшелушивания кожи. Устранение мёртвых клеток кожи c поверхностного слоя кожи подготавливает кожу для дальнейшего интенсивного ухода, а также стимулирует выработку нового коллагена и эластина и придает коже более молодой вид.
Шаг 2. Витаминизация
Жизненно важную роль в производстве эластина и коллагена играет витамин C. Не менее важны для молодости кожи витамины А, D и E.
Обратите внимание на продукты, богатые витамином C, такие как брокколи, киви, сладкий перец и цитрусовые.
Насытить кожу помогут Ампулы с Витамином С DOCTOR BABOR. Они содержит 20% стабильного усиленного витамина C, 2 вида гиалуроновой кислоты и линолевую кислоту. Усилить действие ампул и продлить эффект поможет Крем Комплекс С, который содержит витамины красоты A, C и E.
Источником витамина A: зелёные и жёлтые овощи, печень, икра и молочные продукты.
Для интенсивного обновления кожи отлично подойдёт Концентрат A16, в состав которого входит Retinew A16 — гипоаллергенный и более эффективный аналог ретинола (витамина А).
Витамином D богаты морская рыба и яичный желток. Витамин E вы найдёте в растительных маслах, орехах, фасоли.
Витаминный заряд коже даст концентрат мгновенного действия — Ампулы Мультивитамины. Витамин А — стимулирует процессы клеточного обновления кожи; провитамин А + B5 — активизируют процессы регенерации и успокаивают; витамин Е в липосомах — защищает от свободных радикалов; биотин — поддерживает здоровье кожи.
Шаг 3. Белок
Добавьте одну или две порции здорового белка в ваш ежедневный рацион. Здоровые продукты, богатые белками, включают тофу, орехи, семена, молоко и творог.Шаг 4. Дополнительный коллаген
Для интенсивной коллагеностимуляции, корректирующей первые возрастные изменения, коже необходима профессиональная помощь. Радикальным методом являются инъекции. Но если Вы не сторонник кардинальных вмешательств, то в качестве альтернативы стоит рассмотреть Комбинацию из двух продуктов LIFTING CELLULAR: концентрат Коллаген Буст Инфьюжн и крем Коллаген Бустер Крем.
Шаг 5. Защита от ультрафиолета и синего света
Кожу необходимо защищать от вредного воздействия UF и HEV-лучей, которые расщепляют коллаген и эластин. Предотвращают повреждение клеток солнцезащитные средства с фактором защиты от солнца (SPF) от 15 и выше. Применять их необходимо за 30 минут до выхода на улицу.
Для защита от синего света применяются средства со мощными антиоксидантами, такие, как ампулы BABOR «Идеальное сияние» и линейка Skinovage VITALIZING с комплексом защиты от цифрового старения Blue Light Protect с пептидами какао, сахаридами и полифенолами.
Коллаген и эластин | Библиотека sportivnoepitanie.ru
Мы часто задумываемся, почему со временем наша кожа и внешний вид в целом меняется: появляются возрастные и мимические морщины, кожа обвисает и теряет упругость, от чего черты лица заметно меняются. Данные метаморфозы происходят из-за изменений внутри нашей кожи, а точнее в одном из ее слоев.
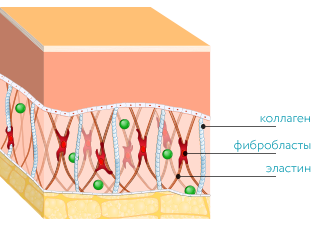
Вся наша кожа состоит всего из трех слоев: эпидермис, дерма и гиподерма. Эпидермис представляет собой самый тонкий слой, главной задачей которого является защита организма от внешних раздражителей. Гиподерма – самый глубокий слой, который содержит жировые ткани. Данные жировые ткани защищают внутренние органы и активно участвуют в терморегуляции организма. Средний уровень, или дерма, является домом эластина и коллагена. Кроме того, в ней находятся волосяные фолликулы, кровеносные сосуды и нервные окончания.
Ведь именно в дерме содержатся такие вещества как коллаген и эластин. Данные протеиновые вещества составляют основу дермы, а в общем, они образуют всю соединительную ткань в организме. Действуя в тандеме, они придают коже упругость и гладкость, поддерживая контур лица. Хотя коллаген и эластин часто встречаются в одном предложении и вообще ассоциируются друг с другом, они далеко не являются одним и тем же.
Действуя в тандеме, они придают коже упругость и гладкость, поддерживая контур лица. Хотя коллаген и эластин часто встречаются в одном предложении и вообще ассоциируются друг с другом, они далеко не являются одним и тем же.
Коллаген
В коже коллагеновые волокна находятся в дерме. Это то вещество, которое можно назвать молодильным яблочком для кожи. Данный протеин обеспечивает структурную поддержку кожи и определяет, насколько твердой она является. Проще говоря, без коллагена кожа просто бы слетела с тела. Производится коллаген клетками, под названием фибробласты. Они, как и сам коллаген, находятся в дерме и, кроме коллагена, производят также эластин.
Проще говоря, без коллагена кожа просто бы слетела с тела. Производится коллаген клетками, под названием фибробласты. Они, как и сам коллаген, находятся в дерме и, кроме коллагена, производят также эластин.
Эластин, как и показывает его имя, влияет на эластичность кожи. Эластин наподобие коллагена образует сети волокон. Данные волокна способны растягиваться и сжиматься, однако быстро возвращаются в первоначальное состояние. Поэтому ткань, содержащая эластин, становится эластичной.
Эластин и коллаген объединяют свои свойства, чтобы сделать нашу кожу здоровой, крепкой и эластичной. Коллаген придает соединительным тканям и органам жесткости, чтобы они были защищены от внешнего воздействия и могли правильно функционировать, а эластин позволяет тканям растягиваться и возвращаться в исходное состояние. Таким образом, коллаген поддерживает эластин и не дает ему растянуться до разрыва тканей.
Факторы, влияющие на разрушение коллагена и эластина
Со временем количество коллагена и эластина в коже уменьшается, что ведет к возникновению морщин, обвисанию кожи и ухудшению ее состояния.
Возраст. Производства коллагена и эластина снижается после подросткового периода, после этого данные клетки начинают разрушаться, причем вышеупомянутый процесс ускоряется с каждым годом все больше. К тому же, коллагеновые волокна становятся все более сжатыми и структурированными, отчего страдает не только кожа. Например, хрусталик глаза может стать чрезмерно жестким, что приведет к проблемам со зрением. Ну а на коже появляются все более глубокие морщины, она начинает обвисать.
Хотя морщины могут появиться не только с возрастом. Процессов, влияющих на целостность волокон достаточно много. К примеру, улыбаясь, хмурясь, гримасничая, мы ускоряем процесс разрушения коллагена и эластина от чего также могут появиться морщинки. Такие морщины мы называем мимическими, зачастую они появляются в примерно одинаковых местах у всех.
Хотя многие считаю, что основным виновником в появлении морщин является возраст, это не так. На самом деле солнце, которое все мы так любим, и которое есть за что любить, не совсем полезно для кожи. Ультрафиолетовые лучи намного интенсивнее разрушают коллагеновые волокна, чем возраст. Кроме того, солнечные лучи приводят к накоплению аномального эластина, который, в свою очередь, стимулирует увеличение металлопротеиназы. Металлопротеиназа представляет собой энзим, который предназначен для возобновления кожи, поврежденной солнцем. Однако при большом его количестве он может перестать работать подобным образом и начнет, наоборот, повреждать коллаген еще больше, отчего коллагеновые волокна перестают быть такими структурированными, и появляются солнечные шрамы. Повторение такого эффекта снова и снова ведет к образованию морщин. Кстати говоря, все эти процессы запускает не только солнце, но и все, что излучает ультрафиолет.
На самом деле солнце, которое все мы так любим, и которое есть за что любить, не совсем полезно для кожи. Ультрафиолетовые лучи намного интенсивнее разрушают коллагеновые волокна, чем возраст. Кроме того, солнечные лучи приводят к накоплению аномального эластина, который, в свою очередь, стимулирует увеличение металлопротеиназы. Металлопротеиназа представляет собой энзим, который предназначен для возобновления кожи, поврежденной солнцем. Однако при большом его количестве он может перестать работать подобным образом и начнет, наоборот, повреждать коллаген еще больше, отчего коллагеновые волокна перестают быть такими структурированными, и появляются солнечные шрамы. Повторение такого эффекта снова и снова ведет к образованию морщин. Кстати говоря, все эти процессы запускает не только солнце, но и все, что излучает ультрафиолет.
Еще одним крайне негативным для кожи фактором являются вредные привычки. И здесь имеется в виду не только курение, или злоупотребление алкоголем, но и неправильные привычки в еде. Конечно же, курение и алкоголь очень вредны для организма, в частности для коллагеновых и эластических волокон: они увеличивают количество свободных радикалов, ослабляют иммунитет, что крайне неприятно для кожи. Однако то, что вы едите – это один из основных факторов для поддержания молодости кожи. Именно с едой вы можете получить достаточное количество веществ для поддержания и здоровой выработки коллагена и эластина, также именно ваше питание, может принести в организм вещества, повреждающие данные волокна.
Конечно же, курение и алкоголь очень вредны для организма, в частности для коллагеновых и эластических волокон: они увеличивают количество свободных радикалов, ослабляют иммунитет, что крайне неприятно для кожи. Однако то, что вы едите – это один из основных факторов для поддержания молодости кожи. Именно с едой вы можете получить достаточное количество веществ для поддержания и здоровой выработки коллагена и эластина, также именно ваше питание, может принести в организм вещества, повреждающие данные волокна.
Предотвращение разрушения коллагена и эластина
Конечно, хоть процесс старения не остановить, его можно существенно замедлить, следуя достаточно простым правилам.
Во-первых, следует избегать ультрафиолетового излучения, или же снижать его эффект по максимуму, пользуясь защитными средствами.
Во-вторых, откажитесь от вредных привычек. Это сделает вас не только молодым и красивым, но также значительно укрепит здоровье и улучшит общее состояние организма.
В-третьих, конечно же, это правильное питание. Следует есть побольше антиоксидантов, к примеру, витамин С способствует правильной выработке коллагена и эластина, витамина А, также поддерживает выработку коллагена на высоком уровне. Не стоит забывать про цинк, встречающийся в мясных, молочных и морепродуктах. Он является особенно важным для эластина. Вещество, известное как генистеин, можно найти в соевых продуктах. Оно способствует выработке коллагена и, по мнению ученых, замедляет процессы старения. Также старайтесь минимизировать потребление фастфуда и вредных веществ.
В-четвертых, существуют специальные косметические средства, которые способствуют сохранению здорового состояния эластина и коллагена кожи. Многие из них сами содержат данные вещества, другие же основаны на ингредиентах, способствующих их защите и усиленной выработке.
Коллаген и эластин для кожи незаменимы, они поддерживают ее в хорошем состоянии, сохраняя ее молодость и свежесть. Поэтому не забывайте, насколько важен правильный уход за кожей, и правильное к ней отношение, если вы хотите сохранить привлекательный внешний вид и красоту надолго.
Maxler
Купить
Olimp
Купить
LiquidLiquid
Купить
Maxler
Купить
Optimum Nutrition
Купить
Maxler
Купить
Universal Nutrition
Купить
Optimum Nutrition
Купить
Протеин
Купить
Спортивные батончики
Купить
Аминокислоты
Купить
Витамины и минералы
Купить
Эластин, аминокислотный состав — Справочник химика 21
Очень своеобразен аминокислотный состав этого белка. Как и в коллагене, одна треть аминокислотных остатков представлена глицином. Эластин богат также про-лином. Однако в отличие от коллагена в эластине очень мало гидроксипролина, пет гидроксилизина и мало полярных аминокислот эластин богат неполярными алифатическими аминокислотами-аланином, валином, лейцином и изолейцином. [c.192] Эластин — это нерастворимый, похожий на резину белок эластических волокон соединительной ткани. Он способен к обратимому растяжению в длину в несколько раз. Такие виды соединительной ткани, как связки и дуга аорты, особенно богаты эластином. Как и в коллагене, в эластине содержится много пролина и глицина в отличие от коллагена в эластине нет гидроксилизина и мало гидроксипролина. Аминокислотный состав эластина характеризуется выраженным преобладанием неполярных аминокислот. Последовательность аминокислот в эластине имеет определенную периодичность. Так, часто повторяется последовательность Рго-С1у-Уа1-С1у-Уа1. Эластин синтезируется в виде растворимого предшественника, который далее переходит в нера- [c.196]
Такие виды соединительной ткани, как связки и дуга аорты, особенно богаты эластином. Как и в коллагене, в эластине содержится много пролина и глицина в отличие от коллагена в эластине нет гидроксилизина и мало гидроксипролина. Аминокислотный состав эластина характеризуется выраженным преобладанием неполярных аминокислот. Последовательность аминокислот в эластине имеет определенную периодичность. Так, часто повторяется последовательность Рго-С1у-Уа1-С1у-Уа1. Эластин синтезируется в виде растворимого предшественника, который далее переходит в нера- [c.196]
Белки чрезвычайно разнообразны. При переходе от одного белка к другому не только и зменяется качественный и количественный аминокислотный состав, но наблюдаются также большие различия в ф изико-химических свойствах. Многие белки, подобно альбуминам, образуют в воде коллоидные растворы другие, например глобулины, не растворяются в воде, но растворимы в растворах нейтральных солей (поваренная соль и др.
 ) кератин, эластин, фиброин и аналогичные им белки характеризуются полной нерастворимостью. Между белками, образующими коллоидные растворы, в свою очередь, существуют различия в отношении способности к высаливанию и осаждению. Эти различия в растворимости используются для разделения белков наряду с описанными [c.395]
) кератин, эластин, фиброин и аналогичные им белки характеризуются полной нерастворимостью. Между белками, образующими коллоидные растворы, в свою очередь, существуют различия в отношении способности к высаливанию и осаждению. Эти различия в растворимости используются для разделения белков наряду с описанными [c.395] Коллагены содержат около 35% остатков глицина и примерно 11% остатков аланина (необьмно большие количества этих аминокислот). Еще более характерным отличительным признаком коллагена служит высокое содержание пролина и 4-гидроксипролина (рис. 7-13)-аминокислоты, которая, за исключением коллагена и эластина, редко встречается в белках. В сумме на долю пролина и ги-дроксипролина приходится около 21% всех аминокислотных остатков коллагена. Необьмный аминокислотный состав коллагена с значительным преобладанием четырех аминокислот над всеми другими определяет относительно низкую питательную ценность желатины как пищевого белка. Самые лучшие пищевые белки содержат все 20 аминокислот, и в частности 10 аминокислот, образующих группу так называемых незаменимых аминокислот, которые должны [c.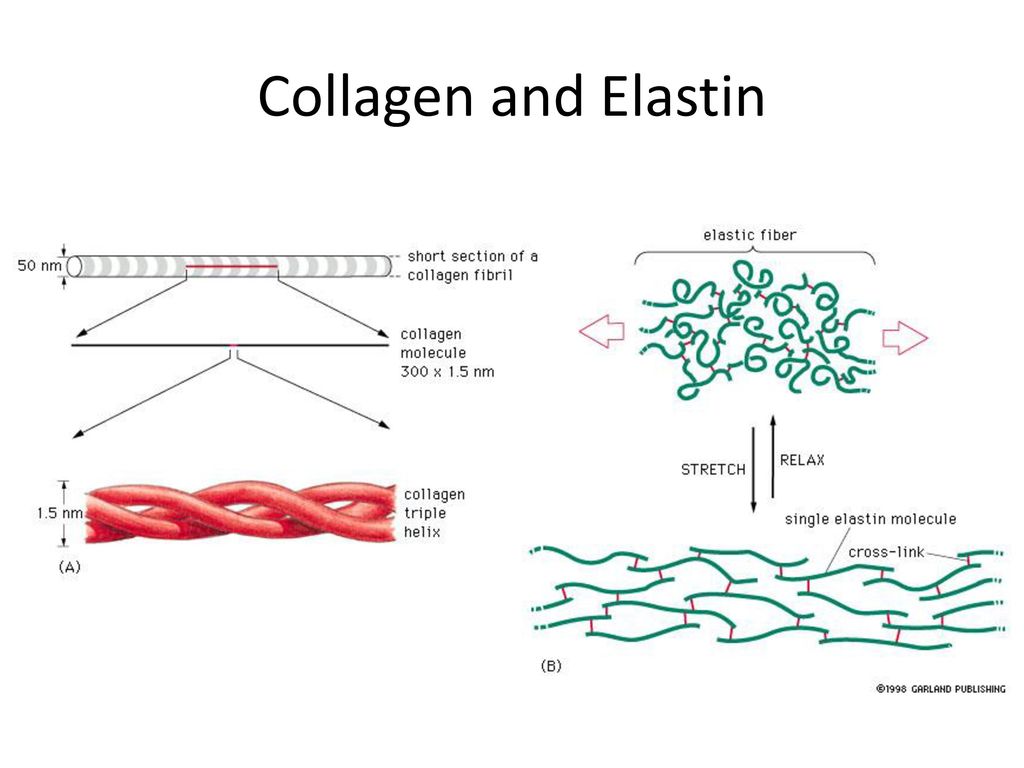 177]
177]
Коллаген (см. табл. 23 и 24). Гистологически ахиллесово сухожилие состоит преимущественно из коллагена, а желтое сухожилие представляет собой смесь эластина и коллагена. Для точного сравнения следовало бы, чтобы данные, приведенные в табл. 24, были получены при использовании препаратов, выделенных из одного и того же исходного материала и идентифицированных соответствующим образом как в гистологическом, так и в морфологическом отношениях. Однако несмотря на отсутствие такого анализа, химические исследования свидетельствуют о том, что изолированный коллаген и ахиллесово сухожилие имеют сходный аминокислотный состав. [c.237]
Эти данные также приводят к заключению о том, что состав желтого сухожилия по содержанию неполярных аминокислот сходен с эластином, а по содержанию треонина, метаонина, гисти-дина и аспарагиновой кислоты он соответствует среднему составу обоих белков (коллагена и эластина). Для установления связи между аминокислотным составом и положением, функцией и активностью сухожилия, а также для обнаружения каких-либо изменений в составе в зависимости от длины сухожилия необходим более детальный анализ.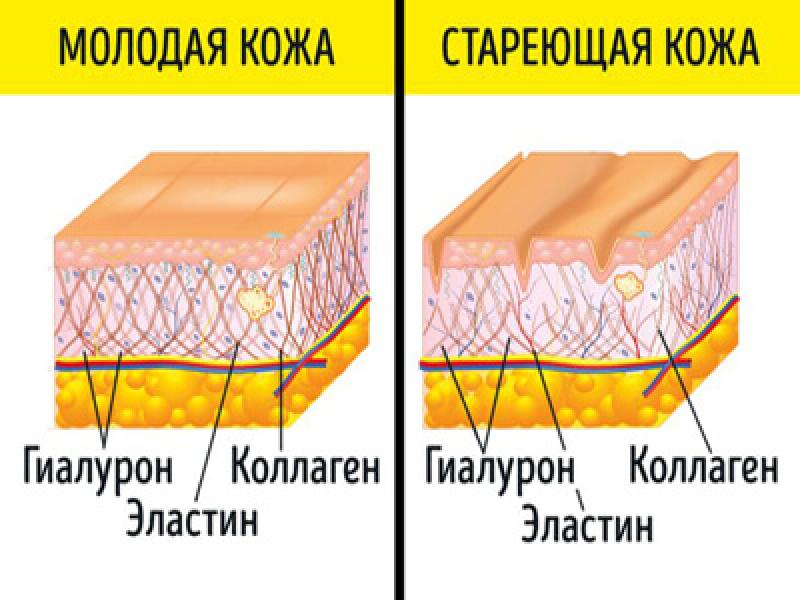 [c.237]
[c.237]
Термин эластические обычно применяется для волокнистых или мембранных структур, основным компонентом которых является эластин — белок со специфическими физико-химическими и биомеханическими свойствами. В настоящее время установлено, что эластин главный, но не единственный компонент эластических волокон, в состав которых входят также микрофибриллы, сформированные из гликопротеина, отличающегося от эластина по аминокислотному составу [Ross R., Bornstein P., 1969]. Поэтому термин эластиновые волокна , используемый в некоторых оригинальных исследованиях, является не вполне точным. Так же как и в случае коллагена и коллагеновых волокон, следует делать разграничения между эластином — белком с определенным химическим составом и эластическими волокнами — двухкомпонентной системой, биомеханические, биохимические, ультраструктурные и гистохимические характеристики которой определяются обоими компонентами, хотя и в большей степени эластином.
 [c.144]
[c.144]Дерма – каркас, обеспечивающий коже упругость, прочность и растяжимость
Дерма – каркас, обеспечивающий коже упругость, прочность и растяжимость.
- Именно в дерме берут свое начало морщины, поры и постакне рубцы. И чтобы их убрать/уменьшать – нужна работа на дермальном уровне. А не далеко не вся косметика (это всего лишь один единственный ингредиент), больше скажу, далеко не все процедуры работают с этим слоем.
- Именно в дерме находятся важные структуры (коллаген, эластин и гликозаминогликаны), с которыми мы активно работаем аппаратными и инъекционными методами.
Для того чтобы понимать, какие косметические процедуры и аппараты воздейсвуют на это трио, очень важно разобраться в структуре и функциях дермы.
ЧТО ПРЕДСТАВЛЯЕТ СОБОЙ ДЕРМА?
Представьте себе комбинацию водного и пружинного матраса, где в роли пружин выступают волокна коллагена и эластина, а в роли набивки – студенистое вещество (гликозаминогликаны) и вода.
Главный гликозаминогликан – это всеми известная гиалуроновая кислота.
Два слоя дермы: сосочковый и сетчатый.
Дерма состоит из двух слоев:
- Сосочковый: мягкая подушка под базальной мембраной и эпидермисом.
- Сетчатый: жесткая опорная сетка нашего «матраса».
Если пружины в матрасе ослабли, а гель вокруг них не держит влагу, то вся конструкция начинает обвисать под воздействием силы тяжести, сморщиваться и терять упругость.
В молодой коже коллагеновые волокна и гликозаминогликановый гель постоянно обновляются, но с возрастом этот процесс неминуемо замедляется.
Дерма богата нервами, потовыми железами и кровеносными сосудами. Хотя дерму и не видно снаружи, именно от нее зависит, упругой выглядит кожа или вялой, гладкой или морщинистой, румяной или бледной.
ФИБРОБЛАСТЫ – ГЛАВНОКОМАНДУЮЩИЕ
Главными клетками дермы являются фибробласты. Эти клетки производят коллаген, эластин, гликозаминогликаны, в т.ч. гиалуроновую кислоту, которые играют ключевую роль в здоровье и внешнем виде вашей кожи. По мере старения кожи количество действующих клеток фибробластов начинает уменьшаться, а оставшиеся фибробласты становятся ленивыми и замедляют выработку коллагена, гиалуроновой кислоты и гликозаминогликанов. Это приводит к истончению, ломкости кожи, появлению мелких морщин, появлению синяков и обвисанию кожи. Большинство продуктов местного применения не проникают в этот слой, однако ретиноиды, такие как ретинол способны глубоко проникать в кожу. Гормоны, такие как эстроген, также легко проникают в этот слой (в косметике запрещено использование гормонов). Стволовые клетки, пептиды, гиалуроновая кислота и другие ингредиенты не проникают в дермальный слой кожи.
Эти клетки производят коллаген, эластин, гликозаминогликаны, в т.ч. гиалуроновую кислоту, которые играют ключевую роль в здоровье и внешнем виде вашей кожи. По мере старения кожи количество действующих клеток фибробластов начинает уменьшаться, а оставшиеся фибробласты становятся ленивыми и замедляют выработку коллагена, гиалуроновой кислоты и гликозаминогликанов. Это приводит к истончению, ломкости кожи, появлению мелких морщин, появлению синяков и обвисанию кожи. Большинство продуктов местного применения не проникают в этот слой, однако ретиноиды, такие как ретинол способны глубоко проникать в кожу. Гормоны, такие как эстроген, также легко проникают в этот слой (в косметике запрещено использование гормонов). Стволовые клетки, пептиды, гиалуроновая кислота и другие ингредиенты не проникают в дермальный слой кожи.
КОЛЛАГЕН – ПРОЧНОСТЬ КОЖИ
Коллаген – это белок, состоящий из цепочек аминокислот, образующих спираль. Толщина коллагенового волокна – всего 1мм, но при этом оно может выдержать нагрузку до 10 кг!
Помимо дермы коллаген встречается в мышцах, связках, волосах, ногтях, сосудах.
Существует много разных типов коллагена, но коллаген 1 и 3 типа играет наиболее важную роль в дерме, обеспечивая коже силу и структуру. Коллаген производится клетками фибробластов в процессе, который зависит от присутствия аскорбиновой кислоты или витамина С, железа, марганца, цинка, кальция, магния, уровня белка и наличия аминокислот: глютамин, пролин, лизин, цистеин, глицины.
- Космецевтические ингредиенты для увеличения коллагена в коже: исследования показывают, что когда аскорбиновая кислота добавляется к культурам фибробластов, производство коллагена увеличивается. Ретиноиды увеличивают синтез коллагена фибробластами за счет активации генов, ответственных за выработку коллагена, и выключения генов, вырабатывающих фермент, расщепляющий коллаген (коллагеназу). Также было показано, что гликолевая кислота стимулирует клетки фибробластов производить коллаген.
- Добавки для перорального применения и напитки с коллагеном: коллаген не проникает в кожу при местном применении, но при употребелении его внутрь многие отмечают улучшение гидратации, эластичности кожи и уменьшение выраженности морщин.

- Косметические процедуры для увеличения коллагена в коже: различные инъекции кожных наполнителей (гиалуроновая кислота и полимолочная кислота), лазерные методики и фототерапия импульсным светом, а также микроиглы (мезроллер, дермапен), фракционный рф также могут стимулировать выработку коллагена.
Выбрать средства с ретиноидами >>
ЭЛАСТИН – УПРУГОСТЬ КОЖИ
Эластин – это тоже нитеобразный белок, состоящий из аминокислот (валин, глицин, пролин, аланин и другие) и уникальных белков десмозинов. Десмозины скрепляют нити эластина между собой подобно паутине.
Благодаря такому строению эластин незаменим для красоты кожи:
- увеличивает тургор
- защищает от обвисания
- препятствует испарению влаги
- предотвращает образование морщин
Волокна эластина могут растягиваться в 1,5 раза, а затем возвращаться в исходное состояние.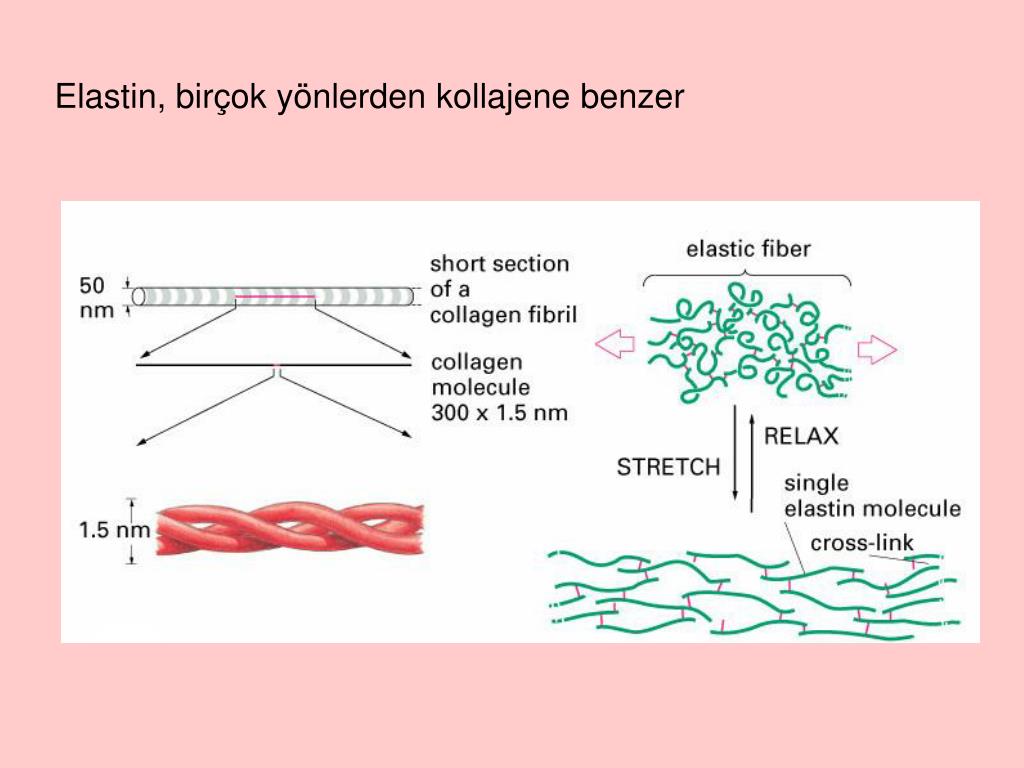 Больше всего их на коже лица, шеи, коленей, локтей, то есть участков, которые постоянно подвергаются сгибанию и растяжению.
Больше всего их на коже лица, шеи, коленей, локтей, то есть участков, которые постоянно подвергаются сгибанию и растяжению.
Всеми известные массажные линии, по которым делают массаж и наносят косметические средства – это как раз длинные диагонали ромбов, образованных волокнами коллагена и эластина в дерме.
Эластин образуется в виде предшественника, называемого тропоэластином, который затем должен быть модифицирован клеткой с образованием зрелого эластина, который образует комплекс с другими волокнами эластина. Этот сложный процесс трудно воспроизвести или стимулировать с помощью лекарств, космецевтики или процедур. По этой причине не существует методов, которые увеличивают эластиновый состав кожи. Лучше всего предотвратить потерю эластина с помощью защиты от солнца и антиоксидантов.
ГИАЛУРОНОВАЯ КИСЛОТА – УВЛАЖНЕННОСТЬ КОЖИ
В аналогии с матрасом гиалуроновая кислота – это набивка. Тот самый гель, которым заполнено пространство между коллагеновыми и эластиновыми волокнами, делает кожу гладкой и придает ей объем.
Главная заслуга гиалуронки – ее способность притягивать и удерживать воду, как губка. Чем богаче и пышнее набивка матраса, тем более упругим и гладким он будет. Так и с кожей – в молодости, когда выработка фибробластами коллагена, эластина и гиалуроновой кислоты на самом пике, мы выглядим, как сочный персик. Но уже к 30-ти годам эти процессы замедляются, и в результате кожа становится суше, начинает обвисать и покрываться морщинками.
- Космецевтические ингредиенты для увеличения содержания гиалуроновой кислоты в коже: было показано, что гликолевая кислота увеличивает уровень гиалуроновой кислоты в коже. Глюкозамин – еще один ингредиент, который, как считается, увеличивает уровень гиалуроновой кислоты в коже. Большинство составов гиалуроновой кислоты для местного применения НЕ проникают в кожу, потому что молекула слишком велика. Многие компании заявляют, что решили эту проблему, используя липосомальные носители или другие ингредиенты, улучшающие проникновение, но трудно дать вам рекомендации, как узнать, какие из них хороши.

- Пероральные добавки: многие исследования поддерживают использование пероральных добавок глюкозамина для увеличения выработки ГК в суставах. Вероятно, что они также увеличивают HA в коже.
- Косметические процедуры для увеличения содержания гиалуроновой кислоты в коже: биоревиталиация для создания гидрорезерва. Внимание! Процедура проводится по показаниям!
Выбрать средства с AHA-кислотами>>
Выбрать средства с BHA-кислотами>>
ГЕПАРАНСУЛЬФАТ
Гепарансульфат – гликоз аминогликан, который помогает клеткам лучше «слышать» важные сигналы. Гепарансульфат делает это, помогая факторам роста достигать своих целей на клетках фибробластов, стимулируя фибробласты вырабатывать коллаген.
ЧТО ЕЩЕ МОЖЕТ ВЛИЯТЬ НА НАШ КАРКАС?
Сон
Ночью, происходит восстановление не только нашего организма, но и кожи – уровень гидратации, стимуляций коллагена (про циркадные ритмы чуть позже будет статья).
Сахар
Влияет на наши белки.
Молекулы сахара + коллаген/эластин = дополнительная сшивка, и как следствие потеря упругости, сухость, морщины.
Половые гормоны
Синтез новых коллагеновых волокон зависит от уровня эстрогенов в организме. В менопаузе мы наблюдаем резкое сокращение содержания коллагена в дерме внешними проявлениям снижение тургор, морщины.
Хронический стресс
Большое количество кортизола (гормона стресса) может способствовать разрушению коллагена и эластина кожи и образованию морщин. Хронический стресс также может привести к инсулинорещситености и как следствие гликации (см выше).
Поняв структуру дермы и роль каждого из ее отважных воинов – коллагена, эластина и гиалуроновой кислоты, вам будет легче разобраться в антивозрастной и увлажняющей косметике, и научиться отличать факты от рекламных обещаний нечестных производителей.
А в следующий раз мы спустимся еще на один слой ниже, в гиподерму – подкожно-жировую клетчатку и приоткроем завесу тайны над образованием коварного целлюлита.
|
* Источник изображения
Коллаген и эластин — восстановить в домашних условиях
Женщины всего мира мечтают оставаться молодыми и красивыми как можно дольше: несмотря на то, что каждый возраст по-своему прекрасен и интересен, большинство женщин не принимают свои морщинки как должное и предпочитают избавляться или предотвращать их любым способом. Множество уходовой косметики, инъекциц, процедур, пластических операций и методик направлено на поддержание молодости и эластичности нашей кожи: лучше всего они работают в комплексе, но часто и отдельные меры по сохранению природной красоты приносят невероятные результаты.
В нашем организме существует множество различных веществ, которые влияют на состояние и здоровье нашей кожи. С возрастом и в связи с не самым здоровым образом жизни либо отсутствием полезных веществ в питании запасы коллагена и эластина в нашем организме могут истощаться: это приводит к тому, что наша кожа теряет эластичность, из-за чего на ней образовываются морщины, а молодость и свежесть покидают нас.
Коллаген — это белок, составляющий основу соединительной ткани животных и человека, обеспечивающий ее прочность и упругость. Он присутствует в составе связок, сухожилий, костей, хрящей, волос и, конечно же, кожи. Коллаген состоит из аминокислот, которые просто необходимы для нормального функционирования организма. С возрастом (в среднем после 25 лет) выработка фибробластами собственного коллагена заметно снижается, и в клетках начинается дистрофия коллагеновых волокон, что приводит к снижению упругости кожи, появлению морщин, ухудшению цвета лица.
Эластин — это белок, присутствующий в волокнах соединительной ткани и обеспечивающий ее эластичность. По функциональным свойствам эластин схож с коллагеном, и, как и коллаген, имеет тенденцию к дистрофии при старении.
Сочетание волокон коллагена и эластина создает тот каркас, который поддерживает нашу кожу прочной, упругой и эластичной. Но со временем волокна коллагена и эластина истончаются, что приводит к эстетическим изменениям формы лица. Мы же, улыбаясь, хмурясь, т.е. проявляя эмоции с помощью нашей мимики, дополнительно повреждаем волокна коллагена. Это приводит к появлению так называемых «мимических» морщин, от которых большинство женщин страстно мечтают избавиться. Внешние факторы, такие как курение, алкоголь, УФ-излучение, неблагоприятная экология ускоряют процесс внутреннего старения кожи, со всеми вытекающими отсюда последствиями. Коллаген, помимо всего прочего, является еще и сильным увлажнителем, который удерживает влагу в коже. Со снижением количества коллагеновых волокон кожа теряет все большее количество влаги и становится более уязвимой к воздействию окружающей среды.
Со снижением количества коллагеновых волокон кожа теряет все большее количество влаги и становится более уязвимой к воздействию окружающей среды.
Именно поэтому, чтобы кожа всегда оставалась подтянутой, упругой и эластичной уже с молодости надо «заботиться» о самых важных белках – коллагене и эластине кожи. Любую проблему проще предотвратить, чем боротсья с ней и ее последствиями: для этого уже после 25 лет многим девушкам стоит задуматься о рационе питания и уходовой косметике, которая сохранит их природную красоту и свежесть на долгие годы. Для того, чтобы в будущем избежать использования дорогостоящей и опасной пластической хирургии и инъекций, требуется подобрать комплекс уходовых средств и витаминов, которые помогут вам сиять долгие годы.
Чтобы сохранить молодость кожи надолго, косметологи рекомендуют употреблять продукты, усиливающие выработку коллагена и эластина в коже, а именно продукты, содержащие:
- Железо — нежирное мясо, язык, печень, зеленые яблоки;
- Медь — различные каши, бобовые;
- Белок — мясо, морепродукты;
- Витамин С – киви, цитрусовые, черная смородина;
- Цинк – ростки пшеницы, пивные дрожжи.

Врачи-косметологи также рекомендуют использовать косметические средства, содержащие коллаген, чтобы увлажнить кожу, поддержать ее изнутри. Коллаген, используемый в косметических средствах, бывает трех видов – растительный, животный и морской. На сегодняшний день морской коллаген является наиболее эффективным средством для поддержания упругости кожи. Компания «Созвездие Красоты» предлагает Вам серию коллагеновых масок американской фирмы Beauty Style. Комплексы масок для лица и для глаз помогут Вам всегда выглядеть молодо и эффектно, а морской коллаген, входящий в состав масок насытит Вашу кожу необходимыми питательными, увлажняющими и лифтинговыми элементами.
Пусть Ваша кожа всегда будет молодой с масками Beauty Style!
Эластин в домашнюю косметику для упругости кожи.
Описание товара
Эластин — это структурный белок, составляющий в коже основу гибких эластичных волокон в составе соединительной ткани. Так же, как и коллаген, он обеспечивает нашему кожному покрову и органам механическую прочность, помогает «затягиваться» повреждениям и защищает от воздействий внешней среды.
Так же, как и коллаген, он обеспечивает нашему кожному покрову и органам механическую прочность, помогает «затягиваться» повреждениям и защищает от воздействий внешней среды.
Эластин так же принимает участие в формировании водного баланса нашей кожи, при достаточном его содержании коже обеспечено длительное стабильное увлажнение, высокий уровень гибкости и упругости кожного покрова, хорошие способности к регенерации и заживания при повреждениях.
С годами выработка собственного эластина снижается и это проявляется в ухудшении эластичности кожи, замедлении выработки пота и кожного сала сальными и потовыми железами кожи, ухудшении циркуляции крови. Наступает время, когда кожу необходимо подпитывать косметическими средствами, в которых содержатся чудодейственные белки эластина.
Больше всего эластина в органах, которые подвержены большим механическим нагрузкам сужения-расширения, растяжения, сокращения, так, например в области шеи или в стенках аорты содержание коллагена и эластина достигает 40%.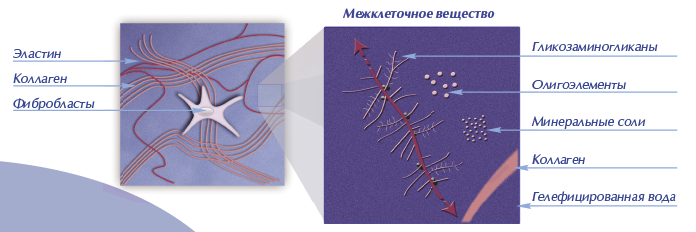 У женщин, ярким признаком уменьшения содержания эластина в организме является «провисание» груди, так как для поддержания ее упругости нужно большое количество эластичных волокон. Так что применение специальных кремов, масок, растираний и обертываний для груди может быть очень кстати, начиная уже с 30-35 лет. Конечно же, появление морщин тоже объясняется недостатком эластина и здесь так же на помощь могут прийти питательные маски, правильные крема и сыворотки.
У женщин, ярким признаком уменьшения содержания эластина в организме является «провисание» груди, так как для поддержания ее упругости нужно большое количество эластичных волокон. Так что применение специальных кремов, масок, растираний и обертываний для груди может быть очень кстати, начиная уже с 30-35 лет. Конечно же, появление морщин тоже объясняется недостатком эластина и здесь так же на помощь могут прийти питательные маски, правильные крема и сыворотки.
Косметические препараты с эластином не «забивают», не закупоривают кожные поры, а позволяют коже «дышать» не нарушая естественной работы потовых и сальных желез. Аминокислоты в составе эластина, способствуют общей нормализации выработки кожного сала и успешно применяются для решения проблем и возрастной и просто сухой или жирной кожи.
Свойства эластина :
- антиоксидант, омолаживает кожу;
- восстанавливает эластичность;
- нормализует липидный баланс;
- насыщает аминокислотами;
- разглаживает кожу;
- консервант;
- ПАВ.

Применение эластина в косметических средствах :
- возрастная косметика;
- натуральное мыло;
- крема, сыворотки;
- маски с лифтинг эффектом;
- лимфодренажные программы;
- бальзамы, шампуни.
Купить эластин во флаконах емкостью 25 мл, 50 мл. и оптовой литровой расфасовке для косметического применения можно сделав заказ через наш сайт или консультантов магазина
Права на текст принадлежат https://мыло-опт.com.ua
границ | Эластин в печени
Введение
Эластин является наиболее стабильным белком внеклеточного матрикса (ECM), который состоит из коллагена, гликопротеинов, гликозаминогликанов и протеогликанов (Aumailley and Gayraud, 1998). Он присутствует в больших количествах в органах, эластические свойства которых необходимы для их функционирования, таких как артерии и легкие. Эластин синтезируется во время родов, когда эти органы начинают функционировать, а в постнатальном периоде его синтез снижается. Большая часть белка сохраняется в организме на всю жизнь (Shapiro et al., 1991). Он может разрушаться и ресинтезироваться в различных органах при патологических состояниях. Эластические волокна появляются в рубце на более поздних стадиях заживления раны (Raghunath et al., 1996; Sproul and Argraves, 2013). Эластин накапливается в фиброзной печени независимо от этиологии фиброза (Liban and Ungar, 1959) и из-за его низкого метаболизма может существенно способствовать необратимости заболевания.
Большая часть белка сохраняется в организме на всю жизнь (Shapiro et al., 1991). Он может разрушаться и ресинтезироваться в различных органах при патологических состояниях. Эластические волокна появляются в рубце на более поздних стадиях заживления раны (Raghunath et al., 1996; Sproul and Argraves, 2013). Эластин накапливается в фиброзной печени независимо от этиологии фиброза (Liban and Ungar, 1959) и из-за его низкого метаболизма может существенно способствовать необратимости заболевания.
Эластические волокна состоят из нерастворимого эластинового ядра, микрофибрилл на поверхности волокон и ряда прикрепленных белков, которые помогают собирать волокна (Kielty et al., 2002). Эластические волокна не являются инертным компонентом ВКМ. Предшественник эластина тропоэластин, полимер эластина и продукты деградации эластина обладают биологической активностью, которая может влиять на воспалительные клетки и клетки соединительной ткани в органе (Almine et al., 2012). Более того, микрофибриллы связывают цитокины суперсемейства TGF-β, которые могут влиять на течение фиброза, регенерации и рака печени (Bissell et al. , 2001; Dooley and ten Dijke, 2012).
, 2001; Dooley and ten Dijke, 2012).
В настоящем обзоре обобщены результаты исследований эластина в печени на фоне современных знаний о биохимии и физиологии эластина.Целью данного обзора является поощрение дальнейших исследований эластина и других компонентов эластических волокон в печени, поскольку это может помочь решить проблему необратимости цирроза.
Эластиновое ядро из эластичных волокон
Эластические волокна состоят из эластинового ядра и микрофибриллярной оболочки, на которой откладывается эластин. Растворимым мономером эластина является тропоэластин (ТЕ) с молекулярной массой около 72 кДа. TE представляет собой белок с одним геном, кодируемый 36 экзонами, которые сохраняются у многих видов животных.Экзоны 34 и 35 были утрачены в процессе эволюции ТЕ человека. Семь других экзонов могут подвергаться альтернативному сплайсингу, отражая функцию эластина в различных тканях (Mithieux and Weiss, 2005; Figure 1A). Экзоны имеют длину от 27 до 114 пар оснований и кодируют домены с чередующимися гидрофобными и гидрофильными структурами. Гидрофобные участки содержат неполярные аминокислоты глицин, аланин, валин, пролин, лейцин и изолейцин, расположены в повторяющихся мотивах, таких как GVGVAP, и имеют тенденцию образовывать β-повороты.Гидрофобные участки придают белку эластичность. Гидрофильные домены богаты лизином и аланином и склонны образовывать α-спирали; остатки лизина разделены двумя или тремя остатками аланина, например, AAKAAAKAA. Остатки лизина в гидрофильных участках образуют поперечные связи, соединяющие соседние молекулы ТЭ. Взаимодействие четырех остатков лизина в определенном пространственном расположении необходимо для синтеза десмозина и изодесмозина, поперечных связей, характерных для эластина (Rosenbloom, 1984; Vrhovski and Weiss, 1998; Wise et al., 2014).
Гидрофобные участки содержат неполярные аминокислоты глицин, аланин, валин, пролин, лейцин и изолейцин, расположены в повторяющихся мотивах, таких как GVGVAP, и имеют тенденцию образовывать β-повороты.Гидрофобные участки придают белку эластичность. Гидрофильные домены богаты лизином и аланином и склонны образовывать α-спирали; остатки лизина разделены двумя или тремя остатками аланина, например, AAKAAAKAA. Остатки лизина в гидрофильных участках образуют поперечные связи, соединяющие соседние молекулы ТЭ. Взаимодействие четырех остатков лизина в определенном пространственном расположении необходимо для синтеза десмозина и изодесмозина, поперечных связей, характерных для эластина (Rosenbloom, 1984; Vrhovski and Weiss, 1998; Wise et al., 2014).
Рисунок 1. (A) Структура гена тропоэластина. Изменено из Mithieux and Weiss (2005). (B) Тропоэластин (TE) в сборе. Молекулы ТЭ полимеризуются по принципу «голова к хвосту» и впоследствии коацервируются. Модифицировано из Wise et al. (2014). (C) Фибриллярная модель эластина. Цепи тропоэластина соединены десмозиновыми поперечными связями. Модифицировано по Врховскому и Вайсу (1998). (D) Молекула десмозина.
Модифицировано из Wise et al. (2014). (C) Фибриллярная модель эластина. Цепи тропоэластина соединены десмозиновыми поперечными связями. Модифицировано по Врховскому и Вайсу (1998). (D) Молекула десмозина.
ТЭ человека состоит из 760 аминокислотных остатков.Он содержит N-концевую сигнальную последовательность, которая удаляется, когда вновь синтезированный белок попадает в эндоплазматический ретикулум. TE взаимодействует с белком, связывающим эластин (EBP), который является ферментативно неактивным вариантом β-галактозидазы. EBP действует как шаперон 67 кДа, который предотвращает внутриклеточную агрегацию TE и защищает TE от протеолитической деградации. TE упакован в секреторные везикулы в аппарате Гольджи (Mithieux and Weiss, 2005). После секреции во внеклеточное пространство молекулы ТЭ быстро связываются в режиме «голова к хвосту» и собираются на поверхности клетки.Этот процесс называется коацервацией (рис. 1В). Клетки временно взаимодействуют с эластическими волокнами, и глобулярный эластин переносится на фибриллинсодержащие микрофибриллы на поверхности волокон (Kozel et al. , 2006). Коацервации способствуют взаимодействия специфических областей ТЕ и фибриллина-1, компонента микрофибрилл (Clarke et al., 2005). Сиалидаза (нейраминидаза-1), связанная с EBP, удаляет терминальную сиаловую кислоту из углеводных цепей микрофибриллярного гликопротеина и облегчает связывание TE.EBP отделяется от TE, и большая его часть рециркулируется (Hinek, 1996; Debelle and Tamburro, 1999; Hinek et al., 2006).
, 2006). Коацервации способствуют взаимодействия специфических областей ТЕ и фибриллина-1, компонента микрофибрилл (Clarke et al., 2005). Сиалидаза (нейраминидаза-1), связанная с EBP, удаляет терминальную сиаловую кислоту из углеводных цепей микрофибриллярного гликопротеина и облегчает связывание TE.EBP отделяется от TE, и большая его часть рециркулируется (Hinek, 1996; Debelle and Tamburro, 1999; Hinek et al., 2006).
Стабилизация коацерватов на микрофибриллярном каркасе требует начального окисления специфических остатков лизина и сшивки TE (Sato et al., 2007). Протеин-лизин-6-оксидаза (лизилоксидаза, LOX), медьсодержащий фермент, окисляет остатки лизина до α-аминоадипиновых δ-полуальдегидов (ализинов), которые могут спонтанно взаимодействовать. Они образуют альдоль в реакции конденсации или основание Шиффа, когда аллизин реагирует с интактным остатком лизина.Эти соединения являются промежуточными продуктами в синтезе эластина, образующего поперечные связи лизинонорлейцина, десмозина и изодесмозина, которые соединяют соседние цепи ТЭ (рис. 1С, D). Окисление лизина требует ферментативного катализа, последующие реакции протекают самопроизвольно (Rucker et al., 1998). ТЭ легко расщепляется протеиназами, но сшивание делает его высокостабильным полимером, устойчивым к протеолизу (Maurice et al., 2013).
1С, D). Окисление лизина требует ферментативного катализа, последующие реакции протекают самопроизвольно (Rucker et al., 1998). ТЭ легко расщепляется протеиназами, но сшивание делает его высокостабильным полимером, устойчивым к протеолизу (Maurice et al., 2013).
Эластин в здоровой и фиброзной печени
Эластические волокна находятся в артериях, легких, коже, эластичных связках и мочевом пузыре — органах, подверженных растяжению и расширению.Однако эластиновые сети также могут быть обнаружены в тканях, основная функция которых не заключается в обеспечении эластичности и упругости, например, в суставном хряще и жировой ткани (Green et al., 2014).
Применение окраски орсеином в гистохимии позволило изучить эластические волокна в нормальной и циррозной печени. По данным Hohenemser (1895), новообразованная эластическая ткань при циррозе печени обнаруживается вокруг основных ветвей печеночной артерии и воротной вены. Волокна менее многочисленны по соседству с тонкими ветвями этих сосудов и в ацинусах. Они окружают желчные протоки. Hohenemser заметил две важные особенности фиброза печени. Во-первых, соединительная ткань при циррозе печени напоминает соединительную ткань, обнаруживаемую в рубцах, образующихся при заживлении ран кожи и других органов, а эластические волокна являются результатом развития рубца. Во-вторых, фиброзные перегородки являются продуктом синтеза новой соединительной ткани (Hohenemser, 1895). Тонкие эластические волокна обнаруживаются в капсуле печени и в портальных зонах нормальной печени. Эластические волокна обнаруживаются в расширенных портальных пространствах и в межузловых фиброзных перегородках при фиброзе печени.Участки эластина присутствуют в стенках поддольковых и центральных вен. Гиперплазия эластических волокон увеличивается при фиброзной печени независимо от происхождения заболевания. Близкие результаты дает окраска орсеином, альдегидфуксином, орцинол-новым фуксином и резорцин-фуксином (Либан и Унгар, 1959). Результаты, полученные при классическом окрашивании, могут быть подтверждены с помощью иммуногистохимии и электронной микроскопии (Porto et al.
Они окружают желчные протоки. Hohenemser заметил две важные особенности фиброза печени. Во-первых, соединительная ткань при циррозе печени напоминает соединительную ткань, обнаруживаемую в рубцах, образующихся при заживлении ран кожи и других органов, а эластические волокна являются результатом развития рубца. Во-вторых, фиброзные перегородки являются продуктом синтеза новой соединительной ткани (Hohenemser, 1895). Тонкие эластические волокна обнаруживаются в капсуле печени и в портальных зонах нормальной печени. Эластические волокна обнаруживаются в расширенных портальных пространствах и в межузловых фиброзных перегородках при фиброзе печени.Участки эластина присутствуют в стенках поддольковых и центральных вен. Гиперплазия эластических волокон увеличивается при фиброзной печени независимо от происхождения заболевания. Близкие результаты дает окраска орсеином, альдегидфуксином, орцинол-новым фуксином и резорцин-фуксином (Либан и Унгар, 1959). Результаты, полученные при классическом окрашивании, могут быть подтверждены с помощью иммуногистохимии и электронной микроскопии (Porto et al. , 1990a).
, 1990a).
При наличии некроза и воспаления в пораженной печени эластические волокна не определяются.Отложение эластических волокон является маркером заживления хронического активного гепатита и сопровождает появление крупных пучков коллагена (Bedossa et al., 1990). Существует хорошая корреляция между количеством эластических волокон в печени и длительностью заболевания (Thung, Gerber, 1982). Новые эластические волокна, образующиеся при активном фиброзе, можно отличить от участков коллапса печеночной паренхимы (Scheuer, Maggi, 1980). Отложение орсеин-позитивного материала, подобное таковому при холестатическом заболевании печени, обнаруживается в печени пациентов, страдающих индийским циррозом у детей (Portmann et al., 1978). Пучки эластических волокон окружают центральные венулы при фиброзе, сопровождающем фиброз III стадии неалкогольного стеатогепатита (Nakayama et al., 2008). Отложение эластических волокон в периферических портальных трактах является характерным признаком идиопатической портальной гипертензии. Сыворотки, полученные от больных этим заболеванием, индуцируют экспрессию эластина в эндотелиальных клетках сосудов. Сыворотки, полученные от больных хроническим вирусным гепатитом или циррозом, оказывают незначительное действие (Sato et al., 2011).Гиперплазия эластической ткани также наблюдается при шистосомальном фиброзе печени (Andrade and Freitas, 1991). Гепатоцеллюлярная карцинома является осложнением декомпенсированного цирроза печени. Накопление эластических волокон коррелирует с развитием карциномы при выраженном фиброзе (Yasui et al., 2016). Отложение эластических волокон в печени человека с циррозом показано на рисунках 2А, В.
Сыворотки, полученные от больных этим заболеванием, индуцируют экспрессию эластина в эндотелиальных клетках сосудов. Сыворотки, полученные от больных хроническим вирусным гепатитом или циррозом, оказывают незначительное действие (Sato et al., 2011).Гиперплазия эластической ткани также наблюдается при шистосомальном фиброзе печени (Andrade and Freitas, 1991). Гепатоцеллюлярная карцинома является осложнением декомпенсированного цирроза печени. Накопление эластических волокон коррелирует с развитием карциномы при выраженном фиброзе (Yasui et al., 2016). Отложение эластических волокон в печени человека с циррозом показано на рисунках 2А, В.
Рис. 2. (A) Гистология цирроза печени — обзор. Выраженный цирроз (пурпурный цвет) отделяет регенеративные узелки гепатоцитов.Существовавшие ранее структуры желчных протоков, ветвей воротной вены и печеночной артерии ущемляются в фиброзных участках. Видно очаговое отложение эластических волокон (черный цвет); Элатическое окрашивание по Ван Гизону, 40х. (Рышка и Нова, неопубликованные результаты). (B) Фрагмент выраженного перипортального фиброза в циррозной печени с отложением тонких эластических волокон. Часть волокон иррадиирует в регенеративные узелки гепатоцитов; окрашивание эластика по Ван-Гизону, 200х. (Рышка и Нова, неопубликованные результаты).
(Рышка и Нова, неопубликованные результаты). (B) Фрагмент выраженного перипортального фиброза в циррозной печени с отложением тонких эластических волокон. Часть волокон иррадиирует в регенеративные узелки гепатоцитов; окрашивание эластика по Ван-Гизону, 200х. (Рышка и Нова, неопубликованные результаты).
Образование эластических волокон в печени можно воспроизвести экспериментально при длительном воздействии на крыс четыреххлористым углеродом. Эластическое окрашивание или антитела к эластину выявляют эластин в перегородках, окружающих регенеративные узелки (Kanta and Bartos, 1978; Kanta et al., 2002). Перевязка общего желчного протока у крыс приводит к отложению эластина в расширенной портальной зоне (Lorena et al., 2004; Guyot et al., 2006). Отложение эластина наблюдается в течение нескольких дней после обструкции желчных протоков сначала в виде точек между клетками, а затем в виде пятен рядом с коллагеновыми волокнами (Desmoulière et al., 1997). Сепсис, индуцированный у мышей полимикробным полиперитонитом, приводит к пролиферации эластических волокон в портальных трактах и поддольковых венах печени выживших животных (Gonnert et al. , 2012). Гранулемы, образующиеся в печени мышей, которым инъецировали яйца Schistosoma mansoni, содержат концентрические орсеин-позитивные эластические волокна (Silva et al., 2000). В поврежденной печени изменено содержание структурных белков ВКМ, коллагена, эластина, фибронектина и фибриллина. Результирующие изменения жесткости тканей могут способствовать регенерации или фиброзу (Klaas et al., 2016).
, 2012). Гранулемы, образующиеся в печени мышей, которым инъецировали яйца Schistosoma mansoni, содержат концентрические орсеин-позитивные эластические волокна (Silva et al., 2000). В поврежденной печени изменено содержание структурных белков ВКМ, коллагена, эластина, фибронектина и фибриллина. Результирующие изменения жесткости тканей могут способствовать регенерации или фиброзу (Klaas et al., 2016).
Микрофибриллы эластичных волокон
Микроскопически аморфный эластин образует ядро эластических волокон. Микрофибриллы диаметром 10–12 нм располагаются на поверхности волокна параллельно его длинной оси (Mithieux, Weiss, 2005). Фибриллины являются основным белковым компонентом микрофибрилл. Это гликопротеины, богатые цистеином, и их молекулярная масса составляет около 350 кДа. Доминирующим структурным элементом фибриллинов являются домены, подобные эпидермальному фактору роста (EGF), большая часть которых связывает кальций (домены cb-EGF).Катионы кальция стабилизируют домены и делают их устойчивыми к протеолизу.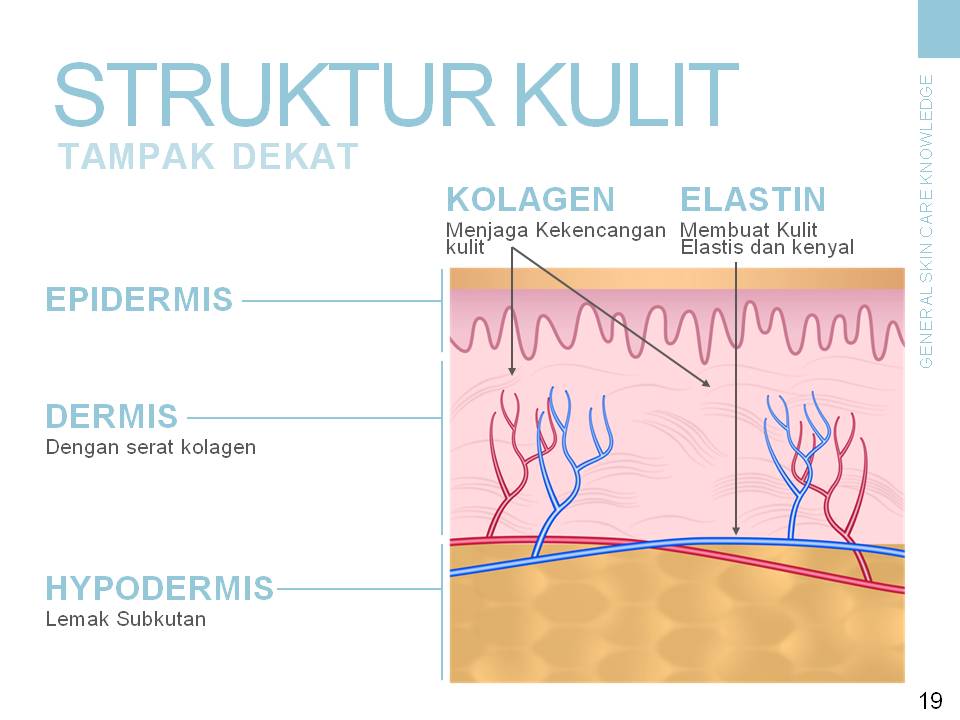 Молекулы фибриллина организованы по принципу «голова к хвосту» (Ramirez and Sakai, 2010). Сборка фибриллина в микрофибриллы требует присутствия сети фибронектина. Клеточный фибронектин синтезируется фибробластами и другими клетками и связывается с интегринами клеточной поверхности, которые связаны с актиновым цитоскелетом. Связывание вызывает конформационные изменения в молекулах фибронектина. Клеточная сократимость облегчает обнажение доменов, связывающих различные белки ECM, включая сам фибронектин (Mao and Schwarzbauer, 2005; Figure 3A).Отдельные микрофибриллы имеют характерный вид «бусинок на нитке». Микрофибриллы стабилизируются с помощью трансглютаминазных поперечных связей между областями между шариками фибрилл (Kielty et al., 2002; Wang et al., 2009). Fibrillin-1 связывает TE с высокой аффинностью, и два белка могут быть сшиты с помощью transglutaminase (Rock et al., 2004). Фибриллин-2 структурно похож на фибриллин-1 и также участвует во внеклеточном отложении тропоэластина (Zhang et al.
Молекулы фибриллина организованы по принципу «голова к хвосту» (Ramirez and Sakai, 2010). Сборка фибриллина в микрофибриллы требует присутствия сети фибронектина. Клеточный фибронектин синтезируется фибробластами и другими клетками и связывается с интегринами клеточной поверхности, которые связаны с актиновым цитоскелетом. Связывание вызывает конформационные изменения в молекулах фибронектина. Клеточная сократимость облегчает обнажение доменов, связывающих различные белки ECM, включая сам фибронектин (Mao and Schwarzbauer, 2005; Figure 3A).Отдельные микрофибриллы имеют характерный вид «бусинок на нитке». Микрофибриллы стабилизируются с помощью трансглютаминазных поперечных связей между областями между шариками фибрилл (Kielty et al., 2002; Wang et al., 2009). Fibrillin-1 связывает TE с высокой аффинностью, и два белка могут быть сшиты с помощью transglutaminase (Rock et al., 2004). Фибриллин-2 структурно похож на фибриллин-1 и также участвует во внеклеточном отложении тропоэластина (Zhang et al. , 1994; Tsuruga et al., 2005). Синтез фибриллина-1 происходит параллельно росту эластических волокон. Фибриллин-2 вырабатывается во время внутриутробного развития и ремоделирования тканей. Его экспрессия высока в фибробластах, выделенных из заживающих ран (Brinckmann et al., 2010; Ramirez and Sakai, 2010).
, 1994; Tsuruga et al., 2005). Синтез фибриллина-1 происходит параллельно росту эластических волокон. Фибриллин-2 вырабатывается во время внутриутробного развития и ремоделирования тканей. Его экспрессия высока в фибробластах, выделенных из заживающих ран (Brinckmann et al., 2010; Ramirez and Sakai, 2010).
Рис. 3. (A) Сборка микрофибрилл Fibrillin. Фибриллин-1 откладывается на матрице фибронектина (ФН), которая связана с поверхностью клетки через интегрины. Модифицировано из Kinsey et al. (2008). (Б) Схема эластического волокна, состоящего из эластинового ядра и микрофибриллы.
Гистологическими методами можно выделить три стадии развития эластического волокна. Окситалановые волокна состоят из микрофибрилл диаметром 10–16 нм, элаунин содержит как микрофибриллы, так и аморфный материал. В зрелом эластическом волокне аморфный материал накапливается и образует центральное ядро (Garner and Alexander, 1986; рисунок 3B). Окситалановые, элауниновые и эластические волокна наблюдаются при развитии алкогольного фиброза печени (Porto et al. , 1990b). В нормальной печени фибриллин-1 колокализуется с эластином в стенках сосудов и в соединительной ткани портального тракта.Это также может быть обнаружено при отсутствии эластина. При циррозе печени его можно обнаружить в ассоциации с эластином в фиброзных перегородках, окружающих регенеративные узелки, и отдельно в перисинудоидальных пространствах (Dubuisson et al., 2001). Фибриллин-1 часто коэкспрессируется с эластином при холестатических заболеваниях у детей, но имеет более широкое распространение в печени (Lamireau et al., 2002).
, 1990b). В нормальной печени фибриллин-1 колокализуется с эластином в стенках сосудов и в соединительной ткани портального тракта.Это также может быть обнаружено при отсутствии эластина. При циррозе печени его можно обнаружить в ассоциации с эластином в фиброзных перегородках, окружающих регенеративные узелки, и отдельно в перисинудоидальных пространствах (Dubuisson et al., 2001). Фибриллин-1 часто коэкспрессируется с эластином при холестатических заболеваниях у детей, но имеет более широкое распространение в печени (Lamireau et al., 2002).
Белки, связанные с эластичными волокнами
Ряд белков связан с фибриллиновыми микрофибриллами и влияет на свойства эластических волокон (Baldwin et al., 2013). Белки, связывающие латентный трансформирующий фактор роста-β (LTBP), представляют собой крупные гликопротеины (молекулярная масса 125–240 кДа), структурно сходные с фибриллином. Семейство LTBPs состоит из четырех членов, которые колокализуются с фибриллиновыми микрофибриллами (Zilberberg et al. , 2012; Robertson et al., 2015). LTBP, за исключением LTBP-2, секретируются большинством клеток в виде большого латентного комплекса (LLC) с димером латентно-ассоциированного пептида (LAP) и трансформирующим фактором роста-β (TGF-β)-димером (Koli et al. ., 2001; рис. 4А).LLC присоединяется к фибриллину во время сборки микрофибрилл (Massam-Wu et al., 2010).
, 2012; Robertson et al., 2015). LTBP, за исключением LTBP-2, секретируются большинством клеток в виде большого латентного комплекса (LLC) с димером латентно-ассоциированного пептида (LAP) и трансформирующим фактором роста-β (TGF-β)-димером (Koli et al. ., 2001; рис. 4А).LLC присоединяется к фибриллину во время сборки микрофибрилл (Massam-Wu et al., 2010).
Рис. 4. (А) Формирование большого латентного комплекса (БЛК). Предшественники TGF-β димеризуются, и димеры расщепляются фуриновой протеазой. Освобожденные фрагменты образуют малый латентный комплекс (SLC), который содержит нековалентно связанный TGF-β. SLC присоединяется к латентному TGF-β-связывающему белку (LTBP). Изменено из Hayashi and Sakai (2012). (B) Возможные пути высвобождения TGF-β из большого латентного комплекса: деградация латентно-ассоциированного пептида (LAP) протеазами и искажение LAP клеточной тягой.Модифицировано из Robertson et al. (2015).
LAP и TGF-β синтезируются в виде одной полипептидной цепи.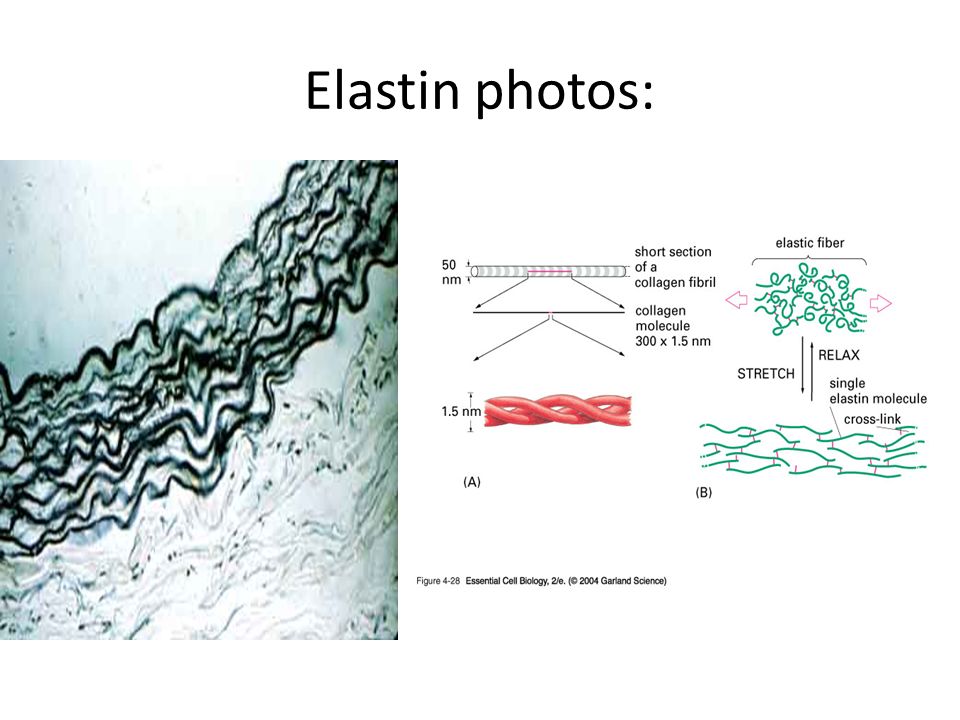 Две цепи объединяются, образуя димер, который затем расщепляется эндопротеазой фурином (Koli et al., 2001). В результате димер LAP (80 кДа) окружает димер TGF-β (25 кДа). TGF-β нековалентно связан с LAP, а LAP связан с LTBP через дисульфидные связи. LAP предотвращает взаимодействие TGF-β со своим рецептором и передачу сигналов. Комплекс LAP и TGF-β называется малым латентным комплексом (SLC) (Hayashi and Sakai, 2012; рисунок 4A).
Две цепи объединяются, образуя димер, который затем расщепляется эндопротеазой фурином (Koli et al., 2001). В результате димер LAP (80 кДа) окружает димер TGF-β (25 кДа). TGF-β нековалентно связан с LAP, а LAP связан с LTBP через дисульфидные связи. LAP предотвращает взаимодействие TGF-β со своим рецептором и передачу сигналов. Комплекс LAP и TGF-β называется малым латентным комплексом (SLC) (Hayashi and Sakai, 2012; рисунок 4A).
Культивируемые миофибробласты печени человека (MFB), выделенные из биоптатов печени, экспрессируют все компоненты, образующие большой латентный комплекс TGF-β: четыре изоформы LTBP и их варианты сплайсинга, LAP и три изоформы TGF-β, что указывает на важность активности TGF-β в больная печень (Mangasser-Stephan et al., 2001). TGF-β1 способствует активации и миофибробластической дифференцировке звездчатых клеток печени (HSCs), что является ключевым событием в фиброгенезе печени (Hayashi and Sakai, 2012). мРНК LTBP-1 можно обнаружить в фиброзных перегородках печени крыс. Он синтезируется ГСК, трансдифференцирующимися в миофибробласты. TGF-β может высвобождаться из комплекса с LTBP путем обработки плазмином (Breitkopf et al., 2001). Поскольку TGF-β экспрессируется по всей печеночной паренхиме, LTBP-1, присутствующий в портальных пространствах, может связывать TGF-β и направлять его в эти области (Corchero et al., 2004). Мыши с нокаутом LTBP-1 менее склонны к фиброгенезу печени, индуцированному лигированием желчных протоков (Drews et al., 2008).
Он синтезируется ГСК, трансдифференцирующимися в миофибробласты. TGF-β может высвобождаться из комплекса с LTBP путем обработки плазмином (Breitkopf et al., 2001). Поскольку TGF-β экспрессируется по всей печеночной паренхиме, LTBP-1, присутствующий в портальных пространствах, может связывать TGF-β и направлять его в эти области (Corchero et al., 2004). Мыши с нокаутом LTBP-1 менее склонны к фиброгенезу печени, индуцированному лигированием желчных протоков (Drews et al., 2008).
TGF-β должен быть активирован, прежде чем он проявит свою биологическую активность.Взаимодействие между LAP и TGF-β может быть нарушено in vitro экстремальными значениями pH, хаотропными агентами или тепловой обработкой (Koli et al., 2001). LTBP может расщепляться протеазами в культуре клеток. Плазмин, эластаза и различные металлопротеазы матрикса разрушают этот белок (Dallas et al., 2002). Интегрины клеточных рецепторов могут служить для доставки металлопротеаз МТ-1, ММР, ММР-9 или ММР-2 в окрестности LLC, прикрепленной к микрофибрилле.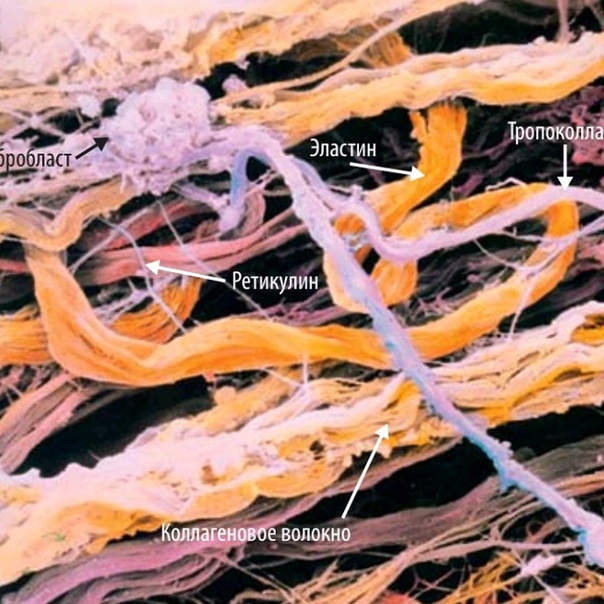 Затем LTBP и LAP расщепляются и высвобождается TGFβ (Wipff and Hinz, 2008).Тяговые силы, создаваемые клетками, также могут способствовать высвобождению TGF-β. Интегрины αv на клеточной поверхности распознают аминокислотную последовательность arg-gly-asp (RGD), присутствующую в LAP, и связывают весь комплекс. LTBP закрепляется в механически стойком матриксе, и когда MFB сокращаются, конформация LAP может изменяться и высвобождать TGF-β (Wipff and Hinz, 2008; Figure 4B). Согласно альтернативному механизму, фрагменты фибриллина, высвобождаемые в результате протеолиза, могут ингибировать взаимодействие фибриллина и LTBP-1, что приводит к высвобождению LLC и увеличению концентрации активного TGFβ (Chaudhry et al., 2007).
Затем LTBP и LAP расщепляются и высвобождается TGFβ (Wipff and Hinz, 2008).Тяговые силы, создаваемые клетками, также могут способствовать высвобождению TGF-β. Интегрины αv на клеточной поверхности распознают аминокислотную последовательность arg-gly-asp (RGD), присутствующую в LAP, и связывают весь комплекс. LTBP закрепляется в механически стойком матриксе, и когда MFB сокращаются, конформация LAP может изменяться и высвобождать TGF-β (Wipff and Hinz, 2008; Figure 4B). Согласно альтернативному механизму, фрагменты фибриллина, высвобождаемые в результате протеолиза, могут ингибировать взаимодействие фибриллина и LTBP-1, что приводит к высвобождению LLC и увеличению концентрации активного TGFβ (Chaudhry et al., 2007).
Тромбоспондин-1 может связываться с SLC, и образующийся тройной комплекс тромбоспондина, LAP и TGF-β является биологически активным (Murphy-Ullrich and Poczatek, 2000). ГСК стимулируются тромбоцитарным фактором роста (PDGF)-BB к пролиферации и миграции. Профиброгенный цитокин PDGF-BB стимулирует коэкспрессию TGF-β1 и тромбоспондина-1 в этих клетках (Breitkopf et al. , 2005). При холестазе латентный TGF-β активируется тромбоспондином-1, экспрессия которого в гепатоцитах индуцируется желчными кислотами (Myung et al., 2007). LTBP-2 не образует ковалентных комплексов с латентным TGF-β, но конкурирует с LTBP-1 за сайты связывания на фибриллин-1. Его много в развивающихся содержащих эластин тканях, и он может отрицательно модулировать хранение LLC в ВКМ (Hirani et al., 2007).
, 2005). При холестазе латентный TGF-β активируется тромбоспондином-1, экспрессия которого в гепатоцитах индуцируется желчными кислотами (Myung et al., 2007). LTBP-2 не образует ковалентных комплексов с латентным TGF-β, но конкурирует с LTBP-1 за сайты связывания на фибриллин-1. Его много в развивающихся содержащих эластин тканях, и он может отрицательно модулировать хранение LLC в ВКМ (Hirani et al., 2007).
TGF-β1 является основным профиброгенным цитокином в печени. Он продуцируется синусоидальными эндотелиальными клетками и клетками Купфера в нормальной печени. Активированные HSCs становятся основным источником TGF-β в поврежденной печени и являются его основной мишенью.Цитокин стимулирует пролиферацию HSCs, их дедифференцировку в MFBs и синтез ECM (Bissell et al., 2001; Dooley and ten Dijke, 2012). TGF-β препятствует синтезу ДНК в гепатоцитах и вызывает их апоптоз или переход из эпителия в мезенхиму. Он играет двустороннюю роль в гепатоцеллюлярной карциноме. Он подавляет рост опухоли на ранних стадиях, но впоследствии способствует ее инвазивности и метастазированию (Dooley and ten Dijke, 2012; Meindl-Beinker et al. , 2012). TGF-β1 увеличивает экспрессию фибриллина-1 в культивируемых фибробластах печени (Lorena et al., 2004).
, 2012). TGF-β1 увеличивает экспрессию фибриллина-1 в культивируемых фибробластах печени (Lorena et al., 2004).
Fibrillin связывает несколько членов семейства костных морфогенетических белков (BMP) (Sengle et al., 2008; Ramirez and Sakai, 2010). Цитокины TGF-β и BMP принадлежат к надсемейству TGF-β. Из-за важной роли, которую они играют в фиброзе, они рассматриваются как потенциальные терапевтические мишени. Действия этих цитокинов опосредованы внутриклеточными белками Smads (Munoz-Félix et al., 2015). BMP регулируют пролиферацию, апоптоз, дифференцировку и миграцию клеток и связаны с заболеваниями и регенерацией печени (Sugimoto et al., 2007; Эррера и др., 2012).
Связанные с микрофибриллами гликопротеины 1 и 2 (MAGP-1, -2) присоединяются к фибриллину. Их молекулярная масса невелика, около 25 кДа. MAGP-1 связывает TE и членов семейства TGF-β и BMP. Он может модифицировать передачу сигналов TGFβ и тканевой гомеостаз (Weinbaum et al., 2008; Mecham and Gibson, 2015). Белки, расположенные на интерфейсе микрофибрилл эластина (EMILIN), представляют собой семейство белков ECM. EMILIN-1 связывается с эластином и фибулином-5 и прилипает к клеткам. Он расположен на поверхности эластинового ядра.Эластогенез нарушен у мышей с дефицитом EMILIN-1. Клетки теряют тесный контакт с эластическими волокнами, что негативно влияет на их морфологию (Zanetti et al., 2004). EMILIN-1 еще не обнаружен в печени. Микрофибриллярно-ассоциированные белки (MFAP) представляют собой низкомолекулярные белки, отличные от MAGP (Mecham and Gibson, 2015). MFAP4 представляет собой гликопротеин, который связывает TE и фибриллин-1 и -2 и сшивающую аминокислоту десмозин in vitro . Он способствует коацервации TE и необходим для сборки микрофибрилл (Kasamatsu et al., 2011; Пилецкий и др., 2016). Его много в HSCs и в фиброзных перегородках печени человека с циррозом (Mölleken et al., 2009). Экспрессия MFAP4 в фиброзной печени увеличивается со стадией фиброза как на уровне транскриптов генов, так и на уровне белков (Bracht et al., 2015).
EMILIN-1 связывается с эластином и фибулином-5 и прилипает к клеткам. Он расположен на поверхности эластинового ядра.Эластогенез нарушен у мышей с дефицитом EMILIN-1. Клетки теряют тесный контакт с эластическими волокнами, что негативно влияет на их морфологию (Zanetti et al., 2004). EMILIN-1 еще не обнаружен в печени. Микрофибриллярно-ассоциированные белки (MFAP) представляют собой низкомолекулярные белки, отличные от MAGP (Mecham and Gibson, 2015). MFAP4 представляет собой гликопротеин, который связывает TE и фибриллин-1 и -2 и сшивающую аминокислоту десмозин in vitro . Он способствует коацервации TE и необходим для сборки микрофибрилл (Kasamatsu et al., 2011; Пилецкий и др., 2016). Его много в HSCs и в фиброзных перегородках печени человека с циррозом (Mölleken et al., 2009). Экспрессия MFAP4 в фиброзной печени увеличивается со стадией фиброза как на уровне транскриптов генов, так и на уровне белков (Bracht et al., 2015).
Фибулины представляют собой семейство гликопротеинов, которое включает белки с большой молекулярной массой, фибулин-1 (90–100 кДа) и фибулин-2 (200 кДа), и белки гораздо меньшего размера, фибулины-3, -4 и -5 (50 кДа). –60 кДа). Их характерной особенностью является наличие доменов, подобных кальций-связывающему эпидермальному фактору роста (cbEGF), и С-концевой области фибулинового типа.Все они связывают TE, но играют разные роли в формировании эластических волокон (Kobayashi et al., 2007). Фибулин-1 присутствует в аморфном ядре эластического волокна (Roark et al., 1995), фибулин-2 колокализуется с фибриллином-1 (El-Hallous et al., 2007). Синтез фибулина-2 и эластина хорошо скоординирован (Hunzelmann et al., 2001). Фибулин-4, LOX и TE образуют тройной комплекс. Этот комплекс регулирует активацию LOX и сшивание эластина до отложения эластина на микрофибриллах.Отсутствие fibulin-4 вызывает подавление экспрессии TE в фибробластах и образование нерегулярных агрегатов эластина вместо эластических волокон (McLaughlin et al., 2006). Нокдаун экспрессии fibulin-4 в фибробластах человека сопровождается снижением экспрессии мРНК TE (Chen et al., 2009). Фибулин-5 откладывается на микрофибриллах фибриллина-1 в культуре фибробластов человека (Hirai et al.
–60 кДа). Их характерной особенностью является наличие доменов, подобных кальций-связывающему эпидермальному фактору роста (cbEGF), и С-концевой области фибулинового типа.Все они связывают TE, но играют разные роли в формировании эластических волокон (Kobayashi et al., 2007). Фибулин-1 присутствует в аморфном ядре эластического волокна (Roark et al., 1995), фибулин-2 колокализуется с фибриллином-1 (El-Hallous et al., 2007). Синтез фибулина-2 и эластина хорошо скоординирован (Hunzelmann et al., 2001). Фибулин-4, LOX и TE образуют тройной комплекс. Этот комплекс регулирует активацию LOX и сшивание эластина до отложения эластина на микрофибриллах.Отсутствие fibulin-4 вызывает подавление экспрессии TE в фибробластах и образование нерегулярных агрегатов эластина вместо эластических волокон (McLaughlin et al., 2006). Нокдаун экспрессии fibulin-4 в фибробластах человека сопровождается снижением экспрессии мРНК TE (Chen et al., 2009). Фибулин-5 откладывается на микрофибриллах фибриллина-1 в культуре фибробластов человека (Hirai et al. , 2007). Он связывается с глобулами эластина и способствует их отложению на микрофибриллах (Choudhury et al., 2009). Ген фибулина-5 индуцируется только в клетках, продуцирующих эластин. Экспрессия мРНК Fibulin-5 следует за экспрессией мРНК тропоэластина и снижается, когда клетки трансфицируют миРНК тропоэластина (Tsuruga et al., 2004).
, 2007). Он связывается с глобулами эластина и способствует их отложению на микрофибриллах (Choudhury et al., 2009). Ген фибулина-5 индуцируется только в клетках, продуцирующих эластин. Экспрессия мРНК Fibulin-5 следует за экспрессией мРНК тропоэластина и снижается, когда клетки трансфицируют миРНК тропоэластина (Tsuruga et al., 2004).
Фибулины-1 и -2 обнаруживаются в портальных областях нормальной печени крыс. Их экспрессия увеличивается при остром повреждении печени. Фибулин-1 обнаруживается в гепатоцитах, активированных HSC и MFB, но экспрессия фибулина-2 ограничена MFB. Фиброзные перегородки в печени с циррозом положительны как для фибулина-1, так и для -2 (Knittel et al., 1999; Пискалия и др., 2009). Фибулин-2 опосредует действие TGF-β при миокардиальном фиброзе (Khan et al., 2016), но неизвестно, действует ли он таким образом в печени. Экспрессия фибулина-5 в биоптатах печени пациентов с фиброзом, ассоциированным с гепатитом В или С, увеличивается по мере увеличения стадии фиброза (Bracht et al. , 2015). Фибулин-5 часто можно обнаружить в крупных ветвях воротной вены у пациентов с идиопатической портальной гипертензией, и его распределение соответствует эластическим волокнам (Sato et al., 2008).
, 2015). Фибулин-5 часто можно обнаружить в крупных ветвях воротной вены у пациентов с идиопатической портальной гипертензией, и его распределение соответствует эластическим волокнам (Sato et al., 2008).
Лизилоксидаза (LOX) участвует в сшивке коллагена и эластина. Fibulin-4 взаимодействует с пропептидом lysyl oxidase (LOX), привязывает LOX к TE и облегчает перекрестное связывание эластина (Horiguchi et al., 2009). Фибулин-5 нацеливает лизилоксидазоподобный белок 1 (LOXL1) на участки эластогенеза. Связывание с фибулином-5 приводит LOXL1 в соприкосновение с его субстратом TE. LOXL1 тесно связан с эластическими волокнами, в отличие от LOX, который распространен более широко (Liu et al., 2004). LOX может быть обнаружен в фиброзных перегородках при экспериментальном фиброзе печени (Siegel et al., 1978), а также при вирусном гепатите человека и первичном билиарном циррозе (Vadasz et al., 2005). Члены семейства LOX присутствуют в ГСК и портальных фибробластах здоровой и поврежденной печени (Перепелюк и др. , 2013).
, 2013).
Clusterin является внеклеточным шапероном, который образует комплексы с белками посредством гидрофобных взаимодействий и стабилизирует их на пути к правильному фолдингу (Poon et al., 2002). Он присутствует снаружи аномальных эластических волокон при кожных заболеваниях и может защищать их от деградации (Aigelsreiter et al., 2013). Кластерин присутствует в желчи при холестатических заболеваниях. Он колокализуется с эластическими волокнами в портальных трактах печени, но эти комплексы отсутствуют в зонах перицеллюлярного фиброза. Коллаген, гепатоциты или холангиоциты не окрашиваются антителами к кластерину (Aigelsreiter et al., 2009). Неясно, маркирует ли кластерин только эластические волокна или он поддерживает их отложение.
Протеогликаны содержат белковое ядро, замещенное цепями гликозаминогликанов. Они классифицируются в соответствии с их молекулярной массой и составом гликозаминогликанов.К фибриллиновым микрофибриллам присоединены протеогликаны различного состава, перлекан, версикан, декорин (Ramirez, Sakai, 2010). Отрицательно заряженные цепи гликозаминогликанов взаимодействуют с положительно заряженными аминогруппами остатков лизина в ТЕ, которые могут изменяться, когда аминогруппы окисляются LOX (Broekelman et al., 2005). Гепарансульфатные протеогликаны регулируют сборку микрофибрилл и отложение эластина на микрофибриллах (Cain et al., 2008). Избыток протеогликанов хондроитинсульфата вызывает аномальное отложение фибриллина-1 и снижение продукции ТЭ и фибулина-5 (Ikeda et al., 2009). Небольшие богатые лейцином хондроитинсульфатные протеогликаны бигликан и декорин могут играть роль в формировании эластических волокон. Бигликан образует тройной комплекс с ТЕ и MAGP-1 (Reinboth et al., 2002), декорин образует комплекс с фибриллином-1 и MAGP-1 (Trask et al., 2000).
Отрицательно заряженные цепи гликозаминогликанов взаимодействуют с положительно заряженными аминогруппами остатков лизина в ТЕ, которые могут изменяться, когда аминогруппы окисляются LOX (Broekelman et al., 2005). Гепарансульфатные протеогликаны регулируют сборку микрофибрилл и отложение эластина на микрофибриллах (Cain et al., 2008). Избыток протеогликанов хондроитинсульфата вызывает аномальное отложение фибриллина-1 и снижение продукции ТЭ и фибулина-5 (Ikeda et al., 2009). Небольшие богатые лейцином хондроитинсульфатные протеогликаны бигликан и декорин могут играть роль в формировании эластических волокон. Бигликан образует тройной комплекс с ТЕ и MAGP-1 (Reinboth et al., 2002), декорин образует комплекс с фибриллином-1 и MAGP-1 (Trask et al., 2000).
Содержание протеогликанов в циррозной печени человека значительно увеличивается. Содержание гепарансульфата, преобладающего в нормальной печени, увеличивается в два раза, а увеличение дерматансульфата и хондроитинсульфата еще более резкое. Активированные ГСК являются основным местом их синтеза (Gressner et al., 1994). Гепатоциты, клетки желчных протоков и клетки Купфера участвуют в синтезе протеогликанов при холестазе (Roskams et al., 1996). Перлекан и синдекан-1 локализованы в синусоидах здоровой печени человека, перлекан откладывается в фиброзных перегородках при циррозе печени (Tátrai et al., 2010). Перлекан и декорин также откладываются в печени крыс и экспрессируются в ГСК, активированных in vitro путем культивирования на пластике (Gallai et al., 1996). Однако связь протеогликанов с синтезом и отложением эластина в печени не изучалась.
Активированные ГСК являются основным местом их синтеза (Gressner et al., 1994). Гепатоциты, клетки желчных протоков и клетки Купфера участвуют в синтезе протеогликанов при холестазе (Roskams et al., 1996). Перлекан и синдекан-1 локализованы в синусоидах здоровой печени человека, перлекан откладывается в фиброзных перегородках при циррозе печени (Tátrai et al., 2010). Перлекан и декорин также откладываются в печени крыс и экспрессируются в ГСК, активированных in vitro путем культивирования на пластике (Gallai et al., 1996). Однако связь протеогликанов с синтезом и отложением эластина в печени не изучалась.
Синтез и распад эластина
Эластин экспрессируется как в портальных фибробластах, так и в ГСК. Эластин может быть обнаружен в изолированных портальных фибробластах с помощью иммуноцитохимии (Li et al., 2007). Экспрессия мРНК эластина в этих клетках увеличивается после перевязки желчных протоков (Перепелюк и др., 2013). Экспрессию эластина клеточными линиями, полученными из портальных фибробластов, можно продемонстрировать с помощью определения мРНК, иммуноблоттинга и иммуноцитохимии (Fausther et al.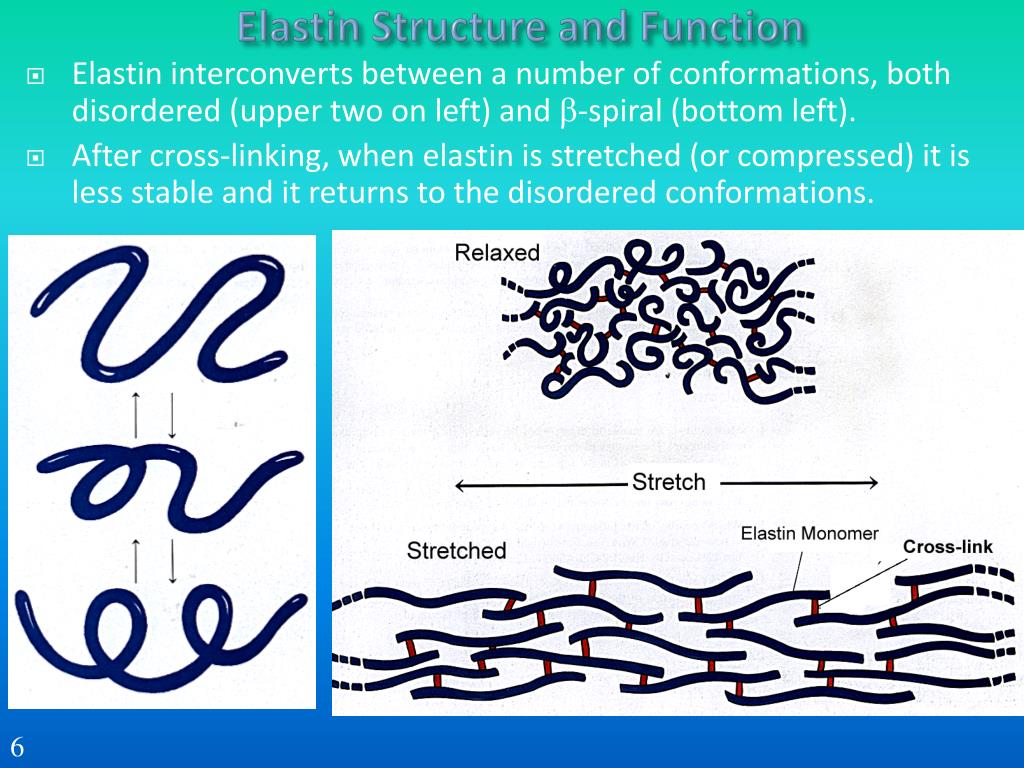 , 2015). Экспрессия мРНК ТЭ в ГСК значительно ниже как в нормальной, так и в остроповрежденной печени (Перепелюк и др., 2013). TE экспрессируется в первичных HSCs как на уровне мРНК, так и на уровне белка и секретируется в культуральную среду (Kanta et al., 2002). TE можно обнаружить с помощью иммуноцитохимии в первичных HSC (Pellicoro et al., 2012). Этанол стимулирует трансдифференцировку ГСК, вызывая изменения в структуре хроматина. При этом увеличивается экспрессия белков ВКМ, включая эластин (Page et al., 2015). Сверхэкспрессия miR-29a приводит к подавлению эластина и др. белков ECM в HSC (Li et al., 2011).
, 2015). Экспрессия мРНК ТЭ в ГСК значительно ниже как в нормальной, так и в остроповрежденной печени (Перепелюк и др., 2013). TE экспрессируется в первичных HSCs как на уровне мРНК, так и на уровне белка и секретируется в культуральную среду (Kanta et al., 2002). TE можно обнаружить с помощью иммуноцитохимии в первичных HSC (Pellicoro et al., 2012). Этанол стимулирует трансдифференцировку ГСК, вызывая изменения в структуре хроматина. При этом увеличивается экспрессия белков ВКМ, включая эластин (Page et al., 2015). Сверхэкспрессия miR-29a приводит к подавлению эластина и др. белков ECM в HSC (Li et al., 2011).
Фиброзные перегородки в печени сильно положительны на эластин, который локализуется совместно с миофибробластами, содержащими α-SMA (Kanta et al., 2002; Guyot et al., 2006), но эластин не обнаруживается в активированных HSCs в паренхиме (Lorena et al. , 2004). ГСК дают 82–96% миофибробластов в моделях как токсического, так и холестатического фиброза (Mederacke et al., 2013).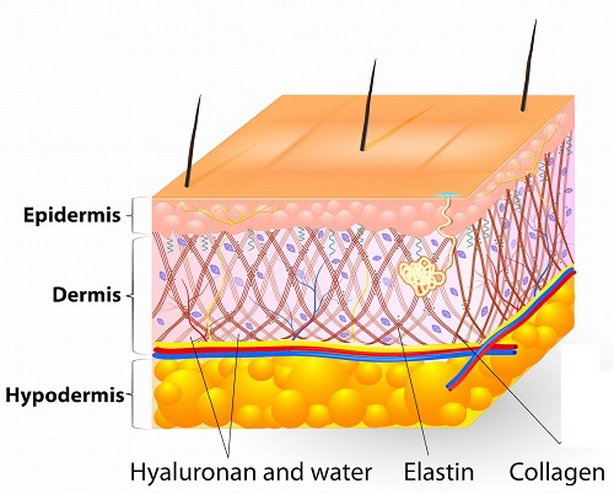 Портальные фибробласты являются основным источником миофибробластов на ранней стадии холестатического поражения печени.Однако их относительный вклад в формирование перегородок снижается по мере того, как HSC активируются и хемотаксически притягиваются к портальным пространствам (Kinnman and Housset, 2002; Iwaisako et al., 2014; Lua et al., 2016). Большая часть эластина, присутствующего в фиброзных перегородках, может быть продуктом MFB, происходящих из HSC.
Портальные фибробласты являются основным источником миофибробластов на ранней стадии холестатического поражения печени.Однако их относительный вклад в формирование перегородок снижается по мере того, как HSC активируются и хемотаксически притягиваются к портальным пространствам (Kinnman and Housset, 2002; Iwaisako et al., 2014; Lua et al., 2016). Большая часть эластина, присутствующего в фиброзных перегородках, может быть продуктом MFB, происходящих из HSC.
Экспрессия эластина регулируется в основном на транскрипционном и посттранскрипционном уровне. Ряд цитокинов участвует в регуляции эластина в развивающихся и больных органах. TGF-β1 является одним из наиболее важных (Sproul and Argraves, 2013).Механические силы играют роль в регуляции синтеза эластина. Синтез коллагена и эластина увеличивается в легочных артериях в период гипоксической легочной гипертензии. Эти изменения обратимы, но сохраняются, если артериальная гипертензия становится хронической (Poiani et al., 1990; Durmowicz et al. , 1994). Растяжение гладкомышечных клеток аорты (ГМК) на культуральных чашках с деформируемым дном или центрифугирование фибробластов в культуральных колбах приводит к активации гена трополастина и усилению синтеза тропоэластина (Sutcliffe and Davidson, 1990; Redlich et al., 2004). Жесткость печени отражает прогрессирование фиброза печени. Соотношение медианных площадей коллагеновых и эластиновых волокон хорошо коррелирует с увеличением жесткости печени, измеренной с помощью транзиентной эластографии (Abe et al., 2013). Повышенная жесткость поврежденной печени, которая способствует активации ГСК, первоначально является результатом сочетания отека гепатоцитов, повышения уровня билирубина и внутрипеченочного отложения коллагена (Dechêne et al., 2010). β-аминопропионитрил, ингибитор LOX, частично устраняет увеличение жесткости печени и экспрессию α-SMA (Georges et al., 2007). Эластиновые волокна формируются позже (Klaas et al., 2016). Экспрессия фибриллина-1 в портальных фибробластах и в MFB печени, культивируемых в ограниченных решетках коллагенового геля, больше, чем в клетках, встроенных в свободно плавающие решетки (Lorena et al.
, 1994). Растяжение гладкомышечных клеток аорты (ГМК) на культуральных чашках с деформируемым дном или центрифугирование фибробластов в культуральных колбах приводит к активации гена трополастина и усилению синтеза тропоэластина (Sutcliffe and Davidson, 1990; Redlich et al., 2004). Жесткость печени отражает прогрессирование фиброза печени. Соотношение медианных площадей коллагеновых и эластиновых волокон хорошо коррелирует с увеличением жесткости печени, измеренной с помощью транзиентной эластографии (Abe et al., 2013). Повышенная жесткость поврежденной печени, которая способствует активации ГСК, первоначально является результатом сочетания отека гепатоцитов, повышения уровня билирубина и внутрипеченочного отложения коллагена (Dechêne et al., 2010). β-аминопропионитрил, ингибитор LOX, частично устраняет увеличение жесткости печени и экспрессию α-SMA (Georges et al., 2007). Эластиновые волокна формируются позже (Klaas et al., 2016). Экспрессия фибриллина-1 в портальных фибробластах и в MFB печени, культивируемых в ограниченных решетках коллагенового геля, больше, чем в клетках, встроенных в свободно плавающие решетки (Lorena et al. , 2004).
, 2004).
Эластин синтезируется во время внутриутробной жизни и в постнатальном периоде. В результате сшивания он становится нерастворимым и чрезвычайно стабильным белком. Это наиболее стабильный компонент ECM. Несмотря на это, он медленно расщепляется, и небольшие количества пептидов эластина (микрограммы/мл) циркулируют в сыворотке крови здоровых людей (Shapiro et al., 1991; Роберт и Лабат-Роберт, 2014). Ремоделирование ВКМ опосредовано главным образом матриксными металлопротеиназами (ММП), содержащими цинк в своем активном центре. ММР-2 (желатиназа А), -7 (матрилизин), -9 (желатиназа В) и -12 (эластаза) активны в отношении эластина. Эластаза нейтрофилов является сериновой протеазой, большинство катепсинов, расщепляющих эластин, относятся к цистеиновым протеазам (Qin, 2015). Протеазы, разрушающие эластин, часто расщепляют микрофибриллы фибриллина (Sherratt, 2009). Физиологический синтез и деградация эластина во взрослом возрасте происходит в инволюционной матке (Starcher and Percival, 1985).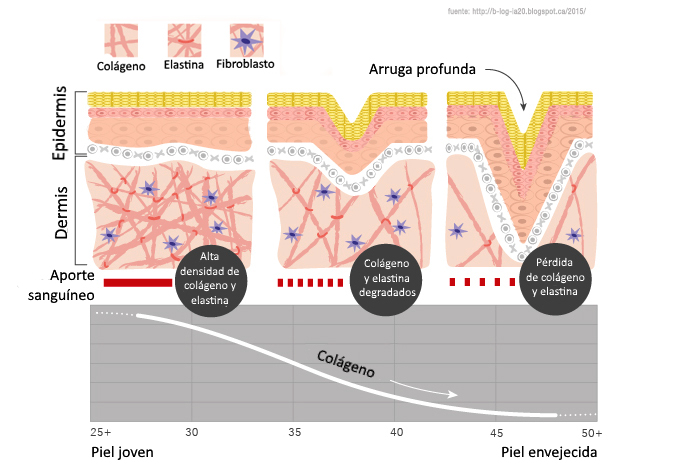 Большое количество эластина разрушается, и синтез эластина может реактивироваться при патологических состояниях, например, при эмфиземе легких. Фрагменты эластина, образующиеся под действием эластазы макрофагов, ММР-12, привлекают моноциты периферической крови (Houghton et al., 2006). Содержание десмозина в печени крыс с циррозом, являющееся показателем зрелого эластина, увеличивается, но эластазоподобная активность в органе не изменяется (Velebný et al., 1983). CCl 4 и тиоацетамид вызывают серьезное повреждение печени как у мышей WT, так и у мышей MMP-12 -∕- , но накопление эластина гораздо более выражено у мышей с нокаутом MMP-12.Эластаза, продуцируемая подмножеством печеночных макрофагов, расщепляет эластин в печени, и ее дефицит приводит к повышенному накоплению эластина при экспериментальном фиброзе печени. Ни в одной из групп животных не наблюдается спонтанного фиброза, но после длительного лечения тиоацетамидом у мышей с нокаутом наблюдается повышенное накопление коллагена по сравнению с мышами дикого типа (Pellicoro et al.
Большое количество эластина разрушается, и синтез эластина может реактивироваться при патологических состояниях, например, при эмфиземе легких. Фрагменты эластина, образующиеся под действием эластазы макрофагов, ММР-12, привлекают моноциты периферической крови (Houghton et al., 2006). Содержание десмозина в печени крыс с циррозом, являющееся показателем зрелого эластина, увеличивается, но эластазоподобная активность в органе не изменяется (Velebný et al., 1983). CCl 4 и тиоацетамид вызывают серьезное повреждение печени как у мышей WT, так и у мышей MMP-12 -∕- , но накопление эластина гораздо более выражено у мышей с нокаутом MMP-12.Эластаза, продуцируемая подмножеством печеночных макрофагов, расщепляет эластин в печени, и ее дефицит приводит к повышенному накоплению эластина при экспериментальном фиброзе печени. Ни в одной из групп животных не наблюдается спонтанного фиброза, но после длительного лечения тиоацетамидом у мышей с нокаутом наблюдается повышенное накопление коллагена по сравнению с мышами дикого типа (Pellicoro et al. , 2012).
, 2012).
Регуляторная роль эластина
Эластичные волокна обеспечивают эластичность и упругость органов, подверженных повторяющимся растяжениям и физиологическим нагрузкам (аорта, легкие, кожа).Однако это не единственная их функция. Регуляторная роль ТЭ, полимера эластина и продуктов деградации эластина стала заметной в последние годы (Lannoy et al., 2014). Эластин действует как аутокринный фактор, который ингибирует пролиферацию сосудистых ГМК в артериях и удерживает их в спокойном сократительном состоянии. Мыши, лишенные гена эластина (Eln -/- ), умирают от окклюзионной фиброцеллюлярной патологии, вызванной субэндотелиальной пролиферацией и накоплением сосудистых ГМК в раннем неонатальном периоде.ГМК, выделенные из новорожденных детенышей Eln -/- , размножаются с гораздо большей скоростью, чем клетки Eln +/+ . Eln -/- SMCs демонстрируют замечательную нехватку актиновых стрессовых волокон, которые могут быть устранены рекомбинантной обработкой TE. TE ингибирует миграцию и пролиферацию ГМК в культуре (Karnik et al., 2003a). Нерастворимый эластин, включенный в коллагеновые каркасы, снижает их жесткость в зависимости от концентрации и модулирует фенотип ГМК в направлении сократительного состояния (Ryan and O’Brien, 2015; Nguyen et al., 2016). Клетки Eln +/+ имеют веретенообразную морфологию с выступающими стрессовыми волокнами в отличие от эпителиоидоподобной морфологии клеток Eln -/- (Karnik et al., 2003b).
TE ингибирует миграцию и пролиферацию ГМК в культуре (Karnik et al., 2003a). Нерастворимый эластин, включенный в коллагеновые каркасы, снижает их жесткость в зависимости от концентрации и модулирует фенотип ГМК в направлении сократительного состояния (Ryan and O’Brien, 2015; Nguyen et al., 2016). Клетки Eln +/+ имеют веретенообразную морфологию с выступающими стрессовыми волокнами в отличие от эпителиоидоподобной морфологии клеток Eln -/- (Karnik et al., 2003b).
Гидрофильные домены тропоэластина, богатые лизином, часто участвуют в образовании поперечных связей, а продуктами эластолитического расщепления являются фрагменты гидрофобных частей молекулы, содержащей гексапептид вал-гли-вал-ала-про-гли (ВГВАПГ) и др. пептиды, содержащие последовательность GXXPG, где X представляет собой гидрофобную аминокислоту.Эти пептиды биологически активны (Almine et al., 2010). Пептиды эластина (EP), иногда называемые эластокинами, могут связываться с комплексом рецепторов эластина, состоящим из EBP, нейраминидазы и защитного белка-катепсина А, и располагаться на клеточной поверхности (Adair-Kirk and Senior, 2008; Maurice et al. , 2013). Интегрин αvβ3 связывает последовательность RKRK на С-конце ТЕ (Rodgers and Weiss, 2004; Almine et al., 2013). Галектин-3, присутствующий в клетках карциномы молочной железы, можно рассматривать как третий рецептор, связывающий эластин (Ochieng et al., 1999). ФП претерпевают фазовый переход и самосборку выше определенной критической температуры, что увеличивает концентрацию ФП и делает их действие более эффективным (Yuan, Koria, 2016).
, 2013). Интегрин αvβ3 связывает последовательность RKRK на С-конце ТЕ (Rodgers and Weiss, 2004; Almine et al., 2013). Галектин-3, присутствующий в клетках карциномы молочной железы, можно рассматривать как третий рецептор, связывающий эластин (Ochieng et al., 1999). ФП претерпевают фазовый переход и самосборку выше определенной критической температуры, что увеличивает концентрацию ФП и делает их действие более эффективным (Yuan, Koria, 2016).
Фрагменты ECM, включая эластин, являются хемотаксическими для моноцитов и полиморфноядерных лейкоцитов (Hauck et al., 1995; Houghton et al., 2006). Они вызывают изменения экспрессии генов воспалительных клеток (Adair-Kirk and Senior, 2008). ВП стимулируют секрецию ММР-12 фибробластами. Эта протеиназа, в свою очередь, может продуцировать больше эластокинов (Almine et al., 2013). Экспрессия провоспалительных цитокинов TNF-α, IL-1β и IL-6 в моноцитах подавляется EP и фрагментами эластина, таким образом модифицируя воспаление (Baranek et al. , 2007).
, 2007).
Гидролизат эластина и ЭП стимулируют пролиферацию фибробластов и ГМК (Chatron-Colliet et al., 2015; Shiratsuchi et al., 2016) и усиливают ангиогенез (Robinet et al., 2005). ЭП стимулирует выработку некоторых ММР (Robinet et al., 2005; Duca et al., 2007) и снижает синтез эластина (Wachi et al., 1995). Протеинкиназы ERK1/2 участвуют в регуляции ММП (Duca et al., 2007). TE модулирует высвобождение фактора роста эндотелия сосудов (VEGF) и фактора роста соединительной ткани (CTGF) из ГМК, стимулируемых TGF-β1 (Reddel et al., 2013).
Эластические волокна в диагностике заболеваний печени
Эластин, который накапливается в печени при прогрессирующем фиброзе, может быть использован для диагностики заболевания. Магнитный резонанс с контрастным веществом, специфичным для эластина, содержащим гадолиний, можно использовать в качестве неинвазивного диагностического метода (Ehling et al., 2013). Накопление эластических волокон в печени является основным предиктором развития гепатоцеллюлярной карциномы независимо от коллагеновых волокон (Yasui et al. , 2016). Экспрессия MFAP4 в печени низкая по сравнению с эластичными тканями (Wulf-Johansson et al., 2013). Однако концентрация MAFP4 в плазме больных хроническим гепатитом и циррозом повышена и положительно коррелирует с жесткостью печени, измеряемой с помощью транзиентной эластографии. Повышение уровня MFAP4 в плазме у пациентов с заболеваниями печени выше, чем у пациентов с сердечными или другими заболеваниями (Sækmose et al., 2013, 2015).
, 2016). Экспрессия MFAP4 в печени низкая по сравнению с эластичными тканями (Wulf-Johansson et al., 2013). Однако концентрация MAFP4 в плазме больных хроническим гепатитом и циррозом повышена и положительно коррелирует с жесткостью печени, измеряемой с помощью транзиентной эластографии. Повышение уровня MFAP4 в плазме у пациентов с заболеваниями печени выше, чем у пациентов с сердечными или другими заболеваниями (Sækmose et al., 2013, 2015).
маркера ECM, деградированный коллаген III, коллаген V и эластин, коррелируют со способностью элиминации галактозы и степенью портальной гипертензии (Leeming et al., 2013). Концентрация циркулирующего EP может отражать ремоделирование ECM и прогнозировать время выживания у пациентов с трансъюгулярным внутрипеченочным порто-системным шунтированием (Nielsen et al., 2015). Кластерин присутствует в сыворотке. Его концентрация снижается у пациентов с алкогольным циррозом печени и коррелирует с их выживаемостью (Høgåsen et al., 1996). Присутствие в моче десмосинов, продуктов деградации эластина, является потенциальным диагностическим маркером фиброза печени (Afdhal et al. , 1997; Stone, 2000).
, 1997; Stone, 2000).
Выводы
Образование фиброзных перегородок расценивается как негативный исход заболеваний печени. Эластические волокна способствуют стабильности перегородки. Однако все аспекты присутствия эластических волокон в печени неизвестны. Синтез отдельных компонентов эластических волокон в печени и их сборка, по-видимому, следуют общей схеме формирования эластических волокон в организме.Информация о регуляции эластогенеза, полученная в исследованиях, проведенных на других органах, может послужить полезным источником вдохновения для изучения эластогенеза в печени. Примером может служить возникающая регулирующая роль фибулинов. Исследования, проводимые на клетках человека, должны иметь приоритет из-за различий в сплайсинге первичного транскрипта гена ТЕ у разных видов животных. Эластин и другие компоненты эластических волокон также могут быть полезны в качестве диагностических инструментов в гепатологии.
Вклад авторов
Автор подтверждает, что является единственным автором данной работы и одобрил ее публикацию.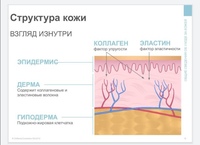
Заявление о конфликте интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Рецензент ПК и редактор-обработчик заявили о своей общей принадлежности, а редактор-обработчик заявляет, что процесс, тем не менее, соответствует стандартам справедливого и объективного обзора.
Благодарности
Это исследование было поддержано грантом Карлова университета PRVOUK P37/01.Автор выражает благодарность доктору Алешу Рышке и доктору Маркете Нова за предоставление гистологических изображений, а также доктору Милошу Хроху за помощь в подготовке рисунков.
Ссылки
Абэ Т., Хашигучи А., Ямадзаки К., Эбинуима Х., Сайто Х., Кумада Х. и др. (2013). Количественная оценка коллагеновых и эластических волокон с использованием цельных изображений образцов биопсии печени. Патол. Междунар. 63, 305–310.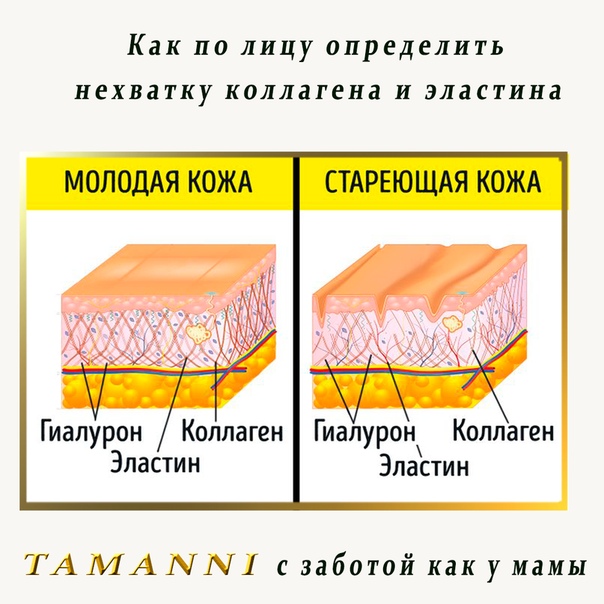 doi: 10.1111/pin.12064
doi: 10.1111/pin.12064
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Адэр-Кирк, Т.Л. и старший, Р. М. (2008). Фрагменты внеклеточного матрикса как медиаторы воспаления. Междунар. Дж. Биохим. Клеточная биол. 40, 1101–1110. doi: 10.1016/j.biocel.2007.12.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Afdhal, N.H., Keaveny, A.P., Cohen, S.B., Nunes, D.P., Maldonado, N., O’Brien, M., et al. (1997). Анализы мочи на десмозин и гидроксилизилпиридинолин при выявлении цирроза печени. J. Гепатол. 27, 993–1002.
Реферат PubMed | Академия Google
Айгельсрайтер, А., Janig, E., Sostaric, J., Pichler, M., Unterthor, D., Halasz, J., et al. (2009). Экспрессия кластерина при холестазе, гепатоцеллюлярной карциноме и фиброзе печени. Гистопатология 54, 561–570. doi: 10.1111/j.1365-2559.2009.03258.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Aigelsreiter, A. , Pichler, M., Pixner, T., Janig, E., Schuller, M., Lackner, C., et al. (2013). Экспрессия кластерина при эластофиброме спины. Гистол. Гистопатол. 28, 597–603.
, Pichler, M., Pixner, T., Janig, E., Schuller, M., Lackner, C., et al. (2013). Экспрессия кластерина при эластофиброме спины. Гистол. Гистопатол. 28, 597–603.
Реферат PubMed | Академия Google
Almine, J.F., Bax, D.V., Mithieux, S.M., Nivison-Smith, L., Rnjak, J., Waterhouse, A., et al. (2010). Материалы на основе эластина. Хим. соц. Ред. 39, 3371–3379. дои: 10.1039/b2p
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Алмин, Дж. Ф., Уайз, С. Г., Хиоб, М., Сингх, Н. К., Тивари, К. К., Вали, С., и др. (2013). Последовательности эластина запускают временные провоспалительные реакции дермальных фибробластов человека. FASEB J. 27, 3455–3465. doi: 10.1096/fj.13-231787
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Андраде З.А. и Фрейтас Л.А.Р. (1991). Гиперплазия эластической ткани при шистосомальном фиброзе печени. Мем. Инст. Освальдо Круз 86, 447–456. дои: 10.1590/S0074-027619
дои: 10.1590/S0074-027619
400014
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Баранек, Т., Дебрет, Р., Антоничелли, Ф., Ламхиуэд, Б., Балаауай, А., Hornebeck, W., et al. (2007). Оккупация эластинового рецептора (сплайсированная галактозидаза) эластиновыми пептидами противодействует экспрессии провоспалительных цитокинов в липополисахарид-стимулированных моноцитах человека посредством подавления NF-κB. Дж. Иммунол. 179, 6184–6192. doi: 10.4049/jиммунол.179.9.6184
Реферат PubMed | Полнотекстовая перекрестная ссылка
Бедосса П., Лемигр Г., Параф Ф. и Мартин Э. (1990). Отложение и ремоделирование эластических волокон при хроническом гепатите. Арка Вирхова.Патол. Анат. 417, 159–162. дои: 10.1007/BF021
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bracht, T., Schweinsberg, V., Trippler, M., Kohl, M., Ahrens, M., Padden, J., et al. (2015). Анализ экспрессии белка, ассоциированного с заболеванием, с использованием количественной протеомики: фибулин-5 экспрессируется в связи с фиброзом печени.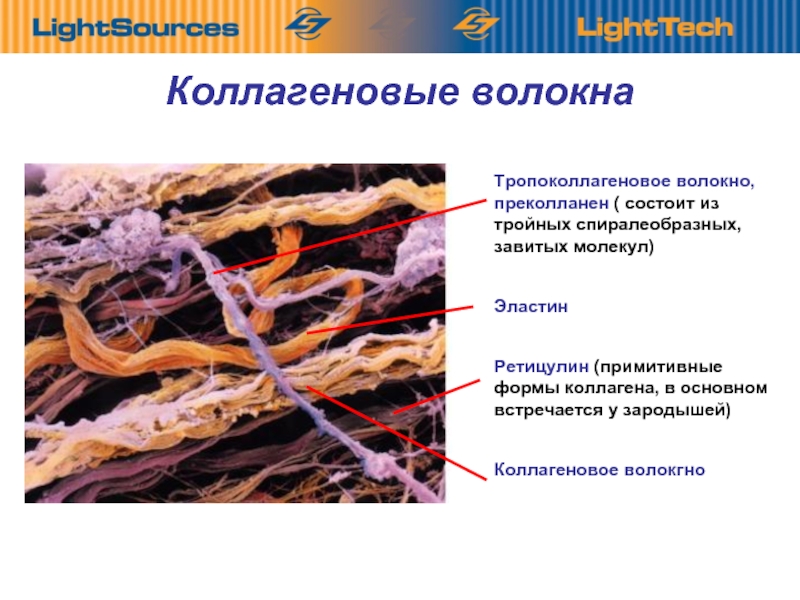 J. Proteome Res. 14, 2278–2286. doi: 10.1021/acs.jproteome.5b00053
J. Proteome Res. 14, 2278–2286. doi: 10.1021/acs.jproteome.5b00053
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Брейткопф, К., Lahme, B., Tag, C.G., и Gressner, A.M. (2001). Экспрессия и отложение в матриксе белков, связывающих латентный трансформирующий фактор роста β, в нормальной и фиброзной печени крыс и трансдифференцирующихся звездчатых клетках печени в культуре. Гепатология 33, 387–396. doi: 10.1053/jhep.2001.21996
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Брейткопф К., Савица И., Вестхофф Дж. Х., Викерт Л., Дули С. и Гресснер А. М. (2005). Тромбоспондин 1 действует как сильный промотор эффектов трансформирующего фактора роста β посредством двух различных механизмов в звездчатых клетках печени. Гут 54, 673–681. doi: 10.1136/gut.2004.042911
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Brinckmann, J., Hunzelmann, N., Kahle, B.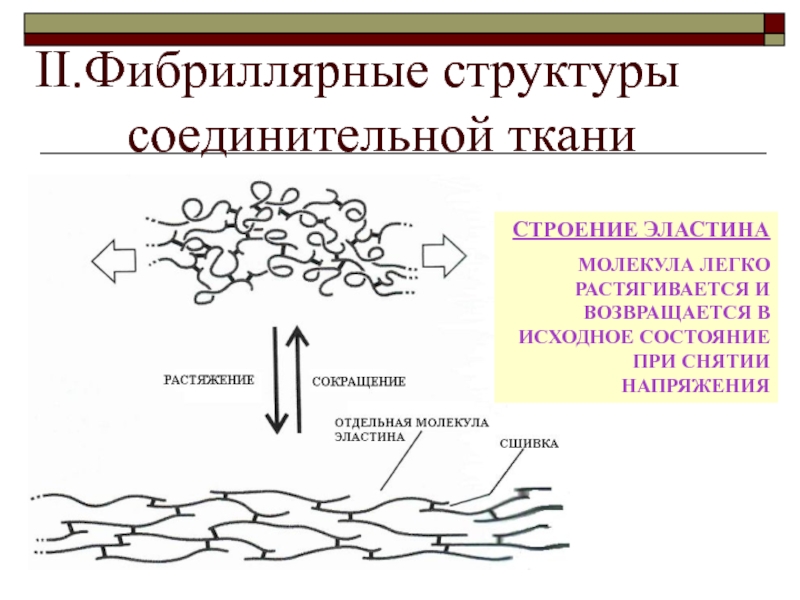 , Rohwedel, J., Kramer, J., Gibson, M.A., et al. (2010). Повышенная экспрессия фибриллина-2 является общим признаком заживления ран и склероза: потенциальное изменение прикрепления клеток и накопление TGF-β. Лаб. Инвестируйте 90, 739–752. doi: 10.1038/labinvest.2010.49
, Rohwedel, J., Kramer, J., Gibson, M.A., et al. (2010). Повышенная экспрессия фибриллина-2 является общим признаком заживления ран и склероза: потенциальное изменение прикрепления клеток и накопление TGF-β. Лаб. Инвестируйте 90, 739–752. doi: 10.1038/labinvest.2010.49
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Брокельман, Т.J., Kozel, B.A., Ishibashi, H., Werneck, C.C., Keeley, F.W., Zhang, L., et al. (2005). Тропоэластин взаимодействует с гликозаминогликанами клеточной поверхности через свой СООН-концевой домен. Дж. Биол. хим. 280, 40939–40947. doi: 10.1074/jbc.M507309200
Реферат PubMed | Полнотекстовая перекрестная ссылка
Каин С.А., Болдуин А.К., Махалингам Ю., Рейнал Б., Джовитт Т.А., Шаттлворт С.А. и др. (2008). Гепарансульфат регулирует N- и C-концевые взаимодействия фибриллина-1. Дж.биол. хим. 283, 27017–27027. дои: 10.1074/jbc.M803373200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chatron-Colliet, A. , Lalun, N., Terryn, C., Kurdykowski, S., Lorenzato, M., Rusciani, A., et al. (2015). Пептид эластина (VGVAPG) 3 индуцирует трехмерную реорганизацию PML-NB и архитектуры спеклов SC 35 и ускоряет пролиферацию фибробластов и клеток меланомы. Гистохим. Клеточная биол. 143, 245–258. дои: 10.1007/s00418-014-1274-2
, Lalun, N., Terryn, C., Kurdykowski, S., Lorenzato, M., Rusciani, A., et al. (2015). Пептид эластина (VGVAPG) 3 индуцирует трехмерную реорганизацию PML-NB и архитектуры спеклов SC 35 и ускоряет пролиферацию фибробластов и клеток меланомы. Гистохим. Клеточная биол. 143, 245–258. дои: 10.1007/s00418-014-1274-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чаудхри, С.С., Каин, С.А., Морган, А., Даллас, С.Л., Шаттлворт, К.А., и Килти, К.М. (2007). Фибриллин-1 регулирует биодоступность TGFβ1. J. Cell Biol. 176, 355–367. doi: 10.1083/jcb.200608167
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chen, Q., Zhang, T., Roshetsky, J.F., Ouyang, J., Essers, J., Fan, C., et al. (2009).Фибулин-4 регулирует экспрессию гена тропоэластина и последующее образование эластических волокон фибробластами человека. Биохим. Дж. 423, 79–89. дои: 10.1042/BJ200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чоудхури, Р. , Макговерн, А., Ридли, К., Каин, С.А., Болдуин, А., Ван, М.-К., и др. (2009). Дифференциальная регуляция образования эластических волокон фибулином-4 и -5. Дж. Биол. хим. 284, 24553–24567. doi: 10.1074/jbc.M109.019364
, Макговерн, А., Ридли, К., Каин, С.А., Болдуин, А., Ван, М.-К., и др. (2009). Дифференциальная регуляция образования эластических волокон фибулином-4 и -5. Дж. Биол. хим. 284, 24553–24567. doi: 10.1074/jbc.M109.019364
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кларк, А.В., Уайз, С.Г., Каин, С.А., Килти, К.М., и Вайс, А.С. (2005). Коацервации способствуют молекулярные взаимодействия между сегментом PF2 фибриллина-1 и областью домена 4 тропоэластина. Биохимия 44, 10271–10281. дои: 10.1021/bi050530d
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Корчеро, Дж., Мартин-Партидо, Г., Даллас, Л., и Фернандес-Сальгерро, П. М. (2004). Портальный фиброз печени у мышей с нулевым рецептором диоксина, которые сверхэкспрессируют латентный трансформирующий фактор роста-β-связывающий белок-1. Междунар. Дж. Эксп. Дорожка. 85, 295–302. doi: 10.1111/j.0959-9673.2004.00397.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Даллас, С.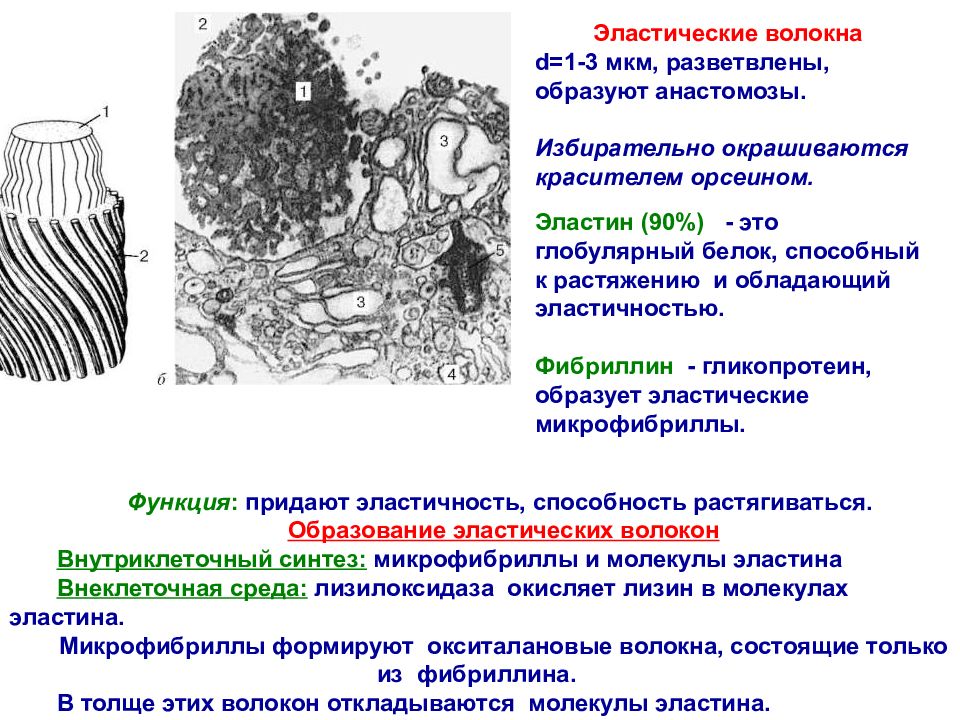 Л., Россер, Дж.Л., Манди, Г.Р., и Боневальд, Л.Ф. (2002). Протеолиз латентного трансформирующего фактора роста-β (TGF-β)-связывающего белка-1 остеокластами. Клеточный механизм высвобождения TGF-β из костного матрикса. Дж. Биол. хим. 277, 21352–21360. doi: 10.1074/jbc.M111663200
Л., Россер, Дж.Л., Манди, Г.Р., и Боневальд, Л.Ф. (2002). Протеолиз латентного трансформирующего фактора роста-β (TGF-β)-связывающего белка-1 остеокластами. Клеточный механизм высвобождения TGF-β из костного матрикса. Дж. Биол. хим. 277, 21352–21360. doi: 10.1074/jbc.M111663200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дешен, А., Sowa, J.P., Gieseler, R.K., Jochum, C., Bechmann, L.P., El Fouly, A., et al. (2010). Острая печеночная недостаточность связана с повышенной жесткостью печени и активацией печеночных клеток. Гепатология 52, 1008–1016. doi: 10.1002/hep.23754
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Desmoulière, A., Darby, I., Costa, A.M.A., Raccurt, M., Tuchweber, B., Sommer, P., et al. (1997). Отложение внеклеточного матрикса, экспрессия лизилоксидазы и дифференцировка миофибробластов на начальных стадиях холестатического фиброза у крыс. Лаб. Вкладывать деньги. 76, 765–778.
Реферат PubMed | Академия Google
Drews, F., Knobel, S., Moser, M., Muhlack, K.G., Mohren, S., Stoll, C., et al. (2008). Нарушение латентного гена связывающего белок-1 трансформирующего фактора роста-β вызывает изменение структуры лица и влияет на биодоступность TGF-β. Биохим. Биофиз. Acta 1783, 34–48. doi: 10.1016/j.bbamcr.2007.08.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дюбюиссон, Л., Lepreux, S., Bioulac-Sage, P., Balabaud, C., Costa, A.M.A., Rosenbaum, J., et al. (2001). Экспрессия и клеточная локализация фибриллина-1 в нормальной и патологической печени человека. J. Гепатол. 34, 514–522. doi: 10.1016/S0168-8278(00)00048-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Duca, L., Blanchevoye, C., Cantarelli, B., Ghoneim, C., Dedieu, S., Delacoux, F., et al. (2007). Комплекс рецептора эластина передает сигналы посредством каталитической активности своей субъединицы Neu-1.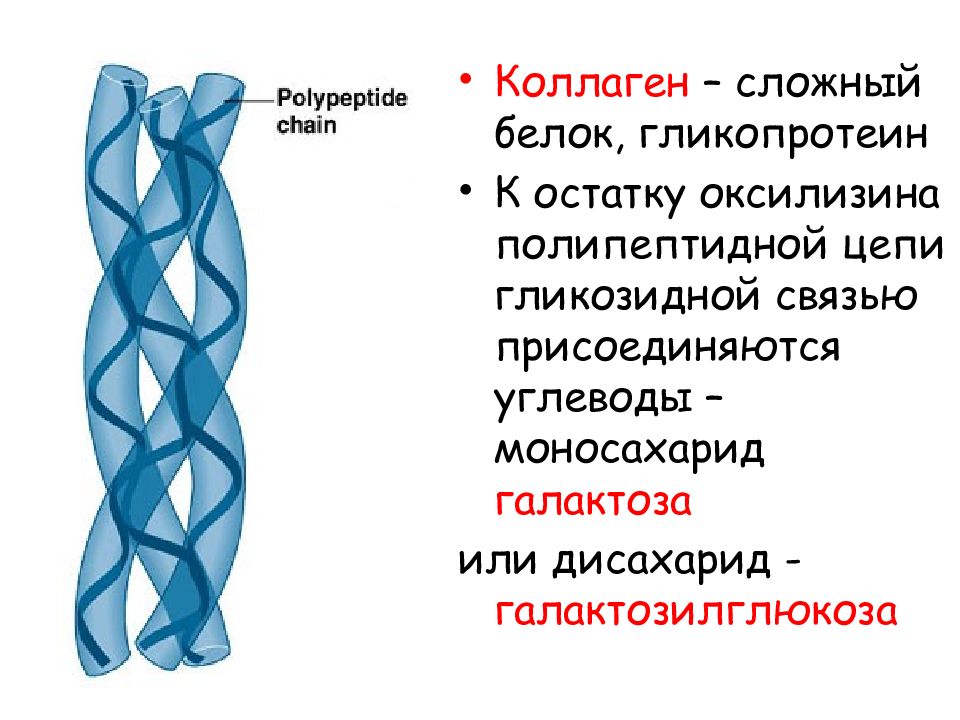 Дж. Биол. хим. 282, 12484–12491. doi: 10.1074/jbc.M609505200
Дж. Биол. хим. 282, 12484–12491. doi: 10.1074/jbc.M609505200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Durmowicz, A.G., Parks, W.C., Hyde, D.M., Mecham, R.P., and Stenmark, K.R. (1994). Стойкость, повторная экспрессия и индукция экспрессии мРНК фибронектина, тропоэластина и проколлагена I типа в легочной артерии при неонатальной гипоксической легочной гипертензии. утра. Дж. Патол. 145, 1411–1420.
Реферат PubMed | Академия Google
Элинг, Дж., Bartneck, M., Fech, V., Butznach, B., Cesati, R., Botnar, R., et al. (2013). Молекулярная МРТ фиброза печени на основе эластина. Гепатология 58, 1517–1518. doi: 10.1002/hep.26332
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эль-Халлоус, Э., Сасаки, Т., Хубмахер, Д., Гети, М., Тидеманн, К., Бринкманн, Дж., и соавт. (2007). Взаимодействия фибриллина-1 с фибулинами зависят от первого гибридного домена и обеспечивают функцию адаптера для тропоэластина. Дж.биол. хим. 282, 8935–8946. doi: 10.1074/jbc.M608204200
Дж.биол. хим. 282, 8935–8946. doi: 10.1074/jbc.M608204200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fausther, M., Goree, J.R., Lavoie, É. Г., Грэм, А.Л., Севиньи, Дж., и Дранофф, Дж.А. (2015). Создание и характеристика клеточных линий портальных миофибробластов крыс. PLoS ONE 10:e0121161. doi: 10.1371/journal.pone.0121161
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Галлай М., Ковальски И., Книттель Т., Нойбауэр, К., Амбруст, Т., и Рамадори, Г. (1996). Экспрессия протеогликанов внеклеточного матрикса перлекана и декорина в печени крыс, поврежденной четыреххлористым углеродом, и в изолированных клетках печени. утра. Дж. Патол. 148, 1463–1471.
Реферат PubMed | Академия Google
Джорджес, П.С., Хуэй, Дж.-Дж., Гомбос, З., Маккормик, М.Е., Ван, А.Ю., Уемура, М., и соавт. (2007). Повышенная жесткость печени крыс предшествует отложению матрикса: значение для фиброза. утра. Дж.Физиол. Гастроинтест. Физиол печени. 293, Г1147–Г1154. doi: 10.1152/ajpgi.00032.2007
утра. Дж.Физиол. Гастроинтест. Физиол печени. 293, Г1147–Г1154. doi: 10.1152/ajpgi.00032.2007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гоннерт Ф.А., Куниш Э., Гайда М., Ламбек С., Вебер М., Клаус Р.А. и соавт. (2012). Фиброз печени в долгосрочной мышиной модели сепсиса. Шок 37, 399–407. дои: 10.1097/SHK.0b013e31824a670b
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гресснер, А. М., Крулл, Н.и Бахем, М. Г. (1994). Регуляция экспрессии протеогликанов в фиброзной печени и культивируемых клетках, накапливающих жир. Путь. Рез. Практика. 190, 864–882. doi: 10.1016/S0344-0338(11)80990-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Guyot, C., Combe, C., and Desmouliere, A. (2006). Перевязка общего желчного протока у крыс: соответствующая модель in vivo для изучения роли механического стресса в поведении клеток и матрикса. Гистохим.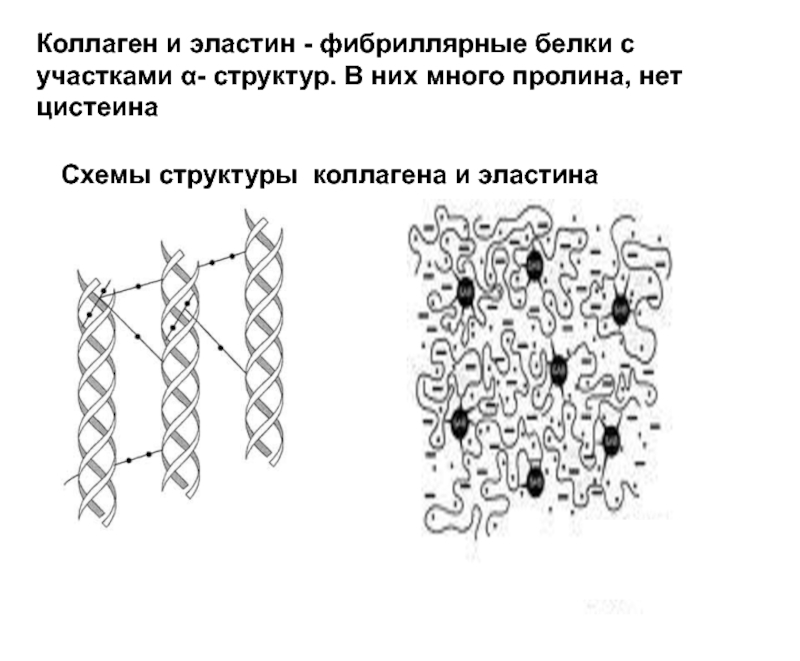 Клеточная биол. 126, 517–523. doi: 10.1007/s00418-006-0185-2
Клеточная биол. 126, 517–523. doi: 10.1007/s00418-006-0185-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хаук, М., Серес, И., Кисс, И., Солнье, Дж., Мохачи, А., Уоллах, Дж., и соавт. (1995). Влияние синтезированных пептидов эластина на лейкоциты человека. Биохим. Мол. биол. Междунар. 37, 45–55.
Реферат PubMed | Академия Google
Хинек А., Пшежецкий А.В., фон Ицштейн М. и Старчер Б. (2006). Лизосомальная сиалидаза (нейраминидаза-1) нацелена на клеточную поверхность в виде мутипротеинового комплекса, который способствует сборке эластических волокон. Дж. Биол. хим. 281, 3698–3710. doi: 10.1074/jbc.M508736200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хираи М., Хоригучи М., Обаяши Т., Кита Т., Чиен К. Р. и Накамура Т. (2007). Латентный TGF-β-связывающий белок 2 связывается с DANCE/fibulin-5 и регулирует сборку эластических волокон. EMBO J. 26, 3283–3295. doi: 10.1038/sj.emboj.7601768
doi: 10.1038/sj.emboj.7601768
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хирани, Р., Ханссен, Э., и Гибсон, Массачусетс (2007). LTBP-2 специфически взаимодействует с аминоконцевой областью фибриллина-1 и конкурирует с LTBP-1 за связывание с этим микрофибриллярным белком. Матрица Биол. 26, 213–223. doi: 10.1016/j.matbio.2006.12.006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Høgåsen, K., Homann, C., Mollnes, T.E., Graudal, N., Hogasen, A.K.M., Hasselqvist, P., et al. (1996). Кластерин и витронектин сыворотки при алкогольном циррозе. Печень 16, 140–146. doi: 10.1111/j.1600-0676.1996.tb00719.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хоэнемсер, А. (1895 г.). Ueber das Vorkommen von elastischern Fasern bei cirrhotischen Prozessen der Leber und Niere. Арх. Дорожка. Анат. Физиол. Клин. Мед. 140, 192–197. дои: 10.1007/BF02116132
Полнотекстовая перекрестная ссылка | Академия Google
Хоригучи М. , Иноуэ Т., Обаяши Т., Хираи М., Нода К., Марморштейн Л.Ю. и др. (2009). Фибулин-4 обеспечивает надлежащий эластогенез посредством взаимодействия со сшивающим ферментом лизилоксидазой. Проц. Натл. акад. науч. США 106, 19029–19034. doi: 10.1073/pnas.0
, Иноуэ Т., Обаяши Т., Хираи М., Нода К., Марморштейн Л.Ю. и др. (2009). Фибулин-4 обеспечивает надлежащий эластогенез посредством взаимодействия со сшивающим ферментом лизилоксидазой. Проц. Натл. акад. науч. США 106, 19029–19034. doi: 10.1073/pnas.0
8106
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Houghton, A.M., Quintero, P.A., Perkins, D.L., Kobayashi, D.K., Kelley, D.G., Marconcini, L.A., et al. (2006). Фрагменты эластина вызывают прогрессирование заболевания в мышиной модели эмфиземы. Дж. Клин. Вкладывать деньги. 116, 753–759. дои: 10.1172/JCI25617
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хунцельманн Н., Ништ Р., Бреннайзен П., Эйкерт А. и Криг Т. (2001). Повышенное отложение фибулина-2 при солнечном эластозе и его колокализация с эластическими волокнами. Бр. Дж. Дерматол. 145, 217–222. doi: 10.1046/j.1365-2133.2001.04337.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Икеда, М. , Наито, М., Кубота, Х., Ishiko, T., Yoshikawa, K., Yamawaki, S., et al. (2009). Сборка эластических волокон нарушается из-за избыточного накопления хондроитинсульфата при кожном фиброзном заболевании, келоиде. Биохим. Биофиз. Рез. коммун. 390, 1221–1228. doi: 10.1016/j.bbrc.2009.10.125
, Наито, М., Кубота, Х., Ishiko, T., Yoshikawa, K., Yamawaki, S., et al. (2009). Сборка эластических волокон нарушается из-за избыточного накопления хондроитинсульфата при кожном фиброзном заболевании, келоиде. Биохим. Биофиз. Рез. коммун. 390, 1221–1228. doi: 10.1016/j.bbrc.2009.10.125
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ивайсако, К., Цзян, К., Чжан, М., Конг, М., Мур-Моррис, Т.Дж., Парк, Т.Дж., и др. (2014). Происхождение миофибробластов в фиброзной печени у мышей. Проц. Натл. акад. науч. США 111, E3297–E3305. doi: 10.1073/pnas.1400062111
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Канта, Дж., и Бартос, Ф. (1978). Образование эластиновых волокон в печени крыс, получавших четыреххлористый углерод. Акта Гепато Гастроэнтерол. 25, 350–352.
Реферат PubMed | Академия Google
Канта, Дж., Дули, С., Дельву, Б., Брейер, С., Д’Амико, Т., и Гресснер, А. М. (2002). Экспрессия тропоэластина повышается во время активации звездчатых клеток печени и в печени крыс CCl 4 с циррозом печени. Печень 22, 220–227. doi: 10.1046/j.0106-9543.2002.01573.x
(2002). Экспрессия тропоэластина повышается во время активации звездчатых клеток печени и в печени крыс CCl 4 с циррозом печени. Печень 22, 220–227. doi: 10.1046/j.0106-9543.2002.01573.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Карник, С.К., Брук, Б.С., Байес-Генис, А., Соренсен, Л., Уайт, Дж.Д., Шварц, Р.С., и соавт. (2003а). Критическая роль передачи сигналов эластина в сосудистом морфогенезе и заболеваниях. Разработка 130, 411–423. doi: 10.1242/dev.00223
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Карник С.К., Wythe, J.D., Sorensen, L., Brooke, B.S., Urness, L.D., и Li, D.Y. (2003b). Эластин индуцирует миофибриллогенез через специфический домен VGVAPG. Матрица Биол. 22, 409–425. doi: 10.1016/S0945-053X(03)00076-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Касамацу, С., Хачия, А., Фуджимура, Т., Шривириянонт, П. , Хакета, К., Висшер, М. О., и соавт. (2011). Существенная роль микрофибриллярно-ассоциированного белка 4 в кожном гомеостазе человека и в его фотозащите. Науч. Респ. 1:164. дои: 10.1038/srep00164
, Хакета, К., Висшер, М. О., и соавт. (2011). Существенная роль микрофибриллярно-ассоциированного белка 4 в кожном гомеостазе человека и в его фотозащите. Науч. Респ. 1:164. дои: 10.1038/srep00164
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хан, С. А., Донг, Х., Джойс, Дж., Сасаки, Т., Чу, М.-Л., и Цуда, Т. (2016). Фибулин-2 необходим для индуцированного ангиотензином II фиброза миокарда, опосредованного трансформирующим фактором роста (TGF)-β. Лаб. Вкладывать деньги. 96, 773–783. doi: 10.1038/labinvest.2016.52
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Киннман, Н.и Хуссет, К. (2002). Перибилиарные миофибробласты при фиброзе печени билиарного типа. Фронт. Бионауч. 47, 496–503. дои: 10.2741/A790
Полнотекстовая перекрестная ссылка | Академия Google
Кинси Р., Уильямсон М.Р., Чаудри С., Меллоди К.Т., Макговерн А., Такахаши С. и др. (2008). Отложение микрофибрилл фибриллина-1 зависит от сборки фибронектина. J. Cell Sci . 121, 2696–2704. doi: 10.1242/jcs.029819
J. Cell Sci . 121, 2696–2704. doi: 10.1242/jcs.029819
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Клаас, М., Кангур Т., Виил Дж., Мяэметс-Аллас К., Минаева А., Вади К. и соавт. (2016). Изменения в составе внеклеточного матрикса направляют восстановление поврежденной ткани печени. Науч. Реп. 6:27398. дои: 10.1038/srep27398
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Knittel, T., Kobold, D., Piscaglia, F., Saile, B., Neubauer, K., Mehde, M., et al. (1999). Локализация миофибробластов печени и звездчатых клеток печени в нормальной и больной печени крыс: различные роли субпопуляций (мио-) фибробластов в восстановлении печеночной ткани. Гистохим. Клеточная биол. 112, 387–401. дои: 10.1007/s004180050421
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кобаяши, Н., Костка, Г., Гарбе, Дж. Х. О., Кин, Д. Р., Бехингер, Х. П., Ханиш, Ф.-Г., и соавт. (2007). Сравнительный анализ семейства белков фибулинов. Биохимическая характеристика, связывающие взаимодействия и локализация в тканях. Дж. Биол. хим. 282, 11805–11816. doi: 10.1074/jbc.M611029200
(2007). Сравнительный анализ семейства белков фибулинов. Биохимическая характеристика, связывающие взаимодействия и локализация в тканях. Дж. Биол. хим. 282, 11805–11816. doi: 10.1074/jbc.M611029200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Коли, К., Saharinen, J., Hyytiäinen, M., Penttinen, C., and Keski-Oja, J. (2001). Латентность, активация и связывание белков TGF-β. Микроск. Рез. Тех. 52, 354–362. doi: 10.1002/1097-0029(20010215)52:4<354::AID-JEMT1020>3.0.CO;2-G
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Козел, Б.А., Ронгиш, Б.Дж., Цирок, А., Зак, Дж., Литтл, К.Д., Дэвис, Э.К., и соавт. (2006). Формирование эластических волокон: динамическое представление сборки внеклеточного матрикса с использованием репортеров-таймеров. Дж. Сотовый. Физиол. 207, 87–96. doi: 10.1002/jcp.20546
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Lamireau, T. , Dubuisson, L., Lepreux, S., Bioulac-Sage, P., Fabre, M., Rosenbaum, J., et al. (2002). Аномальная печеночная экспрессия фибриллина-1 у детей с холестазом. утра. Дж. Сур. Патол. 26, 637–646. дои: 10.1097/00000478-200205000-00010
, Dubuisson, L., Lepreux, S., Bioulac-Sage, P., Fabre, M., Rosenbaum, J., et al. (2002). Аномальная печеночная экспрессия фибриллина-1 у детей с холестазом. утра. Дж. Сур. Патол. 26, 637–646. дои: 10.1097/00000478-200205000-00010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лиминг, Д.J., Karsdal, M.A., Byrjalsen, I., Bendtsen, F., Trebicka, J., Nielsen, M.J., et al. (2013). Новые серологические неоэпитопные маркеры белков внеклеточного матрикса для выявления портальной гипертензии. Алимент. Фармакол. тер. 38, 1086–1096. doi: 10.1111/кв.12484
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Либан, Э., и Унгар, Х. (1959). Эластоз при фиброзных и цирротических процессах печени. Арка АМА. Патол. 68, 331–341.
Реферат PubMed | Академия Google
Li, J., Zhang, Y., Kuruba, R., Gao, X., Gandhi, C.R., Xie, W., et al. (2011). Роль микроРНК-29а в антифиброзном действии фарнезоидного Х-рецептора в звездчатых клетках печени. Мол. Фармакол. 80, 191–200. doi: 10.1124/моль.110.068247
Мол. Фармакол. 80, 191–200. doi: 10.1124/моль.110.068247
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, З., Дранофф, Дж. А., Чан, Э., Уэмуира, М., Севиньи, Дж., и Уэллс, Р. Г. (2007). Трансформирующий фактор роста-β и жесткость субстрата регулируют активацию портальных фибробластов в культуре. Гепатология 46, 1246–1256. doi: 10.1002/hep.21792
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Liu, X., Zhao, Y., Gao, J., Pawlyk, B., Starcher, B., Spencer, J.A., et al. (2004). Для гомеостаза эластических волокон необходим белок, подобный лизилоксидазе 1. Нац. Жене. 36, 178–182. дои: 10.1038/ng1297
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лорена Д., Дарби И. А., Рейнхардт Д. П., Сапин В., Розенбаум Дж.и Десмульер, А. (2004). Экспрессия фибриллина-1 в нормальной и фиброзной печени крыс и в культивируемых печеночных фибробластных клетках: модуляция механическим стрессом и роль в клеточной адгезии. Лаб. Вкладывать деньги. 84, 203–212. doi: 10.1038/labinvest.3700023
Лаб. Вкладывать деньги. 84, 203–212. doi: 10.1038/labinvest.3700023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Lua, I., Li, Y., Zagory, J.A., Wang, K.S., French, S.W., Sévigny, J., et al. (2016). Характеристика звездчатых клеток печени, портальных фибробластов и мезотелиальных клеток в нормальной и фиброзной печени. J. Гепатол. 64, 1137–1146. doi: 10.1016/j.jhep.2016.01.010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мангассер-Стефан, К., Гартунг, К., Ламе, Б., и Гресснер, А. М. (2001). Экспрессия изоформ и вариантов сплайсинга латентного белка, связывающего трансформирующий фактор роста β (LTBP), в культивируемых миофибробластах печени человека. Печень 21, 105–113. doi: 10.1034/j.1600-0676.2001.021002105.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Массам-Ву, Т., Chiu, M., Choudhury, R., Chaudhry, S.S., Baldwin, A.K., McGovern, A.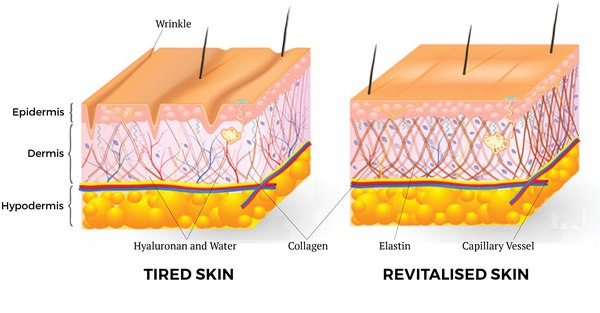 , et al. (2010). Сборка микрофибрилл фибриллина регулирует внеклеточное отложение латентного TGF-β. J. Cell Sci. 123, 3006–3018. doi: 10.1242/jcs.073437
, et al. (2010). Сборка микрофибрилл фибриллина регулирует внеклеточное отложение латентного TGF-β. J. Cell Sci. 123, 3006–3018. doi: 10.1242/jcs.073437
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Морис, П., Блейз, С., Гайрал, С., Дебель, С., Лаффарг, М., Хорнебек, В., и др. (2013). Фрагментация эластина и прогрессирование атеросклероза: концепция эластокинов. Тенденции Сердечно-сосудистые заболевания.Мед. 23, 211–221. doi: 10.1016/j.tcm.2012.12.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
McLaughlin, P.J., Chen, Q., Horiguchi, M., Starcher, B.C., Stanton, J.B., Broekelmann, T.J., et al. (2006). Направленное разрушение фибулина-4 отменяет эластогенез и вызывает перинатальную летальность у мышей. Мол. Клетка. биол. 26, 17:00–17:09. doi: 10.1128/MCB.26.5.1700-1709.2006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Медераке, И., Hsu, C. C., Troeger, J.S., Huebener, P., Mu, X., Dapito, D.H., et al. (2013). Отслеживание судьбы показывает, что звездчатые клетки печени являются доминирующими участниками фиброза печени независимо от его этиологии. Нац. коммун. 4:2823. дои: 10.1038/ncomms3823
C., Troeger, J.S., Huebener, P., Mu, X., Dapito, D.H., et al. (2013). Отслеживание судьбы показывает, что звездчатые клетки печени являются доминирующими участниками фиброза печени независимо от его этиологии. Нац. коммун. 4:2823. дои: 10.1038/ncomms3823
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Mölleken, C., Sitek, B., Henkel, C., Poschmann, G., Sipos, B., Wiese, S., et al. (2009). Обнаружение новых биомаркеров цирроза печени с помощью протеомного анализа. Гепатология 49, 1257–1266. doi: 10.1002/hep.22764
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Муньос-Феликс, Х.М., Гонсалес-Нунес, М., Мартинес-Сальгадо, К., и Лопес-Новоа, Х.М. (2015). Белки TGF-β/BMP как терапевтические мишени при почечном фиброзе. Куда мы пришли после 25 лет испытаний и невзгод? Фармакол. тер. 156, 44–58. doi: 10.1016/j.pharmthera.2015.10.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мерфи-Ульрих, Дж. Э. и Початек М. (2000). Активация латентного TGF-β тромбоспондином-1: механизмы и физиология. Фактор роста цитокинов Ред. 11, 59–69. doi: 10.1016/S1359-6101(99)00029-5
Э. и Початек М. (2000). Активация латентного TGF-β тромбоспондином-1: механизмы и физиология. Фактор роста цитокинов Ред. 11, 59–69. doi: 10.1016/S1359-6101(99)00029-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Myung, S.J., Yoon, J.-H., Gwak, G.-Y., Kim, W., Yang, J.I., Lee, S.H., et al. (2007). Опосредованная желчными кислотами индукция тромбоспондина-1 в гепатоцитах приводит к активации трансформирующего фактора роста-β-зависимой клетки печени. Биохим.Биофиз. Рез. коммун. 353, 1091–1096. doi: 10.1016/j.bbrc.2006.12.157
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Накаяма Х., Ито Х., Кунита С., Курода Н., Хирои М., Мацуура Х. и др. (2008). Наличие перивенулярных эластических волокон при неалкогольном стеатогепатите с фиброзом III стадии. Гистол. Гистопатол. 23, 407–409.
Реферат PubMed | Академия Google
Нгуен, Т.-У., Башур, К.А., и Кишор, В. (2016).Влияние включения эластина в электрохимически выровненные коллагеновые волокна на механические свойства и фенотип мышечных клеток. Биомед. Матер. 11:025008. дои: 10.1088/1748-6041/11/2/025008
Биомед. Матер. 11:025008. дои: 10.1088/1748-6041/11/2/025008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Nielsen, M.J., Lehmann, J., Leeming, D.J., Schierwagen, R., Klein, S., Jansen, C., et al. (2015). Фрагменты циркулирующего эластина не зависят от печеночных, почечных и гемодинамических изменений, но отражают выживаемость при циррозе печени с TIPS. Коп. Дис. науч. 60, 3456–3464. doi: 10.1007/s10620-015-3783-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Очиенг, Дж., Уорфилд, П., Грин-Джарвис, Б., и Фенти, И. (1999). Галектин-3 регулирует адгезивное взаимодействие между клетками карциномы молочной железы и эластином. Дж. Сотовый. Биохим. 75, 505–514.
Реферат PubMed | Академия Google
Page, A., Paoli, P.P., Hill, S.J., Howarth, R., Wu, R., Kweon, S.-M., et al.(2015). Алкоголь напрямую стимулирует эпигенетические модификации звездчатых клеток печени. J. Гепатол. 62, 388–397. doi: 10.1016/j.jhep.2014.09.033
Гепатол. 62, 388–397. doi: 10.1016/j.jhep.2014.09.033
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Pellicoro, A., Aucott, R.L., Ramachandran, P., Robson, A.J., Fallowfield, J.A., Snowdon, V.K., et al. (2012). Накопление эластина регулируется на уровне деградации металлоэластазой макрофагов (ММП-12) при экспериментальном фиброзе печени. Гепатология 55, 1965–1975.doi: 10.1002/hep.25567
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Перепелюк, М., Терадзима, М., Ван, А.Ю., Жорж, П.С., Джанмей, П.А., Ямаути, М., и соавт. (2013). Звездчатые клетки печени и портальные фибробласты являются основными клеточными источниками коллагенов и лизилоксидаз в нормальной печени и в ранние сроки после повреждения. утра. Дж. Физиол. Гастроинтест. Физиол печени. 304, G605–G614. doi: 10.1152/jpgi.00222.2012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пилецкий Б. , Holm, A.T., Schlosser, A., Moeller, J.B., Wohl, A.P., Zuk, A.V., et al. (2016). Характеристика микрофибриллярно-ассоциированного белка 4 (MFAP4) как тропоэластин- и фибриллин-связывающего белка, участвующего в формировании эластических волокон. Дж. Биол. хим. 291, 1103–1114. doi: 10.1074/jbc.M115.681775
, Holm, A.T., Schlosser, A., Moeller, J.B., Wohl, A.P., Zuk, A.V., et al. (2016). Характеристика микрофибриллярно-ассоциированного белка 4 (MFAP4) как тропоэластин- и фибриллин-связывающего белка, участвующего в формировании эластических волокон. Дж. Биол. хим. 291, 1103–1114. doi: 10.1074/jbc.M115.681775
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пискалья Ф., Дудас Дж., Книттель Т., Ди Рокко П., Кобольд Д., Сайле Б. и др. (2009). Экспрессия белков ЕСМ фибулина-1 и -2 при острых и хронических заболеваниях печени и в культивируемых клетках печени крыс. Рез. клеточной ткани. 337, 449–462. doi: 10.1007/s00441-009-0823-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Poiani, G.J., Tozzi, C.A., Yohn, S.E., Pierce, R.A., Belsky, S.A., Berg, R.A., et al. (1990). Метаболизм коллагена и эластина в гипертензивных легочных артериях крыс. Циркуляция рез. 66, 968–978. doi: 10.1161/01.RES. 66.4.968
66.4.968
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пун, С., Тревик, Т.М., Уилсон, М.Р., Истербрук-Смит, С.Б., и Карвер, Дж.А. (2002). Кластерин является внеклеточным шапероном, который специфически взаимодействует с медленно агрегирующими белками на пути их раскладывания. Письмо ФЭБС. 513, 259–266. doi: 10.1016/S0014-5793(02)02326-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Портманн, Б., Таннер, М.С., Моват, А.П., и Уильямс, Р. (1978). Орсеин-положительные отложения в печени при циррозе у детей в Индии. Ланцет 1, 1338–1340. дои: 10.1016/S0140-6736(78)-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Порто Л.С., Шевалье М., Герре С., Хартманн Д.Дж. и Гримо Ж.-А. (1990а). Эластин при алкогольной болезни печени: иммуногистохимическое и иммуноэлектронно-микроскопическое исследование. Путь. Рез. Практика. 186, 668–679. doi: 10.1016/S0344-0338(11)80232-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Порту, Л. К., Шевалье М., Пейрол С., Герре С. и Гримо Ж.-А. (1990b). Эластин в печени человека, павиана и мыши: иммуногистохимическое и иммуноэлектронно-микроскопическое исследование. Анат. Рек. 228, 392–404. doi: 10.1002/ar.10405
К., Шевалье М., Пейрол С., Герре С. и Гримо Ж.-А. (1990b). Эластин в печени человека, павиана и мыши: иммуногистохимическое и иммуноэлектронно-микроскопическое исследование. Анат. Рек. 228, 392–404. doi: 10.1002/ar.10405
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рагхунат М., Бечи Т., Меули М., Альтерматт С., Гобет Р., Брукнер-Тудерман Л. и др. (1996). Экспрессия фибриллина и эластина в коже, регенерирующей из культивированных аутотрансплантатов кератиноцитов: морфогенез микрофибрилл начинается в дермо-эпидермальном соединении и предшествует образованию эластических волокон. Дж. Инвест. Дерматол. 106, 1090–1095. дои: 10.1111/1523-1747.ep12339373
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Reddel, C.J., Cultrone, D., Rnjak-Kovacina, J., Weiss, A.S., and Burgess, J.K. (2013). Тропоэластин модулирует индуцированную TGF-β1 экспрессию VEGF и CTGF в гладкомышечных клетках дыхательных путей.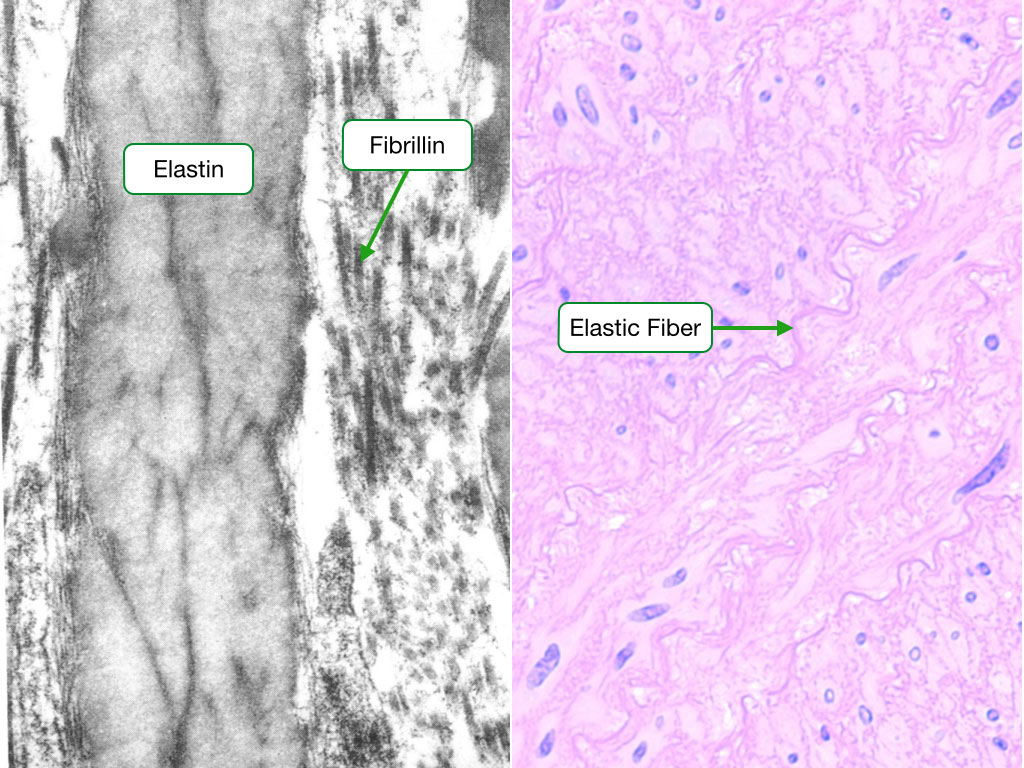 Матрица Биол. 32, 407–413. doi: 10.1016/j.matbio.2013.04.003
Матрица Биол. 32, 407–413. doi: 10.1016/j.matbio.2013.04.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Редлих, М., Roos, H.A., Reichenberg, E., Zaks, B., Mussig, D., Baumert, U., et al. (2004). Экспрессия тропоэластина в фибробластах периодонтальной связки человека после моделирования ортодонтической силы. Арх. Оральный биол. 49, 119–124. doi: 10.1016/j.archoralbio.2003.08.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рейнбот Б., Ханссен Э., Клири Э. Г. и Гибсон М. А. (2002). Молекулярные взаимодействия бигликана и декорина с компонентами эластических волокон.Бигликан образует тройной комплекс с тропоэластином и ассоциированным с микрофибриллами гликопротеином 1. J. Biol. хим. 277, 3950–3957. doi: 10.1074/jbc.M109540200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рорк, Э.Ф., Кин, Д.Р., Хауденшильд, К.С., Година, С., Литтл, К. Д., и Аргрейвс, В.С. (1995). Ассоциация фибулина-1 человека с эластическими волокнами: иммуногистологическое, ультраструктурное и РНК-исследование. J. Histochem. Цитохим. 43, 401–411.дои: 10.1177/43.4.7534784
Д., и Аргрейвс, В.С. (1995). Ассоциация фибулина-1 человека с эластическими волокнами: иммуногистологическое, ультраструктурное и РНК-исследование. J. Histochem. Цитохим. 43, 401–411.дои: 10.1177/43.4.7534784
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Робертсон И. Б., Хоригучи М., Зильберберг Л., Дабович Б., Хаджиолова К. и Рифкин Д. Б. (2015). Латентные TGF-β-связывающие белки. Матрица Биол. 47, 44–53. doi: 10.1016/j.matbio.2015.05.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Робине, А., Фахем, А., Кошар, Ж.-Х., Юэ, Э., Винсент, Л., Лоримье, С., и др. (2005). Пептиды, полученные из эластина, усиливают ангиогенез, способствуя миграции эндотелиальных клеток и тубулогенезу посредством активации MT1-MMP. J. Cell Sci. 118, 343–356. doi: 10.1242/jcs.01613
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Rock, M.J., Cain, S.A., Freeman, L. J., Morgan, A., Mellody, K., Marson, A., et al. (2004). Молекулярные основы образования эластических волокон. Критические взаимодействия и перекрестная связь тропоэластин-фибриллин-1. Дж. Биол. хим. 279, 23748–23758. doi: 10.1074/jbc.M400212200
J., Morgan, A., Mellody, K., Marson, A., et al. (2004). Молекулярные основы образования эластических волокон. Критические взаимодействия и перекрестная связь тропоэластин-фибриллин-1. Дж. Биол. хим. 279, 23748–23758. doi: 10.1074/jbc.M400212200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Роджерс, Ю.Р. и Вайс, А.С. (2004). Интегрин α v β 3 связывается с уникальным не-RGD сайтом вблизи С-конца тропоэластина человека. Биохимия 86, 173–178. doi: 10.1016/j.biochi.2004.03.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Роскамс Т., Розенбаум Дж., Де Вос Р., Дэвид Г. и Десмет В. (1996). Экспрессия протеогликана гепарансульфата при хронических холестатических заболеваниях печени человека. Гепатология 24, 524–532. дои: 10.1002/геп.510240310
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Rucker, R.B., Kosonen, T., Clegg, M. S., Mitchell, A.E., Rucker, B.R., Uriu-Hare, J.Y., et al. (1998). Сшивание меди, лизилоксидазы и белка внеклеточного матрикса. утра. Дж. Клин. Нутр. 67 (доп.), 996S–1002S.
S., Mitchell, A.E., Rucker, B.R., Uriu-Hare, J.Y., et al. (1998). Сшивание меди, лизилоксидазы и белка внеклеточного матрикса. утра. Дж. Клин. Нутр. 67 (доп.), 996S–1002S.
Реферат PubMed | Академия Google
Райан, А. Дж., и О’Брайен, Ф. Дж. (2015). Нерастворимый эластин снижает жесткость коллагенового каркаса, улучшает вязкоупругие свойства и индуцирует сократительный фенотип гладкомышечных клеток. Биоматериалы 73, 296–307. doi: 10.1016/j.biomaterials.2015.09.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Sækmose, S.G., Mössner, B., Christensen, P.B., Lindvig, K., Schlosser, A., Holst, R., et al. (2015). Белок 4, ассоциированный с микрофибриллярами: потенциальный биомаркер для скрининга фиброза печени в смешанной когорте пациентов. PLoS ONE 10:e0140418. doi: 10.1371/journal.pone.0140418
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Секмосе, С.Г., Шлоссер А. , Холст Р., Йоханссон С.Л., Вульф-Йоханссон Х., Торне И. и соавт. (2013). Иммуноферментный анализ, характеризующий базальную изменчивость и наследуемость системного микрофибриллярно-ассоциированного белка 4. PLoS ONE 8:e82383. doi: 10.1371/journal.pone.0082383
, Холст Р., Йоханссон С.Л., Вульф-Йоханссон Х., Торне И. и соавт. (2013). Иммуноферментный анализ, характеризующий базальную изменчивость и наследуемость системного микрофибриллярно-ассоциированного белка 4. PLoS ONE 8:e82383. doi: 10.1371/journal.pone.0082383
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сато Ф., Вачи Х., Исида М., Нонака Р., Оноуэ С., Урбан З. и др. (2007). Для образования эластических волокон необходимы четкие этапы поперечного связывания, самоассоциации и созревания тропоэластина. Дж. Мол. биол. 369, 841–851. doi: 10.1016/j.jmb.2007.03.060
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сато Ю., Рен К. С., Харада К., Сасаки М., Морикава Х., Сиоми С. и др. (2011). Индукция экспрессии эластина в эндотелиальных клетках сосудов связана с гепатопортальным склерозом при идиопатической портальной гипертензии: возможная связь с антителами к эндотелиальным клеткам в сыворотке. клин. Эксп. Иммунол. 167, 532–542. doi: 10.1111/j.1365-2249.2011.04530.х
клин. Эксп. Иммунол. 167, 532–542. doi: 10.1111/j.1365-2249.2011.04530.х
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сато Ю., Савада С. и Наканума Ю. (2008). Фибулин-5 участвует в флебосклерозе крупных ветвей воротной вены, связанном с отложением эластических волокон при идиопатической портальной гипертензии. Гепатол. Рез. 38, 166–173. doi: 10.1111/j.1872-034X.2007.00253.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шойер, П.Дж., и Мэгги, Г. (1980). Фиброз и коллапс печени: гистологическое различие при окрашивании орсеином. Гистопатология 4, 487–490. doi: 10.1111/j.1365-2559.1980.tb02943.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Sengle, G., Charbonneau, N.L., Ono, R.N., Sasaki, T., Alvarez, J., Keene, D.R., et al. (2008). Нацеливание костных морфогенетических белковых комплексов фактора роста на фибриллин. Дж. Биол. хим. 283, 13874–13888. doi: 10.1074/jbc.M707820200
283, 13874–13888. doi: 10.1074/jbc.M707820200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шапиро, С.Д., Эндикотт, С.К., Провинс, Массачусетс, Пирс, Дж.А., и Кэмпбелл, Э.Дж. (1991). Заметная продолжительность жизни паренхиматозных эластических волокон легких человека обусловлена преобладанием D-аспартата и радиоуглерода, связанного с ядерным оружием. Дж. Клин. Вкладывать деньги. 87, 1828–1834 гг. DOI: 10.1172/JCI115204
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ширацути Э., Накаба М. и Ямада М. (2016). Гидролизат эластина, полученный из рыбы, усиливает пролиферацию фибробластов кожи человека и синтез эластина в фибробластах кожи человека и улучшает состояние кожи. J. Sci. Фуд Агрик. 96, 1672–1677. doi: 10.1002/jsfa.7270
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Siegel, R.C., Chen, K.H., Greenspan, J.S., и Aguiar, J.M. (1978). Биохимическое и иммунохимическое исследование лизилоксидазы при экспериментальном фиброзе печени у крыс. Проц. Натл. акад. науч. США 75, 2945–2949. doi: 10.1073/pnas.75.6.2945
Биохимическое и иммунохимическое исследование лизилоксидазы при экспериментальном фиброзе печени у крыс. Проц. Натл. акад. науч. США 75, 2945–2949. doi: 10.1073/pnas.75.6.2945
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сильва, Л.М., Фернандес, А.Л.М., Барбоза, А.младший, Оливейра, И.Р., и Андраде, З.А. (2000). Значение модуляции шистосомальной гранулемы. Мем. Инст. Освальдо Крус 95, 353–361. дои: 10.1590/S0074-02762000000300010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Стоун, П.Дж. (2000). Возможное использование маркеров деградации коллагена и эластина для мониторинга фиброза печени при шистосомозе. Acta Trop. 77, 97–99. doi: 10.1016/S0001-706X(00)00118-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сугимото, Х., Yang, C., LeBleu, V.S., Soubasakos, M.A., Giraldo, M., Zeisberg, M., et al. (2007). BMP-7 функционирует как новый гормон, способствующий регенерации печени. FASEB J. 21, 256–264. doi: 10.1096/fj.06-6837com
FASEB J. 21, 256–264. doi: 10.1096/fj.06-6837com
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сатклифф, М.С., и Дэвидсон, Дж.М. (1990). Влияние статического растяжения на выработку эластина гладкомышечными клетками аорты свиньи. Матрица 10, 148–153. дои: 10.1016/S0934-8832(11)80163-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Татраи, П., Egedi, K., Somorácz, A., van Kuppevelt, T.H., Ten Dam, G., Lyon, M., et al. (2010). Количественные и качественные изменения гепарансульфата при фиброгенных заболеваниях печени и гепатоцеллюлярном раке. J. Histochem. Цитохим. 58, 429–441. doi: 10.1369/jhc.2010.955161
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тунг, С. Н., и Гербер, Массачусетс (1982). Образование эластических волокон в печени при массивном некрозе печени. Арх. Патол. лабораторияМед. 106, 468–469.
Реферат PubMed | Академия Google
Trask, B. C., Trask, T.M., Broekelmann, T., and Mecham, R.P. (2000). Микрофибриллярные белки MAGP-1 и фибриллин-1 образуют тройной комплекс с хондроитинсульфатным протеогликаном декорином. Мол. биол. Ячейка 11, 1499–1507. doi: 10.1091/mbc.11.5.1499
C., Trask, T.M., Broekelmann, T., and Mecham, R.P. (2000). Микрофибриллярные белки MAGP-1 и фибриллин-1 образуют тройной комплекс с хондроитинсульфатным протеогликаном декорином. Мол. биол. Ячейка 11, 1499–1507. doi: 10.1091/mbc.11.5.1499
Реферат PubMed | Полнотекстовая перекрестная ссылка
Цуруга, Э., Ядзима, Т., и Ирие, К. (2004). Индукция гена фибулина-5 регулируется геном тропоэластина и коррелирует с накоплением тропоэластина in vitro . Междунар. Дж. Биохим. Клеточная биол. 36, 395–400. doi: 10.1016/S1357-2725(03)00238-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цуруга, Э., Ядзима, Т., и Ирие, К. (2005). Связанный с микрофибриллами гликопротеин-1 и фибрилин-2 связаны с отложением тропоэластина in vitro . Междунар. Дж. Биохим. Клеточная биол. 37, 120–129. doi: 10.1016/j.biocel.2004.06.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вадаш, З. , Кесслер О., Акири Г., Генгринович С., Каган Х.М., Барух Ю. и соавт. (2005). Аномальное отложение коллагена вокруг гепатоцитов при болезни Вильсона связано со специфичной для гепатоцитов экспрессией лизилоксидазы и лизилоксидазоподобного белка-2. J. Гепатол. 43, 499–507. doi: 10.1016/j.jhep.2005.02.052
, Кесслер О., Акири Г., Генгринович С., Каган Х.М., Барух Ю. и соавт. (2005). Аномальное отложение коллагена вокруг гепатоцитов при болезни Вильсона связано со специфичной для гепатоцитов экспрессией лизилоксидазы и лизилоксидазоподобного белка-2. J. Гепатол. 43, 499–507. doi: 10.1016/j.jhep.2005.02.052
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Велебны, В., Касафирек, Э., и Канта, Дж. (1983). Содержание десмозина и изодесмозина и активность эластазы в нормальной и цирротической печени крыс. Биохим. Дж. 214, 1023–1025. дои: 10.1042/bj2141023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вати Х., Сеяма Ю., Ямасита С., Суганами Х., Уэмура Ю., Окамото К. и др. (1995). Стимуляция пролиферации клеток и ауторегуляция экспрессии эластина с помощью эластинового пептида VPGVG в культивируемых гладкомышечных клетках сосудов кур. Письмо ФЭБС. 368, 215–219. дои: 10.1016/0014-5793(95)00641-L
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вайнбаум, Дж. S., Broekelman, T.J., Pierce, R.A., Werneck, C.C., Segade, F., Craft, C.S., et al. (2008). Дефицит гликопротеина-1, ассоциированного с микрофибриллами, приводит к сложным фенотипам во многих системах органов. Дж. Биол. хим. 283, 25533–25543. doi: 10.1074/jbc.M709962200
S., Broekelman, T.J., Pierce, R.A., Werneck, C.C., Segade, F., Craft, C.S., et al. (2008). Дефицит гликопротеина-1, ассоциированного с микрофибриллами, приводит к сложным фенотипам во многих системах органов. Дж. Биол. хим. 283, 25533–25543. doi: 10.1074/jbc.M709962200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wipff, P.-J., and Hinz, B. (2008). Интегрины и активация латентного трансформирующего фактора роста β1 – тесная связь. евро.Дж. Клеточная биология. 87, 601–615. doi: 10.1016/j.ejcb.2008.01.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wise, S.G., Yeo, G.C., Hiob, M.A., Rnjak-Kovacina, J., Kaplan, D.L., Ng, M.K., et al. (2014). Тропоэластин: универсальный биоактивный сборочный модуль. Акта Биоматер. 10, 1532–1541. doi: 10.1016/j.actbio.2013.08.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вульф-Йоханссон, Х., Йоханссон, С. Л., Schlosser, A., Holm, A.T., Rasmussen, L.M., Mickley, H., et al. (2013). Локализация микрофибриллярно-ассоциированного белка 4 (MFAP4) в тканях человека: клиническая оценка MFAP4 в сыворотке и его связь с различными сердечно-сосудистыми заболеваниями. PLoS ONE 8:e82243. doi: 10.1371/journal.pone.0082243
Л., Schlosser, A., Holm, A.T., Rasmussen, L.M., Mickley, H., et al. (2013). Локализация микрофибриллярно-ассоциированного белка 4 (MFAP4) в тканях человека: клиническая оценка MFAP4 в сыворотке и его связь с различными сердечно-сосудистыми заболеваниями. PLoS ONE 8:e82243. doi: 10.1371/journal.pone.0082243
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ясуи Ю., Абэ Т., Куросаки М., Хигути М., Комияма Ю., Йошида Т. и др. (2016). Накопление эластиновых волокон в печени коррелирует с развитием гепатоцеллюлярной карциномы. PLoS ONE 11:e0154558. doi: 10.1371/journal.pone.0160133
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Юань Ю. и Кориа П. (2016). Пролиферативная активность эластин-подобных пептидов зависит от заряда и фазового перехода. Дж. Биомед. Матер. Рез. 104, 697–706. doi: 10.1002/jbm.a.35609
Полнотекстовая перекрестная ссылка | Академия Google
Занетти М. , Брагетта П., Сабателли П., Мура И., Долиана Р., Коломбатти А. и др.(2004). Дефицит EMILIN-1 вызывает эластогенез и дефекты сосудистых клеток. Мол. Клетка. биол. 24, 638–650. doi: 10.1128/MCB.24.2.638-650.2004
, Брагетта П., Сабателли П., Мура И., Долиана Р., Коломбатти А. и др.(2004). Дефицит EMILIN-1 вызывает эластогенез и дефекты сосудистых клеток. Мол. Клетка. биол. 24, 638–650. doi: 10.1128/MCB.24.2.638-650.2004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhang, H., Apfelroth, S.D., Hu, W., Davis, E.C., Sanguinetti, C., Bonadio, J., et al. (1994). Структура и экспрессия фибриллина-2, нового микрофибриллярного компонента, преимущественно расположенного в эластичных матрицах. J. Cell Biol. 124, 855–863. дои: 10.1083/jcb.124.5.855
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zilberberg, L., Todorovic, V., Dabovic, B., Horiguchi, M., Courussé, T., Sakai, L., et al. (2012). Специфичность включения латентного TGF-β-связывающего белка (LTBP) в матрикс: роль фибриллинов и фибронектина. Дж. Сотовый. Физиол. 227, 3828–3836. doi: 10.1002/jcp.24094
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
границ | Сборка тропоэластина и эластина
Эластичные волокна и эластин
Эластические волокна присутствуют во внеклеточном матриксе (ECM) тканей позвоночных, таких как кожа, легкие, сердечно-сосудистая система, хрящи и сухожилия. Они повсеместно распространены среди большинства позвоночных, кроме низших позвоночных, таких как виды из надкласса Agnatha (бесчелюстные рыбы) (Debelle and Tamburro, 1999). Эластичные волокна обеспечивают тканям механическую устойчивость, долговечность и клеточную интерактивность, которые поддерживают широкий спектр специализированных функций.
Они повсеместно распространены среди большинства позвоночных, кроме низших позвоночных, таких как виды из надкласса Agnatha (бесчелюстные рыбы) (Debelle and Tamburro, 1999). Эластичные волокна обеспечивают тканям механическую устойчивость, долговечность и клеточную интерактивность, которые поддерживают широкий спектр специализированных функций.
Эластические волокна примерно на 90% состоят из эластина, а остальные компоненты в основном состоят из фибриллиновых гликопротеинов (Mecham, 1991).Таким образом, эластин в значительной степени отвечает за свойства эластических волокон. Наиболее важным из этих свойств является способность подвергаться множеству циклов растяжения-отдачи при сохранении структурной и функциональной целостности эластичных тканей на протяжении всей жизни организма. Способность растягиваться и сжиматься обусловлена биохимическими свойствами мономера эластина, тропоэластина (обсуждается ниже). Кроме того, эластин удивительно долговечен, поскольку он в основном откладывается во время внутриутробного развития и в детстве и редко синтезируется во взрослом возрасте. Его предполагаемый период полураспада составляет 70 лет (Shapiro et al., 1991) из-за его обширных поперечных связей и высокой гидрофобности, которые делают его устойчивым к деградации (Vrhovski and Weiss, 1998; Schrader et al., 2018; Hedtke et al. др., 2019).
Его предполагаемый период полураспада составляет 70 лет (Shapiro et al., 1991) из-за его обширных поперечных связей и высокой гидрофобности, которые делают его устойчивым к деградации (Vrhovski and Weiss, 1998; Schrader et al., 2018; Hedtke et al. др., 2019).
Тропоэластин
Субъединица эластина, тропоэластин, представляет собой растворимый белок с молекулярной массой 60–70 кДа, который интенсивно изучался в течение последних трех десятилетий. Тропоэластин представляет собой пружинообразную молекулу, которая чрезвычайно растяжима до образования поперечных связей. Одна молекула тропоэластина может растягиваться в восемь раз больше своей длины в состоянии покоя и имеет модуль Юнга (жесткость при растяжении) около 3 кПа (Baldock et al., 2011) по сравнению с растяжимостью эластина 150% и жесткостью ~1 мПа (Aaron and Gosline, 1981). Тропоэластин претерпевает минимальные потери энергии во время растяжения, подобно другим полимерам, таким как каучук и резилин (Elvin et al., 2005; Cordier et al.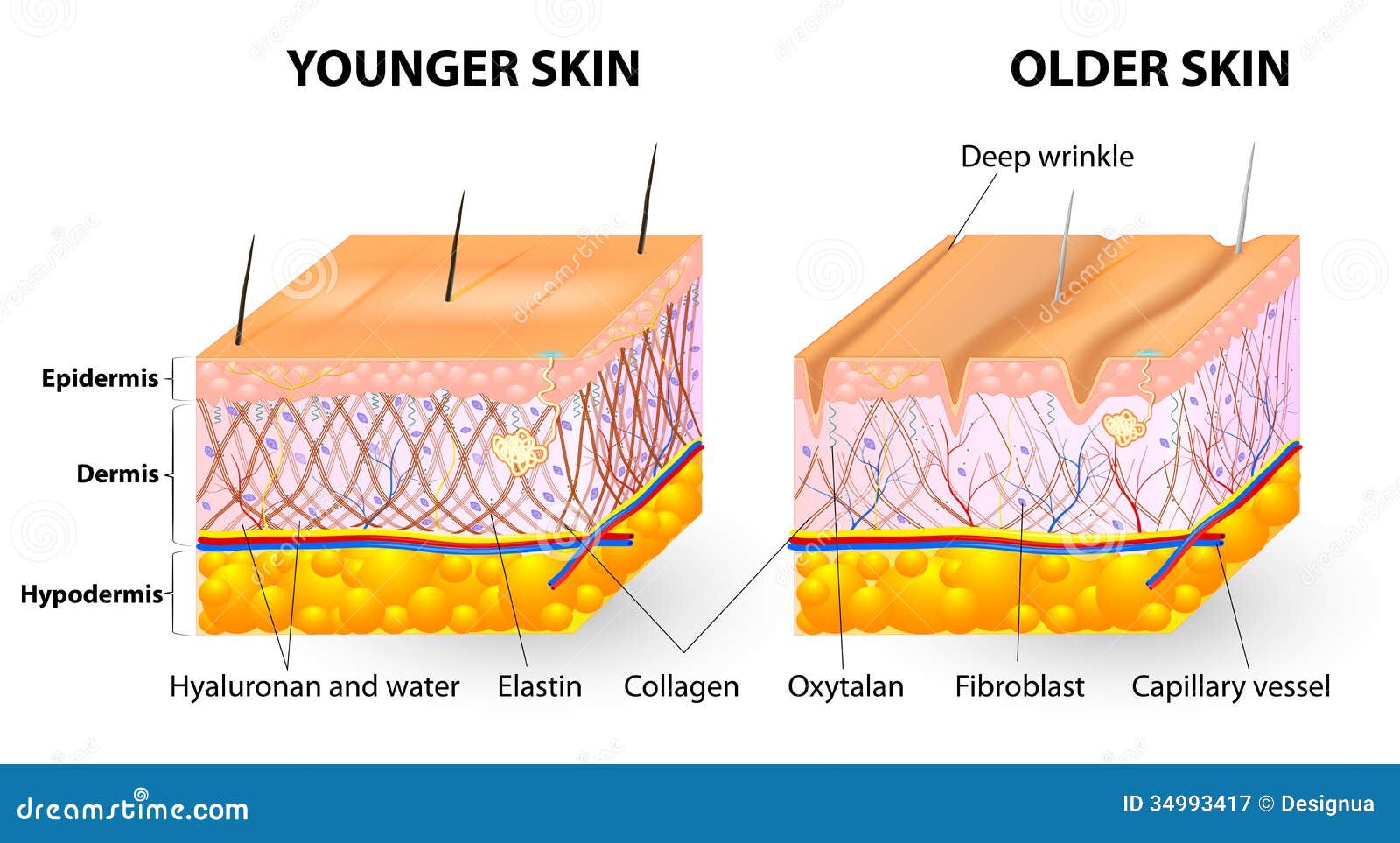 , 2008; Baldock et al., 2011). Эти замечательные свойства возникают из-за его последовательности и структуры, которые делают тропоэластин структурно очень гибким, но не неупорядоченным (Tarakanova et al., 2018). В дополнение к его участию в молекулярной эластичности гибкость тропоэластина также является ключевым требованием для самосборки в эластин, при этом мутации, которые нарушают этот процесс, оказывают вредное воздействие на ткани (Yeo et al., 2016, 2017). Вместе эти два свойства можно настраивать и использовать для создания все большего числа новых биоматериалов для тканевой инженерии и регенеративной медицины, которые недавно рассматривались в другом месте (Wang et al., 2020; Wen et al., 2020).
, 2008; Baldock et al., 2011). Эти замечательные свойства возникают из-за его последовательности и структуры, которые делают тропоэластин структурно очень гибким, но не неупорядоченным (Tarakanova et al., 2018). В дополнение к его участию в молекулярной эластичности гибкость тропоэластина также является ключевым требованием для самосборки в эластин, при этом мутации, которые нарушают этот процесс, оказывают вредное воздействие на ткани (Yeo et al., 2016, 2017). Вместе эти два свойства можно настраивать и использовать для создания все большего числа новых биоматериалов для тканевой инженерии и регенеративной медицины, которые недавно рассматривались в другом месте (Wang et al., 2020; Wen et al., 2020).
Ген тропоэластина и его экспрессия
Тропоэластин кодируется геном ELN, который присутствует у всех позвоночных, кроме бесчелюстных рыб (Chung et al., 2006). Большинство организмов содержат одну копию ELN, кроме костистых и амфибий, которые, в частности, обладают двумя различными типами генов ELN (He et al. , 2007; Мяо и др., 2007, 2009). Ген ELN человека расположен на длинном плече хромосомы 7q11.2 и состоит из 34 экзонов, расположенных между длинными интронами (Indik et al., 1987, 1989; Bashir et al., 1989). ELN человека дает начало большому разнообразию изоформ сплайсинга, причем альтернативный сплайсинг наблюдается с экзонами 22, 23, 24, 26A, 32 и 33 (Fazio et al., 1988; Parks et al., 1992), что приводит к 13 известные человеческие изоформы зрелого белка тропоэластина (Reichheld et al., 2019). Наиболее часто исследуемая изоформа содержит домен 26А и не имеет домена 22, и преимущественно обнаруживается в эластических тканях (Indik et al., 1987; Врховский и др., 1997).
, 2007; Мяо и др., 2007, 2009). Ген ELN человека расположен на длинном плече хромосомы 7q11.2 и состоит из 34 экзонов, расположенных между длинными интронами (Indik et al., 1987, 1989; Bashir et al., 1989). ELN человека дает начало большому разнообразию изоформ сплайсинга, причем альтернативный сплайсинг наблюдается с экзонами 22, 23, 24, 26A, 32 и 33 (Fazio et al., 1988; Parks et al., 1992), что приводит к 13 известные человеческие изоформы зрелого белка тропоэластина (Reichheld et al., 2019). Наиболее часто исследуемая изоформа содержит домен 26А и не имеет домена 22, и преимущественно обнаруживается в эластических тканях (Indik et al., 1987; Врховский и др., 1997).
Различия в относительном количестве альтернативно сплайсированных транскриптов мРНК ELN наблюдались между тканями, и считается, что это разнообразие необходимо для тонкой настройки механических характеристик тканей в соответствии с их уникальными функциональными требованиями (Reichheld et al., 2019) . Действительно, исследования, изучающие последствия вставок и делеций доменов, отмечают изменения внутренней функциональности тропоэластина, подтверждая гипотезу о том, что вставки и делеции доменов приводят к изменению механики ткани (Jensen et al.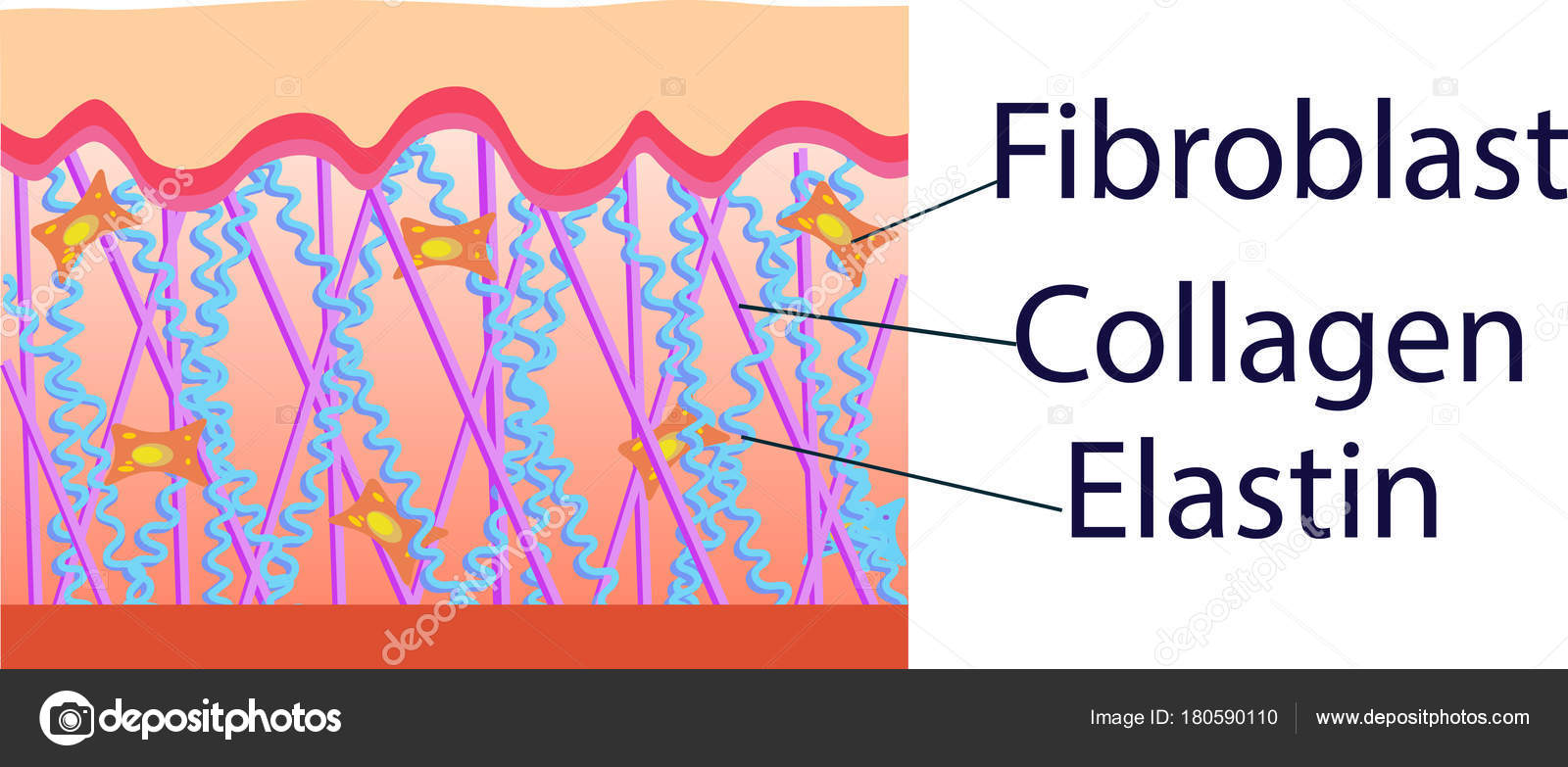 , 2000; Козел и др., 2003; Йео и др., 2016; Мяо и др., 2017). Теория изоформ-функции дополнительно подкрепляется присутствием двух различных генов ELN у костистых рыб, которые по-разному экспрессируются как в пространстве, так и во времени во время развития (Miao et al., 2007). Свойства самосборки и наноструктура этих дополнительных изоформ костистых костей еще предстоит исследовать.
, 2000; Козел и др., 2003; Йео и др., 2016; Мяо и др., 2017). Теория изоформ-функции дополнительно подкрепляется присутствием двух различных генов ELN у костистых рыб, которые по-разному экспрессируются как в пространстве, так и во времени во время развития (Miao et al., 2007). Свойства самосборки и наноструктура этих дополнительных изоформ костистых костей еще предстоит исследовать.
Последовательность
Каждый издоменов тропоэластина возникает из отдельных экзонов гена ELN. Их можно разделить на «гидрофобные» или «сшивающие» в зависимости от их функциональности и содержания аминокислот (рис. 1).Первичная последовательность тропоэластина имеет низкую сложность и содержит повторяющиеся мотивы. Кроме того, гидрофобные и сшивающие домены тропоэластина расположены в чередующемся порядке на протяжении большей части молекулы, что приводит к повторению как междоменного, так и внутридоменного уровня.
Рисунок 1. Последовательность тропоэластина и расположение доменов. Тропоэластин представляет собой белок низкой сложности как на первичном, так и на вторичном уровне последовательности. Его гидрофобные (розовые) и сшивающие (синие) домены состоят из повторяющихся мотивов, которые вносят уникальный вклад в сборку эластина.Гидрофобные домены содержат алифатические аминокислоты с вариантами пролина, которые обеспечивают гибкость и способность собираться в структуры более высокого порядка. Сшивающие домены обогащены мотивами Lys-Pro (KP) или Lys-Ala (KA) и образуют поперечные связи, которые связывают растущие цепи тропоэластина во время эластогенеза; обратите внимание, что экзон 6 кодирует домен KA. С-концевой домен 36 тропоэластина (желтый) не попадает ни в одну из категорий, поскольку он содержит отдельную последовательность, закрытую мотивом Gly-Arg-Lys-Arg-Lys (GRKRK), и в основном участвует в клеточных взаимодействиях.
Тропоэластин представляет собой белок низкой сложности как на первичном, так и на вторичном уровне последовательности. Его гидрофобные (розовые) и сшивающие (синие) домены состоят из повторяющихся мотивов, которые вносят уникальный вклад в сборку эластина.Гидрофобные домены содержат алифатические аминокислоты с вариантами пролина, которые обеспечивают гибкость и способность собираться в структуры более высокого порядка. Сшивающие домены обогащены мотивами Lys-Pro (KP) или Lys-Ala (KA) и образуют поперечные связи, которые связывают растущие цепи тропоэластина во время эластогенеза; обратите внимание, что экзон 6 кодирует домен KA. С-концевой домен 36 тропоэластина (желтый) не попадает ни в одну из категорий, поскольку он содержит отдельную последовательность, закрытую мотивом Gly-Arg-Lys-Arg-Lys (GRKRK), и в основном участвует в клеточных взаимодействиях.
тропоэластина преимущественно состоит из неполярных остатков, включая глицин, валин, аланин и пролин (Debelle and Tamburro, 1999). Гидрофобные домены содержат повторы и вариации мотивов Val-Pro-Gly-Val-Gly (рис. 1), что приводит к вышеупомянутой низкой сложности последовательности (Foster et al., 1973; Gray et al., 1973). Гидрофобные домены различаются по длине: большинство более коротких (9–5 остатков) доменов расположены вблизи N-конца, тогда как более длинные (до 55 остатков) домены находятся в центральной и С-концевой областях тропоэластина (Indik et al. др., 1989). Гидрофобные домены были тщательно изучены и ответственны за способность тропоэластина к самосборке (Vrhovski et al., 1997; Toonkool et al., 2001).
Гидрофобные домены содержат повторы и вариации мотивов Val-Pro-Gly-Val-Gly (рис. 1), что приводит к вышеупомянутой низкой сложности последовательности (Foster et al., 1973; Gray et al., 1973). Гидрофобные домены различаются по длине: большинство более коротких (9–5 остатков) доменов расположены вблизи N-конца, тогда как более длинные (до 55 остатков) домены находятся в центральной и С-концевой областях тропоэластина (Indik et al. др., 1989). Гидрофобные домены были тщательно изучены и ответственны за способность тропоэластина к самосборке (Vrhovski et al., 1997; Toonkool et al., 2001).
Сшивающие домены определяются лизинами, которые ответственны за образование прочных би-, три- и тетрафункциональных поперечных связей в зрелом эластине. Сшивающие домены можно подразделить на домены KP или KA, которые обозначают аминокислоты (пролин или аланин соответственно), которые соседствуют с лизинами (рис. 1).KP-домены обнаруживаются ближе к N-концу, тогда как KA-домены ближе к C-концу и включают аланиновые тракты (Indik et al. , 1987). В отличие от гидрофобных доменов сшивающие домены сами по себе не способны к самосборке; таким образом, они были изучены в контексте сшивания биоматериалов, полученных из эластина (Annabi et al., 2017; Yue et al., 2017). Сшивающие домены способны модулировать самосборку при включении в пептиды и биоматериалы, полученные из гидрофобных доменов тропоэластина.Например, их включение в пептиды, полученные из гидрофобных доменов, приводит к уменьшению времени, необходимого для самосборки, скорее всего, из-за их благоприятного взаимодействия с водным растворителем (Miao et al., 2003). Модулирующие эффекты также наблюдаются в тропоэластине полной длины, где нарушения в домене 26 уменьшают самосборку (Jensen et al., 2000), подчеркивая контекст первичной последовательности в структурах более высокого порядка.
, 1987). В отличие от гидрофобных доменов сшивающие домены сами по себе не способны к самосборке; таким образом, они были изучены в контексте сшивания биоматериалов, полученных из эластина (Annabi et al., 2017; Yue et al., 2017). Сшивающие домены способны модулировать самосборку при включении в пептиды и биоматериалы, полученные из гидрофобных доменов тропоэластина.Например, их включение в пептиды, полученные из гидрофобных доменов, приводит к уменьшению времени, необходимого для самосборки, скорее всего, из-за их благоприятного взаимодействия с водным растворителем (Miao et al., 2003). Модулирующие эффекты также наблюдаются в тропоэластине полной длины, где нарушения в домене 26 уменьшают самосборку (Jensen et al., 2000), подчеркивая контекст первичной последовательности в структурах более высокого порядка.
Другой примечательной областью является домен 36, который содержит лизины, но не участвует в сшивании (Hedtke et al., 2019). Аминокислотная последовательность домена 36 уникальна; кроме того, его последовательность придает положительно заряженный С-конец, содержащий лизины между положительно заряженными аргининами, образуя последовательность RKRK (Vrhovski et al. , 1997). Помимо последовательности RKRK, домен 36 содержит единственные два цистеина тропоэластина и только дисульфидную связь. Нарушение любого из этих компонентов значительно снижает способность тропоэластина к самосборке in vitro и взаимодействию с микрофибрильным каркасом эластических волокон (Nonaka et al., 2014), что указывает на то, что для правильной сборки требуется неповрежденный домен 36.
, 1997). Помимо последовательности RKRK, домен 36 содержит единственные два цистеина тропоэластина и только дисульфидную связь. Нарушение любого из этих компонентов значительно снижает способность тропоэластина к самосборке in vitro и взаимодействию с микрофибрильным каркасом эластических волокон (Nonaka et al., 2014), что указывает на то, что для правильной сборки требуется неповрежденный домен 36.
Структура
Пониманию структуры тропоэластина препятствуют многочисленные внутренние свойства молекулы. Наиболее важно то, что невозможность получения больших количеств чистого тропоэластина исторически представляла значительное препятствие для экспериментальной характеристики его структуры. Эластин широко сшит, и его трудно расщепить на мономеры даже в суровых условиях, поэтому первоначальные стратегии включали кормление животных диетой с дефицитом меди, чтобы предотвратить перекрестное связывание тропоэластина лизилоксидазой (LOX); однако это оказалось неэффективным и отнимало много времени (Wise and Weiss, 2009; Tarakanova et al. , 2018).
, 2018).
Даже после получения рекомбинантного тропоэластина в масштабах, подходящих для характеристических исследований, традиционные методы еще не позволили получить экспериментально подтвержденную атомистическую структуру (Martin et al., 1995; Tarakanova and Buehler, 2013). Гибкость тропоэластина не позволяет ему упаковываться в кристаллическую решетку, а его размер делает его слишком сложным для описания атомных взаимодействий с помощью ядерного магнитного резонанса (ЯМР) на глобальном уровне (Tamburro et al., 2003, 2006; Bochicchio et al., 2004; Пепе и др., 2008). Криоэлектронная микроскопия является быстро развивающимся методом и, вероятно, внесет свой вклад в изучение структуры тропоэластина. Действительно, недавно сообщалось, что крио-ЭМ имеет нижний предел молекулярного размера примерно 50 кДа, однако он еще не был успешно применен для характеристики тропоэластина (Murata and Wolf, 2018).
Из-за отсутствия полной атомистической структуры ряд производных эластина, включая изолированные домены тропоэластина (Toonkool et al. , 2001; Маккей и др., 2005 г.; Dyksterhuis и др., 2007; Dyksterhuis and Weiss, 2010) и синтетические пептиды, производные эластина (EDP) (Luan et al., 1990; Tamburro et al., 1992; Kentsis and Sosnick, 1998; Kumashiro et al., 2006; Reichheld et al., 2014, 2017; Muiznieks et al., 2015; MacEwan et al., 2017; Tarakanova et al., 2017) были изучены для понимания свойств уровня домена тропоэластина. Попытки охарактеризовать структуру тропоэластина привели к постепенному сдвигу от веры в то, что домены тропоэластина имеют фиксированную структуру, к пониманию того, что большинство его доменов способны переходить между случайными клубками и временными упорядоченными структурами.Эти упорядоченные структуры могут включать α-спирали и β-структуры (Vrhovski et al., 1997), которые зависят от содержания аминокислот и расположения доменов (He et al., 2012; Reichheld et al., 2014, 2017; Muiznieks). et al., 2015) и выбор растворителя (Reiersen and Rees, 2000; Muiznieks et al., 2015).
, 2001; Маккей и др., 2005 г.; Dyksterhuis и др., 2007; Dyksterhuis and Weiss, 2010) и синтетические пептиды, производные эластина (EDP) (Luan et al., 1990; Tamburro et al., 1992; Kentsis and Sosnick, 1998; Kumashiro et al., 2006; Reichheld et al., 2014, 2017; Muiznieks et al., 2015; MacEwan et al., 2017; Tarakanova et al., 2017) были изучены для понимания свойств уровня домена тропоэластина. Попытки охарактеризовать структуру тропоэластина привели к постепенному сдвигу от веры в то, что домены тропоэластина имеют фиксированную структуру, к пониманию того, что большинство его доменов способны переходить между случайными клубками и временными упорядоченными структурами.Эти упорядоченные структуры могут включать α-спирали и β-структуры (Vrhovski et al., 1997), которые зависят от содержания аминокислот и расположения доменов (He et al., 2012; Reichheld et al., 2014, 2017; Muiznieks). et al., 2015) и выбор растворителя (Reiersen and Rees, 2000; Muiznieks et al., 2015).
Гидрофобные домены тропоэластина преимущественно ответственны за случайное содержание спирального мономера и являются результатом уникального спаривания пар пролина и глицина, которые разбросаны по большинству гидрофобных доменов (Rauscher and Pomes, 2017). Наименьшая аминокислота, глицин, как известно, способствует гибкости локальных структур из-за отсутствия стерических препятствий, в то время как ограничительная боковая цепь пролина ингибирует конформационную выборку и нарушает формирование пролонгированных вторичных структур (Roberts et al., 2015). Комбинации этих двух аминокислот приводят к доменам, которые подвергаются быстрой выборке конформации (Rauscher and Pomes, 2017), которые, если их изменить в сторону конформации, тяготеющей к стабильности, будут собираться в высокоупорядоченные амилоидоподобные фибриллы, которые не являются эластомерными (Rauscher et al. др., 2006; Робертс и др., 2015).
Наименьшая аминокислота, глицин, как известно, способствует гибкости локальных структур из-за отсутствия стерических препятствий, в то время как ограничительная боковая цепь пролина ингибирует конформационную выборку и нарушает формирование пролонгированных вторичных структур (Roberts et al., 2015). Комбинации этих двух аминокислот приводят к доменам, которые подвергаются быстрой выборке конформации (Rauscher and Pomes, 2017), которые, если их изменить в сторону конформации, тяготеющей к стабильности, будут собираться в высокоупорядоченные амилоидоподобные фибриллы, которые не являются эластомерными (Rauscher et al. др., 2006; Робертс и др., 2015).
Еще более удивительно, что сшивающие домены тропоэластина также способны к сходным переходам между упорядоченными и неупорядоченными структурами. Первоначально считалось, что домены KA образуют α-спирали и спирали полипролина II (PPII) из-за наличия поперечных связей, которые требуют расположения лизина, которое постулировалось для достижения посредством α-спиральной конфигурации (Brown-Augsburger et al. , 1995). Хотя аланиновые пути в других белках предрасположены к образованию α-спиралей (Yang and Honig, 1995; Avbelj, 2000), было показано, что высокое содержание спирали в KA-доменах тропоэластина в первую очередь сохраняется в растворителях, которые стабилизируют вторичную структуру, таких как трифторэтанол, а не в водный раствор (Luo and Baldwin, 1997; Tamburro et al., 2006). Совсем недавно было продемонстрировано, что домены KA состоят из случайного содержимого клубков до самосборки и становятся более упорядоченными по мере агрегации молекул, объединяя наблюдения, обсужденные выше, в связную модель в контексте сборки и требований структур более высокого порядка. (Райхельд и др., 2014).
, 1995). Хотя аланиновые пути в других белках предрасположены к образованию α-спиралей (Yang and Honig, 1995; Avbelj, 2000), было показано, что высокое содержание спирали в KA-доменах тропоэластина в первую очередь сохраняется в растворителях, которые стабилизируют вторичную структуру, таких как трифторэтанол, а не в водный раствор (Luo and Baldwin, 1997; Tamburro et al., 2006). Совсем недавно было продемонстрировано, что домены KA состоят из случайного содержимого клубков до самосборки и становятся более упорядоченными по мере агрегации молекул, объединяя наблюдения, обсужденные выше, в связную модель в контексте сборки и требований структур более высокого порядка. (Райхельд и др., 2014).
В первых успешных экспериментах по определению трехмерной оболочки тропоэластина использовали малоугловое рассеяние рентгеновских лучей (МУРР) и малоугловое рассеяние нейтронов (МУРН) (Baldock et al., 2011). Было обнаружено, что тропоэластин представляет собой асимметричную молекулу с отчетливыми N- и C-концевыми областями, которые соответственно называются «головой» и «ножкой» молекулы. N-концевая головка покрывает протяженную спиральную область, состоящую из доменов 2–18. Под катушкой расположена гибкая «шарнирная» область, состоящая из доменов 20–24, которые непосредственно примыкают к «мостиковым» областям доменов 25–26. Домены 27–36 составляют «ножку» тропоэластина, которые помечены как таковые из-за их пространственного расположения, образуя почти клешнеподобный компонент молекулы.Однако для отображения его неуловимых свойств и производительности в иерархической сборке требовались данные с более высоким разрешением (Tarakanova et al., 2018; Ozsvar et al., 2019).
N-концевая головка покрывает протяженную спиральную область, состоящую из доменов 2–18. Под катушкой расположена гибкая «шарнирная» область, состоящая из доменов 20–24, которые непосредственно примыкают к «мостиковым» областям доменов 25–26. Домены 27–36 составляют «ножку» тропоэластина, которые помечены как таковые из-за их пространственного расположения, образуя почти клешнеподобный компонент молекулы.Однако для отображения его неуловимых свойств и производительности в иерархической сборке требовались данные с более высоким разрешением (Tarakanova et al., 2018; Ozsvar et al., 2019).
Вычислительные модели тропоэластина
Вычислительные подходы приобрели популярность в последние десятилетия, поскольку их методологии были усовершенствованы, чтобы обеспечить точное представление о молекулярной структуре и движении в атомистическом масштабе (Tarakanova et al., 2018). Таким образом, вычислительные подходы можно рассматривать как важное средство, дополняющее эксперименты на мокром стенде.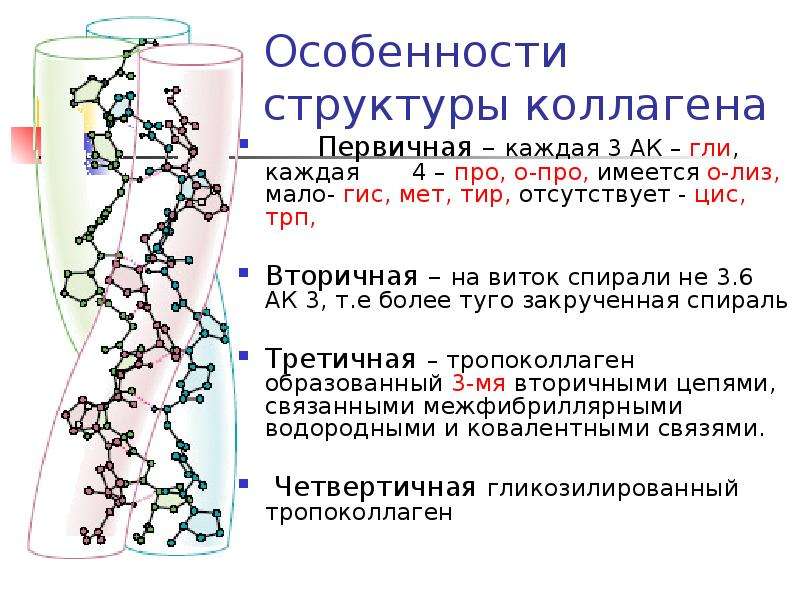 Благодаря использованию преимуществ вычислительных моделей, таких как модели эластичных сетей, полностью атомистические модели и крупнозернистые модели, как показано на рисунке 2, корреляция между структурой, движениями и функциональностью тропоэластина недавно была подробно изучена (Yeo и др., 2016; Тараканова и др., 2018, 2019а).
Благодаря использованию преимуществ вычислительных моделей, таких как модели эластичных сетей, полностью атомистические модели и крупнозернистые модели, как показано на рисунке 2, корреляция между структурой, движениями и функциональностью тропоэластина недавно была подробно изучена (Yeo и др., 2016; Тараканова и др., 2018, 2019а).
Рисунок 2. Обзор расчетных и экспериментальных методологий, которые в последнее время способствовали нашему пониманию сборки эластичных волокон.Глобальная форма тропоэластина SAXS/SANS (Baldock et al., 2011) использовалась для проверки полностью атомистической вычислительной модели тропоэластина посредством геометрического и топологического сравнения (Tarakanova et al., 2018). Кроме того, структура SAXS/SANS была сопоставлена с моделью эластичной сети с настраиваемой жесткостью, чтобы исследовать роль гибкости тропоэластина в сборке волокон (Yeo et al., 2016). Между тем, модификации полностью атомистической модели выявили механизмы, которые способствуют аберрантной структуре волокон (Тараканова и др. , 2018), которые, как предполагается, предрасполагают пациентов к таким заболеваниям, как приобретенная кожная недостаточность (Hu et al., 2006). Кроме того, крупнозернистая полноатомистическая модель позволила изучить мезомасштабную сборку тропоэластина и, в частности, расшифровать ориентацию молекул тропоэластина, которая происходит на ранней стадии сборки (вставка) (Tarakanova et al., 2019a). Будущие исследования позволят преодолеть разрыв между мезомасштабным моделированием и наблюдаемой под микроскопом коацервацией (Clarke et al., 2006).
, 2018), которые, как предполагается, предрасполагают пациентов к таким заболеваниям, как приобретенная кожная недостаточность (Hu et al., 2006). Кроме того, крупнозернистая полноатомистическая модель позволила изучить мезомасштабную сборку тропоэластина и, в частности, расшифровать ориентацию молекул тропоэластина, которая происходит на ранней стадии сборки (вставка) (Tarakanova et al., 2019a). Будущие исследования позволят преодолеть разрыв между мезомасштабным моделированием и наблюдаемой под микроскопом коацервацией (Clarke et al., 2006).
Полноатомистическая модель тропоэластина была разработана на основе моделирования молекулярной динамики с обменом репликами (REMD), метода ускоренной выборки для молекулярной динамики (Tarakanova et al., 2018). Эта модель показала, что тропоэластин сохраняет каноническую или «среднюю» структуру, основанную на распределении его возможных конформаций, несмотря на его гибкую природу (рис. 2), а также возможные роли, которые локальные структуры играют в биологических процессах, в частности, в эластогенезе (рис. 2). Тараканова и др., 2019б). Было установлено, что эта каноническая вычислительная структура очень похожа на оболочку, найденную с помощью SAXS/SANS, где обе состоят из протяженного молекулярного тела, сопровождаемого выступающей ножкой (Baldock et al., 2011). Вычислительная модель выявила вклад каждой молекулярной области в гибкость молекулы. Напр., очень гибкие домены 2-5, которые, как было замечено, генерируют скручивающее движение на N-конце, были расположены рядом с доменом 6, относительно неподвижной областью, которая может помочь в стабилизации последующих областей.Было предложено, чтобы гибкость средней области молекулы обеспечивала общую эластичность получаемых волокон. Ближе к основанию молекулы гибкая шарнирная область между доменами 21 и 23 представлена изгибом, подобным ножницам, который, как теперь полагают, способствует эластичности и мультимерной сборке за счет расширенной выборки конформационного пространства (Tarakanova et al., 2019b). Далее вниз по молекуле было отмечено, что взаимодействующий с клеткой С-конец является очень гибким, что указывает на то, что высокая конформационная выборка может способствовать взаимодействиям тропоэластина между рецепторами клеточной поверхности и белками, ассоциированными с эластическими волокнами.Таким образом, современная вычислительная модель объединяет глобальные и региональные характеристики тропоэластина, делая выводы о механизмах, которые дополняют наблюдаемые экспериментальные явления.
2). Тараканова и др., 2019б). Было установлено, что эта каноническая вычислительная структура очень похожа на оболочку, найденную с помощью SAXS/SANS, где обе состоят из протяженного молекулярного тела, сопровождаемого выступающей ножкой (Baldock et al., 2011). Вычислительная модель выявила вклад каждой молекулярной области в гибкость молекулы. Напр., очень гибкие домены 2-5, которые, как было замечено, генерируют скручивающее движение на N-конце, были расположены рядом с доменом 6, относительно неподвижной областью, которая может помочь в стабилизации последующих областей.Было предложено, чтобы гибкость средней области молекулы обеспечивала общую эластичность получаемых волокон. Ближе к основанию молекулы гибкая шарнирная область между доменами 21 и 23 представлена изгибом, подобным ножницам, который, как теперь полагают, способствует эластичности и мультимерной сборке за счет расширенной выборки конформационного пространства (Tarakanova et al., 2019b). Далее вниз по молекуле было отмечено, что взаимодействующий с клеткой С-конец является очень гибким, что указывает на то, что высокая конформационная выборка может способствовать взаимодействиям тропоэластина между рецепторами клеточной поверхности и белками, ассоциированными с эластическими волокнами.Таким образом, современная вычислительная модель объединяет глобальные и региональные характеристики тропоэластина, делая выводы о механизмах, которые дополняют наблюдаемые экспериментальные явления.
Вычислительные модели также использовались для точного определения молекулярных последствий синтетических и болезненных мутаций тропоэластина. Например, модели, включающие единичные точечные мутации в отрицательно заряженных остатках, продемонстрировали как региональную, так и глобальную дестабилизацию структуры тропоэластина, что было подтверждено структурами SAXS (Yeo et al., 2012; Тараканова и др., 2018). Уменьшение доступной для растворителя площади поверхности мутантных молекул указывает на то, что основной механизм их измененных свойств самосборки, наблюдаемый в экспериментах, обусловлен меньшей экспозицией соответствующих гидрофобных доменов, необходимых для коацервации. Точно так же было обнаружено, что мутационная модель, связанная с cutis laxa, или «болезнью рыхлой кожи» (Hu et al., 2006), демонстрирует более высокую стабильность по сравнению с молекулой дикого типа из-за увеличенного срока службы ее солевых мостиков (Hu et al. др., 2006; Тараканова и др., 2018). Возникающее в результате сгибающее движение, а не движение как ножницы-скручивание, возникающее в результате этой стабилизации, подчеркивает снижение гибкости мутанта как ключевой фактор нарушения сборки волокон в cutis laxa (Tarakanova et al., 2018). Изучая мутации в компьютерных исследованиях, которые разрешают атомарную структуру молекулы, становится возможным вывод механизмов, связанных с изменениями функциональных ролей конкретных доменов, и можно установить связь между локальными структурами и биологическими характеристиками (рис. 2; Тараканова и др.). др., 2018).
Жесткость в контексте самосборки также была исследована как с крупнозернистым, так и с полностью атомистическим моделированием с использованием полипептидов, полученных из гидрофобных доменов тропоэластина. Жесткость, возникшая из-за аминокислотных замен, частично определила результирующую вторичную структуру, которая, в свою очередь, повлияла на сборку (Prhashanna et al., 2019). Такие модели можно использовать в сочетании с полной молекулярной моделью тропоэластина для изучения самосборки дискретных областей, чтобы понять влияние аминокислотных замен на заболевания.Незамещенные модели также важны для понимания самосборки. Моделирование с использованием производных тропоэластина показало, что структурное уплотнение как в клубки, так и в глобулы происходит выше температуры перехода самосборки, что может помочь в объяснении анизотропной природы зрелого эластина (Baul et al., 2020).
Важность гибкости тропоэластина во время самосборки также изучалась в свете природных модификаций ализина, которые конденсируются с образованием поперечных связей в зрелом эластине (подробнее обсуждается в следующем разделе) (Ozsvar et al., 2019). Превращение одного лизина в аллизин приводит к структурной стабилизации, которая может служить контрольной точкой во время самосборки, чтобы гарантировать, что молекулы, неспособные образовывать множественные поперечные связи, не будут включены в растущую цепь. Этот вывод подтверждается наблюдением, что тропоэластин с множественными модификациями allysine демонстрирует конформационную выборку, сравнимую с таковой у молекулы дикого типа, предполагая, что он с большей вероятностью легко участвует в самосборке.
Эластогенез
Эластогенез — это термин, который в совокупности описывает иерархический процесс формирования эластических волокон и состоит из отдельных фаз: синтеза тропоэластина, коацервации, поперечного связывания и отложения.
Эластогенные клетки, такие как фибробласты (Mecham et al., 1985) и гладкомышечные клетки (Narayanan et al., 1976), синтезируют и секретируют тропоэластин. Большая часть синтеза тропоэластина происходит во время перинатального развития (Myers et al., 1983; Noguchi et al., 1990), однако синтез может запускаться в ответ на повреждение тканей (Parks et al., 1992) или при таких заболеваниях, как атеросклероз (Phinikaridou et al., 2018). Тропоэластин секретируется в виде белка с молекулярной массой 60–70 кДа на клеточную поверхность, где он участвует в самосборке (Hinek and Rabinovitch, 1994; Figure 3).
Рисунок 3. Этапы иерархической сборки эластических волокон. Мономеры тропоэластина подвергаются самосборке при достижении температуры перехода посредством агрегации их гидрофобных доменов (Wise et al., 2014). Сборка начинается с события зародышеобразования и подвергается ступенчатой элонгации с образованием мультимера, который может происходить «голова к хвосту» (Wise et al., 2014). Мультимеры могут претерпевать дальнейшие переходы, такие как разветвление, с образованием сферул, состоящих из мультимерных агрегатов (Tu et al., 2010). Сферулы увеличиваются в размерах и откладываются на каркасе микрофибрилл, где сливаются в фибриллярные структуры (Sherratt et al., 2001). Эластические волокна в конечном итоге формируются после интенсивного сшивания посредством процесса, называемого созреванием (Yeo et al., 2016).
Коацервация — это эндотермический, энтропийно благоприятный процесс, посредством которого мономеры тропоэластина самособираются в n-мерные структуры более высокого порядка. Коацервация оптимально происходит при физиологической температуре, однако коацервация in vitro также может происходить при более низких температурах в зависимости от экспериментальных условий и выбора изоформы или производного тропоэластина (Yeo et al., 2011). Эта температура также известна как температура перехода. Первоначально коацервация in vitro характеризуется быстрой агрегацией тропоэластина.в 200 нм, затем в шарики размером 1–2 мкм, которые в конечном итоге вырастают и стабилизируются в шарики диаметром 2–6 мкм (Clarke et al., 2006; Kozel et al., 2006; Tu and Weiss, 2010; Tu et al., 2010). ). Сферулы тропоэластина собираются на клеточной поверхности перед отложением на микрофибриллярный каркас в системах культивирования клеток при физиологической температуре (Kozel et al., 2006). Процесс агрегации тропоэластина изначально обратим, так как шарики диссипируют при понижении температуры (Clarke et al., 2006), однако поддержание физиологической температуры приводит к созреванию, о чем свидетельствует слияние шариков и необратимое образование фибриллярных структур. (Кокс и др., 1974; Брессан и др., 1983; Mithieux и др., 2005). Присутствие шариков тропоэластина, сливающихся с фибриллами, было отмечено в нативной ткани, демонстрируя заметное сходство между коацервацией in vitro и in vivo (Haust et al., 1965; Albert, 1972; Kozel et al., 2006).
Гидрофобные домены тропоэластина в первую очередь ответственны за облегчение коацервации (Tamburro et al., 1992; Miao et al., 2003; Muiznieks et al., 2003). Неполярные остатки вносят основной вклад в сворачивание белка, поскольку их неблагоприятное взаимодействие с водой заставляет их внедряться в ядро белка, однако, поскольку тропоэластин состоит из многочисленных гидрофобных доменов, было продемонстрировано, что многие из этих доменов будут по крайней мере частичное воздействие растворителя (Dyksterhuis et al., 2007). Таким образом, при более низких температурах вода, окружающая эти домены, образует упорядоченные клатратоподобные оболочки, которые предотвращают агрегацию до тех пор, пока не будет достигнута соответствующая температура (Wu and Weiss, 1999; Miao et al., 2003; Danduran et al., 2015). Напротив, более высокие температуры позволяют разорвать водородные связи упорядоченной воды, рассеивая клатратные оболочки и позволяя ассоциировать гидрофобные домены (Yeo et al., 2011). Считается, что предотвращение ранней самоагрегации in vitro опосредовано белками-шаперонами (Hinek and Rabinovitch, 1994; Miao et al., 2013). Кроме того, гибкость гидрофобных доменов также может играть ключевую роль в самосборке. Молекулярно-динамическое моделирование агрегирующих пептидных цепей, полученных из тропоэластина, указывает на поддержание гидратированного, неупорядоченного, жидкоподобного состояния за счет образования короткоживущих межцепочечных связей (Rauscher and Pomes, 2017; Reichheld et al., 2020). , скорее всего, из-за индуцирования случайных спиралей повторами PG (, см. выше ). Это явление подтверждается исследованиями пептида in vitro , в которых отмечается, что увеличение пространства между мотивами PG или удаление пролинов приводит к более упорядоченным структурам (Rauscher et al., 2006).
Подобно другим белкам ЕСМ, таким как коллаген, тропоэластин образует ковалентные поперечные связи через свои лизины. Приблизительно 90% лизинов тропоэластина подвергаются модификации и/или участвуют в поперечных связях, что указывает на то, что зрелый эластин в значительной степени сшит (Kozel et al., 2003; Schmelzer et al., 2019). Сшивка требует модификации по крайней мере одного из лизиновых участников членом семейства медьсодержащих LOX или лизиноксидазоподобных (LOXL) ферментов. LOX и LOXL превращают ε-аминогруппу лизина в δ-полуальдегид α-аминоадипиновой кислоты (ализин) (Schmelzer et al., 2019), которые спонтанно подвергаются либо реакции основания Шиффа с лизином, либо сшивке двух ализинов посредством альдольной конденсации с образованием бифункциональных сшивок (Franzblau et al., 1969; Lent et al., 1969). Бифункциональные поперечные связи могут подвергаться дальнейшей конденсации с образованием тетрафункционального десмозина или изодесмозина (Partridge, 1966). Недавно была проведена серия картографических исследований для точного определения местоположения этих перекрестных связей (Schrader et al., 2018; Hedtke et al., 2019; Schmelzer et al., 2019), поскольку их расположение имеет решающее значение для понимания результирующей молекулярной ориентации тропоэластина внутри сшитого эластина. Исследования молекулярной стыковки с использованием тропоэластина и трехмерной структуры LOX1 (Vallet et al., 2018) могут помочь в нашем понимании того, предпочитает ли фермент модифицировать определенные остатки тропоэластина.
Следующий этап сборки эластина включает отложение тропоэластиновых шариков на микрофибриллярный каркас эластических волокон.Микрофибриллы состоят из нескольких белков, наиболее распространенным из которых является фибриллин-1. Тропоэластин взаимодействует с компонентами микрофибрилл, включая фибриллин-1, фибулин-4 и -5, и другими ассоциированными молекулами, такими как белок-4, связывающий латентный трансформирующий фактор роста β (Visconti et al., 2003; McLaughlin et al., 2006; Urban et al. al., 2009; Yamauchi et al., 2010; Noda et al., 2013; Lockhart-Cairns et al., 2020). Недавно было высказано предположение, что фибриллины способны стабилизировать тропоэластин, возможно, с целью отбора конформаций, благоприятных для сборки эластина (Lockhart-Cairns et al., 2020). Помимо взаимодействия с тропоэластином, фибулины-4 и -5 способны также связывать LOX и фибриллин-1 и, таким образом, играют ключевую роль в облегчении эластогенеза (Hinderer et al., 2015). Более того, фибулины необходимы для направленности эластических волокон, поскольку фибробласты с нокдаунами фибулина-4 и -5 генерируют плохо сформированные эластические волокна (Yamauchi et al., 2010), а мыши с фибулином-4 -/- демонстрируют аберрантные, плохо сшитые, и неволокнистый эластин (McLaughlin et al., 2006).
Текущая модель тропоэластина в сборе
Сначала была выдвинута гипотеза, что тропоэластин собирается от головы к хвосту, подобно другим белкам ВКМ, таким как коллаген, который собирается в фибриллы, которые впоследствии соединяются латерально, образуя листы и более толстые волокна (Kadler, 2017).Решение глобальной структуры тропоэластина (Baldock et al., 2011) позволило провести трехмерное картирование на тропоэластине приблизительного местоположения доменов 10, 19 и 25, которые были первыми открытыми однозначно сшитыми доменами (Brown-Augsburger et al. , 1995). Выравнивание этих трех доменов указывает на то, что по крайней мере две молекулы тропоэластина необходимы для образования этой тетрафункциональной поперечной связи, что приводит к модели сборки «голова к хвосту», включающей рост линейной цепи, которая может собираться латерально с образованием листы и в конечном итоге образуют шарики (Baldock et al., 2011).
Однако некоторые аспекты этой модели требуют дальнейшего изучения. Например, тетрафункциональная сшивка, на которой основана модель, получена из свиного эластина (Brown-Augsburger et al., 1995). Хотя для тропоэластина свиньи не существует 3D-структуры, тропоэластин свиньи отличается от тропоэластина человека (Sandberg et al., 1977), оставляя неясным, выровнены ли эти домены, как ожидается, в ткани человека. Кроме того, современная модель сборки эластина не учитывает, насколько длинные нити или листы тропоэластина способны формировать шарики в макроскопическом масштабе (Tu et al., 2010).
Совсем недавно компьютерная модель тропоэластина была использована для описания структур более высокого порядка и самосборки зонда (Tarakanova et al., 2019a). Моделированию подвергли 40 молекул тропоэластина с использованием крупнозернистой модели на основе MARTINI, интегрированной с моделью эластичной сети (Tarakanova et al., 2019a). Преимущество крупнозернистых методологий заключается в том, что они позволяют моделировать временные масштабы больших молекулярных систем порядка микросекунд, что в противном случае невозможно с вычислительной точки зрения с помощью классической полностью атомистической молекулярной динамики.Были изучены доминирующие движущие факторы сборки, включая воду, температуру и ориентацию пар доменов. Важно отметить, что эти симуляции показали, что самосборка начинается с события зародышеобразования, а удлинение происходит как через глобулярные, так и через фибриллярные структуры (Tarakanova et al., 2019a). Это указывает на высокий уровень конформационной выборки на этой фазе коацервации, указывая на то, что гибкость тропоэластина играет ключевую роль в сборке, которая может сохраняться до некоторой степени на более поздних стадиях сборки (Reichheld et al., 2020). Важно отметить, что присутствие фибрилл указывает на то, что наноструктуры, образующиеся во время начальной сборки, вносят вклад в надмолекулярные структуры, возникающие как на ранней (сферулы), так и на более поздних (фибриллы) стадиях эластогенеза. Интересно отметить, что расположение и ориентация различных доменов, которые контактировали друг с другом во время самосборки, были гетерогенными, что приводило к взаимодействиям «голова к голове», «хвост к хвосту», «голова к хвосту» и латеральным взаимодействиям (Tarakanova et al. ., 2019а). Это отражает экспериментально наблюдаемую гетерогенность поперечных связей в зрелом эластине, что еще раз подтверждает гипотезу о том, что гибкость тропоэластина необходима для сборки (Schrader et al., 2018; Тараканова и др., 2019а).
Взаимодействие тропоэластин-клеточных рецепторов и значение для сборки
Тропоэластин способствует прикреплению и миграции клеток нескольких типов, включая фибробласты, эндотелиальные клетки и мезенхимальные стволовые клетки. Клеточная активность опосредована взаимодействием между тропоэластином или EDP и специфическими рецепторами на клеточной поверхности. Эти взаимодействия запускают широкий спектр процессов, включая заживление ран, эластогенез и поддержание стебля (Yeo and Weiss, 2019).
Белок, связывающий эластин (EBP), представляет собой вариант сплайсинга β-галактозидазы, который распознает повторяющиеся гидрофобные последовательности (VGVAPG) тропоэластина (Tajima et al., 1997). EBP играет две роли в сборке эластина. Первая представляет собой внутриклеточную роль шаперона тропоэластина, а вторая — часть комплекса рецепторов эластина (ERC). Внутриклеточно EBP связывается с тропоэластином после высвобождения сигнального пептида и действует как шаперон для предотвращения самоагрегации и протеолиза при транспортировке к клеточной мембране, после чего EBP затем рециркулируется и служит многоразовым челночным белком (Hinek et al. др., 1995).
На клеточной поверхности EBP образует комплекс с защитным белком/катепсином A (PPCA) и нейраминидазой-1 (Neu-1), давая ERC (Duca et al., 2007). ERC связывает пептиды, полученные из эластина, которые являются продуктом протеолитической активности растворимого и нерастворимого эластина различными эластазами. Эластазы могут быть в форме серин- (например, Ela-2), цистеина- (например, катепсин I) или матриксных металлопротеиназ (ММР-2, -7, -9 и -12), а биоактивные пептиды включают Пептид VGVAPG.Связывание EDP с ERC вызывает ряд биологических эффектов, включая миграцию, адгезию, пролиферацию, экспрессию протеазы и секрецию. EDP могут модулировать множество сигнальных путей (Scandolera et al., 2016), но тропоэластин полной длины не запускает пути через ERC. Это указывает на то, что первичные сигнальные пути ERC участвуют в распознавании ран через фрагменты эластина, где EDP образуются в результате повреждения эластической ткани.
Гликозаминогликаны (ГАГ) представляют собой отрицательно заряженные линейные полисахариды, которые могут быть либо сульфатированными [гепарансульфат (ГС) или хондроитинсульфат], либо несульфатированными (гиалуроновая кислота).HS, который присутствует на протеогликанах клеточной поверхности (синдеканах и глипиканах), сильно взаимодействует с тропоэластином (Cain et al., 2005). Было установлено, что положительно заряженные остатки лизина в доменах 17 взаимодействуют с отрицательно заряженными HS, скорее всего, посредством ионных взаимодействий (Lee et al., 2017). Последние 17 аминокислотных остатков С-конца домена 36 также участвуют во взаимодействиях HS; последние четыре остатка представляют собой Arg-Lys-Arg-Lys и положительно заряжены при физиологическом pH, что обеспечивает заряженный кластер, способный связывать отрицательно заряженные HS (Broekelmann et al., 2005). Было высказано предположение, что взаимодействие между тропоэластином и протеогликанами клеточной поверхности является частью процесса сборки эластина перед его отложением на микрофибриллах. Фибриллин-1 и -2 также взаимодействуют с протеогликанами (Tiedemann et al., 2001), которые в сочетании с взаимодействиями тропоэластин/ГАГ обеспечивают путь к образованию эластических волокон.
Интегрины представляют собой основной класс семейства рецепторов клеточной поверхности, из которых тропоэластин взаимодействует с двумя типами: α v β 3 (Rodgers and Weiss, 2004) и α v β 5 .Интегрины канонически связывают белки, содержащие мотивы Arg-Glu-Asp, но эта последовательность не обнаружена в тропоэластине (Lee et al., 2014). Вместо этого было обнаружено, что домены тропоэластина 14–18 и 36 (последовательность RKRK) связываются с обоими интегринами. Лизины доменов 15 и 17, как полагают, играют ключевую роль в этом взаимодействии. Вполне вероятно, что, как правило, связывание интегрина с тропоэластином опосредуется через ГАГ, чему способствуют повторение первичной последовательности тропоэластина и экспозиция на поверхности положительно заряженных сходных доменов (Lee et al., 2017; Bochicchio и др., 2021). Взаимодействия с этими интегринами на поверхности мезенхимальных стволовых клеток либо посредством связывания с поверхностью, либо в виде растворимого тропоэластина способствуют пролиферации МСК и поддержанию фенотипа посредством FAK и PKB/AKT (Yeo and Weiss, 2019). Узкая специфичность к α v β 3 и α 5 β 3 также может быть полезной по сравнению с другими молекулами адгезии ВКМ, такими как фибронектин (который может прикрепляться к 20 типам интегрина), которые могут конкурируют с тропоэластином и модулируют его связывание, оказывая противоположное влияние на пролиферацию клеток.Более того, поскольку интегрины участвуют в ремоделировании внеклеточного матрикса (Bonnans et al., 2014), это согласуется с моделью, согласно которой взаимодействие тропоэластина-интегрина является частью процесса заживления ран.
Заключение
Тропоэластин — это уникальный белок с биохимическими и физическими свойствами, которые позволяют ему быстро самостоятельно собираться в волокнистые структуры. Становится все более очевидным, что последовательность, структура и последующая функциональность тропоэластина находятся в тонком равновесии; таким образом, нарушения последовательности тропоэластина могут иметь далеко идущие последствия для самосборки и результирующей архитектуры эластических волокон.В течение многих лет было трудно изучать тропоэластин в атомарном масштабе, но применение вычислительных методов, таких как полностью атомистическая молекулярная динамика и модели эластичных сетей, в сочетании с мощными структурными исследованиями с низким разрешением, расширило область и предоставило новые возможности. более глубокое понимание механизмов, способствующих самосборке. Моделирование было проверено с использованием методологий мокрого стенда, сформировав надежный набор дополнительных методологий, которые, несомненно, со временем станут более распространенными для изучения сборки биологических волокон.Благодаря скачкам в улучшении криогенной электронной микроскопии для характеристики гибких молекул, мы прогнозируем, что этот подход будет способствовать более глубокому пониманию структуры и самосборки тропоэластина в контексте образования эндогенных волокон и производства биоматериалов.
Вклад авторов
Все авторы участвовали в написании и редактировании обзора.
Финансирование
Wellcome Trust Center for Cell-Matrix Research финансируется Wellcome Trust (203128/Z/16/Z).CB с благодарностью отмечает финансирование BBSRC (Ref: BB/R008221/1). AW выражает благодарность NHMRC за финансирование (Ref: 1195827). Авторы написали и представили эту рукопись в ответ на приглашение редактора. AT выражает признательность за поддержку начального гранта Института сотрудничества в области здравоохранения, вмешательства и политики Университета Коннектикута.
Конфликт интересов
AW является научным учредителем компании Elastagen Pty. Ltd., которая была продана компании Allergan, в настоящее время являющейся подразделением AbbVie.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Аарон Б. и Гослайн Дж. (1981). Эластин как эластомер со случайной сетью: механический и оптический анализ одиночных эластиновых волокон. Биополимеры 20, 1247–1260. дои: 10.1002/бип.1981.360200611
Полнотекстовая перекрестная ссылка | Академия Google
Альберт, Э.Н. (1972). Развитие эластичной ткани. Электронно-микроскопическое исследование. утра. Дж. Патол. 69, 89–102.
Академия Google
Аннаби Н., Чжан Ю. Н., Ассманн А., Сани Э. С., Ченг Г., Лассалетта А. Д. и соавт. (2017). Разработка высокоэластичного герметика на основе человеческого белка для хирургического применения. Науч. Перевод Мед. 9:eaai7466. doi: 10.1126/scitranslmed.aai7466
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Болдок, К., Oberhauser, A.F., Ma, L., Lammie, D., Siegler, V., Mithieux, S.M., et al. (2011). Форма тропоэластина, очень растяжимого белка, контролирующего эластичность тканей человека. Проц. Натл. акад. науч. США 108, 4322–4327. doi: 10.1073/pnas.1014280108
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Башир, М.М., Индик, З., Йех, Х., Орнштейн-Гольдштейн, Н., Розенблюм, Дж. К., Абрамс, В., и соавт. (1989). Характеристика полного гена эластина человека.Очерчивание необычных особенностей в 5′-фланговой области. Дж. Биол. хим. 264, 8887–8891.
Академия Google
Баул, У., Блей, М., и Джубиэлла, Дж. (2020). Термическое уплотнение неупорядоченных и эластиноподобных полипептидов: зависящая от температуры крупнозернистая имитационная модель, зависящая от последовательности. Биомакромолекулы 21, 3523–3538. doi: 10.1021/acs.biomac.0c00546
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бочиккио, Б., Флоке, Н., Пепе, А., Аликс, А.Дж., и Тамбурро, А.М. (2004). Рассечение тропоэластина человека: структура раствора, динамика и самосборка пептида экзона 5. Химия 10, 3166–3176. doi: 10.1002/chem.200305661
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bochicchio, B., Yeo, G.C., Lee, P., Emul, D., Pepe, A., Laezza, A., et al. (2021). Домены 12-16 тропоэластина способствуют прикреплению и распространению клеток посредством взаимодействия с гликозаминогликаном и интегринами альфаV и альфа5бета1. FEBS J. [Epub перед печатью].
Академия Google
Брессан Г.М., Кастеллани И., Джиро М.Г., Вольпин Д., Форньери К. и Паскуали Ронкетти И. (1983). Ленточные волокна тропоэластина коацерватируют при физиологических температурах. Дж. Ультраструктур. Рез. 82, 335–340. doi: 10.1016/s0022-5320(83)80021-5
Полнотекстовая перекрестная ссылка | Академия Google
Брокельманн, Т.Дж., Козел, Б.А., Ишибаши, Х., Вернек, К.С., Кили, Ф.В., Чжан, Л., и другие. (2005). Тропоэластин взаимодействует с гликозаминогликанами клеточной поверхности через свой СООН-концевой домен. Дж. Биол. хим. 280, 40939–40947. doi: 10.1074/jbc.M507309200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Brown-Augsburger, P., Tisdale, C., Broekelmann, T., Sloan, C., and Mecham, R.P. (1995). Идентификация сшивающего домена эластина, который соединяет три пептидные цепи. Возможная роль в ядерной сборке. Дж. Биол. хим. 270, 17778–17783.doi: 10.1074/jbc.270.30.17778
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Каин, С.А., Балдок, К., Галлахер, Дж., Морган, А., Бакс, Д.В., Вайс, А.С., и соавт. (2005). Взаимодействие фибриллина-1 с гепарином. Последствия для сборки микрофибрилл и эластичных волокон. Дж. Биол. хим. 280, 30526–30537. doi: 10.1074/jbc.M5013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чанг, М. И., Мяо, М., Шталь, Р. Дж., Чан, Э., Паркинсон, Дж., и Кили, Ф.В. (2006). Последовательности и доменные структуры тропоэластинов млекопитающих, птиц, амфибий и костистых костей: ключи к эволюционной истории эластинов. Матрица Биол. 25, 492–504. doi: 10.1016/j.matbio.2006.08.258
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кларк А.В., Арнспанг Э.К., Митье С.М., Коркмаз Э., Брает Ф. и Вайс А.С. (2006). Тропоэластин массивно связывается во время коацервации с образованием квантованных белковых сфер. Биохимия 45, 9989–9996. дои: 10.1021/bi0610092
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кордье П., Турнильак Ф., Сулье-Зиакович К. и Лейблер Л. (2008). Самовосстанавливающийся и термообратимый каучук из супрамолекулярной сборки. Природа 451, 977–980. doi: 10.1038/nature06669
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кокс, Б.А., Старчер, Б.С., и Урри, Д.В. (1974). Связь: коацервация тропоэластина приводит к образованию волокон. Дж. Биол. хим. 249, 997–998. doi: 10.1016/s0021-9258(19)43030-5
Полнотекстовая перекрестная ссылка | Академия Google
Дандуран, Дж., Самуиллан, В., Лакабанн, К., Пепе, А., и Бокиккио, Б. (2015). Структура воды и агрегация эластиноподобных пептидов. Дж. Терм. Анальный. Калорим. 120, 419–426. doi: 10.1007/s10973-014-4254-9
Полнотекстовая перекрестная ссылка | Академия Google
Дебель, Л., и Тамбурро, А.М. (1999). Эластин: молекулярное описание и функция. Междунар. Дж. Биохим. Клеточная биол. 31, 261–272. doi: 10.1016/s1357-2725(98)00098-3
Полнотекстовая перекрестная ссылка | Академия Google
Duca, L., Blanchevoye, C., Cantarelli, B., Ghoneim, C., Dedieu, S., Delacoux, F., et al. (2007). Комплекс рецептора эластина передает сигналы посредством каталитической активности своей субъединицы Neu-1. Дж. Биол. хим. 282, 12484–12491. doi: 10.1074/jbc.M609505200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дайкстерхуис, Л.Б., Болдок, К., Ламми, Д., Весс, Т.Дж., и Вайс, А.С. (2007). Домены 17-27 тропоэластина содержат ключевые области контакта для коацервации и содержат необычный перекрестно-сшивающий домен, содержащий поворот. Матрица Биол. 26, 125–135. doi: 10.1016/j.matbio.2006.10.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Dyksterhuis, L.B., and Weiss, A.S. (2010). Модели гомологии для доменов 21-23 тропоэластина человека проливают свет на сшивание лизина. Биохим.Биофиз. Рез. коммун. 396, 870–873. doi: 10.1016/j.bbrc.2010.05.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Элвин, К.М., Карр, А.Г., Хьюсон, М.Г., Максвелл, Дж.М., Пирсон, Р.Д., Вуоколо, Т., и соавт. (2005). Синтез и свойства сшитого рекомбинантного прорезилина. Природа 437, 999–1002. doi: 10.1038/nature04085
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фацио М.Дж., Олсен Д.Р., Куйваниеми Х., Chu, M.L., Davidson, J.M., Rosenbloom, J., et al. (1988). Выделение и характеристика кДНК эластина человека и возрастные изменения экспрессии гена эластина в культивируемых фибробластах кожи. Лаб. Вкладывать деньги. 58, 270–277.
Академия Google
Фостер, Дж. А., Грей, В. Р., и Францблау, К. (1973). Выделение и характеристика сшитых пептидов из эластина. Биохим. Биофиз. Acta 303, 363–369. дои: 10.1016/0005-2795(73)
-1
Полнотекстовая перекрестная ссылка | Академия Google
Хауст, М.Д., Мор, Р.Х., Бенкосме, С.А., и Балис, Дж.У. (1965). Эластогенез в аорте человека: электронно-микроскопическое исследование. Экспл. Мол. Патол. 4, 508–524. дои: 10.1016/0014-4800(65)-8
Полнотекстовая перекрестная ссылка | Академия Google
He, D., Chung, M., Chan, E., Alleyne, T., Ha, K.C.H., Miao, M., et al. (2007). Сравнительная геномика эластина: анализ последовательности высоко повторяющегося белка. Матрица Биол. 26, 524–540. doi: 10.1016/j.matbio.2007.05.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Он, Д., Miao, M., Sitarz, E.E., Muiznieks, L.D., Reichheld, S., Stahl, R.J., et al. (2012). Полиморфизмы в гене тропоэластина человека модифицируют самосборку in vitro и механические свойства эластиноподобных полипептидов. PLoS One 7:e46130. doi: 10.1371/journal.pone.0046130
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hedtke, T., Schrader, C.U., Heinz, A., Hoehenwarter, W., Brinckmann, J., Groth, T., et al. (2019). Полная карта поперечного связывания эластина человека во время эластогенеза. FEBS J. 286, 3594–3610. doi: 10.1111/февраль 14929
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hinderer, S., Shena, N., Ringuette, L.J., Hansmann, J., Reinhardt, D.P., Brucker, S.Y., et al. (2015). Эластогенез in vitro: инструктирование гладкомышечных клеток сосудов человека для создания каркаса внеклеточного матрикса, содержащего эластичные волокна. Биомед. Матер. 10:034102. дои: 10.1088/1748-6041/10/3/034102
Полнотекстовая перекрестная ссылка | Академия Google
Хинек, А., Кили, Ф.В., и Каллахан, Дж. (1995). Рециркуляция 67-кДа эластин-связывающего белка в артериальных миоцитах необходима для секреции тропоэластина. Экспл. Сотовый рез. 220, 312–324. doi: 10.1006/excr.1995.1321
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хинек, А., и Рабинович, М. (1994). Эластин-связывающий белок массой 67 кДа является защитным «компаньоном» внеклеточного нерастворимого эластина и внутриклеточного тропоэластина. J. Cell Biol. 126, 563–574.doi: 10.1083/jcb.126.2.563
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ху, К., Реймонд, Дж. Л., Пинель, Н., Забот, М. Т., и Урбан, З. (2006). Воспалительная деструкция эластических волокон при приобретенной кожной недостаточности связана с миссенс-аллелями в генах эластина и фибулина-5. Дж. Инвест. Дерматол. 126, 283–290. doi: 10.1038/sj.jid.5700047
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Индик, З., Йех, Х., Орнштейн-Гольдштейн, Н., Kucich, U., Abrams, W., Rosenbloom, J.C., et al. (1989). Структура гена эластина и альтернативный сплайсинг мРНК эластина: значение для болезней человека. утра. Дж. Мед. Жене. 34, 81–90. doi: 10.1002/ajmg.1320340115
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Индик, З., Йе, Х., Орнштейн-Гольдштейн, Н., Шеппард, П., Андерсон, Н., Розенблюм, Дж. К., и соавт. (1987). Альтернативный сплайсинг мРНК эластина человека показан анализом последовательности клонированной геномной и комплементарной ДНК. Проц. Натл. акад. науч. США 84, 5680–5684. doi: 10.1073/pnas.84.16.5680
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дженсен С.А., Врховски Б. и Вайс А.С. (2000). Домен 26 тропоэластина играет доминирующую роль в ассоциации путем коацервации. Дж. Биол. хим. 275, 28449–28454. doi: 10.1074/jbc.M004265200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кенцис, А., и Сосник, Т. Р. (1998).Трифторэтанол способствует образованию спирали, дестабилизируя обнажение остова: десольватация, а не естественная водородная связь, определяет кинетический путь сворачивания димерной спиральной катушки. Биохимия 37, 14613–14622. дои: 10.1021/bi981641y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Козел, Б.А., Ронгиш, Б.Дж., Цирок, А., Зак, Дж., Литтл, К.Д., Дэвис, Э.К., и соавт. (2006). Формирование эластических волокон: динамическое представление сборки внеклеточного матрикса с использованием репортеров-таймеров. J. Cell Physiol. 207, 87–96. doi: 10.1002/jcp.20546
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Козел Б.А., Вачи Х., Дэвис Э.К. и Мечам Р.П. (2003). Домены в тропоэластине, которые опосредуют отложение эластина in vitro и in vivo. Дж. Биол. хим. 278, 18491–18498. дои: 10.1074/jbc.M212715200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кумаширо, К. К., Хо, Дж. П., Нимчура, В. П., и Кили, Ф.В. (2006). Взаимодействие между гидрофобными и сшивающими доменами эластина. Дж. Биол. хим. 281, 23757–23765. дои: 10.1074/jbc.M510833200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли П., Бакс Д. В., Билек М. М. и Вайс А. С. (2014). Новая область клеточной адгезии в тропоэластине опосредует присоединение к интегрину alphaVbeta5. Дж. Биол. хим. 289, 1467–1477. doi: 10.1074/jbc.M113.518381
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, П., Йео, Г.К., и Вайс, А.С. (2017). Клеточный адгезивный пептид из тропоэластина способствует последовательному прикреплению и распространению клеток через различные рецепторы. FEBS J. 284, 2216–2230. doi: 10.1111/февраль 14114
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лент Р.В., Смит Б., Сальседо Л.Л., Фарис Б. и Францблау К. (1969). Исследования по снижению эластина. II. Доказательства наличия дельта-полуальдегида альфа-аминоадипиновой кислоты и продукта его альдольной конденсации. Биохимия 8, 2837–2845. дои: 10.1021/bi00835a022
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Локхарт-Кэрнс, М.П., Ньюанди, Х., Томсон, Дж., Вайс, А.С., Болдок, К., и Тараканова, А. (2020). Опосредованное трансглютаминазой сшивание тропоэластина с фибриллином стабилизирует предшественник эластина перед сборкой эластических волокон. Дж. Мол. биол. 432, 5736–5751. doi: 10.1016/j.jmb.2020.08.023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Луан, К.Х., Харрис Р., Прасад К.У. и Урри Д.В. (1990). Дифференциальная сканирующая калориметрия изучает обратный температурный переход полипентапептида эластина и его аналогов. Биополимеры 29, 1699–1706. doi: 10.1002/бип.3602
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Луо П. и Болдуин Р.Л. (1997). Механизм индукции спирали трифторэтанолом: основа для экстраполяции спиралеобразующих свойств пептидов из смесей трифторэтанол/вода обратно в воду. Биохимия 36, 8413–8421. дои: 10.1021/bi9707133
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
MacEwan, S.R., Weitzhandler, I., Hoffmann, I., Genzer, J., Gradzielski, M., и Chilkoti, A. (2017). Фазовое поведение и самосборка идеально определенной последовательности и монодисперсных многоблочных сополипептидов. Биомакромолекулы 18, 599–609. doi: 10.1021/acs.biomac.6b01759
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Маккей, Дж.П., Муизниекс Л.Д., Тункул П. и Вайс А.С. (2005). Гидрофобный домен 26 тропоэластина человека неструктурирован в растворе. Дж. Структура. биол. 150, 154–162. doi: 10.1016/j.jsb.2005.02.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мартин С.Л., Врховски Б. и Вайс А.С. (1995). Общий синтез и экспрессия в Escherichia coli гена, кодирующего тропоэластин человека. Ген 154, 159–166. дои: 10.1016/0378-1119(94)00848-м
Полнотекстовая перекрестная ссылка | Академия Google
Маклафлин, П.J., Chen, Q., Horiguchi, M., Starcher, B.C., Stanton, J.B., Broekelmann, T.J., et al. (2006). Направленное разрушение фибулина-4 отменяет эластогенез и вызывает перинатальную летальность у мышей. Мол. Клетка. биол. 26, 17:00–17:09. doi: 10.1128/mcb.26.5.1700-1709.2006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мечам, Р. П., Леви, Б. Д., Моррис, С. Л., Мадарас, Дж. Г., и Ренн, Д. С. (1985). Повышенные уровни циклического GMP приводят к стимуляции выработки эластина в фибробластах связок, которая нейтрализуется циклическим AMP. Дж. Биол. хим. 260, 3255–3258. doi: 10.1016/s0021-9258(19)83613-x
Полнотекстовая перекрестная ссылка | Академия Google
Мяо, М., Беллингем, К.М., Шталь, Р.Дж., Ситарз, Э.Е., Лейн, К.Дж., и Кили, Ф.В. (2003). Детерминанты последовательности и структуры для самоагрегации рекомбинантных полипептидов, смоделированных по образцу эластина человека. Дж. Биол. хим. 278, 48553–48562. doi: 10.1074/jbc.M308465200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мяо, М., Брюс А.Е., Бханджи Т., Дэвис Э.К. и Кили Ф.В. (2007). Дифференциальная экспрессия двух генов тропоэластина у рыбок данио. Матрица Биол. 26, 115–124. doi: 10.1016/j.matbio.2006.09.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мяо, М., Райхельд, С.Э., Муизниекс, Л.Д., Хуан, Ю., и Кили, Ф.В. (2013). Белок, связывающий эластин, и FKBP65 модулируют самосборку тропоэластина человека in vitro. Биохимия 52, 7731–7741.дои: 10.1021/bi400760f
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мяо, М., Райхельд, С. Э., Муизниекс, Л. Д., Ситарз, Э. Э., Шарп, С., и Кили, Ф. В. (2017). Однонуклеотидные полиморфизмы и варианты домена/сплайсинга модулируют сборку и эластомерные свойства человеческого эластина. Последствия для тканевой специфичности и долговечности эластической ткани. Биополимеры 107:e23007. дои: 10.1002/бип.23007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мяо, М., Stahl, R.J., Petersen, L.F., Reintsch, W.E., Davis, E.C., and Keeley, F.W. (2009). Характеристика необычного тропоэластина с укороченным С-концом у лягушки. Матрица Биол. 28, 432–441. doi: 10.1016/j.matbio.2009.07.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Митье, С. М., Уайз, С. Г., Рафтери, М. Дж., Старчер, Б., и Вайс, А. С. (2005). Модель двухкомпонентной системы для изучения архитектуры сборки эластина in vitro. Дж. Структура. биол. 149, 282–289. doi: 10.1016/j.jsb.2004.11.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Muiznieks, L.D., Jensen, S.A., and Weiss, A.S. (2003). Структурные изменения и облегченная ассоциация тропоэластина. Арх. Биохим. Биофиз. 410, 317–323. doi: 10.1016/s0003-9861(02)00719-1
Полнотекстовая перекрестная ссылка | Академия Google
Муйжниекс, Л. Д., Райхельд, С. Э., Ситарз, Э. Э., Мяо, М., и Кили, Ф.В. (2015). Гидрофобные домены с низким содержанием пролина модулируют сборку и свойства материала полимерного эластина. Биополимеры 103, 563–573. дои: 10.1002/бип.22663
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мурата, К., и Вольф, М. (2018). Криоэлектронная микроскопия для структурного анализа динамических биологических макромолекул. Биохим. Биофиз. Acta Gen. Subj. 1862, 324–334. doi: 10.1016/j.bbagen.2017.07.020
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Майерс, Б., Дубик, М., Ласт, Дж. А., и Рукер, Р. Б. (1983). Синтез эластина во время перинатального развития легких у крыс. Биохим. Биофиз. Acta 761, 17–22. дои: 10.1016/0304-4165(83)-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нараянан А.С., Сандберг Л.Б., Росс Р. и Лейман Д.Л. (1976). Гладкомышечная клетка. III. Синтез эластина в культуре гладкомышечных клеток артерий. J. Cell Biol. 68, 411–419. doi: 10.1083/jcb.68.3.411
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нода К., Дабович Б., Такаги К., Иноуэ Т., Хоригучи М., Хираи М. и др. (2013). Латентный TGF-β-связывающий белок 4 способствует сборке эластических волокон путем взаимодействия с фибулином-5. Проц. Натл. акад. науч. США 110, 2852–2857. doi: 10.1073/pnas.1215779110
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ногучи А., Фиршинг К., Курсар Дж. Д. и Редди Р. (1990).Изменения синтеза тропоэластина легочными фибробластами крысы в процессе развития и эффекты дексаметазона. Педиатр. Рез. 28, 379–382. дои: 10.1203/00006450-19
00-00015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Озвар, Дж., Тараканова, А., Ван, Р., Бюлер, М.Дж., и Вайс, А.С. (2019). Модификации аллизина нарушают структуру и подвижность тропоэластина в локальном и глобальном масштабе. Матрица Биол. Плюс 2:100002. doi: 10.1016/j.mbplus.2019.03.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Parks, WC, Roby, JD, Wu, LC, and Grosso, LE (1992). Клеточная экспрессия вариантов сплайсинга мРНК тропоэластина. Матрица 12, 156–162. doi: 10.1016/s0934-8832(11)80057-0
Полнотекстовая перекрестная ссылка | Академия Google
Партридж, С. М. (1966). Биосинтез и природа структур эластина. Фед. проц. 25, 1023–1029.
Академия Google
Пепе, А., Flamia, R., Guerra, D., Quaglino, D., Bochicchio, B., Pasquali Ronchetti, I., et al. (2008). Полипептид, кодируемый экзоном 26: изолированный гидрофобный домен тропоэластина человека, способный к самосборке in vitro. Матрица Биол. 27, 441–450. doi: 10.1016/j.matbio.2008.02.006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Финикариду А., Ласерда С., Лавин Б., Андиа М.Е., Смит А., Саха П. и др. (2018). Тропоэластин: новый маркер прогрессирования и нестабильности бляшек. Обр. Кардиовас. Изображение 11:e007303. doi: 10.1161/circimaging.117.007303
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Прашаанна, А., Тейлор, П.А., Цинь, Дж., Киик, К.Л., и Джаяраман, А. (2019). Влияние пептидной последовательности на LCST-подобный переход эластиноподобных пептидов и конъюгатов эластиноподобный пептид–коллагеноподобный пептид: моделирование и эксперименты. Биомакромолекулы 20, 1178–1189. doi: 10.1021/acs.biomac.8b01503
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Раушер, С., Бод, С., Мяо, М., Кили, Ф.В., и Помес, Р. (2006). Пролин и глицин контролируют самоорганизацию белка в эластомерные или амилоидные фибриллы. Строение 14, 1667–1676. doi: 10.1016/j.str.2006.09.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Reichheld, S.E., Muiznieks, L.D., Huynh, Q., Wang, N., Ing, C., Miao, M., et al. (2020). Эволюционный фон и функциональные последствия полиморфизма rs2071307 в тропоэластине человека. Биополимеры [Epub перед печатью].
Академия Google
Райхельд, С.Э., Муизниекс, Л.Д., Кили, Ф.В., и Шарп, С. (2017). Прямое наблюдение за структурой и динамикой при фазовом разделении эластомерного белка. Проц. Натл. акад. науч. США 112, E4408–E4415. doi: 10.1073/pnas.1701877114
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рейхельд, С. Э., Муизниекс, Л. Д., Лу, Р., Шарп, С., и Кили, Ф.В. (2019). Варианты последовательности тропоэластина человека, влияющие на сборку, структурные характеристики и функциональные свойства полимерного эластина в норме и при патологии. Матрица Биол. 84, 68–80. doi: 10.1016/j.matbio.2019.06.010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Райхельд С.Э., Муизниекс Л.Д., Шталь Р., Симонетти К., Шарп С. и Кили Ф.В. (2014). Конформационные переходы сшивающих доменов эластина при самосборке. Дж. Биол. хим. 289, 10057–10068. doi: 10.1074/jbc.M113.533893
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рейерсен, Х., и Рис, А. Р. (2000). Трифторэтанол может образовывать растворяющую матрицу для вспомогательных гидрофобных взаимодействий между боковыми цепями пептидов. Белок Eng. 13, 739–743. doi: 10.1093/белок/13.11.739
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Робертс С., Джурицкий М. и Чилкоти А.(2015). Эластиноподобные полипептиды как модели внутренне неупорядоченных белков. Письмо ФЭБС. 589 (19 часть А), 2477–2486. doi: 10.1016/j.febslet.2015.08.029
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Роджерс, У. Р., и Вайс, А. С. (2004). Интегрин альфа v бета 3 связывается с уникальным не-RGD сайтом вблизи С-конца тропоэластина человека. Биохимия 86, 173–178. doi: 10.1016/j.biochi.2004.03.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сандберг, Л.Б., Грей В.Р., Фостер Дж.А., Торрес А.Р., Альварес В.Л. и Джаната Дж. (1977). Первичная структура свиного тропоэластина. Доп. Эксп. Мед. биол. 79, 277–284. дои: 10.1007/978-1-4684-9093-0_25
Полнотекстовая перекрестная ссылка | Академия Google
Скандолера, А., Одул, Л., Салес, С., Гийо, А., Блейз, С., Кавеки, С., и соавт. (2016). Комплекс рецепторов эластина: уникальный матрицеллюлярный рецептор с высоким противоопухолевым потенциалом. Фронт. Фармакол. 7:32.doi: 10.3389/fphar.2016.00032
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Schmelzer, C.E.H., Heinz, A., Troilo, H., Lockhart-Cairns, M.P., Jowitt, T.A., Marchand, M.F., et al. (2019). Опосредованное лизилоксидазой 2 (LOXL2) поперечное связывание тропоэластина. FASEB J. 33, 5468–5481. doi: 10.1096/fj.201801860
руб.Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шрадер К.У., Хайнц А., Майовски П., Караман Маяк Б., Brinckmann, J., Sippl, W., et al. (2018). Эластин гетерогенно сшит. Дж. Биол. хим. 293, 15107–15119. doi: 10.1074/jbc.RA118.004322
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шапиро С., Эндикотт С., Провинс М., Пирс Дж. и Кэмпбелл Э. (1991). Заметная продолжительность жизни паренхиматозных эластических волокон легких человека обусловлена преобладанием D-аспартата и радиоуглерода, связанного с ядерным оружием. Дж. Клин. расследование 87, 1828–1834 гг.doi: 10.1172/jci115204
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шерратт, М., Весс, Т.Дж., Болдок, К., Эшворт, Дж., Перслоу, П., Шаттлворт, К., и другие. (2001). Богатые фибриллином микрофибриллы внеклеточного матрикса: ультраструктура и сборка. Микрон 32, 185–200. doi: 10.1016/s0968-4328(99)00082-7
Полнотекстовая перекрестная ссылка | Академия Google
Тадзима, С., Вати, Х., Уэмура, Ю., и Окамото, К. (1997). Модуляция эластиновым пептидом VGVAPG клеточной пролиферации и экспрессии эластина в фибробластах кожи человека. Арх. Дерматол. Рез. 289, 489–492. doi: 10.1007/s004030050227
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тамбурро, А. М., Бочикчио, Б., и Пепе, А. (2003). Рассечение человеческого тропоэластина: экзоновый химический синтез и связанные с ним конформационные исследования. Биохимия 42, 13347–13362. дои: 10.1021/bi034837t
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тамбурро, А. М., Гуантьери, В., и Гордини, Д.Д. (1992). Синтез и структурные исследования пентапептидной последовательности эластина. Поли (Вал-Гли-Гли-Леу-Гли). Дж. Биомол. Структура Дин. 10, 441–454. дои: 10.1080/073
.1992.10508661
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тамбурро, А. М., Пепе, А., и Бочиккио, Б. (2006). Локализация альфа-спиралей в тропоэластине человека: сборка эластиновой «головоломки». Биохимия 45, 9518–9530. дои: 10.1021/bi060289i
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тараканова А.и Бюлер, MJ (2013). Молекулярное моделирование белковых материалов: пример эластина. Модель . Симул. Матер. науч. англ. 21:063001. дои: 10.1088/0965-0393/21/6/063001
Полнотекстовая перекрестная ссылка | Академия Google
Тараканова А., Хуанг В., Вайс А. С., Каплан Д. Л. и Бюлер М. Дж. (2017). Вычислительный интеллектуальный дизайн полимера, основанный на изменчивости белка эластина. Биоматериалы 127, 49–60. doi: 10.1016/j.biomaterials.2017.01.041
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тараканова А., Озвар, Дж., Вайс, А.С., и Бюлер, М.Дж. (2019a). Крупнозернистая модель самосборки тропоэластина в зарождающиеся фибриллы. Матер. Сегодня биол. 3:100016. doi: 10.1016/j.mtbio.2019.100016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тараканова, А., Йео, Г. К., Балдок, К., Вайс, А. С., и Бюлер, М. Дж. (2018). Молекулярная модель тропоэластина человека и последствия связанных мутаций. Проц. Натл. акад. науч. США 115, 7338–7343.doi: 10.1073/pnas.1801205115
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тараканова, А., Йео, Г. К., Болдок, К., Вайс, А. С., и Бюлер, М. Дж. (2019b). Тропоэластин представляет собой гибкую молекулу, сохраняющую свою каноническую форму. Макромоль. Бионауч. 19:e1800250. doi: 10.1002/mabi.201800250
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тидеманн, К., Батге, Б., Мюллер, П.К., и Рейнхардт, Д.П. (2001). Взаимодействие фибриллина-1 с гепарин/гепарансульфатом, значение для сборки микрофибрилл. Дж. Биол. хим. 276, 36035–36042. doi: 10.1074/jbc.M104985200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Toonkool, P., Jensen, S.A., Maxwell, A.L., and Weiss, A.S. (2001). Гидрофобные домены тропоэластина человека взаимодействуют контекстно-зависимым образом. Дж. Биол. хим. 276, 44575–44580. doi: 10.1074/jbc.M107
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ту, Ю., и Вайс, А.С. (2010).Временные наночастицы тропоэластина являются промежуточными продуктами ранней стадии коацервации человеческого тропоэластина, агрегации которых способствуют гепарансульфат и гепариндекасахариды. Матрица Биол. 29, 152–159. doi: 10.1016/j.matbio.2009.10.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ту, Ю., Уайз, С.Г., и Вайс, А.С. (2010). Стадии коалесценции тропоэластина во время образования гидрогеля синтетического эластина. Микрон 41, 268–272.doi: 10.1016/j.micron.2009.11.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Урбан, З., Хуктагаудер, В., Шурманн, Н., Тодорович, В., Зильберберг, Л., Чой, Дж., и другие. (2009). Мутации в LTBP4 вызывают синдром нарушения развития легких, желудочно-кишечного тракта, мочеполовой системы, опорно-двигательного аппарата и кожи. утра. Дж. Хам. Жене. 85, 593–605. doi: 10.1016/j.ajhg.2009.09.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Валлет, С.Д., Миле А.Е., Уцеховска-Качмаржик У., Ливо А., Дюкло Б., Самсонов С.А. и соавт. (2018). Взгляд на структуру и динамику пропептида лизилоксидазы, гибкого белка с многочисленными партнерами. Науч. Респ. 8, 1–16.
Академия Google
Висконти, Р.П., Барт, Дж.Л., Кили, Ф.В., и Литтл, К.Д. (2003). Анализ совместного распределения эластина и родственных фибриллярных белков в раннем развитии позвоночных. Матрица Биол. 22, 109–121.doi: 10.1016/s0945-053x(03)00014-3
Полнотекстовая перекрестная ссылка | Академия Google
Врховски, Б., Дженсен, С., и Вайс, А.С. (1997). Характеристики коацервации рекомбинантного тропоэластина человека. евро. Дж. Биохим. 250, 92–98. doi: 10.1111/j.1432-1033.1997.00092.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван З., Лю Л., Митье С. М. и Вайс А. С. (2020). Изготовление организованного эластина в сосудистых трансплантатах. Тенденции биотехнологии. [Epub перед печатью]. дои: 10.1007/978-3-319-71530-8_13-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wise, S.G., Yeo, G.C., Hiob, M.A., Rnjak-Kovacina, J., Kaplan, D.L., Ng, M.K., et al. (2014). Тропоэластин: универсальный биоактивный сборочный модуль. Акта Биоматер. 10, 1532–1541. doi: 10.1016/j.actbio.2013.08.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ву, В.Дж., и Вайс, А.С. (1999).Недостаточная коацервация двух форм тропоэластина человека связана с надклапанным стенозом аорты. евро. Дж. Биохим. 266, 308–314. doi: 10.1046/j.1432-1327.1999.00891.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ямаути Ю., Цуруга Э., Накашима К., Сава Ю. и Исикава Х. (2010). Фибулин-4 и -5, но не фибулин-2, связаны с отложением тропоэластина в культуре клеток, продуцирующих эластин. Acta Histochem. Цитохим. 43, 131–138.doi: 10.1267/ahc.10026
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Yeo, G.C., Baldock, C., Tuukkanen, A., Roessle, M., Dyksterhuis, L.B., Wise, S.G., et al. (2012). Область мостика тропоэластина позиционирует взаимодействующий с клеткой С-конец и способствует сборке эластических волокон. Проц. Натл. акад. науч. США 109, 2878–2883. doi: 10.1073/pnas.1111615108
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йео, Г.К., Балдок, К., Уайз, С.Г., и Вайс, А.С. (2017). Направленная модуляция структуры и сборки тропоэластина. АЦС Биоматер. науч. англ. 3, 2832–2844. doi: 10.1021/acsbiomaterials.6b00564
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йео, Г. К., Тараканова, А., Балдок, К., Уайз, С. Г., Бюлер, М. Дж., и Вайс, А. С. (2016). Тонкий баланс молекулярной формы и гибкости тропоэластина регулирует динамику и иерархическую сборку. Науч.Доп. 2:e1501145. doi: 10.1126/sciadv.1501145
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йео, Г.К., и Вайс, А.С. (2019). Растворимый белок матрикса является мощным модулятором активности мезенхимальных стволовых клеток. Проц. Натл. акад. науч. США 116, 2042–2051. doi: 10.1073/pnas.1812951116
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Юэ К., Ли Х., Шроббак К., Шейхи А., Аннаби Н., Лейтен Дж. и соавт.(2017). Структурный анализ фотосшиваемых метакрилоил-модифицированных белковых производных. Биоматериалы 139, 163–171. doi: 10.1016/j.biomaterials.2017.04.050
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Что такое эластин? — Определение и объяснение — Видео и стенограмма урока
Функция
Если сжать кожу на руке, а затем отпустить ее, вы заметите, что она возвращается на место. Ваша кожа способна сделать это, потому что она содержит эластин.Это очень важное качество — только представьте себе, какие неприятности и трудности возникнут у вас, если ваша кожа не сможет вернуться на свое законное место.
Эластин также является важным компонентом выстилки вен и артерий. Когда вы идете к врачу, первое, что он, вероятно, делает, это проверяет ваше кровяное давление. Изменения в нашем организме вызывают повышение и понижение артериального давления в течение дня. Для наших вен и артерий важно уметь приспосабливаться к изменениям давления.Эластичность белка эластина позволяет эту регулировку.
Такие органы, как наши легкие, также сильно зависят от эластина. С каждым вдохом ваши легкие должны расширяться и сжиматься. Эластин, содержащийся в тканях легких, позволяет им возвращаться к своей первоначальной форме после каждого вдоха. Если бы наши легкие не были в состоянии сделать это, мы бы не смогли выжить.
Для нас также нормально набирать и терять вес на протяжении всей жизни. Эластин имеет решающее значение для того, чтобы позволить нашей коже в некоторой степени вернуться на место после потери веса и позволить коже сгибаться во время упражнений.С возрастом количество эластина, вырабатываемого нашим телом, уменьшается, что приводит к образованию морщин на коже и ее провисанию в некоторых местах. Многие косметические компании воспользовались научными данными о эластине в нашем теле и предлагают кремы и другие продукты, которые рекламируются как содержащие эластин для уменьшения морщин.
Краткий обзор урока
Белки имеют решающее значение для всего, что мы делаем. Одним из важных белков в организме человека является эластин . Эластин — это гибкий белок, который позволяет нашей коже, а также всем органам, окруженным соединительной тканью, принимать свою первоначальную форму.Эта эластичность имеет решающее значение для многих жизненных процессов, включая дыхание и движение.
Эластин локализован в межфасцикулярной матрице энергоаккумулирующих сухожилий и с возрастом становится все более дезорганизованным
Александр Р. Энергосберегающие механизмы при ходьбе и беге. Дж. Экспл. биол. 69 , 55–69 (1991).
Google Scholar
Бенджамин М. и Ральфс Дж. Р. Сухожилия и связки: обзор.pdf. Гистол. Гистопатол. 12 , 1135–1144 (1997).
КАС пабмед Google Scholar
Кубо К., Каваками Ю., Канехиса Х. и Фукунага Т. Измерение вязкоупругих свойств сухожильных структур in vivo . Скан. Дж. Мед. науч. Спорт 12 , 3–8 (2002).
Артикул пабмед Google Scholar
Кер, Р. Механика сухожилия с инженерной точки зрения. Междунар. Дж. Усталость 29 , 1001–1009 (2007).
КАС Статья МАТЕМАТИКА Google Scholar
Thorpe, C.T., Clegg, P.D. & Birch, H.L. Обзор травм сухожилий: почему сухожилие поверхностного сгибателя пальцев у лошадей подвергается наибольшему риску? Ветеринар по лошадям.Дж. 42 , 174–80 (2010).
КАС Статья пабмед Google Scholar
Шеперд, Дж. Х. и др. . Функционально разные пучки сухожилий демонстрируют различное поведение при ползучести и релаксации напряжения. Проц. Инст. мех. англ. Н . doi: 10.1177/0954411
9977 (2013).
Lui, P.P.Y., Maffulli, N., Rolf, C. & Smith, R.K.W. Каковы утвержденные модели тендинопатии на животных? Скан.Дж. Мед. науч. Спорт 21 , 3–17 (2011).
КАС Статья пабмед Google Scholar
Innes, J. F. & Clegg, P. Сравнительная ревматология: что можно узнать из естественных заболеваний опорно-двигательного аппарата у домашних животных? Ревматология (Оксфорд). 49 , 1030–9 (2010).
Артикул пабмед Google Scholar
Берч, Х.Л., Бейли, Дж.В., Бейли, А.Дж. и Гудшип, А.Е. Возрастные изменения молекулярных и клеточных компонентов сухожилий сгибателей лошадей. Ветеринар по лошадям. Дж. 31 , 391–6 (1999).
КАС Статья пабмед Google Scholar
Thorpe, C., Udeze, C.P., Birch, H.L., Clegg, P.D. & Screen, H.R.C. Специализация механических свойств сухожилий является результатом межфасцикулярных различий. JR Soc. Интерфейс 9 , 3108–17 (2012).
Артикул пабмед ПабМед Центральный Google Scholar
Thorpe, C., Udeze, C.P., Birch, H.L., Clegg, P.D. & Screen, H.R.C. Способность к скольжению между пучками сухожилий снижается с возрастом в поврежденных сухожилиях лошадей: возможный механизм возрастной тендинопатии? евро. Клетка. Матер. 25 , 48–60 (2013).
КАС Статья пабмед Google Scholar
Thorpe, C. T. и др. . Анатомическая неоднородность сухожилия: фасцикулярные и межпучковые отделы сухожилий имеют разный протеомный состав. Науч. Респ. 6 , 20455 (2016).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Каннус, П. Структура соединительной ткани сухожилия. Скан. Дж. Мед. науч. Спорт 10 , 312–20 (2000).
КАС Статья пабмед Google Scholar
Fallon, J., Blevins, F.T., Vogel, K. & Trotter, J. Функциональная морфология сухожилия надостной мышцы. Дж. Ортоп. Рез. 20 , 920–6 (2002).
Артикул пабмед Google Scholar
Grant, T.M., Thompson, M.S., Urban, J. & Yu, J. Эластические волокна широко распространены в сухожилиях и сильно локализованы вокруг теноцитов. Дж. Анат. 222 , 573–579 (2013).
КАС Статья пабмед ПабМед Центральный Google Scholar
Thorpe, C. T. и др. . Распределение белков в разных отделах сухожилия зависит от типа сухожилия. Дж. Анат. 229 , 450–458 (2016).
КАС Статья пабмед ПабМед Центральный Google Scholar
Смит, К. Д. и др. . Организация эластина и фибриллинов 1 и 2 в комплексе крестообразных связок. Дж. Анат. 218 , 600–7 (2011).
КАС Статья пабмед ПабМед Центральный Google Scholar
Wagenseil, J.E. & Mecham, R.P. Эластин при жесткости крупных артерий и гипертонии. Дж. Кардиовасц. Транс Рез 5 , 264–273 (2013).
Артикул Google Scholar
Пирс, Дж. А. и Хокотт, Дж. Б. Исследования содержания коллагена и эластина в легких человека. Дж. Клин. Вкладывать деньги. 39 , 8–14 (1960).
КАС Статья пабмед ПабМед Центральный Google Scholar
Браверман И.М. и Фонферко Э. Исследования старения кожи: I. Сеть эластических волокон. Дж. Инвест. Дерматол. 78 , 434–443 (1982).
КАС Статья пабмед Google Scholar
Oxlund, H., Manschot, J. & Vhdik, A. Роль эластина в механических свойствах кожи. Дж. Биомех. 21 , 213–218 (1988).
КАС Статья пабмед Google Scholar
Фостер, Дж. А., Брюнгер, Э., Грей, В. Р. и Сандберг, Л. Б. Выделение и аминокислотные последовательности пептидов тропоэластина *. Дж. Биол. хим. 248 , 2876–2879 (1973).
КАС пабмед Google Scholar
Фостер, Дж. А. и др. .Выделение и характеристика сшитых пептидов из эластина. Дж. Биол. хим. 249 , 6191–6197 (1974).
КАС пабмед Google Scholar
Рамирес Ф. и Перейра Л. Фибриллины. Междунар. Дж. Биохим. Клеточная биол. 31 , 255–259 (1999).
КАС Статья пабмед Google Scholar
Vrhovski, B. & Weiss, A.S. Обзор: Биохимия тропоэластина. Евро J Биохим. 258 , 1–18 (1998).
КАС Статья пабмед Google Scholar
Bedell-Hogan, D., Trackman, P., Abrams, W., Rosenbloom, J. & Kagan, H. Окисление, перекрестное связывание и перевод в нерастворимую форму рекомбинантного тропоэластина очищенной лизилоксидазой. Дж. Биол. хим. 268 , 10345–10350 (1993).
КАС пабмед Google Scholar
Акагава М. и Суяма К. Механизм образования поперечных связей эластина. Подключить. Ткань Res. 41 , 131–141 (2000).
КАС Статья пабмед Google Scholar
Роберт, Л., Роберт, А. и Фюлёп, Т. Быстрое увеличение продолжительности жизни человека: скоро ли оно будет ограничено старением эластина? Биогеронтология 9 , 119–133 (2008).
КАС Статья пабмед Google Scholar
Луизетти М. и др. . Десмозин как биомаркер деградации эластина при ХОБЛ: текущее состояние и будущие направления. евро. Дыхание Дж. 32 , 1146–1157 (2008).
КАС Статья пабмед Google Scholar
Шеррат, М. Дж.Эластичность тканей и старение эластических волокон. Эпоха (Дордр). 31 , 305–25 (2009).
КАС Статья пабмед ПабМед Центральный Google Scholar
Lee, T.C., Midura, R.J., Hascall, V.C. & Vesely, I. Влияние повреждения эластина на механику аортального клапана. Дж. Биомех. 34 , 203–210 (2001).
КАС Статья пабмед Google Scholar
Heinz, A., Taddese, S., Sippl, W., Neubert, R. & Schmelzer, C. Взгляд на деградацию человеческого эластина матрилизином-1. Биохимия 93 , 187–194 (2011).
КАС Статья пабмед Google Scholar
Виера, А. Дж. и Гаррет, Дж.M. Понимание соглашения между наблюдателями: статистика Каппа. Фам Мед 37 , 360–363 (2005).
ПабМед Google Scholar
Thorpe, C. T. и др. . Перегрузка сухожилий приводит к изменению формы клеток и увеличению маркеров воспаления и деградации матрикса. Скан. Дж. Мед. науч. Спорт doi:10.1111/sms.12333 (2015).
Tempfer, H. & Traweger, A. Сосудистая система сухожилий в норме и при патологии. Фронт. Физиол. 6 , 1–7 (2015).
Артикул Google Scholar
Fenwick, S.A., Hazleman, B.L. & Riley, G.P. Сосудистая сеть и ее роль в поврежденном и заживающем сухожилии. Артрит Рез. 4 , 252–260 (2002).
Артикул пабмед ПабМед Центральный Google Scholar
Лю, З. Масштабный космический подход к направленному анализу изображений. Заяв. Опц. 30 , 1369–1373 (1991).
ОБЪЯВЛЕНИЕ КАС Статья пабмед Google Scholar
Беренс, П. CircStat: набор инструментов MATLAB для круговой статистики. J. Стат. ПО 31 , 1–21 (2009).
MathSciNet Статья Google Scholar
Дакин, С. Г. и др. . Протеомный анализ внеклеточного матрикса сухожилий выявляет специфичную для стадии заболевания фрагментацию и дифференциальное расщепление COMP (хрящевого олигомерного матриксного белка). Дж. Биол. хим. 289 , 4919–4927 (2014).
КАС Статья пабмед ПабМед Центральный Google Scholar
Роберт Л., Роберт А. М. и Фу Т. Быстрое увеличение продолжительности жизни человека: скоро ли оно будет ограничено старением эластина? Биогеронтология 9 , 119–133 (2008).
КАС Статья пабмед Google Scholar
Greenwald, S. E. Старение проводящих артерий. Дж. Патол. 211 , 157–172 (2007).
КАС Статья пабмед Google Scholar
Thorpe, C.T., Riley, G.P., Birch, H.L., Clegg, P.D. & Screen, H.R.C. Пучки и межпучковая матрица демонстрируют снижение усталостной долговечности по мере старения в запасающих энергию сухожилиях. Акта Биоматер. 42 , 308–315 (2016).
Артикул пабмед ПабМед Центральный Google Scholar
Thorpe, C. T. и др. . Межпучковая матрица обеспечивает скольжение и восстановление пучков в сухожилиях и ведет себя более эластично в запасающих энергию сухожилиях. Дж. Мех. Поведение Биомед. Матер. 52 , 85–94 (2015).
Артикул пабмед ПабМед Центральный Google Scholar
Thorpe, C.T., Riley, G.P., Birch, H.L., Clegg, P.D. & Screen, H.R.C. Пучки и межпучковая матрица показывают адаптацию к сопротивлению усталости в запасающих энергию сухожилиях. Акта Биоматер. 42 , 308–315 (2016).
Артикул пабмед ПабМед Центральный Google Scholar
Анвар, Р. А. В Биохимическое образование 18 , 162–166 (1990).
Batson, E. L. et al . Определяются ли свойства материала и матричный состав сухожилий сгибателей и разгибателей лошадей их функциями? Ветеринар по лошадям. Дж. 35 , 314–8 (2003).
КАС Статья пабмед Google Scholar
Грант, Т. М., Япп, К., Чен, К., Чернушка, Дж. Т. и Томпсон, М. С. Механические, структурные и композиционные изменения сухожилий, подвергшихся воздействию эластазы. Энн. Биомед. англ. 43 , 2477–2486 (2015).
Артикул пабмед Google Scholar
Nimeskern, L. и др. . Состав ткани регулирует различные вязкоупругие реакции в ушном и суставном хрящах. Дж. Биомех. 49 , 344–352 (2016).
Артикул пабмед Google Scholar
Береза, Х. и др. . Скорость метаболизма матрикса различается в функционально различных сухожилиях. Матрица Биол. 27 , 182–189 (2008).
MathSciNet КАС пабмед Google Scholar
Gunja-Smith, Z. Иммуносорбентный анализ, связанный с ферментом, для количественного определения эластинового сшивающего десмозина в образцах тканей и мочи. Анал. Биохим. 147 , 258–264 (1985).
КАС Статья пабмед Google Scholar
Ватанабе Т., Ишимори К., Дж.В.Верпланке А., Мацуки Х. и Касуга Х. Иммуноферментный анализ (ИФА) для количественного определения десмозина в моче. Tokai J Exp Clin Med 14 , 347–356 (1989).
КАС пабмед Google Scholar
Csóka, T.B., Frost, G.I. & Stern, R. Гиалуронидазы при тканевой инвазии. Метастаз вторжения 17 , 297–311 (1997).
ПабМед Google Scholar
Шинделин, Дж. и др. . Фиджи — платформа с открытым исходным кодом для анализа биологических изображений. Естественные методы . 9 (2013).
Молекулярные механизмы стресс-реактивных изменений коллагеновых и эластиновых сетей в коже — Полный текст — Фармакология и физиология кожи 2016, Vol. 29, № 4
Аннотация
Коллагеновые и эластиновые сети составляют большую часть внеклеточного матрикса во многих органах, таких как кожа.Механизмы, участвующие в поддержании гомеостатического равновесия этих сетей, многочисленны и включают регуляцию генетической экспрессии, секрецию фактора роста, сигнальные пути, системы вторичной передачи сообщений и активность ионных каналов. Однако многие факторы способны нарушать эти пути, что приводит к нарушению гомеостатического равновесия. В конечном итоге это приводит к изменениям физической природы кожи, как функционально, так и косметически. Хотя были идентифицированы различные факторы, включая канцерогенез, воздействие ультрафиолета и механическое растяжение кожи, было обнаружено, что многие из них влияют на аналогичные компоненты регуляторных путей, такие как фибробласты, лизилоксидаза и фибронектин.Кроме того, было обнаружено, что различные пути регуляции пересекаются друг с другом на разных стадиях, а не работают независимо друг от друга. В этом обзорном документе предлагается модель, которая объясняет, как эти молекулярные пути пересекаются друг с другом и как различные внутренние и внешние факторы могут нарушать эти пути, что в конечном итоге приводит к нарушению сетей коллагена и эластина.
© 2016 S. Karger AG, Базель
Введение
Кожа является самым большим органом в организме человека и выступает в качестве первой линии защиты организма, защищая внутренние органы от внешних травм и патогенных инфекций [1].Он состоит из трех слоев (рис. 1): самого внешнего слоя, называемого эпидермисом, более толстого и эластичного среднего слоя, называемого дермой, и внутреннего слоя, называемого гиподермой [2]. Дермальный слой придает коже прочность и эластичность благодаря высокому содержанию коллагеновых и эластиновых волокон [3]. Высокое содержание коллагена и эластина в основном присутствует в ретикулярной части дермального слоя.
Рис. 1
Распределение коллагена в анатомии кожи. По сравнению с верхними слоями дермы, такими как эпидермис и сосочковая дерма, ретикулярная область богата коллагеновыми и эластиновыми волокнами.
Вязкоупругость, свойство обратимой деформации, позволяет коже растягиваться до определенного физиологического предела при физической нагрузке, а затем возвращаться в состояние покоя после снятия нагрузки [1]. Скольжение и перестройка коллагеновых фибрилл позволяет коже деформироваться, сохраняя ее целостность и предотвращая повреждение, а эластические волокна возвращают кожу в исходное состояние после снятия внешней силы [4]. Помимо механического стресса, биологические (рак и старение) и факторы окружающей среды (солнечный и ультрафиолетовый свет, УФ) также способны изменять архитектуру и структурные свойства сетей коллагена и эластина в коже [5].
Физиологические изменения, происходящие в коже после воздействия этих факторов, могут быть взаимосвязаны и влиять друг на друга. Комбинация воздействий может также иметь комбинированный эффект из-за взаимосвязанного характера их физиологических реакций. Этот обзор направлен на то, чтобы выделить структурные и механические свойства коллагена и эластина в коже и описать, как различные факторы могут влиять на эти свойства или изменять их.
Синтез и классификация коллагена
Коллаген является наиболее распространенным структурным белком в организме и может быть обнаружен в соединительной ткани, костях, хрящах и коже [5,6].Коллаген может быть организован в различные структурные конформации, такие как фибриллярный коллаген, коллаген базальной мембраны, фибрилл-ассоциированные коллагены с прерванными тройными спиралями и трансмембранный коллаген [7]. В центре внимания этого обзора будет фибриллярный коллаген, который можно найти в изобилии в коже человека. В коже коллагеновые волокна составляют три четверти ее сухого веса [8,9]. В образовании коллагена участвуют несколько иерархических уровней (рис. 2). Структура самого низкого порядка известна как тропоколлаген, представляющий собой тройную спиральную структуру с правым вращением, состоящую из 3 полипептидных цепей [10].Водородные связи, образующиеся внутри тройной спиральной структуры, обеспечивают стабильность и являются наиболее распространенными в животном мире [9]. Ковалентно сшитые молекулы тропоколлагена образуют полимерные коллагеновые фибриллы, а коллагеновые фибриллы агрегируют, образуя коллагеновые волокна [11]. Комбинация полипептидных цепей, образующих тропоколлаген, определяет типы образующихся коллагеновых фибрилл. На сегодняшний день идентифицировано 46 различных полипептидных цепей, которые синтезируются генами, названными в честь типа продуцируемых ими полипептидных цепей.Например, COL1A1 представляет собой ген, который синтезирует цепь альфа-1 коллагена типа I, тогда как COL4A6 синтезирует цепь альфа-6 коллагена типа IV. Эти 46 полипептидных цепей могут объединяться, образуя 28 различных типов коллагена [12,13]. Коллаген типа I и типа III преобладает в коже и может быть обнаружен в изобилии в дермальном слое, в то время как коллаген типа V, VI, VII и XI также может быть обнаружен по всей коже в различных количествах [9,14].
Рис. 2
Синтез коллагена: 3 полипептидные цепи ( a ) образуют тройную спиральную структуру, известную как тропоколлаген ( b ).Затем молекулы тропоколлагена укладываются друг на друга в шахматном порядке ( c ), что приводит к перекрытию и разрыву областей, которые придают коллагеновым фибриллам характерный рисунок полос, известный как D-период ( d ). Изображение с атомно-силового микроскопа ( d ) было получено с использованием атомно-силового микроскопа NanoWizard® 3 (JPK Instruments, Германия) на стоматологическом факультете Университета Малайи. На изображении показаны коллагеновые фибриллы, присутствующие в коже головы овцы Дорпер.
Структура коллагеновых волокон и биомеханические свойства
Коллагеновые волокна широко изучались для определения их структурных и биомеханических свойств [6,15,16].Молекулы тропоколлагена, основные структурные единицы коллагена, имеют размеры приблизительно 1,6 нм в диаметре и 300 нм в длину [17] и образуют стопку, известную как четвертьступенчатая сборка [18]. Спирально закрученные трипептидные структуры тропоколлагена стабилизированы межцепочечными Н-связями при накручивании друг на друга (рис. 2). Такое расположение молекул приводит к четким образцам полос, наблюдаемым в коллагеновых фибриллах, где области перекрытия и разрыва чередуются вдоль фибриллы. Соседние области перекрытия и разрыва образуют D-период размером примерно 67 нм, где области перекрытия имеют размер примерно 31 нм (0.46 дптр), а размеры зазоров составляют 36 нм (0,54 дптр).
Установлено, что свойства молекул коллагена (фибрилл) отражаются в структурах более высокого порядка, которые они образуют (рис. 3) из-за их большого количества, таких как сухожилия, связки и кожа [19,20,21] . Модуль Юнга (YM) является общим свойством коллагена и коллагеновых тканей, которое измеряется как средство описания его биомеханических свойств. Он определяется как отношение напряжения к деформации [6]. Другими словами, YM описывает внутреннюю способность материалов сопротивляться деформации при приложении физической силы [22].Коллаген и коллагеновые ткани обладают уникальным свойством, заключающимся в резком увеличении жесткости при приложении нагрузки [23]. Напряжение, проявляемое коллагеновыми тканями, примерно экспоненциально приложенной деформации [24]. Различные коллагеновые ткани имеют разные значения YM; однако эти значения сильно различаются из-за ряда факторов. Функция является самой сильной детерминантой YM ткани. Такие ткани, как кожа, легкие и кровеносные сосуды, должны выдерживать упругое растяжение, но не требуют большой силы для деформации, что соответствует относительно более низкому значению YM.Другие структурные ткани, такие как хрящи и кости, должны быть достаточно прочными, чтобы выдерживать силы сжатия, и, таким образом, иметь более высокие значения YM по сравнению с ними [25].
Рис. 3
Биомеханические свойства коллагена на молекулярном (более низком уровне) уровне отражаются в тканях (более высокого порядка), которые они формируют.
Сообщаемые значения YM сильно различаются даже для одного и того же типа ткани. Такая изменчивость объясняется, помимо прочего, измерениями in vivo и ex vivo, уровнем гидратации образцов тканей, временным интервалом во время сбора образцов ткани после смерти, температурой хранения образца и временем измерения YM, а также методами измерения YM, такими как методы вдавливания или растяжения [22].Сообщалось, что кожа демонстрирует значения YM в диапазоне от 6 кПа до 50 МПа при измерении вдавливанием и от 21 до 39 МПа при измерении растяжением при растяжении [22].
Как и у большинства биологических образцов, кривая напряжение-деформация коллагеновых тканей, таких как кожа (рис. 4), нелинейна [26]. Кривые коллагеновых тканей также имеют J-образную форму и обычно делятся на три области [19,27,28,29]. Первая известна как носочная часть и соответствует части кривой, которая наиболее параллельна оси x, обычно до деформации около 0.3. На этом этапе удаляются микроскопические извитости коллагеновых фибрилл, и коллаген оказывает небольшое сопротивление приложенному стрессу. Это связано с естественной волнистой и связанной природой коллагена. В поведении кожи на этой стадии преобладают эластические волокна [1], и для возникновения больших деформаций достаточно небольшого напряжения. Это способствует низкой деформации на этом участке кривой. При более высоких деформациях наклон кривой увеличивается, и эта область известна как пяточная область.Молекулярные перегибы в областях разрывов фибрилл начинают распрямляться, а фибриллы начинают растягиваться и перестраиваться в направлении приложенного напряжения. На этой стадии кривой напряжение-деформация коллаген начинает сопротивляться деформации, и для продолжения деформации ткани требуется большее напряжение. Заключительный этап кривой напряжения-деформации называется линейным участком и соответствует участку кривой с наибольшим наклоном. Коллагеновые фибриллы уже перестроились, а перегибы в области разрыва выпрямились в направлении приложенной силы.Следовательно, при сильном стрессе деформация, вероятно, вызывается скольжением соседних молекул коллагена или растяжением молекул тропоколлагена внутри самих фибрилл. Однако при определенных условиях in vitro можно наблюдать четвертую область. На этом этапе величина напряжения, прикладываемого к коллагеновым тканям, слишком велика, что приводит к превышению предела текучести фибрилл и, в конечном итоге, к отказу, когда некоторые фибриллы ломаются [21,28].
Рис. 4
Кривая напряжение-деформация для кожи с морфологией коллагена на каждой соответствующей стадии. a Пальцевая область. б Пяточная область. c Линейная область. d Четвертая область: при определенных условиях in vitro можно наблюдать четвертую область. На этом этапе величина напряжения, прикладываемого к коллагеновым тканям, слишком велика, что приводит к превышению предела текучести фибрилл и, в конечном итоге, к отказу, когда некоторые фибриллы ломаются.
Эластиновый каркас, синтез и сборка
Внеклеточный матрикс (ECM) сосудистой и других соединительных тканей состоит из сети эластических волокон.Биосинтез эластических волокон представляет собой сложный процесс, начинающийся с синтеза растворимой формы эластина, известного как тропоэластин, который посттрансляционно модифицируется, упаковывается, собирается, сшивается и транспортируется в ВКМ для формирования пучков зрелых волокон. эластичные волокна. Эластические волокна, наиболее важная часть ВКМ, состоят из двух основных компонентов: (i) сердцевины из полимерного нерастворимого эластина и (ii) периферической оболочки из микрофибрилл трубчатого вида [30]. Микрофибриллярные каркасы будут определять форму и ориентацию эластических волокон после отложения молекул тропоэластина [31,32].Эластин содержит ряд гидрофобных аминокислот, таких как валин, аланин, глицин и пролин [33]. Эластин наиболее распространен в эластических волокнах, что способствует характерным свойствам упругой отдачи.
В то время как коллаген придает коже прочность на растяжение, эластические волокна обеспечивают растяжимость и обратимую упругость кожи, что позволяет ей выдерживать повторяющиеся механические деформации без необратимых пластических повреждений [34]. Кривые растяжения кожи (рис.4) в значительной степени иллюстрируют свойства коллагена благодаря его большому содержанию; однако в области пальцев на кривой механические свойства кожи отражают свойства эластических волокон [1].
Окрашивание по Верхоффу с контрастным окрашиванием по Ван Гизону позволяет дифференцировать сине-черный эластин от коллагена и гладких мышц [35]. Другие типы окрашивания эластина включают окрашивание альдегид-фуксином Луны [36] и окрашивание резорцин-фуксином Вейгерта [37]. Под световым микроскопом эластические волокна обычно выглядят волнистыми [33].Эластические волокна, в отличие от коллагеновых, могут растягиваться и втягиваться. Наличие этих волокон позволяет коже вернуться к своей первоначальной форме после устранения любых деформирующих сил [38]. Было замечено, что в ретикулярной дерме эластические волокна кажутся грубыми и переплетаются с пучками коллагеновых волокон, в то время как в сосочковой дерме обнаруживаются более тонкие эластические волокна, которые поднимаются к эпидермису [39]. В нормальной ткани эластин имеет типичный канделяброподобный рисунок, ориентированный перпендикулярно базальной мембране [40].
Фибробласты представляют собой основную группу клеток дермы, участвующих в эластогенезе [41]. Процесс эластогенеза происходит в основном в дерме, особенно в поверхностных слоях дермы. В процессе эластогенеза мономер тропоэластина синтезируется на шероховатой эндоплазматической сети и подвергается незначительной внутриклеточной посттрансляционной модификации [42]. Во время этой фазы эластин-связывающий белок связывается с мономерами тропоэластина, превращаясь в сложную форму, прежде чем высвобождается на клеточной поверхности [43].Эта ассоциация эластин-связывающего белка и мономеров тропоэластина защищает нерастворимый эластин от протеолиза и придает ему исключительную стабильность [44]. Ранее сообщалось, что альдостерон усиливает синтез тропоэластина и проколлагена [45]. Мономеры тропоэластина подвергаются самосборке, имея эластичную N-концевую спиральную область и взаимодействующую с клеткой С-концевую ножку, поперечно сшитые вместе, чтобы сформировать сильно открытую область моста на микрофибриллах [30,46]. Таким образом, во время самосборки тропоэластина фибулин-5 и фибулин-4 могут индуцировать образование эластических волокон, а также способствовать процессу коацервации [47,48].
Тропоэластин растворим в холодных водных растворах при температуре ниже 20°C. Альтернативно, мономеры тропоэластина могут собираться в отсутствие микрофибрилл на клеточной поверхности [49]. Микрофибриллы являются первым видимым компонентом, который появляется в небольшом количестве в эластических волокнах. Лизилоксидаза (LOX) может повышать эффективность сшивания мономеров тропоэластина за счет окислительного дезаминирования остатков лизина с образованием ализина, что приводит к образованию зрелых нерастворимых эластических волокон [50]. Образование десмозиновых и изодесмозиновых поперечных связей посредством реакций аллизина-ализина или ализин-лизина также способствует биомеханическим свойствам эластических волокон, поскольку эти поперечные связи могут противостоять эластолизу [51].В совокупности эти поперечные связи придают эластичным волокнам невероятную долговечность с периодом полураспада примерно 74 года [52]. Когда LOX ингибируется, перекрестное связывание значительно снижается, что может привести к образованию дезорганизованной соединительной ткани [50]. Деградация эластических волокон может происходить, когда концентрация матриксных металлопротеиназ (ММР) в пути повышается [53].
Факторы, влияющие на динамику коллагена и эластина
Биологические факторы
Генетические мутации
Было идентифицировано более 1000 мутаций в более чем 20 генах 12 различных типов коллагена [54,55].Из них примерно 250 мутаций затрагивают коллаген типа I, затрагивая гены, кодирующие полипептидные цепи COL1A1 и COL1A2 [56]. Многие из этих мутаций были идентифицированы у пациентов, страдающих несовершенным остеогенезом, заболеванием, поражающим многие коллагеновые ткани. Замена остатков глицина, которые участвуют в водородных связях, часто вызывает наибольшее повреждение, а место замены, а также идентичность заменяющей аминокислоты могут влиять на патологию [57,58].Мутации часто вызывают образование нулевых аллелей, так как в генах создаются кодоны преждевременной терминации. Симптомы распространяются на различные части тела, богатые коллагеном типа I, такие как хрупкие кости, голубые склеры, аномальные зубы, слабые сухожилия и тонкая кожа [59,60].
Синдром Элерса-Данлоса (СЭД) представляет собой совокупность гетерогенных генетических нарушений, вызывающих гипермобильность суставов, нарушения скелета и разрыв полых органов, а также может влиять на растяжимость, истончение и хрупкость кожи.Было идентифицировано по крайней мере 9 подтипов заболевания, при этом типы I и II в первую очередь влияют на синтез коллагена типа V, но также и коллагена типа I. Эти подтипы могут характеризоваться атрофическими рубцами и повышенной растяжимостью кожи. С другой стороны, синдром Элерса-Данлоса IV типа является наиболее тяжелым подтипом, поражающим коллаген типа III. Ген COL3A1 является основной мишенью этого подтипа, в этом гене идентифицировано более 100 мутаций. Тяжесть этого подтипа обусловлена возможностью разрыва крупных артерий других полых органов [61].
Некоторые другие формы генетических заболеваний, поражающих коллаген, включают синдром Альпорта, являющийся следствием мутаций COL4A3 и COL4A5 [62, 63], миопатию Бетлема, которая следует за мутацией гена COL6A1 [64], а также множественную эпифизарную дисплазию и аутосомно-рецессивную болезнь Стиклера. синдром, который возникает после мутаций в генах COL9A1, COL9A2, COL9A3, COL11A1 и COL11A2 [65].
Cutis laxa (CL) — редкое заболевание, поражающее сборку эластических волокон. Аномалии эластичных волокон влияют на несколько систем организма, таких как дыхательная система, система кровообращения и пищеварительная система, за счет снижения эластичности таких органов, как легкие, аорта и желудочно-кишечный тракт соответственно [66].Однако наиболее очевидные клинические проявления поражают кожу. Пациенты с КЛ часто имеют дряблую обвисшую кожу, обвисшие щеки и преждевременно постаревший вид. Причиной таких симптомов является уменьшение размера и объема эластических волокон в дополнение к нарушению нормального расположения эластических волокон [67,68]. КЛ может наследоваться как по аутосомно-рецессивному, так и по аутосомно-доминантному пути. Аутосомно-рецессивный тип наследования обусловлен мутацией гена, кодирующего фибулин-5. Эта форма КЛ является наиболее тяжелой, так как большинство детей, страдающих этим заболеванием, умирают в младенчестве из-за сердечно-легочных осложнений [69,70,71,72].
Рак
Рак традиционно считался болезнью клеток-изгоев. Однако в настоящее время существует мнение, что рак на самом деле является болезнью дисбаланса, когда организм не может эффективно бороться с клетками-изгоями [73]. Одним из основных факторов, способствующих этому состоянию, является нарушение гомеостаза ВКМ. В качестве основного регулятора клеточной и тканевой функции нарушение гомеостатической среды ECM действует как ключевой компонент стромы опухоли [73].Поскольку коллаген составляет большую часть внеклеточного матрикса, его повышенная или пониженная скорость синтеза, а также структурные изменения могут влиять на злокачественность опухоли [74,75]. MMPs и тканевые ингибиторы металлопротеиназ жизненно важны для регуляции гомеостаза ECM и работают в когезии, строго регулируя деградацию коллагена [76]. Дисбаланс концентрации ММП и тканевых ингибиторов металлопротеиназ может приводить к аберрантному протеолизу ММП, что часто регистрируют при онкологических заболеваниях [77].
Во время опухолевой прогрессии внеклеточный матрикс претерпевает значительные структурные изменения, в том числе повышенный синтез и отложение протеогликанов, фибронектинов и коллагена, особенно типов I, III и IV [78]. В здоровых тканях коллаген, окружающий эпителиальные структуры, обычно гладкий и курчавый. Однако по мере развития опухоли коллаген постепенно утолщается, выпрямляется и становится жестким. Было показано, что жесткие коллагеновые матрицы увеличивают секрецию пролактина in vitro.Это способствует метастазированию и прогрессированию опухоли, обеспечивая миграцию клеток в внеклеточный матрикс [79]. Прижизненная микроскопия ткани рака молочной железы также показала, что раковые клетки быстро мигрируют вдоль коллагеновых волокон [80].
Жесткость коллагена и ЕСМ в целом достигается с помощью нескольких механизмов. LOX-зависимая сшивка коллагеновых и эластиновых волокон является одним из таких механизмов. LOX синтезируется фибробластами в начале канцерогенеза, а затем гипоксическими опухолевыми клетками.LOX индуцирует перекрестное связывание между коллагеном и эластином, что увеличивает отложение нерастворимого матрикса, что приводит к жесткости ткани [81]. Реорганизация коллагена, опосредованная фибронектином, является еще одним механизмом, который приводит к жесткости ВКМ. Динамические взаимодействия между фибронектином и коллагеном, вероятно, вызывают прогрессирование опухоли. Фактически, фибронектин ранее был вовлечен в ранние стадии метастазирования рака [82,83]. Остеонектин, многофункциональный гликопротеин, также известный как SPARC (секретируемый кислый белок, богатый цистеином), участвует в повышении жесткости внеклеточного матрикса.Он синтезируется как фибробластами, так и опухолевыми клетками и обладает высоким сродством к коллагену типов I и IV. Кальций связывается с остеонектином, что, в свою очередь, вызывает жесткость коллагена и внеклеточного матрикса [74].
Старение
Механизмы, вызывающие старение кожи, могут быть как внутренними, так и внешними по своей природе [84]. Внутреннее старение включает в себя изменения в естественных биологических процессах, таких как замедление регенеративной способности, в то время как внешнее старение включает воздействие факторов окружающей среды, таких как УФ-излучение и загрязнители окружающей среды [84].Относительный объем (в процентах) и качество эластических волокон и коллагена в коже существенно меняется с возрастом [5]. Сообщалось о распаде эластических волокон у лиц в возрасте от 30 до 70 лет в небольших количествах; однако большее количество распадов наблюдалось у лиц старше 70 лет [41]. Синтез эластических волокон продолжается в течение нашей жизни, но, как сообщается, прекращается после 50 лет [41]. Таким образом, расположение эластических волокон выглядит рыхлым и мелким с короткими фрагментированными микрофибриллами у пожилых людей по сравнению с более молодыми людьми [41,85].Когда более молодая кожа подвергается актиническому повреждению, отмечаются тонкие структурные изменения, подобные изменениям в неповрежденной коже пожилых людей [86]. мРНК тропоэластина снижается примерно на 45-50% с возрастом, поскольку эластогенез замедляется [87]. Более того, активность растворимой LOX увеличивается с возрастом, тогда как активность нерастворимой LOX снижается в возрасте 60 дней [88].
При сравнении молодого и пожилого возраста в молодом возрасте наблюдается большое количество фибробластов как в сосочковом, так и в ретикулярном слое дермы с большим количеством мРНК коллагена I типа и эластина, в то время как в пожилом возрасте количество клеток и зерен серебра на клетку уменьшается при измерении путем гибридизации in situ [89].Новорожденные крысы имеют очень интенсивное отложение зерен серебра, но значительно сниженную растворимость [88]. Потеря ECM, такая как снижение биосинтетической способности оставшихся клеток, потеря клеток и прогрессивное увеличение количества ферментов, разрушающих матрикс, очевидна при сравнении гистологических срезов кожи молодых и старых людей [90]. Протеаза эластазного типа in vivo и in vitro активировалась, что лежит в основе процесса старения [91]. В процессе старения эластиновые волокна деградируют, в папиллярной дерме увеличивается количество тонкого коллагена с сильным увеличением количества фибронектина, а соотношение коллаген/эластин увеличивается.Внутренне стареющая кожа демонстрирует общую атрофию внеклеточного матрикса с уменьшением эластина и толщины интерстициального коллагена фибрилл [92].
Физические факторы
Механическое растяжение
Кожа способна выдерживать определенное количество физической силы (измеряемой как напряжение на единицу площади) путем деформации (измеряемой как напряжение или пропорциональная деформация). После снятия силы кожа возвращается в состояние покоя, что возможно благодаря вязкоупругим свойствам кожи.Этому биомеханическому свойству кожи способствуют коллагеновые и эластиновые фибриллы [4]. Вязкий компонент кожи включает скольжение коллагеновых фибрилл во время перестройки в направлении приложенной силы. Это рассеивает энергию, приложенную внешней силой, и позволяет коже деформироваться до определенного предела без серьезных повреждений [4,93,94]. Эластиновые волокна способствуют эластичности кожи, накапливая энергию от приложенной силы, и обеспечивают способность кожи вернуться в исходное состояние покоя после снятия силы [27,93].
Механотрансдукция описывает физиологический ответ клеток на физические воздействия стресса. Клетки распознают механические нагрузки как стимулы и передают соответствующие сигналы компонентам внеклеточного матрикса, таким как коллагеновые и эластические волокна, трансмембранные рецепторы, такие как интегрины, актиновые филаменты и немышечный миозин [95]. Циклическое растяжение клеток, таких как фибробласты, активирует генетическую экспрессию компонентов ВКМ, таких как коллаген и фибронектин, что часто приводит к сборке плотного ВКМ, богатого коллагеном [96].Вновь синтезированные фибриллы коллагена и фибронектина будут ориентироваться в том же направлении, что и приложенная сила [97].
Striae Gravidarum
Striae Gravidarum — явление, при котором на коже женщин во время беременности появляются растяжки. Эти пятна появляются в виде эритематозных полос на нескольких частях тела, включая живот, грудь, бедра и бедра. Обычно они начинают появляться с 24-й недели беременности [98]. Точный механизм, который приводит к стриям беременных, еще предстоит выяснить, но он явно связан с изменением динамики соединительной ткани кожи [99, 100].Сообщается, что сочетание механического растяжения и гормональных факторов имеет жизненно важное значение в этиологии [101]. Гормоны, такие как релаксин, эстроген и гормоны коры надпочечников, как полагают, уменьшают клейкость коллагеновых волокон. Они также изменяют структуру как коллагеновых, так и эластиновых волокон, делая их менее склонными к растяжению. Считается, что повышенный эффект гормонов связан с усилением экспрессии рецепторов, поскольку рецепторы эстрогена, андрогена и глюкокортикоидов обнаруживаются в большем количестве в стриях по сравнению с нормальной кожей [102].Растяжение кожи также делает эпидермис тоньше, делая растяжки более заметными [103,104].
Контролируемое расширение тканей
Расширение тканей — это хирургическая техника, которая восходит к концу 1950-х годов [105], при которой экспандеры имплантируются под кожу и дают им набухнуть, таким образом растягивая кожу до точки, где формируется вновь синтезированная кожа [2,106] . Когда кожа физически растягивается сверх своего физиологического предела, напряжение покоя и гомеостатическое равновесие нарушаются.Это инициирует каскад молекулярных путей, которые работают в унисон для восстановления состояния гомеостатического равновесия за счет увеличения площади поверхности кожи [107,108]. Взаимосвязанные пути, которые запускаются после гомеостатического нарушения, включают внеклеточный матрикс, клеточные мембраны, ферментативную активность, системы вторичных мессенджеров, активность ионных каналов, структуру цитоскелета и генетическую экспрессию [2,106].
Активация этих путей в конечном итоге приводит к образованию новой кожи посредством процесса, известного как ползучесть тканей, который далее можно разделить на механическую и биологическую ползучесть [109,110].Механическая ползучесть — это острая реакция на растяжение, когда вязкоупругость кожи позволяет ей деформироваться в ответ на нагрузку или силу растяжения. Этот тип расширения ткани является временным и является вторичным по отношению к приложенной силе нагрузки. Биологическая ползучесть, однако, возникает, когда образуется вновь синтезированная ткань, и она является конечной целью расширения хирургической ткани. Биологическая ползучесть возникает в основном из-за повышенной активности в дермальном слое кожи, такой как пролиферация фибробластов и синтез коллагена, поддерживаемая повышенным синтезом миофиламентов и неоваскуляризацией [109,110].
Факторы окружающей среды
До 1975 года ученые спорили о происхождении и природе эластичных волокон. В конце концов было решено, что эластические волокна представляют собой либо новообразование аномального эластина, либо трансформацию коллагена в аномальный эластин [111]. Условия окружающей среды играют важную роль в определении воздействия на кожу. Внешние факторы, такие как жара, солнце, холодный ветер, низкая и высокая влажность, изменяют микроструктуру кожи. Кроме того, сообщалось, что на кожу человека влияют географические, профессиональные, религиозные и культурные факторы [112]; например, те, кто работает на улице, чаще подвергаются воздействию, чем те, кто работает внутри.
Воздействие солнца
Гистологически хроническое воздействие солнца может вызвать обширные изменения, такие как морщины в кожных скоплениях на коже. В норме эластин находится в сосочковом слое дермы небольшого диаметра и располагается перпендикулярно эпидермису. В более глубоких слоях дермы эластин толще и ориентирован вертикально. Буиссу и др. [113] сообщили, что под воздействием солнца эластиновое ядро истончается, а фибробласты становятся неподвижными, в то время как эластотическая дегенерация усиливается в ретикулярной дерме.В сосочковом слое дермы с возрастом усиливался распад эластических волокон, что приводило к снижению эластичности кожи. Напротив, Уоррен и соавт. [114] продемонстрировали, что содержание эластина увеличивалось при солнечном воздействии, тогда как содержание коллагена уменьшалось. С помощью иммуногистохимического окрашивания защищенная от солнца ткань показывает, что эластин выявляется в виде дискретных волокон под эпидермисом и редко в слое дермы. Увеличение накопления эластических волокон под воздействием солнца было подтверждено Bernstein et al.[115].
Инфракрасное излучение оказывает существенное негативное воздействие на кожу. Эксперименты in vitro на фибробластах человека доказали, что даже небольшие дозы инфракрасного излучения могут продуцировать свободные радикалы, влиять на экспрессию коллагена и эластина и активировать ММП [116].
В коже, подвергшейся воздействию солнца, макромолекулы, такие как гликозаминогликаны (ГАГ) и связанные с белками протеогликаны, отличаются от таковых в коже, не подвергавшейся воздействию солнца. ГАГ, особенно гиалуроновая кислота, больше накапливаются под воздействием солнца [112, 117].Накопленные ГАГ демонстрируют пониженную водосвязывающую способность, а также пониженную способность взаимодействовать с другими компонентами дермального ВКМ [112]. Все эти факторы делают открытую кожу более морщинистой, дряблой, сухой и тонкой.
УФ-излучение
Воздействие УФ-излучения способствует внешнему старению кожи. Сравнивая УФ-А и УФ-В, Bernstein et al. [115] продемонстрировали, что УФ-В обладает более высокой активностью промотора эластина, чем УФ-А. В фотостареющей коже эластин кажется дискретным и редко распределенным, но становится плотно накопленным [115,118].Эффекты УФ-В вполне различимы, когда кожа становится морщинистой, наблюдается увеличение эластоза и образование опухолей, но УФ-А изменяет кожу так же, как хронологические изменения у стареющих мышей [117]. Понимая все эти факторы, мы видим, что эластоз на самом деле состоит из двух фаз: (1) простая гиперплазия, когда эластические волокна увеличиваются в количестве и становятся толще, и (2) актиническая дегенерация, когда лучистая энергия повреждает придающий силу белок. эластин, что делает его хрупким [119].
УФ-излучение вызывает подавление синтеза коллагена и эластических волокон путем блокирования функции TGF-β [120,121]. УФ-излучение стимулирует активацию АФК (активных форм кислорода) и перекиси водорода, но подавляет антиоксидантные ферменты [122]. Увеличивая синтез АФК, он, вероятно, участвует в усилении сигналов, что приводит к активации пути МАРК. Эти MAPK активируют фактор транскрипции AP-1 и активируют MMP [123].Уровень ММП-12 повышается после УФ-облучения [124]. УФ-излучение также разрушает TGF-β, что нарушает дезактивацию MMP-1 и MMP-3 [121, 125].
Сигаретный дым
Эластичные волокна также могут быть затронуты курением. Заядлые курильщики продемонстрировали аномалии эластических волокон. Франсез и др. [126] и Just et al. [127] продемонстрировали, что средняя относительная площадь и общее количество эластических волокон были значительно увеличены у заядлых курильщиков по сравнению с некурящими.У курильщиков эластические волокна были более многочисленными, более короткими, широкими и фрагментированными. Повышенное количество связано с деградацией и фрагментацией эластина, как это происходит при солнечном эластозе, а не с вновь синтезированными эластическими волокнами [127]. Значительно отличающаяся площадь (на 15,3% выше) и количество волокон (667/мм 2 ) в ретикулярной дерме у курильщиков по сравнению с некурящими (11,7% и 557/мм 2 соответственно) [127]. ]. Эти аномалии менее очевидны по сравнению с солнечным эластозом [126].
Сигаретный дым ингибирует регуляцию LOX, транскрипцию тропоэластина и выработку коллагена I типа [128]. Поскольку LOX играют решающую роль в регуляции его экспрессии, это подавляет как эластин, так и коллаген [129, 130]. Никотин в сигаретном дыме также ингибирует пролиферацию фибробластов [131]. Таким образом, курение приводит к снижению влажности рогового слоя кожи лица, что приводит к появлению морщин на коже [132]. Инь и др. [133,134] сообщили, что табачный дым индуцирует ММР-1, ММР-7 и ММР-3, но ингибирует выработку проколлагена типа I и типа III.
Табачный дым блокирует клеточную реакцию на TGF-1 посредством индукции его нефункциональной латентной формы и подавления рецепторов TGF-β 1 [134]. Поскольку TGF-1 имеет решающее значение для стимуляции выработки коллагена и эластина, следовательно, у курильщиков они будут подавлены [132]. TGF-1 также действует как положительный фактор роста, индуцируя синтез белков ECM. Следовательно, этот TGF не будет работать очень хорошо, поскольку он заблокирован дымом.
Применение нутрицевтиков и космецевтиков
Термин «нутрицевтики» был придуман в 1989 году и определяется как пищевые продукты или пищевые продукты, которые обеспечивают пользу для здоровья или здоровья, в то время как термин «космецевтика» описывает косметические продукты, заявленные как полезные для здоровья или здоровья [135,136].Что касается применения на коже человека, было доказано, что некоторые нутрицевтики и космецевтики оказывают положительное воздействие, чаще всего включающее заживление ран и омолаживающие свойства. Например, было показано, что кокосовое масло первого отжима способствует заживлению ран, активно стимулируя синтез компонентов ВКМ, таких как коллаген, эластические волокна и ГАГ [137]. Было показано, что местное применение коммерчески доступных продуктов, содержащих ретинол и витамин С, способно частично обратить вспять изменения кожи, вызванные внутренним и внешним старением [36].Некоторые виды риса, а именно красный и черный рис, содержат фитохимические вещества, которые являются известными антиоксидантами и антивозрастными соединениями, такими как γ-оризанол, токоферолы и токотриенолы [136]. Мед и алоэ вера также являются очень известными средствами, которые способствуют заживлению ран, поскольку они обладают ангиогенными и неоваскуляризирующими свойствами, стимулируют образование грануляционной ткани и усиливают реэпителизацию [138, 139, 140].
Обзор молекулярных изменений, влияющих на динамику коллагена и эластина в коже. один специфический молекулярный путь.Кроме того, также было замечено, что разные факторы влияют на эти пути посредством сходных механизмов, воздействуя на аналогичные компоненты, несмотря на то, что они имеют разное происхождение. LOX, например, индуцируется в случаях канцерогенеза, но ингибируется в ответ на старение. При индуцировании канцерогенеза LOX может стимулировать перекрестное связывание коллагена и эластина, что приводит к жесткости ткани, но ингибирование в ответ на старение снижает синтез тропоэластина, тем самым нарушая образование эластина. Другим примером является IGF-β
1 , который является важным фактором роста в синтезе эластина.Его синтез может быть заблокирован не только воздействием УФ-излучения, но и курением. Предлагается модель, которая иллюстрирует, как пересекаются все эти различные механизмы и как различные внутренние и внешние факторы, описанные выше, могут нарушать гомеостатическое равновесие этих путей (рис. 5).Рис. 5
Процесс эластогенеза на каждой соответствующей стадии. Синтез мономера и . b Коацервация. c Сшивание. г Упаковка.
Заключение
Пути, регулирующие синтез, деградацию и поддержание сетей коллагена и эластина в коже, многочисленны и взаимосвязаны. Таким образом, факторы, влияющие на один путь, скорее всего, опосредованно влияют и на другие пути (рис. 6). В этом обзоре предложен целостный обзор, объединяющий различные молекулярные пути, на которые влияют различные биологические, физические факторы и факторы окружающей среды. Изменения, происходящие на молекулярном уровне в ответ на различные стимулы, включают многочисленные факторы роста, пути экспрессии генов и сигнальные молекулы.В совокупности эти изменения способны негативно влиять на структурную и механическую целостность коллагеновых и эластиновых сетей, влияя тем самым на их функциональные возможности. Эти изменения также проявляются в виде физических симптомов, влияющих на кожу, таких как повышенная растяжимость, обезвоживание, потеря эластичности и сморщивание кожи. Более глубокое понимание того, как внутренние и внешние факторы различного происхождения влияют на динамику коллагеновых и эластиновых сетей в коже, и как эти факторы влияют на многочисленные компоненты различных молекулярных путей, может привести к более совершенным методам диагностики и лечения дерматологических состояний.
Рис. 6
Факторы, влияющие на регуляцию гомеостаза коллагена и эластина.
Благодарность
Эта работа была поддержана грантом Министерства образования Малайзии (UM.C/625/1/HIR/MOHE/DENT/21).
Заявление об этических нормах
Этическое одобрение получено Институциональным комитетом по уходу за животными и их использованию Университета Путра Малайзия (UPM/IACUC/AUP-R031/2013).
Заявление о раскрытии информации
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Silver FH, Freeman JW, DeVore D: Вязкоупругие свойства кожи человека и обработанной дермы. Skin Res Technol 2001; 7:18-23.
- Silver FH, Siperko LM, Seehra GP: Механобиология передачи силы в кожной ткани.Skin Res Technol 2003;9:3-23.
- Бишофф Дж. Э., Арруда Э. М., Грош К.: Моделирование кожи человека методом конечных элементов с использованием изотропной, нелинейной упругой конститутивной модели. Дж. Биомех 2000; 33:645-652.
- Сильвер Ф.Х., Като Ю.П., Оно М., Вассерман А.Дж.: Анализ соединительной ткани млекопитающих: взаимосвязь между иерархическими структурами и механическими свойствами.J Long Term Eff Med Implants 1992; 2:165-198.
- Вителларо-Зуккарелло Л., Каппеллетти С., Даль Поццо Росси В., Сари-Горла М.: Стереологический анализ коллагеновых и эластических волокон в нормальной дерме человека: вариабельность в зависимости от возраста, пола и области тела. Анат Рек 1994; 238:153-162.
- Венгер МПЭ, Лоран Б., Хортон М.А., Патрик М.: Механические свойства коллагеновых фибрилл. Биофиз Дж. 2007; 93:1255-1263.
- Fratzl P: Коллаген: структура и механика.Берлин, Спрингер, 2008.
- Осман О.С., Селуэй Дж.Л., Харикумар П.Е., Стокер С.Дж., Уорджент Э.Т., Коуторн М.А. и др.: Новый метод оценки структуры коллагена в коже. Биоинформатика BMC 2013; 14:260.
- Shoulders MD, Raines RT: Коллагеновая структура и стабильность.Annu Rev Biochem 2009;78:929-958.
- Gelse K: Коллагены — структура, функция и биосинтез. Adv Drug Deliv Rev 2003; 55: 1531-1546.
- Шерман В.Р., Ян В., Мейерс М.А.: Материаловедение коллагена.J Mech Behav Biomed Mater 2015; 52:22-50.
- Фейт Г., Коббе Б., Кин Д.Р., Полссон М., Кох М., Вагенер Р.: Коллаген XXVIII, новый белок, содержащий домен фактора А фон Виллебранда, с множеством дефектов в коллагеновом домене. J Biol Chem 2006; 281:3494-3504.
- Болдуин С.Дж., Куигли А.С., Клегг С., Креплак Л.: Наномеханическое картирование гидратированных фибрилл коллагена I сухожилия крысиного хвоста.Биофиз J 2014; 107: 1794-1801.
- Цафлиду М.: Роль коллагена и эластина в стареющей коже: подход к обработке изображений. Микрон 2004; 35:173-177.
- Birk DE, Zycband EI, Winkelmann DA, Trelstad RL: Коллагеновый фибриллогенез in situ: сегменты фибрилл являются промежуточными продуктами в сборке матрикса.Proc Natl Acad Sci USA 1989; 86:4549-4553.
- Бозек Л., ван дер Хейден Г., Хортон М. Коллагеновые фибриллы: наноразмерные веревки. Биофиз Дж. 2007; 92:70-75.
- Оргель Дж. П., Сан-Антонио Дж. Д., Антипова О.: Молекулярное и структурное картирование взаимодействий коллагеновых фибрилл.Connect Tissue Res 2011; 52:2-17.
- Вуорио Э., де Кромбрюгге Б. Семейство генов коллагена. Annu Rev Biochem 1990;59:837-872.
- Фратцл П., Питер Ф., Клаус М., Иво З., Герт Р., Хайнц А. и др.: Фибриллярная структура и механические свойства коллагена.J Struct Biol 1998; 122:119-122.
- Сасаки Н., Наоки С., Синго О.: Кривая напряжение-деформация и модуль Юнга молекулы коллагена, определенные методом рентгеновской дифракции. Дж. Биомех, 1996; 29:655-658.
- Шен З.Л., Додж М.Р., Кан Х., Балларини Р., Эппелл С.Дж.: Эксперименты по напряжению и деформации на отдельных коллагеновых фибриллах.Биофиз Дж. 2008; 95:3956-3963.
- Макки К.Т., Ласт Дж.А., Пол Р., Мерфи К.Дж.: Вдавливание в сравнении с измерениями модуля Юнга на растяжение для мягких биологических тканей. Tissue Eng Часть B Rev 2011; 17: 155-164.
- Ликуп А.Дж., Мюнстер С., Шарма А., Шейнман М., Яверт Л.М., Фабри Б. и др.: Стресс контролирует механику коллагеновых сетей.Proc Natl Acad Sci USA 2015;112:9573-9578.
- Fung YC: Эластичность мягких тканей при простом растяжении. Am J Physiol 1967; 213:1532-1544.
- Грэм Дж. С., Вомунд А. Н., Филлипс К. Л., Гранбуа М.: Структурные изменения в фибриллах коллагена I типа человека исследованы с помощью силовой спектроскопии.Exp Cell Res 2004; 299:335-342.
- Мюнстер С., Яверт Л.М., Лесли Б.А., Вейц Дж.И., Фабри Б., Вайц Д.А.: Зависимость от нелинейной реакции на стресс фибриновых и коллагеновых сетей от истории деформации. Proc Natl Acad Sci USA 2013;110:12197-12202.
- Гослайн Дж., Лилли М., Кэррингтон Э., Геретт П., Ортлепп С., Сэвидж К. Эластичные белки: биологическая роль и механические свойства.Philos Trans R Soc Lond B Biol Sci 2002; 357:121-132.
- Holzapfel G, GH: Биомеханика мягких тканей; в LeMaitre J (ed): Справочник по моделям поведения материалов. Сан-Диего, Academic Press, 2001, стр. 1057-1071.
- Oxlund H, Hans O, Jan M, Viidik A: Роль эластина в механических свойствах кожи.Дж. Биомех, 1988; 21:213-218.
- Yeo GC, Baldock C, Tuukkanen A, Roessle M, Dyksterhuis LB, Wise SG и др.: Область мостика тропоэластина позиционирует C-конец, взаимодействующий с клеткой, и способствует сборке эластичных волокон. Proc Natl Acad Sci USA 2012;109:2878-2883.
- Козел Б.А., Ронгиш Б.Дж., Цирок А., Зак Дж., Литтл К.Д., Дэвис Е.К. и др.: Формирование эластичных волокон: динамическое представление сборки внеклеточного матрикса с использованием репортеров-таймеров.J Cell Physiol 2006; 207:87-96.
- Сато Ф., Вачи Х., Старчер Б.С., Мурата Х., Амано С., Тадзима С. и др.: Характеристики эластичного волокна, собранного с рекомбинантной изоформой тропоэластина. Клин Биохим 2006;39:746-753.
- Врховский Б., Бернадетт В., Вайс А.С.: Биохимия тропоэластина.Евр. Дж. Биохим 1998; 258:1-18.
- Раушер С., Помес Р.: Структурное расстройство и эластичность белка. Adv Exp Med Biol 2012;725:159-183.
- Казловская В., Мальхотра С., Ламбе Дж., Идрисс М.Х., Элстон Д., Андрес С. Полезность окрашивания эластических тканей по Верхоффу-Ван Гизону в дерматопатологии.Дж. Кутан Патол 2013; 40: 211–225.
- Seité S, Bredoux C, Compan D, Zucchi H, Lombard D, Medaisko C и др.: Гистологическая оценка местного применения комбинации ретинол-витамин C. Skin Pharmacol Physiol 2005;18:81-87.
- Проктор Г.Б., Хоробин Р.В.: Химическая структура и механизмы окрашивания резорцин-фуксином Вейгерта и связанных с ним пятен эластических волокон.Stain Technol 1988;63:101-111.
- Flotte TJ, Seddon JM, Zhang YQ, Glynn RJ, Egan KM, Gragoudas ES: Метод компьютерного анализа изображений для измерения эластичности ткани. J Invest Dermatol 1989;93:358-362.
- Монтанья В., Уильям М., Кей К. Структурные изменения в стареющей коже человека.J Invest Dermatol 1979;73:47-53.
- Zweers MC, van Vlijmen-Willems IM, van Kuppevelt TH, Mecham RP, Steijlen PM, Bristow J и др. Дефицит тенасцина-X вызывает аномалии в морфологии кожных эластичных волокон. J Invest Dermatol 2004;122:885-891.
- Браверман И.М., Фонферко Е. Исследования старения кожи.I. Сеть эластических волокон. J Invest Dermatol 1982;78:434-443.
- Mecham RP: синтез эластина и сборка волокон. Ann NY Acad Sci 1991;624:137-146.
- Нивисон-Смит Л., Вайс А.С.: Выравнивание клеток гладкой мускулатуры сосудов человека на параллельных электропряденных синтетических эластиновых волокнах.J Biomed Mater Res A 2012; 100:155-161.
- Хинек А., Рабинович М.: эластин-связывающий белок массой 67 кДа является защитным «компаньоном» внеклеточного нерастворимого эластина и внутриклеточного тропоэластина. J Cell Biol 1994; 126:563-574.
- Бунда С., Севера Б., Питер Л., Янтинг В., Кела Л., Александр Х.: Альдостерон индуцирует выработку эластина в сердечных фибробластах посредством активации рецепторов инсулиноподобного фактора роста-i независимым от минералокортикоидных рецепторов образом.Ам Дж. Патол 2007; 171:809-819.
- Янагисава Х., Дэвис Э.К.: Разгадка механизма сборки эластичных волокон: роль коротких фибулинов. Int J Biochem Cell Biol 2010;42:1084-1093.
- Horiguchi M, Inoue T, Ohbayashi T, Hirai M, Noda K, Marmorstein LY и др.: Фибулин-4 обеспечивает надлежащий эластогенез посредством взаимодействия со сшивающим ферментом лизилоксидазой.Proc Natl Acad Sci USA 2009; 106:19029-19034.
- Папке С.Л., Янагисава Х.: Фибулин-4 и фибулин-5 в эластогенезе и за его пределами: результаты исследований на мышах и людях. Матрица Биол 2014;37:142-149.
- Wagenseil JE, Mecham RP: Новый взгляд на сборку эластичных волокон.Birth Defects Res C Embryo Today 2007;81:229-240.
- Kothapalli CR, Ramamurthi A: Лизилоксидаза усиливает синтез эластина и образование матрикса клетками гладкой мускулатуры сосудов. J Tissue Eng Regen Med 2009; 3: 655-661.
- Умеда Х., Айкава М., Либби П.: Высвобождение десмозин и изодесмозин в виде аминокислот из нерастворимого эластина эластолитическими протеазами.Biochem Biophys Res Commun 2011;411:281-286.
- Шапиро С.Д., Эндикотт С.К., Провинция М.А., Пирс Дж.А., Кэмпбелл Э.Дж.: Заметная продолжительность жизни паренхиматозных эластичных волокон легких человека, выведенная из преобладания D-аспартата и радиоуглерода, связанного с ядерным оружием. J Clin Invest 1991; 87: 1828-1834.
- Басалыга Д.М.: Деградация и кальцификация эластина в модели повреждения брюшной аорты: роль матриксных металлопротеиназ. Тираж 2004; 110:3480-3487.
- Myllyharju J, Johanna M, Kivirikko KI: Коллагены и заболевания, связанные с коллагеном.Энн Мед 2001; 33:7-21.
- Рикард-Блюм С.: Семейство коллагенов. Cold Spring Harb Perspect Biol 2011;3:a004978.
- Dalgleish R: База данных мутаций коллагена I типа человека.Nucleic Acids Res 1997; 25:181-187.
- Бодиан Д.Л., Мадхан Б., Бродский Б., Кляйн Т.Э.: Прогнозирование клинической летальности несовершенного остеогенеза из-за мутаций глицина в коллагене. Биохимия 2008;47:5424-5432.
- Beck K, Chan VC, Shenoy N, Kirkpatrick A, Ramshaw JA, Brodsky B: Дестабилизация коллагеноподобных модельных пептидов несовершенного остеогенеза коррелирует с идентичностью остатка, заменяющего глицин.Proc Natl Acad Sci USA 2000;97:4273-4278.
- Willing MC, Deschenes SP, Slayton RL, Roberts EJ: Преждевременное обрыв цепи является объединяющим механизмом для нулевых аллелей COL1A1 в клеточных штаммах I типа несовершенного остеогенеза. Am J Hum Genet 1996; 59: 799-809.
- Körkkö J, Ala-Kokko L, De Paepe A, Nuytinck L, Earley J, Prockop DJ: анализ генов COL1A1 и COL1A2 с помощью ПЦР-амплификации и сканирования с помощью конформационно-чувствительного гель-электрофореза выявил только мутации COL1A1 у 15 пациентов с несовершенным типом остеогенеза. I: идентификация общих последовательностей нуль-аллельных мутаций.Am J Hum Genet 1998; 62: 98–110.
- Malfait F, Wenstrup RJ, De Paepe A: Клинические и генетические аспекты синдрома Элерса-Данлоса, классический тип. Genet Med 2010;12:597-605.
- Бейтман Дж. Ф., Бут-Хэндфорд Р. П., Ламанде С. Р.: Генетические заболевания соединительной ткани: клеточные и внеклеточные эффекты мутаций внеклеточного матрикса.Nat Rev Genet 2009; 10: 173-183.
- Ван Агтмаэль Т., Брукнер-Тудерман Л.: Базальные мембраны и болезни человека. Cell Tissue Res 2010;339:167-188.
- Lampe AK: Мышечные расстройства, связанные с коллагеном VI.J Med Genet 2005;42:673-685.
- Carter EM, Raggio CL: Генетические и ортопедические аспекты нарушений коллагена. Curr Opin Pediatr 2009; 21:46-54.
- Андиран Н., Сарикайалар Ф., Сарачлар М., Чаглар М.: Аутосомно-рецессивная форма врожденной лаксы кожи: больше, чем клинический вид.Педиатр Дерматол 2002;19:412-414.
- Marchase P, Holbrook K, Pinnell SR: Семейный синдром слабости кожи с ультраструктурными аномалиями коллагена и эластина. J Invest Dermatol 1980;75:399-403.
- Ringpfeil F: Отдельные заболевания соединительной ткани: эластическая псевдоксантома, лакса кожи и липоидный протеиноз.Клин Дерматол 2005; 23:41-46.
- Тернер-Стокс Л., Тертон С., Поуп Ф.М., Грин М.: Эмфизема и лакса кожи. Торакс 1983;38:790-792.
- Сабо З., Крепо М.В., Митчелл А.Л., Стефан М.Дж., Пунтел Р.А., Инь Локе К. и др.: Аневризматическое заболевание аорты и кожная лакса, вызванные дефектами гена эластина.J Med Genet 2006;43:255-258.
- Loeys B: Гомозиготность по миссенс-мутации в фибулине-5 (FBLN5) приводит к тяжелой форме кутис-лакса. Hum Mol Genet 2002; 11: 2113-2118.
- Tassabehji M: Мутация гена эластина, вызывающая аномальный тропоэластин и аномальные эластические волокна у пациента с аутосомно-доминантным кожным дефектом.Hum Mol Genet 1998; 7: 1021-1028.
- Fang M, Yuan J, Peng C, Li Y: Коллаген как обоюдоострый меч в развитии опухоли. Tumor Biol 2014;35:2871-2882.
- Арнольд С.А., Ривера Л.Б., Миллер А.Ф., Карбон Дж.Г., Динин С.П., Се И. и др.: Отсутствие хозяина SPARC усиливает сосудистую функцию и распространение опухоли в ортотопической мышиной модели карциномы поджелудочной железы.Dis Model Mech 2009; 3: 57-72.
- Левенталь К.Р., Ю. Х., Касс Л., Лакинс Дж. Н., Эгеблад М., Эрлер Дж. Т. и др.: Сшивание матрицы вызывает прогрессирование опухоли за счет усиления передачи сигналов интегрина. Сотовый 2009; 139: 891-906.
- Нагасе Х., Виссе Р., Мерфи Г.: Структура и функция матриксных металлопротеиназ и ТИМП.Cardiovasc Res 2006;69:562-573.
- Чернов А.В., Стронгин А.Ю.: Эпигенетическая регуляция матриксных металлопротеиназ и их коллагеновых субстратов при раке. Концепции Биомола 2011;2:135-147.
- Huijbers IJ, Iravani M, Popov S, Robertson D, Al-Sarraj S, Jones C, et al: Роль отложения фибриллярного коллагена и рецептора интернализации коллагена endo180 при инвазии глиомы.PLoS One 2010;5:e9808.
- Barcus CE, Keely PJ, Eliceiri KW, Schuler LA: Жесткие коллагеновые матрицы увеличивают туморогенную передачу сигналов пролактина в клетках рака молочной железы. J Biol Chem 2013; 288:12722-12732.
- Wyckoff JB, Wang Y, Lin EY, Li J-F, Goswami S, Stanley ER и др.: Прямая визуализация интравазации опухолевых клеток с помощью макрофагов в опухолях молочной железы.Рак Res 2007; 67: 2649-2656.
- Erler JT, Bennewith KL, Cox TR, Lang G, Bird D, Koong A и др.: Лизилоксидаза, индуцированная гипоксией, является важным медиатором рекрутирования клеток костного мозга для формирования преметастатической ниши. Раковая клетка 2009; 15:35-44.
- Kaplan RN, Riba RD, Zacharoulis S, Bramley AH, Vincent L, Costa C, et al: VEGFR1-позитивные гемопоэтические предшественники костного мозга инициируют преметастатическую нишу.Природа 2005;438:820-827.
- Веллинг Т., Ристели Дж., Веннерберг К., Мошер Д.Ф., Йоханссон С.: Полимеризация коллагенов типа I и III зависит от фибронектина и усиливается интегринами α 11 β 1 и α 2 β 1 . J Biol Chem 2002; 277:37377-37381.
- Wölfle U, Seelinger G, Bauer G, Meinke MC, Lademann J, Schempp CM: Реактивные виды молекул и антиоксидантные механизмы в нормальной коже и старении кожи. Skin Pharmacol Physiol 2014;27:316-332.
- Эль-Домиати М., Аттиа С., Салех Ф., Браун Д., Бирк Д.Е., Гаспарро Ф. и др.: Внутреннее старение против старения.фотостарение: сравнительное гистопатологическое, иммуногистохимическое и ультраструктурное исследование кожи. Exp Dermatol 2002; 11:398-405.
- Лавкер Р.М.: Структурные изменения на открытой и открытой стареющей коже. J Invest Dermatol 1979;73:59-66.
- Фостер Дж. А., Рич С. Б., Миллер М., Бенедикт М. Р., Ричман Р. А., Флорини Д. Р.: Влияние возраста и введения IGF-I на экспрессию гена эластина в аорте крысы.Дж. Геронтол 1990; 45: B113-B118.
- Quaglino D, Fornieri C, Nanney LB, Davidson JM: Модификации внеклеточного матрикса в тканях крыс разного возраста. Корреляции между экспрессией мРНК эластина и коллагена I типа и активностью лизилоксидазы. Матрица 1993; 13:481-490.
- Sator PG, Schmidt JB, Sator MO, Huber JC, Hönigsmann H: Влияние заместительной гормональной терапии на старение кожи: экспериментальное исследование.Матуритас 2001; 39:43-55.
- Роберт Л., Лабат-Роберт Дж., А.-М. Р: Физиология старения кожи. Патол Биол 2009;57:336-341.
- Лабат-Роберт Дж., Фуртанье А., Буайе-Лафарг Б., Роберт Л.: Возрастное увеличение активности протеазы типа эластазы в коже мышей: влияние УФ-облучения.J Photochem Photobiol B 2000;57:113-118.
- Ма В., Влашек М., Танчева-Пур И., Шнайдер Л.А., Надери Л., Рази-Вольф З. и др.: Хронологическое старение и фотостарение фибробластов и кожной соединительной ткани. Clin Exp Dermatol 2001; 26:592-599.
- Данн М.Г., Сильвер Ф.Х.: Вязкоупругое поведение соединительных тканей человека: относительный вклад вязких и упругих компонентов.Connect Tissue Res 1983; 12:59-70.
- Dunn MG, Silver FH, Swann DA: Механический анализ гипертрофической рубцовой ткани: структурная основа очевидной повышенной жесткости. J Invest Dermatol 1985;84:9-13.
- Хамфри Д.Д., Дюфрен Э.Р., Шварц М.А.: Механотрансдукция и гомеостаз внеклеточного матрикса.Nat Rev Mol Cell Biol 2014;15:802-812.
- Чике М., Ренедо А.С., Хубер Ф., Флюк М.: Как фибробласты переводят механические сигналы в изменения в продукции внеклеточного матрикса? Матрица Биол 2003;22:73-80.
- Нгуен Т.Д., Лян Р., Ву С.Л.-И, Бертон С.Д., Ву С., Альмарза А. и др.: Влияние посева клеток и циклического растяжения на ремоделирование волокон в биокаркасе, полученном из внеклеточного матрикса.Tissue Eng Часть A 2009; 15: 957-963.
- Chang ALS, Agredano YZ, Kimball AB: Факторы риска, связанные с растяжками беременных. J Am Acad Dermatol 2004; 51:881-885.
- Касельска-Троян А., Собчак М., Антошевски Б.: Факторы риска растяжек беременных.Int J Cosmet Sci 2015; 37: 236-240.
- Осман Х., Рубейз Н., Тамим Х., Нассар А.Х.: Факторы риска развития стрий беременных. Am J Obstet Gynecol 2007;196:62.e1-5.
- Томас Р.Г.Р., Листон В.А.: Клинические ассоциации стрий беременных.J Obstet Gynaecol 2004; 24:270-271.
- Cordeiro RCT, Zecchin KG, de Moraes AM: Экспрессия рецепторов эстрогена, андрогена и глюкокортикоидов в недавних растяжках. Int J Dermatol 2010;49:30-32.
- Лю Д.Т.: Письмо: стрии беременных.Ланцет 1974; 1:625.
- Tunzi M, Grey GR: Распространенные кожные заболевания во время беременности. Am Fam Physician 2007; 75: 211-218.
- Neumann CG: Расширение участка кожи за счет постепенного растяжения подкожного баллона; использование метода фиксации кожи при субтотальной реконструкции уха.Plast Reconstr Surg 1957; 19:124-130.
- Де Филиппо Р.Е., Атала А.: Растяжение и рост: молекулярные и физиологические влияния расширения ткани. Plast Reconstr Surg 2002;109:2450-2462.
- Такей Т., Миллс И., Араи К., Сумпио Б.Э. Молекулярная основа расширения тканей: клинические последствия для хирурга.Plast Reconstr Surg 1998;102:247-258.
- Zöllner AM, Buganza Tepole A, Kuhl E: О биомеханике и механобиологии растущей кожи. J Theor Biol 2012; 297:166-175.
- Аустад Э.Д., Томас С.Б., Пасык К. Расширение тканей: дивиденды или кредит? Plast Reconstr Surg 1986;78:63-67.
- Джонсон П.Е., Кернахан Д.А., Бауэр Б.С.: Реакция кожи и эпидермиса на расширение мягких тканей у свиней. Plast Reconstr Surg 1988;81:390-397.
- O’Brien JP: актиническая гранулема.Заболевание кольцевидной соединительной ткани, поражающее поврежденную солнцем и теплом (эластическую) кожу. Арч Дерматол 1975; 111:460-466.
- Бенедетто А.В.: Окружающая среда и старение кожи. Клин Дерматол 1998;16:129-139.
- Bouissou H, Pieraggi MT, Julian M, Savit T: Эластическая ткань кожи.Сравнение спонтанного и актинического (солнечного) старения. Int J Dermatol 1988; 27:327-335.
- Уоррен Р., Гартштейн В., Клигман А.М., Монтанья В., Аллендорф Р.А., Риддер Г.М.: Возраст, солнечный свет и кожа лица: гистологическое и количественное исследование. J Am Acad Dermatol 1991; 25:751-760.
- Бернштейн Э.Ф., Браун Д.Б., Урбах Ф., Форбс Д., Дель Монако М., Ву М. и др.: Ультрафиолетовое излучение активирует промотор эластина человека у трансгенных мышей: новая модель фотостарения кожи in vivo и in vitro.J Invest Dermatol 1995;105:269-273.
- Robert C, Bonnet M, Marques S, Numa M, Doucet O: Низкие и умеренные дозы инфракрасного излучения А нарушают гомеостаз внеклеточного матрикса кожи и способствуют фотоповреждению кожи. Skin Pharmacol Physiol 2015; 28:196-204.
- Биссетт Д.Л., Хэннон Д.П., Орр Т.В.: Животная модель кожи, подвергшейся солнечному старению: гистологические, физические и видимые изменения в коже голых мышей, облученных УФ-излучением.Фотохим Фотобиол 1987;46:367-378.
- Moloney SJ, Edmonds SH, Giddens LD, Learn DB: Модель фотостарения на безволосых мышах: оценка взаимосвязи между кожным эластином, коллагеном, толщиной кожи и морщинами. Photochem Photobiol 1992;56:505-511.
- О’Брайен Дж. П., Реган В.: Исследование эластической ткани и актинического излучения при «старении», височном артериите, ревматической полимиалгии и атеросклерозе.Актинические бури в современном мире. J Am Acad Dermatol 1991; 24:765-776.
- Ритти Л., Фишер Г. Дж.: Индуцированные ультрафиолетовым излучением сигнальные каскады и старение кожи. Старение Res Rev 2002; 1: 705-720.
- Quan T, He T, Kang S, Voorhees JJ, Fisher GJ: Солнечное ультрафиолетовое облучение снижает содержание коллагена в фотостареющей коже человека путем блокирования рецептора трансформирующего фактора роста-β типа II/передачи сигналов Smad.Ам Дж. Патол 2004; 165:741-751.
- Масаки Х. Роль антиоксидантов в коже: антивозрастной эффект. J Dermatol Sci 2010; 58:85-90.
- Cho Y, Yuri C, Son HJ, Eun-Mee K, Choi JH, Kim ST и др.: Доксициклин обладает нейропротекторным действием против нигральной дофаминергической дегенерации за счет двойного механизма с участием MMP-3.Нейротокс Рез 2009;16:361-371.
- Фортино В., Майоли Э., Торричелли С., Дэвис П., Валаччи Г.: ММР кожи по-разному модулируются стрессорами окружающей среды у старых и молодых мышей. Toxicol Lett 2007; 173:73-79.
- Гресснер А.М., Аксель, Гресснер М.: Роль TGF-β в фиброзе печени.Front Biosci 2002;7:d793.
- Francès C, Boisnic S, Hartmann DJ, Dautzenberg B, Branchet MC, Charpentier YL и др.: Изменения в эластичной ткани не подвергавшейся воздействию солнца кожи курильщиков сигарет. Бр Дж Дерматол 1991;125:43-47.
- Just M, Ribera M, Monsó E, Lorenzo JC, Ferrándiz C: Влияние курения на эластичные волокна кожи: морфометрический и иммуногистохимический анализ.Бр Дж Дерматол 2007;156:85-91.
- Gao S, Chen K, Zhao Y, Rich CB, Chen L, Li SJ и др.: Транскрипционное и посттранскрипционное ингибирование экспрессии лизилоксидазы конденсатом сигаретного дыма в культивируемых фибробластах легких плода крысы. Toxicol Sci 2005;87:197-203.
- Хаутамаки Р.Д., Кобаяши Д.К., Старший Р.М., Шапиро С.Д.: Потребность в макрофагальной эластазе при эмфиземе, вызванной сигаретным дымом, у мышей.Наука 1997;277:2002-2004.
- Шапиро С.Д., Гольдштейн Н.М., Хоутон А.М., Кобаяши Д.К., Келли Д., Белаауай А.: Нейтрофильная эластаза способствует развитию эмфиземы у мышей, вызванной сигаретным дымом. Ам Дж. Патол 2003; 163:2329-2335.
- Jorgensen LN, Kallehave F, Christensen E, Siana JE, Gottrup F: Снижение выработки коллагена у курильщиков.Хирургия 1998;123:450-455.
- Морита А: Табачный дым вызывает преждевременное старение кожи. J Dermatol Sci 2007; 48:169-175.
- Инь Л., Морита А., Цудзи Т.: Изменения внеклеточного матрикса, вызванные экстрактом табачного дыма.Arch Dermatol Res 2000;292:188-194.
- Yin L, Morita A, Tsuji T: Экстракт табачного дыма вызывает возрастные изменения из-за модуляции TGF-β. Exp Dermatol 2003;12(дополнение 2):51-56.
- Калра Э.К.: Нутрицевтики — определение и введение.AAPS PharmSci 2003;5:E25.
- Chulasiri M: Антивозрастная космецевтика из пигментированного риса. Азиатский J Pharm Sci 2016; 11:30.
- Невин К.Г., Раджамохан Т.: Влияние местного применения кокосового масла первого отжима на компоненты кожи и антиоксидантный статус во время заживления кожных ран у молодых крыс.Skin Pharmacol Physiol 2010;23:290-297.
- Дэвис С.К., Перес Р.: Космецевтика и натуральные продукты: заживление ран. Клин Дерматол 2009;27:502-506.
- Бергман А., Янаи Дж., Вайс Дж., Белл Д., Дэвид М.П.: Ускорение заживления ран путем местного применения меда.Модель животного. Ам Дж. Сург 1983; 145:374-376.
- Moon EJ, Lee YM, Lee OH, Lee MJ, Lee SK, Chung MH и др.: Новый ангиогенный фактор, полученный из геля алоэ вера: β-ситостерол, растительный стерол. Ангиогенез 1999;3:117-123.
Автор Контакты
Mohammad Tariqur Rahman
Университет Малайи
Wilayah Persekutuan
Куала-Лумпур 50603 (Малайзия)
Электронная почта [email protected]
Информация о статье / публикации
Предварительный просмотр первой страницы
Получено: 29 января 2016 г.
Принято: 19 мая 2016 г.
Опубликовано онлайн: 20 июля 2016 г.
Дата выпуска выпуска:
Количество печатных страниц: 14
Количество фигурок: 6
Количество столов: 0
ISSN: 1660-5527 (печать)
eISSN: 1660-5535 (онлайн)
Для получения дополнительной информации: https://www.karger.com/SPP
Авторское право / Дозировка препарата / Отказ от ответственности
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам.Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Жидкая структура эластина
Основные версии:
1) Системы моделирования очень упрощены и могут неадекватно отражать все соответствующие свойства реального эластина.Изучаются пептиды с последовательностью простого повтора (VPGVG) 7 . В то время как пентапептид и родственные полипентапептиды были признаны подходящими имитаторами обширных гидрофобных областей эластина, важно обсудить преимущества и возможные недостатки и ограничения, связанные с выбором последовательности. Особую озабоченность вызывает тот факт, что нативный белок в значительной степени характеризуется чередованием гидрофобных и сшивающих доменов. Хотя гидрофобные домены имеют последовательности, сходные с моделью этого исследования, они обычно фланкированы сшивающими доменами, имеющими, по крайней мере, частичный α-спиральный характер.Таким образом, маловероятно, что 27 гидрофобных доменов в нативном белке образуют агрегат, подобный используемому здесь.
Действительно, настоящая модельная система не предназначена для учета всех свойств эластина. Вместо этого мы исследуем структурную и физическую основу фазового разделения гидрофобных эластиноподобных доменов, что также дает представление о структурной основе эластичности. Хотя сшивающие домены необходимы для формирования эластомерных материалов, которым они придают целостность и долговечность, они сами по себе не подвергаются фазовому разделению и не требуются для фазового разделения.Многочисленные исследования, проведенные в лабораториях Тони Вайса, Фреда Кили и Тони Тамбурро за последние пару десятилетий, установили, что гидрофобные домены управляют фазовым разделением полноразмерного тропоэластина. Соответственно, эластин-подобные пептиды, моделирующие гидрофобные домены тропоэластина, но лишенные перекрестно-сшивающих доменов, коацервируются сами по себе. Кроме того, считается, что гидрофобные домены придают эластичность эластину. Вместе с вычислительной осуществимостью это причины, по которым мы решили моделировать гидрофобные домены. – См. измененный текст в первом абзаце введения.
Поскольку гидрофобные домены управляют фазовым разделением полноразмерного тропоэластина и эластичностью полимеризованного эластина, вполне вероятно, что молекулярная основа для фазового разделения и упругой отдачи, обнаруженная в этом исследовании, имеет отношение к полноразмерному тропоэластину. Эта точка зрения подтверждается недавним ЯМР-исследованием самосборки и полимеризации эластиноподобных блок-сополимерных пептидов, состоящих из чередующихся перекрестных связей и (GVPGV) 7 доменов (Reichheld et al., PNAS, май 2017 г.). Структура выделенных нами (ГВПГВ) 7 доменов практически сохраняется в блок-сополимерах: они неупорядочены, гидратированы и сохраняют ту же локальную вторичную структуру, состоящую из переходных β-поворотов, в растворимой и фазово-разделенной формах; и они образуют обширные, неспецифические гидрофобные контакты при фазовом разделении.
Это широкое совпадение не означает, что конформационные ансамбли гидрофобных доменов идентичны в двух модельных пептидах (хотя бы из-за разной длины пептидов), но указывает на то, что существенные свойства гидрофобных доменов принципиально не затрагиваются. наличием перекрестных доменов.Более того, несмотря на небольшой размер нашего агрегата, его жидкое или расплавленное поведение предполагает, что настоящее исследование охватывает фундаментальную основу для разделения фаз ELP. См. новый раздел «Результаты» под названием «Актуальность эластиноподобных пептидов со сшивающими доменами» и наш ответ на пункт 4 ниже.
2) Значимость результатов неясна, поскольку отсутствуют важные отрицательные контроли. Разве не будет вести себя так же любой концентрированный раствор пептидов с примерно сходным последовательностным составом, т.е.е., образуют сольватированную каплю? Было бы полезно сравнить результаты эластина с моделированием пептидных фрагментов IDP, которые не агрегируют, и IDP, которые образуют «твердые» агрегаты при моделировании с использованием аналогичного протокола. В частности, является ли степень гидратации ядра эластинового пучка значительно выше, чем для других агрегирующих пептидов? Авторы упоминают шелк и амилоид как две крайности гидратированных и твердых агрегатов. В литературе даже есть сообщения, указывающие на склонность к фибриллизации (Fred W.Кили, Кэтрин М. Беллингем и Кимберли А. Вудхаус, Philosophical Transactions: Biological Sciences, Vol. 357, № 1418, Эластомерные белки: структуры, биомеханические свойства и биологические роли (28 февраля 2002 г.), стр. 185-189).
Предыдущие исследования предоставили убедительные доказательства особых свойств эластина и других самособирающихся эластомерных белков в отличие от (а) более распространенных типов IDP, которые не самоагрегируются, и (б) белков, образующих амилоидоподобные агрегаты:
а) Большинство IDPs имеют высокое содержание заряда и низкую гидрофобность последовательности, что позволяет им избежать самоагрегации (Uversky, 2000), тогда как эластин из-за высокого содержания гидрофобных остатков подвергается самоагрегации.Несколько вычислительных исследований описали структурные ансамбли более распространенного типа IDP. Среди них пептид RS, который имеет высокий суммарный заряд, был подробно изучен с использованием как моделирования, так и экспериментов (Rauscher et al., JCTC 2015). Были проведены обширные компьютерные исследования IDP с различной долей заряженных остатков (Das and Pappu, 2013).
б) Несвернутые или неправильно свернутые белки склонны к образованию упорядоченных амилоидных агрегатов, но, как мы показали десять лет назад, аминокислотный состав эластина устроен таким образом, чтобы избежать амилоидной судьбы (Rauscher et al., JCTC 2006). В этом совместном вычислительном и экспериментальном исследовании с лабораторией Кили мы показали, что, в отличие от амилоидогенных пептидов, самособирающиеся эластомерные белки, включая эластин и шелк паука, остаются гидратированными и неупорядоченными даже в агрегированном состоянии. Эти свойства проявляются в кажущемся пороге комбинированного состава глицина и пролина, выше которого образование амилоида затруднено и проявляются эластомерные свойства. Высокое содержание P и G препятствует тому, чтобы полипептидный остов самособирающихся эластомерных белков принимал регулярную вторичную структуру, необходимую для образования исключающих воду гидрофобных ядер (в которых ядро практически полностью обезвожено), обнаруживаемых в глобулярных белках и в структуре ядра амилоида. фибриллы, гарантируя вместо этого, что позвоночник гидратирован и неупорядочен.
Чтобы прояснить эти моменты и предоставить больше информации об эластине как IDP, разделяющем агрегацию/фазу, мы добавили новый раздел под названием «Неупорядоченные агрегаты: структура и функция самособирающихся эластомерных белков» в «Результаты и обсуждение» вместе с новым рисунок, подчеркивающий роль гидрофобного эффекта и конформационного беспорядка в сворачивании, сборке и упругой отдаче белков (рис. 7). Кроме того, мы добавили анализ профиля плотности пептида и воды в нашей системе (подраздел «Гидратация и нарушение структуры полипептидного остова», последний абзац, рис. 4), который показывает, что пептиды сохраняют более 20% внутренней гидратации в обоих мономерных и агрегатные состояния.
3) Выбор силового поля кажется проблематичным, потому что сообщалось, что в других системах он благоприятствует чрезмерно компактным структурам. См., например. Рисунок 1 в Piana et al., Curr. мнение Структура биол. v24, p98, 2014, где масштабирование Rg по количеству остатков близко к одной трети степени, тогда как большинство белковых цепей в воде ближе к идеальному масштабированию цепи. Сейчас эластин достаточно гидрофобный, так что, возможно, все в порядке, и его все равно следует коллапсировать, но было бы неплохо провести некоторое обсуждение этого вопроса и, возможно, сравнение с экспериментами, которые показывают, что поведение мономера эластина разумно.
Мы изменили текст, чтобы решить и прояснить проблему с силовым полем, как описано ниже:
а) Мы не можем сравнивать наши результаты с экспериментальными измерениями, проведенными с тем же пептидом, поскольку, насколько нам известно, такие данные отсутствуют для мономера (GVPGV) 7 . Однако наши результаты подтверждаются измерениями ЯМР, выполненными на эластинподобном пептиде, содержащем гидрофобные домены с той же последовательностью. См. наш ответ на пункты (1) и (4) и пересмотренный текст в разделе «Результаты» под названием «Актуальность эластиноподобных пептидов со сшивающими доменами».
b) Наш выбор силовых полей CHARMM22* и TIP3P, усовершенствованных CHARMM, напрямую мотивирован Rauscher et al. (JCTC 2015), который показывает, что из 8 протестированных комбинаций белковых и водных силовых полей именно эта комбинация лучше всего воспроизводила экспериментальные данные для пептида с внутренней неупорядоченностью. См. первый абзац раздела «Материалы и методы» под названием «Выбор силового поля».
c) Первоначально мы провели это исследование несколько лет назад, используя другую комбинацию силового поля (OPLS/AA с TIP3P) (докторская диссертация Сары Раушер, 2012 г.).Это предыдущее исследование привело к значительно более компактным оценкам радиуса вращения пептидного мономера. Как теперь хорошо известно, OPLS имеет тенденцию переоценивать степень коллапса или уплотнения развернутых или неупорядоченных состояний белков. Тем не менее, эти результаты были качественно аналогичны результатам настоящего исследования: неупорядоченные и гидратированные пептиды, характеризующиеся переходными β-поворотами, при самосборке приближались к расплавоподобному состоянию. См. пересмотренный текст в последнем абзаце раздела «Материалы и методы» под названием «Выбор силового поля».
d) Кроме того, чтобы полностью удовлетворить просьбу изучить зависимость наших результатов, особенно в отношении размера пептидного мономера в воде, от выбора силового поля, мы повторили некоторые симуляции с другим силовым полем. комбинация. В частности, мы выполнили 18 повторов MD-траектории длительностью 0,5 мкс, используя CHARMM22* с TIP4P-D, модифицированным силовым полем воды с повышенным взаимодействием дисперсии растворителя и растворенного вещества, недавно предложенным Piana et al. (Дж. Физ.хим. B, 2015) для улучшения гидратации ансамблей неупорядоченных белков. Этот новый набор симуляций приводит к менее коллапсированному (GVPGV) мономеру 7 с показателем масштабирования размера 0,40 по сравнению со значением 0,28, полученным с помощью модели TIP3P. Мы отмечаем, что силовое поле TIP4P-D дестабилизирует нативное состояние двух свернутых белков (Piana et al., 2015). Таким образом, TIP4P-D может недооценивать гидрофобные взаимодействия в изученном здесь гидрофобном IDP. Тем не менее тот факт, что масштабный показатель нашего мономерного ELP, полученного с помощью TIP4P-D, все еще меньше идеального предела, согласуется с гидрофобным коллапсом и общими выводами статьи.Анализ этих новых моделей показан на рис. 1 — дополнение к рисунку 2, рис. 2 — дополнение к рисунку 4 и рис. 5 — дополнение к рисунку 3, а дальнейшее обсуждение зависимости от силового поля было добавлено в раздел «Материалы и методы» («Выбор силовое поле», последний абзац).
Вместе пункты (c) и (d) показывают, что наши выводы относительно структурной и физической основы фазового разделения гидрофобных эластиноподобных пептидов устойчивы к выбору силового поля, независимо от того, превышается ли компактность водного мономера. — или недооценены.
4) Сравнение с экспериментом довольно слабое и в лучшем случае качественное, поэтому его следует усилить. Например, можно ли количественно связать моделирование с экспериментами по рассеянию нейтронов в Perticaroli et al., 2015? В свете значительных проблем с силовым полем при моделировании IDP (хорошо задокументированных работами авторов!), очень важно иметь экспериментальную поддержку. Сравнения с конкретными экспериментами следует проводить таким образом, чтобы хотя бы в принципе исключить эту и/или другие модели.
Как упоминалось выше, экспериментальные измерения мономеров (GVPGV) 7 отсутствуют. Однако результаты, представленные в этой рукописи, прекрасно согласуются с исследованием ЯМР, проведенным Reichheld et al. (2017), который был опубликован после подачи этой рукописи. Исследование ЯМР описывает структуру и динамику блок-пептидов с чередующимися сшивающими доменами и гидрофобными доменами с той же последовательностью, что и в настоящем исследовании, последовательно в растворе, в коацервате и в материалах, полученных сшиванием.Конформационный ансамбль гидрофобного домена, представленный в этом исследовании, согласуется с результатами ЯМР как качественно, так и количественно. В частности, (i) пептиды разупорядочены как до, так и после разделения фаз; (ii) вторичная структура в гидрофобных доменах состоит в основном из редких и временных β-поворотов в повторах VPGV и GVGV, заселенность которых оценивается в диапазоне 20-40% по сравнению с нашей оценкой 16-20%; (iii) эта вторичная структура существенно не изменяется при разделении фаз; (iv) фазовое разделение влечет за собой образование неспецифических межмолекулярных гидрофобных контактов; и (v) богатая белком жидкая фаза значительно гидратирована.
Это согласие подтверждает настоящие результаты и указывает на то, что структурная и физическая основа для самосборки гидрофобных доменов принципиально не зависит от присутствия сшивающих доменов. Мы добавили это экспериментальное подтверждение в исправленный текст (раздел «Значение эластиноподобных пептидов со сшивающими доменами»).
https://doi.org/10.7554/eLife.26526.028Цветная версия этой фигуры доступна онлайн. |