Имплантаты Allergan
Ведущие клиники 60 стран мира используют имплантаты компании Allergan уже более 25 лет. Клиника «РАМИ» – не исключение! Мы пристально следим за качеством наших услуг и используем в своей работе только высококачественные материалы от производителей с мировым именем.
Анатомические имплантаты Allergan имеют различную каплевидную форму, которая максимально точно повторяет очертания женской груди. После увеличения грудных желез, грудь пациентки приобретает нужный размер, сохраняя естественный вид.
Уникальная структура имплантата
Повышенная надежность оболочки имплантата обеспечивается слоями высококачественного силиконового эластомера. Текстурированная поверхность имплантата, созданная по технологии BIOCELLTM, препятствует смещению имплантата.
Контроль и гарантия качества
Имплантаты фирмы Allergan соответствуют высочайшим стандартам качества. Безопасность и долговременность использования имплантатов фирмы Allergan подтверждена результатами обширных клинических исследований, проведенных в США и Европе.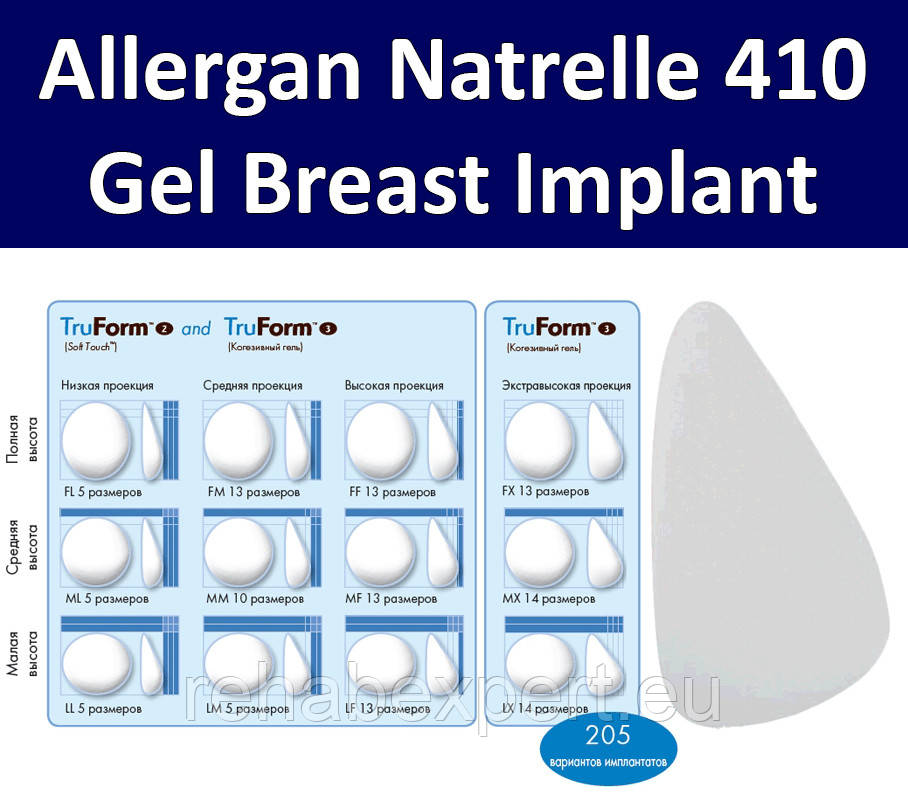
Ожидаемый срок службы имплантатов
Компания Allergan дает пожизненную гарантию на свои импланты. Несмотря на это, необходимо внимательно следить за состоянием прооперированной груди, особенно, если кожа быстро теряет тургор. И, даже если Вас ничего не беспокоит, каждые 10-15 лет необходимо приходить на осмотр к специалисту (пластическому хирургу или маммологу).
Беременность и кормление грудью
Многие женщины, которым установлены имплантаты, успешно кормят своих малышей грудью. Однако на возможность грудного вскармливания влияет техника исполнения операции. Поэтому перед проведением маммопластики важно обсудить этот вопрос с пластическим хирургом.
Если Вы действительно ищете своего доктора…
Врачи отделения пластической хирургии
Крупноклеточная имплант-ассоциированная лимфома — современное состояние проблемы
Лимфомы представляют собой гетерогенную группу заболеваний, происходящих из клеток ретикулоэндотелиальной и лимфатической систем. Существует два основных вида лимфом: лимфома Ходжкина (лимфогранулематоз) и неходжкинские лимфомы. На 2017 г. в России было зарегистрировано 3117 случаев возникновения лимфогранулематоза и 9883 случаев — неходжкинских лимфом, что составляет соответственно 0,51 и 1,6% от общей онкологической заболеваемости [1]. Лимфома Ходжкина встречается преимущественно у молодых пациентов, прогрессирует медленно и чаще всего хорошо поддается лечению. Большинство неходжкинских лимфом состоит из В-лимфоцитов. По степени злокачественности и темпам прогрессирования опухоли, а также в зависимости от ответа на стандартное лечение их можно условно разделить на вялотекущие и агрессивные. К вялотекущим В-клеточным лимфомам относятся лимфомы из клеток маргинальной зоны, фолликулярная, лимфоплазмоцитарная и лимфоцитарная. Наиболее распространенными вариантами агрессивных лимфом являются диффузная В-крупноклеточная, мантийноклеточная, первичная медиастинальная лимфомы, лимфома Беркитта. Т-клеточные лимфомы встречаются реже, характеризуются большим клиническим разнообразием и имеют в большинстве случаев агрессивное течение.
Существует два основных вида лимфом: лимфома Ходжкина (лимфогранулематоз) и неходжкинские лимфомы. На 2017 г. в России было зарегистрировано 3117 случаев возникновения лимфогранулематоза и 9883 случаев — неходжкинских лимфом, что составляет соответственно 0,51 и 1,6% от общей онкологической заболеваемости [1]. Лимфома Ходжкина встречается преимущественно у молодых пациентов, прогрессирует медленно и чаще всего хорошо поддается лечению. Большинство неходжкинских лимфом состоит из В-лимфоцитов. По степени злокачественности и темпам прогрессирования опухоли, а также в зависимости от ответа на стандартное лечение их можно условно разделить на вялотекущие и агрессивные. К вялотекущим В-клеточным лимфомам относятся лимфомы из клеток маргинальной зоны, фолликулярная, лимфоплазмоцитарная и лимфоцитарная. Наиболее распространенными вариантами агрессивных лимфом являются диффузная В-крупноклеточная, мантийноклеточная, первичная медиастинальная лимфомы, лимфома Беркитта. Т-клеточные лимфомы встречаются реже, характеризуются большим клиническим разнообразием и имеют в большинстве случаев агрессивное течение.
Применительно к пластической хирургии первое упоминание о лимфоме у пациенток после аугментации молочной железы было представлено 20 лет назад, когда была описана потенциальная связь между образованием лимфомы и имплантатами молочных желез [2], однако только недавно заболевание вызвало волну беспокойства среди врачей, общественности и средств массовой информации.
Анапластическая крупноклеточная Т-лимфома относится к подгруппе анапластических крупноклеточных лимфом (Anaplastic large cell lymphomas — ALCL), составляющей 2% от всех недавно диагностированных неходжкинских лимфом в мире, также туда входят еще три основных варианта, описанных в литературе: две различные формы системной ALCL — анапластическая киназа-позитивная (Anaplastic lymphoma kinase+ — ALK+) и киназа-негативная (ALK−) лимфома, а также первичная кожная ALCL, которую следует отличать от поражения кожи при системной ALCL [3, 4]. По данным литературы, ранние стадии имплантат-ассоциированной лимфомы (Breast Implant-Associated ALCL — BIA-ALCL) сходны с лимфопролиферативным расстройством, возникающим при выпоте вокруг текстурированного имплантата молочной железы, и могут прогрессировать до инвазивной лимфомы с инфильтрацией фиброзной капсулы, образованием опухолевых масс и регионарными/отдаленными метастазами.
Современное состояние проблемы
В августе 2012 г. Американское общество пластических хирургов (American Society of Plastic Surgeons — ASPS), Фонд пластической хирургии (Plastic Surgery Foundation — PSF) и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration —FDA) подписали соглашение о совместных исследованиях и разработках, направленное на развитие инфраструктуры, в которой были бы централизованно собраны все случаи BIA-ALCL. Результатом этой совместной работы стал Реестр пациентов и результаты лечения имплантат-ассоциированной анапластической крупноклеточной лимфомы, этиология и эпидемиология (Patient Registry and Outcomes For breast Implants and anaplastic large cell Lymphoma etiology and Epidemiology — PROFILE).
В 2016 г. Национальная комплексная сеть по борьбе с раком (National Comprehensive Cancer Network — NCCN) разработала принципы диагностики и лечения BIA-ALCL [5, 6].![]() Руководство NCCN по BIA-ALCL было впоследствии признано FDA, а также национальными обществами пластической хирургии.
Руководство NCCN по BIA-ALCL было впоследствии признано FDA, а также национальными обществами пластической хирургии.
По оценкам разных авторов, заболеваемость BIA-ALCL варьирует от 0,1 до 0,3 на 100 000 женщин с грудными имплантатами в год. При этом 1 из 500 000 женщин с текстурированными грудными имплантатами рискует заболеть через 1 год после вмешательства [7].
Недавние исследования в Австралии и Новой Зеландии выявили резкий рост заболеваемости BIA-ALCL. В общей сложности 56 случаев BIA-ALCL были подтверждены к 2017 г., еще 26 новых случаев были диагностированы в период с января 2017 г. по апрель 2018 г. Заболеваемость была впоследствии пересмотрена с 1 на 300 000 до 1 на 1000—10 000 женщин с имплантатами
В январе 2018 г. было зафиксировано 414 сообщений о случаях BIA-ALCL, из них 9 с летальным исходом2. К февралю 2018 г. было зарегистрировано 518 больных BIA-ALCL в 25 странах, в том числе 194 в США3. Согласно данным от апреля 2018 г. , во всем мире число больных возросло до 570, включая 16 смертей4 [8].
, во всем мире число больных возросло до 570, включая 16 смертей4 [8].
По состоянию на 1 декабря 2018 г. реестр PROFILE включал сведения о более чем 250 пациентах с BIA-ALCL, а ASPS отследило в общей сложности более 573 случаев, в том числе 33 с летальным исходом5 [9].
Самые последние данные о количестве диагностированных случаев представлены в настоящее время на сайте ASPS. На 3 сентября 2019 г. зарегистрировано 779 пациентов по всему миру4.
Анализ случаев возникновения BIA-ALCL, проведенный G. Brody и соавт. [10], выявил существенную вариабельность заболеваемости во всем мире — с самой низкой относительной заболеваемостью в еврозоне, Китае и Бразилии. В настоящее время наибольший зарегистрированный уровень заболеваемости наблюдается в Австралии и Новой Зеландии (1/2832 в зависимости от типа имплантата) [10]. В скандинавских странах до недавнего времени практически не было сообщений о случаях BIA-ALCL. Интересно, что, по данным производителей, 70—80% имплантатов, продаваемых в Европе, текстурированы.
Согласно обзору мировой литературы, наибольшая заболеваемость присуща странам, в которых существуют государственные регистры пациентов с BIA-ALCL, например США, Австралии, Франции, Италии и Великобритании. Видимо, это связано преимущественно с тем, что происходит стандартизированный сбор данных обо всех имплантатах, а также случаях их удаления или замены. С другой стороны, наличие регистров косвенно указывает на высокий уровень осведомленности медицинского сообщества этих стран о проблеме BIA-ALCL. Возможно, до настоящего времени не существует реального представления о распространенности BIA-ALCL среди женщин с имплантатами молочных желез.
Следуя рекомендациям FDA США, в 2011 г. производители имплантатов добавили предупреждение о риске возникновения BIA-ALCL на вкладыши упаковок грудных имплантатов. Всем пациентам, которым планируется эндопротезирование молочных желез, необходимо подписать информированное добровольное согласие, которое преследует три основные цели: 1) информирование пациентов о существовании этого редкого заболевания; 2) объяснение пациенту распространенных симптомов, таких как появление опухолевых масс в молочных железах и возникновение перипротезного выпота; 3) настойчивую рекомендацию пациентам срочно обратиться к врачу в случае появления этих симптомов [12].
Всем пациентам, которым планируется эндопротезирование молочных желез, необходимо подписать информированное добровольное согласие, которое преследует три основные цели: 1) информирование пациентов о существовании этого редкого заболевания; 2) объяснение пациенту распространенных симптомов, таких как появление опухолевых масс в молочных железах и возникновение перипротезного выпота; 3) настойчивую рекомендацию пациентам срочно обратиться к врачу в случае появления этих симптомов [12].
Этиология заболевания
В свете последних исследований предполагается, что наиболее вероятно риск заболевания BIA-ALCL напрямую связан с текстурой поверхности имплантата молочной железы и наиболее высок у генетически предрасположенных женщин [12]. Текстурированные имплантаты подвержены образованию на их поверхности биопленок [11], представляющих собой сообщества бактерий, которые образуются на поверхности раздела фаз, например твердое вещество/жидкость. Бактерии биопленки примечательны тем, что окружены слизисто-полимерным матриксом из продуцируемых ими внеклеточных веществ и чрезвычайно устойчивы к воздействию ультрафиолетового излучения, дегидратации и вирусам, антибиотикам и факторам иммунной защиты. M. Kadin и соавт. [13] выдвинули гипотезу, что BIA-ALCL связан с хронической бактериальной стимуляцией Th2/Th27-антигенуправляемых T-клеток памяти в тканях перипротезной капсулы и, как следствие, устойчивой пролиферацией T-клеток с последующими генетическими событиями в патогенезе BIA-ALCL [14]. H. Hu и соавт. [15] сравнили капсулы имплантатов пациентов с BIA-ALCL и капсулярной контрактурой, обнаружив более высокую бактериальную нагрузку и значительно отличающийся микробиом в образцах BIA-ALCL. Авторами было выявлено большое количество бактерий
Бактерии биопленки примечательны тем, что окружены слизисто-полимерным матриксом из продуцируемых ими внеклеточных веществ и чрезвычайно устойчивы к воздействию ультрафиолетового излучения, дегидратации и вирусам, антибиотикам и факторам иммунной защиты. M. Kadin и соавт. [13] выдвинули гипотезу, что BIA-ALCL связан с хронической бактериальной стимуляцией Th2/Th27-антигенуправляемых T-клеток памяти в тканях перипротезной капсулы и, как следствие, устойчивой пролиферацией T-клеток с последующими генетическими событиями в патогенезе BIA-ALCL [14]. H. Hu и соавт. [15] сравнили капсулы имплантатов пациентов с BIA-ALCL и капсулярной контрактурой, обнаружив более высокую бактериальную нагрузку и значительно отличающийся микробиом в образцах BIA-ALCL. Авторами было выявлено большое количество бактерий
Первоначальное понимание патогенеза и молекулярных факторов BIA-ALCL было получено с помощью проточной иммуногистохимической (ИГХ) цитометрии и функциональных экспериментов при описании иммунофенотипов клеточных линий, полученных из опухолей пациентов. Клетки BIA-ALCL демонстрировали положительное окрашивание на CD30 (белок клеточной мембраны), которое при наличии анапластической цитоморфологии и соответствующей клинической картины следует считать отличительной чертой BIA-ALCL [16, 17]. В норме пул CD30+ T-клеток составляет от 0,1 до 5% всех циркулирующих T-клеток, а при воспалительных состояниях организма их концентрация может существенно повышаться. Повышенная экспрессия CD30 может быть индуцирована как на Т-клетках, так и на В-клетках в результате вирусной инфекции. Описано, что CD30±лимфоциты способны временно увеличиваться с фонового уровня 0,1 до 95% [18]. Другими Т-клеточными антигенами, экспрессируемыми в злокачественных клетках, являются CD3, CD4/8, CD5 и CD7 [19]. В большинстве случаев BIA-ALCL-опухолевые клетки при проведении ИГХ-исследования положительно окрашиваются на множественную миелому 1 (MUM1) (интерферон-регуляторный фактор 4) [20]. Геномная характеристика BIA-ALCL показывает сходные молекулярные аномалии с ALK-негативной системной анапластической крупноклеточной лимфомой (sALCL), включая активацию JAK/STAT и дисрегуляцию MYC/TP53, однако клинически заболевание протекает гораздо менее агрессивно [20].
Клетки BIA-ALCL демонстрировали положительное окрашивание на CD30 (белок клеточной мембраны), которое при наличии анапластической цитоморфологии и соответствующей клинической картины следует считать отличительной чертой BIA-ALCL [16, 17]. В норме пул CD30+ T-клеток составляет от 0,1 до 5% всех циркулирующих T-клеток, а при воспалительных состояниях организма их концентрация может существенно повышаться. Повышенная экспрессия CD30 может быть индуцирована как на Т-клетках, так и на В-клетках в результате вирусной инфекции. Описано, что CD30±лимфоциты способны временно увеличиваться с фонового уровня 0,1 до 95% [18]. Другими Т-клеточными антигенами, экспрессируемыми в злокачественных клетках, являются CD3, CD4/8, CD5 и CD7 [19]. В большинстве случаев BIA-ALCL-опухолевые клетки при проведении ИГХ-исследования положительно окрашиваются на множественную миелому 1 (MUM1) (интерферон-регуляторный фактор 4) [20]. Геномная характеристика BIA-ALCL показывает сходные молекулярные аномалии с ALK-негативной системной анапластической крупноклеточной лимфомой (sALCL), включая активацию JAK/STAT и дисрегуляцию MYC/TP53, однако клинически заболевание протекает гораздо менее агрессивно [20]. Другие исследования также отметили случаи возникновения BIA-ALCL у женщин с приобретенными JAK/STAT-мутациями зародышевой линии [21] и, кроме того, связь заболевания с синдромом Ли—Фраумени, который возникает при наличии мутации онкогена p53 [22, 23]. В таких случаях реконструкция молочной железы с использованием текстурированных грудных имплантатов у женщин после мастэктомии по поводу рака молочной железы совершенно нецелесообразна.
Другие исследования также отметили случаи возникновения BIA-ALCL у женщин с приобретенными JAK/STAT-мутациями зародышевой линии [21] и, кроме того, связь заболевания с синдромом Ли—Фраумени, который возникает при наличии мутации онкогена p53 [22, 23]. В таких случаях реконструкция молочной железы с использованием текстурированных грудных имплантатов у женщин после мастэктомии по поводу рака молочной железы совершенно нецелесообразна.
Влияние текстуры имплантата на риск возникновения заболевания
Текстура поверхности имплантата варьирует в зависимости от производителя и обычно может классифицироваться как макротекстурированная — полиуретан и Biocell («Allergan plc», Ирландия), с промежуточной текстурой («TRUE Texture»; «Sientra», США) или с микротекстурированием (Siltex, «Mentor Worldwide», США) [24, 25]. Агрессивные макротекстурированные имплантаты (полиуретан и Biocell) демонстрируют более высокое количество перипротезных бактерий, чем микротекстурированные (Siltex и Poly Implant Prothèse), и, как следствие, более высокий T-клеточный ответ [15]. Это логично, учитывая, что более агрессивное текстурирование обеспечивает пространство для роста бактерий [26].
Это логично, учитывая, что более агрессивное текстурирование обеспечивает пространство для роста бактерий [26].
По данным некоторых исследователей, риск развития BIA-ALCL примерно в 16,5 раза выше для Biocell и в 23,4 раза — для имплантатов из полиуретана («Silimed», Бразилия) по сравнению с Siltex-текстурой, если принять ее за единицу (табл. 1) Таблица 1. Характеристика имплантатов для молочных желез [27].
Макротекстурированные (или с большой площадью поверхности) имплантаты Biocell («Allergan, Inc.», США) производят с помощью «технологии потери соли», при которой оболочка имплантата прижимается к слою соли. В отличие от них микротекстурированные имплантаты Siltex (или текстурированные с низкой площадью поверхности) («Mentor Worldwide», США) изготавливают посредством обратного негативного импринтинга с текстурированной пеной, при этом получается менее агрессивная форма текстурирования [28].
Компания «Allergan» в 2019 г. полностью отозвала с рынка линейку макротекстурированных имплантатов Biocell. Однако окончательные выводы о роли конкретного вида имплантата в заболеваемости BIA-ALCL делать пока рано.
Однако окончательные выводы о роли конкретного вида имплантата в заболеваемости BIA-ALCL делать пока рано.
Диагностика заболевания
По данным регистра PROFILE, на основании анализа 89 полностью документированных случаев, наиболее частым симптомом BIA-ALCL является перипротезная серома — у 73 (85,9%) пациентов. Капсулярная контрактура имела место у 28 (32,9%) больных, чаще всего III или IV степени. Пальпируемые опухолевые массы в молочной железе были обнаружены только в 13 (15,7%) случаях. Боль, повреждения кожи и покраснение встречались реже, но все же присутствовали. Системные симптомы включали лихорадку, ночную потливость, потерю массы тела и поражения кожи вне области молочных желез. У 2 (2%) пациентов на момент постановки диагноза симптомы отсутствовали [29].
У 2/3 пациентов с BIA-ALCL развивалась поздняя серома — в среднем через 8—10 лет после протезирования. Следовательно, любая серома, возникающая более чем через 1 год после протезирования, не поддающаяся объяснению инфекцией или травмой, должна рассматриваться как возможный признак заболевания. У 1/3 пациентов наблюдали опухолевые массы, которые указывали на более агрессивное клиническое течение [30].
У 1/3 пациентов наблюдали опухолевые массы, которые указывали на более агрессивное клиническое течение [30].
По данным других источников литературы [6, 31, 32], у 8—24% пациентов определялась пальпируемая опухолевая масса, у 4—12% — лимфопатия. Реже (<5% случаев) авторы описывали местные и системные симптомы, включая кожную сыпь, лихорадку и капсулярную контрактуру. Большинство случаев BIA-ALCL диагностировалось во время операции по ревизии имплантата при наличии персистирующей серомы (>1 года), а также болевого синдрома, пальпируемых образований в молочной железе, отека или асимметрии груди [33].
B. Adrada и соавт. [34] рассмотрели 44 cлучая BIA-ALCL с использованием различных методов визуализации. Они сообщили о чувствительности и специфичности при выявлении выпота с помощью ультразвука в 84 и 75% случаев соответственно, компьютерной томографии (КТ) в 55 и 83%, магнитно-резонансной томографии (МРТ) в 82 и 33%, позитронно-эмиссионной томографии (ПЭТ)/КТ в 38 и 83%. Чувствительность и специфичность при определении опухолевой массы методом ультразвукового исследования (УЗИ) — 46 и 100%, КТ — 50 и 100%, МРТ — 82 и 33%, ПЭТ/КТ — 64 и 88%. Было обнаружено, что чувствительность метода маммографии является низкой для визуализации как выпота, так и опухолевых масс и, следовательно, не считается приемлемым методом визуализации при диагностике BIA-ALCL. Исходя из этих данных, УЗИ используется в качестве скринингового метода, тогда как ПЭТ/КТ применяется после установления диагноза, для обследования перед операцией.
Чувствительность и специфичность при определении опухолевой массы методом ультразвукового исследования (УЗИ) — 46 и 100%, КТ — 50 и 100%, МРТ — 82 и 33%, ПЭТ/КТ — 64 и 88%. Было обнаружено, что чувствительность метода маммографии является низкой для визуализации как выпота, так и опухолевых масс и, следовательно, не считается приемлемым методом визуализации при диагностике BIA-ALCL. Исходя из этих данных, УЗИ используется в качестве скринингового метода, тогда как ПЭТ/КТ применяется после установления диагноза, для обследования перед операцией.
Первый этап диагностики должен включать УЗИ для забора перипротезной жидкости, тонкоигольной биопсии опухолевых масс и увеличенных региональных лимфатических узлов. За вовлечением в процесс подмышечных (93%) лимфатических узлов чаще всего следует увеличение внутренних грудных и надключичных лимфоузлов, тогда как поражение нерегиональных групп лимфатических узлов встречается очень редко [35]. Аспирация тонкой иглой является оптимальной для забора проб перипротезной жидкости. Во время аспирации для аккуратного смещения и защиты имплантата можно применять УЗИ. Для диагностики заболевания следует собрать как можно больше жидкости (минимум 50 мл). Перипротезная жидкость при BIA-ALCL обычно более вязкая, чем доброкачественная серома, из-за более высокого содержания белка и клеточности. Образцы жидкости не требуют хранения в каких-либо специализированных средах и должны быть доставлены в лабораторию в течение 48 ч. Хотя клетки могут лизироваться, если их оставить на длительный период, диагностические белковые маркеры в опухолевых клетках не разрушаются, вследствие чего диагностика возможна по фиксированным клеточным блокам спустя годы [6]. Оценка тонкоигольной аспирации затрудняется после серии предыдущих пункций, поскольку титр опухолевых клеток в пунктате может быть искусственно снижен. Наличие опухолевой массы требует проведения биопсии. Образцы необходимо отправлять на морфологическое цитологическое исследование с использованием цитометрии и ИГХ для количественного определения Т-клеток в образце и определения экспрессии CD30.
Во время аспирации для аккуратного смещения и защиты имплантата можно применять УЗИ. Для диагностики заболевания следует собрать как можно больше жидкости (минимум 50 мл). Перипротезная жидкость при BIA-ALCL обычно более вязкая, чем доброкачественная серома, из-за более высокого содержания белка и клеточности. Образцы жидкости не требуют хранения в каких-либо специализированных средах и должны быть доставлены в лабораторию в течение 48 ч. Хотя клетки могут лизироваться, если их оставить на длительный период, диагностические белковые маркеры в опухолевых клетках не разрушаются, вследствие чего диагностика возможна по фиксированным клеточным блокам спустя годы [6]. Оценка тонкоигольной аспирации затрудняется после серии предыдущих пункций, поскольку титр опухолевых клеток в пунктате может быть искусственно снижен. Наличие опухолевой массы требует проведения биопсии. Образцы необходимо отправлять на морфологическое цитологическое исследование с использованием цитометрии и ИГХ для количественного определения Т-клеток в образце и определения экспрессии CD30. ИГХ-исследование CD30 является основополагающей частью диагностических тестов, однако само по себе непатогномонично, поскольку экспрессия CD30 неспецифична. Антиген CD30 может экспрессироваться на доброкачественных воспалительных клетках. Редкие CD30±лимфоциты с нормальной морфологией считаются нормальными и не требуют дальнейшего исследования [13, 36].
ИГХ-исследование CD30 является основополагающей частью диагностических тестов, однако само по себе непатогномонично, поскольку экспрессия CD30 неспецифична. Антиген CD30 может экспрессироваться на доброкачественных воспалительных клетках. Редкие CD30±лимфоциты с нормальной морфологией считаются нормальными и не требуют дальнейшего исследования [13, 36].
После установления диагноза BIA-ALCL врачу настоятельно рекомендуется провести консилиум по конкретному пациенту для определения тактики лечения. Пациентам с агрессивной локальной инвазией или метастазированием в лимфатические узлы рекомендуется выполнить биопсию костного мозга, чтобы исключить вариант системной ALCL. Всем пациентам с подтвержденной BIA-ALCL следует назначить предоперационное сканирование с помощью метода ПЭТ/КТ, который является оптимальным при визуализации ассоциированных капсулярных масс, инвазии грудной стенки, регионарной лимфаденопатии и/или метастазирования в отдаленные органы. От полученных данных будут зависеть стратегия резекции и сроки операции [10].
Стадирование заболевания
В ранних публикациях предполагалось, что BIA-ALCL является бинарным заболеванием, представленным либо ограниченным выпотом, либо инвазивной массой [37]. В настоящее время BIA-ALCL классифицируется как лимфома при любом проявлении заболевания (опухолевые массы или серома). Несмотря на то что BIA-ALCL развивается очень медленно и редко имеет генерализованную симптоматику, она является злокачественным заболеванием на любой стадии [26].
Неходжкинская лимфома традиционно диагностируется с использованием системы стадирования Ann Arbor в модификации Lugano (табл. 2). Таблица 2. Классификация Ann Arbor в модификации Lugano Относительно BIA-ALCL установлено, что стадия болезни IE ограничена только поражением молочной железы или капсулы имплантата, а стадия IIE включает поражение молочной железы и ипсилатеральных подмышечных лимфатических узлов [38]. При применении этой классификации почти все пациенты с BIA-ALCL имеют заболевание начальной стадии: либо IE (от 83 до 96%), либо IIE (от 3,6 до 18,8%) [31, 33].
Из-за ограниченности системы стадирования Ann Arbor, которая не учитывает инвазию капсулы, NCCN в настоящее время использует недавно предложенную систему стадирования центра M. Anderson (M. Anderson Cancer Center) — TNM. Согласно этой системе, BIA-ALCL представляет собой заболевание, подразделяющееся на стадии IA (35,6%), IB (11,5%), IC (13,8%), IIA (25,3%), IIB (4,6%), III (9,2%) и IV (0—9%) (табл. 3, 4) Таблица 4. Классификация M.D. Anderson Cancer Center по стадиям [16].
По результатам исследования M. Clemens и соавт. [31] с участием 87 пациентов с BIA-ALCL, общая выживаемость через 3 года после операции составила 94%, через 5 лет — 91%. В рамках этого исследования стадирование по TNM более точно предсказывало выживаемость и частоту рецидивирования BIA-ALCL, чем система стадирования, А (p=0,01).
NCCN определила стандарт медицинской помощи пациентам с BIA-ALCL, который включает хирургическое лечение, в том числе удаление имплантатов, полную капсулэктомию и резекцию любых ассоциированных опухолевых масс и вовлеченных лимфатических узлов в пределах здоровых тканей. Пациенты с подтвержденной BIA-ALCL в идеале должны быть направлены к онкологу перед любым хирургическим вмешательством. Дополнительное лечение пациентов, у которых отмечается прогрессирование заболевания после операции либо при поражении лимфатических узлов или экстралимфатических органов, а также в случае неоперабельной опухоли, включает комбинированную химиотерапию на основе антрациклина или как альтернативу применение целевой иммунотерапии препаратом брентуксимаб-ведотин [39, 40].
Пациенты с подтвержденной BIA-ALCL в идеале должны быть направлены к онкологу перед любым хирургическим вмешательством. Дополнительное лечение пациентов, у которых отмечается прогрессирование заболевания после операции либо при поражении лимфатических узлов или экстралимфатических органов, а также в случае неоперабельной опухоли, включает комбинированную химиотерапию на основе антрациклина или как альтернативу применение целевой иммунотерапии препаратом брентуксимаб-ведотин [39, 40].
В исследовании M. Clemens и соавт. [31], включающем 87 пациентов с BIA-ALCL, о котором было упомянуто выше, только хирургическое вмешательство получали 40% больных; хирургическое лечение и лучевую терапию — 9%; хирургическое лечение и химиотерапию —19%; хирургическое лечение, химиотерапию и лучевую терапию — 30%; только химиотерапию —2%. Как наличие опухолевых масс во время постановки диагноза, так и экстракапсулярное распространение заболевания было связано с повышенным риском рецидива и смерти пациента. При среднем сроке наблюдения 45 мес у 28% пациентов был обнаружен местный рецидив. В настоящее время в Австралии, Бразилии, Франции, Великобритании, Нидерландах, Новой Зеландии и Швеции в общей сложности 33 пациента умерли от BIA-ALCL [9, 32, 41—43].
При среднем сроке наблюдения 45 мес у 28% пациентов был обнаружен местный рецидив. В настоящее время в Австралии, Бразилии, Франции, Великобритании, Нидерландах, Новой Зеландии и Швеции в общей сложности 33 пациента умерли от BIA-ALCL [9, 32, 41—43].
Причиной, приводящей к развитию тяжелых состояний и связанных с ними летальных исходов, чаще всего являются несвоевременная диагностикаи/или химиотерапевтическое лечение заболевания с неадекватным объемом резекции или вовсе без хирургического вмешательства.
Отсюда следует чрезвычайно важный вывод, что для лечения BIA-ALCL необходимы своевременная диагностика и полное хирургическое иссечение капсулы и опухолевых масс с чистыми краями резекции. Только хирургическое вмешательство увеличивает общую и безрецидивную выживаемость по сравнению с терапевтическими методами лечения. Было отмечено, что BIA-ALCL может проявлять гиперпрогрессию — это онкологический феномен, означающий очень быстрое развитие опухоли при неполном удалении [44]. С другой стороны, в настоящее время нет показаний для радикальной мастэктомии или расширенной лимфодиссекции [45]. Поскольку капсула имплантата может дренироваться в несколько региональных бассейнов лимфатических узлов, биопсия сторожевых лимфатических узлов не имеет смысла. Ряд авторов рекомендуют выполнять эксцизионную биопсию любого подозрительного лимфатического узла [46]. Приблизительно у 2—4% пациентов заболевание развивается билатерально, поэтому хирурги могут рассмотреть возможность удаления контралатерального имплантата и капсулы [16]. Полная резекция опухолевых тканей обеспечивает долговременную безрецидивную выживаемость. Если злокачественные клетки локализованы исключительно в капсуле (Lugano I—IIЕ, M. Anderson Cancer Center IA—IIA), можно лечить заболевание исключительно хирургическим путем. По сравнению со стадией I частота рецидивирования при стадии II в 2,6 раза выше, при стадии III в 2,7 раза [31]. Частота рецидивирования после полного хирургического удаления составляет 14,3% для пациентов со стадией T4 и 0% для пациентов со стадиями T1—T3 [31].
С другой стороны, в настоящее время нет показаний для радикальной мастэктомии или расширенной лимфодиссекции [45]. Поскольку капсула имплантата может дренироваться в несколько региональных бассейнов лимфатических узлов, биопсия сторожевых лимфатических узлов не имеет смысла. Ряд авторов рекомендуют выполнять эксцизионную биопсию любого подозрительного лимфатического узла [46]. Приблизительно у 2—4% пациентов заболевание развивается билатерально, поэтому хирурги могут рассмотреть возможность удаления контралатерального имплантата и капсулы [16]. Полная резекция опухолевых тканей обеспечивает долговременную безрецидивную выживаемость. Если злокачественные клетки локализованы исключительно в капсуле (Lugano I—IIЕ, M. Anderson Cancer Center IA—IIA), можно лечить заболевание исключительно хирургическим путем. По сравнению со стадией I частота рецидивирования при стадии II в 2,6 раза выше, при стадии III в 2,7 раза [31]. Частота рецидивирования после полного хирургического удаления составляет 14,3% для пациентов со стадией T4 и 0% для пациентов со стадиями T1—T3 [31]. Локальный рецидив наиболее вероятен после неполной резекции или частичной капсулэктомии. Неоперабельная опухоль или неполностью иссеченная капсула, вероятнее всего, потребуют адъювантного лечения. Остается неясным, какое влияние на местное рецидивирование оказывает непреднамеренная утечка серомы во время капсулэктомии. Пациентам с неполной капсулэктомией, положительным краем резекции или неоперабельной опухолевой массой и инвазией в грудную стенку рекомендуется местная лучевая терапия от 24 до 36 Гр. Системная терапия оправдана у пациентов со стадиями II—IV по классификации Lugano или стадиями IIB—IV по классификации TNM. Онкологи могут использовать либо стандартный подход, как при лечении системной ALCL (рекомендации NCCN для терапии первой линии периферической Т-клеточной лимфомы), а именно комбинированную химиотерапию на основе антрациклина (циклофосфамид, винкристин, доксорубицин и преднизон), либо как альтернативу комбинацию с ведотином брентуксимабом [47]. При лечении BIA-ALCL в исследованиях была продемонстрирована хорошая эффективность брентуксимаба-ведотина, а комбинация химиотерапии антрациклином и брентуксимабом-ведотином в исследовании ECHELON II показала наилучшие результаты в отношении выживаемости [39, 40, 48, 49].
Локальный рецидив наиболее вероятен после неполной резекции или частичной капсулэктомии. Неоперабельная опухоль или неполностью иссеченная капсула, вероятнее всего, потребуют адъювантного лечения. Остается неясным, какое влияние на местное рецидивирование оказывает непреднамеренная утечка серомы во время капсулэктомии. Пациентам с неполной капсулэктомией, положительным краем резекции или неоперабельной опухолевой массой и инвазией в грудную стенку рекомендуется местная лучевая терапия от 24 до 36 Гр. Системная терапия оправдана у пациентов со стадиями II—IV по классификации Lugano или стадиями IIB—IV по классификации TNM. Онкологи могут использовать либо стандартный подход, как при лечении системной ALCL (рекомендации NCCN для терапии первой линии периферической Т-клеточной лимфомы), а именно комбинированную химиотерапию на основе антрациклина (циклофосфамид, винкристин, доксорубицин и преднизон), либо как альтернативу комбинацию с ведотином брентуксимабом [47]. При лечении BIA-ALCL в исследованиях была продемонстрирована хорошая эффективность брентуксимаба-ведотина, а комбинация химиотерапии антрациклином и брентуксимабом-ведотином в исследовании ECHELON II показала наилучшие результаты в отношении выживаемости [39, 40, 48, 49]. На основании результатов исследования ECHELON II добавление брентуксимаба в схему химиотерапии при лечении периферических Т-клеточных лимфом в настоящее время считается предпочтительным. Брентуксимаб-ведотин также может использоваться в качестве неоадъювантной химиотерапии для снижения инвазии в грудную стенку [40, 50].
На основании результатов исследования ECHELON II добавление брентуксимаба в схему химиотерапии при лечении периферических Т-клеточных лимфом в настоящее время считается предпочтительным. Брентуксимаб-ведотин также может использоваться в качестве неоадъювантной химиотерапии для снижения инвазии в грудную стенку [40, 50].
Замена имплантатов на гладкие может быть рассмотрена в зависимости от предпочтений пациента. Из-за вероятной генетической предрасположенности замена имплантатов на текстурированные нецелесообразна [6].
После операции пациентам необходимо находиться под наблюдением онколога, который может отслеживать рецидивирование заболевания и оценивать необходимость дополнительной терапии. Пациенты должны проходить осмотр каждые 3—6 мес в течение 2 лет, а затем в соответствии с клиническими показаниями. В качестве метода визуализации на послеоперационном этапе можно использовать КТ или ПЭТ КТ (наличие очагов повышенной метаболической активности) каждые 6 мес в течение 2 лет [6].
Опираясь на данные о росте заболеваемости BIA-ALCL, можно сделать два вывода. Первый состоит в том, что с увеличением всеобщей осведомленности растет и количество диагностированных случаев. Пластические хирурги и сами пациенты стали более настороженно относиться к любым симптомам, подозрительным на BIA-ALCL. Второй вывод касается создания регистров. Именно благодаря всемирным и государственным регистрам учета заболеваемости удалось объединить и обработать информацию о пациентах, причинах BIA-ALCL, прогнозах и лечении. Учитывая редкость заболевания, каждый диагностированный случай имеет особую ценность и должен быть донесен до научного сообщества и проанализирован.
Во Франции, Сингапуре, Канаде и некоторых других странах власти уже приостановили действие лицензий на макротекстурированные грудные имплантаты. В США же, согласно заявлению заместителя первого комиссара FDA Эми Абернети, решено пока ограничиться добавлением предупреждения о риске BIA-ALCL на вкладыши текстурированных имплантатов. Более радикальные действия будут предприняты лишь после получения полной информации о заболевании.
Более радикальные действия будут предприняты лишь после получения полной информации о заболевании.
Интересно, что описано 4 случая, когда диагноз BIA-ALCL был поставлен пациенту с гладкой оболочкой имплантата, однако у всех 4 пациентов в анамнезе было проведено эндопротезирование молочных желез с использованием текстурированного имплантата [29]. В исследовании PROFILE при анализе данных 89 пациентов среднее время от эндопротезирования до диагностики заболевания составило 9,0 года [29].
Согласно последним данным, демонстрирующим возможный патогенетический механизм стимуляции Т-клеток при хроническом воспалительном процессе у генетически предрасположенных женщин, эксперты рекомендуют серьезно рассмотреть 14 пунктов, предложенных A. Deva и соавт. [14]:
1. Используйте внутривенную антибиотикопрофилактику во время операции.
2. Избегайте периареолярных/трансаксиллярных разрезов.
3. Используйте асептическую защиту для сосков, чтобы предотвратить попадание бактерий в карман.
4. Выполняйте атравматическую диссекцию, чтобы минимизировать деваскуляризацию тканей.
5. Проведите тщательный проспективный гемостаз.
6. Избегайте расслоения паренхимы молочной железы.
7. Используйте двухплоскостной карман.
8. Выполните орошение кармана раствором бетадина в комбинации с антибиотиком.
9. Выполните действия по минимизации загрязнения кожи.
10. Минимизируйте время вскрытия имплантата и замены имплантата или сайзера.
11. Замените хирургические перчатки перед установкой имплантата и используйте новые или очищенные инструменты и простыни.
12. Избегайте использования послеоперационных дренажей, которые могут быть потенциальным местом проникновения бактерий.
13. Используйте многослойное ушивание раны.
14. Используйте послеоперационную антибиотикопрофилактику.
Двенадцатый пункт является спорным, поскольку врастание фиброзной ткани в поры текстурированного имплантата может снизить вероятность образования биопленок и размножения бактерий, а этот процесс ускоряется при создании отрицательного давления в перипротезном кармане. Отрицательное давление может обеспечить только активная дренажная система. Кроме того, было продемонстрировано, что кровь может увеличить образование эндопротезных биопленок. Этим подчеркивается необходимость ликвидации жидкости вокруг имплантата с помощью дренажной системы [28].
Отрицательное давление может обеспечить только активная дренажная система. Кроме того, было продемонстрировано, что кровь может увеличить образование эндопротезных биопленок. Этим подчеркивается необходимость ликвидации жидкости вокруг имплантата с помощью дренажной системы [28].
Анапластическая крупноклеточная имплантат-ассоциированная Т-клеточная лимфома, или BIA-ALCL, является медленнопрогрессирующим злокачественным заболеванием, которое связано с хроническим воспалением вокруг оболочки текстурированного имплантата и клональной активацией Т-лимфоцитов. Этот вид лимфомы всегда является киназа-негативным (ALK−) и имеет иммуногистохимический маркер СD30, который присущ большинству неходжкинских лимфом и должен рассматриваться в соответствии с анамнезом заболевания и полной клинической картиной. Сочетание этих факторов должно быть ориентиром для патоморфологов.
Технически диагностика BIA-ALCL не составляет проблем, однако крайне затруднена в связи с низкой осведомленностью врачей об этом заболевании. Во всем мире уже разработаны информированные добровольные согласия для пациентов, главной целью которых является повышение онконастороженности пациентов и врачей для наиболее ранней диагностики заболевания. На ранних стадиях BIA-ALCL имеет благоприятный прогноз и зачастую требует исключительно хирургического лечения.
Во всем мире уже разработаны информированные добровольные согласия для пациентов, главной целью которых является повышение онконастороженности пациентов и врачей для наиболее ранней диагностики заболевания. На ранних стадиях BIA-ALCL имеет благоприятный прогноз и зачастую требует исключительно хирургического лечения.
Несомненно, это заболевание требует дальнейшего изучения. Особенно интересны генетические предпосылки возникновения BIA-ALCL.
На сегодняшний день главной задачей является повышение уровня осведомленности врачей и пациентов о BIA-ALCL, возможно, полный отказ от макротекстурированных имплантатов, а также профилактика бактериального загрязнения при установне эндопротеза.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no Bodys of interest.
Сведения об авторах
Мантурова Н.Е. — https://orcid.org/0000-0003-4281-1947
Мельников Д.В. — https://orcid.org/0000-0002-7960-0951
Старцева О. И. — https://orcid.org/0000-0001-9778-2624
И. — https://orcid.org/0000-0001-9778-2624
Прудникова Д.К. — https://orcid.org/0000-0003-3640-4798
Петручук В.А. — https://orcid.org/0000-0003-4098-7770
Автор, ответственный за переписку: Мельников Дмитрий Владимирович — e-mail: [email protected]
Импланты молочной железы могут вызвать рак – Наука – Коммерсантъ
Производитель имплантов молочной железы Allergan объявил, что прекращает поставки и отзывает уже поставленные импланты молочной железы, имеющие рельефную поверхность.
Это решение продиктовано данными американского Управления контроля качества пищевых продуктов и медикаментов (FDA): именно импланты производства Allergan (торговая марка Biocell) с рельефной поверхностью становятся причиной большинства случаев редкой формы лимфомы. Те же сведения поступили от надзорных органов Франции, Австралии и Канады.
Правда, FDA не выпустило рекомендацию женщинам с уже установленными имплантами удалять их: рак очень редкий, но они должны проконсультироваться с врачом, если у них возникли какие-то неприятные симптомы, в частности болевые ощущения или отек.
Рельефная поверхность придумана для имплантов Biocell, чтобы не допустить свободы их движения в молочной железе после имплантации, кроме того, рельефная поверхность минимизирует появление рубцовой ткани. Бренд занимает всего 5% рынка США. Подавляющее большинство грудных имплантатов, используемых в США, имеют гладкую поверхность.
Отзыв Biocell никак не влияет на поставки ни гладких имплантов производства Allergan, ни рельефных имплантов под другим брендом — Microcell.
Впервые надзорные органы связали имплантацию Biocell с возникновением лимфомы еще в 2011 г. Парадокс состоит в том, что причиной появления имплантов у жнщин часто становятся восстановительные операции после частичного удаления молочной железы из-за злокачественного новообразования. Лимфома — это не рак молочной железы, заболевание хотя и злокачественное, но развивается оно медленно и обычно успешно излечивается хирургическим путем, в том числе удалением имплантов.
В мае нынешнего года FDA была более благосклонна и не требовала от Allergan отзывать изделия и прекращать их поставки. Но теперь стала очевидна прямая связь именно этой модели импланта с лимфомой, и пришлось Biocell запретить.
Но теперь стала очевидна прямая связь именно этой модели импланта с лимфомой, и пришлось Biocell запретить.
Связь других рельефных имплантов с онкологическими заболеваниями не установлена.
«Как только было доказано, что продукт конкретного производителя, с большой вероятностью, напрямую связан со значительным вредом для пациента, включая смерть, FDA приняло меры»,— объяснила замруководителя FDA Эми Абернети.
По данным FDA, более 80% из 570 подтвержденных случаев этого вида лимфомы во всем мире были связаны с имплантами Allergan. По оценкам регулирующих органов, риск заболевания в шесть раз выше при использовании имплантов Allergan, чем рельефных имплантов других производителей.
Чиновники FDA сказали, что решили ввести запрет, когда получили 116 новых сообщений о лимфоме, а число смертей от этого заболевания достигло 33, в том числе по меньшей мере в 12 случаях – у женщин с имплантами молочной железы Allergan.
Анатолий Кривов
Ботокс вне конкуренции.
 Зачем покупать акции Allergan :: Новости :: РБК Инвестиции 30 авг 2018, 16:02
Зачем покупать акции Allergan :: Новости :: РБК Инвестиции 30 авг 2018, 16:02 0
Аналитики «Открытие Брокер» рекомендуют покупать акции фармацевтической компании Allergan. По их мнению, основные преимущества компании — верная стратегия, а также ключевые препараты: ботокс и Рестасис
Фото: allergan. com
com
Акции фармацевтической компании Allergan, которая производит ботокс и грудные импланты, привлекательны для инвесторов, полагают аналитики «Открытие Брокер». По их мнению, бумаги компании сильно недооценены и могут подорожать на 31% за ближайший год.
В Morgan Stanley также считают, что акции компании достойны покупки. Недавно в банке подняли прогнозную цену бумаг Allergan на 12%. «Allergan все еще торгуется значительно ниже, чем другие крупные фармацевтические компании», — считают в Morgan Stanley.
Allergan — транснациональная фармацевтическая компания, входящая в десятку крупнейших в мире. Бизнес Allergan развивается по восьми основным терапевтическим направлениям: эстетическая медицина, дерматология, офтальмология, урология, гастроэнтерология, центральная нервная система, женское здоровье и противоинфекционные препараты.
Преимущества Allergan состоят в верной стратегии и безопасном, «защитном» характере ключевых сегментов портфеля — эстетической медицины и офтальмологии, уверены эксперты.
Ботокс и грудные импланты
«Allergan на протяжении многих лет остается крупнейшим производителем ботокса в мире с огромным отрывом от второго по доле конкурента, — отмечают в «Открытие Брокер». — И это несмотря на то, что сроки рыночной эксклюзивности и патентной защиты давно прошли. На мировом рынке ботокса доля компании составляет 70-90%».
Причины кроются в сложном технологическом процессе производства ботокса, жестком регулировании и лицензировании подобной продукции, а также в большом опыте Allergan в данном сегменте, объяснили аналитики.
Продажи ботокса, грудных имплантов и другой косметической продукции, предлагаемой Allergan, растут на 12-20% в годовом сопоставлении. В частности, во втором квартале 2018 финансового года чистая прибыль по ботоксу увеличилась на 14,1% по сравнению с прошлым годом.
Еще более сильную динамику показали доходы от второго по популярности препарата Allergan — Рестасиса. Он применяется для лечения синдрома сухого глаза: за отчетный период чистая прибыль по этому лекарству выросла на 16,7%.
Компания избавилась от дженериков
В недавнем прошлом руководство Allergan предприняло ряд верных стратегических шагов, считают в «Открытие Брокер». Компания вышла из сегмента продаж так называемых дженериков, продав этот бизнес израильской компании Teva, а вырученные средства направила на снижение долговой нагрузки. Впоследствии Teva, как и весь рынок дженериков, начала испытывать трудности из-за сильной конкуренции.
Дженерик — препарат, эквивалентный оригинальному, который могут производить и продавать другие компании после того, как истечет срок действия патента на производство оригинального лекарства.
Недавно стало известно, что Allergan продал относительно слабую дерматологическую франшизу. Это указывает на то, что менеджмент явно фокусируется на продуманной перестройке портфеля и вложении капитала в направления с наибольшей доходностью. Вероятно, в дальнейшем компания продаст некоторые другие франшизы компании, считают аналитики «Открытие Брокер».
Вероятно, в дальнейшем компания продаст некоторые другие франшизы компании, считают аналитики «Открытие Брокер».
Тем не менее, инвесторы все еще отчасти негативно воспринимают компанию: по мнению аналитиков, рынок недооценивает Allergan за относительно слабый в недавнем прошлом портфель разрабатываемых препаратов. Кроме того, игроки, по всей видимости, по-прежнему связывают компанию с индустрией дженериков, переживающей трудные времена.
Автор
Валентина Гаврикова
Импланты Аллерган применяемые в B-Clinic
Среди широкого разнообразия имплантов, применяемых для увеличения груди, одна марка заслуживает особого внимания. Это продукция компании Аллерган, которая признается большинством специалистов имплантами №1 во всем мире. В чем же состоит их исключительность?
Это продукция компании Аллерган, которая признается большинством специалистов имплантами №1 во всем мире. В чем же состоит их исключительность?Начнем с того, что американская компания Аллерган давно и прочно завоевала репутацию области разработки и внедрения новейших средств пластической хирурги, дерматологии и косметологии. Достаточно упомянуть о такой разработке как препарат Ботокс, используемый для борьбы с мимическими морщинами. Этот препарат настолько широко вошел в практику косметологов, что его название стало нарицательным.
Не меньшую популярность сникали и другие продукты компании, например, средства для контурной пластики на основе гиалуроновой кислоты – филлеры Суржидерм и Ювидерм.
Возвращаясь к теме силиконовых имплантов, следует заметить, что компания Аллерган посвятила более 30 лет исследованиям в этой области. В результате накопленного опыта появились импланты Натрелль, в которых был воплощен ряд инновационных разработок, каждая из которых является уникальным ноу-хау. Благодаря этим разработкам удалось минимизировать или полностью исключить риск осложнений, которые долгое время оставались «ахиллесовой пятой» грудного эндопротезирования — капсулярной контрактуры, диффузии геля (протечки имплантов), деформации и смещения имплантов.
Благодаря этим разработкам удалось минимизировать или полностью исключить риск осложнений, которые долгое время оставались «ахиллесовой пятой» грудного эндопротезирования — капсулярной контрактуры, диффузии геля (протечки имплантов), деформации и смещения имплантов.
Грудные импланты Аллерган имеют текстурированную поверхность MICRO CELL. Она не только обеспечивает надежное удержание импланта на одном месте, исключая его ротацию и смещение, но и сводит к минимуму риск капсулярной контрактуры (образования вокруг импланта капсулы из фиброзной ткани).
Второе, что отличает импланты Аллерган – это оболочка с барьерным слоем INTRASHIEL, который исключает протекание и гарантирует максимальную прочность имплантов.
Что касается содержимого имплантов Аллерган – когезивного геля, то использование технологии Soft Touch позволило сделать силиконовую грудь неотличимой на ощупь от натуральной. При этом наряду с обычным когезивным гелем в имплантах Аллерган используется особый гель с памятью формы, которая гарантирует неизменность контуров груди даже по прошествии длительного времени.
Еще одной особенностью имплантов Аллерган является широчайший выбор. На сегодняшний день компания предлагает более 500 вариантов имплантов различного объема, формы и проекции.
«Мой муж очень доволен новой грудью»
Лера Кудрявцева (48) всегда славилась своим внушительным бюстом, но недавно сделала операцию по удалению грудных имплантов. И сейчас, наконец, звезда рассказала в эфире шоу «Звезды сошлись», как отнесся к переменам во внешности ее супруг, хоккеист Игорь Макаров: «Мой муж очень доволен новой грудью. Я переживала, ведь когда 15 лет ходишь с большим бюстом, и тебе что-то мешает, думаешь: ну как же». Сама Кудрявцева призналась, что тоже рада избавлению от инородных предметов в своем теле, учитывая, что один из имплантов (McGhan от компанииAllergan) начал протекать.
View this post on Instagram
1.
Наркоз ещё не отошёл , возможно завтра пожалею о своём откровении , но если мой пост убережёт хоть несколько девушек от установки имплантов , значит все не зря . 2. 15 лет назад в Санкт — Петербурге я поставила импланты в грудь фирмы МакГан . На сертификате было чёрным по белому написано — пожизненная гарантия , а доктор говорил — можно танком давить 3. Тогда не было никакой информации и мы ещё были подопытные кролики ? 4. Каждый год прохожу чек — ап . Отправили на Узи , потом на МРТ с констрастом . Вердикт ! Левый имплант порван , протекает лет 5-6 куда только можно было затечь :((( в срочном порядке операция по удалению имплантов с капсулой и иссечения силикона из тканей . Очень агрессивная операция , очень ?Девочки — этот пост для вас , у меня есть много информации . Вам решать , но вдруг кто то услышит . Подробнее напишу на днях и расскажу вам о « болезни грудных имплантов « Ну а меня я очень надеюсь вы примите и такую ?Будьте здоровы ?#explant
A post shared by KUDRYAVTSEVA LERA (@leratv) on
Кудрявцева написала в Instagram целый пост о своей операции, которую телеведущей провел хирург Рубин Алексей Игоревич: «15 лет назад в Санкт — Петербурге я поставила импланты в грудь фирмы МакГан . На сертификате было чёрным по белому написано — пожизненная гарантия , а доктор говорил — можно танком давить 3. Тогда не было никакой информации и мы ещё были подопытные кролики ? 4. Каждый год прохожу чек — ап . Отправили на Узи , потом на МРТ с констрастом . Вердикт ! Левый имплант порван , протекает лет 5-6 куда только можно было затечь :((( в срочном порядке операция по удалению имплантов с капсулой и иссечения силикона из тканей . Очень агрессивная операция , очень» (орфография и пунктуация автора сохранены — прим.редакции).
На сертификате было чёрным по белому написано — пожизненная гарантия , а доктор говорил — можно танком давить 3. Тогда не было никакой информации и мы ещё были подопытные кролики ? 4. Каждый год прохожу чек — ап . Отправили на Узи , потом на МРТ с констрастом . Вердикт ! Левый имплант порван , протекает лет 5-6 куда только можно было затечь :((( в срочном порядке операция по удалению имплантов с капсулой и иссечения силикона из тканей . Очень агрессивная операция , очень» (орфография и пунктуация автора сохранены — прим.редакции).
Кстати, в конце июля прошлого года компания отозвала из продажи свои импланты в связи с риском развития рака груди у пациентов. «Добровольный отзыв продукции является мерой предосторожности в связи с недавно обновленными данными о безопасности, полученными и опубликованными FDA. Данные касаются нечастых случаев развития анапластической крупноклеточной лимфомы, ассоциированной с имплантами молочной железы», — заявила пресс-служба Allergan.
Данные касаются нечастых случаев развития анапластической крупноклеточной лимфомы, ассоциированной с имплантами молочной железы», — заявила пресс-служба Allergan.
Сама Лера вовсю отговаривает всех от совершения ошибки и рекомендует подписчикам 100 раз подумать, прежде, чем улучшать свою внешность с помощью увеличения груди.
Allergan объявляют об отзыве во всем мире имплантатов груди и тканевых расширителей с биоклеточной текстурой
24 июля 2019 года компания Allergan объявила о глобальном отзыве текстурированных грудных имплантатов и тканевых расширителей Biocell после того, как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) запросило отзыв.
Отзыв произошел после того, как редкий тип рака, называемый анапластической крупноклеточной лимфомой (ALCL), был связан с текстурированными грудными имплантатами. Лимфома — это рак лимфатической системы.
Лимфома — это рак лимфатической системы.
В настоящее время 38 других стран отозвали этот имплант из-за его связи с ALCL.
FDA также обновило количество случаев ALCL, связанных с грудными имплантатами, во всем мире: 573 женщины были диагностированы, и 33 женщины умерли от этого заболевания.
Из 573 случаев ALCL 481 связано с имплантатами Allergan. FDA сообщает, что из 33 смертей производитель имплантатов был известен 13 женщинам. Из этих 13 женщин у 12 был подтвержден грудной имплантат Allergan на момент постановки диагноза ALCL.
Прочтите пресс-релиз Allergan.
Прочтите пресс-релиз FDA.
«Хотя общая заболеваемость ALCL кажется относительно низкой, после того, как доказательства показали, что продукт конкретного производителя, по-видимому, напрямую связан со значительным ущербом пациенту, включая смерть, FDA приняло меры, чтобы предупредить фирму о новых доказательствах, указывающих на отзыв оправдан для защиты здоровья женщин », — заявила в заявлении первый заместитель комиссара FDA Эми Абернети.
FDA не рекомендует удалять или заменять текстурированные грудные имплантаты или расширители тканей у женщин, у которых нет симптомов.
О ALCL
В январе 2011 года FDA впервые сообщило о возможной связи между солевыми и силиконовыми грудными имплантатами и ALCL в ткани рядом с имплантатом.
Многим женщинам, перенесшим мастэктомию для лечения рака груди, в дальнейшем реконструируют одну или обе груди. Восстановить грудь можно двумя способами:
- с использованием ткани, трансплантированной из другой части тела (например, спины, живота или бедер)
- установка имплантата, заполненного физиологическим раствором (соленая вода) или силиконовым гелем
Имплантат с физиологическим раствором имеет силиконовую оболочку, заполненную физиологическим раствором.Имплантаты из силиконового геля заполнены прочным силиконовым гелем. Они, как правило, кажутся мягче, чем солевые имплантаты, и некоторые женщины думают, что текстура больше похожа на натуральную ткань груди.![]()
После установки грудного имплантата вокруг него образуется рубцовая ткань, образуя так называемую тканевую капсулу. ALCL может развиваться внутри и вокруг тканевой капсулы.
В январе 2018 года голландское исследование оценило риск ALCL у женщин с грудными имплантатами следующим образом:
- 1 из 35 000 для женщин в возрасте 50 лет
- 1 из 12 000 в возрасте 70 лет
- 1 из 7000 в возрасте 75 лет
По данным FDA, риск ALCL выше у женщин с текстурированными имплантатами, которые имеют неровную поверхность, в отличие от гладких имплантатов.Материал внутри имплантата — силикон или физиологический раствор — не влияет на риск ALCL.
Таким образом, хотя риск ALCL низок, женщины с грудными имплантатами, особенно с текстурированными грудными имплантатами, действительно имеют более высокий риск заболевания по сравнению с женщинами без грудных имплантатов.
Большинство женщин, которым был поставлен диагноз, обращались к своим врачам и им был поставлен диагноз ALCL, потому что жидкость собралась вокруг имплантата (так называемая серома) спустя годы после установки имплантата. В некоторых случаях диагноз ставился после анализа серомной жидкости. В других случаях ALCL диагностировали после того, как в груди было обнаружено образование, или из-за того, что тканевая капсула сжалась (так называемая капсульная контрактура) и вызвала дискомфорт или косметические проблемы.
В некоторых случаях диагноз ставился после анализа серомной жидкости. В других случаях ALCL диагностировали после того, как в груди было обнаружено образование, или из-за того, что тканевая капсула сжалась (так называемая капсульная контрактура) и вызвала дискомфорт или косметические проблемы.
Большинство ALCL, связанных с грудными имплантатами, лечится путем удаления имплантата и капсулы рубцовой ткани. Дополнительные методы лечения, такие как лучевая терапия и химиотерапия, обычно не требуются, но в некоторых случаях могут быть рекомендованы.
В январе 2019 года группа экспертов-онкологов и пластических хирургов из Национальной комплексной онкологической сети разработала рекомендации по лечению ALCL, связанных с текстурированными грудными имплантатами.
Отзыв товаров
В число отозванных продуктов Allergan входят:
- Натрелле солевой имплантат груди стилей 168, 363, 468
- Натрелл и МакГан 410 типов грудных имплантатов LL, LM, LF, LX, ML, MM, MF, MX, FL, FM, FF, FX
- Натрелл и МакГан 410 грудных имплантатов Soft Touch типов LL, LM, LF, LX, ML, MM, MF, MX, FL, FM, FF, FX
- Natrelle 510 Dual-Gel стили LX, MX, FX
- Грудные имплантаты Natrelle Inspira, стили TRL, TRLP, TRM, TRF, TRX, TSL, TSLP, TSM, TSF, TSX, TCL, TCLP, TCM, TCF, TCX
- Круглые гелевые имплантаты Natrelle и McGhan, стили 110, 110 Soft Touch, 120, 120 Soft Touch
- Грудные имплантаты Natrelle Komuro в стилях KML, KMM, KLL и KLM
- Грудной имплантат Natrelle Ritz Princess в стилях RML, RMM, RFL, RFM
- Natrelle 150 Двухпросветные имплантаты полной и короткой высоты
- Natrelle 133 расширители ткани с шовными язычками и без них: стили 133FV, 133MV, 133LV, 133MX, 133SX, 133SV, T-133FV, T-133MV, T-133LV, T-133MX, T-133SX, T-133SV, 133FV- Т, 133МВ-Т, 133ЛВ-Т, 133МХ-Т, 133СХ-Т, 133СВ-Т
- Natrelle 133 Plus модели расширителей тканей 133P-FV, 133P-MV, 133P-LV, 133P-MX, 133P-SX, 133P-SV, T-133P-FV, T-133P-MV, T-133P-LV, T -133P-MX, T-133P-SX, T-133P-SV, 133P-FV-T, 133P-MV-T, 133P-LV-T, 133P-MX-T, 133P-SX-T, 133P-SV -T
Отзыв не распространяется на грудные имплантаты и расширители тканей Natrelle Smooth или Microcell компании Allergan.
Что это значит для вас
Если у вас есть имплант, FDA рекомендует:
- регулярный мониторинг симптомов ALCL
- , если у вас нет симптомов ALCL, нет необходимости удалять имплант и нет необходимости менять ваше обычное медицинское обслуживание и последующее наблюдение
Если вы планируете реконструкцию груди с помощью имплантата, поговорите со своим врачом о рисках и преимуществах имплантатов, в том числе о различиях между текстурированными и гладкими имплантатами.
Тем не менее, есть два вопроса, на которые нет хороших ответов:
- Имеет ли смысл оставлять имплантат без проблем на месте, если из противоположной груди был удален имплантат и тканевая капсула из-за ALCL?
- Безопасна ли замена имплантата, удаленного из-за ALCL, новым имплантатом?
Для решения этих проблем необходимы дополнительные исследования.
«Мы понимаем, что сегодняшние новости могут вызывать тревогу у некоторых пациентов с грудными имплантатами», — сказал Джефф Шурен, директор Центра устройств и радиологического здоровья FDA. «В опубликованном сегодня информационном сообщении по вопросам безопасности мы предоставляем действенную информацию для людей с определенными грудными имплантатами и их специалистов в области здравоохранения. FDA не рекомендует удаление для пациентов без симптомов из-за потенциальных рисков, но мы предоставляем полезную информацию для пациентов и поставщиков медицинских услуг, которую следует учитывать при обсуждении следующих шагов.
«В опубликованном сегодня информационном сообщении по вопросам безопасности мы предоставляем действенную информацию для людей с определенными грудными имплантатами и их специалистов в области здравоохранения. FDA не рекомендует удаление для пациентов без симптомов из-за потенциальных рисков, но мы предоставляем полезную информацию для пациентов и поставщиков медицинских услуг, которую следует учитывать при обсуждении следующих шагов.
«В дальнейшем мы намерены продолжать делиться с пациентами последней информацией об этой проблеме», — сказал он. «Мы будем постоянно оценивать любую новую информацию и, как следствие, можем принимать меры в отношении других грудных имплантатов, если это будет оправдано.Кроме того, мы продолжаем нашу оценку, чтобы определить, ограничен ли риск развития ALCL конкретными моделями текстурированных грудных имплантатов или всеми текстурированными грудными имплантатами ».
Если у вас есть имплант, и вы обеспокоены этим, позвоните своему врачу. Обязательно позвоните своему врачу, если у вас есть симптомы или проблемы с имплантатом, такие как боль, уплотнения, отек или асимметрия, особенно если эти проблемы развиваются через годы после установки имплантата.
Обязательно позвоните своему врачу, если у вас есть симптомы или проблемы с имплантатом, такие как боль, уплотнения, отек или асимметрия, особенно если эти проблемы развиваются через годы после установки имплантата.
Вы также можете сообщить о проблемах с имплантатом на сайте отчетов FDA MedWatch.Выберите ссылку на форму для потребителя / пациента.
Посетите страницы Breastcancer.org, посвященные реконструкции груди, чтобы узнать больше об операции по имплантации груди и других вариантах реконструкции груди.
Чтобы поговорить с другими об опыте использования грудных имплантатов и других вариантов реконструкции, присоединяйтесь к форуму Доска обсуждений Breastcancer.org Реконструкция груди.
Примечание редактора: Для получения дополнительной информации о заболеваниях, связанных с грудными имплантатами, и о том, что известно в настоящее время, послушайте наш подкаст с Фрэнком ДеллаКроче, M.D. FACS. Доктор ДеллаКроче является партнером-основателем Центра восстановительной хирургии груди и хирургической больницы Св. Чарльза. Эта статья была обновлена 29 августа 2019 г. и содержит более свежую информацию о реконструкции грудного имплантата.
Чарльза. Эта статья была обновлена 29 августа 2019 г. и содержит более свежую информацию о реконструкции грудного имплантата.
Автор: Джейми ДеПоло, старший редактор
Рецензент: Брайан Войцеховски, доктор медицины, медицинский консультант
Эта статья была полезной? Да / Нет Эта статья была полезной?
Опубликовано 24 июля 2019 г. 8:57
Allergan Aesthetics запускает специальную многоканальную кампанию, чтобы связаться с пациентами, которые могут не знать об отзыве BIOCELL®, и улучшить отслеживаемую информацию для U.S. Пациенты с имплантатами груди
IRVINE, Калифорния, 1 июня 2020 г. / PRNewswire / — Allergan Aesthetics, компания AbbVie (NYSE: ABBV), запускает новую цифровую кампанию для улучшения отслеживания устройств, а также дальнейшего выявления и доступа к грудным имплантатам. пациентам, у которых есть или были имплантаты груди и / или расширители тканей BIOCELL ® , чтобы проинформировать их о риске BIA-ALCL. С июля 2019 года, когда было объявлено об отзыве BIOCELL ® , были предприняты активные усилия по охвату пациентов, однако Компания по-прежнему стремится напрямую связываться со всеми U.S. BIOCELL ® пациента, которые еще не были уведомлены. Это связано с неполными данными отслеживания устройства примерно для 52 000 единиц грудных имплантатов BIOCELL ® .
пациентам, у которых есть или были имплантаты груди и / или расширители тканей BIOCELL ® , чтобы проинформировать их о риске BIA-ALCL. С июля 2019 года, когда было объявлено об отзыве BIOCELL ® , были предприняты активные усилия по охвату пациентов, однако Компания по-прежнему стремится напрямую связываться со всеми U.S. BIOCELL ® пациента, которые еще не были уведомлены. Это связано с неполными данными отслеживания устройства примерно для 52 000 единиц грудных имплантатов BIOCELL ® .
Важно отметить, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) сделало следующую рекомендацию: « Если у вас нет симптомов, мы не рекомендуем удаление этих или других типов грудных имплантатов из-за низкого риск развития BIA-ALCL.Однако, если у вас есть какие-либо вопросы, обратитесь к своему врачу ». 1
Allergan Aesthetics запустит многоканальную кампанию, которая будет включать в себя рекламу в цифровых и социальных сетях, чтобы дополнительно проинформировать пациентов о добровольном отзыве и направить их на веб-сайт Allergan Aesthetics www. BIOCELLinformation.com, чтобы узнать, как определить тип имплантата и зарегистрировать его. имплантаты.
BIOCELLinformation.com, чтобы узнать, как определить тип имплантата и зарегистрировать его. имплантаты.
«Allergan Aesthetics стремится к безопасности пациентов, и мы продолжаем прилагать все усилия, чтобы каждый пациент был осведомлен об отзыве BIOCELL ® и знал свой тип имплантата и историю имплантата», — сказал Джон Мальтман. Вице-президент по медицинским вопросам компании Allergan Aesthetics.
Если пациенты не знают об отзыве BIOCELL ® , о котором было объявлено ранее 24 июля 2019 г., и не знают тип имплантата, который у них установлен, или историю своего имплантата, им следует:
- Перейдите на сайт www.BIOCELLinformation.com, чтобы связаться с Allergan Aesthetics и узнать, есть ли у компании информация об имплантатах.
- Обратитесь к своему хирургу или в больницу, где они получили имплантаты, чтобы узнать, есть ли у хирурга или больницы записи об их имплантатах.
Пациенты, которые знают, что у них установлен имплант Allergan и которые, возможно, не участвовали в отслеживании устройств ранее, или которым необходимо обновить свою информацию на сайте www. BIOCELLinformation.com. Веб-сайт проинформирует их, как зарегистрироваться для отслеживания устройств, что настоятельно рекомендуется всем пациентам, и ответит на любые вопросы, которые могут у них возникнуть.
BIOCELLinformation.com. Веб-сайт проинформирует их, как зарегистрироваться для отслеживания устройств, что настоятельно рекомендуется всем пациентам, и ответит на любые вопросы, которые могут у них возникнуть.
Пациенты с имплантатами или расширителями тканей BIOCELL ® либо историей имплантатов или расширителей тканей BIOCELL ® должны перейти на сайт www.BIOCELLinformation.com, чтобы узнать об отзыве BIOCELL ® , симптомах анапластической крупноклеточной лимфомы, связанной с имплантатом груди (BIA-ALCL), важности самообследования груди и необходимости регулярного мониторинга имплантата груди.
«Мы полны решимости убедиться, что каждая женщина имеет необходимую информацию, связанную с добровольным отзывом BIOCELL ® , и мы продолжим поощрять женщин с грудными имплантатами определять свой тип имплантата и подключаться к нашей системе отслеживания устройств. .Обучение пациентов является приоритетом. «Мы сотрудничаем с Американским обществом пластических хирургов (ASPS) и Американским обществом эстетической пластической хирургии (ASAPS) в рамках крупных инициатив по повышению осведомленности о важности отслеживания грудных имплантатов», — сказала Кэрри Стром, старший вице-президент AbbVie и президент Global Allergan Aesthetics.
«Мы сотрудничаем с Американским обществом пластических хирургов (ASPS) и Американским обществом эстетической пластической хирургии (ASAPS) в рамках крупных инициатив по повышению осведомленности о важности отслеживания грудных имплантатов», — сказала Кэрри Стром, старший вице-президент AbbVie и президент Global Allergan Aesthetics.
О GLOBAL BIOCELL ® Отзыв
24 июля 2019 г. компания Allergan инициировала добровольный глобальный отзыв своих имплантатов груди и расширителей тканей BIOCELL ® .Компания Allergan продолжила работу по всему миру, чтобы гарантировать, что пациенты и медицинские работники будут уведомлены об отзыве BIOCELL®. Компания выпустила глобальные пресс-релизы и направила письма непосредственно профессионалам здравоохранения по поводу отзыва. Для повышения осведомленности и предоставления ресурсов для пациентов Компания запустила специальный веб-сайт www.BIOCELLinformation.com, чтобы помочь пациентам идентифицировать свои грудные имплантаты и предоставить информацию и ресурсы, связанные с риском BIA-ALCL.
Allergan Aesthetics, компания AbbVie, будет продолжать тесно сотрудничать с глобальными регулирующими органами, обществами и группами защиты интересов пациентов, чтобы предоставлять пациентам и медицинским работникам важную информацию о добровольном отзыве BIOCELL ® .
Для получения дополнительной информации об отзыве BIOCELL ® щелкните здесь, чтобы получить пресс-релиз.
Дополнительная информация о BIA-ALCL
BIA-ALCL — это не рак груди, это разновидность неходжкинской лимфомы (рак иммунной системы).В настоящее время считается, что вероятность развития BIA-ALCL низкая и встречается менее чем у 0,03% пациентов с текстурированными имплантатами груди BIOCELL ® . Тем не менее, BIA-ALCL является серьезным заболеванием и может привести к смерти, особенно если не диагностировать на ранней стадии или своевременно не начать лечение.
О компании Allergan Aesthetics
В Allergan Aesthetics, компании AbbVie, мы разрабатываем, производим и продаем портфель ведущих косметических брендов и продуктов. В нашем портфолио косметики есть инъекции для лица, коррекция контуров тела, пластика, уход за кожей и многое другое. Наша цель — постоянно предоставлять нашим клиентам инновации, образование, исключительный сервис и стремление к совершенству, и все это с индивидуальным подходом. Для получения дополнительной информации посетите www.AllerganAesthetics.com.
В нашем портфолио косметики есть инъекции для лица, коррекция контуров тела, пластика, уход за кожей и многое другое. Наша цель — постоянно предоставлять нашим клиентам инновации, образование, исключительный сервис и стремление к совершенству, и все это с индивидуальным подходом. Для получения дополнительной информации посетите www.AllerganAesthetics.com.
О компании AbbVie
Миссия AbbVie — открытие и поставка инновационных лекарств, которые решают серьезные проблемы здоровья сегодня и решают медицинские проблемы завтрашнего дня.Мы стремимся оказывать заметное влияние на жизнь людей в нескольких ключевых терапевтических областях: иммунология, онкология, нейробиология, офтальмология, вирусология, женское здоровье и гастроэнтерология, в дополнение к продуктам и услугам во всем портфолио Allergan Aesthetics. Для получения дополнительной информации об AbbVie посетите наш сайт www.abbvie.com. Подпишитесь на @abbvie в Twitter, Facebook, Instagram, YouTube и LinkedIn .
1 FDA.gov; 12.09.2019: Allergan добровольно отзывает текстурированные грудные имплантаты и расширители тканей BIOCELL®
ИСТОЧНИК AbbVie
Следует ли вам подавать иск об отзыве грудного имплантата Allergan?
В июле 2019 года производитель грудных имплантатов Allergen отозвал свои текстурированные имплантаты Natrelle BIOCELL и расширители тканей .
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) запросило отзыв из-за риска рака, известного как анапластическая крупноклеточная лимфома , связанная с грудным имплантатом (BIA-ALCL), у пациентов с этими имплантатами.
Обзор отзыва Allergan
По запросу FDA добровольный отзыв Allergan был инициирован во всем мире. Согласно BreastCancer.org, отзывы были сделаны в 38 странах из-за возможной связи между грудными имплантатами и лимфомой .
На момент первого запроса FDA об отзыве агентство получило 573 сообщения о BIA-ALCL во всем мире и 33 смертельных исходах. Из 573 случаев 481 был связан с имплантатами Allergan. По данным FDA, производитель имплантатов был причастен к 13 из 33 смертей. У двенадцати из этих 13 «на момент постановки диагноза ALCL было подтверждено наличие грудного имплантата Allergan».
Из 573 случаев 481 был связан с имплантатами Allergan. По данным FDA, производитель имплантатов был причастен к 13 из 33 смертей. У двенадцати из этих 13 «на момент постановки диагноза ALCL было подтверждено наличие грудного имплантата Allergan».
«Хотя общая частота BIA-ALCL кажется относительно низкой, после того, как доказательства показали, что продукт конкретного производителя, по-видимому, напрямую связан со значительным ущербом пациенту, включая смерть , FDA приняло меры, чтобы предупредить фирму о новых доказательства, указывающие на то, что отзыв оправдан для защиты здоровья женщин », — заявила первый заместитель комиссара FDA Эми Абернети в заявлении на сайте агентства.
Как и большинство отзывов, отзыв грудного имплантата Allergan направлен на защиту потребителей от опасного продукта. К сожалению, для некоторых женщин отзыв может быть произведен слишком поздно.
Помимо сотен пациентов, которые пострадали от BIA ALCL после имплантации продуктов Allergan, три женщины умерли от BIA ALCL в течение шестимесячного периода, который начался всего за несколько недель до объявления об отзыве, согласно Fortune . Даже с постоянно обновляемыми данными из FDA и других источников, могли быть неопознанные случаи BIA ALCL, которые уносили жизни женщин и не регистрировались.
Даже с постоянно обновляемыми данными из FDA и других источников, могли быть неопознанные случаи BIA ALCL, которые уносили жизни женщин и не регистрировались.
Какие продукты были в списке отзыва имплантатов Allergan?
Список отзыва Allergan включает пять различных имплантатов s. Отзыв касается всех партий перечисленных имплантатов, изготовленных в период с июля 2014 года по июль 2019 года. В США отзыв касается почти 250 000 имплантатов. Все отозванные имплантаты подпадают под действие текстурированного продукта Natrelle BIOCELL и включают каждый из следующих:
- Текстурированные имплантаты груди, заполненные физиологическим раствором, Allergan Natrelle
- Allergan Natrelle 410 Сильно когезивные текстурированные имплантаты груди с силиконовым наполнением анатомической формы
- Текстурированные имплантаты груди с силиконовым наполнителем Allergan Natrelle
- Расширитель тканей Allergan Natrelle 133 с шовными вкладками
- Расширитель тканей Allergan Natrelle 133 Plus
Что делать, если вы пострадали?
Хотя грудные имплантаты Allergan были отозваны компанией из-за их потенциальной связи с раком , этот отзыв Allergan только препятствует распространению новых имплантатов. Женщинам, у которых в организме есть эти имплантаты, не рекомендуется их удалять. Однако многие женщины с имплантатами сообщают, что испытывают беспокойство или дискомфорт из-за того, что они держат потенциально опасные имплантаты в своем теле.
Женщинам, у которых в организме есть эти имплантаты, не рекомендуется их удалять. Однако многие женщины с имплантатами сообщают, что испытывают беспокойство или дискомфорт из-за того, что они держат потенциально опасные имплантаты в своем теле.
Согласно FDA, пациентам, у которых не было симптомов имплантата Allergan, возможно, не нужно удалять имплантаты. Это связано с относительно низким уровнем BIA-ALCL среди тех, у кого есть грудные имплантаты. Тем не менее, согласно Кливлендской клинике, есть предупреждающий знак и симптом, на которые следует обратить внимание, например, покраснение, боль, уплотнения, изменения формы или размера груди или груди, отек или скопление жидкости возле имплантата.
Если вы испытали какой-либо из этих симптомов, вы можете поговорить со своим врачом о своем риске рака, связанного с грудным имплантатом.
Хотя Allergan предложила оплатить стоимость нового набора имплантатов для женщин, у которых в настоящее время есть отозванные имплантаты, компания отказалась покрыть расходы на удаление. Женщины, желающие удалить отозванные имплантаты, должны будут сами покрыть расходы на операцию, если им еще не был поставлен диагноз BIA-ALCL.
Женщины, желающие удалить отозванные имплантаты, должны будут сами покрыть расходы на операцию, если им еще не был поставлен диагноз BIA-ALCL.
Поскольку операции по имплантации груди часто не покрываются страховкой, многие женщины могут оказаться не в состоянии удалить свои потенциально опасные имплантаты в финансовом отношении, поскольку операция по удалению или замене имплантатов может стоить десятки тысяч долларов.
Многие женщины, решившие получить грудные имплантаты, делают это после двойной мастэктомии или другого лечения рака груди, и этот выбор может быть особенно трудным. По словам одной женщины из , которая говорила с Buzzfeed News о своем решении получить грудные имплантаты: «Мне удалили грудь из-за рака.Я не хотел снова возвращать рак ».
Другие женщины, которым поставили только грудные имплантаты из-за лечения рака груди, также сообщили, что боятся заболеть раком во второй раз.
Следует ли подавать иск Allergan об отзыве?
Для обеспечения безопасности потребителей медицинские устройства обычно должны пройти серию испытаний перед выпуском на рынок. Однако иногда опасные или дефектные устройства все же одобряются. Из-за этого некоторые потребители подают иски к производителям о неисправном медицинском устройстве.
Однако иногда опасные или дефектные устройства все же одобряются. Из-за этого некоторые потребители подают иски к производителям о неисправном медицинском устройстве.
Если ваши имплантаты Allergan должны были быть удалены или пересмотрены из-за BIA-ALCL, вы можете иметь право подать иск Allergan об отзыве, чтобы взыскать убытки за вашу боль и страдания, потерю заработной платы, медицинские счета и гонорары адвокатам. Адвокат Allergan по отзыву имплантатов может помочь вам составить убедительный аргумент.
Были ли поданы иски об отзыве компании Allergan?
Был подан ряд исков Allergan BIA-ALCL . Сообщается, что в октябре 2019 года две женщины из Флориды подали иск Allergan против производителя грудных имплантатов.Истцы утверждают, что им не следует выбирать между повышением риска развития рака и оплатой из своего кармана за удаление имплантатов. Они испрашивают компенсацию в размере за расходы на удаление имплантатов .
Истцы утверждают, что Allergan продала продукт, о котором она знала или должна была знать, что представляет риск для потребителей, и что в результате компания получила несправедливую прибыль.
Аналогичный иск был подан в августе истцами с требованием компенсации за удаление и замену имплантата.Allergan также столкнулась с судебными тяжбами со стороны женщин, которые утверждали, что их имплантаты вызвали рак. Согласно MassDevice, две женщины подали иск об отзыве Allergan в сентябре 2019 года, обвиняя в BIA-ALCL текстурированные имплантаты Allergan . Allergan пока отказывается платить за удаление имплантата.
В марте 2021 года судья Нью-Джерси постановил, что Allergan должна подать коллективный иск по поводу грудных имплантатов.
Allergan Breast Implants Рак и побочные эффекты
Что такое текстурированные имплантаты груди?
Во время операции по увеличению груди грудные имплантаты помещаются в тело либо за тканью груди, либо под грудной мышцей. Существует множество типов имплантатов, доступных для использования во время этой косметической операции, включая гладкие, текстурированные, круглые, фигурные, физиологические и силиконовые.
Существует множество типов имплантатов, доступных для использования во время этой косметической операции, включая гладкие, текстурированные, круглые, фигурные, физиологические и силиконовые.
Текстурированные грудные имплантаты отличаются от других имплантатов, поскольку они способствуют прилипанию рубцовой ткани к текстурированной поверхности. Согласно Американскому обществу пластических хирургов , это должно предотвратить смещение имплантатов и снизить риск образования тугой капсулы рубца — чего-то, что может привести к твердой, неестественной на ощупь груди.
В июне 2021 года исследование, проведенное в Rice University , показало, что текстурированная поверхность этих имплантатов может вызывать усиленный ответ иммунных клеток. Со временем это может вызвать мутации клеток и даже рак.
Подробнее: Что такое текстурированные имплантаты груди?
Могут ли грудные имплантаты вызвать лимфому?
В феврале 2019 года FDA предупредило , что грудные имплантаты могут вызывать BIA-ALCL, тип лимфомы.
В отличие от традиционного рака груди, который поражает саму ткань груди, этот рак развивается в капсуле рубца, которая образуется вокруг грудного имплантата в процессе заживления.
Связь между грудными имплантатами и раком была впервые выявлена в 2011 году, но обзор отчетов побудил FDA разослать более подробное объявление о безопасности, а также обратиться к врачам по этому поводу.
Каковы статистические данные FDA по раку от грудных имплантатов?
Согласно анализу отчетов о медицинских изделиях FDA, по крайней мере, 457 женщинам был поставлен диагноз BIA ALCL в Соединенных Штатах. В это число входят девять женщин, умерших от BIA-ALCL.
FDA все еще работает с Американским обществом пластических хирургов, чтобы понять точный риск рака от имплантатов груди.По некоторым оценкам, у 1 из 3817 пациентов разовьется BIA-ALCL, в то время как по другим оценкам только у 1 из 30 000 пациентов разовьется рак грудного имплантата.
Но способствующие факторы все еще не поняты с полной ясностью.![]()
Несмотря на общий недостаток информации, FDA выпустило объявление о безопасности, чтобы помочь американцам оставаться в курсе этого вопроса.
«Хотя количество выявленных случаев BIA-ALCL невелико по сравнению с примерно 1,5 миллионами пациентов, которым ежегодно устанавливаются грудные имплантаты во всем мире, подтвержденные данные и опубликованная информация, рассмотренные на сегодняшний день, предполагают, что пациенты с грудными имплантатами имеют повышенный риск BIA- ALCL », — заявило FDA.
Хотя FDA выпустило предупреждение для всех грудных имплантатов, агентство признало, что большинство зарегистрированных случаев было у людей с текстурированными имплантатами.
Подробнее: FDA предупреждает, что имплантаты груди могут быть связаны с раком
Почему был запрошен отзыв биоячейки Allergan на грудные имплантаты?
В июле 2019 года FDA обратилось к Allergan с просьбой о добровольном отзыве грудных имплантатов и расширителей тканей Natrelle BIOCELL. FDA заявило, что запрашивает отзыв «для защиты людей от повышенного риска анапластической крупноклеточной лимфомы, связанной с грудным имплантатом (BIA-ALCL)».”
FDA заявило, что запрашивает отзыв «для защиты людей от повышенного риска анапластической крупноклеточной лимфомы, связанной с грудным имплантатом (BIA-ALCL)».”
Федеральное агентство заявило, что его решение было основано на новых всемирных отчетах о медицинских устройствах (MDR), касающихся диагнозов BIA-ALCL и связанных смертей, связанных с грудными имплантатами Allergan. По данным FDA, было зарегистрировано 573 случая BIA-ALCL, и 481 из них произошел от женщин, у которых были имплантаты груди Allegan.
В сентябре 2019 года FDA сообщило, что выявляет отзыв текстурированных грудных имплантатов и экспандеров Allergan Natrell BIOCELL класса I — самого серьезного, — поскольку этот продукт был связан с серьезными травмами и смертью.
Как другие страны реагируют на связь между имплантатами груди и раком?
Текстурированные имплантаты также запрещены во всем мире.
В начале апреля 2018 года Франция стала первой страной, запретившей определенные текстурированные грудные имплантаты из-за их связи с лимфомой, связанной с грудным имплантатом, ABC News сообщило, что .
Министерство здравоохранения Канады пошло по стопам Франции, сообщает Toronto Star.
Австралийские регулирующие органы приостановили работу восьми моделей грудных имплантатов в сентябре 2019 года после того, как было зарегистрировано 100 случаев рака из-за имплантатов груди — и четыре смерти — сообщает The Guardian.
Что такое BIA-ALCL?
Заболевание, известное как анапластическая крупноклеточная лимфома, связанная с имплантатом груди (BIA-ALCL), не является раком груди.
Скорее, это вариант той же лимфомы, которая была связана с использованием гербицида , глифосата , злокачественного новообразования, которое атакует иммунную систему, особенно нацелено на лейкоциты или Т-клетки. ALCL является результатом генетической мутации, которая заставляет Т-клетки продуцировать избыточное количество определенного белка, известного как киназа анапластической лимфомы , или ALK-1, согласно Американскому онкологическому обществу.
BIA ALCL — уникальная форма рака, поскольку она поражает клетки в капсуле рубца вокруг имплантата. Это отличается от традиционного рака груди, при котором заболевание поражает ткани груди. Шрамовая капсула, которая образуется в процессе заживления, естественным образом содержит раковые клетки BIA ALCL и часто предотвращает распространение рака на другие части тела.
Каковы симптомы BIA-ALCL?
Первые симптомы обычно представляют собой безболезненную опухоль в подмышечной впадине, паху, шее или в другом месте лимфатического узла.
У пострадавшего может наблюдаться потеря аппетита или необъяснимая потеря веса, жар, ночная потливость и полное отсутствие энергии.
Для постановки точного диагноза необходима биопсия.
К счастью, если этот конкретный рак, вызванный грудными имплантатами, диагностирован на ранней стадии, его можно успешно вылечить.
В большинстве случаев операция проводится по удалению имплантата и пораженных тканей. Однако в более запущенных случаях может потребоваться химиотерапия и лучевая терапия.
Однако в более запущенных случаях может потребоваться химиотерапия и лучевая терапия.
Те, кто страдает BIA-ALCL, могут испытывать эти симптомы , согласно Кливлендской клинике:
- Боль в груди
- Шишки в груди или подмышке
- Набухание
- Изменения внешнего вида груди
- Накопление жидкости
- Сыпь на коже
- Уплотнение груди
FDA выпустило новые рекомендации для медицинских работников, чтобы рассмотреть возможность BIA-ALCL при лечении пациентов с этими симптомами .Хотя рак из грудных имплантатов встречается редко, агентство хочет, чтобы врачи помнили об этом заболевании, а не отклоняли его на основании вероятности.
«Мы хотим, чтобы все поставщики медицинских услуг знали о BIA-ALCL, особенно у пациентов с новой опухолью, опухолью или болью вокруг грудных имплантатов, чтобы ускорить диагностику этого злокачественного новообразования», — говорится в заявлении федерального агентства о безопасности.
Как женщина узнает, что у нее ALCL?
Если у женщины появились симптомы ALCL, ей следует назначить повторный прием к своему врачу , чтобы пройти обследование на наличие этого состояния, согласно PlasticSurgery.орг.
Во время приема врач может проверить наличие ALCL с помощью различных визуализационных тестов, включая УЗИ или МРТ. Это даст врачу четкое представление о любых жидкостях или комках, окружающих имплант.
Если изображение показывает избыток жидкости или шишки вокруг имплантата или в лимфатических узлах, врач, скорее всего, возьмет биопсию и откажется от жидкости для проверки на рак. Эти образцы будут проверены на иммунное окрашивание CD30 (CD30IHC), чтобы подтвердить или исключить диагноз ALCL.
Есть ли анализ крови на ALCL?
Есть нет анализа крови , чтобы подтвердить, есть ли у кого-то ALCL.
Врач должен подтвердить ALCL с помощью биопсии и тестирования. FDA рекомендует врачам проверять ALCL, проводя патологические тесты на свежесобранной жидкости и биоптатах. Это включает тестирование на маркеры CD30IHC и киназы анапластической лимфомы (ALK).
Это включает тестирование на маркеры CD30IHC и киназы анапластической лимфомы (ALK).
При других формах рака кровь проверяется на наличие специфических маркеров, связанных с этой разновидностью опухоли.Тем не менее, в ALCL кровь не может быть эффективно протестирована на онкомаркеры. Вместо этого необходимо проверить жидкость или ткань.
Излечима ли анапластическая крупноклеточная лимфома?
При раннем обнаружении ALCL легко поддается лечению. Пациенты с ранними случаями ALCL обычно видят рак, ограниченный капсулой рубцовой ткани.
Поскольку в этих случаях рак из грудных имплантатов не распространился на другие части тела, лечение так же просто, как удаление грудного имплантата и капсулы рубцовой ткани.
Что связано с лечением BIA-ALCL?
По данным PlasticSurgery.org, после диагностики рака, вызванного имплантатами груди, врач может назначить ПЭТ / КТ-сканирование, чтобы убедиться, что рак не распространился из груди на другие части тела. Распространение рака или его отсутствие определяет лечение и прогноз заболевания.
Распространение рака или его отсутствие определяет лечение и прогноз заболевания.
пациента ALCL будут направлены к онкологу, врачу, специализирующемуся на лечении рака. Врач-онколог сможет оценить болезнь и разработать индивидуальный план лечения.
Если рак находится только вокруг имплантата, лечение может быть относительно простым.
Грудной имплантат и рубцовая капсула, в которой образовавшаяся опухоль будет удалена из тела. В этих случаях дополнительное лечение может не потребоваться.
В некоторых случаях в лимфатических узлах в подмышечной впадине могут образовываться уплотнения. По данным PlasticSurgery.org, хотя это может указывать на распространение рака, это также может отражать увеличение лимфатических узлов в ответ на болезнь.
Если у женщины увеличены лимфатические узлы, образцы, скорее всего, будут взяты с помощью иглы или хирургической биопсии, чтобы врач мог проверить наличие рака.
Лучевая и химиотерапия обычно не нужны для лечения ALCL, но в более запущенных случаях, когда рак распространился по всему телу, может потребоваться лучевая и / или химиотерапия для устранения всех остатков болезни.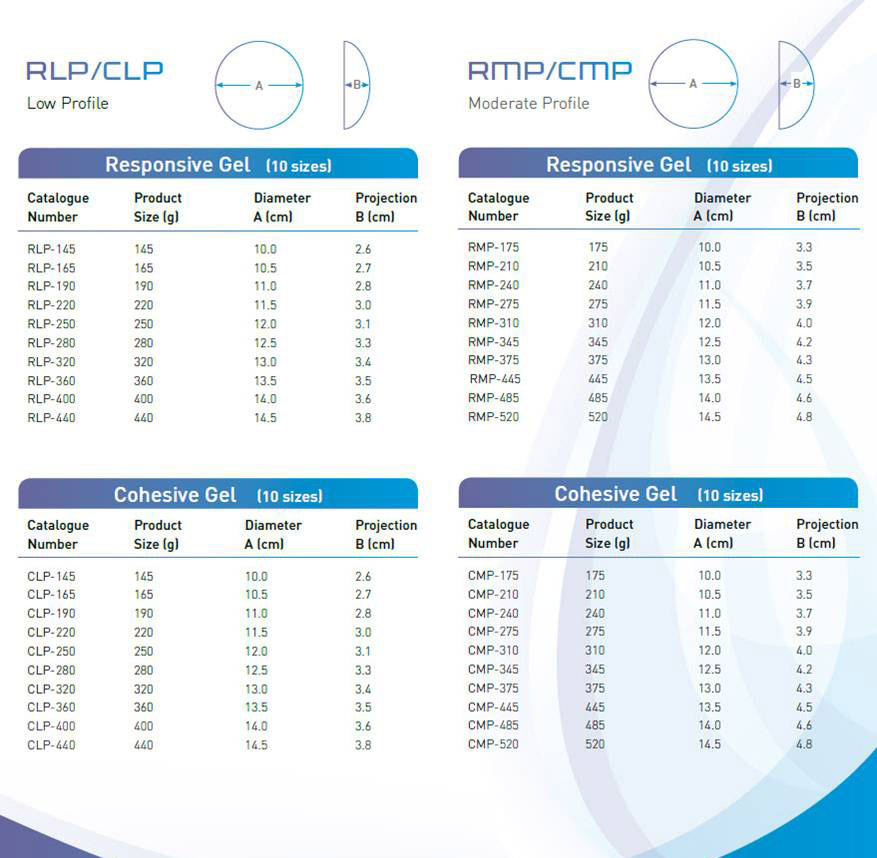
После подтверждения эрадикации ALCL из организма женщине, вероятно, придется регулярно в течение двух лет проводить визуализацию с интервалом в два года.
Если хирургическое удаление было частью лечения на ранних стадиях заболевания, риск рецидива низкий.
Что такое болезнь грудного имплантата?
В 2018 году более 50 000 женщин в двух группах в Facebook сообщили о различных симптомах, которые, по их словам, были вызваны « болезнью грудного имплантата ». Симптомы, о которых они сообщили, были классифицированы как симптомы аутоиммунного заболевания или расстройства соединительной ткани (CTD), хотя они не были связаны с конкретным аутоиммунным заболеванием или CTD.
Пластические хирурги и производители имплантатов говорят, что эти аутоиммунные проблемы и проблемы соединительной ткани не связаны с грудными имплантатами, согласно данным Национального центра исследований здоровья (NCHR) (NCHR), но организация утверждает, что исследования не согласны с этим выводом.
Исследования грудных имплантатов показали связь с этими заболеваниями после того, как женщины получили имплантаты:
Следует ли удалять текстурированные имплантаты груди?
Если у кого-то не развился рак из-за грудных имплантатов, FDA не рекомендует удалять имплантаты. Рекомендуется, чтобы женщины, принимающие продукт Allergan BIOCELL, проходили регулярный медицинский контроль.
Что делает Allergan с этим?
Когда Allergan выпустил отзыв , компания объявила, что оплатит затраты в размере на новые имплантаты для женщин, у которых есть имплантаты Biocell и которые хотят их заменить до 24 июля 2021 года.
Однако компания отказалась покрывать расходы на операцию.
Несмотря на отзыв своих имплантатов, Allergan сталкивается с судебными исками от многочисленных потребителей, которые утверждают, что их рак был прямым результатом грудных имплантатов . В июне 2021 года суд штата Нью-Джерси постановил, что Allergan должна столкнуться с этими исками в рамках коллективного коллективного иска .
Allergan получил предупреждение FDA по отозванным исследованиям безопасности грудных имплантатов
На этой неделе FDA выпустило два предупреждающих письма производителям грудных имплантатов, в том числе Allergan за то, что они не завершили постмаркетинговые исследования безопасности, документирующие риски двух моделей имплантатов, которые компания вывела на мировой рынок последней год.
Письмо пришло через неделю после того, как AbbVie окончательно закрыла свое крупное приобретение компании Allergan на сумму 63 миллиарда долларов, и в то время как ее эстетический бизнес сталкивается с новыми проблемами и проблемами, поскольку поставщики услуг закрываются перед лицом пандемии COVID-19.
В июле прошлого года Allergan опубликовала глобальный отзыв своих текстурированных грудных имплантатов, в том числе грудных имплантатов Natrelle, заполненных физиологическим раствором и силиконом, и расширителей тканей, спустя несколько месяцев после того, как FDA обнаружило всплески числа случаев конкретного рака, развивающегося в рубце. ткань, окружающая имплант, известная как анапластическая крупноклеточная лимфома, связанная с грудным имплантатом, или BIA-ALCL.
ткань, окружающая имплант, известная как анапластическая крупноклеточная лимфома, связанная с грудным имплантатом, или BIA-ALCL.
Предупреждающее письмо агентства на этой неделе сосредоточено на долгосрочных исследованиях Allergan безопасности его гелевых имплантатов Natrelle и имплантатов Natrelle 410 анатомической формы, которые позволят отслеживать уровень заболеваемости этими видами рака среди других проблем со здоровьем.
После того, как ее имплантаты были впервые одобрены FDA, Allergan потребовалось провести большое 10-летнее исследование с участием почти 60 000 участников с имплантатами, заполненными гелем и физиологическим раствором. Примерно девять лет спустя, в 2015 году, агентство утвердило переработанный протокол испытания, в результате которого целевой показатель набора снизился до 2775.
FDA заявило, что исследования продолжали показывать низкие показатели набора и последующего наблюдения и не собирали адекватных данных по безопасности через четыре года, включая частоту местных осложнений при имплантации. Агентство дало Allergan 15 дней на то, чтобы представить план исправления.
Агентство дало Allergan 15 дней на то, чтобы представить план исправления.
СВЯЗАННЫЙ: Генеральный директор AbbVie: Не волнуйтесь, клиенты эстетической косметики Allergan все еще имеют деньги и «сильное желание» на лечение
Письмо перекликается с аналогичными предупреждениями, выпущенными в прошлом году двумя другими производителями грудных имплантатов в середине исследования безопасности рака FDA — дочерней компании Sientra and Johnson & Johnson Mentor Worldwide — за неспособность привлечь тысячи женщин для ежегодных наблюдений в течение как минимум одного года. десятилетие.
«Агентство тщательно отслеживает исследования после утверждения в рамках наших постоянных усилий по оценке, пониманию и предоставлению общественности обновленной информации о безопасности и рисках грудных имплантатов», — сказала Бинита Ашар, директор Управления хирургического и инфекционного контроля FDA. Устройств. «Исследования после утверждения особенно важны для информирования нашего понимания о долгосрочных потенциальных рисках, связанных с имплантатами Allergan, включая модели, которые с тех пор были отозваны с рынка из-за повышенного риска анапластической крупноклеточной лимфомы, связанной с грудным имплантатом. ”
”
СВЯЗАННЫЙ: Allergan объявляет об отзыве по всему миру текстурированных грудных имплантатов по сравнению со случаями рака
«Низкий набор сотрудников производителя и низкие показатели последующего наблюдения за этими устройствами неприемлемы», — добавил Ашар. «FDA продолжит привлекать производителей к ответственности, если они не выполнят свои обязательства».
FDA также направило на этой неделе письмо с предупреждением компании Ideal Implant, производителю из Далласа, за неадекватные корректирующие действия после инспекции его предприятия в начале этого года и за несоблюдение производственных практик и требований к отчетности о побочных эффектах — еще один метод, агентство использует для отслеживания проблем с безопасностью имплантатов.
По данным агентства, Ideal не вела надлежащие файлы для обработки и ответа на жалобы, полученные от клиентов, связанные с ее имплантатами груди, заполненными физиологическим раствором, и не проводила надлежащих испытаний на соответствие готовой продукции спецификациям. Кроме того, компания не сразу сообщила о неисправностях имплантата, сообщило FDA.
Кроме того, компания не сразу сообщила о неисправностях имплантата, сообщило FDA.
По запросу FDA Allergan отзывает грудные имплантаты, связанные с редкой лимфомой
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникнет эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
В ответ на запрос FDA компания Allergan отозвала конкретные модели своих текстурированных грудных имплантатов из-за потенциального риска анапластической крупноклеточной лимфомы, связанной с грудным имплантатом.
Компания Allergan уведомила FDA о том, что она будет отозвать во всем мире свои текстурированные грудные имплантаты Biocell.К ним относятся грудные имплантаты Natrelle с солевым раствором, грудные имплантаты Natrelle с силиконовым наполнителем, грудные имплантаты Natrelle Inspira и высококогезивные грудные имплантаты анатомической формы с силиконовым наполнением Natrelle 410.
Анализ FDA показал, что риск возникновения анапластической крупноклеточной лимфомы, связанной с грудным имплантатом (BIA-ALCL), с текстурированными имплантатами Allergan Biocell примерно в шесть раз выше, чем риск с текстурированными имплантатами других производителей, продающих свою продукцию в США.
«Безопасность пациентов — приоритет компании Allergan. Пациентам рекомендуется поговорить со своим пластическим хирургом о рисках и преимуществах своего типа имплантата, если у них возникнут какие-либо проблемы », — говорится в заявлении компании, размещенном на ее веб-сайте.
Allergan отозвал конкретные модели текстурированных грудных имплантатов из-за потенциального риска редкого типа лимфомы.
Источник: Adobe Stock
Allergan также вспомнит расширители тканей, которые использовали пациенты перед реконструкцией или увеличением груди, в том числе расширитель тканей Natrelle 133 с шовными язычками и расширитель тканей Natrelle 133 Plus.
FDA выпустило сообщение о безопасности, адресованное пациентам и поставщикам медицинских услуг, чтобы объяснить установленные риски. В сообщении по безопасности также содержатся советы пациентам, которые следят за симптомами BIA-ALCL, включая боль в груди и отек.
«Хотя общая заболеваемость BIA-ALCL кажется относительно низкой, после того, как доказательства показали, что продукт конкретного производителя, по-видимому, напрямую связан со значительным ущербом пациенту, включая смерть, FDA приняло меры, чтобы предупредить фирму о новых доказательствах, указывающих на отзыв оправдан для защиты здоровья женщин », — заявила в опубликованном агентством пресс-релизе первый заместитель комиссара FDA Эми Абернети, доктор медицинских наук, .
FDA стало известно о потенциальной связи между грудными имплантатами и ALCL в 2011 году. С тех пор агентство отслеживало тенденции и сообщало пациентам и врачам о рисках для женщин с грудными имплантатами, особенно с текстурированными имплантатами.
Текстурированные имплантаты реже используются в Соединенных Штатах, чем в других странах, а макротекстурированные имплантаты — типа, производимого Allergan — составляют менее 5% всех грудных имплантатов, продаваемых в Соединенных Штатах.
FDA поощряет регистрацию всех случаев BIA-ALCL и отслеживает сообщения в научной литературе и базах данных, включая внешние реестры пациентов.
«Основываясь на новых данных, наша команда пришла к выводу, что в настоящее время необходимо принять меры для защиты здоровья населения», — сказал Абернети. «Мы продолжим отслеживать частоту BIA-ALCL среди других текстурированных и гладких грудных имплантатов и расширителей тканей, а также других устройств, предназначенных для использования в груди. Если в будущем потребуются действия, мы без колебаний сделаем все необходимое для защиты пациентов.”
Если в будущем потребуются действия, мы без колебаний сделаем все необходимое для защиты пациентов.”
ПЕРЕРЫВ
На сегодняшний день FDA сообщает о 573 уникальных случаях BIA-ALCL и 33 случаях смерти пациентов во всем мире. Это отражает увеличение на 116 новых случаев и 24 смертей по сравнению с предыдущим обновлением агентства в начале этого года.
Согласно пресс-релизу FDA, большинство (83%; n = 481) выявленных случаев BIA-ALCL были связаны с имплантатами Allergan.
Производитель имплантата, установленного на момент диагностики BIA-ALCL, был определен для 13 из 33 умерших пациентов.По данным FDA, в 12 из этих 13 случаев у пациентов был установлен грудной имплантат Allergan.
«Мы понимаем, что сегодняшние новости могут вызывать тревогу у некоторых пациентов с грудными имплантатами», — говорится в сообщении Джефф Шурен, доктор медицины, JD, , директор Центра устройств и радиологического здоровья FDA. «В опубликованном сегодня информационном сообщении по вопросам безопасности мы предоставляем действенную информацию для людей с определенными грудными имплантатами и их специалистов в области здравоохранения. FDA не рекомендует удаление для пациентов без симптомов из-за потенциальных рисков, но мы предоставляем полезную информацию для пациентов и поставщиков медицинских услуг, которую следует учитывать при обсуждении следующих шагов.”
FDA не рекомендует удаление для пациентов без симптомов из-за потенциальных рисков, но мы предоставляем полезную информацию для пациентов и поставщиков медицинских услуг, которую следует учитывать при обсуждении следующих шагов.”
FDA продолжит оценку того, ограничен ли риск BIA-ALCL определенными моделями текстурированных грудных имплантатов, сказал Шурен.
«Мы будем постоянно анализировать любую новую информацию и, как следствие, можем принимать меры в отношении других грудных имплантатов, если это будет оправдано», — сказал он.
Перспектива
Вернуться к началуДжошуа Броуди, Мэриленд
Отзыв об этих текстурированных имплантатах имеет большое значение для защиты женщин от потенциальных рисков развития и смерти от этого редкого типа агрессивной лимфомы.Несмотря на то, что сообщения о случаях предполагают потенциальную связь между некоторыми типами грудных имплантатов и этим заболеванием на протяжении более 20 лет, потребовалось время, чтобы получить достаточные доказательства, позволяющие предположить и понять причинную связь. Некоторые типы имплантатов вызывают воспаление, которое может как увеличить вероятность развития рака, так и помочь «скрыть» развивающийся рак от иммунной системы. Во многих случаях лимфомы, связанной с имплантатом, развиваются мутации и экспрессия иммуносупрессивных белков, которые не позволяют противоопухолевым иммунным клеткам избавляться от рака, и эти шансы, вероятно, начинаются с воспаления, вызванного некоторыми имплантатами.Предотвращая дальнейшее использование этих имплантатов, FDA помогает женщинам защитить себя от серьезных с медицинской точки зрения и эмоционально истощающих последствий этих рисков.
Некоторые типы имплантатов вызывают воспаление, которое может как увеличить вероятность развития рака, так и помочь «скрыть» развивающийся рак от иммунной системы. Во многих случаях лимфомы, связанной с имплантатом, развиваются мутации и экспрессия иммуносупрессивных белков, которые не позволяют противоопухолевым иммунным клеткам избавляться от рака, и эти шансы, вероятно, начинаются с воспаления, вызванного некоторыми имплантатами.Предотвращая дальнейшее использование этих имплантатов, FDA помогает женщинам защитить себя от серьезных с медицинской точки зрения и эмоционально истощающих последствий этих рисков.Джошуа Броуди, Мэриленд
HemOnc Today Новатор нового поколения
Институт рака Тиш на горе Синай
Раскрытие информации: Компания Brody не раскрывает значимую финансовую информацию.
Перспектива
Вернуться к началу Лесли Л. Попплуэлл, Мэриленд
Попплуэлл, Мэриленд
Отзыв о конкретных грудных имплантатах в статье является кульминацией наблюдений, сделанных примерно 15 лет назад, о том, что некоторые пациенты с грудными имплантатами заболевают очень редкой разновидностью лимфомы в очень редком месте. Пересечение этих двух маловероятных наблюдений вызвало подозрение, что эти имплантаты могут вызывать проблемы. Механизм развития рака, по-видимому, связан с текстурированной поверхностью этого имплантата, которая может привести к активации иммунной системы.Существует также теория, что инфекция может сыграть роль в развитии этой лимфомы.
Возможно, более уместно называть эти лимфомы «связанными с имплантатом», поскольку, как сообщили исследователи из Калифорнийского университета в Лос-Анджелесе ранее в этом году, была диагностирована по крайней мере еще одна лимфома рядом с ягодичным имплантатом.
Женщины, у которых установлены грудные имплантаты, должны поговорить со своими хирургами, чтобы подтвердить, что они знают, какой тип имплантата использовался. Они должны пройти соответствующее обследование, если у них появятся новые симптомы или проблемы, особенно если они заметят боль, отек или новую асимметрию груди.Женщинам, которым установили грудные имплантаты, не рекомендуется их удаление, если не возникнут проблемы. Когда грудные имплантаты удаляются из-за проблем, этим женщинам следует провести оценку любой жидкости, которая собралась в капсуле имплантата, а не только самого имплантата. Связанную капсулу следует отправить в лабораторию патологии с инструкциями по поиску доказательств поражения лимфомы.
Они должны пройти соответствующее обследование, если у них появятся новые симптомы или проблемы, особенно если они заметят боль, отек или новую асимметрию груди.Женщинам, которым установили грудные имплантаты, не рекомендуется их удаление, если не возникнут проблемы. Когда грудные имплантаты удаляются из-за проблем, этим женщинам следует провести оценку любой жидкости, которая собралась в капсуле имплантата, а не только самого имплантата. Связанную капсулу следует отправить в лабораторию патологии с инструкциями по поиску доказательств поражения лимфомы.
Эта лимфома обычно излечима путем удаления имплантата и окружающей ткани.Конечно, возможно, что некоторые случаи лимфомы остались недиагностированными, когда пациентам удаляли имплантаты в прошлом.
Артикул:
Шаулы О. и др. Aesthet Surg J . 2019; DOI: 10.1093 / asj / sjz044.
Лесли Л. Попплуэлл, Мэриленд
Город надежды
Раскрытие информации: Popplewell не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникнет эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Характеристики имплантата и информация о гарантии Доктор.Ревис рад предложить силиконовый гель Allergan Natrelle ™ и имплантаты груди с солевым раствором в качестве альтернативы своим пациентам, увеличивающим грудь. Доступные размеры имплантатов с соответствующими характеристиками формы, объема, размеров и выступа перечислены ниже вместе с информацией о гарантии на продукт. Доктор Ревис является предпочтительным хирургом Natrelle ™. Характеристики грудного имплантата Allergan с силикон-гелемГладкие круглые силиконовые гелевые грудные имплантаты Allergan Natrelle ™Natrelle ™ Style 40 — Умеренный профиль
Natrelle ™ Style 45 — полный / высокий профиль
Natrelle ™ Style 10 — Умеренный профиль
Natrelle ™ Style 15 — среднечастотный профиль
Natrelle ™ Style 20 — высокий профиль
Характеристики грудного имплантата Allergan с солевым растворомГладкие круглые имплантаты груди Allergan Natrelle ™ с физиологическим растворомNatrelle ™ Style 68LP — Низкопрофильный
Natrelle ™ Style 68MP — средний профиль
Natrelle ™ Style 68HP — высокий профиль
Гарантия на грудной имплантат Allergan Natrelle ™Пожизненная замена продуктаConfidencePlus® Гарантия
ConfidencePlus Premiere® Гарантия
|

 Наркоз ещё не отошёл , возможно завтра пожалею о своём откровении , но если мой пост убережёт хоть несколько девушек от установки имплантов , значит все не зря . 2. 15 лет назад в Санкт — Петербурге я поставила импланты в грудь фирмы МакГан . На сертификате было чёрным по белому написано — пожизненная гарантия , а доктор говорил — можно танком давить 3. Тогда не было никакой информации и мы ещё были подопытные кролики ? 4. Каждый год прохожу чек — ап . Отправили на Узи , потом на МРТ с констрастом . Вердикт ! Левый имплант порван , протекает лет 5-6 куда только можно было затечь :((( в срочном порядке операция по удалению имплантов с капсулой и иссечения силикона из тканей . Очень агрессивная операция , очень ?Девочки — этот пост для вас , у меня есть много информации . Вам решать , но вдруг кто то услышит . Подробнее напишу на днях и расскажу вам о « болезни грудных имплантов « Ну а меня я очень надеюсь вы примите и такую ?Будьте здоровы ?#explant
Наркоз ещё не отошёл , возможно завтра пожалею о своём откровении , но если мой пост убережёт хоть несколько девушек от установки имплантов , значит все не зря . 2. 15 лет назад в Санкт — Петербурге я поставила импланты в грудь фирмы МакГан . На сертификате было чёрным по белому написано — пожизненная гарантия , а доктор говорил — можно танком давить 3. Тогда не было никакой информации и мы ещё были подопытные кролики ? 4. Каждый год прохожу чек — ап . Отправили на Узи , потом на МРТ с констрастом . Вердикт ! Левый имплант порван , протекает лет 5-6 куда только можно было затечь :((( в срочном порядке операция по удалению имплантов с капсулой и иссечения силикона из тканей . Очень агрессивная операция , очень ?Девочки — этот пост для вас , у меня есть много информации . Вам решать , но вдруг кто то услышит . Подробнее напишу на днях и расскажу вам о « болезни грудных имплантов « Ну а меня я очень надеюсь вы примите и такую ?Будьте здоровы ?#explant Сегодня доступно множество захватывающих новых типов имплантатов, в том числе анатомические (в форме капли) и когезивный силиконовый гель (мармеладный мишка). Имплантаты имеют один из нескольких различных профилей, таких как низкий, средний, средний, средний плюс, высокий и сверхвысокий профиль. Внутри этих профилей имплантаты могут различаться по форме, ширине основания, высоте и выступу. Во время консультации д-р.Revis может помочь вам выбрать грудной имплант, соответствующий вашим потребностям.
Сегодня доступно множество захватывающих новых типов имплантатов, в том числе анатомические (в форме капли) и когезивный силиконовый гель (мармеладный мишка). Имплантаты имеют один из нескольких различных профилей, таких как низкий, средний, средний, средний плюс, высокий и сверхвысокий профиль. Внутри этих профилей имплантаты могут различаться по форме, ширине основания, высоте и выступу. Во время консультации д-р.Revis может помочь вам выбрать грудной имплант, соответствующий вашим потребностям. 8 см
8 см 9 см
9 см 8 см
8 см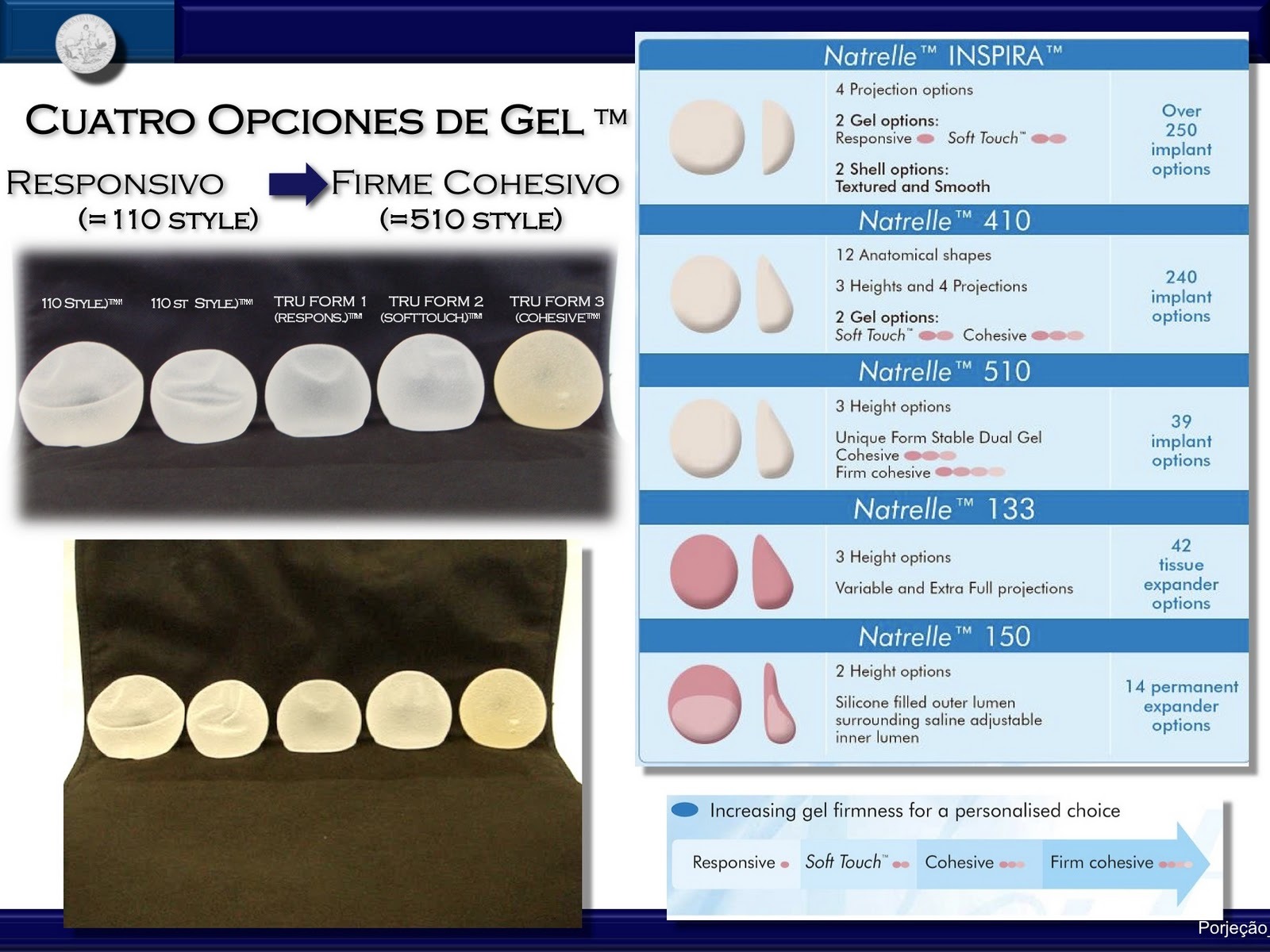 0см
0см 2 см
2 см 7см
7см 0 см
0 см 5 см
5 см 0 см
0 см 4 см
4 см 7см
7см 9 см
9 см 5 см
5 см см
см 2 см
2 см см
см 2 см
2 см См
См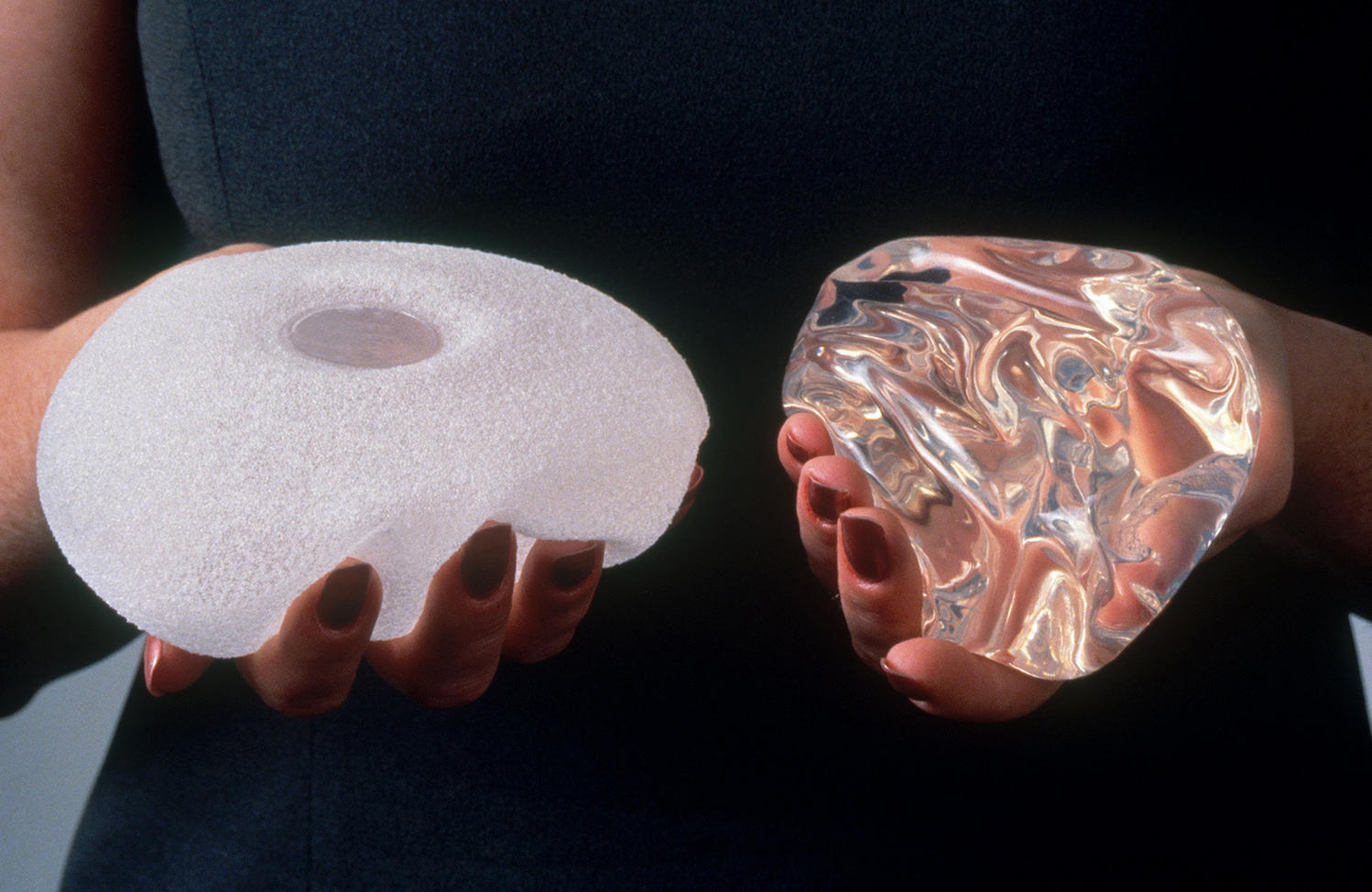 См
См