влияние ферментов на старение организма!
Одной из причин старения организма считается способность клеток делиться лишь конкретное количество раз. Каждый раз после этого ДНК человека укорачивается. При этом защиту генам обеспечивают теломеры. Они представляют собой концевые участки хромосом, которые с каждым делением уменьшаются.
Что такое теломеры
Теломеры обеспечивают защиту главного фрагмента ДНК от поражения при репликации. Когда они заканчиваются, клетки не способны делиться. Однако некоторые из них не сталкиваются с подобными проблемами. Это обусловлено наличием в их составе другого фермента – теломеразы. Он все время удлиняет теломеры. Такие особенности характерны для раковых и стволовых клеток.
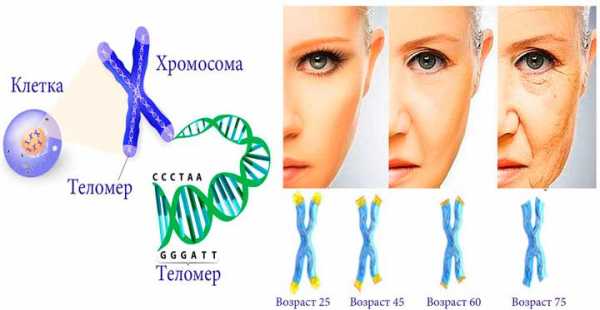
Теломеры находятся на 4 окончаниях хромосом и напоминают кончики шнурков. Эти элементы предотвращают склеивание хромосомных концов друг с другом. Также они помогают избежать слипания с остальными хромосомами. При нарушении этого процесса клетки погибают или трансформируются в опухоли. По мере деления клеток окончания теломеразы укорачиваются. Как следствие, клетки прекращают процесс деления. Эти изменения являются генетическими и эпигенетическими. Это значит, что они зависят от наследственной предрасположенности и воздействия внешних факторов.
Сохранение и регенерация теломеров зависит от активности теломеразы. Благодаря стимуляции синтеза фермента удается предотвратить истощение теломеров. Под ними находятся так называемые гены смерти. Они вызывают возникновение апоптоза. Этот процесс проявляется в виде гибели клеточных элементов. Данный процесс считается естественным и неотвратимым. Однако многочисленные научные исследования помогли установить, что у некоторых людей процесс укорачивания теломеров является слишком быстрым. Это становится причиной возникновения серьезных патологий и преждевременного старения.
Это означает, что существуют определенные отличия между физиологическим возрастом и реальной цифрой. Ткани бывают старше или моложе по сравнению с самим человеком. Чем сильнее укорачиваются теломеры, тем быстрее происходят процессы старения.
Методы защиты теломеров
Синтез фермента теломеразы, способного удлинять теломеры, тоже снижается по мере старения организма. Однако сегодня существуют медикаментозные средства, которые помогают скорректировать этот процесс. При этом они не имеют общедоступного характера и используются довольно редко.
Чтобы сохранить окончания теломеразы, необходима коррекция образа жизни. Согласно научным исследованиям, люди, которые часто медитируют, в меньшей степени подвергаются стрессовым факторам и воспалениям. У поклонников медитации концы хромосом обычно длиннее, чем у людей, которые не занимаются подобными практиками.

Стоит учитывать, что хронические воспаления провоцируют снижение активности теломеразы и ускоряют сокращение окончаний теломеров. Это обусловлено нарушением РН, поведением интерлейкинов и прочими процессами в организме.
Если человек хочет остановить старение и продлить долголетие, нужно приступать к лечению хронических воспалений в организме. Для этого необходимо своевременно устранять кариозное поражение зубов, простатит, воспаления в кишечнике, пародонтоз, гинекологические патологии.
Способы удлинения теломеров
Теломераза подвергается определенному воздействию. Активизация фермента достигается с помощью эстрогена. Количество данных гормонов увеличивается при беременности. Потому для многодетных женщин обычно характерна большая длина теломеров. Данная особенность является одним из обоснований большей продолжительности жизни у женщин.
Еще одним механизмом, которые способствует, удлинению теломеров, считается уменьшение калорийности рациона. Есть данные, что снижение количества потребляемых калорий лишь на 10 % от привычной нормы помогает увеличить продолжительность жизни на 5 лет. При этом переедание и существенное превышение веса снижает длину теломеров.
Эффективным методом удлинения теломеров считаются ежедневные прогулки. Их длительность должна составлять не меньше 40 минут. Еще одним действенным способом активизации синтеза теломеразы считается повышение уровня витамина D. Согласно многочисленным исследованиям, количество вещества на уровне 100 мг/л повышает длину теломеров на 19 %. Синтез теломеразы активизируют коэнзим Q10, ресфератрол. За этот процесс отвечают витамин С, омега-3 кислоты, а также другие антиоксиданты.
Нужно активизировать синтез теломеразы?
Есть мнение, что активизация продукции теломеразы может приводить к отрицательным последствиям. Это обусловлено тем, что данный фермент препятствует гибели опухолевых клеток. Но это не относится к коррекции образа жизни. Благодаря употреблению продуктов с омега-3 стимулируется синтез теломеразы в здоровых клетках. При этом выработка вещества в аномальных клетках наоборот замедляется.

Потому применение медикаментозных препаратов для активизации синтеза теломеразы осуществляется при наличии строгих показаний – к примеру, при развитии онкологических патологий. При этом коррекция образа жизни не может провоцировать отрицательные последствия. Потому врачи советуют употреблять полезные продукты, своевременно лечить воспаления и справляться с воздействием стрессовых факторов на организм.
Полезные продукты
Существуют продукты, которые стимулируют активность теломеразы. К ним относят следующее:
- лосось;
- авокадо;
- яйца;
- зеленый чай;
- мясо;
- бобовые;
- голубика;
- чеснок;
- грейпфрут.
Чтобы уменьшить выраженность воспалительных изменений в организме и улучшить питание клеток, нужно употреблять продукты, которые содержат много цинка. К ним относят говяжью печень и устрицы. Также стоит есть продукты из пшеницы. Для сокращения влияния стрессовых факторов полезно употреблять магний. Он присутствует в зеленых овощах, бобовых, растительных маслах. Также вещество включает шоколад и цельнозерновые каши.
В качестве антиоксидантов стоит использовать витамин Е. Элемент присутствует в авокадо, орехах, растительных маслах. Немаловажное значение имеют омега-3 жирные кислоты. Данные вещества входят в состав морепродуктов. Помимо этого, стимуляции синтеза теломеразы способствуют виноград и чай благодаря наличию полифенолов. Обязательно стоит добавлять в пищу куркуму, которая оказывает противовоспалительный эффект.

Очень полезно употреблять пищу с витамином А. Это вещество присутствует в тыкве, моркови, томатах. Также оно содержится в шпинате, болгарском перце. Немаловажное значение имеет и витамин D. Данное вещество содержится в печени трески, селедке, сардинах. Указанные элементы благоприятно влияют на нервную систему и структуру костных тканей.
Чтобы предотвратить преждевременное старение, необходимо употреблять аминокислоты. Особенно важно делать это по вечерам. Это обусловлено активным делением клеток в ночное время. Благодаря этим особенностям пептиды могут восстанавливать пораженные теломеры. 5 раз в неделю на ужин следует употреблять белковую пищу. Если человек занимается спортом, белок должен присутствовать в ежедневном рационе. При этом ужинать необходимо за 3 часа до сна. Количество пищи вечером не должно превышать 2/3 порции обеда.
Таким образом, активность теломеразы можно увеличивать. Улучшение функционирования фермента и увеличение длины теломер связано с умеренной физической нагрузкой. Также этому способствуют витамины и полиненасыщенные кислоты, которые присутствуют в здоровой пище.
Врачи уверяют, что длина теломеров у людей, которые привыкли вести здоровый образ жизни, намного больше. Этого нельзя сказать о тех, кто употребляет много алкогольных напитков, курит, не контролирует свой вес и ведет недостаточно активный образ жизни. Стремительное уменьшение длины теломеров наблюдается под воздействием стрессовых факторов и вирусных инфекций.
Использование активатора теломеразы
Со времени возникновения теломер-теломеразной теории старения начались поиски препарата, который способен стимулировать синтез теломеразы и замедлить возрастные изменения. В результате крупная биотехнологическая компания США Geron Inc сумела отыскать молекулу, которая стала базой первого активатора теломеразы, который называется ТА-65.
Особенности состава
Эта молекула была получена из корневища перепончатого астрагала. Это лекарственное растение с давних времен применяется в китайской медицине для профилактики раковых заболеваний. Состав данного средства включает больше 2000 молекул. При этом только одна может активизировать теломеразу. Ее назвали ТА-65.
Процесс получения и очищения этой молекулы является достаточно трудоемким и многоступенчатым. Вещество не только нужно отличить от остальных, но и максимально качественно очистить его от примесей. Молекула и метод ее получения была запатентованы. Чтобы получить минимальный объем ТА-65, нужно переработать примерно 5-6 т сырья. Потому доза активного компонента, которая находится в одной капсуле, может приравниваться к нескольким литрам экстракта.
Для достижения стойких результатов требуется применять средство минимум 3 месяца. Потому заменить препарат употреблением нескольких литров обыкновенного экстракта не удастся.
Механизм действия
При проникновении в системный кровоток молекула попадает в клетку и активизирует функции гена, который отвечает за временную активизацию теломеразы. Благодаря этому фермент начинает формировать конечные зоны хромосом. Это достигается за счет добавления оснований нуклеотидов. За счет наращивания теломеров клетка получает новую возможность к делению и функционированию. Таким образом продолжается ее жизнь. Можно сказать, что клетки из стареющих трансформируются в молодые и активные. Данный процесс влияет на работу всего организма.
Когда человек прекращает употреблять ТА-65, фермент теломераза снова снижает свою активность. Это значит, что стимулирование элемента носит временный и контролируемый характер. Предельный объем активного компонента в крови достигается спустя 3 часа после применения вещества. Исследования препарата проводились на клетках, животных и людях. Первая категория экспериментов помогла доказать, что добавление ТА-65 к структуре клеток продлевает их жизненный цикл и позволяет справиться с лимитом Хейфлика.
Первое свидетельство об обратимости возрастных процессов у млекопитающих под влиянием ТА-65 было представлено в 2011 году. Публикация появилась в журнале The Nature. Мыши, на которых проводились опыты, имели короткие теломеры. Для них была характерна минимальная активность теломеразы. Грызуны имели поражения ДНК, серьезные поражения мозга и дегенеративные процессы в органах. В результате у них присутствовали нарушения репродуктивных функций, преждевременное старение. Длительность жизни животных не превышала 43 недель.
В 30-35 недель ученые каждый день вводили грызунам активатор теломеразы. Такая терапия проводилась в течение 1 месяца. Как следствие, продолжительность жизни увеличивалась примерно до 80 недель. Применение средства способствовало удлинению теломеров, восстановлению активность теломеразы и уменьшению поражения ДНК в хромосомах. Также активатор ТА-65 обеспечивал уменьшение дегенеративных поражений органов. При этом страдала селезенка, мозг, кишечник, яички.

Благодаря применению вещества восстанавливались репродуктивные возможности грызунов. Это помогло добиться заметного омоложения мышей. При этом ни одно из животных не столкнулось с развитием злокачественных опухолей. Таким образом, ТА-65 можно назвать первым активатором теломеразы, который имеет подтвержденную эффективность и безопасность. Благодаря применению вещества удается добиться омоложения клеток за счет стимуляции теломеразы.
Удлинение теломеров позволяет увеличить длительность здоровой жизни. Применение вещества на долгие годы обеспечивает человека жизненной энергией. Благодаря этому удается изнутри остановить процессы старения и оставаться активным в любом возрасте.
Преимущества препарата
Активатор ТА-65 представляет собой натуральное средство, результативность которого подтверждена многочисленными исследованиями. Благодаря его применению удается стимулировать активность теломеразы и запустить восстановление коротких теломеров в организме. Это помогает существенно замедлить процессы старения.
Вследствие омоложения клеток на фоне применения ТА-65 удается получить такие эффекты:
- уменьшить вероятность возрастных заболеваний;
- сократить риск развития онкологии;
- увеличить эластичность кожи;
- улучшить функционирование иммунной системы;
- поддерживать в норме когнитивные функции;
- нормализовать состояние волос и ногтей;
- сохранить в норме сексуальную энергию;
- улучшить остроту зрения;
- повысить плотность костных структур.
Теломеры и теломераза – важные элементы, от которых напрямую зависят возрастные изменения в организме. Чтобы остановить процессы старения, можно применять активатор ТА-65, который имеет немало преимуществ.
superkosmetolog.ru
что это? Состав, плюсы препарата, прием
 ТА-65 другими словами активатор теломеразы является главным веществом продукта FINITI от фирмы Jeunesse Global. Фактически, данный препарат представляет собой так называемый чистый активатор теломеразы ТА-65, дополненный полезными веществами, которые углубляют и усиливают действие препарата. Однако самым основным компонентов является ТА-65, который способен содержаться абсолютно в каждой капсуле в количестве 212,5 грамм.
ТА-65 другими словами активатор теломеразы является главным веществом продукта FINITI от фирмы Jeunesse Global. Фактически, данный препарат представляет собой так называемый чистый активатор теломеразы ТА-65, дополненный полезными веществами, которые углубляют и усиливают действие препарата. Однако самым основным компонентов является ТА-65, который способен содержаться абсолютно в каждой капсуле в количестве 212,5 грамм.
Что такое ТА-65
Очень интересно, что благодаря высокому содержанию препарата FINITI по сути считается очень дешевым препаратом ТА-65 на рынке.
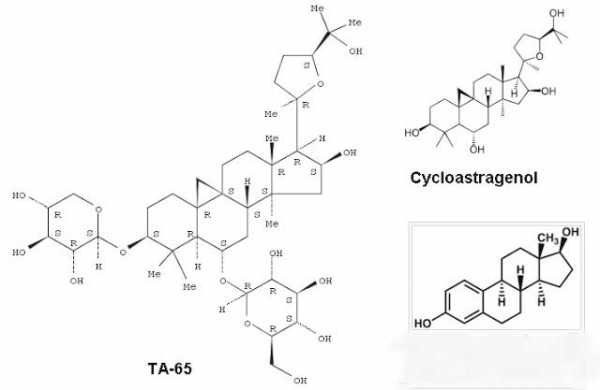 ТА-65 – компонент, который состоит из молекул циклоастрогенола, которых около девяноста восьми процентов. Циклоастрогенол извлекают из корня Астрагала перепончатого при помощи весьма тяжелой многостадийной экстракции.
ТА-65 – компонент, который состоит из молекул циклоастрогенола, которых около девяноста восьми процентов. Циклоастрогенол извлекают из корня Астрагала перепончатого при помощи весьма тяжелой многостадийной экстракции.
Корень этого растения содержит более 2000 компонентов и соединений и циклоастрогенол, однако всего лишь один. Именно поэтому эффект от экстракта Астрагала не идет в сравнение к ТА-65.
 Для производства всего одной капсулы нужно колоссальное число корней.
Для производства всего одной капсулы нужно колоссальное число корней.
ТА-65 запускает выработку человеческим организмом особенного фермента, а именно теломеразы. Человеческий организм сам производит данный фермент, однако снабжает он лишь стволовые и половые клетки.

Иные же клетки организма теломеразу не получают.
Теломераза делает клетки можно сказать вечными. ТА-65 способен заставить организм человека снабжать теломеразой абсолютно все клетки.
Пока человек потребляет активатор теломеразы, его клетки не знают, что такое старение.
Теломеры и теломераза – основа
Они проявляются путем деления старых клеток.
В процессе деления клеток также делятся и хромосомы, то есть из одной получаются две, по одной на каждую новую клетку.
Однако новые клетки значительно отличаются от основных, они короче.
При всем этом также короче становятся концы хромосом, наименованные теломерами. Теломеры очень похожи на колпаки на концах хромосом.
При каждом новом делении клеток, теломеры становятся короче и короче. Когда эти теломеры станут очень короткими, клетка перестает делиться.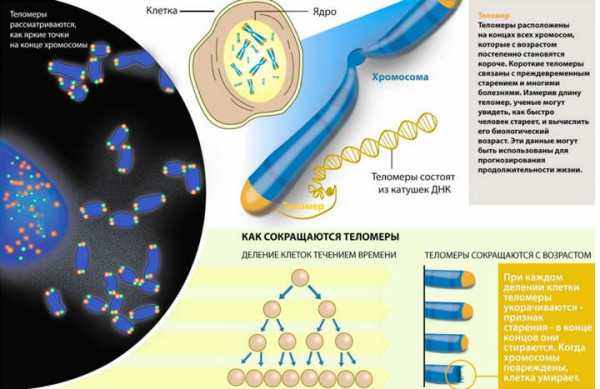
Эта клетка может остаться жить, конечно, уже бесполезной и старой (апоптоз), а также может быть уничтожена самим человеческим организмом. Однако есть еще куда хуже путь, эта клетка способна стать раковой.
В основном клетка делится примерно пятьдесят два раза, однако присутствуют исключения.
Также в организме присутствуют и «бессмертные» клетки, это половые и стволовые. Стволовыми считаются заготовками, которые способны превратиться в любую из других клеток: кровяную, иммунную, нервную и так далее, а половые нам необходимы для размножения.
Эти бессмертные клетки могут делиться безграничное количество раз.
Теломераза
Теломеразой называют фермент, который способен обработать стволовые и половые клетки организма. Теломераза удлиняет концы хромосом (теломеры).
Как итог, эти клетки способны делиться бесконечно.
Однако оказалось, что за производство теломеразы отвечает особый ген, а именно ген каталитического вещества теломеразы (hTERT).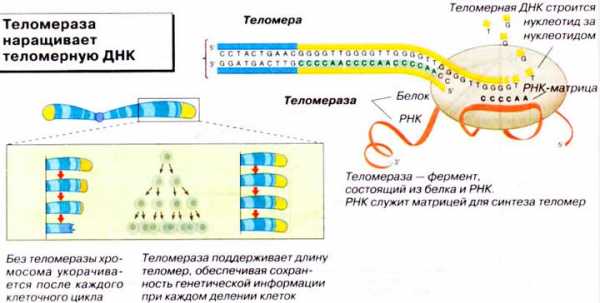
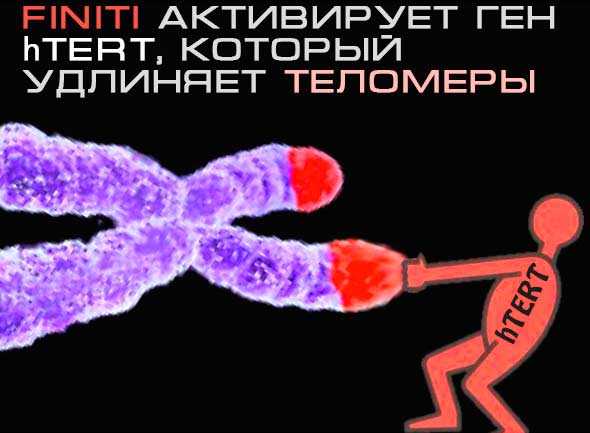
Возможность активировать hTERT есть, при помощи вышеупомянутого растения Астрагала перепончатого, а если точнее его циклоастрогенол.
Американская компания Geron научилась вынимать циклоастрогенол из корня астрагала и назвали его ТА-65, то есть активатор термоплазмы.
 Короткие теломеры считаются признаком очень старого организма, а как вы знаете, там где старость, там и заболевания.
Короткие теломеры считаются признаком очень старого организма, а как вы знаете, там где старость, там и заболевания.
Однако не только физическое здоровье зависит от теломер, но также и психическое здоровье и интеллект.
Лучше всего приобрести в виде капсул FINITI, помимо основного компонента там есть и большое количество других полезных веществ. А также это будет намного дешевле, и как ни странно, эффективнее.
Что лучше FINITI или ТА-65 (чистый)
Советуем вам лучше всего выбирать FINITI, потому как:
Во-первых — цена на FINITI намного ниже, чем ТА-65, притом, что основного компонента (циклоастрогенола) в них одинаково.
 Во-вторых — FINITI содержит дополнительные полезные компоненты, которые также способны оказать воздействие на длину теломеров, к примеру, L-карнозин и омега 3-кислоты.
Во-вторых — FINITI содержит дополнительные полезные компоненты, которые также способны оказать воздействие на длину теломеров, к примеру, L-карнозин и омега 3-кислоты.
В третьих — в составе FINITI находятся огромное количество антиоксидантов, которые работают с разными типами окислителей:
 фукоидан;
фукоидан;- граната;
- коэнзим Q-10;
- птеростильбен;
- ацетилцистеин;
- витамин Е;
- кверцитин;
- экстракт портулака;
- водоросль.

Все это способно бороться с большим количеством специфических возрастных изменений, в особенности с раковой активностью.
В четвертых — FINITI способен бороться со старением клеток комплексно, и это делает его особым и мощным препаратом.
Доза и прием препарата
В основном, рекомендуемая дозировка данного препарата зависит исключительно от возраста:
 Если пациенту до пятидесяти лет, то ему следует принимать по одной капсуле в день;
Если пациенту до пятидесяти лет, то ему следует принимать по одной капсуле в день;- Если возрастная категория от пятидесяти до шестидесяти, то по две капсулы в сутки;
- А если от шестидесяти и выше, то по четыре капсулы в сутки.
Содержание активатора теломеразы 65 в FINITI от компании Jeunesse намного больше, нежели в чистом ТА-65md от компании ТА Sciendes, примерно на семь процентов.
Применять препарат лучше всего за один час до приема пищи или же через два часа после приема еды. Капсулы запиваются водой.
iplastica.ru
в 2009 году отмечены работы по теломерам и теломеразе
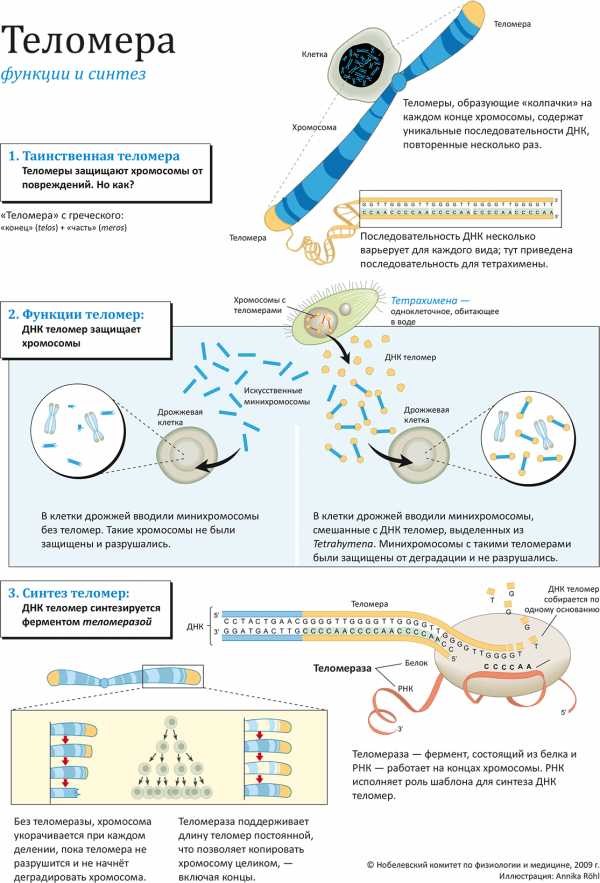
В 2009 году Нобелевская премия по физиологии и медицине вручена трём американским учёным, разрешившим важную биологическую проблему: как хромосомы при делении клетки копируются полностью, без того, чтобы ДНК на их кончиках укорачивалась? В результате их исследований стало известно, что «защитным колпачком» для хромосом служат особым образом устроенные окончания ДНК — теломеры, достройкой которых занимается специальный фермент — теломераза.
Длинная нитеобразная молекула ДНК — главный компонент хромосом, несущий генетическую информацию, — с обоих концов закрыта своего рода «заглушками» — теломерами. Теломеры представляют собой участки ДНК с уникальной последовательностью и защищают хромосомы от деградации. Это открытие принадлежит двум лауреатам Нобелевской премии по физиологии и медицине за 2009 г. — Элизабет Блэкберн (Elizabeth Blackburn), уроженке США и в настоящее время сотруднице Университета Калифорнии (Сан-Франциско, США), и Джеку Шостаку (Jack Szostak), профессору Института Ховарда Хьюза. Элизабет Блэкберн в сотрудничестве с третьим лауреатом премии этого года — Кэрол Грейдер (Carol Greider), сотрудницей Университета Джона Хопкинса, — открыла в 1984 году фермент теломеразу, синтезирующий ДНК теломер (и тем самым достраивая их после неизбежного при каждом копировании хромосомы укорачивания). Таким образом, исследования, отмеченные премией в этом году (около 975 тысяч евро, поделенные поровну между лауреатами), объясняют, как теломеры защищают кончики хромосом, и как теломераза синтезирует теломеры.
Давно отмечено, что старение клетки сопровождается укорачиванием теломер. И, наоборот, в клетках с высокой активностью теломеразы, достраивающей теломеры, длина последних остается неизменной, и старение не наступает. Это, кстати, относится и к «вечно молодым» раковым клеткам, в которых механизм естественного ограничения роста не действует. (А для некоторых наследственных заболеваний характерна дефектная теломераза, что приводит к преждевременному клеточному старению.) Присуждение за работы в этой области Нобелевской премии является признанием фундаментального значения этих механизмов в живой клетке и огромного прикладного потенциала, заложенного в отмеченных работах.
Таинственная теломера
В хромосомах содержится наш геном, а «физическим» носителем генетической информации являются молекулы ДНК. Ещё в 1930 году Герман Мёллер (лауреат Нобелевской премии по физиологии и медицине 1946 года «за открытие появления мутаций под влиянием рентгеновского облучения») и Барбара Мак-Клинток (лауреат Нобелевской премии в той же категории 1983 года «за открытие транспозирующих генетических систем») обнаружили, что структуры на концах хромосом — так называемые теломеры — предотвращали слипание хромосом между собой. Было высказано предположение, что теломеры выполняют защитную функцию, но механизм этого явления оставался совершенно неизвестным.
Позже, в 1950-х, когда уже было в общих чертах понятно, как копируются гены, возникла другая проблема. При делении клетки основание за основанием дублируется и вся клеточная ДНК, — при помощи ферментов ДНК-полимераз. Однако для одной из комплементарных цепей возникает проблема: самый конец молекулы не может быть скопирован (дело тут в «посадочном» сайте ДНК-полимеразы). Вследствие этого, хромосома должна укорачиваться при каждом делении клетки, — хотя на самом деле этого не происходит (на рисунке: 1).
И та, и другая проблема были со временем решены, за что в этом году и вручают премию.
ДНК теломер защищает хромосомы
Ещё в начале своей научной карьеры Элизабет Блэкберн занималась картированием последовательностей ДНК на примере одноклеточного жгутикового организма тетрахимены (Tetrahymena). На концах хромосомы она обнаружила повторяющиеся последовательности ДНК вида CCCCAA, функция которых была на тот момент совершенно неизвестна. В то же время Джек Шостак обнаружил, что линейные молекулы ДНК (что-то вроде минихромосомы), введённые в клетку дрожжей, очень быстро деградируют.
Исследователи встретились на конференции в 1980 г., где Блэкберн докладывала свои результаты, заинтересовавшие Шостака. Они решили провести совместный эксперимент, в основе которого было «растворение барьеров» между двумя эволюционно весьма далёкими видами (на рисунке: 2). Блэкберн выделила из ДНК тетрахимены последовательности CCCCAA, а Шостак присоединил их к минихромосомам, помещённым затем в клетки дрожжей. Результат, опубликованный в 1982 году, превзошёл ожидания: теломерные последовательности действительно защищали ДНК от деградации! Это явление наглядно продемонстрировало существование неизвестного ранее клеточного механизма, регулирующего процессы старения в живой клетке. Позже подтвердилось наличие теломер в подавляющем большинстве растений и животных — от амёбы до человека.
Фермент, синтезирующий теломеры
В 1980-х аспирантка Кэрол Грейдер работала под началом Элизабет Блэкберн; они начали изучение синтеза теломер, за который должен был отвечать неизвестный на ту пору фермент. В канун рождества 1984 года Грейдер зарегистрировала искомую активность в клеточном экстракте. Грейдер и Блэкберн выделили и очистили фермент, получивший название теломераза, и показали, что в его состав входит не только белок, но и РНК (на рисунке: 3). Молекула РНК содержит «ту самую» последовательность CCCCAA, используемую в качестве «шаблона» для достройки теломер, в то время как ферментативная активность (типа обратной транскриптазы) принадлежит белковой части фермента. Теломераза «наращивает» ДНК теломеры, обеспечивая «посадочное место» для ДНК-полимеразы, достаточное для копирования хромосомы без «краевых эффектов» (то есть, без потерь генетической информации).
Теломераза отсрочивает старение клетки
Учёные начали активно заниматься исследованием роли теломер в клетке. Лаборатория Шостака установила, что дрожжевая культура с мутацией, приводящей к постепенному укорачиванию теломер, развивается очень медленно и, в конце концов, вообще прекращает рост. Сотрудники Блэкберн показали, что в тетрахимене с мутацией в РНК теломеразы наблюдается в точности такой же эффект, который можно охарактеризовать фразой «преждевременное старение». (По сравнению с этими примерами, «нормальная» теломераза предотвращает укорачивание теломер и задерживает наступление старости.) Позже в группе Грейдер открыли, что те же механизмы работают и в клетках человека. Многочисленные работы в этой области помогли установить, что теломера координирует вокруг своей ДНК белковые частицы, образующие защитный «колпачок» для кончиков молекулы ДНК.
Части головоломки: старение, рак и стволовые клетки
Описанные открытия имели самый сильный резонанс в научном сообществе. Многие учёные заявляли, что укорачивание теломер является универсальным механизмом не только клеточного старения, но и старости всего организма в целом. Однако со временем стало понятно, что теломерная теория не является пресловутым «молодильным яблоком», поскольку процесс старения на самом деле чрезвычайно сложен и многосторонен, и не сводится исключительно к «подрезанию» теломер. Интенсивные исследования в этой области продолжаются и сегодня.
Большинство клеток делится не так уж часто, так что их хромосомы не находятся в зоне риска чрезмерного укорачивания и, в общем-то, не требуют высокой теломеразной активности. Другое дело — раковые клетки: они обладают способностью делиться бесконтрольно и бесконечно, как бы не зная о бедах с укорачиванием теломер. Оказалось, что в опухолевых клетках очень высокая активность теломеразы, что и защищает их от подобного укорачивания и придаёт потенциал к неограниченному делению и росту. В настоящее время существует подход к лечению рака, использующий концепцию подавления теломеразной активности в раковых клетках, что привело бы к естественному исчезновению точек бесконтрольного деления. Некоторые средства с антителомеразным действием уже проходят клинические испытания.
Ряд наследственных заболеваний характеризуется сниженной теломеразной активностью, — например, апластическая анемия, при которой из-за низкого темпа деления стволовых клеток в костном мозге развивается анемия. К этой же группе относится ряд заболеваний кожи и лёгких.
Открытия, сделанные Блэкберн, Грейдер и Шостаком, открыли новое измерение в понимании клеточных механизмов, и, несомненно, имеют огромное практическое применение — хотя бы в лечении перечисленных заболеваний, а может быть (когда-нибудь) — и в обретении если не вечной, то хотя бы более длительной жизни.
По материалам пресс-релиза Нобелевского комитета.
biomolecula.ru
Ученые в деталях разглядели фермент клеточного бессмертия — теломеразу

Thi Hoang Duong Nguyen et al / Nature 2018
Ученые с помощью криоэлектронной микроскопии получили самую детальную на сегодняшний день структуру теломеразы человека — фермента, который обеспечивает бессмертие клеток, в том числе, опухолевых. Статья с описанием тонкостей строения фермента в комплексе с его субстратом — ДНК, опубликована в Nature.
Механизм репликации ДНК требует для начала синтеза новой цепи наличия короткой «затравки», которая потом уничтожается. Это приводит к тому, что на самом конце молекулы ДНК остаются недореплицированными короткие кусочки, то есть концы хромосом с каждым раундом репликации укорачиваются. Сохранить важные части хромосомы от концевой недорепликации помогают теломеры — области на концах хромосом, состоящие из повторяющихся последовательностей, которые по сути представляют собой «запасную» ДНК. Длина теломер ограничивает число клеточных делений определенным значением (это значение называют пределом Хейфлика). В «бессмертных» клеточных линиях, к которым относятся стволовые и раковые клетки, длина теломер поддерживается на постоянном уровне ферментом теломеразой.
Благодаря участию в процессах канцерогенеза теломераза представляет интерес для ученых в качестве мишени для терапии рака — вещества, подавляющие ее активность, могут останавливать рост опухоли. Однако для рациональной разработки эффективных ингибиторов фермента необходимо в деталях представлять его структуру. Общий план строения теломеразы довольно хорошо изучен — ее основным компонентом является субъединица с функцией обратной транскриптазы (TERT), которая синтезирует теломерную ДНК на РНК-матрице, роль которой выполняет РНК-часть теломеразы (TR).
Несмотря на принципиально схожую схему работы фермента, у разных организмов теломераза может включать дополнительные субъединицы, а TERT может состоять из разных доменов. До сих пор самая лучшая структура с разрешением в девять ангстрем была получена для теломеразы инфузории тетрахимены, а для человеческого фермента, который представляет основной интерес для медиков, достаточно качественных данных о структуре не было. Исследователи из университета Калифорнии в Беркли под руководством Кэтлин Коллинз (Kathleen Collins) при помощи криоэлектронной микроскопии получили изображения человеческой теломеразы, связанной с субстратом, в субнанометровом разрешении.
Необработанные изображения частиц теломеразы
Thi Hoang Duong Nguyen et al / Nature 2018
Для того, чтобы получить частицы для микроскопии, ученые сверхэкспрессировали гены, кодирующие TERT и TR в клетках человека, а затем очистили комплекс белка и РНК таким образом, чтобы сохранить вспомогательные субъединицы. После этого активность комплекса проверили in vitro и in vivo. Для детального изучения взаимодействия фермента с ДНК к препарату добавили субстрат — олигонуклеотид, содержащий структурную единицу последовательности теломерной ДНК.Оказалось, что частицы из активной фракции состоят из двух ассиметричных долей, соединенных гибкой перемычкой. Полученные изображения замороженных частиц помогли выяснить точное расположение молекулы РНК внутри комплекса. Кроме того, ученым удалось уточнить детали взаимодействия основных компонентов теломеразы с вспомогательными белками семейства H/ACA, которые вносят модификации в РНК и участвуют также в биогенезе рибосом. Мутации в генах этих белков приводят к развитию ряда наследственных синдромов у человека. Выяснилось, что одна из долей активного фермента представляет из себя TERT-субъединицу, связанную с РНК и ДНК, а вторая часть молекулы РНК связывает вспомогательные белки. Для каталитической и вспомогательной долей фермента были получены структуры с разрешением 7,7 и 8,2 ангстрем соответственно.
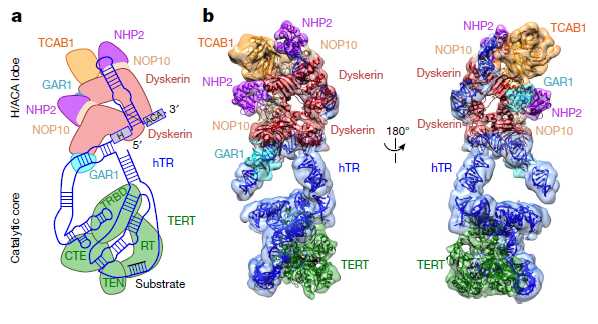
Детальная структура теломеразы с указанием каталитического и «вспомогательного» доменов
Thi Hoang Duong Nguyen et al / Nature 2018
Подробнее про принцип работы криоэлектронной микроскопии — метода, при помощи которого удалось получить ряд важных для биологии и медицины данных, например, о строении амилоидной фибриллы, и за разработку которого в 2017 году была присуждена Нобелевская премия по химии, можно прочитать в нашем материале «Тени во льду». Дарья Спасскаяnplus1.ru
Теломерол » Теломерол – первый российский клинический опыт применения
В настоящее время сформировались новые глобальные медико-социальные и демографические тенденции, связанные с существенным увеличением средней продолжительности жизни современного человека. В этих условиях перед современной медициной также поставлены новые задачи, которые заключаются в обеспечении не столько дальнейшего увеличения продолжительности жизни, сколько в обеспечении продолжительности максимально качественной жизни (качественного доживания) путем ранней профилактики возраст-ассоциированных заболеваний. Вся современная антивозрастная медицина опирается на достижения фундаментальной науки, которая позволила к настоящему времени сформулировать многочисленные теории клеточного старения. Одной из наиболее молодых теорий биологического старения является теломеразная теория, основанная на революционных открытиях фундаментальной науки последних десятилетий. В статье рассматриваются механизмы клеточного старения, связанные с деятельностью теломер хромосом и их ключевого регуляторного фермента – теломеразы. Представлены краткие современные данные о первой синтетической субстанции с теломеразной активностью – циклоастрогеноле и приведены данные о составе и механизмах действия новой комбинированной субстанции с теломеразной активностью – комплексе циклоастрогенола и регуляторных пептидов эпифиза и вилочковой железы (тимуса), которая под торговым лейблом «Теломерол» появилась в 2017 году на российском фармацевтическом рынке. Клинический опыт применения Теломерола в отечественной медицине пока весьма скромный, но он начинает накапливаться, что и послужило основой для предварительного анализа и обсуждения первого клинического российского опыта применения Теломерола в рамках настоящей статьи.
С биологической точки зрения старение — это процесс постепенного нарушения и потери важных функций организма или его частей, в частности способности к размножению и регенерации. Старение человека – это старение его внутренних органов, старение органов в свою очередь – это старение их клеток, а старение клеток – это старение их информационно-наследственной системы в виде молекулы ДНК, которая содержится в ядрах человеческих клеток.
По своей сути смерть человека от старения – это ухудшение до критического уровня всех биохимических механизмов жизнедеятельности миллиарда клеток по причине структурной деградации молекул ДНК.
Старение человека – это более многогранный, сложный и генетически обусловленный процесс. Предотвратить его нельзя, а вот затормозить – полностью реально. Человек становится старым и очень старым только в том случае, если сам себе это позволяет: можно быть старым и в 30–40 лет, а в 90–100 лет – только пожилым. Почему и как мы стареем? Ответы на эти вопросы человечество искало с момента своего зарождения. На сегодняшний день предложено множество теорий старения, выявляются различные патологические процессы, со временем развивающиеся в организме, и активно разрабатываются методы их торможения.
Наиболее популярные современные ТЕОРИИ СТАРЕНИЯ сводятся к следующим:
- Теория запрограммированности смерти (старение закодировано в генах, а смерть – своего рода запрограммированное самоубийство).
- Теломеразная теория. На конце каждой хромосомы имеется несколько тысяч копий определенных последовательностей ДНК, содержащих по 6 пар оснований и образующих вместе так называемую теломеру. При каждом делении соматической клетки хромосомы теряют около 200 пар оснований. Поэтому продолжительность жизни организма ограничена длиной теломеры.
- Мутационная теория объясняет старение накоплением в течение жизни спонтанных мутаций клеток, что ведет к их гибели.
- Теория накопления вредных продуктов метаболизма (липофусцин, свободные радикалы) – смерть организма происходит из-за токсического повреждения клеток данными веществами.
- Аутоиммунная теория – с возрастом накапливаются аутоиммунные антитела к клеткам организма, что ведет к их гибели.
- Теория физиологических сдвигов в эндокринных органах (дизгормональная теория) – с возрастом в эндокринной системе происходят необратимые потери структуры и функции клеток, связанные с дефицитом гормонов, среди которых ключевую роль играет дефицит половых гормонов.
Многообразие существующих теорий биологического старения позволяет сделать однозначный вывод о том, что все известные механизмы клеточного и системного старения тесно связаны между собой и, очевидно, какого-то одного ключевого механизма старения все-таки не существует. Тем не менее, в настоящее время хорошо известны универсальные механизмы клеточного старения (возрастной гормональный дисбаланс, окислительный стресс, митохондриальная дисфункция, укорочение длины теломер хромосом, нестабильность генетического материала клетки, ускорение клеточного апоптоза на фоне современных негативных эпигенетических влияний – вот, очевидно, основные звенья возрастной биологии, своеобразного «смертельного цикла», в рамках которого синергическое взаимодействие и взаимное отягощение указанных факторов приводит к старению и последующей смерти клетки и организма на любом из этих этапов (Рис. 1.)
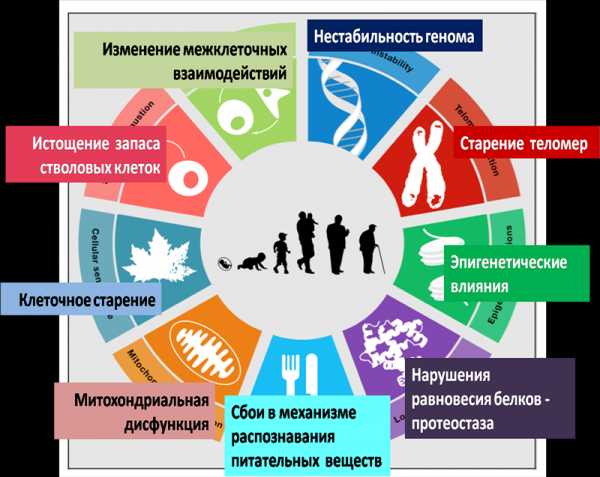
Рис. 1. Ключевые факторы биологического старения
Теломеразная теория старения. На сегодняшний день наибольший резонанс в научном сообществе имеет генетическая теория теломер (теломеразная теория старения). В 1961 году американский геронтолог Л. Хейфлик путем несложных опытов определил, что фибробласты кожи могут делиться вне организма около 50 раз. Хейфлик попробовал заморозить фибробласты после 20 делений, а потом через год разморозил. И они делились в среднем еще 30 раз, то есть до своего предела. Это максимальное количество делений для определенной клетки было названо «пределом Хейфлика». Конечно, различные клетки имеют свои «пределы Хейфлика» и конечное количество делений. Некоторые клетки нашего организма, например стволовые, половые клетки, а также раковые клетки могут делиться неограниченное количество раз. Однако, долгое время оставалось неясным, почему ДНК в составе хромосом стабильна, а обломки без концевых последовательностей подвержены перестройкам. Исследования Пауля Германа Мюллера (лауреат Нобелевской премии по физиологии и медицине 1946 года) и Барбары Мак-Клинток (лауреат Нобелевской премии по физиологии и медицине 1983 года) в начале 1940-х годов показали, что концевые участки защищают хромосомы от перестроек и разрывов. Мюллер назвал эти особые участки теломерами — от двух греческих слов: telos — конец и meros — участок. Но что представляют собой эти участки и какую функцию они выполняют в клетке, учёные тогда ещё не знали.
В 1975 году Элизабет Блэкбёрн в лаборатории Джозефа Гала в Йельском университете, изучая внехромосомные молекулы ДНК инфузории, обнаружила, что концевые участки этих молекул содержат тандемные повторяющиеся последовательности, состоящие из шести нуклеотидов: на каждом конце таких повторов было от 20 до 70. В дальнейших экспериментах Блэкбёрн и Шостак добавили в дрожжи молекулы ДНК с присоединёнными к ним повторами из инфузории и обнаружили, что молекулы ДНК стали стабильнее. В 1982 году в совместной публикации они предположили, что эти повторяющиеся последовательности нуклеотидов и есть теломеры. Их догадка подтвердилась. Теперь уже точно известно, что теломеры состоят из повторяющихся нуклеотидных участков и набора специальных белков, особым образом организующих эти участки в пространстве. Теломерные повторы — весьма консервативные последовательности, например, повторы всех позвоночных состоят из шести нуклеотидов — TTAGGG, повторы всех насекомых из пяти — TTAGG, повторы большинства растений из семи — TTTAGGG.
Благодаря наличию в теломерах устойчивых повторов клеточная система репарации не путает теломерный участок со случайным разрывом. Таким путём обеспечивается стабильность хромосом: конец одной хромосомы не может соединиться с разрывом другой. Теломеры — повторяющиеся последовательности нуклеотидов TTAGGG, расположенные на концах хромосом, которые не несут генетической информации. Каждая клетка нашего организма содержит 92 теломеры, которые играют важную роль в процессе деления клетки — обеспечивают стабильность генома, защищают хромосомы в процессе репликации от деградации и слияния, обеспечивают структурную целостность окончаний хромосом и защищают клетки от мутаций, старения и смерти.
Длина теломерной ДНК человека составляет около 15 000 пар оснований (базовых пар, ВР). При каждом делении клетки теломеры становятся на 200-300 ВР короче. При достижении границы 3 000 – 5 000 BP длина теломер становится критически короткой — клетки уже не могут больше делиться. Они стареют, либо умирают. С возрастом длина теломер соматических клеток человека уменьшается (Рис.2.).
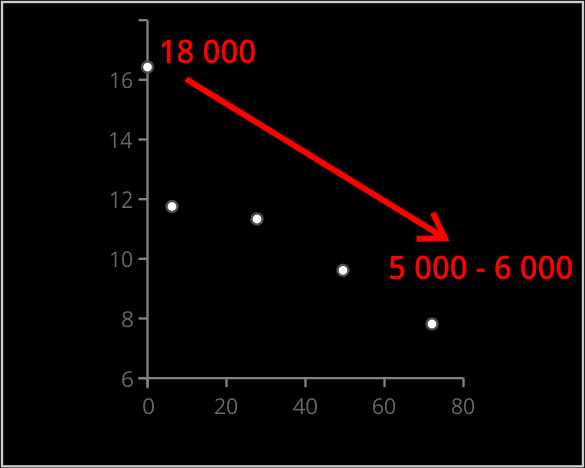
Рис.2. Возрастная динамика длины теломер человека
Теломерные повторы не просто стабилизируют хромосомы, они выполняют ещё одну важную функцию. Как известно, воспроизведение генетического материала от поколения к поколению происходит за счёт удвоения молекул ДНК с помощью специального фермента (ДНК-полимеразы). Этот процесс называется репликацией. Проблему «концевой репликации» ещё в 1970-х годах независимо сформулировали Алексей Матвеевич Оловников и нобелевский лауреат Джеймс Уотсон. Она заключается в том, что ДНК-полимераза неспособна полностью скопировать концевые участки линейных молекул ДНК, она лишь наращивает уже имеющуюся полинуклеотидную нить. Откуда же берётся начальный участок? Специальный фермент синтезирует небольшую РНК-«затравку». Её размер (<20 нуклеотидов) невелик по сравнению с размером всей цепи ДНК. Впоследствии РНК-«затравка» удаляется специальным ферментом, а образовавшаяся при этом брешь заделывается ДНК-полимеразой. Удаление крайних РНК-«затравок» приводит к тому, что «дочерние» молекулы ДНК оказываются короче «материнских». То есть теоретически при каждом цикле деления клеток должна происходить потеря генетической информации. Но так происходит далеко не во всех клеточных популяциях. Чтобы клетки не растеряли при делении часть генетического материала, теломерные повторы обладают способностью восстанавливать свою длину. В этом и заключается суть процесса «концевой репликации». Но учёные не сразу поняли, каким образом наращиваются концевые последовательности. Было предложено несколько различных моделей. Русский учёный А.М. Оловников предположил существование специального фермента (теломеразы), наращивающего теломерные повторы и тем самым поддерживающего длину теломер постоянной. В середине 1980-х годов в лабораторию Блэкбёрн пришла работать Кэрол Грейдер, и именно она обнаружила, что в клеточных экстрактах инфузории происходит присоединение теломерных повторов к синтетической теломероподобной «затравке». Очевидно, в экстракте содержался какой-то белок, способствовавший наращиванию теломер. Так блестяще подтвердилась догадка Оловникова и был открыт фермент теломераза. Кроме того, Грейдер и Блэкбёрн определили, что в состав теломеразы входят белковая молекула, которая, собственно, осуществляет синтез теломер, и молекула РНК, служащая матрицей для их синтеза. Теломераза решает проблему «концевой репликации»: синтезирует повторы и поддерживает длину теломер. В отсутствие теломеразы с каждым клеточным делением теломеры становятся короче и короче, и в какой-то момент теломерный комплекс разрушается, что служит сигналом к программируемой гибели клетки. То есть длина теломер определяет, какое количество делений клетка может совершить до своей естественной гибели (Рис. 3.).
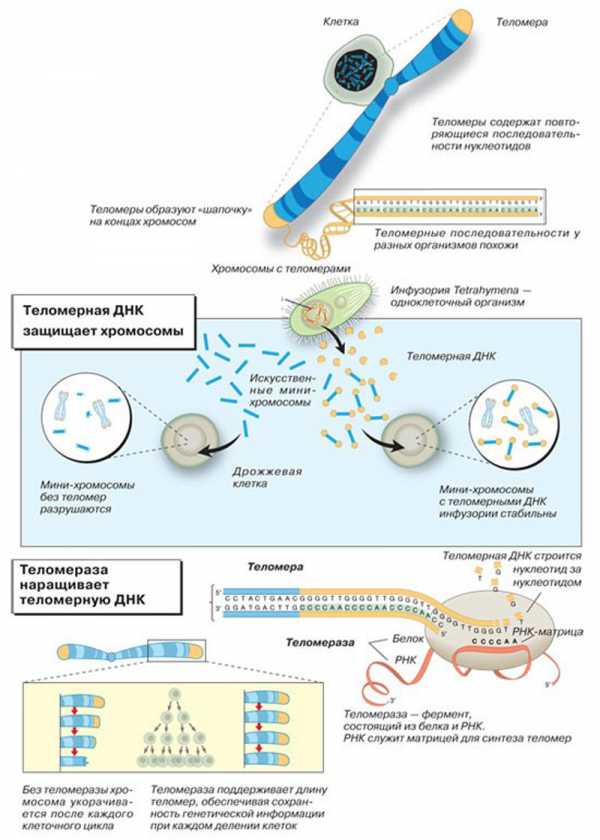
Рис. 3. Механизм действия теломеразы
На самом деле у разных клеток могут быть разные сроки жизни. В эмбриональных стволовых клеточных линиях теломераза очень активна, поэтому длина теломер поддерживается на постоянном уровне. Вот почему эмбриональные клетки — «вечно молодые» и способны к неограниченному размножению. В обычных стволовых клетках активность теломеразы ниже, поэтому укорачивание теломер скомпенсировано лишь отчасти. В соматических клетках теломераза вовсе не работает, поэтому теломеры укорачиваются с каждым клеточным циклом. Укорочение теломер приводит к достижению предела Хайфлика — к переходу клеток в состояние сенессенса. После этого наступает массовая клеточная смерть. Уцелевшие клетки перерождаются в раковые (как правило, в этом процессе задействована теломераза). Раковые клетки способны к неограниченному делению и поддержанию длины теломер. Наличие теломеразной активности в тех соматических клетках, где она обычно не проявляется, может быть маркёром злокачественной опухоли и индикатором неблагоприятного прогноза. Так, если активность теломеразы появляется в самом начале лимфогранулематоза, то можно говорить об онкологии. При раке шейки матки теломеразаактивна уже на первой стадии. Мутации в генах, кодирующих компоненты теломеразы или других белков, участвующих в поддержании длины теломер, являются причиной наследственной гипопластической анемии (нарушения кроветворения, связанные с истощением костного мозга) и врождённого Х-сцеплённого дискератоза (тяжёлое наследственное заболевание, сопровождающееся умственной отсталостью, глухотой, неправильным развитием слёзных каналов, дистрофией ногтей, различными дефектами кожи, развитием опухолей, нарушениями иммунитета и др.) (Рис. 4.).
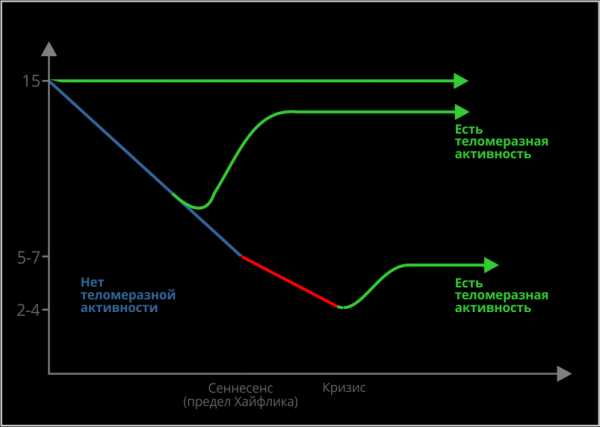
Рис.4. Теломеразная регуляция клеточного жизненного цикла
Вместе с тем, скорость укорочения длины теломер хромосом рассматривается многими исследователями как один из наиболее точных маркеров скорости клеточного старения, которое проявляется всем спектром возраст-ассоциированных заболеваний и патологических состояний (Рис. 5.).
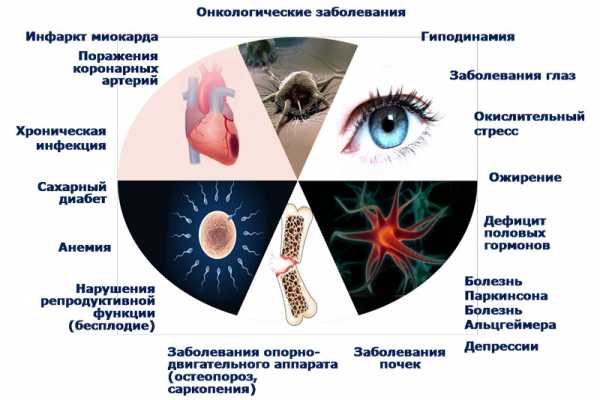
Рис. 5. Возраст-ассоциированные заболевании и патологические состояния, ассоциированные с ускоренным укорочением теломер
Активаторы теломеразы – новое направление в эпигенетической терапии XXI века. Образ и стиль жизни – это ключ, который открывает дверь к изменению генов в новом тысячелетии. Интенсивные исследования теломеразной активности различных природных субстанций, проведенные за последние 5 лет, позволили путем эмпирического скрининга получить, искусственно синтезировать и вывести на фармацевтический рынок первый активатор теломеразы на основе циклоастрогенола – экстракта корня перепончатого астрагала (Astragalus membranaceus) чистотой 98%, полученного методом многоступенчатой очистки и последующей концентрации одного из 2000 компонентов, обнаруженных в корнях данного растения. Перепончатый астрагал имеет давнюю историю применения в китайской и тибетской медицине. В России он тоже произрастает в Западной Сибири и на Дальнем Востоке.
Несмотря на то, что доказательная база эффективности и безопасности данного циклоастрогенола находится пока в стадии своего формирования, поскольку он был синтезирован сравнительно недавно, имеющиеся результаты клинико-экспериментальных исследований свидетельствуют о наличии у него доказанного дозозависимого эффекта активации теломеразы за счет усиления экспрессии гена hTERT – одного из ключевых молекулярных регуляторов активности данного фермента, что сопровождалось увеличением длины теломер в неонатальных кератиноцитах и фибробластах человека.
Согласно имеющимся данным, циклоастрогенол (ТА-65) увеличивает среднюю длину теломер, уменьшает долю критически коротких теломер и повреждений ДНК в фибробластах мыши, но не повышает теломеразную активность и не удлиняет теломеры в фибробластах мышей с нокаутом гена hTERT. У мышей, получавших ТА-65, улучшалось состояние кожи и костей, возросла толерантность к глюкозе, но частота злокачественных заболеваний при этом не возрастала. У людей, принимавших ТА-65 (10–50 мг ежедневно в течение 3–6 месяцев) и наблюдавшихся в течение года, улучшались показатели иммунной системы: уменьшалось количество стареющих цитотоксических (CD8+/CD28–) T-лимфоцитов и натуральных киллерных клеток, значительно уменьшалось количество клеток с короткими теломерами, хотя средняя длина теломер не изменилась.
Таким образом, циклоастрогенол позволяет замедлить скорость укорочения теломер за счет активации ключевого гена hTERT экспрессии данного фермента в клетке (гена hTERT). Исследования последних лет показали, что теломеразная активность действительно зависит от количества фермента в клетке, что во многом определяется уровнем экспрессии не менее двух генов, прежде всего, генов коровых субъединиц теломеразы (hTERT и hTR), представленных в геноме человека только одной копией. При этом разнообразные проявления активности теломеразы зависят, в первую очередь, от экспрессии именно гена hTERT, на который и оказывает активирующее влияние циклоастрогенол.
В дальнейшем были выявлены различные клеточные факторы транскрипции, регулирующие экспрессию гена hTERT. Так, опухолевый супрессор WT1 (взаимодействует с промотором гена hTERT), фактор CTCF (взаимодействует с экзонами 1 и 2 гена hTERT), метилирование ДНК в области кор-промотора hTERT и некоторые другие факторы способны резко угнетать активность теломеразы. Напротив, активирующее влияние на теломеразу оказывают киназа Akt (фосфорилирование повышает активность теломеразы), белок TCAB1 (осуществляет перенос РНК-компонента теломеразы в ядро), белок TPP1 (предположительно участвует в доставке теломеразы к теломерам и увеличивает процессивность теломеразы) и ER (рецептор эстрогенов) α и β.
В последнее время установлено, что некоторые растительные субстанции также обладают способностью стимулировать теломеразную активность (ауксин, содержащий индолилуксусную кислоту), генистеин (изофлавон-фитоэстроген, выделенный из сои, лугового клевера и других растений, дозозависимо регулирует активность теломеразы), а также росвератрол, которым богат красный виноград и ряд других растений (он относится к фенолам-фитоалексинам и влияет на посттрансляционную модификацию и локализацию теломеразы, ингибирует фермент в опухолевых клетках и увеличивает его активность в предшественниках эпителиальных и эндотелиальных клеток).
Активирующим эффектом в отношении теломеразы обладают также регуляторные пептиды (например, комплексы пептидов эпифиза (эпиталон), тимуса и ряд других).
Теломерол — новое слово в антивозрастной медицине XXI<века. В начале 2017 года на российском рынке появился уникальный препарат «Теломерол», разработанный на основе фундаментальных исследований в области клеточной биологии и новейших разработок мировой фармакологии. В его состав входит уже широко известная молекула циклоастрогенола, а также пептидные комплексы Эпивиаль и Тимовиаль. Таким образом, Теломерол состоит из уникальных компонентов, оказывающих двойной синергический эффект в отношении активности теломеразы (циклоастрогенол и пептидные комплексы повышает экспрессию гена hTERT теломеразы, при этом вторые усиливают стимулирующий эффект первого).
Пептиды – это семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями. Данные пептидные комплексы, являются короткими белками, которые наш организм должен получать извне (с приемом пищи) для полноценной работы и функционирования всех систем. Механизм действия пептидов следующий: короткие пептиды проникают в клетку через цитоплазматическую и ядерную мембраны, участвуют в активации отдельных генов, в частности, активируют молекулу теломеразы. Пептиды увеличивают содержание эухроматина в ядре клетки, большее число генов становится доступным для транскрипции, транскрипция происходит интенсивно и синтез белка увеличивается. Взаимодействие пептидов с блоками нуклеотидов приводит к реактивации теломеразного промоутера в соматических клетках, которая инициирует внутриклеточный синтез теломеразы, удлиняет теломеры, тем самым влияя на продолжительность и качество жизни. Короткие пептиды не проявляют иммуногенности и являются тканеспецифичными.
Пептидный комплекс Эпивиаль содержит в качестве активных компонентов пептиды ASP-GLU-GLU, LYS-ASP-GLU, ALA-ASP-GLU-LEU в терапевтически эффективных количествах.
Эпифиз – особая железа в нашем организме, влияющая на скорость старения всего организма. Эпифиз регулирует деятельность всех желез внутренней секреции, вырабатывающих гормоны. Мелатонин – основной гормон эпифиза – оказывает антиоксидантное, адаптогенное и снотворное действие, регулирует цикл сон–бодрствование, положительно влияет на функции мозга, адаптирует организм к быстрой смене часовых поясов, снижает реакции на стресс и выполняет целый ряд других важных физиологических функций.
Пептидный комплекс Эпивиаль вырабатывается из 6 аминокислот: L-аланина, L- глутаминовой кислоты, глицина, L-аспарагиновой кислоты, L-лизина, L-лейцина.
Аланин – аминокислота, которая используется в качестве «стройматериала» для карнозина, а он, как известно, может усилить выносливость и предотвратить быстрое старение. Основные запасы карнозина концентрируются в скелетных мышцах, частично в клетках головного мозга и сердца. По своей структуре карнозин представляет собой дипептид – две аминокислоты (аланин и гистидин) связанные между собой. В разной концентрации он присутствует практически во всех клетках организма.
Одна из ключевых функций карнозина – поддержание кислотно-щелочного равновесия в организме. Но помимо этого, он обладает нейропротекторными, антивозрастными, антиоксидантными свойствами, является мощным хелатором (предотвращает избыточное накопление ионов металлов, которые могут повредить клетки). Также карнозин может повышать чувствительность мышц к кальцию и делать их стойкими перед тяжелыми физическими нагрузками. Кроме того, данная аминокислота способна избавлять от раздражительности и нервозности, ослаблять головные боли.
Уникальность глутаминовой и аспарагиновой кислоты состоит в том, что они играют интегрирующую роль в азотном обмене, так как все заменимые аминокислоты вначале должны превратиться в глутаминовую и аспарагиновую кислоты. Ведущая роль в процессе перераспределения азота принадлежит глутаминовой кислоте. Глутаминовая кислота составляет 25% от общего количества всех (заменимых и незаменимых) аминокислот в организме. Хотя глутаминовая кислота и считается классической заменимой аминокислотой, в последние годы выяснено, что для отдельных тканей человеческого организма глутаминовая кислота является незаменимой и ничем другим (никакой другой аминокислотой) не может быть восполнима. В организме существует своеобразный «фонд» глутаминовой кислоты. Глутаминовая кислота расходуется в первую очередь там, где она нужнее всего.
Аспарагиновая кислота не имеет в организме такого большого удельного веса, как глутаминовая. Помимо перераспределения азота в организме, наряду с глутаминовой кислотой, аспарагиновая кислота принимает участие в обезвреживании аммиака.
Во-первых, аспарагиновая кислота способна присоединять к себе токсичную молекулу аммиака, превращаясь в нетоксичный аспарагин. И, во-вторых, аспарагиновая кислота способствует превращению аммиака в нетоксичную мочевину, которая выводится затем из организма.
Лизин – незаменимая, то есть не синтезируемая организмом самостоятельно, аминокислота, входящая в состав практически каждого белка в теле человека. Это значит, что она постоянно должна поступать в организм человека с пищей, так как сам он её синтезировать не может. Лизин входит в состав практически всех белков, необходим организму человека для нормального роста, производства гормонов, антител, ферментов, а также для восстановления тканей. Эта аминокислота оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес и острые респираторные инфекции.
Лейцин – незаменимая алифатическая аминокислота с разветвленной цепью. Входит в состав всех природных белков. Применяется для лечения различных заболеваний и имеет существенное влияние на общее состояние организма. Лейцин берет под защиту наши клетки и мышцы, оберегает их от распада и старения. Способствует регенерации мышечной и костной ткани после повреждений, участвует в обеспечении азотистого баланса и понижает уровень сахара в крови. Лейцин укрепляет и восстанавливает иммунную систему, участвует в кроветворении и необходим для синтеза гемоглобина, нормальной работы печени и стимуляции выработки гормонов роста. Нельзя не отметить и то, что эта незаменимая аминокислота положительно влияет на ЦНС, так как обладает стимулирующим эффектом. Лейцин предотвращает избыток серотонина и его последствия. А также лейцин способен сжигать жиры, что немаловажно для людей страдающих избыточным весом.
И, наконец, глицин, который не нуждается в представлении, так как достаточно и широко известен. Глицин – это простейшая алифатическая аминокислота, единственная, не имеющая оптических изомеров. Глицин, улучшает умственные и физические способности. Таким образом, пептидный комплекс Эпивиаль является уникальным и необходимым источников пептидов для организма каждого человека. Особое место пептидный комплекс занимает в профилактике заболеваний и активации естественного иммунитета организма. Пептидный комплекс Тимовиаль – это синтетический зеркальный аналог натурального пептидного экстракта тимуса. Получают его путем твердофазного синтеза дипептида Lys-Glu из двух аминокислот – D-глутаминовой кислоты и D-лизина. Тимус – мощный иммунный орган, формирующий иммунные клетки, обеспечивая устойчивую взаимосвязь иммунитета и высокой продолжительности жизни. В эксперименте было установлено, что дипептид Lys-Glu обладает иммуномодулирующей активностью.
Теломерол – первый российский клинический опыт применения в управлении скоростью старения теломер.
Сегодня в России есть возможность сделать анализ крови и измерить длину теломер. Лаборатория «Архимед» делает тест, который позволяет оценить среднюю длину теломер клеток лейкоцитарной фракции периферической крови методом полимеразной цепной реакции (ПЦР) (Рис. 6.).

Рис.6. Пример оформления анализа периферической крови для измерения длины теломер лейкоцитов периферической крови
Результат представляется как индекс теломера (T/S или т.н.о. (тысяч нуклеотидных повторов)) и сравнивается с индексами исследуемой популяции в одном возрастном диапазоне. Вычисляемый индекс представляет собой среднюю длину теломер, индекс эволюционирует, изменяется с течением времени и возрастом человека. Как следствие, высокий индекс теломеры, является сигнатурой молодых клеток, тогда как низкий индекс теломеры, представляет собой стареющие клетки.
Гендерное и географическое происхождение человека, являются одними из основных факторов, влияющих на длину его теломер. Также на длину теломер оказывают значительное влияние оксидативный стресс, индекс массы тела, потребление алкоголя и табака, низкая физическая активность и неправильное питание. Возраст и наследственность являются важными факторами, влияющими на длину теломер, но все-таки основными факторами являются образ жизни и окружающая среда.
Наблюдение за динамикой индекса теломер является на сегодняшний день частью глобальной диагностики пациента, которая складывается в 4 основных фактора: прогноз, профилактика, персонализация, участие.
В современной медицине длина теломер рассматривается как показатель глобального биологического старения или специфического старения отдельных систем. Именно поэтому длину теломер можно и необходимо соотносить с патологиями, которые связаны со старением человека.
Новая технология в исследовании длины теломер и применение инновационного препарата «Теломерол» являются бесценными инструментами в Вашей ежедневной, медицинской практике и вот почему: легко оценить биологический возраст пациента и составить прогноз; диагностика сердечно-сосудистых заболеваний, таких как: атеросклероз, гипертония, ожирение, сахарный диабет; применение в лечении хронических заболеваний; диагностика индивидуального риска развития нарушения обмена веществ;применение при лечении бесплодия: нарушение гаметогенеза, нарушение ядерной реакции сперматозоидов, нарушение частоты анеуплодии, повышение репродуктивного возраста, как у мужчин, так и у женщин; стволовые клетки: оценка их качественного контроля и характеристик; применение при лечении ожирения: формирование индивидуальной диеты и питания для пациента; короткие теломеры, показывают на вероятность развития онкоклеток у пациента; управление возрастом, процессом старения Вашего пациента: функциональная медицина, персонализированная медицина, профилактическая медицина. Теломерол оказывает индивидуальный эффект на каждого пациента, так как восстанавливаются в организме в первую очередь критически короткие теломеры, именно поэтому эффект Вы и Ваш пациент будете видеть со стороны тех органов и систем, которые находятся в худшем состоянии.
Клиника профессора Калинченко в Москве, пожалуй, одной из самых первых в России стала широко применять в своей клинической практике определение длины теломер у пациентов с возраст-ассоциированными заболеваниями (с 2014 года) и назначать сначала циклоастрогенол (ТА-65), а сегодня – Теломерол. Собственный 4-летний опыт работы в данном направлении антивозрастной медицины, основанный на обследовании и лечении более 120 пациентов с применением активаторов теломеразы, позволяет сделать некоторые предварительные выводы относительно места данных препаратов в комплексной Anti-Ageing Medicine патогенетической anti-age медицине.
Прежде всего, следует применять принцип рациональной обоснованности назначения данных препаратов, основанный на обязательной предварительной лабораторной диагностике активности теломеразы, отражением которой является длина теломер хромосом лейкоцитов периферической крови. Это и понятно, так как при исходно неизвестной активности фермента результаты терапии активаторами теломеразы могут оказаться весьма непредсказуемыми. Все пациенты разные, что делает их таковыми различный уровень метаболизма, различные особенности гормонально-метаболического фона и показателей гомеостаза организма и т.д., иными словами, терапия активаторами теломеразы должна носить фенотипический, пациент-таргетированный характер, и если скорость биологического старения, оцененная по длине теломер, у пациента соответствует возрасту, то очевидно, что назначение активаторов теломеразы целесообразно рекомендовать пациенту для профилактики возраст ассоциированных и простудных заболеваний, для поддержания хорошего самочувствия и внешнего вида, регулирования ссистемы сон-бодрствование и в период умственных нагрузок и стресса. Иными словами, активаторы теломеразы не являются «универсальным эликсиром молодости», но безусловно занимают основное место в современной концепции перехода человека от HOMO SAPIENS в HOMO LONGEVUS, когда человек в зрелые годы полностью сохраняет умственную и физическую активность, бодрость.
По нашему мнению, основным показанием для обсуждения дополнительного к проводимой фармакотерапии назначения активаторов теломеразы является несоответствие биологического и паспортного возраста пациента, выявленное на основании лабораторного теста скорости старения теломер в сочетании с субъективной и/или объективной недостаточностью эффекта от ранее назначенной и проводимой патогенетической терапии.
С другой стороны, при выявлении лабораторных признаков снижения активности теломеразы (быстрое, не соответствующее биологическому возрасту, укорочение теломер) дополнительное назначение активаторов теломеразы является целесообразным и патогенетически обоснованным компонентом комплексной anti-age терапии. По данным собственных наблюдений, назначениее Теломерола позволяет приостановить процессы ускоренного биологического старения, достоверно удлиняя теломеры уже к концу первого месяца лечения в среднем на 10–20%. Наш клинический опыт применения активаторов теломеразы, основывается на применении этих препаратов, как в монотерапии, так и в составе лечебно-профилактической концепции «Квартет Здоровья». Препараты показали практически равнозначную эффективность, но так как лечебно-профилактическая концепция «Квартета Здоровья» направлена на комплексную терапию всего организма, здесь активаторы теломеразы все-таки показали наиболее ярко-выраженную эффективность. Это совершенно логично, так как все компоненты «Квартета здоровья» (половые гормоны, витамин D, Омега-3 ПНЖК и антиоксиданты) являются по сути непрямыми активаторами теломер, поэтому терапевтическая эффективность комбинации «Квартет здоровья»+Теломерол» существенно превосходит эффективность монотерапии каждым из них по отдельности в среднем на 20–30%. Уже в течение первых месяцев терапии большинство пациентов отмечают значительное улучшение настроения, восстановление циркадного ритма, улучшение общего самочувствия, даже ощущение внутренней гармонии. Безусловно, клиническое применение Теломерола в России только началось, поэтому данные доказательных исследований не так велики, но уже существуют, поэтому сегодня мы говорим о его эффективности и безопасностиСовершенно очевидно, что для того, чтобы клиническая база применения стала более обширной, все мы должны активно применять все доступные сегодня фармакотерапевтические опции для обеспечения продолжительности качественной жизни наших родных, близких и пациентов, а активаторы теломеразы сегодня являют собой яркий пример того, как одна из самых доказательных на сегодняшний день фундаментальных теорий клеточного старения (теломеразная теория) уже реализуется в повседневной клинической практике врачей самых разных специальностей.
Заключение. Современные болезни XXI века, увы, которым подвержены все жители мегаполиса, мешают человеку жить долго и качественно. Ревизия медицины, к которой призывал Залманов А.С. еще в 1963 году в своей революционной по тому времени книге «Тайная мудрость человеческого тела», сегодня тем более назрела. Сегодня врач каждой специальности должен ориентироваться в новом понятии «антивозрастная медицина», как каждый врач XX века ориентировался в ставших не столь актуальными в XXI веке инфекционных заболеваниях. У всех пациентов с любой возраст-ассоциированной патологией aprioir имеется окислительный стресс, поэтому применение эффективных и безопасных при длительном приеме антиоксидантов должно стать клинической нормой и носить характер постоянного пожизненного приема, так как с возрастом интенсивность окислительного стресса и его негативных метаболических последствий только усиливаются. С учетом ухудшающихся показателей всех сторон здоровья современного человека в XXI веке прерогативой клинической медицины становится ранняя диагностика и своевременная коррекция всех патологических процессов, ускоряющих клеточное и системное старение, среди которых ключевыми являются возрастные гормональные дефициты/дисбалансы и окислительный стресс, приводящие к более быстрому укорочению теломер клеток, что в совокупности предопределяет ускорение клеточного и системного старения и омоложение большинства возраст-ассоциированных заболеваний. Однако, этот процесс в умелых руках может быть довольно легко управляемым, тем более, что для патогенетического фармакотерапевтического управления и профилактики ускоренного старения и возраст-ассоциированной патологии уже сегодня есть уникальные и эффективные препараты с мощными патогенетическими anti-age эффектами, среди которых синтетические активаторы теломеразы (циклоастрогенол и регуляторные пептиды) очень скоро могут занять свое достойное место в арсенале современного врача. Главное в данном случае – искусство врача умело и по показаниям их применить, чтобы каждый нашел «своего» пациента.
telomerol.ru
Теломераза поворачивает процесс старения вспять?

Защитные колпачки хромосом – теломеры – не только предотвращают старение. Они могут повернуть его вспять. (Lansdorp/Visuals Unlimited/Corbis)
Ученые из Онкологического института Дана-Фарбера (Dana-Farber Cancer Institute) Гарвардского университета (Harvard University) впервые частично обратили вспять возрастную дегенерацию тканей у мышей, что привело к увеличению размеров головного мозга, повышению плодовитости и возвращению потерянных когнитивных функций.
Профессор генетики Гарвардской медицинской школы (Harvard Medical School) Рональд де Пиньо (Ronald A. DePinho), MD, считает, что их эксперименты являются вехой в науке о старении. Таких результатов они достигли, создав генно-инженерных мышей с управляемым геном теломеразы. Фермент теломераза поддерживает постоянную длину защитных колпачков на концах хромосом – теломер.
Свойственные пожилому возрасту низкие уровни теломеразы связаны с прогрессирующей эрозией теломер, что вносит свой вклад в дегенерацию тканей и приводит к функциональным расстройствам. Создав мышей с «переключателем» теломеразы, исследователи получили преждевременно стареющих животных. Этот сложный генно-инженерный «трюк» позволил им ответить на вопрос, может ли реактивированная теломераза восстановить теломеры и смягчить симптомы старения. Работа показала значительное отступление многих из признаков старения, в том числе бесплодия и заболеваний мозга.
Профессор генетики Гарвардской медицинской школы Рональд де Пиньо (Ronald A. DePinho), MD. Его работа – первая демонстрация обратного развития многих проявлений возрастной тканевой дегенерации у мышей. Ученый считает ее вехой в науке о старении. Результаты получены на генно-инженерных мышах с контролируемым геном теломеразы. На заднем плане — изображения хромосом с теломерами (выделены красным) на концах. (Photo by Kris Snibbe)
Хотя использование подобного подхода для возвращения молодости людям сегодня невозможно, стратегия как таковая может быть когда-нибудь применена для лечения таких редких заболеваний, как генетически обусловленный синдром преждевременного старения, при котором укорочение хромосом играет важнейшую роль.
«Можно ли таким образом повлиять на процесс нормального старения – более сложный вопрос», — считает профессор де Пиньо. «Но следует отметить, что укорочение теломер связано с возрастными заболеваниями и, таким образом, восстановление теломер могло бы замедлить их дальнейшее развитие».
Важно отметить, что у животных не наблюдалось никаких признаков развития рака. Этот вопрос по-прежнему вызывает обеспокоенность, так как, чтобы стать практически бессмертными, раковые клетки активируют именно теломеразу. Профессор Де Пиньо считает, что риск развития рака можно минимизировать, включая выработку теломеразы только на короткие отрезки времени — несколько дней или недель, что не приведет к «оживлению» скрытых раковых клеток или образованию новых. Однако этот важный вопрос требует дальнейших исследований.
Кроме того, считают ученые, полученные результаты могут открыть новые перспективы в регенеративной медицине, так как они дают основания полагать, что покоящиеся взрослые стволовые клетки в тканях даже очень старых людей остаются жизнеспособными и могут быть реактивированы для устранения возрастных повреждений.
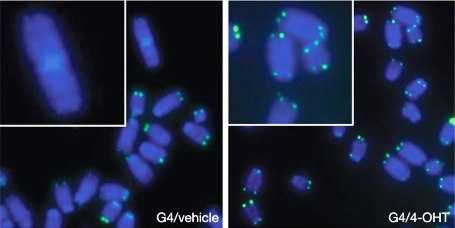
Клетки селезенки мышей с активированной теломеразой в метафазе. (Фото: nature.com)
«Если устранить основные повреждения и стрессы, стимулирующие процесс старения и вызывающие прекращение роста стволовых клеток, их можно использовать в обратном, регенеративном, направлении для омоложения тканей и сохранения здоровья в старости», — предполагает профессор де Пиньо. Среди таких стрессов и происходящее в течение всей жизни укорочение теломер, ведущее к фатальному повреждению клеток и тканей.
Потеря теломер вызывает каскад сигналов, заставляющих клетки прекратить деление или перейти к выполнению программы клеточной смерти, или апоптоза, стволовые клетки «уйти на отдых», органы атрофироваться, а нейроны умереть. В целом укорочение теломер клеток нормальных тканей указывает на устойчивое снижение жизнеспособности.
В проведенных профессором де Пиньо экспериментах использовались генно-инженерные мыши, у которых в результате аномального, преждевременного старения развивались тяжелые повреждения ДНК и тканей. У этих животных были короткие нефункциональные теломеры, и они страдали многими ассоциированными со старением заболеваниями, прогрессирующими в последующих поколениях. Среди нарушений были такие как уменьшение размеров яичек, бесплодие, атрофия селезенки, повреждения кишечника, сокращение размеров головного мозга и неспособность образовывать новые нейроны.
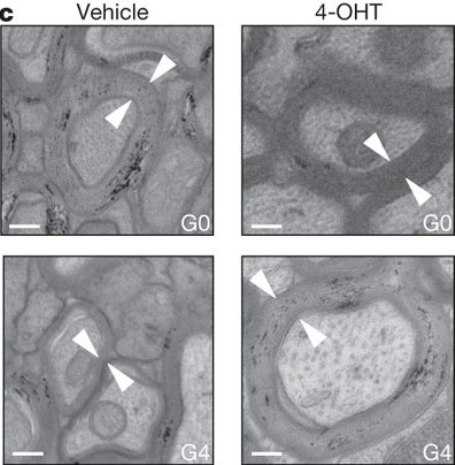
Электронная микрофотография покрытых миелиновыми оболочками аксонов в мозолистом теле головного мозга генно-инженерных мышей. Концы стрелок указывают на толщину миелиновых оболочек (х12000). Шкала 200 нм. (Фото: nature.com)
«Мы хотели узнать, что произойдет, если у животных с тяжелейшими возрастными заболеваниями включить теломеразу и восстановить теломеры», — объясняет профессор де Пиньо. «Замедлит ли это старение, стабилизирует его или, может быть, повернет вспять?»
Вместо того чтобы вводить грызунам дополнительные количества теломеразы извне, ученые разработали способ включения их собственного гена теломеразы, известного как TERT. Они создали инженерный ген TERT, кодирующий гибридный белок гена TERT и рецептора эстрогена (ER). Этот гибридный белок активируется только особой формой эстрогена (4-hydroxytamoxifen, 4-OHT). Таким образом, они могли стимулировать выработку гибридного белка TERT-ER и активировать с его помощью восстановление теломер в любое время, давая мышам специальный препарат эстрогена.
Эстроген вводился с помощью постепенно рассасывающихся подкожных гранул. В контрольной группе гранулы не содержали активного вещества.
Через четыре недели у мышей, получавших эстроген, наблюдались заметные признаки омоложения. В целом мыши демонстрировали повышенные уровни теломеразы и удлинение теломер, биологические изменения, свидетельствующие о возвращении клеток в состояние роста с обратным развитием тканевой дегенерации, увеличение размера селезенки, яичек и головного мозга. «Это было похоже на эффект Понсе де Леоне», — замечает де Пиньо, имея в виду испанского конкистадора, искавшего мифическую вечную молодость.
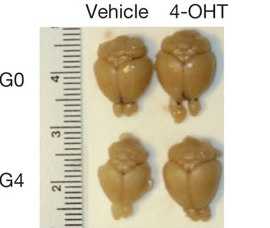
Головной мозг мышей-ровесников из экспериментальной и контрольной групп. (Фото: nature.com)
«Через месяц после включения теломеразы головной мозг в значительной степени вернулся к норме», — комментирует результаты работы де Пиньо. Теломераза ревитализировала дремлющие стволовые клетки и они начали производить новые нейроны. Кроме того, увеличились в диаметре окружающие нервные клетки липидные миелиновые оболочки, истончающиеся у старых животных.
Чтобы показать, что вся эта новая активность действительно вызвала положительные функциональные изменения, ученые протестировали способность мышей избегать определенных пространств, где они ощущали неприятные запахи, ассоциирующиеся у них с чувством опасности – хищниками или испорченной пищей. Лишенные теломеразы животные потеряли способность к выживанию, так как их обонятельные нервы атрофировались, но после повышения уровня фермента эти нервы регенерировали, и важное для мышей обоняние восстановилось.
«Одни из самых удивительных изменений произошли в яичках животных, которые по существу были бесплодны, так как старение привело к гибели или отсутствию у них сперматозоидов», — рассказывает профессор де Пиньо. «Когда мы восстановили теломеразу, яички начали производить новые сперматозоиды, и плодовитость мышей повысилась – они дали большее количество пометов».
Повышение уровня теломеразы увеличило и продолжительность жизни животных, но только по сравнению с контрольной группой — они не жили дольше, чем обычные мыши, признают ученые.
«Беспрецедентное обращение вспять возрастного снижения функций центральной нервной системы и других жизненно важных для здоровья взрослых млекопитающих органов оправдывает изучение стратегий омоложения теломер для лечения ассоциированных с возрастом заболеваний» — делают вывод авторы.
По материалам
Partial reversal of aging achieved in mice
Оригинальная статья:
Mariela Jaskelioff, Florian L. Muller, Ji-Hye Paik, Emily Thomas, Shan Jiang, Andrew C. Adams, Ergun Sahin, Maria Kost-Alimova, Alexei Protopopov, Juan Cadiñanos, James W. Horner, Eleftheria Maratos-Flier & Ronald A. DePinho. Telomerase reactivation reverses tissue degeneration in aged telomerase-deficient mice
© «Теломераза поворачивает вспять процесс старения?». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Старение. Письменное разрешение обязательно.
Еще о старении
Новая группа белков увеличивает продолжительность жизни лабораторных червей на 30 процентов
Биологи нашли еще один ключ к клеточному старению
Секреты долголетия
Почему так долго живет саламандра?
Установлена связь между белками множественной лекарственной резистентности и продолжительностью жизни клеток
Ученые подтвердили тесную связь белка SIRT1 и гипоталамуса в реакции организма на низкокалорийную диету
Белки, связанные с нейродегенеративными заболеваниями, образуют бляшки в процессе нормального старения
Очередной шаг на пути к созданию антивозрастных препаратов
Биологические часы: ученые изучают вклад эпигенетики в старение клеток
Ученые выведали у природы ключевой путь к старению
Related Articles:
www.lifesciencestoday.ru
Активация теломеразы – самый перспективный подход к продлению молодости
Josh Mitteldorf, перевод Евгении Рябцевой
Изучение биологии теломер должно помочь увеличить продолжительность жизни людей и значительно снизить частоту встречаемости заболеваний, в настоящее время являющихся основными причинами смертности: болезней сердца, инсульта и болезни Альцгеймера. Риск развития всех этих заболеваний экспоненциально возрастает по мере старения человека, и оказываемая ими нагрузка на общество значительно снизится, когда мы научимся воздействовать на работу биологических часов старения организма.
Казалось бы, что Нобелевская премия 2009 года должна была стимулировать изучение биологии теломер, однако это направление до сих пор остается специализированной отраслью медицинских исследований, и только немногие биологи серьезно воспринимают его перспективы в профилактике и лечении возрастных болезней. Национальные институты здравоохранения США располагают средствами на изучение заболеваний сердца, рака, а также болезней Альцгеймера и Паркинсона, но самым лучшим вложением в данном случае было бы инвестирование в исследования биологии теломер. На изучение перечисленных заболеваний тратятся многие миллиарды долларов, так как они считаются «медициной» и финансируются Национальными институтами здравоохранения, тогда как изучение биологии теломер считается «наукой» и финансируется Национальным научным фондом США. В 2013 году на изучение биологии клетки было выделено всего 123 миллиона долларов, и только мизерная часть этой суммы была потрачена на изучение биологии теломер. Частный сектор уделяет данному вопросу немного больше внимания, однако они делают лишь краткосрочные вложения, тогда как в действительности необходимо проведение направленных исследований с долгосрочной перспективой.
Существуют убедительные свидетельства в пользу того, что изменение длины теломер является одним из основных механизмов работы биологических часов старения. Организм знает, как удлинять теломеры, однако предпочитает не делать этого. Нам надо только дать ему сигнал к активации гена теломеразы (фермента, восстанавливающего длину теломер), имеющегося в каждой клетке. Очевидно, что эффективность этого подхода не гарантирована, однако по сравнению с вялым прогрессом в изучении отдельных заболеваний он является весьма привлекательной проблемой, особенно учитывая то, что его мишень достаточно проста. По мнению автора, описанная перспектива достойна проведения прорывного исследовательского проекта.
Три возражения против изучения теломеразы
- «Старение неизбежно, так как, согласно законам физики, ничто не вечно».
Это утверждение ссылается на второй закон термодинамики, согласно которому развивающиеся в изоляции закрытые системы со временем утрачивают упорядоченность. Однако живые системы являются открытыми, потребляющими энергию в виде продуктов питания или солнечного света и высвобождающими свою энтропию в окружающую среду. Не существует причин, по которым подобные системы не могут поддерживать свое существование бесконечно. В действительности рост и созревание не были бы возможны при распространении упомянутого закона физики на открытые термодинамические системы. Уже в 19-м столетии, когда были сформулированы законы термодинамики, стало очевидным то, что старение нельзя объяснить физическими законами и, соответственно, его объяснение следует искать в механизмах эволюции. - «Эволюция была направлена на увеличение продолжительности жизни для того, чтобы повысить выносливость организма. Маловероятно, что какое-либо простое вмешательство в физиологию, которое сможет разработать человек, обеспечит результаты, превосходящие достигнутое эволюцией за миллионы лет».
В действительности эволюция была направлена не на увеличение продолжительности жизни, а на обеспечение достаточного количества времени для репродукции. Старение является формой запрограммированной гибели, происходящей согласно гибкой, но непреклонной схеме. Существуют механизмы старения, запрограммированные в живых организмах уже на уровне первых эукариотных клеток. Укорочение теломер используется для управления клеточным циклом и является основным механизмом запрограммированной клеточной гибели в течение, по крайней мере, миллиарда лет. Многие виды простейших не экспрессируют теломеразу в процессе митоза (только в фазе конъюгации), поэтому их теломеры укорачиваются при каждом делении, что накладывает ограничение в несколько сотен циклов репродукции на одну клеточную линию. Этот механизм является предшественником старения теломер, по сей день происходящего в клетках человека и других высших животных. - «Экспрессия теломеразы повысит риск развития рака». Вокруг данного предположения существует достаточно много теоретических обоснований, которые, по мнению автора, совершенно неверны. Злокачественные клетки действительно экспрессируют теломеразу. Однако предложение, согласно которому экспрессия теломеразы превращает клетку в раковую, в корне неверно. Подробное объяснение этой взаимосвязи дано двумя уважаемыми экспертами (Shay and Wright, 2011).
При проведении ранних исследований единственным методом повышения активности теломеразы в клетках лабораторных животных было введение в их геном дополнительных копий гена, кодирующего этот фермент. Доступная в начале 2000-х годов технология не позволяла встраивать ген в заданный регион хромосомы. Встраивание происходило случайным образом. Известно, что подобные манипуляции со структурой ДНК повышают риск развития рака независимо от того, какие гены встраиваются или удаляются. При проведении трех из этих ранних исследований было зарегистрировано повышение риска развития рака у мышей [1, 2, 3].
Не существует лабораторных исследований, результаты которых свидетельствовали бы о том, что активация собственной теломеразы повышает риск развития рака. Согласно современным представлениям, теломераза – не необходимое условие запуска процесса озлокачествления ее экспрессия является обязательной только для поддержания роста большинства прогрессирующих злокачественных опухолей. Последние исследования, проведенные лабораторией Роберта де Пино (Robert de Pinho) из Гарвардского университета и испанской лаборатории Марии Бласко (Maria Blasco), посвящены изучению возможности манипуляций с теломеразой для снижения риска развития рака. Следует отметить, что ранние исследования, на основании которых десять лет назад было высказано беспокойство по поводу безопасности работы с теломеразой, были проведены этими же учеными.
Также проведено большое количество исследований, продемонстрировавших, что (а) экспрессия теломеразы не повышает риск развития рака у лабораторных животных и (b) короткие теломеры ассоциированы с очень высоким риском развития рака. По мнению автора, использование активаторов теломеразы значительно снизит вероятность развития рака. Это произойдет, во-первых, благодаря уничтожению провоспалительных клеток, являющихся потенциально канцерогенными из-за укороченных теломер, и во-вторых, за счет омоложения иммунной системы, обеспечивающей защиту организма от развития рака. В прошлом году автор опубликовал статью, посвященную этому вопросу (J.J.Mitteldorf, Telomere biology: Cancer firewall or aging clock?, Biokhimiya, 2013, Vol. 78, No. 9, pp. 1345–1353; перевод на русский доступен в «бумажном» издании журнала «Биохимия»).
Почему мы можем ожидать от удлинения теломер значительного увеличения продолжительности жизни
Ответ на этот вопрос очевиден, поэтому сформулируем его по-другому: какие факторы указывают на то, что увеличение длины теломер окажет очень мощное влияние на разнообразные аспекты биологии старения?
А) Укорочение теломер является древним механизмом старения
Протисты – это первые одноклеточные эукариоты, появившиеся на Земле миллиард лет назад (их структура значительно сложнее структуры бактерий, появившихся примерно на 3 миллиарда лет раньше). Протисты имеют линейную ДНК и, соответственно, потребность в теломеразе. Так как протисты размножаются простым делением, можно было бы предположить, что эти клетки не должны «стареть» или даже то, что концепция старения не имеет смысла для их клеточного цикла. Однако клеточные линии протистов могут стареть, а с некоторыми это в действительности происходит. В основе этого лежит самый старый из известных механизмов старения, заключающийся в воздержании от использования теломеразы.
В качестве примера можно привести парамеции (инфузории-туфельки). Репродукция парамеций заключается в делении клетки и репликации ДНК в отсутствии экспрессии теломеразы. В результате при каждом делении клетки происходит укорочение ее теломер. Парамеции могут вступать в конъюгацию, являющуюся примитивной формой полового обмена генетической информацией. Клетки двух парамеций сливаются и обмениваются ДНК, после чего разделяются. Экспрессия теломеразы характерна исключительно для процесса конъюгации. Поэтому любая не вступающая в конъюгацию клеточная линия вымирает через несколько сотен поколений. Это предотвращает возникновение чрезмерной однородности клеточных колоний. Таким образом, можно утверждать, что возраст механизма старения составляет миллиард лет, а некоторые из его генетических компонентов сохранялись и передавались через все трансформации многоклеточных форм жизни. William R Clark написал на эту тему де книги, находящиеся в открытом доступе [1, 2].
В) Теломеры человека укорачиваются с возрастом
Этот факт стал известен более 20 лет назад.
С) Люди с короткими теломерами входят в группу риска по преждевременной смертности
Этот факт установлен Ричардом Каутоном (Richard Cawthon, 2003) и описан в статье, удивившей специалистов, занимающихся изучением данного вопроса. В конце концов, если вся сложность процесса старения заключается в укорочении теломер, почему бы организму не решить эту проблему путем экспрессии теломеразы? Это бы усилило индивидуальную выносливость организмов. Почему же эволюция не воспользовалась таким простым приемом? (Ответ на это, конечно, заключается в том, что естественный отбор благоприятствует старению ради сохранения демографической стабильности. Большинство эволюционных биологов не рассматривают эту движущую силу эволюции.) Каутон продемонстрировал, что для 25% 60-летних участников исследования, имевших наиболее длинные теломеры, был характерен в два раза более низкий риск смерти, чем для 25% участников с наиболее короткими теломерами. Каутон имел доступ к уникальной базе данных, содержащей законсервированные образцы крови 20-летней давности. Насколько известно автору, в течение 11 лет (на момент написания данной статьи) никому не удалось ни воспроизвести, ни опровергнуть полученные Каутоном результаты.
D) При анализе данных с учетом возрастного фактора, люди с короткими теломерами входят в группу риска по развитию различных заболеваний, в особенности болезней сердечно-сосудистой системы
Эта взаимосвязь выявлена не только в оригинальном исследовании Каутона, но и при проведении целого ряда других работ [1, 2]. Продемонстрирована также взаимосвязь между длиной теломер и риском развития слабоумия [1, 2], а также сахарного диабета [1, 2].
Е) При анализе результатов с учетом возраста, животные с короткими теломерами также входят в группу высокого риска скорой смерти
Это было продемонстрировано в исследованиях на нескольких видах птиц [1, 2, 3] и павианах. Уже в 2003 году было установлено, что теломеры особей долгоживущих видов укорачиваются медленнее, чем теломеры представителей видов с малой продолжительностью жизни.
F) Небольшие исследования на мышах продемонстрировали способность стимуляторов теломеразы омолаживать организм животных
(Считается, что мыши являются значительно менее эффективной мишенью данной стратегии по сравнению с человеком, так как, судя по всему, старение человека намного сильнее зависит от укорочения теломер, чем старение мышей.)
Первый подобный эксперимент был проведен в 2008 году. Испанский исследователь Томас Лоба (Tomas-Loba) из лаборатории Марии Бласко создал генетически модифицированных мышей, одновременно устойчивых к раку и имеющих дополнительную копию гена теломеразы, экспрессируемую в некоторых тканях, для которых в норме экспрессия этого гена нехарактерна даже у мышей. Продолжительность жизни этих животных была на 18% выше продолжительности жизни устойчивых к раку мышей, имеющих только обычный ген теломеразы.
Однако вскоре было установлено, что предосторожности, предпринятые в отношении риска развития рака, могли быть излишними. Другой исследователь из той же лаборатории Бернардез де Хесус (Bernardes de Jesus, 2011) опубликовал данные, согласно которым ему удалось увеличить продолжительность жизни мышей с помощью коммерчески доступного продукта TA-65 (широко известного как циклоастрогенол) без увеличения риска развития рака. Циклоастрогенол является слабым активатором теломеразы, по сравнению с синтетическими соединениями, разработанными специалистами компании Sierra Sciences. Его активность сопоставима с активностью ряда других растительных экстрактов. Однако исследователи лаборатории Марии Бласко продемонстрировали, что краткосрочная терапия TA-65 обеспечивала удлинение даже наиболее коротких теломер мышей. Это сопровождалось улучшением целого ряда показателей состояния здоровья, в том числе чувствительности тканей к инсулину.
Впоследствии лаборатория Blasco работала с более мощным (хотя и более опасным) методом индукции теломеразы – инфицированием модифицированным ретровирусом, встраивающим ген теломеразы в ядерную ДНК инфицированных клеток. «Введение мышам в возрасте 1 и 2 года терапевтического аденоассоциированного вируса широкого тропизма, экспрессирующего мышиный ген TERT, оказывало выраженное влияние на состояние здоровья и выносливость животных, в том числе на такие показатели, как чувствительность тканей к инсулину, выраженность симптомов остеопороза, нервно-мышечная координация и несколько молекулярных биомаркеров старения» (Bernardes de Jesus et al., 2012). При начале терапии в 2-летнем возрасте продолжительность жизни мышей увеличивалась на 13%, а при начале терапии в возрасте 1 год – на 24%. При этом увеличения частоты развития рака не наблюдалось.
Наиболее выдающимся примером омоложения является достижение лаборатории Роберта де Пино из Гарвардского университета. Как правило, клетки мышей (в отличие от клеток человека) экспрессируют теломеразу на протяжении всей жизни. Исследователи создали модифицированных мышей, не имеющих нормальной (постоянно активной) версии гена теломеразы. Вместо этого животные имели ген теломеразы, который можно было активировать или инактивировать с помощью химического соединения, добавляемого в корм животных. По мере старения у таких мышей развивалось множество тяжелых симптомов дегенерации семенных желез, селезенки, кишечника, нервной системы и других органов. Прогрессирование этих симптомов не только прекращалось, но и обращалось вспять при активации теломеразы на поздних этапах жизни животных. Особенно интересным оказалось влияние на нервную систему, так как, в отличие от клеток кишечника и кожи, нервные клетки функционируют на протяжении всей жизни организма и не нуждаются в постоянном обновлении за счет стволовых клеток. Несмотря на это, у стареющих мышей с инактивированным геном теломеразы снижалась чувствительность органов чувств и способность к обучению. Активация теломеразы полностью восстанавливала эти нарушения.
Исследователи Стэнфордского университета и компании Geron провели эксперименты с «кожей», выращенной из клеток человека в лабораторных условиях. Они установили, что инфицирование клеток модифицированным ретровирусом, встраивающим в их геном ген теломеразы, обеспечивает искусственной коже восстановление эластичности, мягкости и фактуры, характерных для кожи молодого организма.
G) Помимо выполнения основной функции, заключающейся в удлинении теломер, теломераза выступает в роли своего рода гормона роста
Эта гипотеза была предложена в 90-х годах прошлого столетия и получила убедительное подтверждение в виде результатов, полученных учеными Стэнфордского университета [1, 2, 3, 4]. В рамках этой работы была создана линия мышей, имеющих измененную теломеразу, в которой отсутствовал компонент, необходимый для синтеза теломер. Несмотря на это, была продемонстрирована способность теломеразы индуцировать рост шерсти животных. Была также показана способность теломеразы воздействовать на гормональный сигнальный механизм, известный как Wnt. Другие функции теломеразы рассматриваются в статье Cong and Shay (2008).
Н) На примере одного человека продемонстрировано, что прием больших доз активаторов теломеразы растительного происхождения обеспечивает омоложение
С недавнего времени автор поддерживает отношения с физиком из Канзаса, который в течение шести лет принимает огромные дозы активирующих теломеразу растительных препаратов и пищевых добавок и заявляет, что это улучшило его внешний вид и самочувствие, а также положительно сказалось на его физических способностях. Он может быть интересен для изучения проблемы на примере одного случая. Jim Green комментирует эксперимент над собственным организмом в своем блоге.
Выводы
По мнению автора, активация теломеразы является направлением, открывающим наиболее перспективные возможности увеличения продолжительность жизни человека уже в течение ближайших нескольких лет. Исследования в этой области ведутся очень медленно из-за дефицита финансирования и недостатка внимания.
Портал «Вечная молодость» http://vechnayamolodost.ru
23.005.2014
www.vechnayamolodost.ru

 фукоидан;
фукоидан; Если пациенту до пятидесяти лет, то ему следует принимать по одной капсуле в день;
Если пациенту до пятидесяти лет, то ему следует принимать по одной капсуле в день;