Осведомленность о молочных железах и самообследование молочной железы
Эта информация поможет вам узнать, что такое осведомленность о молочных железах и самообследование молочной железы.
Осведомленность о молочных железах означает понимание того, как должны выглядеть нормальные молочные железы, и какими они должны быть на ощупь. Каждый из нас должен быть осведомлен о состоянии своих молочных желез. Это даст возможность заметить у себя любые изменения в молочных железах. Если вы заметили у себя какие-то изменения, например появление уплотнения или выделений из соска, позвоните своему врачу.
Самообследование молочной железы (breast self-exam (BSE)) — это регулярное обследование своих молочных желез на наличие изменений. Вы можете проводить BSE ежемесячно, время от времени или вовсе его не проводить. Если вы решите не проводить BSE, вам все равно обязательно нужно знать, как должны выглядеть нормальные молочные железы, и какими они должны быть на ощупь.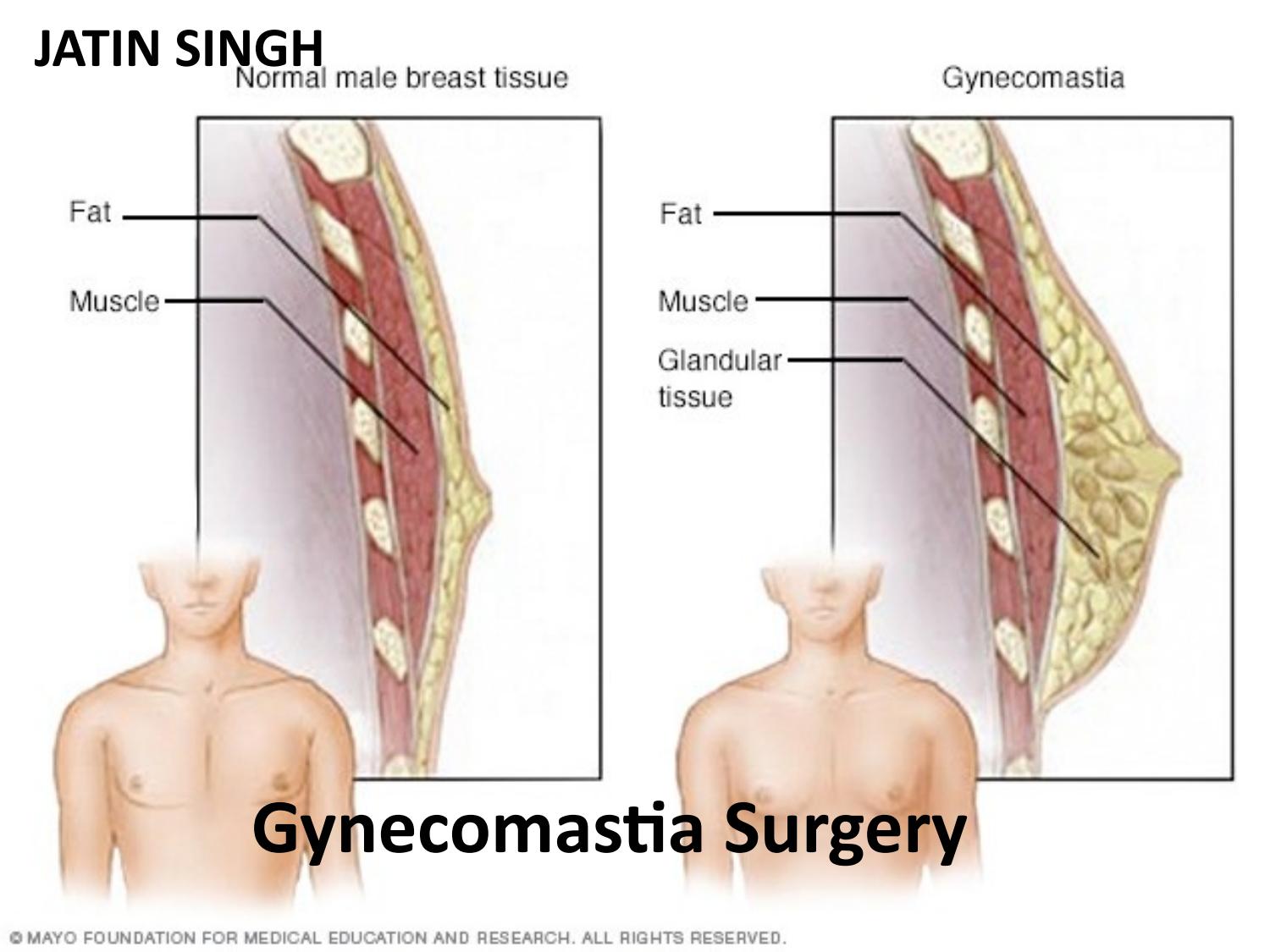
Мужчины с высоким риском развития рака молочной железы (например те, у кого была обнаружена мутация гена предрасположенности к раку молочной железы BRCA), должны проводить BSE с 35 лет.
Если вы увидели или почувствовали на ощупь какое-то изменение в молочной железе, важно не поддаваться панике. В большинстве случаев такие изменения вызваны не раком.
Вернуться к началуКогда нужно проводить BSE
Обследовать молочные железы лучше всего тогда, когда они не болезненные и не опухшие. Если у вас менструация (месячные), желательно сделать самообследование через несколько дней после ее окончания.
Вернуться к началуКак проводить BSE
Перед зеркалом
- Станьте перед зеркалом, обнажив грудь и уперев руки в бедра (см. рисунок 1).
Рисунок 1. Обследование стоя перед зеркалом
- Посмотрите в зеркало и проверьте, нет ли у вас перечисленных ниже изменений в молочных железах (см.
 рисунок 2):
рисунок 2):Рисунок 2. Покраснение и втяжение на молочной железе
- изменение размера, формы или контура;
- втяжение;
- покраснение или шелушение соска или кожи молочной железы;
- выделения из соска.
- Немного поднимите одну руку и осмотрите область подмышки. Прощупайте подмышечную впадину на наличие изменений или уплотнений. Сделайте то же самое в другой подмышечной впадине. Не поднимайте руку прямо вверх — из-за этого ткани в этой зоне натянутся, и их будет труднее обследовать.
Обследование в положении лежа
- Лягте на спину и положите правую руку за голову. Когда вы лежите, ткани молочной железы распространяются вширь максимально тонким слоем, из-за чего их легче полностью прощупать.
- Подушечками трех средних пальцев левой руки прощупайте правую молочную железу на наличие уплотнений (см. рисунки 3 и 4). Делайте это круговыми движениями, описывая перекрывающие друг друга окружности размером с монету и передвигаясь вверх и вниз по молочной железе.

Рисунок 3. Подушечки трех средних пальцев руки
Рисунок 4. Самообследование молочной железы в положении лежа
Вам необходимо будет варьировать силу надавливания в пределах 3 уровней. При прощупывании тканей молочной железы применяйте все 3 уровня силы надавливания в каждой точке, прежде чем переходить к следующей. Если вы не уверены, с какой силой следует надавливать, проконсультируйтесь со своим врачом или медсестрой/медбратом.
- Легкими надавливаниями прощупывайте подкожный слой тканей.
- Надавливаниями средней силы прощупывайте более глубокий слой.
- Сильными надавливаниями прощупывайте ткани, примыкающие к грудной клетке и ребрам. Если по нижнему изгибу каждой молочной железы прощупывается твердая кромка, это нормальное явление.
Рисунок 5. Использование вертикальной схемы для обследования груди
- Затем обследуйте всю молочную железу по восходяще-нисходящей схеме, которую иногда называют вертикальной схемой (см.
 рисунок 5). Начните в области подмышки и понемногу перемещайте пальцы вниз, пока не дойдете до низа грудной клетки. Затем переместите пальцы немного ближе к центру и двигайтесь вверх, пока не дойдете до ключицы. Продолжайте передвигаться по этой схеме, обследуя всю молочную железу до самой середины грудины (также известной как грудная или грудинная кость).
рисунок 5). Начните в области подмышки и понемногу перемещайте пальцы вниз, пока не дойдете до низа грудной клетки. Затем переместите пальцы немного ближе к центру и двигайтесь вверх, пока не дойдете до ключицы. Продолжайте передвигаться по этой схеме, обследуя всю молочную железу до самой середины грудины (также известной как грудная или грудинная кость). - Повторите обследование на левой молочной железе, выполняя его правой рукой.
Если вы заметили какие-либо изменения в молочных железах, позвоните своему врачу.
Вернуться к началуРак груди: не надо бояться маммолога!
Что нужно знать о раке молочной железы: cервис по бесплатному поиску врачей TopDoc.me задал самые важные вопросы высококвалифицированному онкологу-маммологу.
Доктор медицины Ганноверского медицинского института, онколог-маммолог и химиотерапевт Бримова Айгуль Демеугалиевна обучалась не только в Казахстане, но и в нескольких западных странах: Германии, Австрии, США. Айгуль Демугалиевна – действительный член консорциума маммологических центров NCBC США, владеет информацией по новым методам диагностики и лечения доброкачественных и злокачественных заболеваний молочных желез. Принимает доктор в Онкологическом центре томотерапии UMIT в городе Нур-Султан.
Айгуль Демугалиевна – действительный член консорциума маммологических центров NCBC США, владеет информацией по новым методам диагностики и лечения доброкачественных и злокачественных заболеваний молочных желез. Принимает доктор в Онкологическом центре томотерапии UMIT в городе Нур-Султан.
Именно к доктору Бримовой TopDoc.me обратился за актуальной информацией о раке молочной железы (РМЖ).
– Что такое рак молочной железы?
– Рак молочной железы (РМЖ) – это злокачественная опухоль, которая имеет разные типы, отличающиеся как по своему течению, так и по чувствительности к противоопухолевому воздействию. В зависимости от вида опухоли подбирается лечение.
В среднем в Казахстане ежегодно выявляют около 3500 женщин с РМЖ, из которых примерно 1400, к сожалению, умирают – это почти 45%. Пятилетняя выживаемость на сегодня составляет более 54%. Пик заболеваемости приходится на женщин 58-61 года, тем не менее рак выявляется во всех возрастных группах.
И в последнее время прослеживается тенденция омоложения РМЖ, то есть рак может встречаться у женщин до 40 лет.
– Какие факторы повышают риск развития рака молочной железы?
– Во-первых, воздействие радиации, химических веществ, длительное применение гормональных препаратов, контрацептивов, заместительная гормонотерапия, в частности, при менопаузе. Уже есть много исследований, доказывающих связь между длительным применением гормональной заместительной терапии в менопаузе и повышением риска развития РМЖ.
Во-вторых, играет роль образ жизни, такое понятие как повышение социального уровня, приводящее к набору веса, к развитию сахарного диабета, гипертонии – это может спровоцировать заболевание. Помимо них, определенное воздействие оказывают гормональные изменения при менопаузе, при заболеваниях щитовидной железы.
Все эти факторы не обязательно ведут к раку, но при определенных обстоятельствах и при наличии стресса провоцируют появление и развитие злокачественного новообразования.
С развитием технологий стало возможно определение наследственной предрасположенности. Примерно в 10% случаев играет роль наследственный фактор, когда есть ген, передающийся из поколения в поколение. Когда мы видим в одной семье, например, РМЖ у бабушки и у мамы, тогда и дочь будет находиться в группе высокого риска. В лабораториях можно сдать анализ на гены BRCA1 и BRCA2, – это генетический анализ на предрасположенность к раку молочной железы. То есть женщина может узнать, унаследовала ли она этот ген, в связи с которым вероятность развития РМЖ или яичников повышается.
У РМЖ есть несколько подтипов, по которым мы определяем, спровоцирована ли опухоль действием гормонов или связана с мутацией определенных генов. Очень важно для последующего успешного лечения определить статус опухоли, ее биологический подтип.
– Как быстро растет злокачественная опухоль молочной железы?
– Это зависит от вида опухоли, а также играет роль возраст женщины.
В пожилом возрасте опухоль развивается медленно, может расти годами, в течение 5-10 лет. Но если это молодой возраст, до 50 лет, то рост идет быстрее, а до 40 лет – очень агрессивно, может вырасти в течение одного года. Так же быстро опухоль может вырасти у женщины, которая в пре-менопаузе или менопаузе принимает заместительную гормональную терапию (ЗГТ).
– Каковы ранние симптомы РМЖ?
– Ранних симптомов рака молочной железы, к сожалению, нет. Опухоль на ранних стадиях не определяется, нет никаких болей, уплотнений, нет выделений из соска, женщину ничего не беспокоит. Поэтому очень важно, начиная с 40 лет, проходить скрининги, делать маммографию, чтобы была возможность выявить рак на ранней стадии.
Ранний рак можно увидеть только на маммографии. На раннем этапе РМЖ представляет собой сгруппированные микрокальцинаты – это мелкие точки, буквально пылинки, которые можно увидеть только на рентгеновском снимке.
Поэтому я настоятельно рекомендую женщинам, чтобы они проходили скрининг с 40 лет.
И вообще любая девушка, как только начались месячные, должна раз в год посещать маммолога, потому что любые изменения в молочной железе может увидеть и распознать только специалист. Этого будет достаточно, чтобы выявить ту или иную патологию и не дать ей развиться.
– Какие еще симптомы могут появиться при РМЖ?
Если вы обнаружили, что:
- одна грудь визуально стала отличаться от другой;
- появилось покраснение на груди;
- изменился сосок, стал плотным, отечным или втянутым;
- из соска пошла кровь;
- появилась впадинка на коже груди,
надо немедленно обратиться к маммологу.
– Где обычно локализуется рак молочной железы?
– Локализация может быть в любой части молочной железы, и даже может встречаться за пределами молочной железы, например в подмышечной области, или выше груди, между ребрами.
Во время скрининга такую опухоль, расположенную вне молочной железы, можно не увидеть, так как она не попадает в зону снимка. И поэтому еще раз повторюсь, что раз в год нужно ходить к маммологу, так как врач прощупывает и молочную железу, и все зоны вокруг и может определить образование.
– Айгуль Демеугалиевна, сейчас большой процент женщин страдает мастопатиями. Может ли мастопатия перейти в рак?
– Мастопатия – это гормональная дисфункция молочных желез, для которого характерно изменение в гормональном статусе женщин. Эти изменения могут сочетаться с другими гормональными изменениями, например могут быть дисфункции щитовидной железы – гипотиреоз или гипертиреоз, могут быть кисты, миомы, эндометриозы, полипы – это все может вызвать изменения в молочной железе, которые требуют консервативного лечения.
Говорить, что мастопатия может вызвать рак – неправильно. Сама мастопатия рак не вызывает, но в организме женщины могут быть клетки, которые при определенных обстоятельствах мутируют, начинают быстро развиваться и перерождаться в злокачественную опухоль.

Раковые клетки есть в организме любого человека, они появляются ежедневно, но наша иммунная система распознает их и уничтожает. Если произошел сбой иммунной системы, раковые клетки начинают беспрепятственно расти и воспринимаются организмом как свои.
– Куда идут метастазы при раке молочной железы?
– Чаще всего метастазы при РМЖ появляются в лимфатических узлах, костях, печени, легких, головном мозге и яичниках – это органы мишени. Самыми первыми реагируют лимфатические узлы, поэтому их надо проверять в первую очередь. Обычно делается пункция или во время операции делается биопсия так называемого «сторожевого» узла, самого ближнего к опухоли, который берет на себя всю нагрузку, пытается бороться с раковыми клетками.
– Как строится лечение РМЖ?
– На мультидисциплинарном консилиуме, куда входят хирурги, химиотерапевты, радиационные онкологи, гистологи и другие специалисты, выставляется диагноз – рак молочной железы.
Мы все вместе обсуждаем каждый случай, исходя из данных подтипа опухоли, учитываются найденные у пациента мутации генов. Благодаря молекулярно-генетическому анализу, смотрим какие мутации есть и чем они спровоцированы, как можно на них воздействовать. Генетики дают заключение по мутациям в генах и по их чувствительности к определенным препаратам. Применяя эти результаты, индивидуально для данного человека подбирается лечение.
Оптимально для пациента составляется план лечения: либо это хирургическое удаление опухоли и сторожевого узла, либо сначала проводится химиотерапия. Например, мы приняли решение провести химиотерапию перед операцией, чтобы уменьшить размеры опухоли и затем сделать органосохраняющую операцию. Проводя химиотерапию до операции, мы тем самым проводим профилактику развития метастазов, то есть до операции мы уже убиваем раковые клетки, циркулирующие в крови. На сегодняшний день есть исследования, что уже при нулевой стадии некоторых видов рака идет выброс раковых клеток в кровь.
Здесь речь идет о прогнозе жизни для каждого отдельного пациента. Проводится оценка эффективности проведенного лечения и затем проводится хирургическая операция по удалению опухоли.
РМЖ и любой другой рак требует именно мультидисциплинарного подхода – так как при злокачественных новообразованиях идет поражение не только одного органа, вовлекается весь организм.
– Какие побочные эффекты могут быть от лучевой терапии при РМЖ?
– Зачастую происходят ожоги на коже. При облучении молочной железы в процесс могут вовлекаться легкие, сердце, пищевод. В легких в результате может развиться фиброз, при котором появляется одышка при самых незначительных нагрузках. Страдает сердце, может появится аритмия.
– Какие преимущества дает томотерапия в лечение рака молочной железы?
– Такой вид лучевого лечения, как томотерапия, имеет важные преимущества: идет облучение фотонами, и есть визуализация опухоли компьютерной томографией.
Томоаппарат создает трехмерное изображение опухоли, точно определяются ее размеры, форма и локализация. Это позволяет, во-первых, с большой точностью доставить нужную дозу облучения к опухоли. И во-вторых, за счет спирального облучения идет воздействие на опухоль со всех проекций, вся опухоль равномерно подвергается лучевому воздействию.
Целенаправленно облучается только то место, которое нужно облучить, только туда идет доставка луча без вовлечения соседних органов и тканей. Опухоль облучается более аккуратно и бережно, и, конечно, это дает меньше осложнений.
Томотерапия более безопасна, воздействует более щадяще. Женщина получает полноценное эффективное лечение и при этом качество ее жизни не страдает. Лечение томотерапией – амбулаторное, то есть пациентка имеет возможность сохранять социальную активность.
Онкологический центр томотерапии UMIT предоставляет возможность оформить квоту на лечение томотерапией. Подробнее о том, как оформить квоту, читайте в интервью с директором центра Ержаном Мукатаевичем Шаяхметовым.
Подробнее о том, как оформить квоту, читайте в интервью с директором центра Ержаном Мукатаевичем Шаяхметовым.
– Сколько живут после лечения рака молочной железы? Можно ли полностью излечиться?
– Нулевая и первая стадия РМЖ излечивается на 100%. Если у женщины уже третья-четвертая стадия, то результаты гораздо хуже. По статистке пятилетняя выживаемость (пять лет жизни после постановки диагноза) составляет 54-55%.
Здесь мы снова возвращаемся к необходимости скрининга. К сожалению, плохая посещаемость скринингов – это наша слабая сторона. О своем здоровье у нас начинают думать, когда уже становится поздно.
– Но в других странах бывает наоборот. Например, известный случай с киноактрисой Анджелиной Джоли – она профилактически удалила молочные железы и яичники. Насколько это оправдано?
– Все женщины, у которых есть генетические мутации генов BRCA1 и BRCA2 – у них высокая вероятность развития РМЖ.
Джоли, удалив органы, снизила вероятность развития РМЖ, но нельзя сказать, что она полностью исключила вероятность рака. Могут остаться единичные клетки молочной железы в грудной клетке, и при наличии данной мутации есть вероятность развития рака. Поэтому посещение маммолога и прохождение маммографии (доступной и бесплатной) все равно обязательно для всех женщин.
– Некоторые женщины опасаются проходить маммографию, считая, что это ненужное облучение.
– Такой страх не оправдан. Маммография – это рентгенография молочной железы, делается в двух проекциях. Почти везде сейчас стоят аппараты цифровой рентгенографии, у них лучевая нагрузка гораздо ниже, чем, например, у флюорографии, а разрешение очень высокое. С 40 лет каждая женщина должна проходить маммографию, так как с этого возраста риск РМЖ повышается в два раза.
Более молодым женщинам до 40 лет маммографию не делают, так как у них структура молочной железы другая, более плотная, и маммография менее информативна.
Они проходят УЗИ обследование.
– Айгуль Демугалиевна, давайте развеем пару мифов, которые часто обсуждаются среди женщин. Правда ли, что использование дезодорантов-стиков приводит к РМЖ за счет накопления оксида алюминия в лимфоузлах? Еще говорят, тесные бюстгальтеры с косточками могут привести к раку.
– Ни одно исследование не доказало, что использование дезодорантов может привести к развитию РМЖ. То же самое про тесные бюстгальтеры на косточках. Статистически достоверных научных данных нет. Конечно, нужно, чтобы белье было по размеру и не тесным, желательно хлопчатобумажным, это более гигиенично.
– Влияют ли грудные импланты на развитие онкологических заболеваний?
– Сами импланты не приводят к раку. Но если произошло повреждение импланта и его содержимое вытекло, то в отдельных случаях это может вызвать развитие лимфомы – злокачественного заболевания крови.

Женщины с имплантами должны в обязательном порядке не реже одного раза в год проходить осмотры у маммолога. Риск в том, что могут быть микротравмы, не ощущаемые женщиной.
– Могут ли влиять частые аборты на возникновение проблем в молочной железе?
– Конечно. Аборты вызывают изменения в молочной железе. Когда женщина беременеет, у нее начинается подготовка к лактации, идет выработка определенных гормонов. Аборт – это грубое вмешательство в гормональную сферу, которое не проходит бесследно для молочной железы.
– Бывает ли рак грудной железы у мужчин?
– Бывает. Но очень редко и обычно он связан с наличием гена BRCA1 и/или BRCA2. Здесь нужно смотреть всю семью, обычно у мамы или у сестры есть ген рака или же рак молочной железы. Мужчины с раком грудной железы проходят такую же процедуру обследования и лечения, как и женщины.

– У некоторых мальчиков в пубертатном периоде бывает набухание груди. Почему это происходит?
– Это связано с образом жизни подростка, продуктами, которые он потребляет, в которых может быть высокое содержание эстрогенов. Также возможна связь с заболеваниями щитовидной железы, патологиями желчного пузыря, печени, которые могут привести к выработке женских гормонов. В таких случаях мы работаем вместе с эндокринологами и гастроэнтерологами.
Не нужно считать, что проблема с молочными железами – это проблема только женщин. Проблемы с грудными железами бывают у мужчин тоже, и у мальчиков. Поэтому надо быть настороже. Увидели какую-то шишку у мальчика или у мужчины – сразу к маммологу.
– Айгуль Демугалиевна, что бы вы хотели сказать женщинам?
– Не нужно боятся ходить к маммологу. К сожалению, зачастую, если женщина обнаруживает в груди образование, она боится идти к врачу.
Но таким поведением, стремлением спрятаться от проблемы – они усугубляют течение болезни и ухудшают прогноз.
При малейших симптомах – что-то вам показалось в груди необычным, странным, что-то заболело – обратитесь сразу к маммологу. Любую патологию лучше предупредить заранее, чем потом лечить на поздних стадиях. Рак на поздней стадии, с распадом, с метастазами, лечить гораздо труднее, лечение переносится очень тяжело и физически, и морально, и социально.
Когда в семье женщина болеет РМЖ – страдает вся семья, все вовлекаются в это процесс. Поэтому мы работаем совместно с психиатрами, которые знают специфику онкологических заболеваний, они консультируют женщин в процессе лечения. У многих пациенток бывает депрессия, могут быть суицидальные мысли, может быть разлад в семье. Поэтому в лечение РМЖ надо подходить комплексно, это проблема не только одного человека.
Доктор Айгуль Демугалиевна Бримова принимает в Онкологическом центре томотерапии UMIT в городе Нур-Султан. Записаться на прием можно, оставив заявку на сайте или позвонив по телефону +7-707-22-55-009.
Записаться на прием можно, оставив заявку на сайте или позвонив по телефону +7-707-22-55-009.
проблема в гормонах — Кыштымская ЦГБ
Up one levelНелактационный мастит чаще всего возникает в период гормональных нарушений. Например, он достаточно часто возникает у женщин в период климакса и менопаузы, а также у подростков (как у девочек, так и у мальчиков), что связано как с гормональными изменениями, так и с нарушениями иммунитета. Что такое нелактационный мастит и почему он может возникать?
Нелактационный мастит — это воспалительный процесс в молочной железе, который начался вне периода кормления ребенка грудью (лактации). Такие маститы встречаются гораздо реже, чем лактационные. Причины их могут быть разными, но в основном они связаны с гормональными нарушениями и со снижением иммунитета.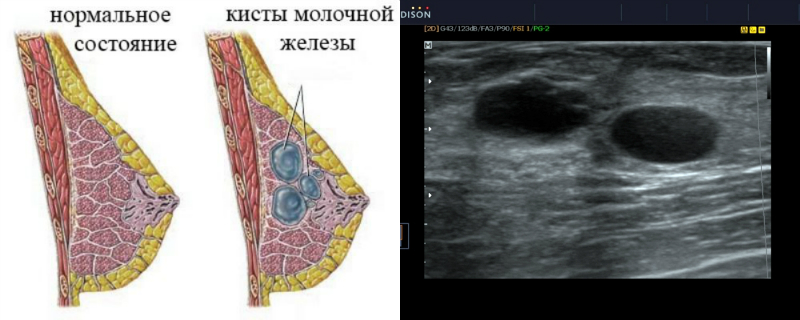 Например, такие маститы часто возникают при снижении гормонального фона у женщин. Снижение выработки женских половых гормонов начинается после 45 лет, тогда же начинается период климакса, в 50 — 55 лет обычно наступает менопауза. В этот период времени женщина становится очень чувствительной к любой инфекции.
Например, такие маститы часто возникают при снижении гормонального фона у женщин. Снижение выработки женских половых гормонов начинается после 45 лет, тогда же начинается период климакса, в 50 — 55 лет обычно наступает менопауза. В этот период времени женщина становится очень чувствительной к любой инфекции.
У девочек-подростков ткань молочной железы под влиянием эстрогенов увеличивается, но, как правило, быстрый рост и развитие организма приводят к снижению иммунитета, все это может быть причиной возникновения мастита. По этой же причине маститы могут возникать и у мальчиков. К возникновению мастита могут привести любые заболевания, которые вызывают снижение иммунитета: сахарный диабет, любые хронические, длительно протекающие инфекции, заболевания обмена веществ. Во всех этих случаях инфекция может попасть в ткань молочной железы через мелкие ссадины на коже или в области сосков, а также с током крови из других очагов инфекции.
Наконец, достаточно часто нелактационный мастит является следствием оперативных вмешательств на молочных железах, например, при внесении инфекции в рану после удаления доброкачественной опухоли.
Признаки нелактационного мастита
Нелактационный мастит обычно протекает не так тяжело, как лактационный. Тем не менее, процесс нельзя запускать, так как он может перейти в острый гнойный и состояние резко осложнится. Острый процесс также может стихнуть и перейти в хронический с периодическими обострениями.
Острый нелактационный мастит начинается с появления припухлости и болезненности в области молочной железы. Иногда почти сразу увеличиваются и становятся болезненными подмышечные лимфатические узлы. Боли могут быть как незначительными, так и очень сильными, настолько, что трудно поднять руку. Это состояние, если вовремя обратиться к врачу, хорошо поддается лечению.
Но можно и не заметить, как процесс перейдет в гнойный, в таком случае поднимается высокая температура, боли становятся тянущими и дергающими, в области молочной железы появляется покраснение, увеличивается отек и врач во время осмотра может обнаружить признаки появления жидкости в месте воспаления. Все эти симптомы говорят о наличии нагноения и необходимости экстренной помощи.
Все эти симптомы говорят о наличии нагноения и необходимости экстренной помощи.
Хронический мастит часто появляется у женщин в климактерическом периоде и во время менопаузы. Он может быть также исходом острого мастита. Температура тела при этом заболевании может быть нормальной или слегка повышенной. Молочная железа увеличена в размере в месте воспаления, иногда в этом месте может быть покраснение и втяжение кожи. Если хронический процесс начался после острого, то можно увидеть свищи (каналы, соединяющие полость с гноем с поверхностью кожи) со скудным гнойным отделяемым. Подмышечные лимфатические узлы увеличены. В некоторых случаях проявления хронического мастита похожи на рак молочной железы.
Диагностика нелактационного мастита
Нелактационный мастит имеет характерные проявления, и если вовремя обратиться к врачу, то он их, безусловно, увидит. Подтвердить мастит можно при помощи ультразвукового исследования, посева выделений из сосков или из свищей на питательные среды (микробиологическое исследование), а также в некоторых случаях и путем взятия кусочка ткани для лабораторного исследования (биопсии).
Кроме того, проводится полное обследование пациента с целью выявления основного заболевания, которое могло привести к нарушению гормонального фона или к снижению иммунитета.
Лечение нелактационного мастита
Лечение острого нелактационного мастита зависит от фазы заболевания. В начальной фазе, когда еще не началось формирование гнойника, лечение проводится консервативно: назначаются антибиотики с учетом чувствительности к ним возбудителей инфекции, молочной железе создается покой и возвышенное положение. При абсцедировании мастита проводится операция вскрытия гнойника.
Профилактика нелактационных маститов заключается в своевременном обращении к врачу при любых изменениях в молочных железах, а также в лечении всех заболеваний, которые могут привести к снижению иммунитета и нарушению гормонального фона.
Источник:www.womenclub.ru
Уплотнение в подмышечной области: стоит ли бить тревогу
Образования в подмышечной области часто вызывают беспокойство у женщин – сразу на ум приходит самое плохое. Онколог-маммолог Надежда Ивановна Рожкова в эфире канала «Россия 1» рассказала, что это нечастое явление, но при регулярном самообследовании женщины порой обнаруживают уплотнения. Какие же причины у этого явления и стоит ли бить тревогу?
Онколог-маммолог Надежда Ивановна Рожкова в эфире канала «Россия 1» рассказала, что это нечастое явление, но при регулярном самообследовании женщины порой обнаруживают уплотнения. Какие же причины у этого явления и стоит ли бить тревогу?
Гидраденит, в народе сучье вымя, как правило, проявляет себя в летнее время. Его может спровоцировать, например, слишком частое использование дезодоранта, неудобная тесная одежда. Воспаление потовых желез может сопровождаться температурой и ознобом. Соблюдайте личную гигиену, и эта проблема обойдет вас стороной.
Воспаление лимфатического узла дает болевые ощущения, может быть покраснение, температура. Здесь необходимо сделать УЗИ, причина заболевания может быть любой (аллергия, фурункулез), в том числе той, которой мы боимся.
Туберкулез – хоть и редкая, но тоже причина возникновения уплотнений в подмышечной впадине.
Рак молочной железы не дает ни боли, ни покраснений – исключительно уплотнение. В этом случае женщина должна забить тревогу и сделать УЗИ. Идеально – сразу после завершения менструации. В группе риска – женщины старше 40 лет, женщины с избыточным весом и плохой наследственностью. Прием оральных контрацептивов и роды после 30-40 лет – также факторы риска. Но нерожавшие и некормившие женщины также подвергаются опасности. Важный момент – травмы и ушибы, они усугубляют проблемы с молочной железой. Психоэмоциональный настрой тоже влияет на состояние груди и лимфоузлов. Хронические и острые стрессовые ситуации в корне меняют гормональный баланс. Будьте спокойны, учитесь снимать стресс, живите с удовольствием, и все будет хорошо!
В этом случае женщина должна забить тревогу и сделать УЗИ. Идеально – сразу после завершения менструации. В группе риска – женщины старше 40 лет, женщины с избыточным весом и плохой наследственностью. Прием оральных контрацептивов и роды после 30-40 лет – также факторы риска. Но нерожавшие и некормившие женщины также подвергаются опасности. Важный момент – травмы и ушибы, они усугубляют проблемы с молочной железой. Психоэмоциональный настрой тоже влияет на состояние груди и лимфоузлов. Хронические и острые стрессовые ситуации в корне меняют гормональный баланс. Будьте спокойны, учитесь снимать стресс, живите с удовольствием, и все будет хорошо!
Врачи назвали симптомы рака у детей — РБК
Фото: Кирилл Зыков / АГН «Москва»
Слабость, снижение веса, бледность, потеря массы тела, снижение упругости кожи могут быть признаками онкологических заболеваний у детей, рассказал РБК советник директора НИИ детской онкологии и гематологии НМИЦ онкологии им. Н.Н. Блохина, академик РАН Владимир Поляков.
Н.Н. Блохина, академик РАН Владимир Поляков.
«К сожалению, специфических признаков злокачественного новообразования нет. Есть общий опухолевый симптомокомплекс: появляется вялость, плаксивость, снижение массы тела, наблюдается снижение тургора [упругости] кожи, бледность кожных покровов, постоянное недомогание. На первых порах эти признаки пропускают и расценивают как простудное заболевание. А потом оказывается, что у ребенка уже далеко зашедший опухолевый процесс», — объяснил он.
По словам другого детского онколога, доктора медицинских наук Игоря Долгополова, о наличии опухоли также могут свидетельствовать изменения в поведении детей, хромота, тошнота и рвота по утрам, головные боли. «В этом случае, конечно, нужно срочно обратиться к врачу и пройти комплекс обследования: анализ крови, офтальмолог, УЗИ брюшной полости и другие исследования, чтобы исключить онкологическое заболевание», — отметил он.
Долгополов уточнил, что рак у детей принципиально отличается от злокачественных опухолей у взрослых. Если у взрослых онкологические заболевания являются приобретенными, могут быть связаны с вредными условиями труда, образом жизни, то большая часть онкозаболеваний у детей врожденные, связанные с нарушениями развития плода. Кроме того, злокачественные опухоли у детей всегда развиваются очень быстро.
Если у взрослых онкологические заболевания являются приобретенными, могут быть связаны с вредными условиями труда, образом жизни, то большая часть онкозаболеваний у детей врожденные, связанные с нарушениями развития плода. Кроме того, злокачественные опухоли у детей всегда развиваются очень быстро.
«Все детские опухоли быстро растущие и агрессивные. У взрослых есть понятие «рак средней степени злокачественности», «низкой степени». А у детей всегда только высокой степени. С одной стороны, это беда. С другой — благо, потому что чем быстрее растет опухоль, тем чувствительнее она к химиотерапии, потому что химиотерапия больше воздействует на быстро делящиеся клетки. А поскольку дети еще не накопили болезней, как взрослые — ни диабета, ни гипертонии, то мы можем позволить себе лечить их интенсивно и получать прекрасные результаты», — считает врач.
Поражения молочных желез у детей и подростков: диагностика и лечение
Korean J Radiol. 2018 сен-октябрь; 19(5): 978–991.
Eun Ji Lee
Департамент радиологии, Brinchunhyang Университетская больница Сеула, Сеул 04401, Корея.
Yun-Woo Chang
Отделение радиологии, Сеульский госпиталь Университета Сунчунхян, Сеул 04401, Корея.
Jung Hee Oh
Отделение радиологии, Сеульская больница Университета Сунчунхян, Сеул 04401, Корея.
Jiyoung Hwang
Отделение радиологии, Сеульская больница Университета Сунчунхян, Сеул 04401, Корея.
Seong Sook Hong
Отделение радиологии, Сеульская больница Университета Сунчунхян, Сеул 04401, Корея.
Hyun-joo Kim
Отделение радиологии, Сеульская больница Университета Сунчунхян, Сеул 04401, Корея.
Отделение радиологии, Сеульская больница Университета Сунчунхян, Сеул 04401, Корея.
Автор, ответственный за переписку. Автор, ответственный за переписку: Юн-Ву Чанг, доктор медицинских наук, отделение радиологии, Сеульский госпиталь Университета Сунчунхян, 59 Тэсагван-ро, Йонсан-гу, Сеул 04401, Корея. Тел.: (822) 709-9396, факс: (822) 709-3928, rk.ca.cmhcs@gnahcwy
Автор, ответственный за переписку: Юн-Ву Чанг, доктор медицинских наук, отделение радиологии, Сеульский госпиталь Университета Сунчунхян, 59 Тэсагван-ро, Йонсан-гу, Сеул 04401, Корея. Тел.: (822) 709-9396, факс: (822) 709-3928, rk.ca.cmhcs@gnahcwyПоступила в редакцию 25 января 2018 г.; Принято 4 апреля 2018 г.
Copyright © Корейское общество радиологии, 2018 г.org/licenses/by-nc/4.0/), который разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы. Эта статья цитировалась в других статьях PMC.Abstract
Заболевания молочной железы у детей встречаются редко, а первичная карцинома молочной железы у детей встречается крайне редко. Таким образом, подход, используемый для лечения поражений молочной железы у детей, во многом отличается от такового у взрослых. Знание нормальных особенностей визуализации на различных стадиях развития и характеристик заболевания молочной железы у детей может помочь рентгенологу поставить уверенный диагноз и надлежащим образом вести пациентов.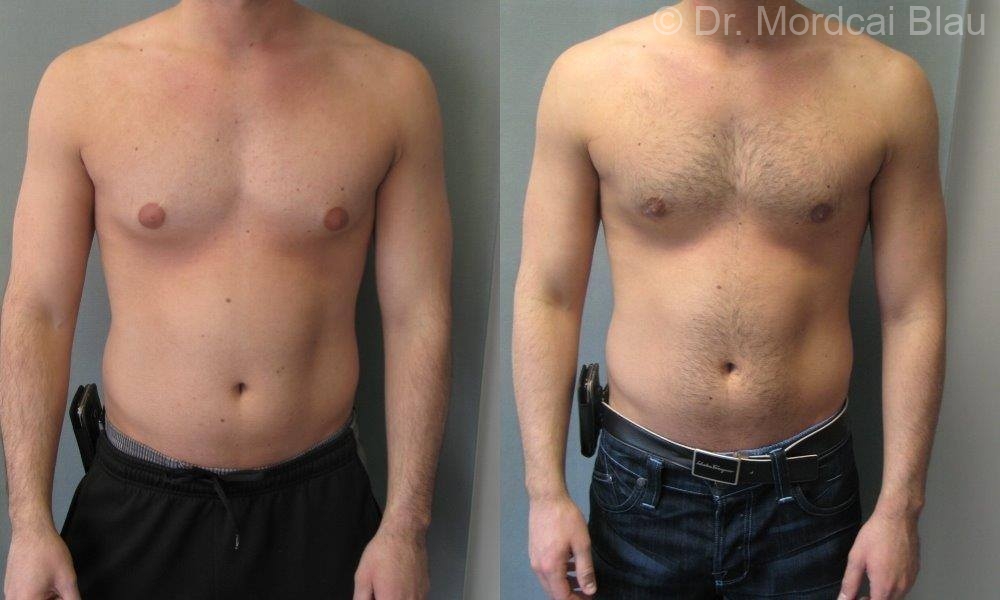 Большинство заболеваний молочной железы у детей доброкачественные или связаны с развитием молочной железы, что предполагает необходимость консервативного лечения. Интервенционные процедуры могут повлиять на развивающуюся грудь и показаны только в ограниченном числе случаев. Гистологическое исследование должно быть выполнено у детей, принимая во внимание размер поражения и историю болезни вместе с данными визуализации. Биопсия толстой иглы полезна для точной диагностики и предотвращения непоправимого повреждения у педиатрических пациентов.Биопсию следует рассматривать в случае аномальных результатов визуализации, таких как неотграниченные края, сложные солидные и кистозные компоненты, задняя акустическая тень, размер более 3 см или увеличение размера новообразования. Клинический анамнез, который включает фактор риска злокачественности, такой как предшествующее облучение грудной клетки, известный сопутствующий рак, не поражающий молочные железы, или семейный анамнез рака молочной железы, должен побудить к рассмотрению вопроса о биопсии, даже если поражение имеет вероятно доброкачественный вид на УЗИ.
Большинство заболеваний молочной железы у детей доброкачественные или связаны с развитием молочной железы, что предполагает необходимость консервативного лечения. Интервенционные процедуры могут повлиять на развивающуюся грудь и показаны только в ограниченном числе случаев. Гистологическое исследование должно быть выполнено у детей, принимая во внимание размер поражения и историю болезни вместе с данными визуализации. Биопсия толстой иглы полезна для точной диагностики и предотвращения непоправимого повреждения у педиатрических пациентов.Биопсию следует рассматривать в случае аномальных результатов визуализации, таких как неотграниченные края, сложные солидные и кистозные компоненты, задняя акустическая тень, размер более 3 см или увеличение размера новообразования. Клинический анамнез, который включает фактор риска злокачественности, такой как предшествующее облучение грудной клетки, известный сопутствующий рак, не поражающий молочные железы, или семейный анамнез рака молочной железы, должен побудить к рассмотрению вопроса о биопсии, даже если поражение имеет вероятно доброкачественный вид на УЗИ.
Ключевые слова: Детская молочная железа, Ребенок, Подростковый возраст, Нормальное развитие, Фиброаденома, Гинекомастия, Киста, Опухоль Филлода, Сонография
ВВЕДЕНИЕ
Поражения молочной железы у детей и подростков встречаются редко и отличаются от заболеваний молочной железы у взрослых в нескольких отношениях. Во-первых, заболевания молочных желез у детей и подростков включают преимущественно доброкачественные образования, связанные с нормальным развитием молочной железы, и доброкачественные опухоли. Во-вторых, злокачественные новообразования у детей и подростков встречаются очень редко (1,2,3,4,5).Рак молочной железы у подростков составляет 0,1% всех случаев рака груди и менее 1% всех случаев рака у детей (1,2,3,6). В-третьих, подходы к клинической визуализации, используемые для лечения поражений молочной железы у детей и подростков, отличаются от тех, которые используются для раннего выявления рака молочной железы у взрослых, учитывая, что у детей и подростков редко бывают злокачественные образования (1,2,3,7,8). Учитывая эти различия, лечение заболеваний молочной железы у детей и подростков должно отличаться от такового у взрослых.
Учитывая эти различия, лечение заболеваний молочной железы у детей и подростков должно отличаться от такового у взрослых.
Большинство поражений молочных желез у детей лечат консервативно.Интервенционное лечение может повлиять на развитие зачатков молочной железы у детей и подростков, поэтому его следует рекомендовать с осторожностью на основании клинических и визуализационных особенностей (1,2,7).
Рентгенологи должны быть осведомлены о характеристиках заболеваний молочных желез у детей и признавать различия между детьми и взрослыми для целей надлежащей оценки и лечения. В данной статье мы рассматриваем дифференциальную диагностику поражений молочной железы у детей и подростков, в том числе развитие доброкачественных и злокачественных заболеваний, и даем рекомендации по их лечению.
Визуализирующая оценка молочной железы у детей
Визуализирующая оценка молочной железы у взрослых проводится для ранней диагностики рака молочной железы. Маммография позволяет диагностировать злокачественное заболевание с микрокальцинатами; следовательно, это первая модальность визуализации. Однако маммографию обычно не проводят в педиатрической популяции, потому что молочные железы у развивающихся подростков очень чувствительны к ионизирующему излучению, а у подростков плотная грудь с обильной фиброзно-железистой тканью.Таким образом, ультразвуковое исследование (УЗИ) является предпочтительным методом, поскольку оно позволяет обнаружить поражения в плотных тканях молочной железы и не подвергает детей ионизирующему излучению (1, 2, 7, 8). При проведении УЗИ молочных желез у девочек и подростков следует помнить о психологических проблемах, которые могут болезненно реагировать на обследования молочных желез, поэтому им требуется соответствующий скрининг с обеспечением уверенности и комфорта. УЗИ можно проводить с помощью линейного датчика высокого разрешения 15–17 МГц. Полезным ориентиром для определения задней границы молочной железы является грудная мышца (1,3).Рентгенологи должны знать подводные камни, связанные с нормальными анатомическими структурами, видимыми на УЗИ. Ребро или сосок могут быть ошибочно приняты за аномальное поражение.
Однако маммографию обычно не проводят в педиатрической популяции, потому что молочные железы у развивающихся подростков очень чувствительны к ионизирующему излучению, а у подростков плотная грудь с обильной фиброзно-железистой тканью.Таким образом, ультразвуковое исследование (УЗИ) является предпочтительным методом, поскольку оно позволяет обнаружить поражения в плотных тканях молочной железы и не подвергает детей ионизирующему излучению (1, 2, 7, 8). При проведении УЗИ молочных желез у девочек и подростков следует помнить о психологических проблемах, которые могут болезненно реагировать на обследования молочных желез, поэтому им требуется соответствующий скрининг с обеспечением уверенности и комфорта. УЗИ можно проводить с помощью линейного датчика высокого разрешения 15–17 МГц. Полезным ориентиром для определения задней границы молочной железы является грудная мышца (1,3).Рентгенологи должны знать подводные камни, связанные с нормальными анатомическими структурами, видимыми на УЗИ. Ребро или сосок могут быть ошибочно приняты за аномальное поражение. На поперечном сканировании хрящевая часть ребра может имитировать массу молочной железы. Ребро, расположенное кзади в грудной мышце, имеет сильную заднюю акустическую тень, выглядящую как удлиненное поражение при продольном сканировании. Иногда пациенты жалуются на выраженное реберно-хрящевое соединение в виде пальпируемого образования (1). Связки Купера, которые являются нормальными структурами, имеют заднюю тень.Любая из этих структур может быть ошибочно истолкована как аномалия. Такие данные на УЗИ можно идентифицировать как нормальные, убрав заднюю тень, регулируя угол датчика и контролируя силу нажатия (1,8). Сосок также создает сильную заднюю акустическую тень и может быть неправильно истолкован как субареолярное образование. Соответствующее сжатие и наклон датчика могут устранить заднюю акустическую тень, позволяя легко распознать анатомическую структуру как нормальную при УЗИ в реальном времени.Жировая долька иногда видна как изоэхогенная твердая масса, особенно в паренхиме молочной железы.
На поперечном сканировании хрящевая часть ребра может имитировать массу молочной железы. Ребро, расположенное кзади в грудной мышце, имеет сильную заднюю акустическую тень, выглядящую как удлиненное поражение при продольном сканировании. Иногда пациенты жалуются на выраженное реберно-хрящевое соединение в виде пальпируемого образования (1). Связки Купера, которые являются нормальными структурами, имеют заднюю тень.Любая из этих структур может быть ошибочно истолкована как аномалия. Такие данные на УЗИ можно идентифицировать как нормальные, убрав заднюю тень, регулируя угол датчика и контролируя силу нажатия (1,8). Сосок также создает сильную заднюю акустическую тень и может быть неправильно истолкован как субареолярное образование. Соответствующее сжатие и наклон датчика могут устранить заднюю акустическую тень, позволяя легко распознать анатомическую структуру как нормальную при УЗИ в реальном времени.Жировая долька иногда видна как изоэхогенная твердая масса, особенно в паренхиме молочной железы. Однако жировую дольку можно рассматривать как нормальную структуру, если вращать датчик и подтверждать ее интеграцию с окружающей нормальной жировой тканью (9).
Однако жировую дольку можно рассматривать как нормальную структуру, если вращать датчик и подтверждать ее интеграцию с окружающей нормальной жировой тканью (9).
A. На ультразвуковом изображении при сканировании пальпируемой области видно нормальное хостохондральное соединение. Обратите внимание, что ребро расположено позади грудной мышцы (стрелка), демонстрируя заднюю акустическую тень (стрелка).В паренхиме молочной железы аномалий не отмечается. B. Обзорная рентгенограмма грудной клетки, показывающая расщепление левого пятого ребра в реберно-хрящевом соединении, что свидетельствует о раздвоении ребра (стрелка).
При использовании компьютерной томографии для обследования заболеваний грудной клетки у педиатрических пациентов поражения молочной железы могут быть обнаружены случайно () (1,2). Магнитно-резонансная томография (МРТ) молочной железы не так широко используется у детей, но может облегчить хирургическое планирование и выявление сосудистых или лимфатических аномалий в различных анатомических областях (1, 2, 8). Как и у взрослых, у детей грудные образования можно оценить морфологически и гемодинамически с помощью МРТ молочных желез.
Как и у взрослых, у детей грудные образования можно оценить морфологически и гемодинамически с помощью МРТ молочных желез.
A. КТ показывает увеличивающееся образование в левой молочной железе (стрелка). B. Ультрасонографическое изображение показывает, вероятно, доброкачественное образование в левой молочной железе, которое коррелирует с результатами КТ. Этот пациент наблюдался без патологического подтверждения, вероятно, доброкачественного образования. КТ = компьютерная томография
Находки у однодневного мальчика с пальпируемым образованием в правом боковом отделе грудной клетки. A. Ультрасонографическое изображение показало кисту с тонкой перегородкой, предполагающую лимфангиому. B. Т2-взвешенное МРТ-изображение с подавлением жира, показывающее лимфангиому с высокой интенсивностью сигнала с тонкими перегородками. C. Т1-взвешенное МРТ-изображение, показывающее двустороннюю пролиферацию железистой ткани в субареолярной области, связанную с физиологически увеличенной железистой тканью под влиянием материнских гормонов. МР = магнитный резонанс
C. Т1-взвешенное МРТ-изображение, показывающее двустороннюю пролиферацию железистой ткани в субареолярной области, связанную с физиологически увеличенной железистой тканью под влиянием материнских гормонов. МР = магнитный резонанс
Нормальное развитие молочной железы
Женская грудь проходит две стадии развития.Первая стадия начинается на 5-6 неделе внутриутробного развития. Эпидермальные клетки инвагинируют, и первичный грудной гребень начинает расти от обеих подмышечных впадин к паховой области. Инволюция молочных линий происходит за исключением уровня четвертого межреберья, где формируются нормальные грудные зачатки. Оставшиеся грудные зачатки в четвертом межреберье развиваются во вторичные зачатки, а затем в ветвящиеся млечные протоки в паренхиме молочной железы. На поверхности кожи над грудными зачатками образуется небольшая молочная ямка, которая далее развивается в сосково-ареолярный комплекс (1,2,3,7,8).Двусторонние субареолярные узелки часто встречаются у новорожденных.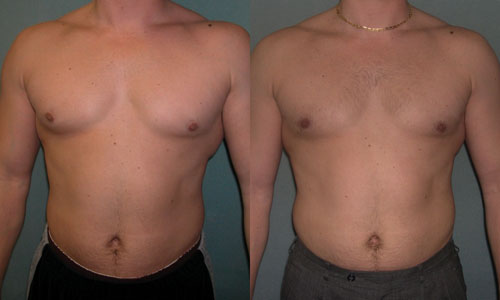 Это временные проявления физиологического клиновидного развития в ответ на материнские гормоны, которые исчезают в течение 12 мес. Грудные зачатки часто асимметричны по размеру и на первой стадии развития выглядят сгруппированными. Одностороннее развитие молочной железы может иметь вид субареолярного уплотнения молочной железы (1,2,3,7,8,10).
Это временные проявления физиологического клиновидного развития в ответ на материнские гормоны, которые исчезают в течение 12 мес. Грудные зачатки часто асимметричны по размеру и на первой стадии развития выглядят сгруппированными. Одностороннее развитие молочной железы может иметь вид субареолярного уплотнения молочной железы (1,2,3,7,8,10).
Вторая стадия развития происходит в подростковом возрасте и известна как телархе.Гормоны влияют на развитие молочных желез у девочек-подростков. Гормоны эстрогена участвуют в удлинении и дифференцировке протоков, тогда как гормоны прогестерона способствуют развитию терминальных долек. Средний возраст начала телархе составляет 9,8 лет. Преждевременное телорхе определяется как начало до 8 лет, а отсроченное телорхе определяется как начало после 13 лет (1, 2, 3, 8, 11). Раннее развитие груди может происходить отдельно или в связи с преждевременным половым созреванием.Идиопатическое преждевременное телорхе может возникать у девочек в возрасте 1–3 лет; это не связано с преждевременным половым созреванием и обычно регрессирует, поэтому достаточно успокоить пациента и ухаживающего за ним человека (). Когда на УЗИ выявляются гипоэхогенные субареолярные зачатки молочной железы без других признаков преждевременного полового созревания, клинического наблюдения достаточно, и дальнейшая визуализация или вмешательство не требуются (1,2,3,8). Однако, если раннее развитие молочной железы связано с симптомами вторичного полового созревания, необходимы дальнейшие обследования, в том числе измерение костного возраста и УЗИ органов брюшной полости и таза, чтобы оценить развитие матки и яичников и исключить опухоль надпочечников (1, 2,3,8) ().
Когда на УЗИ выявляются гипоэхогенные субареолярные зачатки молочной железы без других признаков преждевременного полового созревания, клинического наблюдения достаточно, и дальнейшая визуализация или вмешательство не требуются (1,2,3,8). Однако, если раннее развитие молочной железы связано с симптомами вторичного полового созревания, необходимы дальнейшие обследования, в том числе измерение костного возраста и УЗИ органов брюшной полости и таза, чтобы оценить развитие матки и яичников и исключить опухоль надпочечников (1, 2,3,8) ().
A. УЗИ молочной железы с двусторонним гипогенезом фиброзно-железистой ткани. B. УЗИ малого таза выявляет незрелую матку, что свидетельствует о половой незрелости. УЗИ = ультрасонография
Ультрасонографическое изображение годовалой девочки с пальпируемыми образованиями в обеих молочных железах. На снимке видно двустороннее разрастание железистой ткани в субареолярной области без других признаков преждевременного полового созревания. Клинического наблюдения было достаточно, и дальнейшая визуализация или вмешательство не потребовалось.
Клинического наблюдения было достаточно, и дальнейшая визуализация или вмешательство не потребовалось.
A. Ультрасонографическое изображение молочной железы, показывающее гипоэхогенную линейную проекцию железистой ткани в субареолярной области (стадия 3 по Таннеру). B. Ультрасонографическое изображение таза, показывающее увеличенную матку с яичниками, которые имеют нормальный диапазон объема (не показано).
Стадии развития подростков основаны на шкале Таннера.Развитие груди делится на пять клинических стадий. УЗИ молочных желез можно использовать для получения изображений, отражающих пять стадий шкалы Таннера. Результаты УЗИ могут частично совпадать между стадиями Таннера 2 и 4. Однако существует корреляция между гормонами эстрогена и оценкой развития ткани молочной железы с помощью УЗИ (1,2,3,8). Сравнение стадий Таннера 1–5 в США показано в (1,2,3,8,12).
Сравнение стадий Таннера 1–5 в США показано в (1,2,3,8,12).
A. Tanner стадия 1. Видно клиническое возвышение сосочка.УЗИ показывает мелкие очаги эхогенной ткани в субареолярной области. B. Стадия Таннера 2. Видно клиническое возвышение молочной железы и сосочка с небольшим увеличением диаметра ареолы. УЗИ показывает гипоэхогенный субареолярный зачаток молочной железы с гиперэхогенной паренхимой молочной железы, состоящей из жировой ткани и рыхлой соединительной ткани. C. Tanner 3 стадия. Клинически пальпируется субареолярный узел с дальнейшим увеличением груди и ареолы без разделения их контуров. УЗИ показывает расширение гиперэхогенной фиброзно-железистой ткани с центральными паукообразными и гипоэхогенными линейными выступами от ретроареолярной области, отражающими удлиненные протоки. D. Стадия Таннера 4. Клиническая проекция ареолы и сосочка образует вторичный бугорок над молочной железой с обособлением их контура. УЗИ показывает более широко вытянутый гипоэхогенный зачаток груди и потерю округлой формы. Может присутствовать подкожный жир. E. Стадия Таннера 5. Клиническая проекция сосочка только с рецессией ареолы до общего контура молочной железы. УЗИ показывает вид зрелой груди, неоднородную эхогенность паренхимы молочной железы, смешанную с эхогенной железистой и стромальной тканью, а также увеличенное количество подкожного жира.
УЗИ показывает более широко вытянутый гипоэхогенный зачаток груди и потерю округлой формы. Может присутствовать подкожный жир. E. Стадия Таннера 5. Клиническая проекция сосочка только с рецессией ареолы до общего контура молочной железы. УЗИ показывает вид зрелой груди, неоднородную эхогенность паренхимы молочной железы, смешанную с эхогенной железистой и стромальной тканью, а также увеличенное количество подкожного жира.
Врожденные аномалии развития молочной железы
Добавочный сосок (полителия) и добавочная грудь (полимастия) представляют собой врожденные аномалии, связанные с неполной регрессией грудного гребня. Эти аномалии могут возникать в любом месте эмбрионального грудного гребня от подмышечной впадины до паха, но чаще всего возникают в подмышечной или подгрудной складках (2,3). Добавочный сосок обнаруживается у 1-2% населения и может быть клинически неправильно диагностирован как невус или пигментация (1,2,3,7,13).Клинически добавочная грудь в подмышечной впадине обычно проявляется периодическими болями при выпячивании подмышечной впадины. УЗИ может подтвердить наличие фиброзно-железистой ткани в подмышечной впадине (1, 2, 3, 7, 8). Гипоплазия и амастия (отсутствие ткани молочной железы, соска и ареолы) встречаются редко и встречаются при синдроме Поланда (4). Амазия отличается от амастии тем, что присутствуют сосок и ареола, но отсутствует подлежащая ткань молочной железы; это может быть связано с ятрогенной резекцией молочных желез или лучевой терапией в подростковом возрасте (1,2,14,15).
УЗИ может подтвердить наличие фиброзно-железистой ткани в подмышечной впадине (1, 2, 3, 7, 8). Гипоплазия и амастия (отсутствие ткани молочной железы, соска и ареолы) встречаются редко и встречаются при синдроме Поланда (4). Амазия отличается от амастии тем, что присутствуют сосок и ареола, но отсутствует подлежащая ткань молочной железы; это может быть связано с ятрогенной резекцией молочных желез или лучевой терапией в подростковом возрасте (1,2,14,15).
На изображении показан очаг гетерогенной фиброзно-железистой ткани в подкожно-жировом слое левой подмышечной впадины (стрелки), аналогичный таковому в молочной железе.
Синдром Поланда у 13-летнего мальчика.(A) КТ и (B) изображения реконструкции MIP, показывающие отсутствие грудной мышцы в правой грудной стенке (стрелка). MIP = проекция максимальной интенсивности
Гинекомастия
Гинекомастия относится к чрезмерному развитию ткани молочной железы у лиц мужского пола, включая новорожденных, подростков и пожилых мужчин (16). Около 60–75% случаев приходится на мальчиков-подростков (3). Клинически пациенты с гинекомастией жалуются на пальпируемое образование или болезненность в субареолярной области молочной железы. Гинекомастия проявляется односторонним или асимметричным развитием ткани молочной железы. Считается, что это вызвано дисбалансом уровней эстрогена и тестостерона. Лептин, фермент жировой ткани, играет роль в повышении уровня эстрогена и приводит к развитию ткани молочной железы у мужчин. Лекарства, такие как анаболические стероиды, антидепрессанты и антибиотики, также могут вызывать гинекомастию (1,2,3,8).Важно заверить пациентов и лиц, ухаживающих за ними, в том, что гинекомастия у новорожденных и подростков обычно исчезает в течение двух лет. Однако чрезмерная и стойкая гинекомастия может потребовать дальнейшего обследования на наличие опухолей, таких как тестикулярная опухоль Сертоли-Лейдига, кора надпочечников или гепатобластома, которые могут продуцировать гормоны эстрогена. Следует также учитывать возможность заболевания печени или синдрома Клайнфельтера (1,2,7,8).
Около 60–75% случаев приходится на мальчиков-подростков (3). Клинически пациенты с гинекомастией жалуются на пальпируемое образование или болезненность в субареолярной области молочной железы. Гинекомастия проявляется односторонним или асимметричным развитием ткани молочной железы. Считается, что это вызвано дисбалансом уровней эстрогена и тестостерона. Лептин, фермент жировой ткани, играет роль в повышении уровня эстрогена и приводит к развитию ткани молочной железы у мужчин. Лекарства, такие как анаболические стероиды, антидепрессанты и антибиотики, также могут вызывать гинекомастию (1,2,3,8).Важно заверить пациентов и лиц, ухаживающих за ними, в том, что гинекомастия у новорожденных и подростков обычно исчезает в течение двух лет. Однако чрезмерная и стойкая гинекомастия может потребовать дальнейшего обследования на наличие опухолей, таких как тестикулярная опухоль Сертоли-Лейдига, кора надпочечников или гепатобластома, которые могут продуцировать гормоны эстрогена. Следует также учитывать возможность заболевания печени или синдрома Клайнфельтера (1,2,7,8). При наличии пальпируемой субареолярной массы молочной железы УЗИ позволяет определить увеличенную субареолярную фиброгландулярную ткань и исключить опухоли (1).Иногда у пациентов с ожирением может развиться псевдогинекомастия, которая характеризуется наличием жира без фиброзно-железистой ткани (1,3).
При наличии пальпируемой субареолярной массы молочной железы УЗИ позволяет определить увеличенную субареолярную фиброгландулярную ткань и исключить опухоли (1).Иногда у пациентов с ожирением может развиться псевдогинекомастия, которая характеризуется наличием жира без фиброзно-железистой ткани (1,3).
A. Ультрасонографическое изображение, показывающее нормальную железистую ткань молочной железы в субареолярных областях обеих грудей, что указывает на гинекомастию. B. Компьютерная томография, показывающая линейную или тубулярную плотность мягких тканей в субареолярной области обеих молочных желез.
Неопухолевые образования молочной железы
Простые кисты молочной железы у взрослых обычно обнаруживаются в возрасте 35–50 лет, но могут появиться в любом возрасте. Эти поражения относятся к спектру фиброзно-кистозных заболеваний и могут возникать из-за расширения лобулярных ацинусов из-за дисбаланса между секрецией и абсорбцией жидкости или обструкцией протоков (17). Киста в подростковом возрасте выглядит как бессимптомное образование, прилегающее к соску, и у некоторых пациентов может сопровождаться воспалением или такими симптомами, как лактация (2,3,18).На УЗИ киста выглядит как круглая или овальная анэхогенная масса с задним акустическим усилением и отсутствием кровотока при цветовом допплеровском исследовании. Простые бессимптомные кисты с типичными визуализирующими признаками не требуют специального лечения, дальнейшего обследования или вмешательства. Однако кисты с атипичными визуализирующими характеристиками, такими как внутренняя эхогенность, уровень жидкости, внутренние перегородки или толстая стенка, могут потребовать аспирации для дифференциации от других возможных диагнозов, таких как галактоцеле, абсцесс или осложненная киста (1,4, 8).
Киста в подростковом возрасте выглядит как бессимптомное образование, прилегающее к соску, и у некоторых пациентов может сопровождаться воспалением или такими симптомами, как лактация (2,3,18).На УЗИ киста выглядит как круглая или овальная анэхогенная масса с задним акустическим усилением и отсутствием кровотока при цветовом допплеровском исследовании. Простые бессимптомные кисты с типичными визуализирующими признаками не требуют специального лечения, дальнейшего обследования или вмешательства. Однако кисты с атипичными визуализирующими характеристиками, такими как внутренняя эхогенность, уровень жидкости, внутренние перегородки или толстая стенка, могут потребовать аспирации для дифференциации от других возможных диагнозов, таких как галактоцеле, абсцесс или осложненная киста (1,4, 8).
Эктазия протоков — редкое заболевание, встречающееся у новорожденных и детей младшего возраста. Клинически у пациентов с эктазией протока наблюдаются кровянистые выделения из соска или пальпируемое образование в молочной железе. На УЗИ в субареолярных областях видны многосептированные кистоподобные образования или тубулярные анэхогенные структуры (4). Этиология эктазии протоков неизвестна, но материнские гормоны могут играть важную роль. Новорожденным с такими находками показано консервативное лечение. Грудное вскармливание следует прекратить и при необходимости использовать антибиотики (1,2,8).
На УЗИ в субареолярных областях видны многосептированные кистоподобные образования или тубулярные анэхогенные структуры (4). Этиология эктазии протоков неизвестна, но материнские гормоны могут играть важную роль. Новорожденным с такими находками показано консервативное лечение. Грудное вскармливание следует прекратить и при необходимости использовать антибиотики (1,2,8).
A, B. Ультрасонографические изображения, показывающие гетерогенное многосептированное кистозное образование в субареолярной области обеих грудей как признаки эктазии протоков.
Мастит и абсцесс часто встречаются у кормящих женщин. Однако они также могут встречаться в педиатрических случаях с бимодальным распределением, включающим младенцев (в возрасте < 2 месяцев) и детей старшего возраста (в возрасте 8-17 лет) (5). Мастит – это клинический диагноз, основанный на признаках и симптомах инфекции, т. е.д., лихорадка, эритема и болезненность. Стафилококки или пневмококки являются наиболее распространенными возбудителями в подростковом возрасте (1,4,7,8). УЗИ полезно при проведении тонкоигольной аспирации в диагностических и лечебных целях. На УЗИ абсцесс выглядит как сложная киста со стенкой различной толщины и окружен усиленным кровотоком при цветном допплеровском исследовании (1,2,3,4,7,8). Лечение мастита с абсцессом включает антибактериальную терапию и дренирование с тонкоигольной аспирацией. Большой абсцесс может потребовать хирургического разреза и дренирования с последующим обследованием для подтверждения разрешения (1, 2, 3, 7, 8).
е.д., лихорадка, эритема и болезненность. Стафилококки или пневмококки являются наиболее распространенными возбудителями в подростковом возрасте (1,4,7,8). УЗИ полезно при проведении тонкоигольной аспирации в диагностических и лечебных целях. На УЗИ абсцесс выглядит как сложная киста со стенкой различной толщины и окружен усиленным кровотоком при цветном допплеровском исследовании (1,2,3,4,7,8). Лечение мастита с абсцессом включает антибактериальную терапию и дренирование с тонкоигольной аспирацией. Большой абсцесс может потребовать хирургического разреза и дренирования с последующим обследованием для подтверждения разрешения (1, 2, 3, 7, 8).
A. Ультрасонографическое изображение, показывающее неоднородное эхогенное объемное образование с диффузной жировой инфильтрацией в ткани молочной железы, указывающее на абсцесс. B. Цветное допплеровское исследование, показывающее повышенную васкуляризацию, которая предполагает гиперваскуляризацию из-за воспаления.
Цветное допплеровское исследование, показывающее повышенную васкуляризацию, которая предполагает гиперваскуляризацию из-за воспаления.
Галактоцеле представляет собой ретенционную кисту, наполненную молоком, вызванную закупоркой млечного протока.Обычно наблюдается у беременных или кормящих женщин. Однако галактоцеле также можно увидеть у младенцев и подростков. На УЗИ галактоцеле демонстрируют различные особенности визуализации в зависимости от относительного состава жира и воды (от анэхогенных кист до сложных кист). УЗИ, показывающее уровень жировой жидкости в кисте, является диагностическим признаком галактоцеле (1,2,7,8). Неосложненные галактоцеле без атипичных визуализационных особенностей проходят сами по себе и не требуют дальнейшего обследования или лечения. Как и в случае простых кист, тонкоигольную аспирацию под контролем УЗИ следует выполнять у пациентов с симптомами и у пациентов с атипичными визуализирующими признаками (1, 2, 7, 19).
Гематома или жировой некроз могут быть связаны с травмой молочной железы или операцией в анамнезе. Недавняя травма или хирургическое вмешательство в анамнезе необходимы для постановки диагноза (1). УЗИ гематомы выявляет изменения во времени в зависимости от степени разжижения. Гематома появляется как гиперэхогенное очаговое поражение с плохо очерченными краями в острой фазе, а затем превращается в кистозное поражение с внутренним мусором и перегородками (1,2,8). На УЗИ жировой некроз обычно локализуется в подкожно-жировом слое, демонстрируя различные эхо-структуры, начиная от солидных сложных кист и заканчивая маслянистыми кистами в зависимости от возраста поражения (20).Краткосрочное последующее визуализирующее наблюдение рекомендуется пациентам с типичной клинической историей и типичными визуализирующими характеристиками. Атипичные визуализационные особенности или рост с течением времени являются показаниями к аспирации как в диагностических, так и в терапевтических целях (1,2).
Недавняя травма или хирургическое вмешательство в анамнезе необходимы для постановки диагноза (1). УЗИ гематомы выявляет изменения во времени в зависимости от степени разжижения. Гематома появляется как гиперэхогенное очаговое поражение с плохо очерченными краями в острой фазе, а затем превращается в кистозное поражение с внутренним мусором и перегородками (1,2,8). На УЗИ жировой некроз обычно локализуется в подкожно-жировом слое, демонстрируя различные эхо-структуры, начиная от солидных сложных кист и заканчивая маслянистыми кистами в зависимости от возраста поражения (20).Краткосрочное последующее визуализирующее наблюдение рекомендуется пациентам с типичной клинической историей и типичными визуализирующими характеристиками. Атипичные визуализационные особенности или рост с течением времени являются показаниями к аспирации как в диагностических, так и в терапевтических целях (1,2).
Доброкачественные новообразования
Фиброаденомы являются наиболее распространенными доброкачественными опухолями у детей и подростков, на которые приходится 54–94% случаев.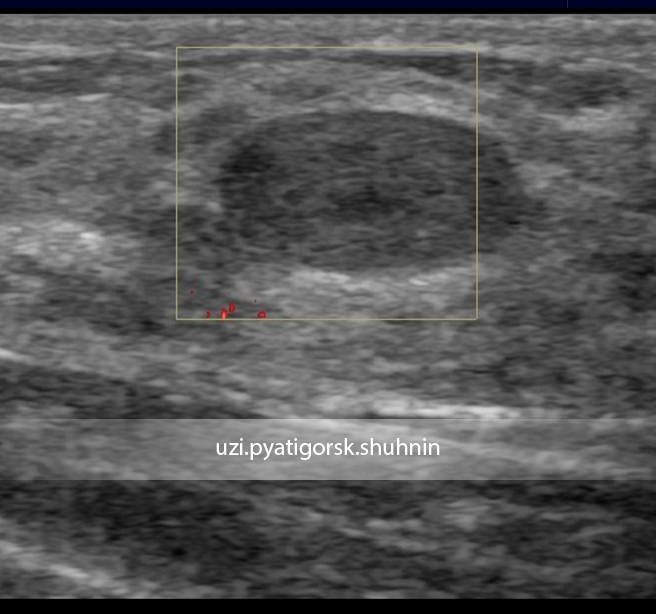 Фиброэпителиальная ткань аденомы представляет собой доброкачественную пролиферацию, которая клинически пальпируется (1,2,4,5).Фиброаденомы чувствительны к эстрогену и быстро растут во время беременности и полового созревания (21). Фиброаденома классифицируется в зависимости от ее размера и гистологических характеристик. Наиболее распространенным типом является обычная фиброаденома, размер которой обычно составляет 2–3 см (22). Если фиброаденома больше 5–10 см, ее называют гигантской фиброаденомой (1). Ювенильная (клеточная) фиброаденома является относительно редким вариантом фиброзной аденомы с гиперклеточной стромальной пролиферацией и быстрым ростом и составляет 7-8% случаев (1,2,5,8).Результаты УЗИ для типичной фиброаденомы включают гипоэхогенное образование круглой или овальной формы с очерченными краями и ориентацией параллельно коже. Часто наблюдается заднее акустическое усиление, и изменение кровотока можно наблюдать при цветном доплеровском УЗИ (1,3,4,5,8).
Фиброэпителиальная ткань аденомы представляет собой доброкачественную пролиферацию, которая клинически пальпируется (1,2,4,5).Фиброаденомы чувствительны к эстрогену и быстро растут во время беременности и полового созревания (21). Фиброаденома классифицируется в зависимости от ее размера и гистологических характеристик. Наиболее распространенным типом является обычная фиброаденома, размер которой обычно составляет 2–3 см (22). Если фиброаденома больше 5–10 см, ее называют гигантской фиброаденомой (1). Ювенильная (клеточная) фиброаденома является относительно редким вариантом фиброзной аденомы с гиперклеточной стромальной пролиферацией и быстрым ростом и составляет 7-8% случаев (1,2,5,8).Результаты УЗИ для типичной фиброаденомы включают гипоэхогенное образование круглой или овальной формы с очерченными краями и ориентацией параллельно коже. Часто наблюдается заднее акустическое усиление, и изменение кровотока можно наблюдать при цветном доплеровском УЗИ (1,3,4,5,8).

Ультрасонографическое изображение показывает очерченное, овальное, параллельное изоэхогенное образование размером около 6,5 см в левой молочной железе.
Обычная фиброаденома у девушки 17 лет.Ультрасонографические изображения показывают ограниченное, овальное, параллельное, изоэхогенное образование с задним усилением в левой молочной железе.
Последующее УЗИ может быть выполнено при небольших фиброаденомах размером менее 3 см, которые имеют типичный внешний вид на изображениях и симптомы. В течение первого года УЗИ можно проводить каждые 6 месяцев с последующим УЗ-обследованием через год, чтобы подтвердить стабильность поражения в течение двух лет. Иногда фиброаденомы обнаруживают нетипичные признаки на УЗИ, такие как угловая граница или задняя акустическая тень (5,8).Если есть подозрительные особенности визуализации с быстрым ростом или симптомами, следует рассмотреть биопсию или хирургическую резекцию (1,2,5,8,23).
Дифференциальные диагнозы включают филлодные опухоли или псевдоангиоматозную стромальную гиперплазию (ПАСГ), которые трудно различить при УЗИ из-за их общих признаков визуализации (1,2,5,7).
ПАГ — редкое заболевание у детей, характеризующееся пролиферацией гормонально-опосредованных мезенхимальных клеток, присутствующих на фоне ткани молочной железы и ассоциированных с другими патологиями молочной железы.ПАСГ наблюдается у женщин в пременопаузе, но редко встречается у детей и подростков. Сообщалось, что PASH связан с нейрофиброматозом 1 типа и статусом иммунодефицита. Когда PASH образует опухоль, ее клинические и ультразвуковые данные аналогичны таковым при фиброаденоме (2). Достаточно повторного УЗИ, хотя хирургическое вмешательство показано при поражениях большого размера (1,2,7).
ПАШ.Ультрасонографическое изображение 44-летней женщины показывает овальное, ограниченное, параллельное и гипоэхогенное образование с задним акустическим усилением в правой молочной железе.Особенности визуализации аналогичны таковым при фиброаденоме. Пункционная пункционная биопсия под контролем УЗИ выявила PASH. ПАСГ = псевдоангиоматозная стромальная гиперплазия
Ювенильный папилломатоз — очень редкое доброкачественное заболевание. Ее также называют болезнью швейцарского сыра, и она характеризуется небольшими фиброзными массами с локализованными множественными кистами и расширенными протоками (7,24). Это происходит в позднем подростковом возрасте, в среднем в возрасте 19 лет, и может быть связано с лежащими в основе доброкачественными опухолями молочной железы. Клинически это твердая и подвижная опухоль, которую невозможно отличить от фиброаденомы.УЗИ может облегчить диагностику ювенильного папилломатоза, выявляя множественные периферические мелкие кисты с нечеткими краями (4). Можно увидеть связанные кластерные микрокальцификаты (2). Ювенильный папилломатоз является гистологически доброкачественным поражением, но связан с повышенным риском рака молочной железы. Приблизительно у 5–15% пациентов одновременно обнаруживают рак молочной железы и ювенильный папилломатоз, поэтому необходим постоянный мониторинг. Семейный анамнез рака молочной железы, гистопатологические признаки атипии, билатеральность, множественность поражений и рецидивы связаны с высоким риском малигнизации.
Ее также называют болезнью швейцарского сыра, и она характеризуется небольшими фиброзными массами с локализованными множественными кистами и расширенными протоками (7,24). Это происходит в позднем подростковом возрасте, в среднем в возрасте 19 лет, и может быть связано с лежащими в основе доброкачественными опухолями молочной железы. Клинически это твердая и подвижная опухоль, которую невозможно отличить от фиброаденомы.УЗИ может облегчить диагностику ювенильного папилломатоза, выявляя множественные периферические мелкие кисты с нечеткими краями (4). Можно увидеть связанные кластерные микрокальцификаты (2). Ювенильный папилломатоз является гистологически доброкачественным поражением, но связан с повышенным риском рака молочной железы. Приблизительно у 5–15% пациентов одновременно обнаруживают рак молочной железы и ювенильный папилломатоз, поэтому необходим постоянный мониторинг. Семейный анамнез рака молочной железы, гистопатологические признаки атипии, билатеральность, множественность поражений и рецидивы связаны с высоким риском малигнизации. Лечение включает полную резекцию, поскольку при частичной резекции поражения может возникнуть рецидив (1, 2, 7, 8, 25).
Лечение включает полную резекцию, поскольку при частичной резекции поражения может возникнуть рецидив (1, 2, 7, 8, 25).
Ультрасонографическое изображение показывает эктазию пузырного протока в правой молочной железе по типу швейцарского сыра. При хирургическом удалении выявлен внутрипротоковый папилломатоз.
Опухоль филлода
Опухоль филлода — редкая форма фиброэпителиального новообразования, требующая дифференциации от фиброаденомы. Гистологически филлоды подразделяются на низкозлокачественные, промежуточные и высокозлокачественные.Все гистологические типы могут рецидивировать, но редко метастазируют. Существует очень редкий злокачественный подтип филлодной опухоли, который имеет признаки низкодифференцированной веретеноклеточной саркомы (1, 3, 4, 8, 26, 27) и часто встречается у женщин в возрасте 30 лет. На его долю приходится менее 1% заболеваний молочной железы у детей, но это наиболее распространенная первичная злокачественная опухоль молочной железы в подростковом возрасте (1,3,6,26). Хотя 85% филлодных опухолей у детей и подростков являются доброкачественными, сообщалось о случаях инфильтрации, метастазирования или рецидива с уровнем смертности около 3% (1,3,6).Результаты УЗИ для филлодных опухолей неотличимы от таковых для фиброаденом. Типичные филлодные опухоли представляют собой очерченные, овальные и гипоэхогенные солидные массы на УЗИ (). Периферический кистозный компонент и расщелина чаще встречаются в филлодах, чем в фиброаденомах, но не являются уникальными для филлодов (1, 2, 3, 4, 8, 26) (1, 2, 3, 4, 8, 26).
Хотя 85% филлодных опухолей у детей и подростков являются доброкачественными, сообщалось о случаях инфильтрации, метастазирования или рецидива с уровнем смертности около 3% (1,3,6).Результаты УЗИ для филлодных опухолей неотличимы от таковых для фиброаденом. Типичные филлодные опухоли представляют собой очерченные, овальные и гипоэхогенные солидные массы на УЗИ (). Периферический кистозный компонент и расщелина чаще встречаются в филлодах, чем в фиброаденомах, но не являются уникальными для филлодов (1, 2, 3, 4, 8, 26) (1, 2, 3, 4, 8, 26).
Ультрасонографическое изображение показывает очерченное, овальное, изоэхогенное параллельное образование размером 2,5 см в левой молочной железе.При вакуумной биопсии выявлена доброкачественная филлодная опухоль.
14-летняя девочка с пальпируемым образованием в груди. Ультрасонографическое изображение показывает правую и центральную части огромного образования. Видно огромное, очерченное, круглое образование с периферическим кистозным компонентом (стрелки). У пациента была подтверждена злокачественная опухоль филлодов низкой степени злокачественности.
Видно огромное, очерченное, круглое образование с периферическим кистозным компонентом (стрелки). У пациента была подтверждена злокачественная опухоль филлодов низкой степени злокачественности.
УЗ-характеристики филлодовой опухоли сходны с фиброаденомой, и для различения этой опухоли и фиброаденомы можно использовать пункционную биопсию (8,10,23).Если опухоль быстро увеличилась или внутри опухоли видны кисты, необходима пункционная биопсия под контролем УЗИ (1, 2, 4, 28). Если размер больше 5 см, показана хирургическая резекция, потому что способность толстоигольной биопсии отличить фиброаденому от филлодной опухоли ограничена (1,2,7,8,23). Если при биопсии опухоль диагностирована как филлодия, следует выполнить широкое хирургическое иссечение с запасом 1-2 см независимо от гистологического подтипа. Прогноз, как правило, хороший.Однако рецидив возникает даже после полной резекции, по крайней мере, в 20% доброкачественных филлоидных опухолей (7,26). Метастазирование филлодовой опухоли встречается редко, но может происходить гематогенным путем. Легкие обычно являются местом метастазирования (7).
Легкие обычно являются местом метастазирования (7).
Злокачественные образования
Злокачественные образования молочной железы довольно редко встречаются у детей. Метастатическое заболевание или гематологическое злокачественное новообразование является более распространенной этиологией злокачественного образования молочной железы, чем карцинома молочной железы у детей и подростков. Злокачественное образование молочной железы может иногда возникать у детей в результате гематологического злокачественного новообразования, обычно лимфомы/лейкемии, или метастазов рабдомиосаркомы или нейробластомы.Злокачественная опухоль phyllodes является наиболее распространенным первичным злокачественным новообразованием молочной железы в педиатрической популяции (1,2,3,5,6,7,8,23).
Метастазы в молочные железы указывают на диссеминацию заболевания с неблагоприятным прогнозом. Хотя множественные и двусторонние опухоли предполагают метастатическое злокачественное новообразование, доброкачественные фиброаденомы также могут проявляться как многоочаговые и двусторонние поражения. Однако многоочаговые или двусторонние поражения не являются характерными признаками злокачественного поражения молочной железы (8). Метастазы в молочные железы на УЗИ выглядят как неравномерные, негомогенные и гипоэхогенные массы.Они также могут проявляться в различных формах. Метастазы в молочные железы у пациентов с лейкемией или лимфомой можно увидеть в виде очерченных гипоэхогенных солидных образований (2, 29). МРТ помогает выявить множественные поражения или обширное заболевание. Несмотря на то, что на МРТ наблюдались различные признаки лимфомы/лейкемии, лимфому можно рассматривать как высокую интенсивность сигнала на Т2-взвешенных изображениях с ободком или гетерогенным усилением и быстрой кинетикой усиления на изображениях с динамическим усилением (2, 29, 30). Важно знать, что метастатический рак молочной железы имеет различные особенности визуализации, которые часто предполагают, что поражение, вероятно, доброкачественное.Таким образом, пациент с известным первичным экстрамаммарным злокачественным новообразованием, у которого имеется поражение молочной железы, должен быть тщательно рассмотрен для биопсии молочной железы, даже если особенности визуализации предполагают, что поражение, вероятно, доброкачественное (1,2).
Однако многоочаговые или двусторонние поражения не являются характерными признаками злокачественного поражения молочной железы (8). Метастазы в молочные железы на УЗИ выглядят как неравномерные, негомогенные и гипоэхогенные массы.Они также могут проявляться в различных формах. Метастазы в молочные железы у пациентов с лейкемией или лимфомой можно увидеть в виде очерченных гипоэхогенных солидных образований (2, 29). МРТ помогает выявить множественные поражения или обширное заболевание. Несмотря на то, что на МРТ наблюдались различные признаки лимфомы/лейкемии, лимфому можно рассматривать как высокую интенсивность сигнала на Т2-взвешенных изображениях с ободком или гетерогенным усилением и быстрой кинетикой усиления на изображениях с динамическим усилением (2, 29, 30). Важно знать, что метастатический рак молочной железы имеет различные особенности визуализации, которые часто предполагают, что поражение, вероятно, доброкачественное.Таким образом, пациент с известным первичным экстрамаммарным злокачественным новообразованием, у которого имеется поражение молочной железы, должен быть тщательно рассмотрен для биопсии молочной железы, даже если особенности визуализации предполагают, что поражение, вероятно, доброкачественное (1,2).
A. Ультрасонография, показывающая множественные очерченные, овальные, гипоэхогенные массы с задним усилением в обеих молочных железах. B. Т2-взвешенное МРТ-изображение с подавлением жира, показывающее множественные круглые неоднородные образования с высокой интенсивностью сигнала в обеих молочных железах. C. Т1-взвешенное МРТ-изображение с ранним вычитанием после введения гадолиниевого контраста, показывающее неоднородное усиливающееся образование молочных желез на двусторонней основе. Биопсия толстой иглы выявила метастатическую лимфобластную В-клеточную лимфому молочной железы.
Первичный рак молочной железы крайне редко встречается у детей и подростков. Заболеваемость раком молочной железы составляет 1 на 1000000 у женщин моложе 20 лет, но значительно выше у женщин старше 25 лет (1,2,6,31). Наиболее распространенным гистологическим подтипом первичного рака молочной железы в детском возрасте является секреторная карцинома молочной железы, которая имеет относительно благоприятный прогноз (32,33). Лучевая терапия грудной клетки является основным фактором риска. Кроме того, сообщалось, что риск рака молочной железы увеличивается в 75 раз, когда пациенту в возрасте 10–16 лет проводят лучевую терапию по поводу болезни Ходжкина (7,8). Факторы риска рака молочной железы включают генные мутации, такие как BRCA1 или BRCA2 (1,2,8). Первичный рак молочной железы имеет неправильную форму с неограниченным краем, непараллельной ориентацией, неоднородной гипоэхогенностью, задним затенением и повышенным кровотоком на УЗИ (4).Сопутствующие признаки, такие как архитектурное искажение, изменения протоков и ипсилатеральная подмышечная лимфаденопатия, также могут повысить подозрение на злокачественное новообразование (7). Микрокальцинаты с тонкой плеоморфной или тонкой линейной ветвящейся морфологией и групповым или сегментарным распределением на маммографии являются очень подозрительными находками. Однако маммография обычно не проводится у детей и имеет ограниченную диагностическую ценность.
Лучевая терапия грудной клетки является основным фактором риска. Кроме того, сообщалось, что риск рака молочной железы увеличивается в 75 раз, когда пациенту в возрасте 10–16 лет проводят лучевую терапию по поводу болезни Ходжкина (7,8). Факторы риска рака молочной железы включают генные мутации, такие как BRCA1 или BRCA2 (1,2,8). Первичный рак молочной железы имеет неправильную форму с неограниченным краем, непараллельной ориентацией, неоднородной гипоэхогенностью, задним затенением и повышенным кровотоком на УЗИ (4).Сопутствующие признаки, такие как архитектурное искажение, изменения протоков и ипсилатеральная подмышечная лимфаденопатия, также могут повысить подозрение на злокачественное новообразование (7). Микрокальцинаты с тонкой плеоморфной или тонкой линейной ветвящейся морфологией и групповым или сегментарным распределением на маммографии являются очень подозрительными находками. Однако маммография обычно не проводится у детей и имеет ограниченную диагностическую ценность. Особенности визуализации рака молочной железы у пациентов с мутацией BRCA1 аналогичны таковым при доброкачественных поражениях, таких как фиброаденома, поэтому при их лечении важно учитывать как клинические, так и визуализационные особенности (34,35).Органосохраняющая операция возможна, хотя единого мнения по этому поводу нет. Учитывая, что в 20–30% случаев имеются метастазы в подмышечные впадины, рекомендуется забор сторожевых лимфатических узлов (1,7,8).
Особенности визуализации рака молочной железы у пациентов с мутацией BRCA1 аналогичны таковым при доброкачественных поражениях, таких как фиброаденома, поэтому при их лечении важно учитывать как клинические, так и визуализационные особенности (34,35).Органосохраняющая операция возможна, хотя единого мнения по этому поводу нет. Учитывая, что в 20–30% случаев имеются метастазы в подмышечные впадины, рекомендуется забор сторожевых лимфатических узлов (1,7,8).
A. Ультрасонографическое изображение молочной железы, показывающее неправильное, нечеткое гипоэхогенное образование с задним затемнением. B. МРТ-изображение раннего вычитания, усиленное реконструкцией MIP, показывающее быстро увеличивающуюся массу с неоангиогенными сосудистыми структурами.Увеличенный усиленный подмышечный лимфатический узел также отмечен на уровне I левой подмышечной впадины. Биопсия толстой иглы левой молочной железы под контролем УЗИ подтвердила инвазивную карциному протоков.
Биопсия толстой иглы левой молочной железы под контролем УЗИ подтвердила инвазивную карциному протоков.
Лечение заболеваний молочных желез у детей и подростков
Заболевания молочных желез у детей и подростков отличаются от таковых у взрослых. Оценка результатов визуализации, основанная на Системе отчетов и данных визуализации молочной железы (BI-RADS) (36), обычно не используется у педиатрических пациентов (1, 5, 8), поскольку ее цель состоит в том, чтобы классифицировать заболевание в соответствии с вероятностью малигнизации, что крайне редко встречается в детской популяции.Большинство поражений молочной железы у детей можно отнести к категории 2 (доброкачественные) или 3 (вероятно, доброкачественные) с рекомендацией последующей визуализации в течение определенного периода времени. Фиброаденома является наиболее распространенной опухолью молочной железы у детей и подростков. Обычно это выглядит как вероятно доброкачественная опухоль с категорией 3 по BI-RADS на УЗИ и имеет потенциал злокачественности менее 2%. Если клинические и УЗ-данные благоприятны, все, что необходимо, — это заверение пациента и/или опекуна. Рекомендуются консервативные последующие обследования, такие как УЗИ (5,8,23).Как правило, последующее УЗИ проводят с интервалом в 6 месяцев в первый год и повторное УЗИ через 12 месяцев в конце второго года. При заболеваниях молочной железы у детей размер и рост опухоли также могут влиять на лечение (1, 5, 8, 10, 23, 37).
Если клинические и УЗ-данные благоприятны, все, что необходимо, — это заверение пациента и/или опекуна. Рекомендуются консервативные последующие обследования, такие как УЗИ (5,8,23).Как правило, последующее УЗИ проводят с интервалом в 6 месяцев в первый год и повторное УЗИ через 12 месяцев в конце второго года. При заболеваниях молочной железы у детей размер и рост опухоли также могут влиять на лечение (1, 5, 8, 10, 23, 37).
Хирургическое иссечение предлагается для новообразований с доброкачественными УЗ-характерами, размерами более 5 см или быстро растущими (5,8). Гордон и др. (37) предложили удалять образования, которые увеличиваются в размере более чем на 20% за 6 месяцев или превышают 3 см, чтобы отличить их от филлодной опухоли.Однако инвазивная хирургия может повредить нормально развивающуюся ткань молочной железы, а атипичные филлоидные опухоли у детей встречаются редко. Многие филлодные опухоли сходны с фиброаденомами. Рекомендуется биопсия толстой иглы, а не операция (8,10,23). Сандерс и др. (23) показали, что 1% филлодных опухолей имеет размер 3 см или меньше, в то время как 3,6% имеют размер 3–5 см, что позволяет предположить, что 3 см можно использовать в качестве критерия для основной биопсии. Иссечение предлагается при образованиях размером более 5 см. Хотя большинство поражений молочных желез у детей доброкачественные, возможно злокачественное заболевание.Гистологическое исследование рассматривается на основании клинических признаков, анамнеза, семейного анамнеза и результатов УЗИ (1,5,6). Показана биопсия или хирургическое вмешательство. Даже если визуализационные признаки не вызывают подозрений у пациента с клиническим анамнезом высокого риска, например, наличием в анамнезе других злокачественных новообразований, семейным анамнезом рака молочной железы, предшествующим облучением грудной клетки или генетическими мутациями, биопсия должна быть тщательно продумана (1). ,3,8). Пункционная пункционная биопсия имеет высокую точность в педиатрической популяции, особенно при дифференциации фиброаденом и филлодных опухолей.
Сандерс и др. (23) показали, что 1% филлодных опухолей имеет размер 3 см или меньше, в то время как 3,6% имеют размер 3–5 см, что позволяет предположить, что 3 см можно использовать в качестве критерия для основной биопсии. Иссечение предлагается при образованиях размером более 5 см. Хотя большинство поражений молочных желез у детей доброкачественные, возможно злокачественное заболевание.Гистологическое исследование рассматривается на основании клинических признаков, анамнеза, семейного анамнеза и результатов УЗИ (1,5,6). Показана биопсия или хирургическое вмешательство. Даже если визуализационные признаки не вызывают подозрений у пациента с клиническим анамнезом высокого риска, например, наличием в анамнезе других злокачественных новообразований, семейным анамнезом рака молочной железы, предшествующим облучением грудной клетки или генетическими мутациями, биопсия должна быть тщательно продумана (1). ,3,8). Пункционная пункционная биопсия имеет высокую точность в педиатрической популяции, особенно при дифференциации фиброаденом и филлодных опухолей. Хирургическое иссечение показано в случае неполного забора ткани или диагностических трудностей при пункционной биопсии (1,23). Некоторые доброкачественные новообразования, включая поражения, связанные с травмой и инфекцией, могут проявляться подозрительными визуализирующими признаками, и перед немедленными интервенционными процедурами важен подробный анализ истории болезни (4).
Хирургическое иссечение показано в случае неполного забора ткани или диагностических трудностей при пункционной биопсии (1,23). Некоторые доброкачественные новообразования, включая поражения, связанные с травмой и инфекцией, могут проявляться подозрительными визуализирующими признаками, и перед немедленными интервенционными процедурами важен подробный анализ истории болезни (4).
Краткий обзор лечения заболеваний молочной железы у детей.
Алгоритм ультразвуковой оценки и лечения поражений молочной железы у детей. * Категория оценки BI-RADS 2: простая киста. Овальное, круглое, ограниченное, анэхогенное образование с задним акустическим усилением. ** Категория оценки BI-RADS 3: овальное, ограниченное, гипо-/изо-/гиперэхогенное образование с различной васкуляризацией. *** Категория оценки BI-RADS 4 или 5: массы с подозрительными особенностями; неровный край, непараллельная ориентация, неограниченный край, повышенная васкуляризация, неоднородная эхо-картина (в том числе сложная кистозная и солидная), сопутствующие признаки. BI-RADS = система отчетов и данных визуализации молочной железы, МРТ = магнитно-резонансная томография, Sx/знак = симптом/признак
BI-RADS = система отчетов и данных визуализации молочной железы, МРТ = магнитно-резонансная томография, Sx/знак = симптом/признак
ЗАКЛЮЧЕНИЕ
Диагностика и лечение заболеваний молочной железы у детей и подростков отличаются от таковых у взрослых. Большинство поражений молочных желез у детей и подростков связаны с развитием молочных желез или являются доброкачественными опухолями. Поэтому их управление должно быть консервативным. УЗИ является важным первым методом визуализации у педиатрических пациентов. Многие доброкачественные опухоли кажутся похожими на УЗИ, и часто требуется последующее ультразвуковое исследование.Злокачественные опухоли у детей встречаются очень редко. Следует тщательно рекомендовать гистологическое исследование, сочетая историю болезни, размер новообразования, скорость роста и результаты УЗИ у педиатрических пациентов. Биопсия толстой иглы является полезным методом, который может обеспечить точный диагноз, не вызывая непоправимых повреждений у детей.
Ссылки
1. Valeur NS, Rahbar H, Chapman T. УЗИ детских молочных желез: что делать с комками и бугорками. Педиатр Радиол. 2015;45:1584–1599.викторина 1581-1583. [PubMed] [Google Scholar]2. Чанг Э.М., Куб Р., Холл Г.Дж., Гонсалес С., Стокер Дж.Т., Глассман Л.М. Из архивов AFIP: новообразования молочной железы у детей и подростков: рентгенопатологическая корреляция. Рентгенография. 2009; 29: 907–931. [PubMed] [Google Scholar]3. Гарсия С.Дж., Эспиноза А., Динамарка В., Наварро О., Данеман А., Гарсия Х. и др. УЗИ молочных желез у детей и подростков. Рентгенография. 2000;20:1605–1612. [PubMed] [Google Scholar]4. Кронемер К.А., Ри К., Сигель М.Дж., Зиверт Л., Хильдеболт С.Ф.Сонография новообразований молочной железы в оттенках серого у девочек-подростков. J УЗИ Мед. 2001; 20: 491–496. викторина 498. [PubMed] [Google Scholar]5. Санчес Р., Ладино-Торрес М.Ф., Бернат Дж.А., Джо А., ДиПьетро М.А. Фиброаденомы молочной железы в педиатрической популяции: общие и необычные сонографические данные.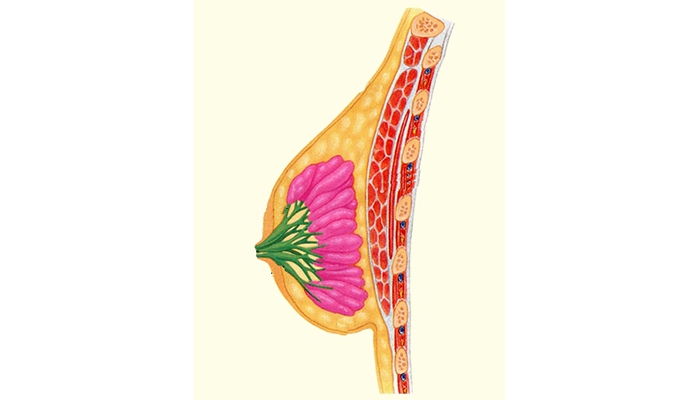 Педиатр Радиол. 2010;40:1681–1689. [PubMed] [Google Scholar]6. Гутьеррес Дж. К., Хусри Н., Кониарис Л. Г., Фишер А. С., Сола Дж. Э. Злокачественный рак молочной железы у детей: обзор 75 больных. J Surg Res. 2008; 147: 182–188. [PubMed] [Google Scholar]7.Kaneda HJ, Mack J, Kasales CJ, Schetter S. Педиатрические и подростковые массы груди: обзор патофизиологии, визуализации, диагностики и лечения. AJR Am J Рентгенол. 2013; 200:W204–W212. [PubMed] [Google Scholar]8. Гао Ю., Саксена М.А., Брахтель Э.Ф., ТерМюлен Д.К., Рафферти Э.А. Как лечить поражения молочной железы у детей и подростков. Евр Дж Радиол. 2015;84:1350–1364. [PubMed] [Google Scholar]9. Бейкер Дж.А., Су М.С., Розен Э.Л. Артефакты и подводные камни при ультразвуковой визуализации груди. AJR Am J Рентгенол.2001; 176:1261–1266. [PubMed] [Google Scholar] 10. Дурмаз Э., Озтек М.А., Арыоз Хабиби Х., Кезимал У., Синдел Х.Т. Заболевания молочной железы у детей: спектр рентгенологических данных в когортном исследовании. Диагн Интерв Радиол.
Педиатр Радиол. 2010;40:1681–1689. [PubMed] [Google Scholar]6. Гутьеррес Дж. К., Хусри Н., Кониарис Л. Г., Фишер А. С., Сола Дж. Э. Злокачественный рак молочной железы у детей: обзор 75 больных. J Surg Res. 2008; 147: 182–188. [PubMed] [Google Scholar]7.Kaneda HJ, Mack J, Kasales CJ, Schetter S. Педиатрические и подростковые массы груди: обзор патофизиологии, визуализации, диагностики и лечения. AJR Am J Рентгенол. 2013; 200:W204–W212. [PubMed] [Google Scholar]8. Гао Ю., Саксена М.А., Брахтель Э.Ф., ТерМюлен Д.К., Рафферти Э.А. Как лечить поражения молочной железы у детей и подростков. Евр Дж Радиол. 2015;84:1350–1364. [PubMed] [Google Scholar]9. Бейкер Дж.А., Су М.С., Розен Э.Л. Артефакты и подводные камни при ультразвуковой визуализации груди. AJR Am J Рентгенол.2001; 176:1261–1266. [PubMed] [Google Scholar] 10. Дурмаз Э., Озтек М.А., Арыоз Хабиби Х., Кезимал У., Синдел Х.Т. Заболевания молочной железы у детей: спектр рентгенологических данных в когортном исследовании. Диагн Интерв Радиол. 2017; 23:407–413. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Бок К., Дуда В.Ф., Хаджи П., Рамасвами А., Шульц-Вендтланд Р., Клозе К.Дж. и др. Патологические состояния молочной железы в детском и подростковом возрасте: оценка с помощью сонографической диагностики. J УЗИ Мед. 2005; 24:1347–1354. викторина 1356-1357.[PubMed] [Google Scholar] 12. Юн И, Пак С.Х., Лим И.С., Ким С.Дж. Ультразвуковая оценка развития груди: различие между преждевременным телорхе и преждевременным половым созреванием. AJR Am J Рентгенол. 2015; 204: 620–624. [PubMed] [Google Scholar] 13. Адлер Д.Д., Ребнер М., Пеннес Д.Р. Добавочная ткань молочной железы в подмышечной впадине: маммографический вид. Радиология. 1987; 163: 709–711. [PubMed] [Google Scholar] 14. Моджаллал А., Ла Марка С., Шипков С., Синна Р., Брей Ф. Синдром Поланда и опухоль молочной железы: отчет о клиническом случае и обзор литературы.Эстет Сург Дж. 2012; 32: 77–83. [PubMed] [Google Scholar] 15. Zhang F, Qi X, Xu Y, Zhou Y, Zhang Y, Fan L и др.
2017; 23:407–413. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Бок К., Дуда В.Ф., Хаджи П., Рамасвами А., Шульц-Вендтланд Р., Клозе К.Дж. и др. Патологические состояния молочной железы в детском и подростковом возрасте: оценка с помощью сонографической диагностики. J УЗИ Мед. 2005; 24:1347–1354. викторина 1356-1357.[PubMed] [Google Scholar] 12. Юн И, Пак С.Х., Лим И.С., Ким С.Дж. Ультразвуковая оценка развития груди: различие между преждевременным телорхе и преждевременным половым созреванием. AJR Am J Рентгенол. 2015; 204: 620–624. [PubMed] [Google Scholar] 13. Адлер Д.Д., Ребнер М., Пеннес Д.Р. Добавочная ткань молочной железы в подмышечной впадине: маммографический вид. Радиология. 1987; 163: 709–711. [PubMed] [Google Scholar] 14. Моджаллал А., Ла Марка С., Шипков С., Синна Р., Брей Ф. Синдром Поланда и опухоль молочной железы: отчет о клиническом случае и обзор литературы.Эстет Сург Дж. 2012; 32: 77–83. [PubMed] [Google Scholar] 15. Zhang F, Qi X, Xu Y, Zhou Y, Zhang Y, Fan L и др. Рак молочной железы и синдром Поланда: отчет о болезни и обзор литературы. Грудь Дж. 2011; 17: 196–200. [PubMed] [Google Scholar] 17. Вайнштейн С.П., Конант Э.Ф., Орел С.Г., Цукерман Дж.А., Белла Р. Спектр результатов УЗИ у педиатрических и подростковых пациентов с пальпируемыми массами груди. Рентгенография. 2000; 20:1613–1621. [PubMed] [Google Scholar] 18. Хьюнеус А., Шиллинг А., Хорват Э., Пиночет М., Карраско О.Ретроареолярные кисты у подростков. J Pediatr Adolesc Gynecol. 2003; 16:45–49. [PubMed] [Google Scholar] 19. Уэлч С.Т., Бэбкок Д.С., Баллард Э.Т. Сонография новообразований молочной железы у детей мужского пола: гинекомастия и не только. Педиатр Радиол. 2004; 34: 952–957. [PubMed] [Google Scholar] 20. Су М.С., Корнгут П.Дж., Герцберг Б.С. Жировой некроз молочной железы: сонографические особенности. Радиология. 1998; 206: 261–269. [PubMed] [Google Scholar] 21. Симмонс П.С. Диагностические аспекты заболеваний молочных желез у детей и подростков.Obstet Gynecol Clin North Am. 1992; 19: 91–102.
Рак молочной железы и синдром Поланда: отчет о болезни и обзор литературы. Грудь Дж. 2011; 17: 196–200. [PubMed] [Google Scholar] 17. Вайнштейн С.П., Конант Э.Ф., Орел С.Г., Цукерман Дж.А., Белла Р. Спектр результатов УЗИ у педиатрических и подростковых пациентов с пальпируемыми массами груди. Рентгенография. 2000; 20:1613–1621. [PubMed] [Google Scholar] 18. Хьюнеус А., Шиллинг А., Хорват Э., Пиночет М., Карраско О.Ретроареолярные кисты у подростков. J Pediatr Adolesc Gynecol. 2003; 16:45–49. [PubMed] [Google Scholar] 19. Уэлч С.Т., Бэбкок Д.С., Баллард Э.Т. Сонография новообразований молочной железы у детей мужского пола: гинекомастия и не только. Педиатр Радиол. 2004; 34: 952–957. [PubMed] [Google Scholar] 20. Су М.С., Корнгут П.Дж., Герцберг Б.С. Жировой некроз молочной железы: сонографические особенности. Радиология. 1998; 206: 261–269. [PubMed] [Google Scholar] 21. Симмонс П.С. Диагностические аспекты заболеваний молочных желез у детей и подростков.Obstet Gynecol Clin North Am. 1992; 19: 91–102. [PubMed] [Google Scholar] 22. Ставрос А.Т., Тикман Д., Рэпп К.Л., Деннис М.А., Паркер С.Х., Сисни Г.А. Твердые узлы молочной железы: использование УЗИ для различения доброкачественных и злокачественных образований. Радиология. 1995; 196: 123–134. [PubMed] [Google Scholar] 23. Сандерс Л.М., Шарма П., Эль Мадани М., Кинг А.Б., Гудман К.С., Сандерс А.Е. Клинические проблемы с грудью у педиатрических пациентов с низким уровнем риска: обзор практики с предлагаемыми рекомендациями. Педиатр Радиол. 2018;48:186–195. [PubMed] [Google Scholar] 24.Паттерсон С.К., Йорнс Дж.М. Случай ювенильного папилломатоза, также известного как «болезнь швейцарского сыра» Breast J. 2013;19:440–441. [PubMed] [Google Scholar] 25. Гилл Дж., Гринолл М. Ювенильный папилломатоз и рак молочной железы. J Surg Educ. 2007; 64: 234–236. [PubMed] [Google Scholar] 26. Це Г.М., Ниу Ю., Ши Х.Дж. Филлодозная опухоль молочной железы: обновление. Рак молочной железы. 2010;17:29–34. [PubMed] [Google Scholar] 27. Cecen E, Uysal KM, Harmancioglu O, Balci P, Kupelioglu A, Canda T.
[PubMed] [Google Scholar] 22. Ставрос А.Т., Тикман Д., Рэпп К.Л., Деннис М.А., Паркер С.Х., Сисни Г.А. Твердые узлы молочной железы: использование УЗИ для различения доброкачественных и злокачественных образований. Радиология. 1995; 196: 123–134. [PubMed] [Google Scholar] 23. Сандерс Л.М., Шарма П., Эль Мадани М., Кинг А.Б., Гудман К.С., Сандерс А.Е. Клинические проблемы с грудью у педиатрических пациентов с низким уровнем риска: обзор практики с предлагаемыми рекомендациями. Педиатр Радиол. 2018;48:186–195. [PubMed] [Google Scholar] 24.Паттерсон С.К., Йорнс Дж.М. Случай ювенильного папилломатоза, также известного как «болезнь швейцарского сыра» Breast J. 2013;19:440–441. [PubMed] [Google Scholar] 25. Гилл Дж., Гринолл М. Ювенильный папилломатоз и рак молочной железы. J Surg Educ. 2007; 64: 234–236. [PubMed] [Google Scholar] 26. Це Г.М., Ниу Ю., Ши Х.Дж. Филлодозная опухоль молочной железы: обновление. Рак молочной железы. 2010;17:29–34. [PubMed] [Google Scholar] 27. Cecen E, Uysal KM, Harmancioglu O, Balci P, Kupelioglu A, Canda T. Phyllodes опухоль груди у девочки-подростка.Педиатр Гематол Онкол. 2008; 25:79–82. [PubMed] [Google Scholar] 28. Ябуучи Х., Соэда Х., Мацуо Ю., Окафудзи Т., Эгучи Т., Сакаи С. и др. Филлодная опухоль молочной железы: корреляция между результатами МРТ и гистологической степенью. Радиология. 2006; 241:702–709. [PubMed] [Google Scholar] 29. Суров А., Хольцхаузен Х.Дж., Винке А., Шмидт Дж., Томссен С., Арнольд Д. и др. Первичная и вторичная лимфома молочной железы: распространенность, клинические признаки и рентгенологические особенности. Бр Дж Радиол. 2012;85:e195–e205. [Бесплатная статья PMC] [PubMed] [Google Scholar]30.Винбек С., Мейер Х.Дж., Улиг Дж., Герцог А., Немат С., Тейфке А. и др. Рентгенологические характеристики интрамаммарных гематологических злокачественных новообразований: результаты немецкого многоцентрового исследования. Научный доклад 2017; 7:7435. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Мерфи Дж.Дж., Морзария С., Гоу К.В., Маги Дж.Ф. Рак молочной железы у ребенка 6 лет.
Phyllodes опухоль груди у девочки-подростка.Педиатр Гематол Онкол. 2008; 25:79–82. [PubMed] [Google Scholar] 28. Ябуучи Х., Соэда Х., Мацуо Ю., Окафудзи Т., Эгучи Т., Сакаи С. и др. Филлодная опухоль молочной железы: корреляция между результатами МРТ и гистологической степенью. Радиология. 2006; 241:702–709. [PubMed] [Google Scholar] 29. Суров А., Хольцхаузен Х.Дж., Винке А., Шмидт Дж., Томссен С., Арнольд Д. и др. Первичная и вторичная лимфома молочной железы: распространенность, клинические признаки и рентгенологические особенности. Бр Дж Радиол. 2012;85:e195–e205. [Бесплатная статья PMC] [PubMed] [Google Scholar]30.Винбек С., Мейер Х.Дж., Улиг Дж., Герцог А., Немат С., Тейфке А. и др. Рентгенологические характеристики интрамаммарных гематологических злокачественных новообразований: результаты немецкого многоцентрового исследования. Научный доклад 2017; 7:7435. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Мерфи Дж.Дж., Морзария С., Гоу К.В., Маги Дж.Ф. Рак молочной железы у ребенка 6 лет. J Pediatr Surg. 2000; 35: 765–767. [PubMed] [Google Scholar] 33. Горовиц Д.П., Шарма С.С., Коннолли Э., Гидеа-Аддео Д., Дойч И. Секреторная карцинома молочной железы: результаты выживаемости, эпидемиологии и базы данных конечных результатов.Грудь. 2012;21:350–353. [PubMed] [Google Scholar] 34. Ха С.М., Че Э.Ю., Ча Ч.Х., Ким Х.Х., Шин Х.Дж., Чой В.Дж. Ассоциация типов мутаций BRCA, особенностей визуализации и патологических находок у пациентов с раком молочной железы с мутациями BRCA1 и BRCA2. AJR Am J Рентгенол. 2017;209:920–928. [PubMed] [Google Scholar] 35. Ли М.В., Катабатина В.С., Бауэрсон М.Л., Митюл М.И., Шетти А.С., Элсайес К.М. и соавт. Рак, связанный с BRCA: роль визуализации в скрининге, диагностике и лечении. Рентгенография. 2017;37:1005–1023.[PubMed] [Google Scholar] 36. Мендельсон Э.Б., Бём-Велес М., Берг В.А. и соавт. ACR BI-RADS Atlas, ред. Система отчетности и данных по визуализации груди. 5-е изд. Рестон, Вирджиния: Американский колледж радиологии; 2013. УЗИ ACR BI-RADS; стр.
J Pediatr Surg. 2000; 35: 765–767. [PubMed] [Google Scholar] 33. Горовиц Д.П., Шарма С.С., Коннолли Э., Гидеа-Аддео Д., Дойч И. Секреторная карцинома молочной железы: результаты выживаемости, эпидемиологии и базы данных конечных результатов.Грудь. 2012;21:350–353. [PubMed] [Google Scholar] 34. Ха С.М., Че Э.Ю., Ча Ч.Х., Ким Х.Х., Шин Х.Дж., Чой В.Дж. Ассоциация типов мутаций BRCA, особенностей визуализации и патологических находок у пациентов с раком молочной железы с мутациями BRCA1 и BRCA2. AJR Am J Рентгенол. 2017;209:920–928. [PubMed] [Google Scholar] 35. Ли М.В., Катабатина В.С., Бауэрсон М.Л., Митюл М.И., Шетти А.С., Элсайес К.М. и соавт. Рак, связанный с BRCA: роль визуализации в скрининге, диагностике и лечении. Рентгенография. 2017;37:1005–1023.[PubMed] [Google Scholar] 36. Мендельсон Э.Б., Бём-Велес М., Берг В.А. и соавт. ACR BI-RADS Atlas, ред. Система отчетности и данных по визуализации груди. 5-е изд. Рестон, Вирджиния: Американский колледж радиологии; 2013. УЗИ ACR BI-RADS; стр. 128–130. [Google Академия] 37. Гордон П.Б., Ганьон Ф.А., Ланцковски Л. Твердые массы молочной железы, диагностированные как фиброаденома при тонкоигольной аспирационной биопсии: приемлемые темпы роста при длительном наблюдении. Радиология. 2003; 229: 233–238. [PubMed] [Google Scholar]
128–130. [Google Академия] 37. Гордон П.Б., Ганьон Ф.А., Ланцковски Л. Твердые массы молочной железы, диагностированные как фиброаденома при тонкоигольной аспирационной биопсии: приемлемые темпы роста при длительном наблюдении. Радиология. 2003; 229: 233–238. [PubMed] [Google Scholar]Симптомы и причины гинекомастии | Бостонская детская больница
Углубленное
Что вызывает гинекомастию?
Обычно это просто результат повышенного уровня эстрогена в период полового созревания.Этот вид гинекомастии почти всегда проходит со временем.
В редких случаях могут быть другие причины:
- Рецептурные препараты
- Безрецептурные лекарства
- Незаконные наркотики (такие как марихуана и стероиды)
- Опухоли
- Определенные генетические нарушения и состояния, такие как синдром Клайнфельтера.
Насколько распространена гинекомастия?
Это не является чем-то необычным или ненормальным у мальчиков-подростков. Временное увеличение груди часто происходит в подростковом возрасте, когда происходят гормональные изменения.
Временное увеличение груди часто происходит в подростковом возрасте, когда происходят гормональные изменения.
- Около половины всех мужчин в возрасте от 12 до 16 лет, переживающих период полового созревания, страдают той или иной формой гинекомастии в одной или обеих грудях.
- Обычно это временное состояние, и совершенно ненормально, чтобы грудь оставалась развитой и в конечном итоге полностью уплощалась в течение от нескольких месяцев до нескольких лет.
- Поскольку он обычно проходит сам по себе, обычно не требуется никакого лечения или хирургического вмешательства.
Можно ли это предотвратить?
Поскольку гинекомастия естественным образом возникает в организме в период полового созревания, ни один известный метод не может ее предотвратить.
Здоровый образ жизни с диетой и физическими упражнениями может повлиять на развитие груди. И имейте в виду, что некоторые формы незаконного употребления наркотиков связаны с гинекомастией.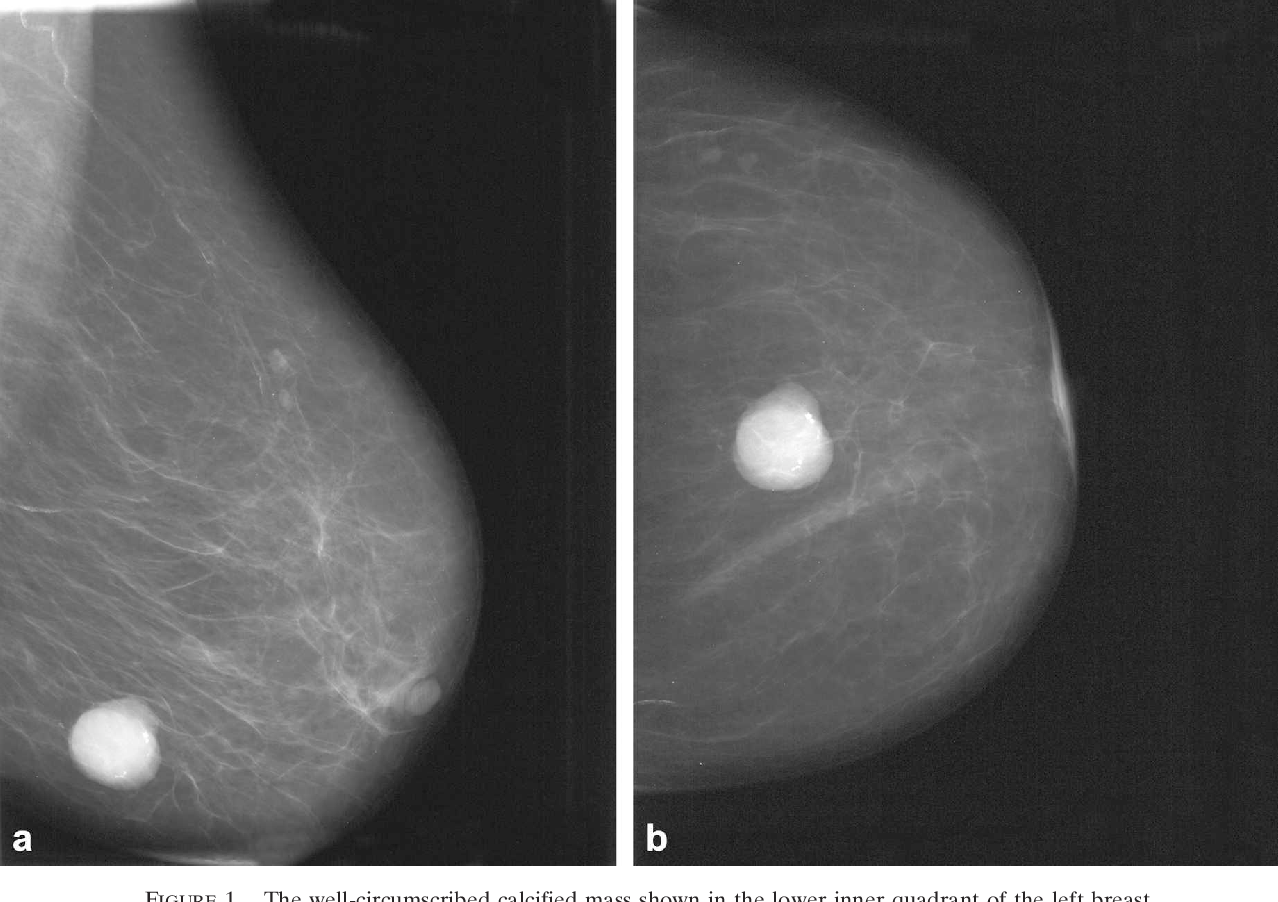
Каковы симптомы?
Гинекомастия не опасна физически, хотя иногда может указывать на более серьезные основные заболевания.Иногда мальчики с гинекомастией испытывают чувствительность, которую можно лечить с помощью лекарств.
Чаще возникают психологические и социальные проблемы, чем физические.
Имеются ли сопутствующие заболевания?
Псевдогинекомастия (или ложная гинекомастия) не имеет ничего общего с половым созреванием или гормонами.
- Это просто связано с тем, что у некоторых мужчин может быть лишний жир в области груди, из-за чего кажется, что у них есть грудь.
- Простой осмотр у врача может определить, есть ли у вашего ребенка гинекомастия или псевдогинекомастия.
- Гинекомастия может оказывать сильное эмоциональное воздействие на мальчиков и может включать чувство стыда, смущения и депрессию.
- Мальчики с гинекомастией часто скрывают свою грудь на публике или замыкаются в себе в обществе и избегают обсуждения своих проблем с родителями и сверстниками.

Свяжитесь с нашими специалистами напрямую, если гинекомастия причиняет вам или вашему сыну эмоциональный стресс.
Шишка груди | Мультимедийная энциклопедия | Медицинская информация
Масса грудиПрипухлость молочной железы — это припухлость, новообразование или припухлость в молочной железе.
Уплотнения в груди как у мужчин, так и у женщин вызывают беспокойство рак молочной железы , хотя большинство шишек не являются раком.
Соображения
И мужчины, и женщины всех возрастов имеют нормальную ткань молочной железы. Эта ткань реагирует на гормональные изменения. Из-за этого комки могут появляться и исчезать.
Из-за этого комки могут появляться и исчезать.
Уплотнения в груди могут появиться в любом возрасте:
- У младенцев мужского и женского пола при рождении могут быть уплотнения в груди из-за эстрогена их матери.Припухлость чаще всего исчезает сама по себе, когда эстроген выводится из организма ребенка.
- У молодых девушек часто развиваются «грудные зачатки», которые появляются непосредственно перед началом полового созревания. Эти удары могут быть нежными. Они распространены в возрасте около 9 лет, но могут возникнуть и в возрасте 6 лет.
- У мальчиков-подростков может развиться увеличение груди и уплотнение из-за гормональных изменений в середине полового созревания. Хотя это может расстраивать мальчиков, шишки или новообразования почти всегда исчезают сами по себе в течение нескольких месяцев.
Причины
Уплотнения у женщин часто обусловлены фиброзно-кистозными изменениями, фиброаденомами и кистами.
Фиброзно-кистозные изменения болезненные, комковатые груди. Фиброзно-кистозные изменения молочной железы не увеличивают риск рака молочной железы.Симптомы чаще всего усиливаются непосредственно перед менструацией, а затем улучшаются после ее начала.
фиброаденомы
доброкачественные комки, которые чувствуют себя резиновыми. Они легко перемещаются внутри ткани молочной железы. Как и фиброзно-кистозные изменения, они чаще всего возникают в репродуктивном возрасте.Они чаще всего не нежные. За исключением редких случаев, они не становятся злокачественными позже. Медицинский работник может почувствовать во время осмотра, является ли опухоль фиброаденомой. Однако единственный способ убедиться в этом — удалить опухоль или провести биопсию.
кисты представляют собой заполненные жидкостью мешочки, которые часто напоминают мягкий виноград.Иногда они могут быть болезненными, часто непосредственно перед менструацией.
Другие причины образования уплотнений в груди включают:
- Рак молочной железы.
- Травма. Кровь может собираться и ощущаться как комок, если ваша грудь сильно ушиблена. Эти шишки, как правило, проходят сами по себе в течение нескольких дней или недель.Если они не улучшатся, вашему врачу, возможно, придется слить кровь.
- Липома.
 Это скопление жировой ткани.
Это скопление жировой ткани. - Молочные кисты (мешочки, наполненные молоком) и инфекции ( мастит ), что может превратиться в абсцесс .Обычно это происходит, если вы кормите грудью или недавно родили ребенка.
Уход на дому
Обратитесь к своему врачу, если у вас появились какие-либо новые опухоли или изменения в молочной железе. Спросите о своих факторах риска рака молочной железы, а также о скрининге и профилактике рака молочной железы.
Когда обращаться к медицинскому работнику
Позвоните своему провайдеру, если:
- Кожа на груди имеет ямочки или морщины (как кожура апельсина).

- Во время ежемесячного самообследования вы обнаружили новое уплотнение в груди.
- У вас синяк на груди, но никаких травм не было.
- У вас есть выделения из сосков, особенно если они кровянистые или розоватые (с примесью крови).
- Ваш сосок вывернут (повернут внутрь), но обычно не вывернут.
Также звоните, если:
- Вы женщина в возрасте 20 лет и старше и хотите получить рекомендации по самостоятельному обследованию молочных желез.
- Вы женщина старше 40 лет и в течение последнего года не проходили маммографию.
Что ожидать в вашем офисе Посетите
Ваш провайдер получит от вас полную историю.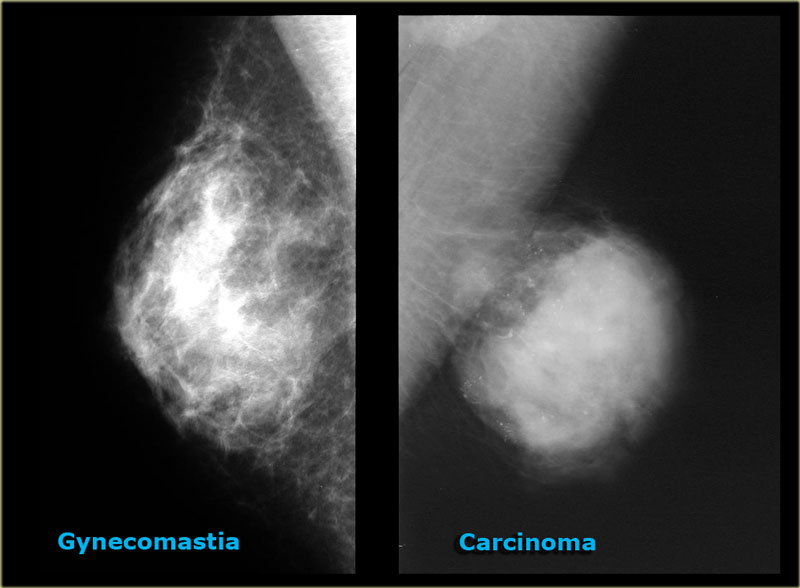 Вас спросят о факторах, которые могут увеличить риск
рак молочной железы
. Врач проведет тщательный осмотр груди.Если вы не знаете, как проводить самообследование молочных желез, попросите своего врача научить вас правильному методу.
Вас спросят о факторах, которые могут увеличить риск
рак молочной железы
. Врач проведет тщательный осмотр груди.Если вы не знаете, как проводить самообследование молочных желез, попросите своего врача научить вас правильному методу.
Вам могут задать такие вопросы по истории болезни, как:
- Когда и как вы впервые заметили припухлость?
- Есть ли у вас другие симптомы, такие как боль, выделения из сосков или лихорадка?
- Где находится шишка?
- Вы проводите самообследование молочных желез, и это новообразование появилось недавно?
- Были ли у Вас какие-либо травмы груди?
- Принимаете ли вы какие-либо гормоны, лекарства или добавки?
Следующие шаги, которые может предпринять ваш поставщик, включают:
- Закажите маммографию для выявления рака или УЗИ груди чтобы увидеть, является ли комок твердым или кистой
- Использование иглы для извлечения жидкости из кисты, которая будет исследована под микроскопом на наличие раковых клеток
- Заказать биопсия молочной железы
- Изучение любых выделений из соска под микроскопом
Способ лечения уплотнения молочной железы зависит от причины.
- Твердые уплотнения молочной железы часто удаляют хирургическим путем.
- Кисты можно дренировать в медицинском учреждении. Если удаляемая жидкость прозрачная или зеленоватая, а комок исчезает после ее дренирования, дальнейшее лечение не требуется. Если опухоль не исчезает или появляется снова, ее чаще всего удаляют хирургическим путем.
- Инфекции молочной железы лечат антибиотиками.
- Если вам поставили диагноз рак молочной железы , вы тщательно и тщательно обсудите свои варианты со своим поставщиком услуг.
Ссылки
Хант К. К., Грин М.С., Бухгольц Т.А.Заболевания молочной железы. В: Townsend CM, Beauchamp RD, Evers BM, et al, eds. Учебник хирургии Sabiston . 19 изд. Сент-Луис, Миссури: Эльзевир Сондерс; 2012: глава 36.
К., Грин М.С., Бухгольц Т.А.Заболевания молочной железы. В: Townsend CM, Beauchamp RD, Evers BM, et al, eds. Учебник хирургии Sabiston . 19 изд. Сент-Луис, Миссури: Эльзевир Сондерс; 2012: глава 36.
Джейкобс Л., Хардин Р. Лечение доброкачественных заболеваний молочной железы. В: Кэмерон Дж. Л., Кэмерон А. М., ред. Современная хирургическая терапия .11-е изд. Филадельфия, Пенсильвания: Эльзевир Сондерс; 2014: 565-567.
Шварц МХ. Грудь. В: Шварц М.Х., изд. Учебник физической диагностики . 7-е изд. Филадельфия, Пенсильвания: Эльзевир Сондерс; 2014: глава 13.
7-е изд. Филадельфия, Пенсильвания: Эльзевир Сондерс; 2014: глава 13.
Вольф А.С., Домчек С.М., Дэвидсон Н.Э. и соавт.Рак молочной железы. В: Niederhuber JE, Armitage JO, Doroshow JH и др., ред. Клиническая онкология Абелоффа . 5-е изд. Филадельфия, Пенсильвания: Эльзевир Сондерс; 2014: глава 91.
Потребление красного мяса и риск рака молочной железы | Новости
9 октября 2014 г. — Марьям С. Фарвид, приглашенный ученый и научный сотрудник Такеми в Гарвардской школе общественного здравоохранения, была первым автором двух недавних исследований, которые показали, что молодые женщины, которые ели больше красного мяса, имели более высокий риск рака груди.
В: Насколько сильно вы обнаружили связь между употреблением красного мяса и повышенным риском рака молочной железы?
A: Мы обнаружили, что женщины, которые ели больше всего красного мяса в подростковом или раннем взрослом возрасте, имели повышенный риск развития рака молочной железы в более позднем возрасте. Увеличение потребления красного мяса на одну порцию в день в подростковом возрасте было связано с повышением риска рака молочной железы в пременопаузе на 22%, а увеличение каждой порции в день в раннем взрослом возрасте было связано с повышением риска рака молочной железы на 13% в целом.Те, кто ел больше мяса птицы в течение того же периода, имели более низкий риск развития рака молочной железы.
Конечно, красное мясо — не единственный фактор риска рака молочной железы. И это обсервационное исследование, поэтому мы не можем сказать, что употребление красного мяса было единственной причиной, по которой эти женщины заболели раком. Но наш анализ принял во внимание большинство известных факторов риска рака молочной железы, и мы сделали поправку на курение, употребление алкоголя, возраст, гормональную терапию и использование оральных контрацептивов. Тем не менее, красное мясо было одним из важных факторов риска рака молочной железы.
Тем не менее, красное мясо было одним из важных факторов риска рака молочной железы.
В: Некоторые предыдущие исследования не обнаружили связи между красным мясом и раком молочной железы. Как вы объясняете это несоответствие?
A: Разница между нашим исследованием и другими исследованиями заключается в периоде измерения воздействия. В большинстве исследований измерялся рацион женщин среднего и старшего возраста. Мы рассмотрели подростковый и ранний взрослый возраст, поскольку в этом возрасте молочные железы, по-видимому, более восприимчивы к канцерогенному воздействию.
Мы разработали эту гипотезу на основе результатов атомных бомбардировок Хиросимы и Нагасаки.Девочки и молодые женщины, подвергшиеся воздействию этого излучения, впоследствии имели более высокий риск развития рака молочной железы. Но женщины, подвергшиеся воздействию в возрасте 40 лет и старше, не имели повышенного риска.
Кроме того, женщины часто уменьшают количество красного мяса, которое они едят в среднем возрасте, поэтому более низкое потребление красного мяса в возрасте 50 лет не обязательно означает, что женщины потребляли мало в возрасте 20 лет.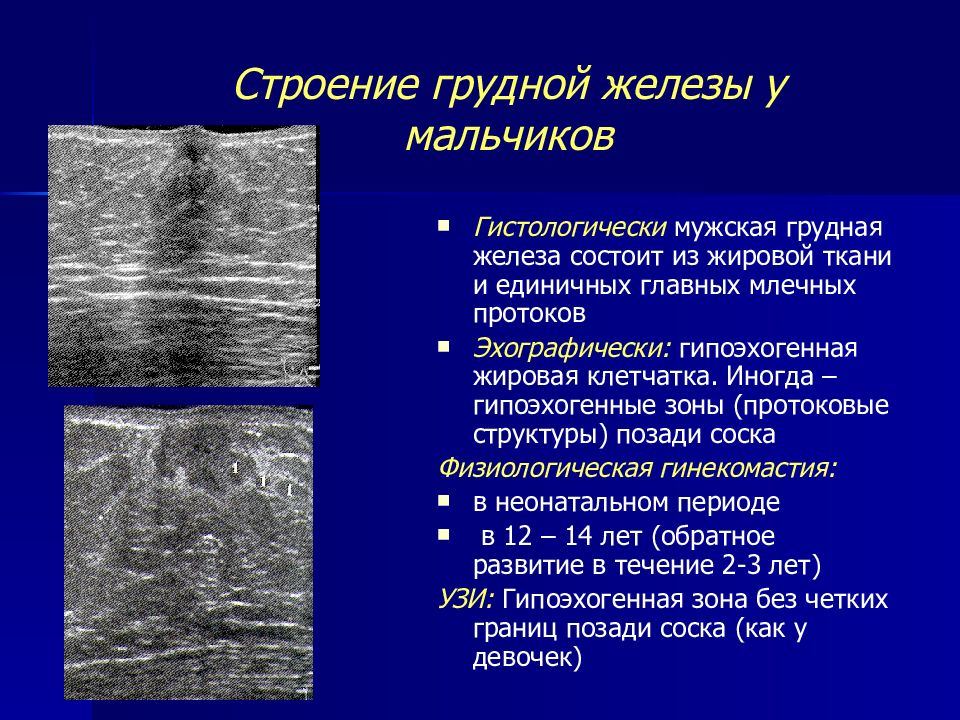
В: Основываясь на ваших выводах, каковы ваши рекомендации для женщин и будут ли они отличаться в зависимости от возраста женщины?
A: Женщинам не обязательно становиться вегетарианцами и отказываться от красного мяса.Но если они уменьшат количество потребляемого красного мяса, например, будут есть его один раз в неделю вместо двух раз в день, то у них снизится риск развития рака молочной железы. Хорошая новость заключается в том, что они могут заменить красное мясо другими источниками белка, включая птицу, бобовые, орехи или рыбу. Женщины получат наибольшую пользу, если сделают это раньше, чем позже.
А поскольку красное мясо — не единственный фактор риска рака молочной железы, мы рекомендуем женщинам вести здоровый образ жизни: пить меньше алкоголя, не курить и заниматься физической активностью.
Читать Потребление мяса подростками и риск рака молочной железы ( International Journal of Cancer )
Читать Источники пищевого белка в раннем взрослом возрасте и заболеваемость раком молочной железы: проспективное когортное исследование ( BMJ )
— Эми Родер
Опухоли молочных желез у детей и подростков
У детей и подростков опухоли молочной железы почти всегда доброкачественные, самокупирующиеся и лечатся консервативно, в отличие от взрослых, где злокачественные опухоли встречаются относительно часто и часто требуют удаления. 1-5 Кроме того, у молодых людей чаще встречаются нормальные варианты развития, которые могут имитировать опухоль. В этой статье описываются особенности визуализации вариантов развития и новообразований молочной железы у детей и подростков, а также связанные с ними клинические данные, которые могут облегчить диагностику и соответствующее лечение этих пациентов.
1-5 Кроме того, у молодых людей чаще встречаются нормальные варианты развития, которые могут имитировать опухоль. В этой статье описываются особенности визуализации вариантов развития и новообразований молочной железы у детей и подростков, а также связанные с ними клинические данные, которые могут облегчить диагностику и соответствующее лечение этих пациентов.
Визуализирующая оценка молочной железы у детей
Ультрасонография является основным методом визуализации молочных желез у детей и подростков, в отличие от взрослых, где маммография является стандартным скрининговым исследованием. 1,2,5 Маммография не используется рутинно у молодых людей, так как детская грудь более плотная, чем взрослая, что может ограничивать чувствительность маммографии. В маммографии также используется ионизирующее излучение, и принцип радиационного облучения молодого населения заключается в поддержании дозы облучения на разумно достижимом низком уровне. Компьютерная томография и магнитно-резонансная томография (МРТ) являются вспомогательными исследованиями, которые могут быть полезны для характеристики образований молочной железы, когда сонография сомнительна, а также для оценки распространенности метастатического заболевания или первичной опухоли при планировании хирургического вмешательства.
Нормальное развитие молочной железы
Ультразвуковые изображения до телархе показывают полосу эхогенной ретроареолярной ткани впереди грудной мышцы (рис. 1А). Когда начинается развитие груди, зачаток груди выглядит как ретроареолярная гипоэхогенная масса (рис. 1В). По мере развития груди увеличивается фиброзно-жировая и железистая ткани. В зрелой груди УЗИ показывает передний подкожный жировой слой, прилежащую железистую ткань, которая является эхогенной, и жировую ткань, которая является гипоэхогенной, и заднюю грудную мышцу.В жировой ткани можно отметить линейную эхогенную полосу, представляющую соединительную ткань (рис. 1С).
Новообразования молочной железы
Преждевременный телархе
Преждевременное телорхе — это начало развития молочной железы у женщин в возрасте до 8 лет. Это может быть изолированным или связанным с истинным преждевременным половым созреванием. Изолированное преждевременное телархе обычно возникает у девочек в возрасте от 1 до 3 лет, у которых пальпируются одно- или двусторонние субареолярные образования. Сонография показывает гипоэхогенное образование в подкожных тканях перед мускулатурой грудной клетки, представляющее собой развивающийся зачаток молочной железы (рис. 2).
Сонография показывает гипоэхогенное образование в подкожных тканях перед мускулатурой грудной клетки, представляющее собой развивающийся зачаток молочной железы (рис. 2).
Гинекомастия
Гинекомастия — это увеличение груди у мужчин, которое клинически проявляется болезненным твердым субареолярным узлом. Физиологическая гинекомастия имеет пик частоты в два периода: в неонатальном периоде и в подростковом возрасте. У новорожденных увеличение груди связано со стимуляцией материнских гормонов в утробе матери. 5 В период полового созревания гинекомастия возникает примерно в возрасте 13–14 лет, и ею страдает до 75% подростков мужского пола. Обычно это проходит в течение от нескольких месяцев до 2 лет. 4,6 Патологическая гинекомастия связана с феминизирующими опухолями коры надпочечников, эстроген-продуцирующими опухолями яичек (клетки Сертоли или Лейдига), гонадотропин-секретирующими опухолями и другими состояниями, связанными с повышенным уровнем гонадотропинов (гепатобластома, пролактиномы, синдром Клайнфельтера, синдром тестикулярной феминизации, и нейрофиброматоз типа 1 и лекарственные препараты (эстрогены, анаболические стероиды, наперстянка, кортикостероиды, трициклические антидепрессанты и марихуана) 4,6 Независимо от причины, сонография показывает гипоэхогенную ткань молочной железы в субареолярной области, аналогичную той, что наблюдается на ранних стадиях нормального развитие груди у девочек-подростков и при преждевременном телархе (рис.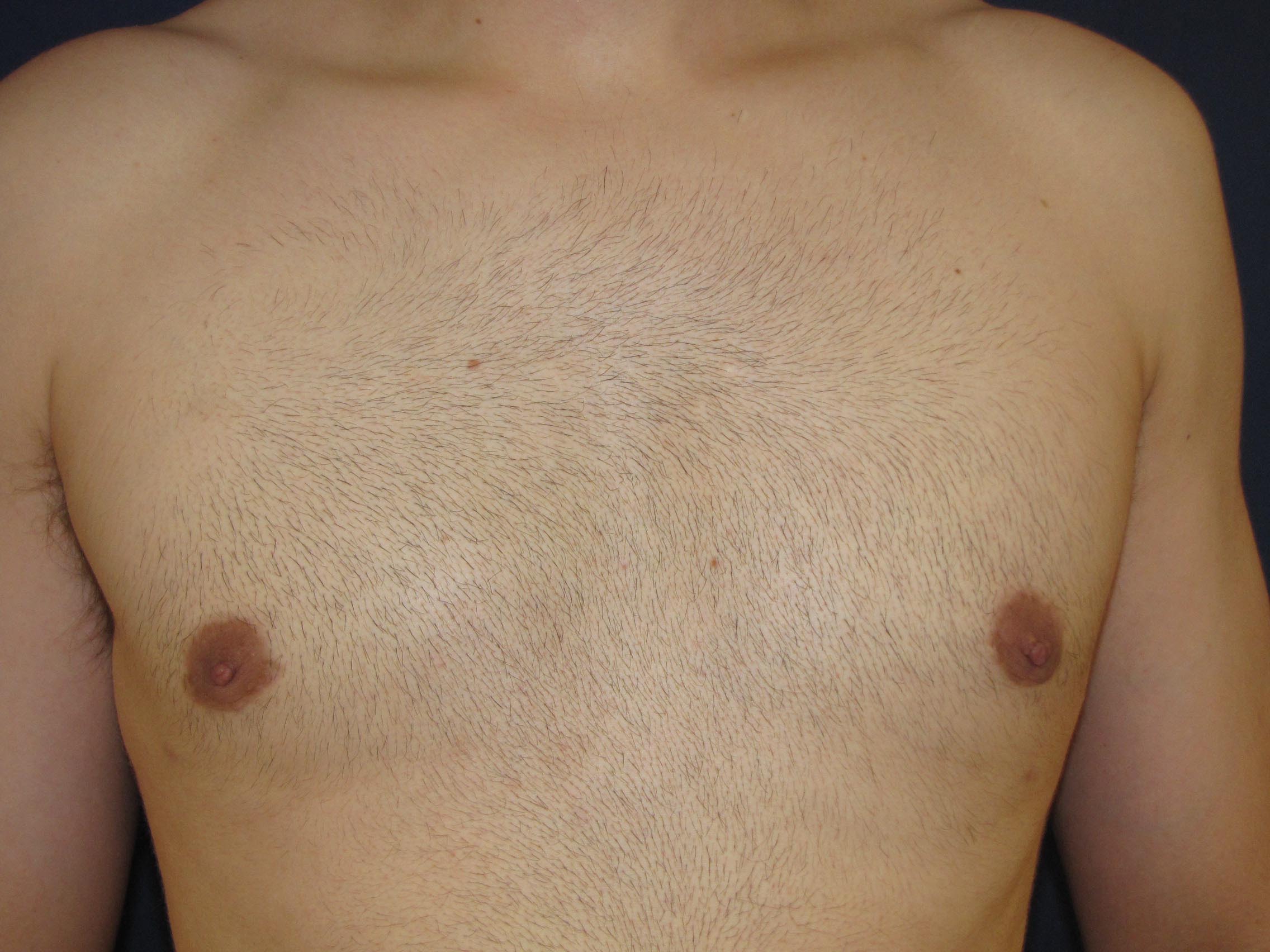 1В и рис. 2). 1,2,5,6
1В и рис. 2). 1,2,5,6
Неопухолевые кистозные поражения
Эктазия протоков
Эктазия протока возникает, когда ретроареолярный проток заполняется жидкостью. Заболевание часто не вызывает никаких симптомов, но у некоторых подростков могут проявляться пальпируемое образование, выделения из сосков, болезненность молочных желез или воспаление (перидуктальный мастит). 1-4 Ультрасонография показывает ретроареолярные тубулярные анэхогенные структуры, представляющие собой протоки, заполненные жидкостью. Инфицированные протоки могут содержать мусор или перегородки (рис. 3). 1-3,7
Фиброзно-кистозная болезнь
Пораженные девочки-подростки имеют циклически болезненные молочные железы, узловатые при пальпации. 1-3 Сонографические признаки включают одиночные или множественные кисты, расширенные протоки и высокоэхогенные очаги с задней акустической тенью, представляющие собой фиброзную ткань (рис. 4). 1,2 Эти кисты могут быть простыми или сложными и сильно различаться по размеру.
Посттравматические поражения
Посттравматические гематомы и жировой некроз чаще всего являются вторичными по отношению к спортивным травмам и представляют собой болезненные массы. 4 На УЗИ острая гематома гиперэхогенна по отношению к окружающим тканям, становится комплексной с внутренним эхом и со временем становится анэхогенной (рис. 5). Жировой некроз проявляется как эхогенное сложное образование с кистозными пространствами или как гипоэхогенное образование с задней акустической тенью или без нее.
Мастит и абсцесс
Воспалительные поражения могут возникать в результате инфицирования закупоренного субареолярного протока, целлюлита в области грудной стенки, пирсинга сосков или травмы молочной железы. 1,2,4,8,9 Пораженные пациенты проявляют болезненность, уплотнение и эритематозную грудь. При УЗИ мастит выглядит как утолщенная, эхогенная ткань молочной железы с центральным цветовым допплеровским потоком. Абсцесс выглядит как гипоэхогенное толстостенное образование с внутренним дебрисом и периферическим цветным допплеровским потоком (рис.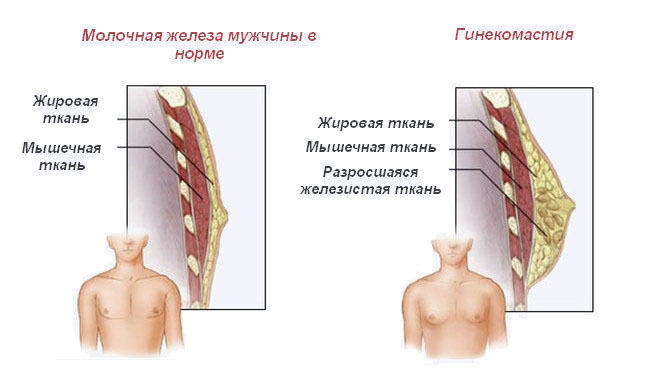 6).
6).
Доброкачественные новообразования
Фиброаденома
Фиброаденомы являются наиболее распространенными твердыми образованиями молочной железы в этой популяции, составляя до 90% масс молочной железы. 1,2,10 Классически фиброаденомы представляют собой подвижные безболезненные массы молочной железы. Характерными сонографическими признаками являются хорошо очерченное гипоэхогенное образование овальной формы, ширина которого больше высоты. Диаметр обычно колеблется от 2 до 3 см. Цветной допплер обычно показывает внутренний кровоток (рис. 7). 1,2,5,9,10 Термин гигантская фиброаденома зарезервирован для фиброаденом, диаметр которых превышает 5 см. Гигантская фиброаденома может содержать заполненные жидкостью щели (рис. 8). 9,10
Опухоли Phyllodes, также известные как phyllodes цистосаркомы, гистологически сходны с фиброаденомами, но демонстрируют более стромальную пролиферацию. У пораженных пациентов наблюдается большое, безболезненное, твердое, подвижное образование.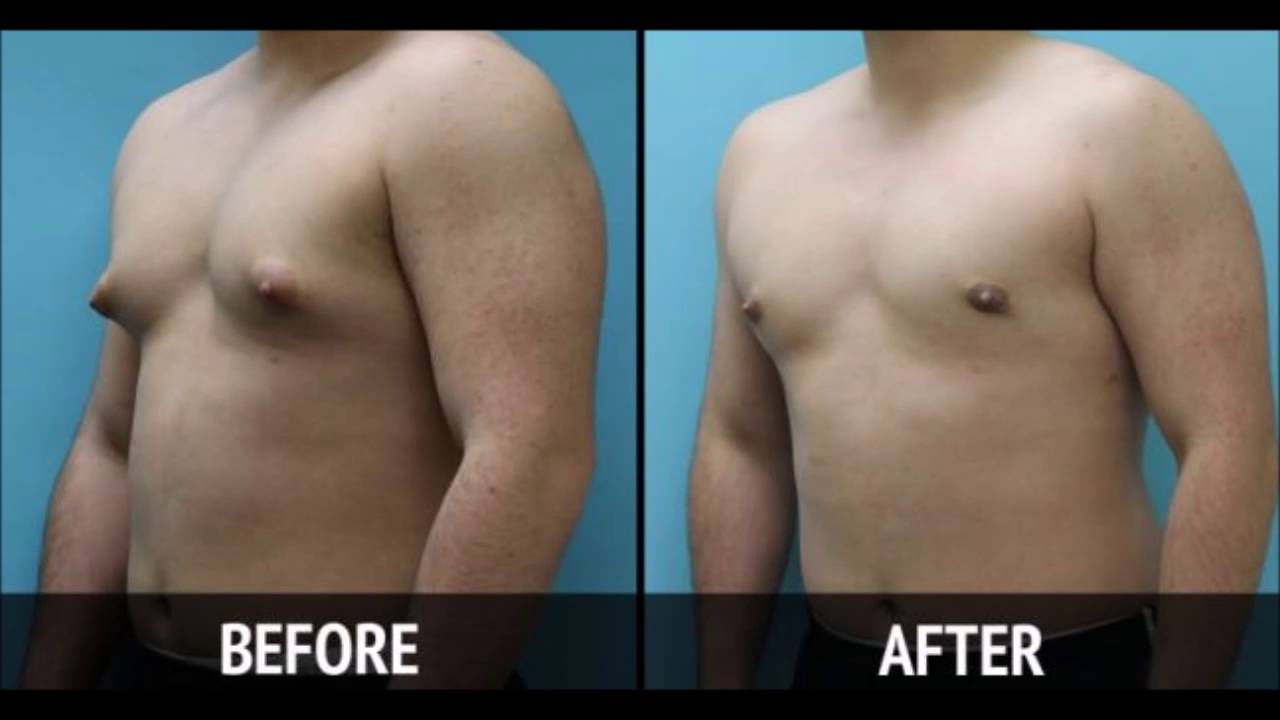 3 Phyllodes опухоли могут быть доброкачественными, промежуточными или злокачественными. Злокачественные опухоли имеют повышенную скорость митоза и проявляют сходство с саркомами. 11 Несмотря на их гистологическую классификацию, все филлодные опухоли могут метастазировать и локально рецидивировать.Сонографические данные аналогичны гигантской фиброаденоме (рис. 9). 1,2,5,12 Для дифференциации требуется образец ткани.
3 Phyllodes опухоли могут быть доброкачественными, промежуточными или злокачественными. Злокачественные опухоли имеют повышенную скорость митоза и проявляют сходство с саркомами. 11 Несмотря на их гистологическую классификацию, все филлодные опухоли могут метастазировать и локально рецидивировать.Сонографические данные аналогичны гигантской фиброаденоме (рис. 9). 1,2,5,12 Для дифференциации требуется образец ткани.
Гемангиома
Инфантильная гемангиома — распространенное новообразование молочной железы у младенцев раннего возраста. Он проходит фазу начального роста, за которой следует инволюция в течение от нескольких месяцев до нескольких лет, и поэтому лечится консервативно. Гемангиома гипоэхогенна по сравнению с окружающими тканями и показывает сосудистые каналы на цветных допплеровских изображениях (рис. 10). 2
Ювенильный папилломатоз
Ювенильный папилломатоз, также называемый болезнью «швейцарского сыра», обычно проявляется твердым, подвижным образованием на периферии молочной железы у подростков и молодых женщин. 3 Это было связано с положительным семейным анамнезом рака молочной железы (от 33% до 58% случаев), и приблизительно от 5% до 15% пораженных пациентов имеют сопутствующий рак молочной железы. 1 При УЗИ он выглядит как сложное образование с небольшими кистами и эхогенными перегородками, а также с нечеткими или четко очерченными краями (рис. 11). 1-3,13
3 Это было связано с положительным семейным анамнезом рака молочной железы (от 33% до 58% случаев), и приблизительно от 5% до 15% пораженных пациентов имеют сопутствующий рак молочной железы. 1 При УЗИ он выглядит как сложное образование с небольшими кистами и эхогенными перегородками, а также с нечеткими или четко очерченными краями (рис. 11). 1-3,13
Внутрипротоковая папиллома
Внутрипротоковая папиллома — это доброкачественное разрастание эпителия протоков, которое может наблюдаться у девочек и мальчиков подросткового возраста. 1,2,14 У пациентов часто наблюдаются серозные или серозно-геморрагические выделения из сосков. Сонографические данные представляют собой эхогенное внутрипротоковое образование с расширением протока или без него и с внутренним потоком при допплеровском исследовании (рис. 12). 14
Псевдоангиоматозная стромальная гиперплазия
Псевдоангиоматозная стромальная гиперплазия (ПАСГ) представляет собой доброкачественную миофибробластную пролиферацию.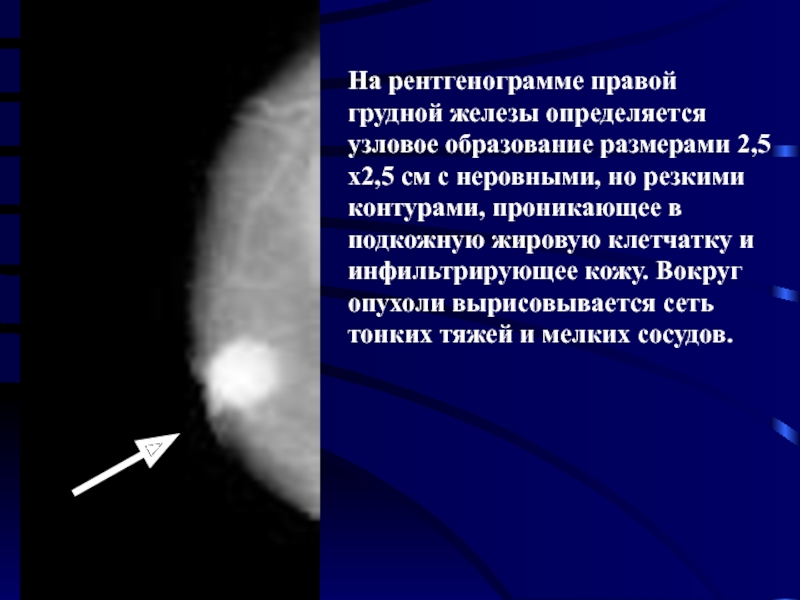 1,2,5 У пораженных пациентов наблюдается безболезненное, твердое, подвижное образование. Сонографические данные представляют собой хорошо очерченное гипоэхогенное овоидное образование с длинной осью, ориентированной параллельно грудной стенке, похожее на фиброаденому (рис. 13). 1,2,5,15 Для дифференциации от фиброаденомы требуется забор ткани.
1,2,5 У пораженных пациентов наблюдается безболезненное, твердое, подвижное образование. Сонографические данные представляют собой хорошо очерченное гипоэхогенное овоидное образование с длинной осью, ориентированной параллельно грудной стенке, похожее на фиброаденому (рис. 13). 1,2,5,15 Для дифференциации от фиброаденомы требуется забор ткани.
Образования молочной железы от метастатического заболевания и первичного рака молочной железы
Злокачественные опухоли в педиатрической возрастной группе встречаются крайне редко, составляя менее 5% масс молочной железы, и они с большей вероятностью являются метастатическими, чем первичный рак молочной железы. 1–3,11 Первичные злокачественные новообразования, метастазирующие в молочную железу, включают рабдомиосаркому, нейробластому, карциному почки, лимфому Ходжкина и лейкемию. 1,2,16 Радиационное облучение во время развития молочной железы является фактором риска развития рака молочной железы в более позднем возрасте. 17 Секреторная карцинома является наиболее распространенным первичным раком молочной железы, за которым следует внутрипротоковый рак. 18 Медуллярный и воспалительный рак также были описаны у детей, хотя они встречаются гораздо реже, чем секреторная карцинома. 11
17 Секреторная карцинома является наиболее распространенным первичным раком молочной железы, за которым следует внутрипротоковый рак. 18 Медуллярный и воспалительный рак также были описаны у детей, хотя они встречаются гораздо реже, чем секреторная карцинома. 11
При физикальном обследовании первичный рак молочной железы и метастазы представляют собой твердое неподвижное образование неправильной формы.При УЗИ обе массы выглядят как гипоэхогенные поражения с неровными, заостренными или дольчатыми краями, внутренней неоднородностью, длинной осью, перпендикулярной грудной стенке, и различной задней акустической тенью (рис. 14,15). 1,2,16,19
Заключение
Опухоли молочных желез у детей относительно редко встречаются у детей и подростков, и их спектр отличается от такового у взрослых. Большинство поражений являются доброкачественными, это либо вариации нормального развития молочной железы, либо неопластический процесс с доброкачественным течением. К счастью, первичный рак молочной железы и метастатические поражения невероятно редки. Из-за отсутствия излучения ультразвуковое исследование является идеальным визуализирующим исследованием для выявления, характеристики и руководства лечением поражений молочной железы у молодых людей. Осведомленность об ультразвуковом изображении нормального развития молочной железы и специфических поражений наряду с клиническими данными имеет важное значение для постановки точного диагноза.
К счастью, первичный рак молочной железы и метастатические поражения невероятно редки. Из-за отсутствия излучения ультразвуковое исследование является идеальным визуализирующим исследованием для выявления, характеристики и руководства лечением поражений молочной железы у молодых людей. Осведомленность об ультразвуковом изображении нормального развития молочной железы и специфических поражений наряду с клиническими данными имеет важное значение для постановки точного диагноза.
Ссылки
- Chang E, Cube R, Hall GJ и др. Массы молочной железы у детей и подростков: рентгенопатологическая корреляция. Рентгенография . 2009 г.; 29:907-931.
- Чанг Э., Сигел М.Дж. Грудь. В Siegel MJ, изд. Педиатрическая сонография . 4-е изд. Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс; 2010: 200-213
- ДеСильва Н.К., Брандт М.Л. Заболевания молочных желез у детей и подростков, часть 2: новообразования молочных желез. J Педиатр Подростковый Гинек.
 2006 г.; 19:415-418.
2006 г.; 19:415-418. - Грейданус Д.Е., Матыцина Л., Гейнс М. Болезни молочных желез у детей и подростков. Первичный уход .2006 г.; 33:455-502.
- Kaneda HJ, Mack J, Kasales CJ, et al. Педиатрические и подростковые массы молочной железы: обзор патофизиологии, визуализации, диагностики и лечения. AJR Am J Рентгенол . 2013; 200:W204-W212.
- Уэлч С.Т., Бэбкок Д.С., Баллард Э.Т. Сонография новообразований молочной железы у детей мужского пола: гинекомастия и не только. Педиатр Радиол . 2004 г.; 34:952-957.
- Huneeus A, Schilling A, Horvath E, et al. Ретроареолярные кисты у подростков. J Педиатр Подростковый. Гинекол. 2003; 16:45-49.
- Бордерс Х, Мичалиска Г, Гербарски К.С. Сонографические признаки неонатального мастита и абсцесса молочной железы. Педиатр Радиол . 2009 г.; 39:955-58.
- Kronemer KA, Rhee K, Siegel MJ, et al. Сонография новообразований молочной железы в оттенках серого у девочек-подростков.
 J УЗИ Мед . 2001 г.; 20:491-496.
J УЗИ Мед . 2001 г.; 20:491-496. - Санчес Р., Ладино-Торрес М.Ф., Бернат Дж.А. и др. Фиброаденомы молочной железы в педиатрической популяции: общие и необычные сонографические данные. Педиатр Радиол . 2010 г.; 40:1681-1689.
- Кеннеди Р.Д., Бугиди JC. Лечение опухолей молочной железы у детей и подростков. Семин Пласт Сург . 2013; 27:19-22.
- Йилмаз Э., Сал С., Лебе Б. Дифференциация филлодных опухолей по сравнению с фиброаденомами. Акта Радиол . 2002 г.; 43:34-39.
- Kersschot EA, Hermans ME, Pauwels C, et al. Ювенильный папилломатоз молочной железы: сонографическая картина. Радиология . 1988 год; 169:631-633.
- Ганесан С., Картик Г., Джоши М. и др.Ультразвуковой спектр при внутрипротоковых папиллярных новообразованиях молочной железы. БрДж Радиол . 2006 г.; 79:843-849.
- Mercado CL, Naidrich SA, Hamele-Bena D, et al. Псевдоангиоматозная стромальная гиперплазия молочной железы: сонографические особенности с гистопатологической корреляцией.
 Грудь J . 2004 г.; 10:427–432.
Грудь J . 2004 г.; 10:427–432. - Kumar PRG, Grossman Z, Scorza L, et al. Изолированный экстрамедуллярный рецидив острого лимфобластного лейкоза молочной железы у девочки-подростка: рентгенологические данные и обсуждение. Педиатр Радиол . 2010 г.; 40:773-776.
- Moskowitz CS, Chou JF, Wolden SL, et al. Рак молочной железы после лучевой терапии грудной клетки по поводу рака у детей. J Клин Онкол . 2014; 32:2217-2223.
- Горовиц Д.П., Шарма К.С., Коннолли Э. и др. Секреторная карцинома молочной железы: результаты по выживаемости, эпидемиологии и базе данных конечных результатов. Грудь . 2012 г.; 21: 350–353.
- Мун С.Х., Ко Э.Ю., Хань Б.К. и др. Секреторный рак молочной железы: сонографические особенности. J УЗИ Мед. 2008 г.; 27:947–954.
Микроокружение молочной железы определяет судьбу клеток-предшественников in vivo
Молочная железа — уникальный орган, который постоянно претерпевает изменения в постнатальном развитии. У мышей молочная железа формируется с помощью сигналов от концевых зачатков, которые направляют рост и удлинение протоков. Интересно, что вполне вероятно, что весь клеточный репертуар молочной железы формируется из одной предшествующей клетки.Кроме того, для получения потомства различных клонов (напр., люминальных и миоэпителиальных клеток) сигналы от микроокружения локальной ткани влияют на судьбу стволовых/прогениторных клеток молочных желез. Данные показали, что клетки из микроокружения молочной железы перепрограммируют взрослые соматические клетки из других органов (семенников, нерва) в клетки, которые производят молоко и экспрессируют белки эпителиальных клеток молочной железы. Аналогичные результаты были получены для клеток онкогенной эпителиальной карциномы человека. В настоящее время неясно, как детерминированная сила микроокружения молочной железы контролирует судьбу эпителиальных клеток.Несмотря на это, сигналы, генерируемые микроокружением, оказывают сильное влияние на дифференцировку клеток-предшественников in vivo .
У мышей молочная железа формируется с помощью сигналов от концевых зачатков, которые направляют рост и удлинение протоков. Интересно, что вполне вероятно, что весь клеточный репертуар молочной железы формируется из одной предшествующей клетки.Кроме того, для получения потомства различных клонов (напр., люминальных и миоэпителиальных клеток) сигналы от микроокружения локальной ткани влияют на судьбу стволовых/прогениторных клеток молочных желез. Данные показали, что клетки из микроокружения молочной железы перепрограммируют взрослые соматические клетки из других органов (семенников, нерва) в клетки, которые производят молоко и экспрессируют белки эпителиальных клеток молочной железы. Аналогичные результаты были получены для клеток онкогенной эпителиальной карциномы человека. В настоящее время неясно, как детерминированная сила микроокружения молочной железы контролирует судьбу эпителиальных клеток.Несмотря на это, сигналы, генерируемые микроокружением, оказывают сильное влияние на дифференцировку клеток-предшественников in vivo .
1. Введение
Первое документальное описание клеток со стволовыми свойствами, обнаруженных в определенной среде, произошло более века назад, когда Александр Максимов предположил, что определенные клетки, расположенные в системе кроветворения, обладают регенеративными свойствами [1]. Много лет спустя McCulloch и Till идентифицировали самообновляющиеся клетки в костном мозге мыши [2].Совсем недавно Эванс, Кауфман и Мартин продемонстрировали, что эмбриональные стволовые клетки присутствуют во внутренней клеточной массе эмбриона мыши [3, 4]. Стволовые клетки/клетки-предшественники находятся в каждой ткани организма и выполняют различные клеточные функции, которые поддерживают тканевый гомеостаз. Направление этих функций — окружающая среда, которая состоит из стромы, эпителия и других типов клеток, характерных для этой области.
2. Концепция ниши
Выявленный более 30 лет назад при изучении кроветворной системы Р.Шофилд впервые ввел термин «ниша» (также известный как локальная тканевая микросреда) при определении микроанатомического пространства, включающего все клеточные, молекулярные и физические факторы, которые взаимодействуют со стволовой клеткой и регулируют ее [5]. Тканеспецифические ниши (микроокружения) составляют основную единицу физиологии, которая объединяет сигналы, передаваемые клеткам ниши для интерпретации [6]. Было обнаружено, что при эксплантации в условиях 2D-культуры клетки ниши часто теряют свои нормальные тканеспецифические функции, что указывает на то, что тканевое микроокружение регулирует судьбу клеток-предшественников [7].При возвращении в условия, более близкие к микроокружению ткани, клетка восстанавливает специфические черты и функции и выглядит более нормальной [8].
Тканеспецифические ниши (микроокружения) составляют основную единицу физиологии, которая объединяет сигналы, передаваемые клеткам ниши для интерпретации [6]. Было обнаружено, что при эксплантации в условиях 2D-культуры клетки ниши часто теряют свои нормальные тканеспецифические функции, что указывает на то, что тканевое микроокружение регулирует судьбу клеток-предшественников [7].При возвращении в условия, более близкие к микроокружению ткани, клетка восстанавливает специфические черты и функции и выглядит более нормальной [8].
Концепция ниши была четко определена с использованием Caenorhabditis elegans и Drosophila melanogaster [9]. Исследования с использованием этих двух моделей подчеркивают важность как межклеточных контактов, так и факторов диффузии в управлении клеточной судьбой. Например, асимметричное клеточное деление зародышевой стволовой клетки C.elegans регулируется нишевой клеткой, называемой клеткой дистального кончика. Клетка дистального конца экспрессирует дельта-гомолог лиганда Lag-2, а стволовые клетки зародышевой линии экспрессируют рецептор Glp-1 [10].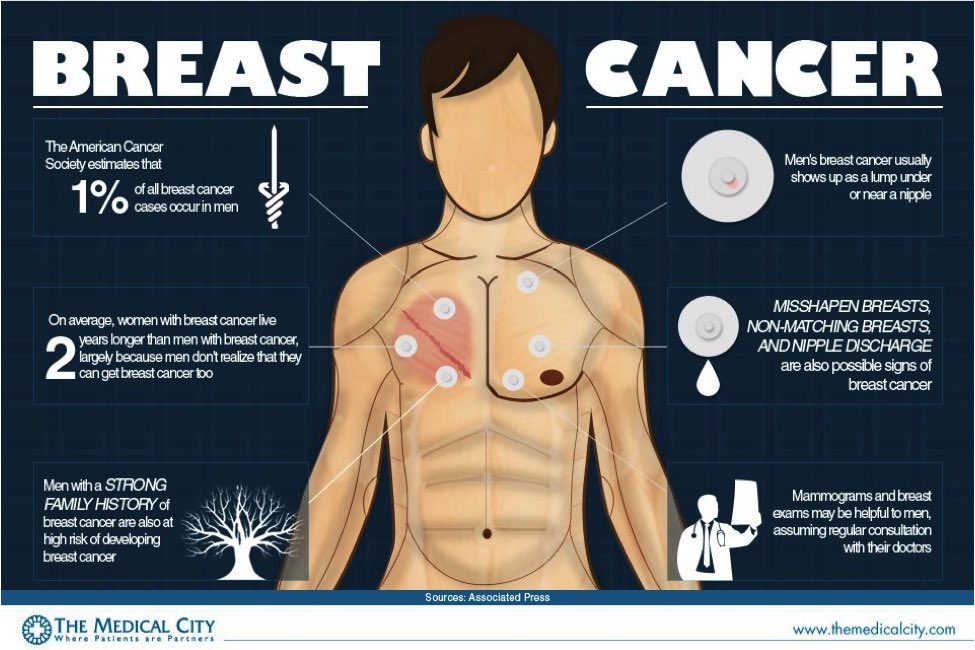 Связывание Lag-2 с Glp-1 приводит к митотическому делению стволовых клеток зародышевой линии у C. elegans (рис. 1) . Альтернативно, уменьшение связывания (и последующее накопление РНК-связывающего белка Gld-1) приводит к тому, что стволовые клетки зародышевой линии подвергаются мейозу [11] (рис. 1).Более того, диффундирующие факторы, такие как обнаруженные в сигнальном пути Wnt, влияют на развитие клеток дистальных кончиков. Потеря функции pop-1 и sys-1 ( C. elegans , гомологи Tcf млекопитающих и β -catenin, соответственно) приводит к снижению продукции клеток дистального конца, что способствует мейотическому делению дифференцированными зародышевыми клетками . C. elegans [12]. Подобные события, подчеркивающие важность физического контакта и диффузионных факторов тканевого микроокружения в поддержании и регуляции зародышевых стволовых клеток, также были хорошо задокументированы у D.melanogaster [9, 13, 14].
Связывание Lag-2 с Glp-1 приводит к митотическому делению стволовых клеток зародышевой линии у C. elegans (рис. 1) . Альтернативно, уменьшение связывания (и последующее накопление РНК-связывающего белка Gld-1) приводит к тому, что стволовые клетки зародышевой линии подвергаются мейозу [11] (рис. 1).Более того, диффундирующие факторы, такие как обнаруженные в сигнальном пути Wnt, влияют на развитие клеток дистальных кончиков. Потеря функции pop-1 и sys-1 ( C. elegans , гомологи Tcf млекопитающих и β -catenin, соответственно) приводит к снижению продукции клеток дистального конца, что способствует мейотическому делению дифференцированными зародышевыми клетками . C. elegans [12]. Подобные события, подчеркивающие важность физического контакта и диффузионных факторов тканевого микроокружения в поддержании и регуляции зародышевых стволовых клеток, также были хорошо задокументированы у D.melanogaster [9, 13, 14].
3. Структура молочной железы
Молочная железа мыши является надежной моделью для изучения влияния тканевого микроокружения на стволовые клетки/клетки-предшественники. Было обнаружено, что функциональная молочная железа мыши может быть регенерирована всего из одной клетки-предшественника молочной железы [15, 16], в дополнение к регенерации любой части самой железы [17, 18]. Эта характеристика ниши не меняется со временем и не зависит от репродуктивного анамнеза [19].Следовательно, вполне вероятно, что стволовые/прогениторные клетки молочной железы сохраняются в микроокружении молочной железы на протяжении всей жизни.
Было обнаружено, что функциональная молочная железа мыши может быть регенерирована всего из одной клетки-предшественника молочной железы [15, 16], в дополнение к регенерации любой части самой железы [17, 18]. Эта характеристика ниши не меняется со временем и не зависит от репродуктивного анамнеза [19].Следовательно, вполне вероятно, что стволовые/прогениторные клетки молочной железы сохраняются в микроокружении молочной железы на протяжении всей жизни.
Молочная железа состоит из двух тканевых компартментов, разделенных базальной мембраной: эпителия, включающего протоки и дольки, и стромы, состоящей из соединительной ткани, образующей жировую ткань молочной железы [20]. В нелактирующей взрослой груди строма занимает ту большую часть ткани, где доля фиброзной и жировой ткани меняется с возрастом [21].Внутри стромы ткань молочной железы состоит из сложной сети долек и молочных протоков, а также жира. Дольки молочной железы, состоящие из групп альвеол (также называемых ацинусами или терминальными протоками), представляют собой железистые структуры сферической формы, которые производят молоко [21]. Внутри альвеол можно обнаружить один слой просветных эпителиальных клеток, окружающих внутренний просвет [22]. Рядом с люминальными клетками существует слой миоэпителиальных клеток, ответственных за отложение белков базальной мембраны, а также обеспечивающих сократительные движения во время секреции молока [23, 24].Во время беременности эпителиальные клетки альвеол подвергаются экстенсивной пролиферации, что приводит к увеличению числа альвеолярных единиц и, следовательно, к увеличению размера и количества долек [21]. Молоко, вырабатываемое дольками молочной железы, затем дренируется разветвленной сетью протоков, по которым молоко переносится из долек к соскам во время лактации [25]. Протоки, которые дренируют отдельные альвеолы, ведут к постепенно увеличивающимся протокам, которые соединяются с соском [21, 22]. В области соска протоки расширяются, образуя млечные синусы.Затем синусы заканчиваются конусообразными ампулами непосредственно под поверхностью соска [21].
Внутри альвеол можно обнаружить один слой просветных эпителиальных клеток, окружающих внутренний просвет [22]. Рядом с люминальными клетками существует слой миоэпителиальных клеток, ответственных за отложение белков базальной мембраны, а также обеспечивающих сократительные движения во время секреции молока [23, 24].Во время беременности эпителиальные клетки альвеол подвергаются экстенсивной пролиферации, что приводит к увеличению числа альвеолярных единиц и, следовательно, к увеличению размера и количества долек [21]. Молоко, вырабатываемое дольками молочной железы, затем дренируется разветвленной сетью протоков, по которым молоко переносится из долек к соскам во время лактации [25]. Протоки, которые дренируют отдельные альвеолы, ведут к постепенно увеличивающимся протокам, которые соединяются с соском [21, 22]. В области соска протоки расширяются, образуя млечные синусы.Затем синусы заканчиваются конусообразными ампулами непосредственно под поверхностью соска [21].
4. Факторы, которые регулируют и поддерживают молочную нишу
Было показано, что весь функциональный эпителиальный отросток молочной железы может состоять из потомства одной клетки [16]. Эти компоненты, клетки-предшественники, базальная мембрана и внеклеточный матрикс, являются основными функциональными единицами тканевого микроокружения. Эти структуры вместе с межклеточными коммуникациями и растворимыми факторами создают функциональную сигнальную нишу, которая направляет клеточную активность через прямой контакт или через паракринную передачу сигналов (Рис. 2).Микроокружение молочной железы представляет собой сложную сеть внутриклеточных коммуникаций между клетками просвета, базальными клетками и стромой [26]. В дополнение к гормонам, необходимым для развития молочных протоков и долек (эстроген и прогестерон), множество других факторов составляют нишу молочной железы, включая физические факторы, такие как межклеточный контакт, и диффузионные факторы, такие как гормоны и цитокины.
Эти компоненты, клетки-предшественники, базальная мембрана и внеклеточный матрикс, являются основными функциональными единицами тканевого микроокружения. Эти структуры вместе с межклеточными коммуникациями и растворимыми факторами создают функциональную сигнальную нишу, которая направляет клеточную активность через прямой контакт или через паракринную передачу сигналов (Рис. 2).Микроокружение молочной железы представляет собой сложную сеть внутриклеточных коммуникаций между клетками просвета, базальными клетками и стромой [26]. В дополнение к гормонам, необходимым для развития молочных протоков и долек (эстроген и прогестерон), множество других факторов составляют нишу молочной железы, включая физические факторы, такие как межклеточный контакт, и диффузионные факторы, такие как гормоны и цитокины.
5. Клеточные компоненты
Молочная железа и окружающая ее строма состоят из различных типов клеток, составляющих микроокружение молочной железы.Клетки, составляющие нишу молочной железы, включают эпителиальные клетки, адипоциты, фибробласты, эндотелиальные клетки, нервные клетки и лимфоидные клетки. Подсчитано, что эти клетки либо являются поддерживающими клетками, либо играют роль в секретировании растворимых факторов, либо регулируются развитием молочной железы [27-29]. Было показано, что макрофаги и, возможно, их сигналы необходимы для развития протоков, а также для поддержки функции стволовых клеток молочной железы (рис. 2) [30, 31]. В отсутствие макрофагов или колониестимулирующего фактора-1 (CSF-1) функция стволовых клеток молочной железы, включая потенциал роста и способность к регенерации, серьезно нарушена [30].Макрофаги, эозинофилы и их соответствующие цитокины, включая CSF-1 и эотаксин, необходимы для формирования терминальных зачатков. Эти клетки также обнаруживаются вблизи ацинусов молочной железы во время беременности и лактации [32]. Ландскронер-Эйгер и др. и Кулдри и др. обнаружили, что адипоциты необходимы для формирования протоков молочных желез в период полового созревания (рис. 2) [33, 34]. Кроме того, было обнаружено, что адипоциты поддерживают альвеолярные зачатки, формирующиеся во время беременности [33].
Подсчитано, что эти клетки либо являются поддерживающими клетками, либо играют роль в секретировании растворимых факторов, либо регулируются развитием молочной железы [27-29]. Было показано, что макрофаги и, возможно, их сигналы необходимы для развития протоков, а также для поддержки функции стволовых клеток молочной железы (рис. 2) [30, 31]. В отсутствие макрофагов или колониестимулирующего фактора-1 (CSF-1) функция стволовых клеток молочной железы, включая потенциал роста и способность к регенерации, серьезно нарушена [30].Макрофаги, эозинофилы и их соответствующие цитокины, включая CSF-1 и эотаксин, необходимы для формирования терминальных зачатков. Эти клетки также обнаруживаются вблизи ацинусов молочной железы во время беременности и лактации [32]. Ландскронер-Эйгер и др. и Кулдри и др. обнаружили, что адипоциты необходимы для формирования протоков молочных желез в период полового созревания (рис. 2) [33, 34]. Кроме того, было обнаружено, что адипоциты поддерживают альвеолярные зачатки, формирующиеся во время беременности [33]. В отсутствие адипоцитов формируются рудиментарные структуры в молочной железе, но ветвления протоков не происходит [34].Наконец, было обнаружено, что стромальные фибробласты влияют на морфогенез эпителиальных клеток молочной железы человека (рис. 2) [35].
В отсутствие адипоцитов формируются рудиментарные структуры в молочной железе, но ветвления протоков не происходит [34].Наконец, было обнаружено, что стромальные фибробласты влияют на морфогенез эпителиальных клеток молочной железы человека (рис. 2) [35].
6. Факторы диффузии
6.1. Гормоны и их рецепторы
В молочной железе обычно находятся два основных гормона, которые необходимы для нормального развития молочной железы: эстроген и прогестерон (рис. 2). В период полового созревания развитие протоков обусловлено преимущественно эстрогеном [20]. У зрелых девственниц прогестерон регулирует боковое разветвление протоков, в то время как пролактин, прогестерон, плацентарные лактогены и ErbB4 инициируют формирование альвеолярных зачатков во время беременности [20].Во время лактации пролактин и ErbB4 обычно стимулируют выработку молока [20].
Кроме того, рецепторы гормонов, рецептор эстрогена (ER) и рецептор прогестерона (PR), необходимы для развития молочной железы. В частности, ER- α преимущественно экспрессируется в клетках просвета, но также может быть обнаружен в ядрах эпителиальных клеток протоков (рис. 2) [21]. ER- α обычно не экспрессируется в миоэпителиальных клетках [21]. Большинство ER- α -позитивных клеток являются негативными по Ki-67 во время пременопаузы, что свидетельствует о том, что большинство ER- α -позитивных клеток не подвергаются пролиферации в течение этого времени.Однако с возрастом женщины количество ER- α -позитивных клеток, подвергающихся пролиферации, увеличивается, в конечном итоге достигая плато после менопаузы [21]. Потеря ER- α связана с нарушением ветвления и удлинения протоков молочной железы [36, 37]. Также известно, что второй рецептор эстрогена, ER-β, экспрессируется в молочной железе. ER- β экспрессируется в эпителиальных клетках протоков и долек, а также в миоэпителиальных клетках и клетках стромы.
В частности, ER- α преимущественно экспрессируется в клетках просвета, но также может быть обнаружен в ядрах эпителиальных клеток протоков (рис. 2) [21]. ER- α обычно не экспрессируется в миоэпителиальных клетках [21]. Большинство ER- α -позитивных клеток являются негативными по Ki-67 во время пременопаузы, что свидетельствует о том, что большинство ER- α -позитивных клеток не подвергаются пролиферации в течение этого времени.Однако с возрастом женщины количество ER- α -позитивных клеток, подвергающихся пролиферации, увеличивается, в конечном итоге достигая плато после менопаузы [21]. Потеря ER- α связана с нарушением ветвления и удлинения протоков молочной железы [36, 37]. Также известно, что второй рецептор эстрогена, ER-β, экспрессируется в молочной железе. ER- β экспрессируется в эпителиальных клетках протоков и долек, а также в миоэпителиальных клетках и клетках стромы.
PR экспрессируется в просветных эпителиальных клетках протоков и долек (рис. 2). Данные показали, что образование как PR-позитивных, так и PR-негативных клеток опосредовано прогестероном [36]. Однако, в отличие от ER- α , PR не зависит от стадии менструации [21]. В модели мышей с мутациями PR -/- (где нарушена транскрипция как A, так и B форм PR) развитие секреторных альвеол нарушено [36, 37].
2). Данные показали, что образование как PR-позитивных, так и PR-негативных клеток опосредовано прогестероном [36]. Однако, в отличие от ER- α , PR не зависит от стадии менструации [21]. В модели мышей с мутациями PR -/- (где нарушена транскрипция как A, так и B форм PR) развитие секреторных альвеол нарушено [36, 37].
Рецепторы эстрогена, в частности, опосредованы членом семейства эпидермальных факторов роста амфирегулином (рис. 2) [37, 38].Амфирегулин, гепарин-связывающий, гликозилированный белок, необходим для развития протоков и терминальных зачатков [39]. В молочных железах млекопитающих в период полового созревания амфирегулин экспрессируется в миоэпителиальных клетках, люминальных клетках и колпачковых клетках, расположенных в терминальной концевой почке [39].
6.2. Cytokines
В поддержании клеток-предшественников молочных желез участвуют два основных пути передачи сигналов цитокинов: RANKL и Wnt/ β -catenin. Wnt4, в частности, является ключевым фактором, который опосредует прогестерон и, таким образом, боковое ветвление молочной железы (рис. 2) [40].Кроме того, добавление белка Wnt3A к стволовым клеткам молочных желез в культуре приводит к размножению стволовых клеток в последующих поколениях (рис. 2) [41]. При трансплантации стволовые клетки, обработанные белком Wnt3A, демонстрировали устойчивый рост по сравнению с имплантированными необработанными стволовыми клетками молочной железы [41]. С другой стороны, было показано, что активатор рецептора ядерного фактора- κβ лиганда (RANKL) опосредует пролиферативный ответ эпителия молочной железы мышей на прогестерон во время лактационного морфогенеза молочной железы (рис. 2) [42].Кроме того, Фата и соавт. показали, что молочные железы мышей с дефицитом RANK и RANKL демонстрируют нормальное развитие желез во время полового созревания, но не формируют лобулоальвеолярные структуры во время беременности [43]. Кроме того, было обнаружено, что RANKL увеличивает пролиферацию дочерних клеток, которые образуются после асимметричного деления стволовых клеток [44, 45].
2) [40].Кроме того, добавление белка Wnt3A к стволовым клеткам молочных желез в культуре приводит к размножению стволовых клеток в последующих поколениях (рис. 2) [41]. При трансплантации стволовые клетки, обработанные белком Wnt3A, демонстрировали устойчивый рост по сравнению с имплантированными необработанными стволовыми клетками молочной железы [41]. С другой стороны, было показано, что активатор рецептора ядерного фактора- κβ лиганда (RANKL) опосредует пролиферативный ответ эпителия молочной железы мышей на прогестерон во время лактационного морфогенеза молочной железы (рис. 2) [42].Кроме того, Фата и соавт. показали, что молочные железы мышей с дефицитом RANK и RANKL демонстрируют нормальное развитие желез во время полового созревания, но не формируют лобулоальвеолярные структуры во время беременности [43]. Кроме того, было обнаружено, что RANKL увеличивает пролиферацию дочерних клеток, которые образуются после асимметричного деления стволовых клеток [44, 45].
6.
 3. Факторы роста
3. Факторы роста В молочной железе надсемейство трансформирующих факторов роста β (TGF- β ) играет решающую роль в развитии железы.Три лиганда TGF- β , TGF- β 1, TGF- β 2 и TGF- β 3 передают сигнал через рецепторы TGF- β типа I и II. Фосфорилирование рецепторов приводит к передаче сигналов через один из четырех основных путей: сигнальный путь Smad и PI3-киназу, а также пути TAK1 и RhoA [46]. Изоформы TGF- β , в частности, помогают поддерживать тканевой гомеостаз в концевых зачатках и молочных протоках путем ограничения клеточной пролиферации (Рис. 2) [47].Было обнаружено, что отсроченное формирование протоков связано со сверхэкспрессией TGF- β 1 [47]. Кроме того, было замечено увеличение экспрессии TGF- β во время беременности [48]. Наконец, TGF- β 1, TGF- β 2 и особенно TGF- β 3, как было обнаружено, увеличивают экспрессию во время инволюции, что указывает на роль в железистом апоптозе [49].
TGF- β также является основным индуктором эпителиально-мезенхимального перехода (ЭМП).Во время ЭМП утрачивается клеточная экспрессия белков, участвующих в адгезии [50]. Одновременно эти клетки теряют все характеристики, относящиеся к эпителиальному фенотипу [50]. С другой стороны, клетки, подвергшиеся EMT, обнаруживают повышенную экспрессию мезенхимальных белков, таких как α -гладкомышечный актин и виментин [50]. В результате эти клетки проявляют повышенную способность к миграции. Клетки, которые обычно подвергаются EMT, включают клетки-предшественники и опухолевые клетки [51, 52]. TGF- β , в частности, является мощным индуктором Snail1, который, в свою очередь, увеличивает экспрессию провоспалительных интерлейкинов, таких как интерлейкин 6 (IL-6) [53].Повышенные уровни в сыворотке IL-6, плейотропного цитокина, коррелируют с поздней стадией опухоли молочной железы, метастазированием и плохим прогнозом [54]. Было показано, что клетки метастатического рака молочной железы MCF7 конститутивно экспрессируют IL-6, что связано с повышенной экспрессией Snail1 и Twist1 и проявляют фенотип EMT [55].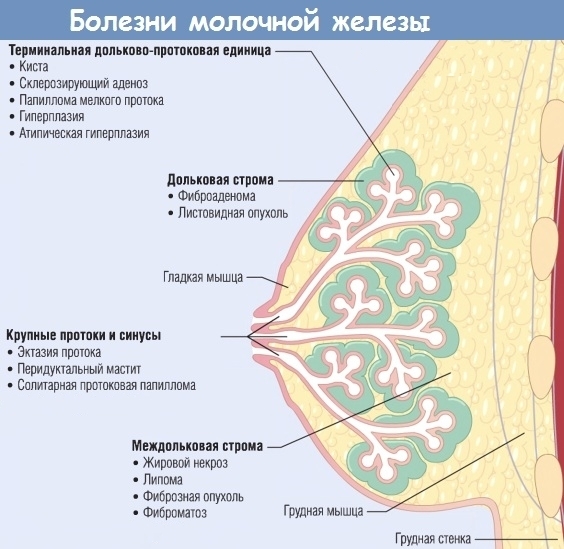
Другие индукторы развития молочной железы, влияющие на микроокружение молочной железы, включают преобразователь сигнала и активатор транскрипции-5a (STAT5a), STAT5b и семейство факторов роста эпидермального фактора роста (EGF) и их рецепторы.И STAT5a, и STAT5b передают сигнал через рецептор пролактина, чтобы контролировать пролиферацию и дифференцировку молочной железы (рис. 2) [20]. Было обнаружено, что инактивация STAT 5a приводит к нарушению лактации, хотя пролиферация и расширение альвеолярного компартмента происходили практически нормально [20]. Кроме того, семейство факторов роста и рецепторов EGF, амфирегулин и трансформирующий фактор роста- α [26] экспрессируются во время постнатального развития молочной железы.Амфирегулин, как упоминалось ранее, необходим для развития протоков и образования концевых зачатков [38]. Экспрессия трансформирующего фактора роста- α была обнаружена в пролиферирующей шапочке клеток концевых зачатков (рис. 2) [56]. EGF необходим для пролиферации и дифференцировки клеток молочной железы (рис. 2) [56]. Многие рецепторы семейства EGF, рецептор EGF, erbB1, erbB2, erbB3 и erbB4, экспрессируются либо у девственных самок, либо во время беременности, либо во время лактации [26].
2) [56]. Многие рецепторы семейства EGF, рецептор EGF, erbB1, erbB2, erbB3 и erbB4, экспрессируются либо у девственных самок, либо во время беременности, либо во время лактации [26].
Другим важным сигналом в микроокружении молочной железы является производный от стромы фактор инсулиноподобного фактора роста (IGF). IGF является важным фактором роста молочной железы, регулирующим гормональный контроль роста протоков (рис. 2) [57]. Было обнаружено, что у мышей с нулевым IGF-1 снижен рост протоков и образование терминальных концевых зачатков, указывая на то, что IGF-1 необходим для ветвления протоков и продукции терминальных концевых зачатков в развивающихся молочных железах [58]. Кроме того, было обнаружено, что ИФР-1, а также ИФР-2 регулируют экспрессию эстрогена, прогестерона, пролактина и гормона роста в молочной железе (рис. 2) [57].IGF-1 и эстроген действуют как митогены в развитии нормальной молочной железы. Повышенная экспрессия IGF-1 и эстрогена приводит к увеличению пролиферации эпителиальных клеток молочной железы [59]. Кроме того, было обнаружено, что IGF-1 осуществляет контроль факторов роста как аутокринный, паракринный и эндокринный регуляторный сигнал [57]. И IGF-1, и IGF-2 экспрессируются в концевых зачатках и строме молочной железы. IGF-1 опосредует альвеолярное отпочкование и пролиферацию во время беременности [60]. Повышенные уровни циркулирующего ИФР-1 приводят к ускоренному росту молочных желез [57].Таким образом, ИФР-1 является необходимым фактором для развития молочной железы.
Кроме того, было обнаружено, что IGF-1 осуществляет контроль факторов роста как аутокринный, паракринный и эндокринный регуляторный сигнал [57]. И IGF-1, и IGF-2 экспрессируются в концевых зачатках и строме молочной железы. IGF-1 опосредует альвеолярное отпочкование и пролиферацию во время беременности [60]. Повышенные уровни циркулирующего ИФР-1 приводят к ускоренному росту молочных желез [57].Таким образом, ИФР-1 является необходимым фактором для развития молочной железы.
7.
β 1 Интегрин как ключевой регулятор регенерации и развития молочной железыМикроокружение молочной железы также может влиять на поведение эпителиальных клеток, изменяя состав внеклеточного матрикса. В частности, внеклеточный матрикс влияет на сигнальные пути интегринов, которые, как было показано, играют важную роль во время клеточного роста и дифференцировки.
Интегрины представляют собой тип рецептора, который обеспечивает взаимодействие с внеклеточным матриксом [61].Кроме того, интегрины участвуют в подвижности клеток и в определении клеточной формы. Интегрины представляют собой трансмембранные гетеродимеры, состоящие из двух нековалентно связанных субъединиц гликопротеина α и β . После связывания со своим лигандом интегрины активируют внутриклеточные сигнальные пути, такие как MAP-киназный путь [61]. В частности, гетеродимеры интегрина β 1 важны для различных клеточных функций, включая развитие кожи, волос, нервов и хондроцитов [62–64].Кроме того, интегрин β 1 участвует в пролиферации, выживании и дифференцировке эпителиальных клеток молочных желез [65, 66]. Недавние сообщения показали, что удаление гена интегрина β 1 приводит к замедлению роста молочной железы и изменению развития лобулоальвеол и паттерна ветвления протоков [67]. Кроме того, было обнаружено, что интегрин β 1 играет критическую роль в альвеолярном развитии железистого эпителия и необходим для дифференцировки эпителиальных клеток молочных желез [68].Таким образом, эти данные свидетельствуют о том, что интегрин β 1 является ключевым регулятором активности стволовых/прогениторных клеток молочных желез.
Интегрины представляют собой трансмембранные гетеродимеры, состоящие из двух нековалентно связанных субъединиц гликопротеина α и β . После связывания со своим лигандом интегрины активируют внутриклеточные сигнальные пути, такие как MAP-киназный путь [61]. В частности, гетеродимеры интегрина β 1 важны для различных клеточных функций, включая развитие кожи, волос, нервов и хондроцитов [62–64].Кроме того, интегрин β 1 участвует в пролиферации, выживании и дифференцировке эпителиальных клеток молочных желез [65, 66]. Недавние сообщения показали, что удаление гена интегрина β 1 приводит к замедлению роста молочной железы и изменению развития лобулоальвеол и паттерна ветвления протоков [67]. Кроме того, было обнаружено, что интегрин β 1 играет критическую роль в альвеолярном развитии железистого эпителия и необходим для дифференцировки эпителиальных клеток молочных желез [68].Таким образом, эти данные свидетельствуют о том, что интегрин β 1 является ключевым регулятором активности стволовых/прогениторных клеток молочных желез.
Для дальнейшего изучения того, требуется ли интегрин β 1 для поддержания стволовых клеток молочной железы, а также для развития альвеол, эпителиальные/прогениторные клетки молочной железы выделяли из мышей Itg β 1 fx/fx , CreER δ . и обрабатывали 4-ОН-тамоксифеном (Bussard, неопубликованные данные). Добавление тамоксифена приведет к диссоциации CreER δ от Hsp90, что позволит CreER δ переместиться в ядро, а также разрезать и удалить ген интегрина β 1 (рис. 3).Это событие происходит в эпителиальных/прогениторных клетках молочной железы, а также в любой клетке, содержащей комплекс CreER δ /Hsp90 в эпителии молочной железы, и позволяет определить важность гена в развитии молочной железы. В имплантатах первого поколения рост желез отсутствовал в 89% молочных желез, лишенных эпителия молочной железы, которые были имплантированы Itg β 1 fx/fx , эпителиальные клетки молочной железы CreER, обработанные 4-OH-тамоксифеном (таблица 1) (Бассард, неопубликованные данные). Эти результаты позволяют предположить, что интегрин β 1 необходим для поддержания стволовых клеток молочной железы и развития молочной железы. В имплантатах второго поколения железистый рост присутствовал в ~ 60% наростов (таблица 2) (Bussard, неопубликованные данные). Мышей, которым имплантировали клетки эпителия молочной железы Itg β 1 fx/fx , CreER, обработанные 4-OH-тамоксифеном, дополнительно скрещивали для изучения роли интегрина β 1 в развитии молочной железы во время беременности.Подобно имплантатам второго поколения, железистый рост присутствовал в ~ 60% наростов (таблица 2) (Bussard, неопубликованные данные). Эти данные в сочетании с аналогичными результатами, полученными для ранее описанных небеременных имплантатов второго поколения, позволяют предположить, что удаление интегрина β 1 в эпителии приводит к снижению эффективности роста. Необходима дополнительная работа, чтобы полностью выяснить роль интегрина β 1 в развитии молочной железы.
Эти результаты позволяют предположить, что интегрин β 1 необходим для поддержания стволовых клеток молочной железы и развития молочной железы. В имплантатах второго поколения железистый рост присутствовал в ~ 60% наростов (таблица 2) (Bussard, неопубликованные данные). Мышей, которым имплантировали клетки эпителия молочной железы Itg β 1 fx/fx , CreER, обработанные 4-OH-тамоксифеном, дополнительно скрещивали для изучения роли интегрина β 1 в развитии молочной железы во время беременности.Подобно имплантатам второго поколения, железистый рост присутствовал в ~ 60% наростов (таблица 2) (Bussard, неопубликованные данные). Эти данные в сочетании с аналогичными результатами, полученными для ранее описанных небеременных имплантатов второго поколения, позволяют предположить, что удаление интегрина β 1 в эпителии приводит к снижению эффективности роста. Необходима дополнительная работа, чтобы полностью выяснить роль интегрина β 1 в развитии молочной железы.
| |||||||||||||||||||||||||||||
| ||||||||||||||||||||
8.
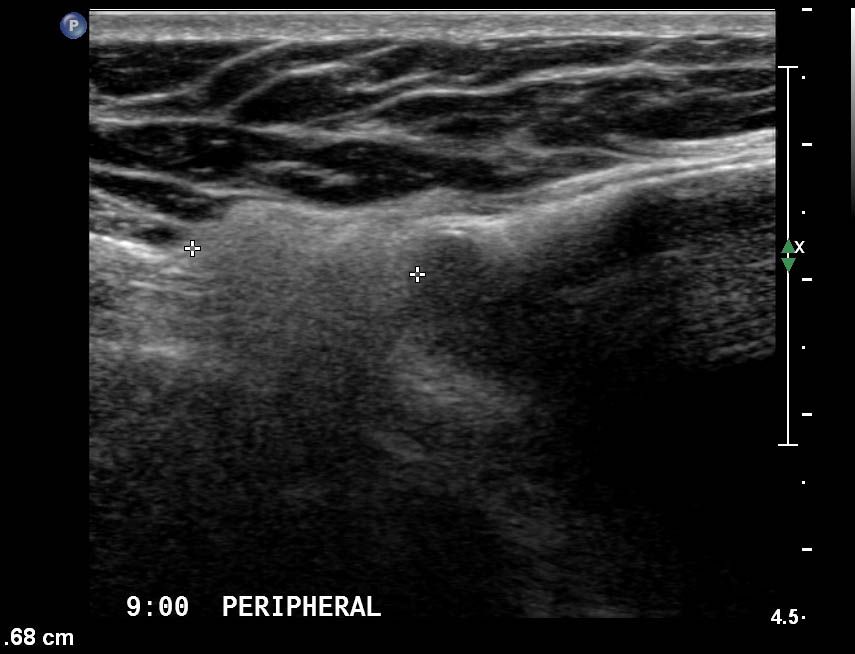 Контроль микросреды молочной железы клеток-предшественников
Контроль микросреды молочной железы клеток-предшественников Какие факторы микроокружения молочной железы, в частности, влияют на судьбу клеток-предшественников/эпителиальных клеток? Скорее всего, существует комбинация межклеточных, клеточно-растворимых факторов и межклеточных взаимодействий с внеклеточным матриксом, которые имеют место как для поддержания, так и для дифференцировки клеток-предшественников [69, 70]. Чтобы решить этот технически сложный вопрос, Labarge et al. недавно разработали интересную технологию, использующую микрочипы белков микроокружения для идентификации комбинаций белков молочной железы и молекул из внеклеточного матрикса, которые влияли на судьбы клеток-предшественников молочной железы [71].Сообщалось, что jagged1 поддерживает пул клеток-предшественников [71]. Кроме того, было обнаружено, что laminin1 поддерживает клетки-предшественники молочной железы в состоянии покоя [71]. Для дифференцировки в миоэпителиальные клетки исследователи обнаружили, что экспрессия Р-кадгерина в микроокружении молочной железы ведет к дифференцировке клеток-предшественников в базальные клетки [71].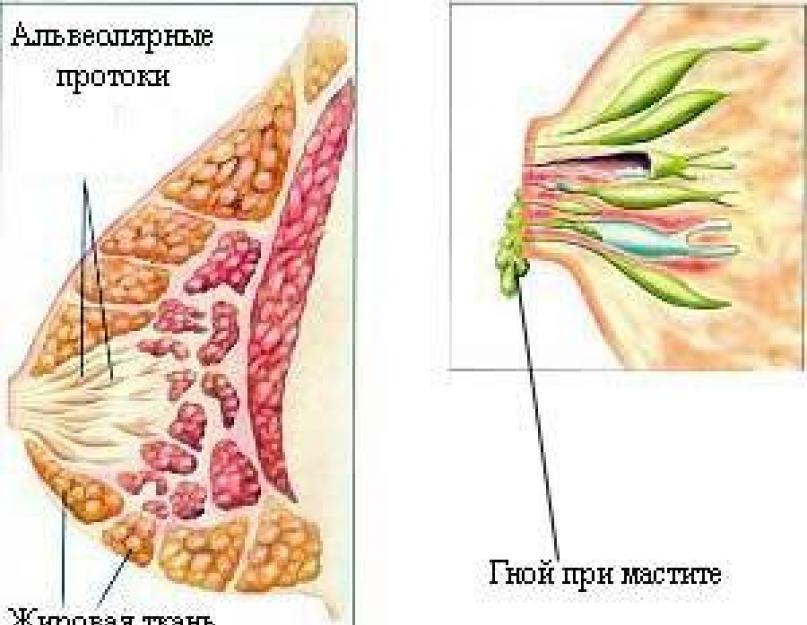 С другой стороны, было обнаружено, что межклеточный контакт, или экспрессия E-cadherin, способствует дифференцировке клеток-предшественников в эпителиальные клетки просвета [71].Т.о., эти результаты указывают на то, что экспрессия специфических белков в тканевом микроокружении может обеспечивать судьбу клеток-предшественников.
С другой стороны, было обнаружено, что межклеточный контакт, или экспрессия E-cadherin, способствует дифференцировке клеток-предшественников в эпителиальные клетки просвета [71].Т.о., эти результаты указывают на то, что экспрессия специфических белков в тканевом микроокружении может обеспечивать судьбу клеток-предшественников.
9. Notch, амфирегулин или сигнальные пути Hedgehog могут опосредовать клеточную судьбу стволовых/прогениторных клеток молочной железы разветвленное жировое тело молочной железы. Амфирегулин, как обсуждалось ранее, является членом семейства эпидермальных факторов роста и регулирует морфогенез молочной железы посредством паракринной активации рецептора эпидермального фактора роста [72].В экспериментах, проведенных Booth et al., экспрессия амфирегулина была подавлена в линии бессмертных эпителиальных клеток молочной железы с характеристиками стволовых клеток с помощью siRNAs [72]. Данные показали, что амфирегулин не только контролирует удлинение протоков, но также опосредует самообновление клеток-предшественников [72].
 Сообщалось, что в дополнение к амфирегулину Notch регулирует судьбу стволовых/прогениторных клеток молочных желез. При исследовании в культуре маммосфер было обнаружено, что синтетический пептид, полученный из домена Delta-Serrate-LAG 2 (DSL), который консервативен во всех лигандах Notch, способствует самообновлению стволовых клеток, а также регулируемой асимметричной клетке-предшественнику. подразделение [73].Было обнаружено, что на более поздних стадиях развития молочной железы тот же пептид DSL способствует развитию миоэпителиальных клеток [73]. Пептид DSL не влияет на полностью дифференцированные эпителиальные клетки молочных желез, что указывает на то, что эффекты полученного из Notch пептида ограничены ранними клетками-предшественниками молочных желез [73].
Сообщалось, что в дополнение к амфирегулину Notch регулирует судьбу стволовых/прогениторных клеток молочных желез. При исследовании в культуре маммосфер было обнаружено, что синтетический пептид, полученный из домена Delta-Serrate-LAG 2 (DSL), который консервативен во всех лигандах Notch, способствует самообновлению стволовых клеток, а также регулируемой асимметричной клетке-предшественнику. подразделение [73].Было обнаружено, что на более поздних стадиях развития молочной железы тот же пептид DSL способствует развитию миоэпителиальных клеток [73]. Пептид DSL не влияет на полностью дифференцированные эпителиальные клетки молочных желез, что указывает на то, что эффекты полученного из Notch пептида ограничены ранними клетками-предшественниками молочных желез [73]. Наконец, в дополнение к амфирегулину и Notch было обнаружено, что члены сигнального пути Hedgehog и Bmi-1 регулируют самообновление стволовых клеток молочной железы.Было обнаружено, что передача сигналов Hedgehog, которая включает гены PTCh2, Gli1 , Gli2 и Bmi-1, , увеличивает количество инициирующих маммосферу клеток, а также увеличивает размер маммосферы [74]. При дальнейшем исследовании было обнаружено, что более высокие концентрации этих генов были экспрессированы в клетках-предшественниках молочных желез, тогда как их концентрации были снижены в более дифференцированных клетках [74]. Более того, было обнаружено, что белки Sonic Hedgehog и Indian Hedgehog экспрессируются в более дифференцированном эпителии молочной железы [75, 76], тогда как экспрессия Desert Hedgehog выше в концевых зачатках по сравнению со стромой молочной железы [77].Кроме того, было обнаружено, что белок Gli2 экспрессируется в строме, окружающей протоки молочной железы, а также в концевых зачатках [78]. Gli3, с другой стороны, расположен в более дифференцированном эпителии и строме молочной железы [79]. Белки семейства Hedgehog регулируют несколько фаз развития молочной железы, включая развитие протоков и лактацию [80]. Эти результаты указывают на то, что в дополнение к амфирегулину и Notch члены сигнального пути Hedgehog играют роль в регуляции и самообновлении клеток-предшественников молочных желез.
При дальнейшем исследовании было обнаружено, что более высокие концентрации этих генов были экспрессированы в клетках-предшественниках молочных желез, тогда как их концентрации были снижены в более дифференцированных клетках [74]. Более того, было обнаружено, что белки Sonic Hedgehog и Indian Hedgehog экспрессируются в более дифференцированном эпителии молочной железы [75, 76], тогда как экспрессия Desert Hedgehog выше в концевых зачатках по сравнению со стромой молочной железы [77].Кроме того, было обнаружено, что белок Gli2 экспрессируется в строме, окружающей протоки молочной железы, а также в концевых зачатках [78]. Gli3, с другой стороны, расположен в более дифференцированном эпителии и строме молочной железы [79]. Белки семейства Hedgehog регулируют несколько фаз развития молочной железы, включая развитие протоков и лактацию [80]. Эти результаты указывают на то, что в дополнение к амфирегулину и Notch члены сигнального пути Hedgehog играют роль в регуляции и самообновлении клеток-предшественников молочных желез.
В качестве прямого примера микроокружения, контролирующего клетки-предшественники, наша лаборатория недавно продемонстрировала, что микроокружение молочной железы мыши может перенаправлять клетки взрослых мышей немаммарного происхождения на расширение и дифференцировку в эпителиальные клетки молочной железы во время регенерации желез in vivo [81 , 82]. Было обнаружено, что как взрослые тестикулярные клетки, так и добросовестные нейральные стволовые клетки могут быть перепрограммированы молочной железой мыши, чтобы они вели себя как эпителиальные клетки молочной железы [81, 82].Для взрослых клеток яичка смесь 10% сперматогоний типов A и B, 28% клеток Сертоли и 62% дифференцирующихся сперматоцитов, выделенных из семенных канатиков взрослых самцов мышей WAP-Cre/Rosa26R, имплантировали с эпителиальными клетками самок молочной железы в свободная от эпителия жировая подушка трехнедельных самок бестимусных голых мышей. Шесть-восемь недель спустя мышей спаривали, доводили до полного срока беременности и впоследствии подвергали эвтаназии. Собирали железы и исследовали на наличие маркеров клеток молочной железы казеина (молоко) и кератина 5 (маркер миоэпителиальных клеток), которые были обнаружены среди потомства инокулированных мужских клеток [81].Кроме того, флуоресцентная гибридизация in situ показала, что как мужские (сперматогенные, Y-хромосома), так и женские (молочные железы, двойная X-хромосома) клетки соседствуют друг с другом и присутствуют в одном и том же ацинусе [81]. Эти результаты наблюдались как в трансплантатах первого, так и во втором поколении и показали, что мужские клетки-предшественники вносят вклад в формирование функциональной женской молочной железы. Аналогичный подход был применен для изучения того, может ли микроокружение молочной железы перепрограммировать эмбриональные и взрослые нейральные стволовые клетки, выделенные и размноженные в селективной среде для нейральных стволовых клеток, в качестве добросовестных нейральных стволовых клеток.По сравнению с клетками яичка, было замечено, что нейральные стволовые клетки WAP-Cre/Rosa26R также могут быть перенаправлены на экспрессию маркера эпителиальных клеток молочной железы казеина (молоко) [82].
Собирали железы и исследовали на наличие маркеров клеток молочной железы казеина (молоко) и кератина 5 (маркер миоэпителиальных клеток), которые были обнаружены среди потомства инокулированных мужских клеток [81].Кроме того, флуоресцентная гибридизация in situ показала, что как мужские (сперматогенные, Y-хромосома), так и женские (молочные железы, двойная X-хромосома) клетки соседствуют друг с другом и присутствуют в одном и том же ацинусе [81]. Эти результаты наблюдались как в трансплантатах первого, так и во втором поколении и показали, что мужские клетки-предшественники вносят вклад в формирование функциональной женской молочной железы. Аналогичный подход был применен для изучения того, может ли микроокружение молочной железы перепрограммировать эмбриональные и взрослые нейральные стволовые клетки, выделенные и размноженные в селективной среде для нейральных стволовых клеток, в качестве добросовестных нейральных стволовых клеток.По сравнению с клетками яичка, было замечено, что нейральные стволовые клетки WAP-Cre/Rosa26R также могут быть перенаправлены на экспрессию маркера эпителиальных клеток молочной железы казеина (молоко) [82]. Эти результаты, в дополнение к результатам, обсуждаемым Bussard et al. [83], демонстрируют, что поведение стволовых клеток/клеток-предшественников зависит от микроокружения, в котором они находятся, указывая на доминирование тканеспецифичной ниши над судьбой клеток-предшественников.
Эти результаты, в дополнение к результатам, обсуждаемым Bussard et al. [83], демонстрируют, что поведение стволовых клеток/клеток-предшественников зависит от микроокружения, в котором они находятся, указывая на доминирование тканеспецифичной ниши над судьбой клеток-предшественников.
10. Микроокружение и рак
Появляется все больше данных, свидетельствующих о том, что тканевое микроокружение также может регулировать злокачественный фенотип опухолей.Начиная с 1975 г. Mintz и Illmensee вводили клетки эмбриональной карциномы либо подкожно мышам, либо в бластоцисты, которые впоследствии имплантировали ложнобеременным хозяевам [84]. Тератокарциномы образуются у мышей, которым непосредственно инокулировали клетки эмбриональной карциномы. Однако, когда клетки эмбриональной карциномы были инокулированы в бластоцисты и имплантированы беременным хозяевам, были получены «нормальные» химерные мыши без развития опухоли [84]. Кроме того, онкогенный вирус, вирус саркомы Рауса, вызывает агрессивные опухоли при введении непосредственно в крылья цыплят [85]. Однако, когда куриные эмбрионы были инфицированы in ovo меченым pp 60src (нерецепторная протеинтирозинкиназа, которая опосредует активность вируса саркомы Рауса), опухоли не образовывались, хотя вирус экспрессировался в большинстве клеток инфицированных эмбрионов. [86]. При выращивании в культуре клетки этих эмбрионов образовывали опухоли [86]. Эти исследования показывают, что «нормальное» тканевое микроокружение доминирует над опухолевым образованием. Совсем недавно Фельшер продемонстрировал, что добросовестные онкогены являются туморогенными только в определенных клеточных линиях [87].Фельшер обнаружил, что для того, чтобы стать туморогенным, онкоген должен находиться в среде, благоприятной для развития опухоли [87]. Таким образом, если бы условия не благоприятствовали онкогенезу, опухоль не росла бы. В другом исследовании Hochedlinger et al. использовали ядерную трансплантацию для введения ядер злокачественных раковых клеток в энуклеированные ооциты, которые впоследствии использовали для получения химерных мышей [88].
Однако, когда куриные эмбрионы были инфицированы in ovo меченым pp 60src (нерецепторная протеинтирозинкиназа, которая опосредует активность вируса саркомы Рауса), опухоли не образовывались, хотя вирус экспрессировался в большинстве клеток инфицированных эмбрионов. [86]. При выращивании в культуре клетки этих эмбрионов образовывали опухоли [86]. Эти исследования показывают, что «нормальное» тканевое микроокружение доминирует над опухолевым образованием. Совсем недавно Фельшер продемонстрировал, что добросовестные онкогены являются туморогенными только в определенных клеточных линиях [87].Фельшер обнаружил, что для того, чтобы стать туморогенным, онкоген должен находиться в среде, благоприятной для развития опухоли [87]. Таким образом, если бы условия не благоприятствовали онкогенезу, опухоль не росла бы. В другом исследовании Hochedlinger et al. использовали ядерную трансплантацию для введения ядер злокачественных раковых клеток в энуклеированные ооциты, которые впоследствии использовали для получения химерных мышей [88].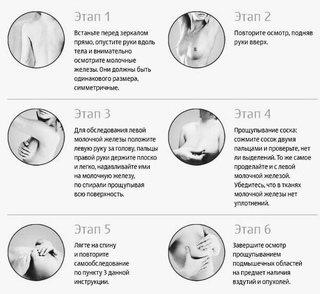 Несмотря на то, что мыши имели предрасположенность к онкогенному фенотипу, большинство их тканей были нормальными; регулируется «нормальным», неопухолевым микроокружением энуклеированного ооцита [88].
Несмотря на то, что мыши имели предрасположенность к онкогенному фенотипу, большинство их тканей были нормальными; регулируется «нормальным», неопухолевым микроокружением энуклеированного ооцита [88].
Кроме того, установлено, что тканевая микросреда играет ключевую роль в развитии рака и метастазировании. При исследовании экспрессии генов во время опухолевой прогрессии в молочной железе было обнаружено, что обширные изменения экспрессии генов происходят в опухолеассоциированной строме, включая повышение экспрессии MMP2, MMP11 и MMP14 при переходе от преинвазивного к инвазивному фенотипу [89]. ]. Кроме того, клетки рака молочной железы с метастазами в кости кооптируют нативные костные клетки, такие как остеобласты, для увеличения выработки ими воспалительных цитокинов IL-6, MCP-1, VEGF, MIP-2 (человеческий IL-8) и KC (человеческий GRO-). α ) [90].Эти результаты предполагают, что (1) микроокружение опухоли играет роль в онкогенезе до инвазии опухолевых клеток в строму и что (2) раковые клетки кооптируют нормальные клетки микроокружения, чтобы облегчить колонизацию раковых клеток.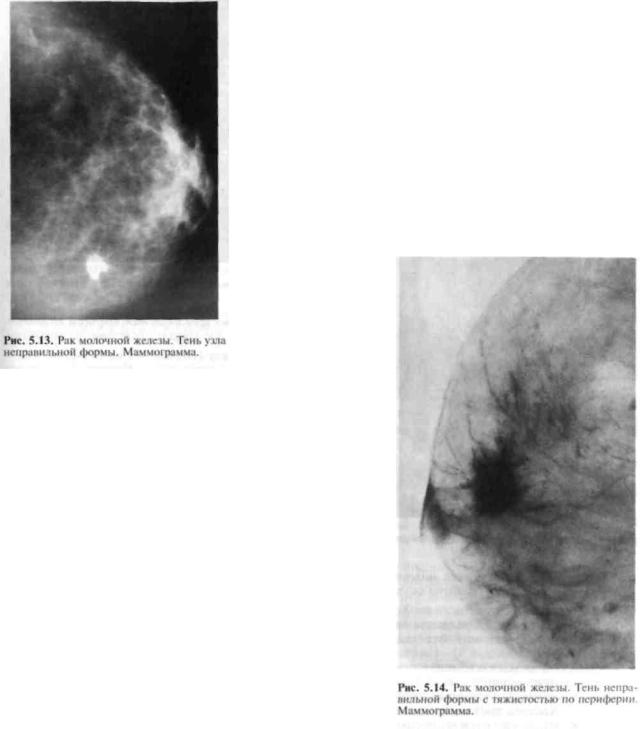 Таким образом, клеточное микроокружение больше не может рассматриваться как невинный наблюдатель прогрессии опухоли.
Таким образом, клеточное микроокружение больше не может рассматриваться как невинный наблюдатель прогрессии опухоли.
Несколько недавних исследований, в частности, непосредственно изучали взаимодействие раковых клеток с микроокружением. В одном эксперименте Booth et al.исследовали, могут ли клетки, трансформированные канцерогенным вирусом опухоли молочной железы мыши (MMTV-) neu, направляться микроокружением нормальной молочной железы мыши для участия в развитии функциональной молочной железы [91]. Чтобы изучить этот вопрос, клетки MMTV-neu были собраны из опухолей WAP-Cre/Rosa26R/MMTV-neu, смешаны с первичными эпителиальными клетками молочной железы дикого типа, а затем инокулированы в лишенные эпителия жировые подушечки самок бестимусных голых мышей. [91]. Было обнаружено, что при смешивании с эпителиальными клетками молочной железы дикого типа из первичных культур эпителиальных клеток молочной железы эпителиальное потомство, полученное от MMTV-neu-трансформированных клеток, участвует в нормальном развитии молочной железы [91]..jpg) В другом эксперименте Bussard et al. показали, что клетки эмбриональной карциномы человека могут быть перенаправлены с их туморогенного фенотипа на дифференцировку в функциональных добросовестных человеческих эпителиальных клеток молочной железы посредством взаимодействия с микроокружением молочной железы мыши in vivo [83]. Когда клетки эмбриональной карциномы человека инокулировали с эпителиальными клетками молочной железы мыши в лишенный эпителия жировой слой самок бестимусных голых мышей, перенаправленные клетки эмбриональной карциномы человека способствовали формированию нормальной молочной железы, экспрессировали специфичные для человека кератины, а также секретировали специфические для человека молочные белки у кормящих хозяев [83].Когда клетки эмбриональной карциномы человека были инокулированы отдельно (без эпителиальных клеток молочной железы) в лишенный эпителия жировой слой самок бестимусных голых мышей, опухоли образовывались как в отростках первого, так и во втором поколении [83].
В другом эксперименте Bussard et al. показали, что клетки эмбриональной карциномы человека могут быть перенаправлены с их туморогенного фенотипа на дифференцировку в функциональных добросовестных человеческих эпителиальных клеток молочной железы посредством взаимодействия с микроокружением молочной железы мыши in vivo [83]. Когда клетки эмбриональной карциномы человека инокулировали с эпителиальными клетками молочной железы мыши в лишенный эпителия жировой слой самок бестимусных голых мышей, перенаправленные клетки эмбриональной карциномы человека способствовали формированию нормальной молочной железы, экспрессировали специфичные для человека кератины, а также секретировали специфические для человека молочные белки у кормящих хозяев [83].Когда клетки эмбриональной карциномы человека были инокулированы отдельно (без эпителиальных клеток молочной железы) в лишенный эпителия жировой слой самок бестимусных голых мышей, опухоли образовывались как в отростках первого, так и во втором поколении [83]. Совсем недавно было продемонстрировано, что при смешивании с нормальными эпителиальными клетками молочной железы мыши клетки рака молочной железы с метастазами, неметастатическими и подавленными метастазами в кости человека экспрессировали маркеры нормальных эпителиальных клеток молочной железы человека в первом и втором поколениях трансплантата (Bussard, неопубликовано). .Таким образом, эти результаты в целом не только свидетельствуют о том, что раковые клетки могут реагировать на «нормальные» сигналы развития, но также в определенных ситуациях доказывают доминирование «нормального» микроокружения над развитием опухоли.
Совсем недавно было продемонстрировано, что при смешивании с нормальными эпителиальными клетками молочной железы мыши клетки рака молочной железы с метастазами, неметастатическими и подавленными метастазами в кости человека экспрессировали маркеры нормальных эпителиальных клеток молочной железы человека в первом и втором поколениях трансплантата (Bussard, неопубликовано). .Таким образом, эти результаты в целом не только свидетельствуют о том, что раковые клетки могут реагировать на «нормальные» сигналы развития, но также в определенных ситуациях доказывают доминирование «нормального» микроокружения над развитием опухоли.
11. Выводы и соображения на будущее
Данные показали, что сигналы от тканевого микроокружения влияют на судьбу клеток-предшественников. Для изучения сигналов тканевого микроокружения на клетках-предшественниках молочная железа служила надежной модельной системой.Было обнаружено, что ниша молочной железы (микроокружение) играет ключевую роль в развитии желез и направлении судьбы эпителиальных клеток. Кроме того, недавно было показано, что микроокружение молочной железы также может перенаправлять соматические клетки из других тканей (взрослые яички, добросовестные нейральные стволовые клетки и клетки эмбриональной карциномы человека), чтобы они вели себя и функционировали как эпителиальные клетки молочной железы. Эти результаты показывают, что ненативные соматические клетки взаимодействуют с сигналами от молочной железы мыши и реагируют на них и способны быть направленными на дифференцировку в клетки, которые проявляют различные фенотипы эпителиальных клеток молочной железы.Эти наблюдения демонстрируют доминирование тканевой ниши над судьбой клетки-предшественника/рака. Хотя конкретные молекулярные механизмы этих явлений еще предстоит определить, эти данные добавляют провокационную информацию к пониманию клеточной пластичности. Понимание механизмов, связанных с клеточным перепрограммированием, создаст новые терапевтические возможности для лечения заболеваний, а также продлит время выживания и улучшит качество жизни пациентов с изнурительными заболеваниями.
Кроме того, недавно было показано, что микроокружение молочной железы также может перенаправлять соматические клетки из других тканей (взрослые яички, добросовестные нейральные стволовые клетки и клетки эмбриональной карциномы человека), чтобы они вели себя и функционировали как эпителиальные клетки молочной железы. Эти результаты показывают, что ненативные соматические клетки взаимодействуют с сигналами от молочной железы мыши и реагируют на них и способны быть направленными на дифференцировку в клетки, которые проявляют различные фенотипы эпителиальных клеток молочной железы.Эти наблюдения демонстрируют доминирование тканевой ниши над судьбой клетки-предшественника/рака. Хотя конкретные молекулярные механизмы этих явлений еще предстоит определить, эти данные добавляют провокационную информацию к пониманию клеточной пластичности. Понимание механизмов, связанных с клеточным перепрограммированием, создаст новые терапевтические возможности для лечения заболеваний, а также продлит время выживания и улучшит качество жизни пациентов с изнурительными заболеваниями.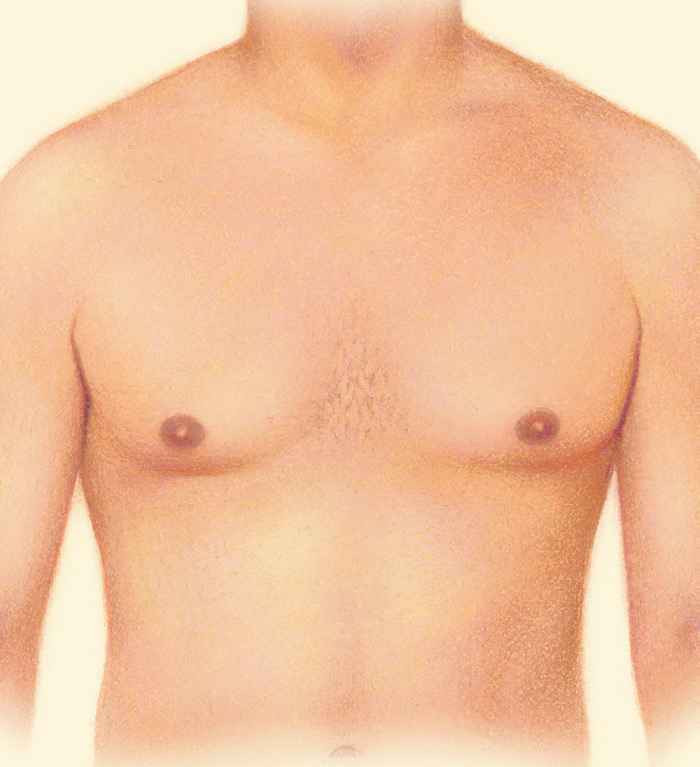
Однако остается много вопросов.Почему это событие интеграции происходит только тогда, когда количество нормальных, нативных эпителиальных клеток превышает количество ненативных клеток? Каковы механизмы, по которым происходят эти события? Может ли перепрограммирование клеток-предшественников происходить в органах помимо молочной железы? Существуют ли ограничения на тип/количество клеток, которые можно перепрограммировать? Ответы на эти и другие вопросы помогут в расшифровке сложной передачи сигналов, происходящей между тканевым микроокружением и клетками-предшественниками.Выявление специфических комбинаций межклеточных взаимодействий и межклеточных взаимодействий с внеклеточным матриксом, таких как продемонстрированные LaBarge et al. кажутся хорошим началом и дают представление о механизмах, с помощью которых происходит клеточное перепрограммирование нишей [71]. Вполне вероятно, что множество взаимодействующих факторов и путей необходимо для перенаправления клеточной судьбы in vivo . Тем не менее, понимание сложности этих взаимодействий не только поможет расшифровать молекулярные тонкости молочной железы, но также поможет понять биологию стволовых клеток и неопластическую трансформацию в целом.
Тем не менее, понимание сложности этих взаимодействий не только поможет расшифровать молекулярные тонкости молочной железы, но также поможет понять биологию стволовых клеток и неопластическую трансформацию в целом.
Ограничение калорийности и заболеваемость раком молочной железы | Рак молочной железы | ДЖАМА
Контекст Ограничение потребления калорий является одним из наиболее эффективных способов увеличить продолжительность жизни и уменьшить спонтанное возникновение опухолей у экспериментальных животных, но существуют ли подобные ассоциации у людей, не было должным образом изучал.
Цель Определить, снижает ли ограничение калорийности в раннем возрасте риск инвазивного рака молочной железы.
Дизайн, обстановка и участники Ретроспективное когортное исследование с использованием данных из Шведского регистра стационарных больных,
Шведский регистр рака, Шведский регистр смерти и Шведский регистр фертильности
Реестр. Участниками стали 7303 шведские женщины, госпитализированные с нервной анорексией.
в возрасте до 40 лет в период с 1965 по 1998 год. Женщины были исключены (n = 31)
если у них был диагностирован рак до их первой выписки из больницы
для нервной анорексии.
Участниками стали 7303 шведские женщины, госпитализированные с нервной анорексией.
в возрасте до 40 лет в период с 1965 по 1998 год. Женщины были исключены (n = 31)
если у них был диагностирован рак до их первой выписки из больницы
для нервной анорексии.
Измерение основного результата Заболеваемость инвазивным раком молочной железы.
Результаты По сравнению с населением Швеции в целом, женщины, госпитализированные по поводу нервная анорексия в возрасте до 40 лет имела 53% (95% доверительный интервал [ДИ], 3%-81%) более низкая заболеваемость раком молочной железы; нерожавшие женщины с анорексией nervosa имели на 23% (95% ДИ, от 79% выше до 75% ниже) заболеваемость ниже, а у рожавших у женщин с нервной анорексией заболеваемость была на 76% (95% ДИ, 13–97%) ниже.
Выводы Строгое ограничение калорийности у людей может обеспечить защиту от инвазивных
рак молочной железы. Низкое потребление калорий до первых родов с последующим последующим
беременность, по-видимому, связана с еще более выраженным снижением
в опасности.
Ограничение потребления калорий — один из самых эффективных способов увеличить продолжительности жизни и для уменьшения спонтанного возникновения опухолей у экспериментальных животных. 1 ,2 Ограничение калорийности имеет важное защитную роль в экспериментальном канцерогенезе молочной железы. 3 ,4 А недавний метаанализ обобщил имеющиеся данные о влиянии энергии ограничение спонтанных опухолей молочной железы у мышей. 5 комбинированная оценка для 14 включенных исследований подразумевала, что энергетически ограниченный у животных развивалось на 55 % (95 % доверительный интервал [ДИ], 41–69 %) меньше молочных желез. опухолей, чем в контрольных группах, независимо от типа ограничения питательное вещество. 5 Авторы призвали к диетической когорте исследования, чтобы получить представление о влиянии ограничения энергии на развитие рака молочной железы у людей. 5
Было обнаружено, что снижение потребления калорий у экспериментальных животных
сопровождается снижением уровня циркулирующего инсулина, инсулиноподобных факторов роста
I и II и эпидермальный фактор роста, а также измененная клеточная реактивность
к эстрогенам, повышенная иммунологическая реактивность, изменения клеточного цикла
регулирование, снижение скорости клеточной пролиферации, увеличение репарации ДНК, снижение
экспрессия онкогенов и усиленная экспрессия генов-супрессоров опухолей. 5 -10
5 -10
Ограничение энергии может иметь решающее значение в раннем возрасте и до первого беременность, когда ткани молочных желез особенно подвержены канцерогенным процессам. 11 ,12 Эта гипотеза подтверждается наблюдение, что больший рост, который, хотя и генетически повлиял, все же отражает состояние питания и, следовательно, потребление калорий во время роста, связано с повышенной заболеваемостью раком молочной железы. 13 ,14
Ограничение энергии трудно изучать на людях. Один маркер калорийности ограничением является нервная анорексия, болезнь, которая обычно возникает в подростковом возрасте или в раннем взрослом возрасте и характеризуется очень низким потреблением калорий, низкой индекс массы (ИМТ) и аменорея.
Мы провели ретроспективное когортное исследование в Швеции, чтобы оценить,
женщины с нервной анорексией, достаточно тяжелой, чтобы потребовать госпитализации и лечения
имеют более низкую заболеваемость раком молочной железы, чем ожидается в общей популяции.
Группа шведских женщин, госпитализированных по поводу нервной анорексии. между 1965 и 1998 годами было ретроспективно сформировано и отслежено возникновение рака молочной железы путем связи со Шведским регистром рака, Шведским Реестр смерти и Реестр эмиграции, использующий Национальную регистрацию Номер, уникальный идентификатор для каждого жителя Швеции. Мы констатировали рак диагноз после 1965 г., дату и причину смерти после 1965 г., дату цензура из-за эмиграции.Наблюдаемые числа рака сравнивали с ожидаемые показатели заболеваемости раком, основанные на показателях женского населения Швеции с 5-летним возрастным интервалом в течение одного календарного периода. Исследование было одобрено институциональным наблюдательным советом Бригама и Женской больницы в Бостоне, Массачусетса, а также Управлением по защите исследований человека Каролинского института, Стокгольм, Швеция.
Исследуемая популяция и установление воздействия
Используя Шведский регистр стационарных больных, мы выявили всех женщин в Швеции. которые были госпитализированы и лечились от тяжелой нервной анорексии в период с 1965 г.
и 1998 г.Шведский регистр стационарных больных был создан в 1965 г. и состоит из
соматических и психиатрических медицинских услуг в Швеции
Население. Каждая запись содержит лечебную процедуру, выписной диагноз
кодируется в соответствии с Международной классификацией болезней , редакции с седьмой по девятую ( МКБ-7 :
1965-1968 годы; МКБ-8 : 1969-1987; ICD-9 : 1988 и далее) и национальный регистрационный номер. Реестр
завершена в шведских графствах и охватывает 60% населения Швеции.
в 1969 г., 75% в 1978 г., 85% в 1983 г. и все население Швеции с тех пор
1987.
которые были госпитализированы и лечились от тяжелой нервной анорексии в период с 1965 г.
и 1998 г.Шведский регистр стационарных больных был создан в 1965 г. и состоит из
соматических и психиатрических медицинских услуг в Швеции
Население. Каждая запись содержит лечебную процедуру, выписной диагноз
кодируется в соответствии с Международной классификацией болезней , редакции с седьмой по девятую ( МКБ-7 :
1965-1968 годы; МКБ-8 : 1969-1987; ICD-9 : 1988 и далее) и национальный регистрационный номер. Реестр
завершена в шведских графствах и охватывает 60% населения Швеции.
в 1969 г., 75% в 1978 г., 85% в 1983 г. и все население Швеции с тех пор
1987.
Нервная анорексия определяется в этом исследовании как стационарное
уход за болезнью. Выявлена госпитализация по поводу нервной анорексии
по выписным диагнозам МКБ-7 коды 316.99 и 784.09, МКБ-8 код 306.50 и МКБ-9 код 307Б. Это исследование было ограничено первой госпитализацией по поводу нервной анорексии.
Мы выявили 7303 женщины из регистра стационарных больных Швеции, которым госпитализирован по поводу нервной анорексии в возрасте до 40 лет в период с 1965 по 1998 год.Из этой популяции больных анорексией исключена 31 женщина, у которой был диагностирован рак. до их первой выписки из стационара по поводу нервной анорексии.
Установление результатов
Все первые первичные случаи рака, диагностированные в нашей когорте больных анорексией были установлены путем связи с записью в Шведском регистре рака, который содержит все диагнозы заболеваемости раком среди жителей Швеции из с 1 января 1958 г. по 31 декабря 2000 г., и была оценена его полнота. превышать 95%. 15 ,16 Отчеты укажите национальный регистрационный номер и диагноз рака в соответствии с коды МКБ-7 .
Оценка модификаторов эффекта
Шведский регистр фертильности содержит информацию о каждом рождении в Швеции.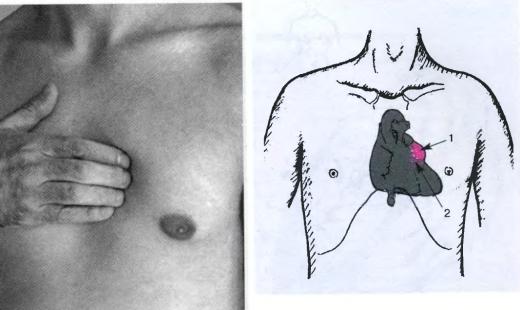 среди всех женщин, родившихся в 1925 году и позже.Мы получили информацию о паритете
статус из этого реестра для членов нашей когорты анорексии.
среди всех женщин, родившихся в 1925 году и позже.Мы получили информацию о паритете
статус из этого реестра для членов нашей когорты анорексии.
человеко-время наблюдения было рассчитано для каждого члена анорексии когорта с момента первой выписки из стационара по поводу анорексии nervosa до постановки диагноза рака, смерти, эмиграции или до 31 декабря, 2000 г. (конец наблюдения), в зависимости от того, что наступит раньше. Ожидаемое количество случаев рака в нашей когорте рассчитывали путем умножения 5-летнего возрастного интервала на и показатели заболеваемости раком за календарный год среди населения Швеции в целом. по человеко-времени, накопленному в каждом интервале облученного населения после цензуры на предмет смерти, эмиграции или прекращения наблюдения.
Стандартизированный коэффициент заболеваемости (SIR) рассчитывался как отношение
наблюдаемое число первых случаев первичного рака к ожидаемому числу. 17 95% CI вокруг SIR был построен на основе
предположение, что наблюдаемое число следует распределению Пуассона. 17
17
Модификация эффекта по паритету оценивалась путем разделения когорты на нерожавших и рожавших женщин на основе полученной информации о паритетах из Шведского регистра фертильности.Роженицы внесли вклад в человеко-время как nulliparae, пока они не родили.
Распределение женщин, госпитализированных по поводу нервной анорексии, в нашей когорте по возрасту и календарному году выписки диагноз представлен в табл. 1. Большинство случаев анорексии (73%) были диагностированы ранее. до 20 лет.
Среди 7303 женщин, у которых анорексия была диагностирована в возрасте до 40 лет. лет мы выявили 52 женщины, у которых в течение жизни был диагностирован любой тип рака. 96 887 человеко-лет наблюдения в период с 1965 по 2000 год; ожидаемый число случаев рака составило 56.6. SIR для всех видов рака вместе взятых. был 0,92 (95% ДИ, 0,69-1,21) (таблица 2).
Среди женщин, у которых анорексия была диагностирована в возрасте до 40 лет,
SIR для рака молочной железы составил 0,47 (95% ДИ, 0,19–0,97) (таблица 2). У семи женщин в этой группе развился рак молочной железы. То
ожидаемое количество случаев рака молочной железы составило 14,8; Таким образом, женщины в этой группе
имели на 53% (95% ДИ, 3–81%) более низкую заболеваемость раком молочной железы, чем в Швеции.
основное население. Среди женщин с диагнозом нервной анорексии в раннем возрасте
20 лет не было ни одного случая рака молочной железы; количество случаев рака молочной железы
ожидается в этой группе 2.7. Среди женщин с диагнозом в возрасте от
20 и 29 лет диагностировано 4 случая и ожидаемо 6,4; среди женщин с диагнозом
с анорексией в возрасте от 30 до 39 лет наблюдали 3 случая и
Ожидается 5.7.
У семи женщин в этой группе развился рак молочной железы. То
ожидаемое количество случаев рака молочной железы составило 14,8; Таким образом, женщины в этой группе
имели на 53% (95% ДИ, 3–81%) более низкую заболеваемость раком молочной железы, чем в Швеции.
основное население. Среди женщин с диагнозом нервной анорексии в раннем возрасте
20 лет не было ни одного случая рака молочной железы; количество случаев рака молочной железы
ожидается в этой группе 2.7. Среди женщин с диагнозом в возрасте от
20 и 29 лет диагностировано 4 случая и ожидаемо 6,4; среди женщин с диагнозом
с анорексией в возрасте от 30 до 39 лет наблюдали 3 случая и
Ожидается 5.7.
В нашей когорте анорексии 73% женщин оставались нерожавшими в течение период наблюдения. Среди женщин, которые остались нерожавшими, SIR для рак молочной железы составлял 0,77 (95% ДИ, 0,25–1,79) в течение 78 984 человеко-лет. наблюдения; было диагностировано 5 случаев и 6.5 ожидается, а значит, женщины в этой группе было 23% (95% ДИ, 79% увеличение до 75% снижение) снижение заболеваемости рака молочной железы. Соответствующее значение SIR среди рожавших женщин составило 0,24. (95% ДИ, 0,03–0,87) в течение 17 903 человеко-лет наблюдения; существовал 2 диагностированных случая и 8,3 ожидаемых, и, таким образом, у женщин в этой группе было 76% (95% ДИ, 13%-97%) снижение заболеваемости (табл. 2).
Анализы других гормонозависимых видов рака, таких как рак матки или яичников рак не выявил значимой обратной связи, но статистическая мощность был ограничен (данные не показаны).
Среди этой когорты шведских женщин с диагнозом при выписке из больницы нервной анорексии в возрасте до 40 лет мы обнаружили значительное снижение заболеваемости раком молочной железы по сравнению с женской популяцией Швеции в целом сопоставимого возраста и возрастной группы. Поскольку нервная анорексия требует госпитализация связана с серьезным ограничением калорийности во время длительного периода ранней жизни, делаем вывод, что такое голодание в подростковом возрасте и ранний взрослый возраст может повлиять на механизмы, имеющие решающее значение для развития молочной железы. рак.Большинство случаев рака молочной железы в этой группе возникло в пременопаузе. женщин в связи с возрастной структурой когорты.
Эти результаты подтверждают наблюдения, сделанные на грызунах, у которых ограничение было очень эффективной мерой для снижения заболеваемости раком. Нам известно только об одном другом исследовании, в котором связь между анорексией nervosa и заболеваемость раком среди людей. Исследование, проведенное в Дании использовали аналогичный подход, связав Датский регистр психиатрических и от Национального регистра пациентов до Датского онкологического регистра. 18 Авторы сообщают о SIR 0,80 (95% ДИ, 0,52-1,18) для общей заболеваемости раком среди 2151 женщины с диагнозом при выписке из больницы нервной анорексии на основе 25 наблюдаемых случаев. В этой когорте статистически мощность была ограничена для рассмотрения локализованных раков. SIR наблюдается для рак молочной железы был 0,8 (95% ДИ, 0,3-1,7), но исследуемая популяция не была только для женщин, которые испытали анорексию в возрасте до 40 лет. 18 В другом исследовании девочки препубертатного возраста, подвергшиеся воздействию до норвежского голода во время Второй мировой войны, который съел в среднем 22% меньше калорий имели более низкий последующий уровень рака молочной железы, чем женщины из когорты раннего или позднего рождения. 19
Среди женщин с анорексией в нашей когорте, впоследствии родивших 1 или более детей риск рака молочной железы снизился на 76%. Среди этих женщин мы подражаем окружающая среда развивающихся стран, где женщины испытывают ограничения в калориях но продолжайте беременеть и рожать детей. Показатели рака молочной железы в развивающихся странах значительно ниже, чем в большинстве богатых стран. 20 Возможно, ограничение калорийности во время ранние периоды жизни связаны со снижением развития паренхимы молочной железы и что последующая дифференцировка клеток молочной железы во время беременности дает защита сильнее, чем среди женщин в промышленно развитых странах.Следовательно, низкий заболеваемость раком молочной железы в развивающихся странах может быть связана с низким потреблением калорий до первого рождения, и предоставляется особенно выраженная защита при последующей беременности.
У женщин с нервной анорексией более поздняя фертильность, по-видимому, не быть скомпрометированы, но плодовитость снижается. 21 ,22 В В целом, женщины с нервной анорексией могут иметь задержку родов и, следовательно, нижний паритет. В нашей когорте только 26% женщин родили после постановки диагноза. нервной анорексии, но в силу возрастной структуры когорты большинство женщин находятся еще в детородном возрасте.В Швеции средний возраст рождения первого ребенка составляет на данный момент 30 лет. 23
В основе наших наблюдений может лежать ряд возможных механизмов. Калорийность ограничение может иметь прямое влияние на рост и развитие клеток молочной железы. Длительное ограничение калорий также может влиять на экспрессию различных онкогенов. и гены-супрессоры опухолей. Снижение уровня экспрессии эпидермального фактора роста, снижение уровня ERBB2, снижение экспрессии циклина D1 и повышение p53 и экспрессия p27 были обнаружены в тканях молочных желез хронически ограниченных в калориях грызуны. 7 -9
Кроме того, было обнаружено, что ограничение калорий и анорексия снижают уровни эстрогенов (которые могут проявляться аменореей) 10 ,24 и инсулиноподобный фактор роста I (IGF-I). 6 ,25 Последние исследования определили IGF-I как важный биомаркер для прогнозирования рака молочной железы. 26 ,27 ИФР-I мощный гормон роста, уровни которого в сыворотке и тканях достигают пика в подростковом возрасте. 28 Нервная анорексия может привести к снижению уровня в тканях IGF-I во время критической фазы развития молочной железы и, таким образом, влияет на риск рака молочной железы.
Нервная анорексия связана с аменореей и, следовательно, снижением количество овуляций в течение жизни, которые могут обеспечить защиту от рака молочной железы. Женщины с анорексией часто усиливают потерю веса за счет напряженной физической активности. Эпидемиологические данные о связи между физической активностью и риском рака молочной железы не являются окончательными, но больше данных подтверждает обратное связь с постменопаузальным раком молочной железы 29 ,30 чем с пременопаузой 31 ,32 грудь рак.Некоторые исследования указывают на снижение риска рака молочной железы среди женщин. которые много тренировались в подростковом возрасте. 33 ,34 Тяжелый упражнения были связаны с самым сильным снижением риска рака молочной железы среди женщин с низким ИМТ как минимум в 1 исследовании. 35
Анорексия может быть связана со значительными колебаниями веса, которые также было обнаружено, что он защищает от рака молочной железы на животных моделях. 36 Нам известно только об 1 эпидемиологическом исследовании, в котором считается цикличностью веса и раком молочной железы среди людей. 37 В популяционное исследование случай-контроль, проведенное в США, вес езда на велосипеде определялась как потеря 20 фунтов (9 кг) или более и набор не менее чем наполовину потерянный вес возвращается в течение 1 года; 1 цикла было достаточно для квалификации человек в качестве силового велосипедиста. Связи с раком молочной железы обнаружено не было.
Биологические пути связи между массой тела и риск рака молочной железы является комплексным, с противоположными эффектами высокого ИМТ на пременопаузальный и постменопаузальный риск рака молочной железы. 38 ,39 А ряд сообщений связывают высокий ИМТ в подростковом возрасте со сниженным риск рака молочной железы. 40 -43 Покрытия и коллеги 44 сообщили о U-образной зависимости между относительным весом в подростковом возрасте и более поздним риском рака молочной железы: женщины которые были либо намного тяжелее, либо намного тоньше, чем в среднем, риск. И нервная анорексия, и ожирение в подростковом возрасте могут быть связаны с ановуляцией и, следовательно, с задержкой наступления менархе.Как вариант, механизмы лежащие в основе защиты, обеспечиваемой низким и высоким потреблением калорий, могут различаться; в то время как очень низкий уровень циркулирующих эстрогенов и других гормонов роста может быть защитным, довольно высокие уровни могут вызывать раннюю дифференцировку молочной железы клетки. 43
Наше исследование имеет ряд ограничений. Количество наблюдаемых случаев в нашей когорте ограничено. Кроме того, существует возможность неизмеримого сбивающий с толку. Однако маловероятно, что установленные факторы риска рак, такой как семейный анамнез, будет связан с нервной анорексией.Пока наша когорта женщин с анорексией может отличаться от общей популяции некоторые аспекты, кроме общего потребления калорий, женщины с анорексией, продолжающие забеременеть, больше похожи на население в целом, что дает поддержку наших выводов. Репродуктивные факторы (например, возраст наступления менархе, паритет, возраст при первом рождении) и антропометрические переменные (например, рост, ИМТ) могут быть в причинном пути интересующей ассоциации; таким образом, мы не хотели бы подстроиться под них.Кроме того, более низкий паритет и более поздний возраст первых родов поместит женщин с анорексией в более высокий риск рака молочной железы. В этом Шведская когорта, воздействие и результат были установлены с высокой точностью. Ни дифференциальная, ни недифференциальная неправильная классификация воздействия или заболевания вероятны. Поэтому маловероятно, что наши результаты связаны с предвзятость.
Наши наблюдения указывают на важную роль потребления калорий в этиологии рака молочной железы и призывают к дальнейшим исследованиям, изучающим лежащие в его основе механизмы этой ассоциации, чтобы выяснить, связано ли это в первую очередь с прямое влияние ограничения калорийности на рост и развитие клеток молочной железы, к аменорее и связанному с ней гипоэстрогенизму или к снижению уровня роста факторы.
1.Роус П. Влияние диеты на течение рака. Bull Johns Hopkins Hosp. 1915;26:146-148.Google Scholar2.Росс М.Х., Брас Г. Длительное влияние раннего ограничения калорийности на распространенность новообразований в крысе. J Natl Cancer Inst. 1971;47:1095-1113.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =4330798&dopt=AbstractGoogle Scholar3.Танненбаум А., Сильверстоун Х. Влияние ограниченного потребления пищи на выживаемость мышей, несущих спонтанную рак молочной железы и частота метастазов в легкие. Рак Рез. 1953;13:532-536.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =13067072&dopt=AbstractGoogle Scholar4. Visscher MB, Ball ZB, Barnes RH, Siversten I. Влияние ограничения калорийности на частоту спонтанных рак молочной железы у мышей. Хирургия. 1942;11:48-55.Google Scholar5.Dirx MJM, Zeegers MPA, Dagnelie PC, van den Bogaard T, van den Brandt PA. Ограничение энергии и риск спонтанных опухолей молочной железы у мышей: метаанализ. Int J Рак. 2003;106:766-770.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =12866038&dopt=AbstractGoogle Scholar6.Руггери Б., Клурфельд Д., Кричевский Д., Фурланетто Р.В.Ограничение калорий и молочные железы, вызванные 7,12-диметилбенз(а)антраценом рост опухоли у крыс: изменения циркулирующего инсулина, инсулиноподобный рост факторы I и II и эпидермальный фактор роста. Рак Рез. 1989;49:4130-4134.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =2501021&dopt=AbstractGoogle Scholar7.Engelman RW, Owens UE, Bradley WG, Day NK, Good RA. Экспрессия эпидермального фактора роста молочной и поднижнечелюстной желез снижается за счет ограничения калорий. Рак Рез. 1995;55:1289-1295.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =7882324&dopt=AbstractGoogle Scholar8.Фернандес Г., Чандрасекар Б., Тройер Д.А., Венкатраман Дж.Т., Гуд Р.А. Диетические липиды и ограничение калорий влияют на частоту возникновения рака молочной железы и экспрессия генов у трансгенных мышей вируса опухоли молочной железы/v-Ha- ras мыши. Proc Natl Acad Sci U S A. 1995;92:6494-6498.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7604020&dopt=AbstractGoogle Scholar9.Zhu Z, Цзян В., Томпсон Х.Дж. Влияние ограничения энергии на экспрессию циклина D1 и p27 во время предраковых и злокачественных стадий химически индуцированного канцерогенеза молочной железы. Мол Карциног. 1999;24:241-245.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10326860&dopt=AbstractGoogle Scholar10.Spady TJ, Harvell DM, Lemus-Wilson A. и другие. Модуляция действия эстрогенов в гипофизе и молочных железах крыс. по энергоемкости рациона. J Nutr. 1999;129 (дополнение 2S):587S-590S.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd =Retrieve&db=PubMed&list_uids=10064338&dopt=AbstractGoogle Scholar11.Michels KB. Вклад окружающей среды (особенно диеты) в развитие рака молочной железы риск. Рак молочной железы Res. 2002;4:58-61.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =11879564&dopt=AbstractGoogle Scholar12.Michels KB, Trichopoulos D, Robins JM. и другие. Масса тела при рождении как фактор риска рака молочной железы. Ланцет. 1996;348:1542-1546.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =8950880&dopt=AbstractGoogle Scholar13.Суонсон К.А., Джонс Д.Ю., Шацкин А., Бринтон Л.А., Циглер Р.Г. Риск рака молочной железы, оцененный с помощью антропометрии в эпидемиологическом исследовании NHANES I последующее исследование. Рак Рез. 1988;48:5363-5367.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =3409257&dopt=AbstractGoogle Scholar14.Tretli S. Рост и вес в связи с заболеваемостью и смертностью от рака молочной железы: проспективное исследование 570 000 женщин в Норвегии. Int J Рак. 1989;44:23-30.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =2744893&dopt=AbstractGoogle Scholar15.Mattsson B, Wallgren A. Полнота Шведского регистра рака: незарегистрированные случаи на свидетельства о смерти в 1978 г. Acta Radiol Oncol. 1984;23:305-313.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =6095600&dopt=AbstractGoogle Scholar16.Шведский регистр рака. Заболеваемость раком в Швеции, 1990 г. . Стокгольм: Национальный совет здравоохранения и социального обеспечения; 1993.
17.Breslow NE, Day NE. Статистические методы исследования рака . Лион, Франция: Международное агентство по изучению рака; 1987. Научная публикация IARC № 82.
18. Меллемкьер Л., Эмборг С., Гридли Г. и другие. Нервная анорексия и риск развития рака. Рак вызывает контроль. 2001;12:173-177.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11246846&dopt=AbstractGoogle Scholar19.Tretli S, Gaard M. Изменения в образе жизни в подростковом возрасте и риск рака молочной железы: исследование экологическое исследование последствий Второй мировой войны в Норвегии. Рак вызывает контроль. 1996;7:507-512.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =8877047&dopt=AbstractGoogle Scholar20.Всемирная организация здравоохранения. Доклад о состоянии здравоохранения в мире, 2003 г. . Женева, Швейцария: Всемирная организация здравоохранения; 2003.
21. Теандер С. Исход и прогноз нервной анорексии и булимии: некоторые результаты предыдущих исследований по сравнению с результатами шведского долгосрочного исследования. J Psychiatr Res. 1985;19:493-508.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =3862842&dopt=AbstractGoogle Scholar22.Крайпе Р.Е., Черчилль Б.Х., Штраус Дж. Долгосрочные результаты у подростков с нервной анорексией. АЖДС. 1989;143:1322-1327.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =2816858&dopt=AbstractGoogle Scholar23.Статистическое управление Швеции. Сколько детей у меня будет, когда я вырасту [in Шведский]? Стокгольм: Статистическое управление Швеции; 2002. Отчет SCB 2002:5.
24. Теандер С. Нервная анорексия: психиатрическое исследование 94 пациенток. Acta Psychiatr Scand Suppl. 1970;214:1-194.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =5270554&dopt=AbstractGoogle Scholar25.Munoz MT, Argente J. Нервная анорексия у девочек-подростков: эндокринные и костные минералы нарушения плотности. Eur J Endocrinol. 2002;147:275-286.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12213663&dopt=AbstractGoogle Scholar26.Hankinson SE, Willett WC, Colditz GA. и другие. Циркулирующие концентрации инсулиноподобного фактора роста-1 и риск рака молочной железы. Ланцет. 1998;351:1393-1396.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =9593409&dopt=AbstractGoogle Scholar27.Bruning PF, Van Doorn J, Bonfrär JMG. и другие.Инсулиноподобный белок, связывающий фактор роста 3, снижен на ранней стадии. операбельный пременопаузальный рак молочной железы. Int J Рак. 1995;62:266-270.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =7543079&dopt=AbstractGoogle Scholar28.Hall K, Hilding A, Thoren M. Детерминанты циркулирующего инсулиноподобного фактора роста-I. J Endocrinol Invest. 1999; 22:48-57.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10442571&dopt=AbstractGoogle Scholar29.Gammon MD, John EM, Britton JA. Рекреационные и профессиональные физические нагрузки и риск рака молочной железы рак. J Natl Cancer Inst. 1998;90:100-117.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =9450570&dopt=AbstractGoogle Scholar30.Патель А.В., Калле Э.Э., Бернштейн Л., Ву А.Х., Тун М.Дж. Рекреационная физическая активность и риск рака молочной железы в постменопаузе в большой когорте женщин США. Рак вызывает контроль. 2003;14:519-529.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =12948283&dopt=AbstractGoogle Scholar31.Gammon MD, Schoenberg JB, Britton JA. и другие. Рекреационная физическая активность и риск рака молочной железы среди женщин в возрасте до возраст 45 лет. Am J Epidemiol. 1998;147:273-280.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =9482502&dopt=AbstractGoogle Scholar32.Rockhill B, Willett WC, Hunter DJ. и другие. Физическая активность и риск рака молочной железы в когорте молодых женщин. J Natl Cancer Inst. 1998;90:1155-1160.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9701365&dopt=AbstractGoogle Scholar33.Frisch RE, Wyshak G, Albright NL. и другие. Низкая заболеваемость раком молочной железы и раком репродуктивных органов в течение жизни система среди бывших спортсменов колледжа. Am J Clin Nutr. 1987;45(дополнение 1):328-335.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd =Retrieve&db=PubMed&list_uids=3799523&dopt=AbstractGoogle Scholar34.Mittendorf R, Longnecker MP, Newcomb PA.и другие. Интенсивная физическая активность в молодом возрасте и риск рака молочной железы (Соединенные Штаты). Рак вызывает контроль. 1995;6:347-353.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =7548722&dopt=AbstractGoogle Scholar35.Thune I, Brenn T, Lund E, Gaard M. Физическая активность и риск рака молочной железы. N Engl J Med. 1997;336:1269-1275.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=29&dopt=AbstractGoogle Scholar36.Cleary MP, Jacobson MK, Phillips FC, Getzin SC, Grande JP, Maihle NJ. Циклическое изменение веса снижает заболеваемость и увеличивает латентность молочных желез. опухоли в большей степени, чем хроническое ограничение калорий у мышей. самок мышей, трансформирующих фактор роста-альфа вируса опухоли молочной железы. Эпидемиологические биомаркеры рака Prev. 2002;11:836-843.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12223427&dopt=AbstractGoogle Scholar37.Trentham-Dietz A, Newcomb PA, Egan KM. и другие. Изменение веса и риск рака молочной железы в постменопаузе (США). Рак вызывает контроль. 2000;11:533-542.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =10880035&dopt=AbstractGoogle Scholar38.van den Brandt PA, Spiegelman D, Yaun SS. и другие.Объединенный анализ проспективных когортных исследований роста, веса и риск рака молочной железы. Am J Epidemiol. 2000;152:514-527.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =10997541&dopt=AbstractGoogle Scholar39.Friedenreich CM. Обзор антропометрических факторов и риска рака молочной железы. Eur J Рак Prev. 2001;10:15-32.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11263588&dopt=AbstractGoogle Scholar40.Le Marchand L, Kolonel LN, Earle ME, Mi MP. Размеры тела в разные периоды жизни и риск рака молочной железы. Am J Epidemiol. 1988;128:137-152.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =3381822&dopt=AbstractGoogle Scholar41.Magnusson C, Baron J, Persson I. и другие. Размер тела в разные периоды жизни и риск рака молочной железы в постменопаузе женщины. Int J Рак. 1998;76:29-34.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =9533758&dopt=AbstractGoogle Scholar42.Berkey CS, Frazier AL, Gardner JD, Colditz GA. Подростковый возраст и риск рака молочной железы. Рак. 1999;85:2400-2409.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =10357411&dopt=AbstractGoogle Scholar43.Хилакиви-Кларк Л., Форсен Т., Эрикссон Дж. Г. и другие. Высокий рост и избыточный вес в детстве оказывают противоположное влияние на молочные железы. риск рака. Br J Рак. 2001;85:1680-1684.http://www.ncbi.nlm.nih.gov/htbin-post/Entrez/query?db=m&form=6&Dopt=r&uid=entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids =11742488&dopt=AbstractGoogle Scholar44.Coates RJ, Uhler RJ, Hall HI. и другие.

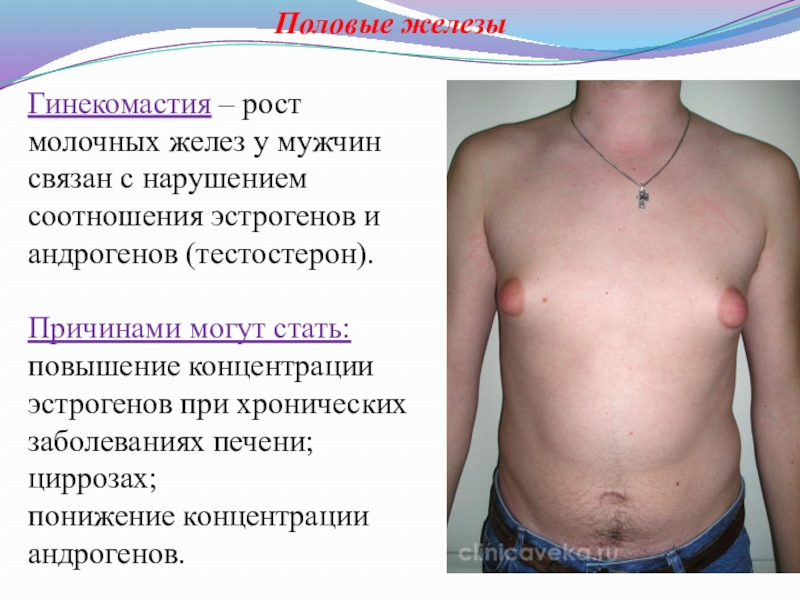 рисунок 2):
рисунок 2):
 рисунок 5). Начните в области подмышки и понемногу перемещайте пальцы вниз, пока не дойдете до низа грудной клетки. Затем переместите пальцы немного ближе к центру и двигайтесь вверх, пока не дойдете до ключицы. Продолжайте передвигаться по этой схеме, обследуя всю молочную железу до самой середины грудины (также известной как грудная или грудинная кость).
рисунок 5). Начните в области подмышки и понемногу перемещайте пальцы вниз, пока не дойдете до низа грудной клетки. Затем переместите пальцы немного ближе к центру и двигайтесь вверх, пока не дойдете до ключицы. Продолжайте передвигаться по этой схеме, обследуя всю молочную железу до самой середины грудины (также известной как грудная или грудинная кость). И в последнее время прослеживается тенденция омоложения РМЖ, то есть рак может встречаться у женщин до 40 лет.
И в последнее время прослеживается тенденция омоложения РМЖ, то есть рак может встречаться у женщин до 40 лет.

 В пожилом возрасте опухоль развивается медленно, может расти годами, в течение 5-10 лет. Но если это молодой возраст, до 50 лет, то рост идет быстрее, а до 40 лет – очень агрессивно, может вырасти в течение одного года. Так же быстро опухоль может вырасти у женщины, которая в пре-менопаузе или менопаузе принимает заместительную гормональную терапию (ЗГТ).
В пожилом возрасте опухоль развивается медленно, может расти годами, в течение 5-10 лет. Но если это молодой возраст, до 50 лет, то рост идет быстрее, а до 40 лет – очень агрессивно, может вырасти в течение одного года. Так же быстро опухоль может вырасти у женщины, которая в пре-менопаузе или менопаузе принимает заместительную гормональную терапию (ЗГТ).
 Поэтому я настоятельно рекомендую женщинам, чтобы они проходили скрининг с 40 лет.
Поэтому я настоятельно рекомендую женщинам, чтобы они проходили скрининг с 40 лет.
 Во время скрининга такую опухоль, расположенную вне молочной железы, можно не увидеть, так как она не попадает в зону снимка. И поэтому еще раз повторюсь, что раз в год нужно ходить к маммологу, так как врач прощупывает и молочную железу, и все зоны вокруг и может определить образование.
Во время скрининга такую опухоль, расположенную вне молочной железы, можно не увидеть, так как она не попадает в зону снимка. И поэтому еще раз повторюсь, что раз в год нужно ходить к маммологу, так как врач прощупывает и молочную железу, и все зоны вокруг и может определить образование.
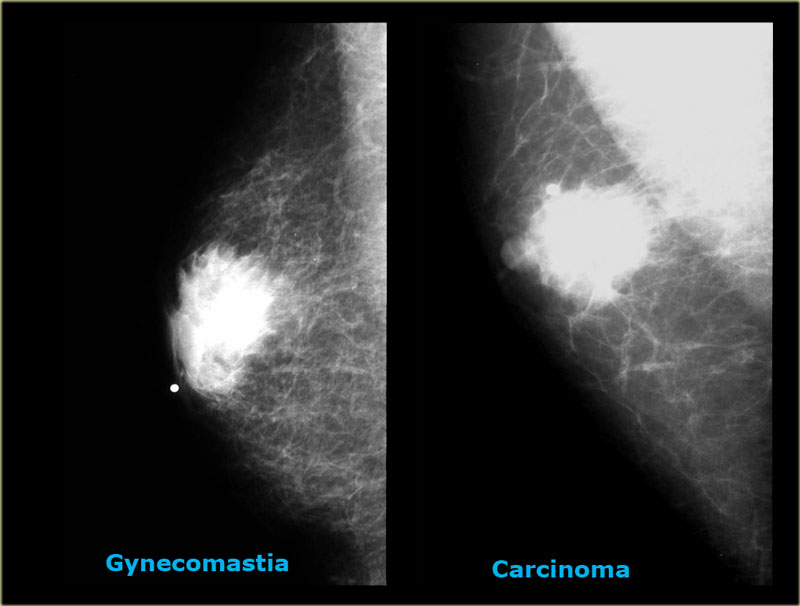
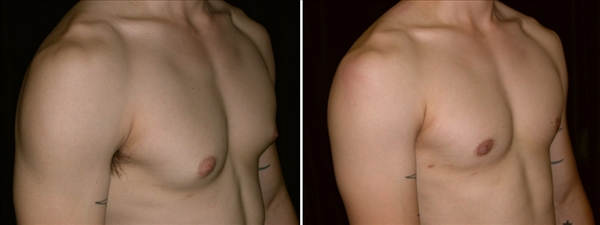 Мы все вместе обсуждаем каждый случай, исходя из данных подтипа опухоли, учитываются найденные у пациента мутации генов. Благодаря молекулярно-генетическому анализу, смотрим какие мутации есть и чем они спровоцированы, как можно на них воздействовать. Генетики дают заключение по мутациям в генах и по их чувствительности к определенным препаратам. Применяя эти результаты, индивидуально для данного человека подбирается лечение.
Мы все вместе обсуждаем каждый случай, исходя из данных подтипа опухоли, учитываются найденные у пациента мутации генов. Благодаря молекулярно-генетическому анализу, смотрим какие мутации есть и чем они спровоцированы, как можно на них воздействовать. Генетики дают заключение по мутациям в генах и по их чувствительности к определенным препаратам. Применяя эти результаты, индивидуально для данного человека подбирается лечение.
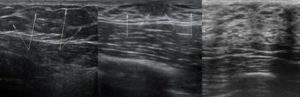 Здесь речь идет о прогнозе жизни для каждого отдельного пациента. Проводится оценка эффективности проведенного лечения и затем проводится хирургическая операция по удалению опухоли.
Здесь речь идет о прогнозе жизни для каждого отдельного пациента. Проводится оценка эффективности проведенного лечения и затем проводится хирургическая операция по удалению опухоли.
 Томоаппарат создает трехмерное изображение опухоли, точно определяются ее размеры, форма и локализация. Это позволяет, во-первых, с большой точностью доставить нужную дозу облучения к опухоли. И во-вторых, за счет спирального облучения идет воздействие на опухоль со всех проекций, вся опухоль равномерно подвергается лучевому воздействию.
Томоаппарат создает трехмерное изображение опухоли, точно определяются ее размеры, форма и локализация. Это позволяет, во-первых, с большой точностью доставить нужную дозу облучения к опухоли. И во-вторых, за счет спирального облучения идет воздействие на опухоль со всех проекций, вся опухоль равномерно подвергается лучевому воздействию.
 Джоли, удалив органы, снизила вероятность развития РМЖ, но нельзя сказать, что она полностью исключила вероятность рака. Могут остаться единичные клетки молочной железы в грудной клетке, и при наличии данной мутации есть вероятность развития рака. Поэтому посещение маммолога и прохождение маммографии (доступной и бесплатной) все равно обязательно для всех женщин.
Джоли, удалив органы, снизила вероятность развития РМЖ, но нельзя сказать, что она полностью исключила вероятность рака. Могут остаться единичные клетки молочной железы в грудной клетке, и при наличии данной мутации есть вероятность развития рака. Поэтому посещение маммолога и прохождение маммографии (доступной и бесплатной) все равно обязательно для всех женщин.
 Они проходят УЗИ обследование.
Они проходят УЗИ обследование.


 Но таким поведением, стремлением спрятаться от проблемы – они усугубляют течение болезни и ухудшают прогноз.
Но таким поведением, стремлением спрятаться от проблемы – они усугубляют течение болезни и ухудшают прогноз.

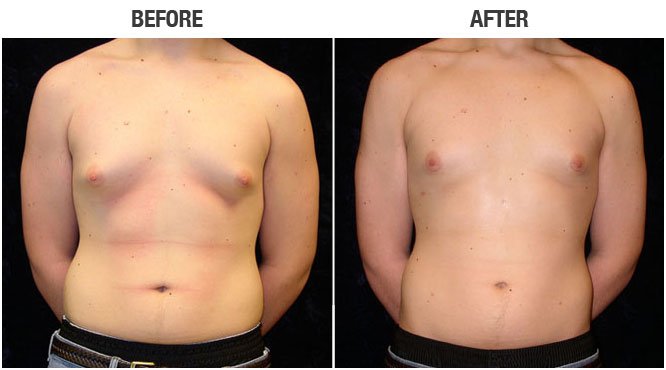 Это скопление жировой ткани.
Это скопление жировой ткани.
 2006 г.; 19:415-418.
2006 г.; 19:415-418. J УЗИ Мед . 2001 г.; 20:491-496.
J УЗИ Мед . 2001 г.; 20:491-496.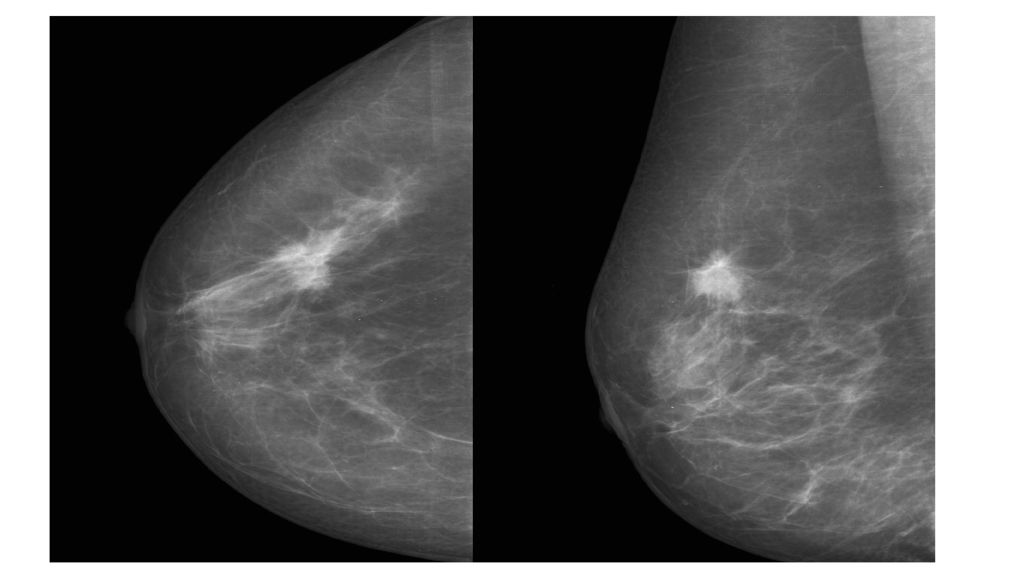 Грудь J . 2004 г.; 10:427–432.
Грудь J . 2004 г.; 10:427–432.