Восстановление ушной раковины в Москве от 10 000 руб
Пластика ушной раковины – разновидность отопластических операций, целью которой выступает восстановление эстетики ушей. Процедура позволяет избавиться от врожденных и приобретенных дефектов наружных органов слуха, при этом имеет минимум ограничений. Пластические хирурги «СМ-Пластика» применяют современные малотравматичные технологии, что упрощает операцию и делает ее полностью безопасной для пациента.
Показания и противопоказания
Восстановление ушной раковины посредством пластической операции требуется при следующих состояниях:
- серьезные травмы ушей, которые привели к частичной или полной утрате хрящевой ткани;
- врожденное отсутствие раковины;
- асимметрия ушей;
- дефицит мягкой ткани в данной области;
- разрастание рубцовой ткани;
- недоразвитость завитка.
Операцию на ушных раковинах проводят по желанию пациента, если его не устраивает форма, положение, степень прилегания ушей.
Индивидуальная консультация
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Противопоказаниями для отопластики являются:
- декомпенсированный сахарный диабет;
- острые воспалительные процессы в области ушных раковин;
- тяжелые сердечно-сосудистые патологии;
- заболевания щитовидной железы;
- хронические заболевания в фазе обострения;
- беременность и лактация.
Врач рассматривает каждый клинический случай в индивидуальном порядке. При наличии противопоказаний процедуру рекомендуют отложить до стабилизации состояния пациента. Пластические хирурги «СМ-Пластика» могут предложить одномоментное сочетание нескольких пластических вмешательств в области лица.
Описание операции
Техника проведения операции по восстановлению ушной раковины зависит от особенностей клинического случая. Врач может удалить излишек кожи или хрящевой ткани, либо устранить их дефицит путем вживления имплантов или аутотрансплантата. Контуры уха корректируют до достижения полной симметрии с 2 сторон.
Врач может удалить излишек кожи или хрящевой ткани, либо устранить их дефицит путем вживления имплантов или аутотрансплантата. Контуры уха корректируют до достижения полной симметрии с 2 сторон.
При необходимости можно скорректировать угол прилегания ушных раковин и избавиться от лопоухости. При полном отсутствии раковины проводят пересадку кожи и внедрение имплантов из силикона или других материалов. Благодаря высокому профессионализму врачей «СМ-Пластика», смоделированный орган полностью соответствует «натуральному» вне зависимости от площади дефекта.
Восстановление после операции
В «СМ-Пластика» активно применяются лазерные технологии, что существенно сокращает сроки реабилитационного периода и минимизирует неприятные ощущения после реконструкции ушей. После отопластики раннее восстановление продолжается в среднем 7-10 дней. В это время пациент соблюдает домашний режим, регулярно приходит к лечащему врачу на осмотры и перевязки. Другие ограничения определяются пластическим хирургом в индивидуальном порядке.
Эффект от операции
Отопластика позволяет частично решить проблемы слуха, связанные с врожденным отсутствием раковины. Данный тип пластической хирургии преимущественно решает эстетические проблемы. Пациент получает:
- симметричные уши;
- гармоничный вид лица;
- аккуратную форму ушных раковин;
- эстетичные завитки хрящевой ткани;
- абсолютно естественный вид моделированного органа.
После операции на ушных раковинах наши пациенты отмечают полное удовлетворение формой и внешним видом своих ушей. Это хирургическое вмешательство позволяет избавиться от серьезных комплексов и обрести уверенность в себе. Пластические хирурги «СМ-Пластика» гарантируют природный внешний вид ушей после операции, даже если их приходится реконструировать полностью.
Цена на пластику ушных раковин в «СМ-Пластика» соответствует средним расценкам по Москве. Сумма зависит от сложности случая и методики проведения вмешательства.
Наши преимущества
Опытные хирурги
Современное оборудование
Бесплатная консультация
Доступные цены
Европейский сервис
Операция в кредит
Нашим пациентам доступна пластическая хирургия ушной раковины в кредит*, независимо от того, проводится ли данная операция по эстетическим соображениям или медицинским показаниям.
Для этого необходимо:
- Прийти на индивидуальную консультацию к специалисту «СМ-Пластика», где врач определит возможность проведения операции, объем хирургического вмешательства и предварительный план лечения.

- На основании этих данных будет определена стоимость.
- Заполнить заявление на получение кредита* по форме банка и дождаться одобрения заявки, после чего приступить к лечению по установленному врачом плану.
Записаться на консультацию и узнать подробности условий получения кредита* на оплату услуг «СМ-Пластика» можно по телефону: +7 (495) 777-48-05.
В случае оплаты медицинских услуг в кредит* скидки по дисконтной программе «СМ-Клиника» и «СМ-Пластика» не предоставляются.
* Кредит предоставляется АО «ОТП Банк» на основе Генеральной лицензии Банка России № 2766 от 27.11.2014 г.
Пластика ушных раковин
Эстетические показания к пластике ушных раковин в большинстве сводятся к коррекции лопоухости (оттопыренных ушных раковин). Ее причинами бывают: недоразвитие завитка и противозавитка, гипертрофия чаши, выпячивание мочки уха, а также комбинация вышеуказанных вариантов.
Точная диагностика имеющихся проблем, обсуждение ее с пациентом являются основой для качественного лечения.
Коррекцию лопоухости можно выполнять в любом возрасте, однако, если делать ее в возрасте 5-6 лет, это избавляет ребенка от комплекса, который в школе часто подогревается другими детьми. Оптимальным является ситуация, когда Ваш ребенок начинает задавать вопросы относительно своих ушных раковин и хотел бы, чтобы они стали такими же, как у большинства детей. Тогда поход к хирургу проходит легко для Вас и для него.
К 5-6 годам ушная раковина полностью сформирована и выросла до 85% своего окончательного размера, хрящи мягко эластичные и легко принимают нужную форму во время операции.
Противопоказаниями к операции являются острые и хронические воспалительные заболевания уха, болезни крови, связанные с нарушением свертывающей системы, системные заболевания соединительной ткани и некоторые другие заболевания.
Перед операцией пластики ушных раковин необходимо сдать анализы и пройти все необходимые обследования.
Две недели перед отопластикой и неделю после нельзя принимать препараты уменьшающие свертывание крови (аспирин и др.).
Вечером или утром накануне проведения отопластики следует тщательно вымыть волосы и уши с антибактериальным мылом. Если операция будет проводиться под наркозом, то в день операции, за 5 часов до отопластики нельзя есть и пить.
Существует несколько техник выполнения отопластики. Их можно разделить на три группы.
Первая группа операций (шовные) для коррекции ушной раковины использует наложение швов на хрящ.
Вторая группа операций (резекционные) – предусматривает удаление участков хряща с последующим их сшиванием.
Третья группа представляет собой сочетание шовных и резекционных методик.
Выбор хирургической техники, для коррекции лопоухости, зависит от правильного предоперационного анализа.
Пластика ушных раковин выполняется амбулаторно и не требует госпитализации. Операция проводится под местной анестезией и обычно длится около часа, иногда чуть дольше.
Операционное поле обрабатывают и накрывают стерильным хирургическим бельем. Разрез кожи длиной до 4 см осуществляют позади ушной раковины. После гемостаза, на хряще путем нанесения насечек и наложения швов выполняют моделирование его формы.
Швы накладываются не рассасывающимися нитками таким образом, чтобы сформировать правильную форму ушной раковины и избавиться от лопоухости.
Разрез кожи позади ушной раковины часто зашивают нитками, которые рассасываются самостоятельно.
В операционной на голову пациента накладывают повязку, которая будет снята на перевязке на следующий день.
Как правило, днем пациенту разрешается ходить без повязки, конечно оберегая ушные раковины от случайной травмы, однако на ночь мы рекомендуем надевать повязку в виде чепчика (самый обычный чепчик, подобный тем, которые надевают маленьким детям), который завязывается на подбородке. Смысл повязки состоит не в том, чтобы придавить ушные раковины, а в том, что не дать им травмироваться во время сна. Спать в таком чепчике следует до 8 недель. За это время форма ушной раковины начинает удерживаться не за счет, наложенных швов, а за счет внутренних рубцов.
Смысл повязки состоит не в том, чтобы придавить ушные раковины, а в том, что не дать им травмироваться во время сна. Спать в таком чепчике следует до 8 недель. За это время форма ушной раковины начинает удерживаться не за счет, наложенных швов, а за счет внутренних рубцов.
В первые дни после операции Вы будете испытывать умеренные болевые ощущения, которые уменьшаются с помощью обезболивающих лекарств.
После отопластики ушная область, может ощущаться онемевшей и отечной, а в области операции имеются, как правило, кровоизлияния.
Синяки и отеки обычно полностью проходят через две недели после отопластики.
Волосы обычно можно вымыть на 2-е сутки.
Обычно швы после отопластики снимать не нужно, так как раны ушиваются нитками, которые самостоятельно рассасываются.
Большинство пациентов возвращаются к труду уже на следующий день после операции. В течение 8 недель нельзя заниматься контактными видами спорта (борьба, баскетбол), чтобы не получить случайную травму.
Дети могут вернуться к занятиям в школе через неделю.
Пластика ушных раковин выполняется по эстетическим показаниям, поэтому наиболее частой проблемой является отсутствие планируемого результата. Это может возникать в результате технических ошибок, неправильно выбранной методики операции, случайной травмы, полученной пациентом в послеоперационном периоде, но и не достаточным взаимопониманием между хирургом и пациентом при планировании результата операции.
Легкая степень асимметрии в размерах, форме и расположении ушной раковины является нормой, однако, пациенты особенно с выраженной степенью лопоухости, иногда начинают страдать перфекционизмом — поиском совершенства в несовершенном мире. До операции Вы должны четко понимать, что абсолютная симметрия желательна, но не всегда достижима.
Нагноение операционной раны после отопластики бывает очень редко .
Если температура поднимается до высоких цифр, возникает сильный отек, или появляется интенсивная боль в области раны надо немедленно обратиться в клинику, возможно, это воспаление.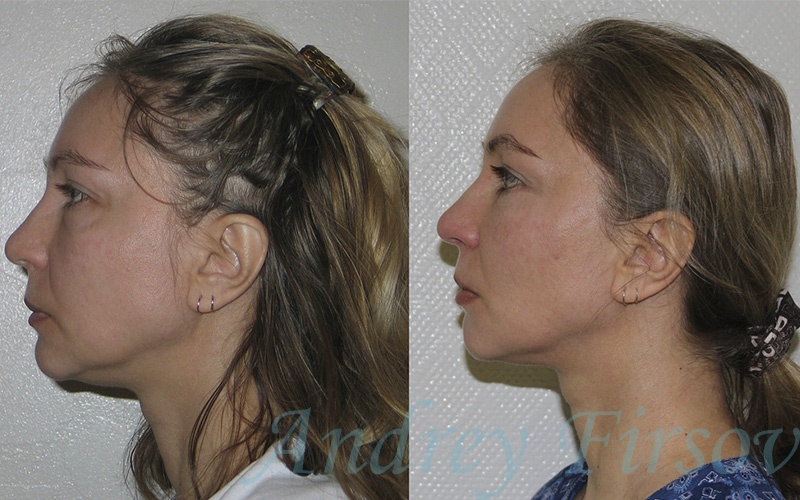
Другим осложнением пластики ушных раковин может быть образование гематомы. Для лечения гематомы нужно снять кожные швы, удалить скопление крови и остановить кровотечение из сосуда. Послеоперационное кровотечение не оказывает отрицательного воздействия на результат отопластики. Риск кровотечения после отопластики больше, если пациент перед операцией принимал аспирин.
Отопластика в Самаре. Цены. Пластика ушных раковин.
Не каждого человека природа награждает правильной формой ушей. Раньше приходилось мириться, жить с этим недостатком, название которому – лопоухость. Пластическую операцию по исправлению формы ушей, называют отопластикой .
Результаты пластической хирургии подразумевают симметрию и аккуратное прижатие ушных раковин, при котором можно носить любимую прическу, не испытывая комплексов в общении с людьми.
Ушные раковины – это парная часть тела, поэтому целью любой пластики ушей является симметрия. В некоторых случаях не требуется вмешательство по всей области ушной раковины, а лишь ее части. Так как имеются случаи лопоухости, например, только верхней 1/3 части ушей. В этой ситуации проводить длинный разрез в заушной борозде не приходится. Предоставляется лишь небольшой доступ к хрящу, после чего хрящ моделируется и фиксируется только в верхней 1/3 части. В большинстве случаев вместе с процедурой по устранению лопоухости проводится симметризация или уменьшение мочек ушей. Каждая ситуация рассматривается индивидуально и тщательно.
В некоторых случаях не требуется вмешательство по всей области ушной раковины, а лишь ее части. Так как имеются случаи лопоухости, например, только верхней 1/3 части ушей. В этой ситуации проводить длинный разрез в заушной борозде не приходится. Предоставляется лишь небольшой доступ к хрящу, после чего хрящ моделируется и фиксируется только в верхней 1/3 части. В большинстве случаев вместе с процедурой по устранению лопоухости проводится симметризация или уменьшение мочек ушей. Каждая ситуация рассматривается индивидуально и тщательно.
Технология и виды пластики ушей
В зависимости от сложности операции, коррекцию лопоухости проводят под общей или местной анестезией. Операционные разрезы проводятся хирургическим лазером и скальпелем. Шрамов практически не остается, так как разрезы делаются по естественной складке кожи за ухом, и швы в ней незаметны.
Восстановительная пластика ушей- самый сложный вид хирургического вмешательства, требующий от хирурга большого опыта.
Реконструкционная пластика ушей проводится, если необходимо исправить врожденную патологию строения ушных раковин, последствия травмы. Реконструкционная пластика способствует так же восстановлению отсутствующего уха.
Эстетическая отопластика предназначена для исправления неправильных форм ушных раковин и устранить косметологический дефект. Чаще всего причиной хирургического вмешательства является лопоухость. Эстетическую отопластику делают при асимметрии ушных раковин. Чаще всего, операции по исправлению лопоухости и асимметрии проводят в раннем возрасте: её можно делать, начиная с 5 – 6 лет. Данные операции никак не влияют на качество слуха.
Отопластика
Лопоухость — та проблема, которая волнует многих людей с детства. Дисгармония, недовольство внешностью и даже детские насмешки делают операцию по изменению формы ушной раковины мечтой.
Отопластика — пластика ушной раковины — одна из самых популярных операций, причем как среди женщин, так и мужчин. Вмешательство не требует наркоза — в большинстве случаев достаточного местного обезболивания — проводится в течение часа и не требует долгой реабилитации.
Вмешательство не требует наркоза — в большинстве случаев достаточного местного обезболивания — проводится в течение часа и не требует долгой реабилитации.
Методы проведения отопластики
Современная пластическая хирургия обладает двумя основными методиками коррекции формы ушной раковины: шовная и бесшовная.
Бесшовная методика, как правило, применяется при избавлении от лопоухости у детей. Хирургия при этом использует свойство ушного хряща сгибаться в обратном направлении от сделанных хирургом засечек. Так в ходе естественного их заживления уши «подтягиваются» и обретают желаемые аккуратные формы.
Шовная методика предполагает работу хирурга по ушиванию сделанных на ушной раковине засечек. Разрезы делаются в незаметных местах, и после полного заживления незаметны.
Операция проводится при местном обезболивании, пациент находится в сознании. В ходе операции доктор показывает пациенту в зеркало результат, что позволяет вместе скорректировать ход коррекции и получить желаемый результат.
Подготовка и ход операции
Перед операцией обязательна консультация пластического хирурга, на которой доктор осмотрит пациента, узнает пожелания и предложит свои варианты решения этого вопроса. Также на этом этапе будет определена методика проведения операции, а также назначена дата ее проведения.
До этого дня необходимо получить результаты ряда лабораторных исследований.
В день операции до ее проведения рекомендуется отказаться от пищи. За время операции доктор делает разрез за ушной раковиной, после чего отделяет от кожных покровов хрящ. Хрящ отгибается и необходимая для коррекции его часть удаляется. Ушной раковине придается нужное положение, после чего накладываются швы (или не накладываются, в зависимости от методики) и накладывается повязка.
Несколько часов после операции необходимо провести в дневном стационаре, после чего можно идти домой.
После операции
Швы снимаются на 3-4 сутки после операции, повязка остается на 7-10 дней. Небходимое условие — ее ежедневная смена.
Небходимое условие — ее ежедневная смена.
Полноценное заживление тканей происходит в течение двух месяцев. В это время необходимо оберегать уши от физического воздействия. В этой связи мы рекомендуем на протяжении нескольких недель после операции надевать повязку на уши на ночь.
Осложнений после отопластики не возникает. Даже в случае образования отечности или гематом они проходят самостоятельно. Может также наблюдаться общее ухудшение самочувствия после операции в течение двух-трех дней. Это реакция организма на вмешательство, которая в скором времени компенсируется.
Современная хирургия позволяет получить желаемый результат даже в самых сложных случаях и обрести желаемый элегантный образ.
цены на отопластику в клинике МЕДСИ в Санкт-Петербурге.
Виды отопластики
Выделяют 2 основные разновидности коррекции:
- Эстетическая. Она направлена на исправление формы ушей.
 В рамках операции хирургу удается придать раковинам более привлекательный внешний вид. Такое вмешательство назначается при желании самого пациента скорректировать внешние недостатки
В рамках операции хирургу удается придать раковинам более привлекательный внешний вид. Такое вмешательство назначается при желании самого пациента скорректировать внешние недостатки - Реконструктивная. Такая пластика направлена на восстановление отдельных участков ушных раковин при их отсутствии. Эта коррекция обычно выполняется при врожденных или приобретенных в результате травм дефектах
Показания
Отопластика проводится при:
- Выраженной лопоухости
- Неправильной форме, слишком крупном или малом размере ушной мочки
- Неправильном формировании раковины или ее повреждениях
- Увеличении угла между черепом и ухом и др.
Важно! Некоторые из вмешательств (например, для устранения лопоухости) лучше проводить еще в раннем возрасте. Это связано с тем, что все части раковины формируются у ребенка до 6 лет. В раннем возрасте операции проводятся достаточно быстро и не требуют длительного восстановления.
Противопоказания
Отопластику не проводят при:
- Онкологических патологиях
- Сахарном диабете
- Патологиях свертываемости крови
Отложить вмешательство следует при болезнях уха, острых инфекционных и воспалительных процессах в организме, во время беременности и кормления грудью.
Обо всех противопоказаниях до операции расскажет врач. Предварительно вы сдадите необходимые анализы и пройдете обследование. Это позволит предотвратить операционные и послеоперационные риски.
Методы операции
Коррекция различных дефектов ушных раковин проводится с использованием нескольких методик.
Традиционная отопластика
При таком вмешательстве все разрезы хирург выполняет с помощью скальпеля. Операция является достаточно длительной. Обычно она проводится в течение 1-3 часов (в зависимости от имеющихся дефектов). Длительной является и реабилитация после вмешательства. Нередко швы долго заживают.
Длительной является и реабилитация после вмешательства. Нередко швы долго заживают.
Лазерная отопластика
Этот метод является более современным. При вмешательстве все разрезы хирург делает при помощи специального лазера. Это обеспечивает одновременное «запаивание» сосудов и предотвращение риска развития инфекционного процесса. Кроме того, реабилитация после лазерной операции проходит значительно быстрее. Сокращается и вероятность многочисленных осложнений.
К достоинствам методики также относят:
- Бесконтактное воздействие на ткани ушей
- Смягчение хрящей под воздействием лазерного луча
- Идеальную точность проведения всех манипуляций
- Стимуляцию регенерации тканей еще во время операции
Пластичность хряща позволяет придавать ему любую нужную форму. Это обеспечивает высокий эстетический эффект отопластики. Сокращается вероятность возникновения синяков и отеков после вмешательства.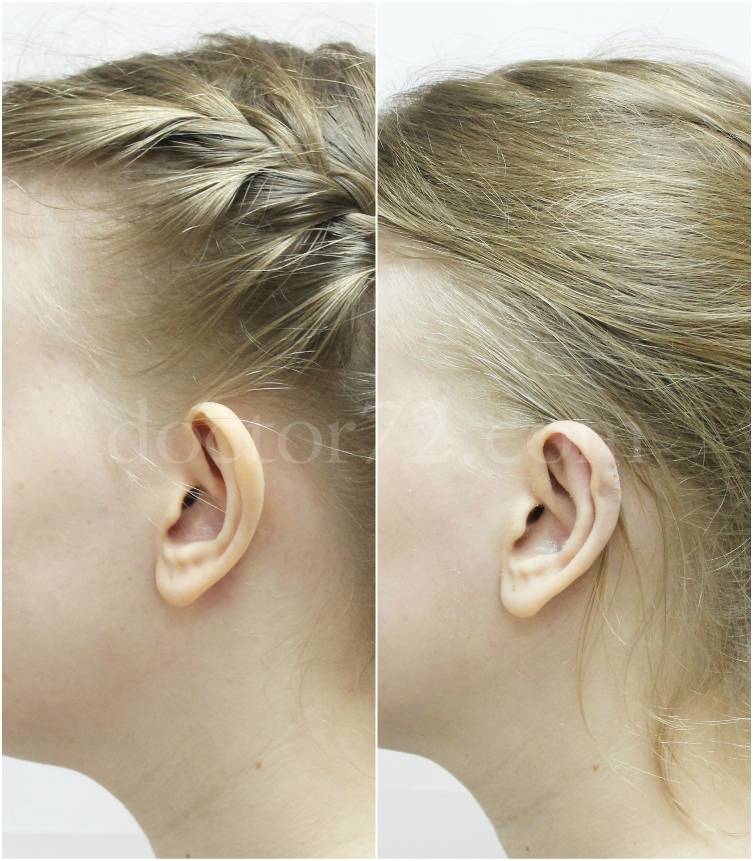 После коррекции не остается крупных рубцов и шрамов. Это позволяет скрыть факт проведения операции от окружающих.
После коррекции не остается крупных рубцов и шрамов. Это позволяет скрыть факт проведения операции от окружающих.
Пластика ушей может выполняться с использованием различных техник.
В их числе:
- Бесшовная. Устранение всех дефектов ушных раковин проводится благодаря эластичности хрящевой ткани. Она легко сгибается и может быстро иссекаться вместе с кожей. Швы после операции не накладываются. Также хирурги используют метод, при котором на ушных раковинах (наружной части хрящей) делаются насечки. При этом легко исправляются все дефекты
- Шовная. Технология бывает двух видов. Furnas – такое вмешательство проводится путем удаления кожи на задней стороне уха. При этом хрящевая ткань подшивается к височной части головы. Mustarde – при такой шовной технологии на внутренней стороне уха хирург делает разрез. Форма уха корректируется благодаря наложению швов на хрящевую ткань.
При лопоухости проводится корректировка без удаления хряща. В ходе вмешательства хирург отрезает участок кожи за ухом, отгибает хрящ и обеспечивает закрепление тканей специальными несъемными швами.
В ходе вмешательства хирург отрезает участок кожи за ухом, отгибает хрящ и обеспечивает закрепление тканей специальными несъемными швами.
Также применяется и закрытый метод отопластики. Он по праву считается наименее травматичным. При такой коррекции для доступа к хрящу хирург делает несколько проколов на задней части уха. Через эти проколы и устраняются имеющиеся недостатки.
Важно! Метод проведения пластики ушей врач определяет заранее. При этом он обязательно получает согласие от пациента. Выбор техники зависит как от индивидуальных особенностей человека, так и от выявленных недостатков.
Ход операции
Подготовка
Сначала пациент вводится в состояние наркоза. Отопластика детям обычно проводится под общим наркозом, взрослым зачастую рекомендуют местную анестезию.
Непосредственно вмешательство
Хирург выполняет необходимые проколы или разрезы, убирает лишнюю кожу и хрящевую ткань.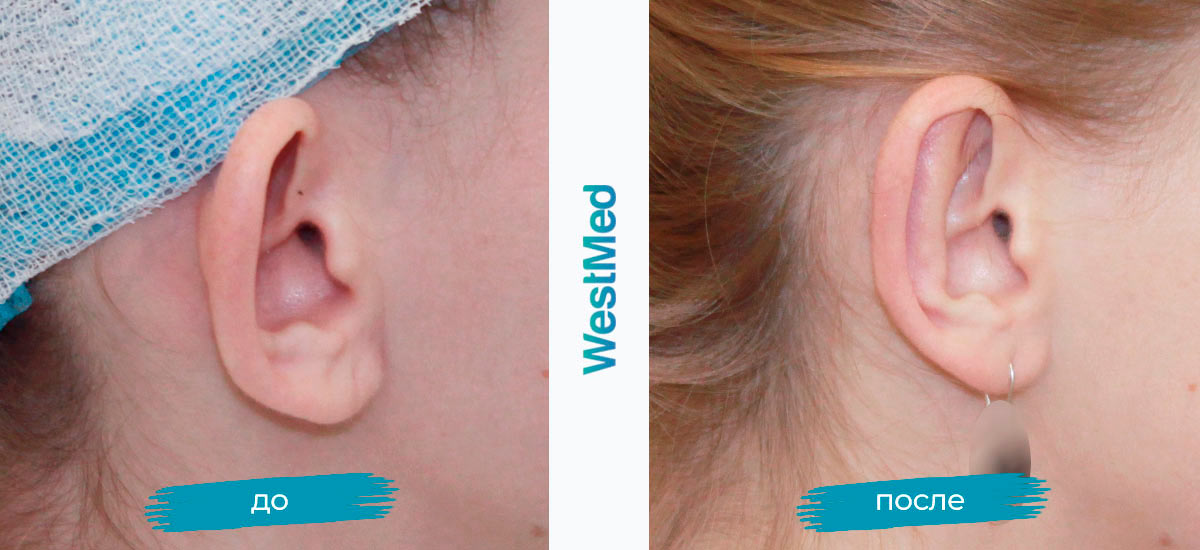 Затем определяется новое положение ушной раковины. Конкретная методика выполнения всех манипуляций определяется заранее.
Затем определяется новое положение ушной раковины. Конкретная методика выполнения всех манипуляций определяется заранее.
Наложение швов и специальной повязки
Повязку пациент носит несколько дней. С ее помощью обеспечивается фиксация ушной раковины в нужном положении
Если операция выполнялась под местной анестезией, пациент может пойти домой уже через 1-2 часа. Если вмешательство проводилось под общим наркозом, человека оставляют в клинике на несколько дней (как правило, от одного до трех).
Реконструктивная пластика ушей
Такая операция позволяет восстановить как отдельные элементы, так и ушные раковины полностью. Каждый случай рассматривается индивидуально. Обычно решение о том, как проводить вмешательство, принимается несколькими опытными пластическими хирургами. Это связано со сложностью любой реконструкции.
Выполняется пластика в 4 этапа:
- Восстановление хряща
- Приживление раковины
- Восстановление мочки
- Формирование раковины
Сложные манипуляции должен выполнять опытный хирург. Только в этом случае можно рассчитывать на положительный исход реконструктивной пластики ушей.
Только в этом случае можно рассчитывать на положительный исход реконструктивной пластики ушей.
Реабилитация
Восстановление после отопластики у детей и взрослых обычно проходит достаточно быстро. Пациенту регулярно выполняют перевязку.
Также следует соблюдать ряд рекомендаций, касающихся:
- Ограничения попадания влаги на прооперированную область
- Физических нагрузок. Воздержаться от занятий спортом следует в течение 2-3 недель после вмешательства
- Приема лекарственных препаратов. Они назначаются только врачом
Осложнения
К основным неопасным последствиям вмешательства относят отечность, образование гематом, повышение температуры тела, болевой синдром. Они не требуют посещения врача, если не доставляют выраженного дискомфорта.
Обратиться к специалисту следует при:
- Нагноении раны
- Расхождении краев разреза
- Образовании выступающих над плоскостью кожи келоидных рубцов
- Кровотечении
- Отите бактериальной или гнойной природы
Эти осложнения являются опасными, могут привести к повторной деформации и проблемам со слухом.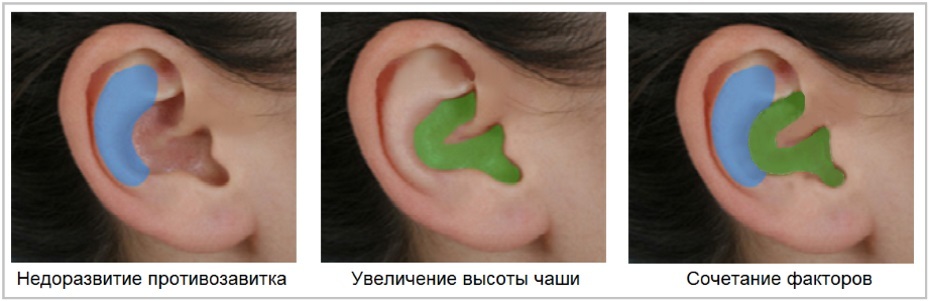
Преимущества обращения в МЕДСИ
- Опытные врачи. Наши специалисты обладают высоким уровнем квалификации и могут проводить вмешательства любой сложности пациентам даже с выраженными деформациями ушных раковин. Врачи международного уровня тщательно следят за появлением новых методик, быстро внедряют их и самостоятельно совершенствуют. Это позволяет достигать высочайшей эффективности вмешательств
- Персонализированный подход. Все операции назначаются только после тщательной комплексной диагностики и выявления показаний и противопоказаний к определенным процедурам
- Современные методики. Мы проводим не только традиционные хирургические вмешательства, но и применяем безоперационные аппаратные и другие техники, позволяющие сокращать травматизацию тканей и риски осложнений
- Комфортные условия в стационаре. Палаты оснащены всем необходимым. За каждым пациентом в период реабилитации постоянно наблюдает опытный персонал
- Доступность услуг.
 Цена на пластику ушных раковин (отопластику) в Санкт-Петербурге не завышается нами. Это позволяет обращаться за помощью всем категориям пациентов
Цена на пластику ушных раковин (отопластику) в Санкт-Петербурге не завышается нами. Это позволяет обращаться за помощью всем категориям пациентов - Быстрое восстановление. Оно обеспечивается как с помощью грамотного ухода, так и с использованием современных методик
Если вы решили сделать отопластику (пластику ушей) в нашей клинике в Санкт-Петербурге, вас интересует цена вмешательства и другие его особенности, запишитесь на консультацию по телефону + 7 (812) 336-33-33.
Отопластика — Цена коррекции ушей в Челябинске
Отопластика: как это делают хирурги клиники «ЛораВита»
Детская отопластика в Челябинске выполняется под общим наркозом, взрослым может назначаться местный. Длительность операции от 30 минут до 2-3 часов.
В процессе коррекции пациент находится в положении лежа, хирург выполняет процедуру поочередно на обеих ушных раковинах.
Пластика бывает двух видов:
- косметическая, направленная на исправление внешних недостатков: лопоухости, размера ушей;
- реконструктивная — восстановление после травм или патологий при рождении.

Операция считается сложной, так как врач добивается полной симметрии ушных раковин.
- На задней стороне уха хирург делает разрез длиной 3-4 см;
- Хрящ рассекается скальпелем и избыток ткани удаляют;
- Если корректируется лопоухость, хирург придает хрящу необходимую форму;
- Далее изменения фиксируются и рана ушивается косметическим швом.
Послеоперационные рубцы по прошествии периода заживления незаметны, и нет необходимости в процедурах по удалению рубцов. На слух отопластика не влияет.
Показания к проведению отопластики
Нестандартная форма ушей — предмет насмешек окружающих и ощутимо портит жизнь ее обладателям. Пышные прически, прикрывающие оттопыренные уши — не выход. Исправить недостаток с помощью отопластики в Челябинске — решение проблемы на всю оставшуюся жизнь.
Операцию выполняют при:
- лопоухости и желании от нее избавиться;
- необходимости скорректировать размер ушной раковины — увеличить или уменьшить;
- ухудшении ориентации по слуху в пространстве, связанное с формой обоих ушей.

Список противопоказаний
- обострение тяжелых, хронических, инфекционных заболеваний;
- воспаление наружного уха;
- беременность и период менструации у женщин;
- возраст до 6 лет;
- нарушения функционирования эндокринной системы — проблемы со щитовидной железой;
- плохая свертываемость крови.
Подготовка к операции
Процедура безопасна и безболезненна. Обязательна консультация пластического хирурга, на которой он выберет способ коррекции и расскажет о возможных последствиях и восстановительном периоде. За консультацией последует сдача анализов и выявление отсутствия противопоказаний, далее выполнять рекомендации.
Анализы и процедуры для проведения операции под общим наркозом
- общий анализ крови с тромбоцитами и длительностью кровотечения
- общий анализ мочи
- коагулограмма
- уровень глюкозы крови
- общий белок крови
- общий билирубин крови
- АСТ и АЛТ
- группа крови и РН фактор
- анализ крови на ВИЧ
- анализ крови на сифилис
- анализ крови на гепатиты В и С
- ЭКГ и заключение терапевта о состоянии здоровья
Годность анализов не более 14 дней, пункты 9, 10, 11 — 3 месяца
Реабилитация
- пациент проводит в клинике после процедуры от 3-х часов до суток;
- 7-10 дней носить повязку, которая фиксирует ушные раковины и предохраняет от внешних повреждений и инфекции;
- можно принимать препараты, способствующие заживлению, которые назначает пластический хирург:
- болевые ощущения могут наблюдаться в течение первой недели.
 Они легко снимаются приемом анальгетиков;
Они легко снимаются приемом анальгетиков; - в процессе заживления делаются перевязки: на второй и в 3-4-й день;
- через неделю снимаются швы.
Рекомендуется
- принимать витамины;
- полноценно питаться здоровой пищей;
- за неделю до операции прекратить прием аспирина и аналогичных препаратов во избежание кровотечения;
- курильщики должны отказаться от употребления никотина;
- стараться умеренно употреблять или вовсе исключить алкогольные напитки.
Корекция формы ушных раковин | Pro Cosmetic. Пластическая хирургия
Примеры устранения лопоухости. Операции произведены хирургом А. Б. Резником.
Обычно деформированы обе ушные раковины, хотя в ряде случаев встречаются пациенты с просьбой: “…подогнать одно ухо под другое”.
Пример коррекции оттопыренной правой ушной раковины у 26-летней пациентки. Контрольные фото через 2 недели после операции. Хирург: А. Б. Резник.
Б. Резник.
ВОЗРАСТНЫЕ ОГРАНИЧЕНИЯ
Операции по устранению деформаций наружного уха рекомендуем выполнять, начиная с 6 – 7 летнего возраста, когда в основном заканчиваются формирование и рост ушных раковин. Переход ребенка из детского сада в школьную среду, социальное неприятие «Чебурашки» или «Микки-Мауса» сверстниками, делают визит ребенка в клинику хирургии уже сформировавшимся и сознательным выбором.
Комментарий доктора A.Б. Резника. Современная техника позволяет располагать линию швов в естественных складках заушных впадин. Эти приемы скроют факт произведенной хирургии даже от Вашего парикмахера.
Техника операции
Мнимая простота понятия «прижать ушки» заставляет многих «умельцев» заниматься деформациями ушных раковин. Иногда, при этом возникают непоправимые изменения хряща и кожи.
Степень и виды деформаций ушных раковин чрезвычайно вариабельны, что требует от хирурга строго индивидуального подхода ко всякому пациенту, непременно исключающего некую «пригодную для всех» универсальную методику операции.
Комментарий доктора А.Резника
На етапе выбора хирурга, настоятельно рекомендуем смотреть послеоперационные фото пациентов в разных ракурсах.
Комментарий доктора А.Резника
Всем четырем пациентам в ходе коррекции оттопыреных ушных раковин я использовал различные методики акцентирования противозавитка ладъевидной ямки
В настоящее время известно большое количество различных методов коррекции оттопыренных ушных раковин, знание и логичное применение которых позволяет получать хорошие результаты.
Пятидесятилетний опыт Львовской городской косметологической больницы позволил видоизменить некоторые известные классические методики отопластики и создать собственные авторские техники.
У пациентов мы использовали технику “Лепестка” являющейся разработкой нашей клиники. Хирург А.Б. Резник.
ДООПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ*
- общий морфологический анализ крови
- общий анализ мочи
- коагулограмма
- сахар крови
- RW, HBsAg
* результаты обследований действительны в течение недели
АНЕСТЕЗИЯ
Операцию проводят под местным или комбинированным обезболиванием в условиях хирургического стационара. Длительность операции обычно составляет 1,5 – 2 часа.
РЕАБИЛИТАЦИЯ
Пребывание в стационаре обычно составляет 3-5 суток. После выписки из стационара, частота Ваших визитов в клинику на перевязки будет определяться лечащим доктором. После снятия швов с кожи (10-14 сутки) рекомендуем наложение эластичной повязки на ночь в течение 3 недель во избежание подворачивания ушной раковины во время сна.
На некоторое время, чувствительность уха возможно нарушится. Это состояние не требует дополнительного лечения и проходит самостоятельно в течение двух месяцев. Школьникам и студентам по окончании лечения предоставляется освобождение от занятий физической культурой сроком на полтора месяца.
Школьникам и студентам по окончании лечения предоставляется освобождение от занятий физической культурой сроком на полтора месяца.
ПОСЛЕОПЕРАЦИОННЫЕ ФОТОГРАФИИ ПАЦИЕНТОВ
ушная раковина | Ключ пластической хирургии
(1)
Кафедра анатомии, Медицинская школа Демокритский университет Фракии, Александруполис, Эврос, Греция
Реферат
Ушная раковина имеет уникальную морфологию, сильно варьирует по размеру и форме. преобладающая черта лица. Вместе с наружным слуховым проходом он составляет наружное ухо. Ушная раковина представляет собой хрящевую структуру скелета, покрытую кожным вкладышем, соответствующим его форме.
Ушная раковина снабжена богатой анастомотической сетью, которая образована ветвями заднего предсердия и поверхностных височных сосудов. Лишь несколько лоскутов простой конструкции можно извлечь из ушной раковины, и они предназначены для восстановления небольших дефектов самой ушной раковины.
Ушная раковина вместе с наружным слуховым проходом составляет наружное ухо. Это морфологически уникальная структура, сильно различающаяся по размеру и форме и преобладающая черта лица.
Это морфологически уникальная структура, сильно различающаяся по размеру и форме и преобладающая черта лица.
7.1 Анатомия ушной раковины
Ушная раковина представляет собой сложную хрящевую скелетную структуру, покрытую кожным вкладышем, соответствующим его форме.
Выпуклый и вогнутый элементы хрящевого каркаса отвечают за конфигурацию ушной раковины и соответствуют ориентирам ушной раковины (рис. 7.1).
Рис. 7.1
Топографические ориентиры боковой поверхности ушной раковины
7.1.1 Кожа и подкожная ткань
Кожа, покрывающая ушную раковину, очень тонкая, с минимальным количеством подкожной ткани. Он прикрепляется к подлежащему хрящу и обнаруживает важные с хирургической точки зрения различия между латеральной и краниальной (медиальной) поверхностями ушной раковины. Кожа боковой поверхности плотно прилегает к надхрящнице с ограниченной подвижностью, а подкожная клетчатка скудна (рис. 7.2). Прикрепление кожи к хрящу усиливается по мере прохождения через раковину и далее в наружный слуховой проход.

Рис. 7.2
Кожа боковой поверхности ушной раковины практически лишена подкожной клетчатки
На краниальной поверхности ушной раковины кожа толще и меньше прилегает к надхрящнице, с большей подвижностью и более подкожная клетчатка присутствует (рис. 7.3). Долька не имеет хрящевой структуры и состоит исключительно из кожи и подкожно-жировой клетчатки.
Рис. 7.3
На медиальной поверхности ушной раковины кожа толще и присутствует больше подкожной клетчатки
7.1.2 Мышцы
Мускулатура наружного уха включает внешние и внутренние мышцы. Внешние мышцы представляют собой три очень тонких веера мышечных волокон, которые образуют переднюю ушную мышцу, верхнюю ушную мышцу и заднюю ушную мышцу (рис. 7.4). Они охватываются височно-теменной фасцией и соединяют ушную раковину с волосистой частью головы и черепом (см. Главу 2). Передняя и задняя связки усиливают прикрепление наружного уха к черепу.
Рис.
 7.4
7.4Внешние мышцы предсердия
Внутренняя группа мышц включает большую спираль, малую спираль, трагикус, антитрагическую мышцу, поперечную мышцу ушной раковины и косую мышцу ушной раковины. Эти мышцы очень разнообразны и часто недоразвиты. Редко они выглядят грубо как очень тонкие и разбросанные мышечные волокна. Все эти мышцы иннервируются височной и задней ушной ветвями лицевого нерва.
7.1.3 Анатомия сосудов
Артериальное кровоснабжение ушной раковины обеспечивается богатой анастомотической сетью, которая образована ветвями задней ушной раковины и поверхностной височной артерии (рис.7.5). Задняя предсердная артерия является основным источником кровоснабжения ушной раковины (Park et al. 1992 ; Imanishi et al. 1997 ; Pinar et al. 2003 ).
Рис. 7.5
Артериальная васкуляризация ушной раковины
Поверхностная височная артерия дает начало трем небольшим ветвям, которые проходят к передней части боковой поверхности ушной раковины.
 Эти ветви представляют собой верхнюю, среднюю и нижнюю ушные артерии и распространяются на переднюю и боковую стороны ушной раковины.Верхняя предсердная артерия входит в спиральный корень и продолжается вдоль края спирали («спиральная артерия») и сообщается с задней ушной артерией, образуя артериальную аркаду («спиральную аркаду») (Song et al. 1996 ; Moschella et al. 2003 ; Erdmann et al. 2009 ).
Эти ветви представляют собой верхнюю, среднюю и нижнюю ушные артерии и распространяются на переднюю и боковую стороны ушной раковины.Верхняя предсердная артерия входит в спиральный корень и продолжается вдоль края спирали («спиральная артерия») и сообщается с задней ушной артерией, образуя артериальную аркаду («спиральную аркаду») (Song et al. 1996 ; Moschella et al. 2003 ; Erdmann et al. 2009 ). Задняя ушная артерия после ответвления от наружной сонной артерии поднимается вверх и разделяется на затылочную и ушную ветви. Ветвь ушной раковины проходит вдоль ретроаурикулярной борозды, проходящей под задней ушной мышцей, и дает три ветви к краниальной поверхности ушной раковины.Эти ветви также подразделяются на веточки, которые идут к свободному краю спирального обода и проходят вокруг него к боковой поверхности, а другие ветви проникают в хрящ, достигая также боковой поверхности. Через эти перфораторы задняя предсердная артерия в значительной степени участвует в васкуляризации боковой поверхности ушной раковины.
 Park et al. ( 1992 ) обнаружили, что основные перфораторы задней ушной артерии появляются на переднеаурикулярной поверхности в треугольной ямке, cymba cocha, спиральном корне, кавум cocha и мочке уха.
Park et al. ( 1992 ) обнаружили, что основные перфораторы задней ушной артерии появляются на переднеаурикулярной поверхности в треугольной ямке, cymba cocha, спиральном корне, кавум cocha и мочке уха.Венозный дренаж ушной раковины сопровождает артериальное кровоснабжение. Задние ушные вены впадают во внешнюю яремную вену, а передние ушные вены — в поверхностные височные и задние лицевые вены.
7.1.4 Сенсорная иннервация
Ушная раковина иннервируется большим ушным нервом, малым затылочным нервом и ушно-височным нервом (рис. 7.6).
Рис. 7.6
Сенсорная иннервация ушной раковины
Только золотые участники могут продолжить чтение.Войдите или зарегистрируйтесь, чтобы продолжить СвязанныеНаш опыт по показаниям и новейшим методам
Biomed Res Int. 2014; 2014: 373286.
, 1 , * , 1 , 1 , 1 , 2 , 2 и 1K.
 Storck
Storck1 Отделение оториноларингологии, хирургии головы и шеи, Klinikum Rechts der Isar, Technische Universität München, Ismaninger Strasse 22, 81675 München, Германия
R.Staudenmaier
1 Отделение оториноларингологии, хирургии головы и шеи, Klinikum Rechts der Isar, Technische Universität München, Ismaninger Strasse 22, 81675 München, Германия
M. Buchberger
Отделение хирургии шеи и шеи 1 Отделение хирургии шеи и шеи 1 , Klinikum Rechts der Isar, Technische Universität München, Ismaninger Strasse 22, 81675 München, Germany
T. Strenger
1 Отделение оториноларингологии, хирургии головы и шеи, Klinikum Rechts der Isar Isar, Ismaninger Strasse, 22 81675 Мюнхен, Германия
K.Kreutzer
2 Отделение челюстно-лицевой хирургии, Technische Universität München, Ismaninger Strasse 22, 81675 München, Германия
A. von Bomhard
2 Отделение челюстно-лицевой хирургии, Technischen Münchenünününütung, 22, Ismaninger Münchenününününününününchen, Ismaninger 16, Ismaninger Strasse, 22 Германия
T.
 Stark
Stark1 Отделение оториноларингологии, хирургии головы и шеи, Klinikum Rechts der Isar, Technische Universität München, Ismaninger Strasse 22, 81675 München, Германия
1 Отделение хирургии шеи и шеи , Klinikum Rechts der Isar, Technische Universität München, Ismaninger Strasse 22, 81675 München, Германия
2 Отделение челюстно-лицевой хирургии, Technische Universität München, Ismaninger Strasse 22, 81675
Academic, Германия,0005, ГерманияПоступила в редакцию 29 ноября 2013 г .; Пересмотрено 9 февраля 2014 г .; Принята в печать 10 февраля 2014 г.
Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Аннотация
Введение . Реконструкция ушной раковины — сложная задача в пластической хирургии лица. С развитием хирургических методов и биотехнологий стали доступны различные варианты.Целью данной статьи является обзор знаний о различных техниках тотальной реконструкции ушной раковины на основе литературы и нашего опыта. Методы . Было идентифицировано около 179 статей, опубликованных с 1980 по 2013 год, и 59 статей были включены. Мы сосредоточили внимание на текущем состоянии тотальной реконструкции ушной раковины, основываясь на нашем личном опыте и на статьях, представляющих особый интерес, опубликованных в период обзора. Мы также включили перспективный взгляд на тканевую инженерию хряща. Результаты . Большинство хирургов до сих пор практикуют полную реконструкцию ушной раковины, используя методы, разработанные Брентом, Нагатой и Фирмином, с использованием аутологичного реберного хряща. В последние годы хорошо зарекомендовали себя аллопластические каркасы для реконструкции. Выбор методов реконструкции в основном зависит от предпочтений и опыта хирурга. Протезная реконструкция по-прежнему предназначена для особых случаев, хотя материал постоянно совершенствуется.
С развитием хирургических методов и биотехнологий стали доступны различные варианты.Целью данной статьи является обзор знаний о различных техниках тотальной реконструкции ушной раковины на основе литературы и нашего опыта. Методы . Было идентифицировано около 179 статей, опубликованных с 1980 по 2013 год, и 59 статей были включены. Мы сосредоточили внимание на текущем состоянии тотальной реконструкции ушной раковины, основываясь на нашем личном опыте и на статьях, представляющих особый интерес, опубликованных в период обзора. Мы также включили перспективный взгляд на тканевую инженерию хряща. Результаты . Большинство хирургов до сих пор практикуют полную реконструкцию ушной раковины, используя методы, разработанные Брентом, Нагатой и Фирмином, с использованием аутологичного реберного хряща. В последние годы хорошо зарекомендовали себя аллопластические каркасы для реконструкции. Выбор методов реконструкции в основном зависит от предпочтений и опыта хирурга. Протезная реконструкция по-прежнему предназначена для особых случаев, хотя материал постоянно совершенствуется. Тканевая инженерия имеет растущий потенциал для клинического применения. Заключение . Реконструкция ушной раковины по-прежнему привлекает внимание пластических / челюстно-лицевых хирургов и отоларингологов. Несмотря на то, что клиническая применимость отстает от первоначальных ожиданий, разработка тканевых конструкций продолжает свое потенциальное развитие.
Тканевая инженерия имеет растущий потенциал для клинического применения. Заключение . Реконструкция ушной раковины по-прежнему привлекает внимание пластических / челюстно-лицевых хирургов и отоларингологов. Несмотря на то, что клиническая применимость отстает от первоначальных ожиданий, разработка тканевых конструкций продолжает свое потенциальное развитие.
1. Введение
Реконструкция ушной раковины по-прежнему является огромной проблемой для лицевых пластических хирургов и требует широкого взгляда на различные методы, чтобы найти лучшее лечение для каждого пациента.Дефекты и деформации ушной раковины включают не только приобретенные дефекты, связанные с травмами, ожогами, опухолями, дефектами пирсинга, шрамами и воспалениями / аллергией, но также врожденные пороки развития ушной раковины, начиная от пороков развития I степени (например, выступающие уши) до пороков развития III степени, включая тяжелую микротию. изменения. Часто они сопровождаются атрезией слуха, пороками развития среднего уха, а иногда даже лицевыми аномалиями с поражением лицевого нерва на ипсилатеральной стороне.
В зависимости от дефекта и окружающих обстоятельств восстановление полностью удовлетворительной и полной ушной раковины всегда является основной задачей пациента и пластического хирурга. С развитием хирургической техники и биотехнологии спектр возможностей использования трансплантатов реберного хряща, аллопластических материалов или протезов становится шире. Более того, достижения в тканевой инженерии культивированного хряща будут представлять клинический интерес в будущем. Первая известная описанная операция микротии Grade III была проведена в 1870 г. фон Сизмановским [1].Однако с тех пор методы сильно изменились. Основные факторы, влияющие на варианты лечения, включают патологию каждого пациента, состояние местных тканей и кожи, а также предпочтения лицевого пластического хирурга и пациента.
Поскольку основная цель пластического хирурга всегда должна быть на благо пациента с соответствующим улучшением качества жизни, эта статья посвящена текущим знаниям о различных вариантах лечения врожденных и приобретенных (суб) полных дефектов. ушной раковины на основе новейшей литературы.Он также включает многообещающую область тканевой инженерии культивируемого хряща, о которой сообщалось в недавних публикациях. Информация, представленная в этой статье, должна помочь хирургу в процессе принятия решения относительно наилучшего использования доступных материалов для полной реконструкции.
ушной раковины на основе новейшей литературы.Он также включает многообещающую область тканевой инженерии культивируемого хряща, о которой сообщалось в недавних публикациях. Информация, представленная в этой статье, должна помочь хирургу в процессе принятия решения относительно наилучшего использования доступных материалов для полной реконструкции.
2. Материал и методы
База данных MEDLINE использовалась для поиска всех исследований на английском и других языках, включающих полную реконструкцию ушной раковины и результаты различных техник.Мы использовали поисковый термин (микротия, ампутация ушной раковины или травма наружного уха) и реконструкция (аутологичная или аллопластическая, или Medpor, или протезная). Было отобрано сто семьдесят девять статей и оценены тезисы. Сосредоточившись на полной реконструкции с клинической применимостью, мы исключили исследования на животных, все обзорные статьи и исследования, опубликованные до 1980 года. Исследования также исключались, если они не могли быть переведены, включали частичные реконструкции (не основное внимание в этой статье) или были связаны с другими или множественными реконструкциями лица, поскольку на процесс принятия решения могут влиять другие дефекты.
Наконец, 59 статей, посвященных реконструкции с помощью реберного хряща ( n = 32), пористого полиэтилена ( n = 8), протеза ( n = 11) или сравнения различных материалов ( n = 8) были найдены (). Из всех статей мы включили статьи, представляющие особый интерес, в основном основанные на нашем собственном опыте. Другими источниками информации были в основном материалы конференций и личные сообщения. Нашим основным интересом было текущее состояние тотальной реконструкции ушной раковины с помощью различных альтернатив, таких как аутологичный, аллопластический или протезный материал.Их плюсы и минусы были зарегистрированы, в дополнение к текущим экспериментальным знаниям о тканевой инженерии хряща, с основной целью приблизиться к клинической применимости (эта тема не была включена в основное исследование PubMed, поскольку клиническая применимость, как правило, все еще отсутствует) . Для полноты картины мы также включаем краткий обзор частичных дефектов.
Поиск по базе данных MEDLINE дал 59 публикаций, посвященных тотальной реконструкции ушной раковины.
3.Результат
3.1. Анатомия
3.1.1. Нормальная ушная раковина
Размер нормальной ушной раковины зависит от различных факторов, таких как возраст, пол и рост (). У взрослых длина ( L ) составляет около 58–66 мм (женщины 58–63 мм, мужчины 62–66 мм), а ширина ( W ) примерно 32–34 мм. К 8 годам ушная раковина достигает своего полного размера, что является важным фактором при реконструкции уха у детей.
Анатомия и ориентиры ушной раковины.
4. Деформации ушной раковины
В исследовании Guo et al. [2] полная реконструкция ушной раковины протезом у 46 пациентов была проведена из-за врожденных деформаций (65,2%), резекции опухоли (26,1%), травмы (4,3%), ожогов (2,2%) и инфекции (2,2%). %).
4.1. Приобретенные деформации
4.1.1. Опухоли
Злокачественные поражения наружного уха составляют примерно 6% всех раковых заболеваний кожи головы и шеи и могут происходить из всех видов тканей в этой области, таких как кожа, сосуды, нервы, кости и хрящи. Наиболее распространенными злокачественными новообразованиями являются карциномы спинальных клеток и базальноклеточные карциномы. В этих случаях обычно страдают пожилые мужчины с историей чрезмерного пребывания на солнце. Редко наблюдаемые виды рака включают злокачественные меланомы, кератоакантомы, аденокарциномы, аденоидзистические карциномы, карциномы из клеток Меркеля, ангиосаркомы, болезнь Боуэна или генерализованные неопластические изменения, такие как саркома Капоши. Однако доброкачественные опухоли, такие как рецидивирующий полихондрит, тофус подагры, нейрофиброма и келоиды, также могут потребовать хирургического лечения.Кроме того, воздействие экзогенных стимуляторов и подавление иммунитета может вызвать злокачественные новообразования. В зависимости от структуры и размера опухоли дефект может сильно различаться и требует применения различных стратегий реконструкции.
Наиболее распространенными злокачественными новообразованиями являются карциномы спинальных клеток и базальноклеточные карциномы. В этих случаях обычно страдают пожилые мужчины с историей чрезмерного пребывания на солнце. Редко наблюдаемые виды рака включают злокачественные меланомы, кератоакантомы, аденокарциномы, аденоидзистические карциномы, карциномы из клеток Меркеля, ангиосаркомы, болезнь Боуэна или генерализованные неопластические изменения, такие как саркома Капоши. Однако доброкачественные опухоли, такие как рецидивирующий полихондрит, тофус подагры, нейрофиброма и келоиды, также могут потребовать хирургического лечения.Кроме того, воздействие экзогенных стимуляторов и подавление иммунитета может вызвать злокачественные новообразования. В зависимости от структуры и размера опухоли дефект может сильно различаться и требует применения различных стратегий реконструкции.
4.1.2. Травмы и (не) воспалительные процессы: [3]
Открытое положение ушной раковины делает ее уязвимой для многих видов травм.
Острая травма ушной раковины включает химические ожоги. Кислотные ожоги приводят к поверхностным травмам, а щелочные ожоги — к более проникающим.Термические травмы включают ожоги от горячих жидкостей и воздействие огня, взрыва газа, пара и ожоги в результате несчастных случаев. В зависимости от степени ожога степень поражения ушной раковины может варьироваться от просто болезненной эритемы до полной потери структуры ушной раковины. Острая травма также включает отосерому и отогематому.
Травмы ушной раковины включают тупые травмы в результате ссадины, разрыва и отрыва ушной раковины с децессией кожи и надхрящницы. Однако укусы и колющие травмы, а также воспаление / аллергия могут повлиять на ушную раковину в различной степени.Луо и др. [4] описали распределение травм у 60 пациентов: 35/60 ожогов, 10/60 дорожно-транспортных происшествий, 8/60 порезов во время драк и 7/60 человеческих укусов.
4.1.3. Классификация приобретенных дефектов
В литературе появились различные классификации приобретенных дефектов ушной раковины [3, 4]. Поскольку группа частичных дефектов очень неоднородна, такие классификации концентрируются либо на локализации дефекта, либо на пораженной ткани.Луи и др. [5], например, обычно разделяют случаи на кожные дефекты, затрагивающие только кожу ушной раковины, сложные дефекты с дефектами как кожи, так и хряща, и полные или почти полные дефекты, требующие полной реконструкции ушной раковины (фокус данной статьи ). Композитные дефекты можно разделить на маргинальные и немаргинальные дефекты; Почти тотальные и полные дефекты предсердия можно подразделить на те, у которых есть здоровая / неповрежденная окружающая ткань, и поврежденная окружающая ткань ().
Классификация приобретенных дефектов уха Луи [5].
5. Врожденные деформации
Эпидемиологически Weerda [3] описывает одну тяжелую деформацию у 10 000–20 000 новорожденных. Хотя никаких конкретных хромосомных аномалий для микротии не приводилось, предполагалось многофакторное наследование, особенно для таких синдромов, как синдром Франческетти или синдром Гольденхара. Однако предполагается, что экзогенные факторы также являются причиной пороков развития примерно в 10% случаев (талидомид, эмбриопатия краснухи, другие вирусные инфекции, алкоголизм).
5.1. Эмбриология и классификация
Пороки развития ушной раковины основаны на врожденных пороках развития первой и второй жаберных дуг, окружающих первую жаберную щель. Поскольку возможно большое разнообразие пороков развития, существует большое количество систем классификации врожденных пороков, которые зависят от предпочтений автора.
В прошлом различные классификации, встречающиеся в литературе, в основном основывались на степени деформации и определенных анатомических ориентирах, например, Marx (1926) [6] и Tanzer (1977) [7].Поскольку международной системы классификации не существует, сравнение исследований, основанных на различных используемых терминологиях и номенклатурах, иногда бывает затруднено.
Классификация Weerda [3] объединяет предложения различных авторов и дает обзор, основанный на возрастающих уровнях деформации и необходимом хирургическом вмешательстве (). При пороках развития I степени присутствует большинство структур нормальной ушной раковины. Примерами являются выступающие уши, макротия, криптотия, расщелина уха, умеренные деформации чашечного уха, деформации мочки уха и другие незначительные деформации ушной раковины [3].Дисплазия II степени включает тяжелые деформации чашечного уха III типа и мини-уха (микротия раковинного уха) [8]. Некоторые из структур уха сохранились, но для полной реконструкции необходима дополнительная кожа и / или хрящ. При дисплазии III степени нормальные структуры отсутствуют. В эту группу входят одно- или двусторонние зачатки ушной раковины и анотии [9–11]. В частности, дисплазия III степени часто связана с изменениями в наружном слуховом проходе, включая атрезию слуха, пороки развития среднего уха, а иногда даже дисплазию каменистой кости с лицевыми аномалиями и поражением лицевого нерва на ипсилатеральной стороне.В таких случаях для полной реконструкции требуется дополнительная кожа и хрящи или другие материалы.
Таблица 1
Классификация пороков развития ушной раковины по Верде, основанная на возрастающей тяжести порока развития (укороченная) [3].
| Степень дисплазии | Определение | Подгруппа |
|---|---|---|
| I: Пороки развития низкой степени | Общие: большая часть структуры нормальной ушной раковины присутствует иногда Хрящи: только кожные покровы и хрящи требуется для реконструкции | (i) Выступающая ушная раковина (ii) Макротия (iii) Криптотия (карманное ухо) (iv) Расщелина (поперечная щель) (v) Скафоидное ухо (vi) Ухо Шталя (vii) Ухо сатира (viii) Небольшие деформации (ix) Деформации дольки (x) Деформации чашеобразного уха по Танзеру типов I, IIA и IIB |
| II: микротия II степени; пороки развития средней степени тяжести | Общие: ушная раковина все еще демонстрирует некоторую структуру нормальной ушной раковины Хирургическое: дополнительная кожа и хрящ, необходимые для частичной реконструкции | (i) Чашечно-ушная деформация типа III по Танцерсу (ii) Miniear (Гипоплазия верхней, середина нижнего предсердия) |
| III: микротия III степени с анотией; тяжелые пороки развития | Общие: структур нормальной ушной раковины больше нет Хирургическое: дополнительная кожа и хрящ, необходимые для полной реконструкции | (i) Односторонняя микротия III степени (микротия типа дольки Нагаты) (ii) Двусторонняя микротия III степени ( iii) Анотия (iv) Обычно обнаруживается врожденная атрезия слуха |
6.Варианты оценки и лечения
Чтобы определить наилучшее хирургическое лечение, клиническая оценка должна включать различные переменные, такие как факторы, связанные с пациентом (например, состояние здоровья, лекарства и курение), их восстановительные цели, патологию остаточного ухо (например, причина дефекта, размер и расположение дефекта и тип пораженной ткани), а также состояние окружающей твердой и мягкой ткани (например, шрамы, предыдущие инфекции и предыдущие попытки реконструкции).Диапазон вариантов реконструкции ушной раковины широк и включает в себя небольшие вмешательства, такие как первичное закрытие раны, местная реконструкция через закрытие лоскута, трансплантация композитного трансплантата из контралатерального уха, а также трансплантаты расщепленной кожи или трансплантаты полной толщины, вплоть до больших. вмешательства, такие как полная реконструкция, включая аутологичный хрящ, аллопластический материал или протез. Поскольку пациенты с врожденной атрезией слуха и микротией также страдают нарушением слуха, оптимальная функция слуха так же важна, как и эстетическая реконструкция, и поэтому должна приниматься во внимание при предоперационном планировании [12].
6.1. Общее количество приобретенных дефектов
Как упоминалось выше, причины приобретенных дефектов разнообразны. В случае опухолей первой целью всегда должна быть полная резекция с гистологическим контролем края; это иногда затрудняет поиск наилучшей техники реконструкции впоследствии. Поскольку самые высокие показатели метастазов при кожно-клеточной карциноме позвоночника — это губа (14%) и ухо (10%), лимфодренаж, особенно преаурикулярный, инфрааурикулярный и постурикулярный, всегда необходимо проверять вручную и с помощью ультразвука.В случаях, когда дефект больше, мы предпочитаем резекцию опухоли и временное закрытие дефекта аллогенным трансплантатом. После получения окончательного гистологического результата со свободными полями проводим реконструкцию. Поскольку частичные дефекты не являются основным предметом интереса данной статьи, исчерпывающий обзор всех доступных методов восстановления частичных дефектов выходит за рамки этого текста. В 2004 году Редди и Зайд [13], например, описали различные методы локальной реконструкции в зависимости от размера и локализации.Мы отсылаем заинтересованных читателей к этому обзору [13].
В случае приобретенных полных дефектов добиться идеальной анатомии ушной раковины может быть сложно. Если доступно достаточное количество окружающих мягких тканей, предпочтительным методом лечения должна быть реконструкция. Следовательно, воспроизведение основных ориентиров и правильное положение, размер и ориентация ушной раковины важны.
6.2. Ведение врожденных деформаций (тяжелая степень II и степень III)
6.2.1.Порок развития II степени
При хирургических операциях умеренных деформаций ушной раковины (микротия II степени), также называемых деформациями чашеобразного уха, тип III [10] или микротия / мини-уши типа раковины [14], необходимы дополнительные кожные и реберные хрящи или аллопластический материал для реконструкция. В ухе все еще видны некоторые структуры нормальной ушной раковины, но при тяжелой деформации чашеобразного уха ушная раковина слишком мала и демонстрирует явный бугор в верхней части. Также часто встречается ассоциированная дистопия (нижнее положение и переднее смещение).Слуховой проход и среднее ухо в основном в норме [15].
Создание шаблона из противоположного уха, забор реберного хряща и изготовление хрящевого каркаса, аналогичного по форме и размеру на противоположной стороне, описаны ниже в разделе, посвященном микротиям степени III. В некоторых случаях пороков развития II степени неоаурикулу можно пришить к оставшемуся естественному хрящу ушной раковины, особенно в нижней части ушной раковины, если это применимо.
6.2.2. Порок развития III степени
Реконструкция микротии III степени является сложной задачей для лицевых пластических хирургов и требует полной реконструкции ушной раковины. Решение о том, проводить реконструкцию с использованием аутологичного реберного хряща или пористых полиэтиленовых каркасов, в основном зависит от хирурга и его опыта. Что касается этих двух материалов, только несколько особых ситуаций подходят для использования только аутологичного материала (предыдущие операции с неудачным височно-теменным фасциальным лоскутом) или Medpor (деформации грудной клетки).Использование ортопедических техник также следует использовать в особых случаях.
7. Аутологический материал
Реконструкция ушной раковины с использованием реберного хряща была описана еще в 1968 году Конверсом [16]. В 1971 году Танзер [17] описал шестиступенчатую процедуру, модифицированную Брентом [18, 19] и Нагатой [14] до двухэтапной техники, которая является основой большинства современных методов. Эти процедуры были, например, оптимизированы Weerda [20], Firmin [21], Siegert [22], Staudenmaier [23] и другими.
Основным принципом современных технологий является забор реберного хряща в качестве первого шага. После создания каркаса ушной раковины во время той же процедуры он помещается под кожу на мастоиде. С интервалом от 3 до 6 месяцев трехмерная (3D) проекция сосцевидного отростка выполняется путем поднятия неоаурикулы над сосцевидным отростком и создания задней борозды предсердия. Часто требуется третий этап для уточнения контуров ушной раковины.
Показания к реконструкции с использованием аутологичного реберного хряща зависят от характера и степени деформации ушной раковины, а также от пациента. В возрасте от 8 до 9 лет это также хороший вариант для детей. В этом возрасте можно собрать достаточно хряща, и ребенок достаточно послушен, чтобы завершить процедуру [23]. Как упоминалось ранее, для полной реконструкции ушной раковины необходимы как минимум два операционных шага. В нашей клинике мы применяем методику, модифицированную после Нагаты [9–11, 23].
Перед первой операцией создается силиконовый шаблон, используя нормальную ушную раковину на противоположной стороне, чтобы очертить ключевые структуры. Чтобы ушная раковина выглядела естественно, ключевые структуры шаблона всегда должны включать в себя полную спираль, антиспираль (переднюю и заднюю ножки) с треугольной ямкой, козелок и антитрагус (23). Если поражены оба уха, можно нарисовать стандартное ухо на силиконовом листе. В зависимости от типа рудиментарной ушной раковины или размера приобретенного дефекта необходимы различные методы и различное количество хряща.
Кремниевый шаблон и реконструированная ушная раковина, полученные с использованием 6, 7 и 8 ребра, ключевые структуры отмечены красными кружками.
7.1. Процедура
На первом этапе берут хрящ из синхондроза шестого и седьмого ребер и реберный хрящ свободно плавающего восьмого ребра (). Основной каркас состоит из шестого и седьмого ребер, придающих форму треугольной ямке и ладони. Чтобы завершить трехмерный вид, мы используем плавающее восьмое ребро для формирования передней и задней ножек антиспирали, спирального обода, козелка и антитрагуса.Для наложения швов на основной каркас мы используем прозрачный нейлоновый шов 4/0, чтобы предотвратить просвечивание швов через кожу (в демонстрационных целях показаны бывшие синие нейлоновые швы).
Хрящ из синхондроза шестого и седьмого ребер, а также реберный хрящ свободно плавающего восьмого ребра.
Мальформация III степени справа у мальчика 7 лет, хрящевой каркас и реконструированная ушная раковина через 6 месяцев.
Одновременно необходимо подготовить подкожный карман путем мобилизации и истончения кожи. По словам Нагаты [9–11], могут потребоваться различные линии разреза. Мы предпочитаем W-образную линию разреза, поскольку ее обычно достаточно для позиционирования каркаса.
Начальная форма рудиментарной ушной раковины у каждого пациента может сильно различаться. Кроме того, важную роль могут играть положение и анатомические вариации асимметрии нижней челюсти и сосцевидного отростка.В некоторых случаях рудиментарная ткань служит для формирования неолобулы или частей ушной раковины, если может быть достигнуто гладкое соединение между ушным хрящом и реберным хрящом. Большинство неформирующих тканей (хрящи или подкожные мягкие ткани) необходимо удалить, чтобы создать гладкую поверхность и создать дополнительную кожу, покрывающую неоаурикулу. После размещения нового хрящевого каркаса под кожей на мастоиде, в соответствии с положением на противоположной стороне и окружающими условиями, подкожно помещают вакуумный дренаж для прикрепления кожи к хрящевому каркасу во время сшивания кожи.Мы используем гладкую рельефную повязку вместо матрасных швов, чтобы дополнительно прикрепить кожу к хрящу и предотвратить повреждение кожи от некроза под давлением (). Этот вакуумный слив необходимо удалить через пять дней. Мы размещаем болевой катетер в межреберье (на донорской стороне), чтобы минимизировать послеоперационный дискомфорт и свести к минимуму использование пероральных или внутривенных обезболивающих, особенно у детей.
Неоаурикула в конце первого этапа с вакуумным дренажом, подкожно помещается для прикрепления кожи к хрящевому каркасу.
После периода заживления 6–8 недель проводится второй этап. Этот второй шаг имеет решающее значение для 3D-проекции ушной раковины. Создается ретроаурикулярная борозда, чтобы приподнять новообразованное ухо со стороны головы. Теперь можно получить кусок хряща, который подкожно располагался в грудном ложе во время первой операции. После надреза кожи за спиралью нижняя часть неоаурикулы мобилизуется. Под ним располагается клин хряща, который фиксируется к каркасу швами.Затем хрящ покрывается случайно васкуляризованным лоскутом дорсальной фасции (Нагата использует височно-теменный лицевой лоскут). Чтобы свести к минимуму дефект на мастоиде, мы мобилизуем окружающую кожу (особенно в направлении шеи на грудино-ключично-сосцевидной мышце) и фиксируем кожу с помощью V / Y пластики в ретроаурикулярной складке. Остаточная открытая рана в форме полумесяца закрывается с помощью кожного трансплантата на всю толщину (чтобы минимизировать риск усадки), взятого из грудной клетки (). Мы также используем рельефную повязку на 7-10 дней, чтобы оптимизировать заживление ран.
Второй этап трехмерной проекции ушной раковины, создание ретроаурикулярной борозды с использованием хрящевого клина. Для закрытия раны используется V / Y пластика в ретроаурикулярной складке и дополнительный кожный трансплантат на всю толщину. ( ⟶ ).
В некоторых случаях может потребоваться дополнительная операция для уточнения контура ушной раковины. Это может быть выполнено либо под местной анестезией, либо под общим наркозом ().
7.2. Особые обстоятельства
Особое внимание следует уделять пациентам с тяжелыми периаурикулярными состояниями мягких тканей.В случае предыдущих попыток реконструкции, травм, резекции опухоли и особенно ожогов необходимо проверить локальные периаурикулярные мягкие ткани на подвижность кожи, образование рубцов и перфузию. Часто варианты мягких тканей были исчерпаны во время предыдущих операций. В этих ситуациях покрытия неоаурикулы местной тканью может быть недостаточно.
Височно-теменный фасциальный лоскут со свободным кожным трансплантатом с разделенной толщиной может быть полезен в качестве покрытия в случаях отсутствия местной ткани или васкуляризации.Этот метод требует всего одной операции, так как одновременно формируется ретроаурикулярная борозда. Однако недостатком такой техники является немного другая текстура и цвет кожи. В качестве альтернативы некоторые авторы описывают использование расширителей тканей для покрытия мягких тканей. Они используют один или два расширителя ткани почек, помещают их на сосцевидный отросток под подкожно-жировой клетчаткой и поочередно надувают. После 3-6 месяцев расширения конструкция помещается во вторую операцию [24].В случаях серьезного повреждения кожи и мягких тканей и тяжелого ожогового повреждения с разрушением поверхностной височной артерии протезная реконструкция может быть единственным разумным решением. При рассмотрении преимуществ и недостатков использования аутологичного реберного хряща основной проблемой является забор реберного хряща и сопутствующая патология на донорском участке [25]. В предыдущем исследовании мы рассмотрели 321 пациента, нуждающегося в реберном хряще в случаях реконструкции ушной раковины или носа.Оставив внутреннюю надхрящницу на месте, можно свести к минимуму риск утечки плевры. Катетер для межреберной боли может минимизировать послеоперационный дискомфорт. В 48 случаях мы наблюдали неровности контура, особенно у худых пациентов, без функционального дефицита. Siegert и Magritz [26] описали резорбируемую викриловую сетку, заполненную остальным хрящом; его поместили обратно в донорский участок, чтобы выровнять дефект контура.
Основным преимуществом этой техники является использование аутологичного материала для реконструкции.Это сводит к минимуму риск инфицирования или выдавливания имплантата. Для многих пациентов важно знать, как имплантировать аутологичный материал.
Кроме того, в нормальных условиях височно-теменный фасциальный лоскут не требуется.
8. Аллопластический материал
Поскольку мы не применяем эту технику в нашей клинике, нижеследующее основано на недавней литературе. В качестве альтернативы некоторые хирурги предпочитают использовать комбинацию аллопластических материалов, таких как пористые полиэтиленовые каркасы и височно-теменный фасциальный лоскут [27–31].Первоначально использовались силиконовые каркасы [32]. Из-за высокой частоты инфекций, кожных перфораций и вывихов, помимо реакций на инородное тело и фиброза капсулы, его приемлемость снизилась [33]. Таким образом, пористые полиэтиленовые каркасы (Medpor, Stryker, Kalamazoo, MI, USA) стали наиболее подходящими аллопластическими каркасами для большинства хирургов. Он описан как биосовместимый термопласт. Его открытая пористая структура (размер пор от 40 до 200, 90 · 105 мкм, 90 · 106 мкм) позволяет ткани врастать в нее.
8.1. Методика эксплуатации
Полиэтиленовый каркас состоит из двух частей (спиральный обод и основание ушка) с преимуществом большего диапазона размеров и расположения спирального обода на части основания. Обе части соединяются путем нагревания пластика или сшивания их вместе. Тонкую коррекцию можно произвести с помощью скальпеля. Таким образом, при необходимости можно произвести адаптацию к рудиментарному уху. Перед имплантацией конструкцию замачивают в растворе антибиотика, чтобы предотвратить раннее инфицирование [34].Reinisch и Lewin [35] описали метод предотвращения обнажения каркаса с помощью хорошо васкуляризованного двухслойного лоскута (подгалеальная фасция и височно-теменная фасция). Большинство хирургов, практикующих эту технику с аллопластическим материалом, используют височно-теменный лицевой лоскут для закрытия имплантата, который фиксируется в необходимом положении с помощью швов. Для прикрытия височно-теменного фасциального лоскута, местной кожи и полнослойного кожного трансплантата из контралатеральной ретроаурикулярной области используется брюшная стенка или область паха.Как и в случае с аутологичными конструкциями, под лоскутом располагаются вакуумные дренажи для отсасывания секрета из раны и обеспечения тесного контакта между кожей, лоскутом фасции и скелетом. Этот метод требует всего одной операции. Осложнения, описанные в литературе для аллопластических материалов, включают риск инфицирования и экструзии [29].
Кроме того, особые риски использования височно-теменного фасциального лоскута связаны с сохранением поверхностной височной артерии и вены для обеспечения осевого кровоснабжения с целью получения надежного лоскута; алопеция — еще один риск [36].
9. Протезирование
Третьей возможностью восстановления эстетики лица является метод протезной реконструкции [5, 37–39]. Протезное восстановление является хорошей альтернативой аутогенной реконструкции, особенно в случаях травматической потери всей ушной раковины с большими дефектами и глубокими повреждениями мягких тканей, а также после резекции злокачественной опухоли у пожилых пациентов. Даже в случае неудачной аутогенной реконструкции остеоинтегрированная аллопластическая реконструкция уха может быть выполнена в качестве терапии второй линии.Поскольку эстетические результаты становятся более благоприятными, протезная реставрация также является хорошим вариантом для терапии первой линии, например, для пациентов, которым вы отказываетесь или не можете пройти обширный многоэтапный подход, необходимый для операции по тотальной реконструкции ушной раковины.
Показаниями к остеоинтегрированной аллопластической реконструкции уха являются [37]
резекция крупного рака;
лучевая терапия;
сильно поврежденная ткань;
предпочтения пациентов;
неудачная аутогенная реконструкция;
потенциальная черепно-лицевая аномалия;
низкий операционный риск.
Аллопластическое ухо изготовлено из силикона и может быть сформировано зеркально перевернутым по отношению к контралатеральному неповрежденному уху. В случае двусторонней атрезии уха протез может быть изготовлен с учетом родительского уха и пропорции черепа пациента. Подбор цвета внутреннего силикона осуществляется на основе уникального тона кожи пациента (рисунки и). Доступны различные способы крепления протеза к коже. Протез удерживается оригинальным дефектом, зацепленным за костный край, протез прикрепляется к дефекту с помощью клея или протез прикрепляется к хирургически имплантированным и остеоинтегрированным титановым винтам.Первый вариант — хороший выбор при дефектах носа, в то время как в случаях атрезии или полной потери ушной раковины обычно плоская поверхность не имеет выступающих краев. Оба последних метода обычно используются для протезирования уха. При использовании адгезивов хирургическое вмешательство не требуется. Хотя использование имплантатов имеет несколько недостатков, в том числе возможность инфицирования и воспаления вокруг винтов, преимущества перевешивают недостатки. С использованием имплантатов пациенту намного проще правильно поставить протез даже без помощи зеркала.За счет меньшей механической нагрузки протеза увеличивается срок службы устройства. Самым большим преимуществом является улучшенная фиксация протеза на голове, особенно в случае сил сдвига. В частности, когда пациент занимается спортом, клеи обычно снимаются с потоотделением.
Силиконовый протез ушной раковины со встроенными магнитами. Обратите внимание на очень тонкий передний край, маскирующий границу с кожей пациента.
Реконструкция ушной раковины с помощью протеза и остеоинтегрированных имплантатов после полной резекции ушной раковины по поводу рака кожи.Протез удерживается на месте с помощью встроенных магнитов как на винтах имплантата, так и на силиконовой ушной раковине.
Хирургическая процедура обычно проводится в два этапа. Первый шаг включает иссечение любого остатка ушной раковины или иссечение неблагоприятного результата неудачной предыдущей хирургической реконструкции ушной раковины и установку винтов имплантата (например, имплантата Понто, Oticon Medical AB, Askim, Швеция) в кость. Затем имплантаты загружаются специальными винтами-заглушками и рана закрывается.После заживления раны через несколько недель следует второй этап. На втором этапе имплантаты открываются с помощью пробойника для кожи и проникающие в кожу магнитные вставки (например, Titanmagnetics, steco-system-technic, Гамбург, Германия) присоединяются к имплантатам. В то время как второй шаг можно легко выполнить в амбулаторных условиях под местной анестезией, первый шаг следует выполнять под общим наркозом.
Если необходимо иссечение остатков ушной раковины, этот разрез в основном можно использовать для установки имплантатов ().В противном случае необходимо сделать дополнительный разрез для создания кожного лоскута. Для определения правильного положения имплантата используется индивидуальный предоперационный хирургический шаблон (). В случае врожденной микротии с атрезией слухового прохода реабилитация слуха может быть достигнута путем установки дополнительного имплантата для слухового аппарата с костной проводимостью (). Во всех случаях предоперационная компьютерная томография височной кости и анатомии среднего уха является благоприятной. показан тот же пациент с протезом на имплантате и без него.Кроме того, пациент носит слуховой аппарат с костной фиксацией (Ponto pro, Oticon Medical AB, Askim, Швеция).
(a) Стерильный силиконовый хирургический шаблон. (b) Неудачная предыдущая аутогенная реконструкция с отметками как для протезов, так и для имплантатов слуховых аппаратов с костной фиксацией. (c) Удаление остатков ушной раковины. Разрез сразу используется для установки протезных имплантатов. (d) После подготовки надкостничного лоскута просверливаются отверстия для имплантата. (e) Имплантаты загружаются винтами-заглушками до второго этапа операции.(f) Закрытая рана с установленным абатментом для слухового аппарата с костной фиксацией.
Тот же пациент, что и с протезом на имплантате или без него. Обратите внимание на дополнительный слуховой аппарат с костной фиксацией (Ponto Pro, Oticon Medical AB, Askim, Швеция) с правой стороны.
10. Функциональная реконструкция слуха
Как упоминалось выше, оптимальная функция слуха важна для качества жизни пациента [12]. Поскольку пациенты с врожденной атрезией слуха и микротией особенно страдают от нарушения слуха, оптимальная функция слуха так же важна, как и эстетическая реконструкция, и ее необходимо учитывать при предоперационном планировании.Реконструкция слухового прохода при тяжелых пороках развития II и III степени с атрезией слуха по эстетическим, а также по функциональным причинам остается сложной задачей [40]. В течение последних нескольких лет были описаны другие подходы, такие как слуховые аппараты с костной фиксацией или активные имплантаты среднего уха (MEI) для функционального восстановления. В обзоре, основанном на 107 публикациях, Nadaraja et al. [41] недавно сообщили, что слух после использования костно-проводящих устройств превосходит результаты атрезиопластики.В исследовании Kiefer и Staudenmaier [42] пятнадцати пациентам была имплантирована активная MEI (динамический звуковой мост). Вибрирующий элемент, датчик плавающей массы (FMT), был соединен либо с круглым окном, стремечками, либо с овальным окном или наковальней в зависимости от ситуации в среднем ухе. У 14 из 15 пациентов удалось достичь удовлетворительного функционального результата (аудиометрия чистого тона <30 дБ), что делает звуковой мост ценным вариантом для функциональной реконструкции. В сочетании с реконструкцией ушной раковины с помощью аутогенного хряща мы рекомендуем такую имплантацию на втором этапе операции ().
Молодой пациент с микротией III степени и атрезией уха после реконструкции ушной раковины с помощью реберного хряща и имплантации динамического слухового аппарата с звуковым мостом.
11. Тканевая инженерия хряща
Тканевая инженерия — многообещающая область для восстановления или замещения всех видов поврежденных тканей. Грин и Диккенс [43] описали первую культуру хряща в 1972 году. С тех пор различные группы со всего мира сосредоточились на тканевой инженерии хряща.Тем не менее, клинический результат все еще не оправдывает многообещающих ожиданий относительно жизнеспособности клеток, гомогенного посева клеток в 3D-каркасы, стабильности формы и возможной васкуляризации культивируемых конструкций для снабжения питательными веществами и кислородом [44].
Для культивирования ушного хряща можно использовать плюрипотентные стволовые клетки или изолированные первичные хондроциты. Затем популяция клеток должна быть увеличена in vitro и засеяна на подходящие каркасы для создания функциональной ушной раковины. Этот подход может избежать заболеваемости донорского участка и заболеваемости донорского участка, связанной со сбором реберного хряща и вырезанием ушной раковины вручную [45].Работа со стволовыми клетками возможна при использовании широкого диапазона тканей в качестве источника клеток, хотя дифференцировка клеток часто бывает неполной. Остатки ушной раковины или контралатеральной ушной раковины в идеале могут быть использованы в качестве донорской ткани для аутологичных хондроцитов. Также возможна небольшая биопсия носовой перегородки. Однако следует иметь в виду, что носовой хрящ менее эластичен и имеет тенденцию к кальцификации по сравнению с эластичным хрящом. Использование очень маленьких кусочков хряща требует множества клеточных пассажей для достижения достаточного количества клеток.Это приводит к дедифференцировке хондроцитов. Трехмерное формирование культивированного хряща возможно с использованием синтетических (например, поли-е-капролактон, полигликолевая кислота, поли-L-лактидная кислота или сополимер молочной и гликолевой кислот) или биологических (например, коллагенового, альгинатного или фибринового геля). , или хитозан) каркасы. Также возможно комбинировать каркас естественного происхождения с синтетическим материалом (например, гибкой проволокой) для предотвращения усадки конструкции [46].
Тканевая ушная раковина может быть сконструирована по индивидуальному заказу, чтобы соответствовать противоположной ушной раковине и внешнему виду пациента, используя быстрое прототипирование [47].показаны возможные методы тканевой инженерии ушной раковины.
Инженерия тканей ушной раковины. Плюрипотентные стволовые клетки дифференцируются по хрящу или, в качестве альтернативы, аутологичные хондроциты выделяют из биопсии ушной раковины (например, из раковин (красные) или остатков ушной раковины). После расширения их высевают на каркас ушной формы и культивируют в 3D-культуре. После этого можно имплантировать культивированную ушную раковину. Для лучших результатов рекомендуется неоваскуляризация [44]. Рисунок изменен после Bichara et al.[45].
Наши предыдущие и недавние экспериментальные исследования привели к хорошим результатам в тканевой инженерии хряща с предварительным изготовлением трехмерных хрящевых конструкций (полиуретановые каркасы на основе поликапролактона) (), ведущих к тканевой инженерии ушной раковины [44, 48]. В модели аутологичного кролика конструкции хрящевых клеток неоваскуляризировали с помощью сосудистых петель, имплантированных микрохирургически и помещенных подкожно в кожный лоскут. Минимум через 21 день трехмерную конструкцию можно было свободно трансплантировать с помощью микрохирургии.Этот метод позволит восстановить с помощью реконструкции случаи серьезных повреждений кожи и / или мягких тканей. Было показано, что после эксплантации конструкции сформировали сконструированную хрящевую ткань со специфическими для хряща компонентами внеклеточного матрикса (GAG, коллаген типа II), даже в центре, и конструкции показали хорошую неоваскуляризацию [44]. Эта процедура кажется многообещающей альтернативой для клинической практики, но необходимы дальнейшие исследования.
Тканевая инженерия хондроцитов с предварительным изготовлением трехмерной конструкции хрящевой ушной раковины (полиуретановый каркас на основе поликапролактона) перед имплантацией кролику.
12. Обсуждение
Реконструкция ушной раковины — одна из самых сложных задач в пластической хирургии лица, и с развитием хирургических методов и биотехнологий хирурги и пациенты могут рассмотреть множество вариантов. Первоначально описанная такими авторами, как Converse [16], Tanzer [17] и Brent [18], имеющими дело с большим количеством пациентов, реконструкция ушной раковины была позже разработана Нагатой [9–11] и Фирмином [21], также с большим количеством пациентов. пациентов, и теперь сводится к операции в два этапа.
Анализируя литературу, можно сказать, что многие другие авторы сообщали о реконструкции ушной раковины в течение последних трех десятилетий с большими достижениями в области аутологичной, аллопластической, а также протезной реконструкции. Большинство хирургов по-прежнему предпочитают аутологичную реконструкцию; многие приняли подход Нагаты во многих вариациях. Эти изменения включают форму каркаса, лоскуты, закрывающие каркас, и количество используемого хряща. Для трехмерной проекции уха Нагата использует клин из хряща, который расположен на нижней стороне для поднятия каркаса и фиксируется к каркасу швами.Он использует височно-теменный фасциальный лоскут, чтобы закрыть хрящ [49]. Мы используем васкуляризованный лоскут, чтобы закрыть хрящ. Лоскут тоньше, и, таким образом, мы можем сохранить височно-теменный фасциальный лоскут в случае таких осложнений, как некроз кожи.
В 1966 году Кронин [32] представил аллопластический материал (силикатный каркас). Он описал такие осложнения, как выдавливание и инфицирование каркаса. В последнее время пористые каркасы из полиэтилена стали использовать для реконструкции ушной раковины в различных медицинских центрах [39, 42].Аллопластический каркас должен быть покрыт хорошо васкуляризованным лоскутом для предотвращения выдавливания. Выбор использования височно-теменного фасциального лоскута (риск облысения и рубцевания) зависит от хирурга. Два больших преимущества, которые пропагандируют сторонники этого метода, — это одноэтапная процедура и отсутствие болезненности донорского участка (грудного ложа). С другой стороны, нельзя упускать из виду заболеваемость со стороны донора при заборе больших кусков кожи. Кроме того, забор височно-теменного фасциального лоскута с риском облысения является важным аспектом, о котором следует помнить.
Третья возможность — реконструкция с помощью протеза. Современные методы с использованием остеоинтегрированных титановых винтов предлагают такие преимущества, как улучшенное крепление протеза, простота использования и правильное положение протеза [5]. Тем не менее, использование протеза по-прежнему сохраняется для особых ситуаций, таких как неудачная аутогенная / аллопластическая реконструкция с серьезными дефектами мягких тканей или рубцами или у пожилых пациентов после приобретенного полного дефекта ушной раковины (особенно для пациентов, носящих очки).
Недавние авторы сосредотачиваются на исходе, пользе для качества жизни пациентов и их психологическом улучшении после операции (с реберным хрящом или Medpor) ретроспективно [30, 50] и проспективно [51], тема, которая кажется очевидной. стали важной проблемой в последние несколько лет. Как отмечают в своей статье Сивайохам и Вулфорд [52], «становится все более важным, чтобы мы могли оправдать проведение таких операций, как полная реконструкция уха, не только интуитивным наблюдением, что, конечно, желательно иметь два уха, но с доказательствами высокого качества.”Браун и др. [30] и Соукуп и др. [50] использовали инвентарную шкалу Глазго, которая является инструментом оценки качества жизни, связанного со здоровьем, для определения удовлетворенности пациентов после реконструкции ушной раковины (аутологичный или аллопластический материал). Оба исследования показывают положительное влияние на качество жизни, связанное со здоровьем (общий балл и подшкала социального здоровья), при полной реконструкции с использованием аутологичного материала (Soukup) или Medpor (Braun). Steffen et al. [51] показали сопоставимые результаты, используя другой вопросник.
Younis et al. [53] сообщают об удовлетворенности пациентов ( n = 20) после реконструкции с помощью костно-закрепленного ушного протеза типа Branemark после того, как 14/20 пациентов перенесли неудачную аутологичную реконструкцию ушной раковины; результаты показывают общее одобрение эстетического внешнего вида, а также множественные хронические проблемы с кожей (15/20 пациентов) и другие проблемы с имплантатами.
Эти данные еще раз демонстрируют использование аутологичного или аллопластического материала в качестве метода выбора, при этом реконструкция с помощью протеза используется только в особых случаях.представляет собой руководство к процессу принятия решений при лечении полного дефекта ушной раковины.
Рекомендации по полной реконструкции ушной раковины.
13. Заключение
Реконструкция ушной раковины остается серьезной проблемой для хирургов, реконструктивных лицевых органов. Выбор метода такой реконструкции зависит не только от патологии пациента и состояния местных тканей и кожи, но и от предпочтений лицевого пластического хирурга и пациента.Существуют различные возможности реконструкции, такие как аутологичный реберный хрящ, аллопластический материал или протезирование. При небольших дефектах местных мягких тканей и кожи может быть достаточно, чтобы покрыть дефект различными лоскутными техниками. Недавняя литература указывает на то, что современная практика все еще поддерживает использование трансплантатов реберного хряща, хотя можно найти много сторонников аллопластических имплантатов. Выбор часто зависит от предпочтений автора и от того, указаны ли плюсы или минусы каждой техники.В нашей клинике мы предпочитаем реконструкцию с помощью реберного хряща и за многие годы добились хороших результатов с помощью этого метода. Однако, как упоминалось выше, использование протеза может быть лучшим лечением в особых ситуациях. Независимо от используемой техники, имплантация слухового аппарата с костной фиксацией или активного имплантата среднего уха должна быть принята во внимание перед операцией, чтобы восстановить полный слух в случаях врожденной атрезии.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Список литературы
1. von Szymanowski J. Ohrbildung, otoplastik. В: von Szymenowski J, редактор. Handbuch der Operativen Chirurgie . Брауншвейг, Германия: Vieweg & Sohn; 1870. С. 303–306. [Google Scholar] 2. Guo G, Schwedtner O, Klein M. Ретроспективное исследование ушных протезов с фиксацией на имплантатах. Международный журнал оральных и челюстно-лицевых имплантатов . 2008. 23 (3): 539–543. [PubMed] [Google Scholar] 3. Верда Х. Хирургия ушной раковины: опухоли, травмы, дефекты, аномалии .Издательство Thieme Medical; 2007. [Google Scholar] 4. Ло X, Ян Дж, Ян Q, Ван X. Классификация и реконструкция посттравматической деформации уха. Журнал черепно-лицевой хирургии . 2012. 23 (3): 654–657. [PubMed] [Google Scholar] 5. Луи П., Апонте-Вессон Р., Фернандес Р., Клемоу Дж. Аутогенная и протезная реконструкция уха. Клиники челюстно-лицевой хирургии Северной Америки . 2013. 25 (2): 271–286. [PubMed] [Google Scholar] 6. Маркс Х. Die Mißbildungen des Ohres.В: Калер Д.А., редактор. Handbuch der HNO-Heilkunde . Берлин, Германия: Springer; 1926. (немецкий) [Google Scholar] 7. Танцер RC. Реконструктивно-пластическая хирургия . 2-е издание. Филадельфия, Пенсильвания, США: У. Б. Сондерс; 1977 г. [Google Scholar] 8. Танцер RC. Суженное (чашечно-лопаточное) ухо. Пластическая и реконструктивная хирургия . 1975. 55 (4): 406–415. [PubMed] [Google Scholar] 9. Нагата С. Модификация этапов тотальной реконструкции ушной раковины: часть I. Трансплантация трехмерного каркаса реберного хряща для микротии дольчатого типа. Пластическая и реконструктивная хирургия . 1994; 93 (2): 221–230. [PubMed] [Google Scholar] 10. Нагата С. Модификация этапов тотальной реконструкции ушной раковины: часть II. Пересадка трехмерного каркаса реберного хряща при микротии раковинного типа. Пластическая и реконструктивная хирургия . 1994. 93 (2): 231–242. [PubMed] [Google Scholar] 11. Нагата С. Модификация этапов тотальной реконструкции ушной раковины: часть III. Пересадка трехмерного каркаса реберного хряща при небольших микротиях раковинного типа. Пластическая и реконструктивная хирургия . 1994. 93 (2): 243–253. [PubMed] [Google Scholar] 12. Роберсон Дж. Б., Гольдштейн Х, Балакер А., Шендель С. А., Райниш Дж. Ф. КАРТА СЛУХА — классификация врожденной микротии / атрезии, основанная на обследовании 742 пациентов. Международный журнал детской оториноларингологии . 2013. 77 (9): 1551–1554. [PubMed] [Google Scholar] 13. Редди Л.В., Зиде М.Ф. Реконструкция раковых дефектов кожи ушной раковины. Журнал челюстно-лицевой хирургии .2004. 62 (12): 1457–1471. [PubMed] [Google Scholar] 14. Нагата С. Новый метод тотальной реконструкции ушной раковины при микротии. Пластическая и реконструктивная хирургия . 1993. 92 (2): 187–201. [PubMed] [Google Scholar] 15. Верда Х, Зигерт Р. Хирургия ушной раковины, часть I: хирургия пороков развития ушной раковины, введение с клиническими примерами . Туттлинген, Германия: Endo Press; 2012. [Google Scholar] 16. Converse JM. Построение ушной раковины при односторонней врожденной микротии. Труды Американской академии офтальмологии и отоларингологии . 1968. 72 (6): 995–1013. [PubMed] [Google Scholar] 17. Танцер RC. Тотальная реконструкция ушной раковины. Эволюция плана лечения. Пластическая и реконструктивная хирургия . 1971. 47 (6): 523–533. [PubMed] [Google Scholar] 18. Брент Б. Коррекция микротии аутогенными хрящевыми трансплантатами: I. Классическая деформация. Пластическая и реконструктивная хирургия . 1980; 66 (1): 1–12. [PubMed] [Google Scholar] 19.Брент Б. Коррекция микротии аутогенными хрящевыми трансплантатами: II. Атипичные и сложные деформации. Пластическая и реконструктивная хирургия . 1980; 66 (1): 13–21. [PubMed] [Google Scholar] 20. Верда Х. Реконструктивная хирургия ушной раковины. Пластическая хирургия лица . 1988. 5 (5): 399–410. [PubMed] [Google Scholar] 21. Фирмин Ф. Реконструкция уха при типичной микротии. Личный опыт основан на 352 микротических коррекциях ушей. Скандинавский журнал пластической и реконструктивной хирургии и хирургии кисти .1998. 32 (1): 35–47. [PubMed] [Google Scholar] 22. Siegert R. Neue Wege bei der chirurgischen Behandlung der kongenitalen Gehörgangsatresie. ГНО . 2004. 52 (3): 275–286. [PubMed] [Google Scholar] 23. Staudenmaier R. Optimierung der Ohrmuschelrekonstruktion mit autologem Rippenknorpel. ГНО . 2006. 54 (10): 749–755. [PubMed] [Google Scholar] 24. Zhang GL, Zhang JM, Liang WQ, Chen YH, Ji CY. Имплантируйте двойные расширители ткани в области сосцевидного отростка для полной реконструкции уха без кожных трансплантатов. Международный журнал детской оториноларингологии . 2012. 76 (10): 1515–1519. [PubMed] [Google Scholar] 25. Сторк К., Бас М., Гурр А., Штауденмайер Р., Старк Т. Осложнения в 312 случаях реконструкции носа и ушной раковины с использованием аутологичного реберного хряща. Ларингориноотология . 2013. 92 (12): 808–814. [PubMed] [Google Scholar] 26. Зигерт Р., Магриц Р. Rippenknorpelrekonstruktion nach ausgedehnter Knorpelentnahme. Ларингориноотология . 2005. 84: 474–478. [Google Scholar] 27.Уильямс Дж. Д., Ромо Т., III, Склафани А. П., Чо Х. Пористые имплантаты из полиэтилена высокой плотности в реконструкции ушной раковины. Архив отоларингологии: хирургия головы и шеи . 1997. 123 (6): 578–583. [PubMed] [Google Scholar] 28. Бергхаус А. Пористый полиэтилен в реконструктивной хирургии головы и шеи. Архив отоларингологии . 1985. 111 (3): 154–160. [PubMed] [Google Scholar] 29. Ченци Р., Фарина А., Зуккарино Л., Каринчи Ф. Клинические результаты 285 трансплантатов Medpor, использованных для черепно-лицевой реконструкции. Журнал черепно-лицевой хирургии . 2005. 16 (4): 526–530. [PubMed] [Google Scholar] 30. Браун Т., Граца С., Беккер С. и др. Реконструкция ушной раковины с использованием пористых полиэтиленовых каркасов: результаты и польза для пациента у 65 детей и взрослых. Пластическая и реконструктивная хирургия . 2010. 126 (4): 1201–1212. [PubMed] [Google Scholar] 31. Ромо Т., III, Фозо М.С., Склафани А.П. Реконструкция микротоков с использованием пористого полиэтиленового каркаса. Пластическая хирургия лица . 2000. 16 (1): 15–22.[PubMed] [Google Scholar] 32. Cronin TD. Использование силиконового каркаса для полной и субтотальной реконструкции наружного уха: предварительный отчет. Пластическая и реконструктивная хирургия . 1966. 37 (5): 399–405. [PubMed] [Google Scholar] 33. Линч Дж. Б., Поути А., Дойл Дж. Э., Льюис С. Р.. Наш опыт применения ушных имплантатов из силикона. Пластическая и реконструктивная хирургия . 1972: 49 (3): 283–285. [PubMed] [Google Scholar] 34. Бергхаус А. Имплантаты для реконструктивной хирургии носа и ушей. Текущее мнение в области отоларингологии и хирургии головы и шеи .2007; 6 [Google Scholar] 35. Reinisch JF, Lewin S. Реконструкция уха с использованием пористого полиэтиленового каркаса и лоскута височно-теменной фасции. Пластическая хирургия лица . 2009. 25 (3): 181–189. [PubMed] [Google Scholar] 36. Александр Г, Раджачич Н., Ибрагим М.К., Аль-Джамиль С. Комбинированный задний височно-теменный и галеальный фасциальный лоскут: новый лоскут на возвышении сконструированной ушной раковины (второй этап коррекции микротии) British Journal of Plastic Surgery . 2002. 55 (7): 582–584. [PubMed] [Google Scholar] 37.Wilkes GH, Wolfaardt JF, Dent M. Остеоинтегрированная аллопластическая реконструкция уха в сравнении с аутогенной реконструкцией уха: критерии выбора лечения. Пластическая и реконструктивная хирургия . 1994; 93 (5): 967–979. [PubMed] [Google Scholar] 38. Торн Ч., Брехт Л. Е., Брэдли Дж. П., Левин Дж. П., Хаммершлаг П., Лонгакер М. Т.. Реконструкция ушной раковины: показания к аутогенным и протезным методикам. Пластическая и реконструктивная хирургия . 2001. 107 (5): 1241–1252. [PubMed] [Google Scholar] 39. Federspil PA.Эпистезы уха как альтернатива аутогенной реконструкции. Пластическая хирургия лица . 2009. 25 (3): 190–203. [PubMed] [Google Scholar] 40. Зигерт Р. Новые хирургические методы лечения атрезии ушной раковины. ГНО . 2004. 52 (3): 275–288. [PubMed] [Google Scholar] 41. Надараджа Г.С., Гургель Р.К., Ким Дж., Чанг К.В. Слуховые результаты хирургии атрезии по сравнению с остеоинтегрированным устройством костной проводимости у пациентов с врожденной атрезией слуха: систематический обзор. Отология и невротология .2013; 34: 1394–1399. [PubMed] [Google Scholar] 42. Кифер Дж., Штауденмайер Р. Комбинированная эстетическая и функциональная реконструкция пороков развития уха. Успехи в оторино-ларингологии . 2010. 68: 81–94. [PubMed] [Google Scholar] 43. Грин В.Т., мл., Диккенс ДР. Модель культуры для исследования формирования хрящевого матрикса. Хирургический форум . 1972; 23: 453–455. [PubMed] [Google Scholar] 44. фон Бомхард А., Вейт Дж., Бермюллер С. и др. Предварительное изготовление трехмерных хрящевых конструкций: к ушной раковине тканевой инженерии — модель, испытанная на кроликах. PLoS ONE . 2013; 8 (8) e71667 [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Бичара Д.А., О’Салливан Н.А., Померанцева И. и др. Ушная раковина с тканевой инженерией: прошлое, настоящее и будущее. Tissue Engineering B: Обзоры . 2012. 18 (1): 51–61. [PubMed] [Google Scholar] 46. Чжоу Л., Померанцева И., Бассетт Е.К. и др. Инженерные конструкции ушей с композитным каркасом для сохранения размеров. Тканевая инженерия А . 2011; 17 (11-12): 1573–1581. [PubMed] [Google Scholar] 47.Штауденмайер Р., Хоанг Н. Т., Мандлик В. и др. Индивидуальная тканевая инженерия для реконструкции уха. Успехи в оторино-ларингологии . 2010. 68: 120–131. [PubMed] [Google Scholar] 48. Hoang NT, Hoehnke C, Hien PT, Mandlik V, Feucht A, Staudenmaier R. Неоваскуляризация и свободный микрохирургический перенос конструкций, созданных с помощью хряща in vitro. Микрохирургия . 2009. 29 (1): 52–61. [PubMed] [Google Scholar] 49. Нагата С., Брент Б.Д. Модификация этапов тотальной реконструкции ушной раковины: часть IV.Возвышение уха для сконструированной ушной раковины. Пластическая и реконструктивная хирургия . 1994. 93 (2): 254–268. [PubMed] [Google Scholar] 50. Соукуп Б, Машхади С.А., Булстроуд Северо-Запад. Оценка качества жизни, связанного со здоровьем, и результаты хирургических вмешательств при реконструкции ушной раковины с использованием аутологичного реберного хряща. Пластическая и реконструктивная хирургия . 2012. 129 (3): 632–640. [PubMed] [Google Scholar] 51. Штеффен А., Волленберг Б., Кениг И. Р., Френцель Х. Проспективная оценка психосоциальных результатов после реконструкции уха с помощью реберного хряща при микротии. Журнал пластической, реконструктивной и эстетической хирургии . 2010. 63 (9): 1466–1473. [PubMed] [Google Scholar] 52. Сивайохам Э., Вулфорд Т. Текущее мнение о реконструкции ушной раковины. Текущее мнение в области отоларингологии и хирургии головы и шеи . 2012; 20: 287–290. [PubMed] [Google Scholar] 53. Юнис I, Голт Д., Саббаг В., Канг Н.В. Удовлетворенность пациентов и эстетические результаты после реконструкции уха с помощью ушного протеза с костной фиксацией типа Branemark: обзор за 16 лет. Журнал пластической, реконструктивной и эстетической хирургии .2010. 63 (10): 1650–1655. [PubMed] [Google Scholar]Гематома ушной раковины | Tidsskrift для Den norske legeforening
Гематомы ушной раковины обычно возникают в результате вытягивания ушной раковины или тупой травмы в связи с контактными видами спорта, несчастными случаями или насилием. Гематома ушной раковины требует незамедлительного хирургического вмешательства, чтобы избежать появления уха из цветной капусты, также известного как «ухо борца». Ухо из цветной капусты — это необратимая деформация, состоящая из соединительной ткани и хряща.
Ухо поддерживается каркасом, состоящим из нескольких хрящевых компонентов: спирали, антиспирали, раковины, козелка и антитрагуса. Кожа, покрывающая этот хрящевой каркас, чрезвычайно тонкая, практически без подкожной жировой ткани, а также прочно прилегает к нижележащей надхрящнице. Надхрящница обильно васкуляризована и снабжает кровью бессосудистый хрящ (1).
При гематоме ушной раковины кровь скапливается в слое между надхрящницей и хрящом.Таким образом, гематома образует механический барьер между хрящом и кровоснабжением надхрящницы (2). При отсутствии достаточного количества питательных веществ хрящ может некротизироваться и / или инфицироваться. Это в конечном итоге вызовет беспорядочный фиброз и образование хряща вокруг различных хрящевых компонентов (3).
Как следствие, обычно вогнутая структура уха заполняется соединительной тканью. Впоследствии хрящ деформируется и искривляется, в результате чего возникают варианты так называемого «ушка цветной капусты» (рис. 1).Быстрая эвакуация гематомы восстанавливает тесный контакт между хрящом и надхрящницей, тем самым снижая вероятность деформации.
Рисунок 1 Нелеченная гематома ушной раковины может привести к появлению уха цветной капусты. Выше показаны три пациента с постоянными и твердыми ушами цветной капусты в результате невозможности эвакуации гематомы. Фотографии: Кристоффер Аам Ингвальдсен
В этой статье представлен обзор лечения гематомы ушной раковины. Информация об оптимальных методах лечения острых состояний остается ограниченными (4).Литература состоит из небольшого количества отчетов о случаях, систематических обзоров и руководств по клинической практике.
Статья основана на собственном опыте авторов работы в отделении неотложной и неотложной помощи и в качестве пластических хирургов, а также на обзоре рекомендаций, предоставленных UpToDate (5), и подборке статей, полученных с помощью поиска в PubMed и Макмастер ПЛЮС.
Клиническая картина
Гематома ушной раковины обычно представляет собой болезненную, напряженную и колеблющуюся припухлость на передней поверхности уха с пульсирующей болью от легкой до умеренной.Большинство пациентов обращаются за медицинской помощью в первую очередь из-за видимого отека или из-за наличия дополнительных травм, которые они хотят исследовать (травма головы / шеи, рваные раны и т. Д.).
В отделении неотложной помощи у пациента с гематомой ушной раковины часто бывает много других травм, особенно если эти травмы были получены в результате насилия. Таким образом, гематому ушной раковины легко не заметить, если не приложить особых усилий для ее исключения во время клинического обследования.
Гематома обычно заполняет полость между спиралью и антиспиралью (scapha) и распространяется вперед в треугольную ямку. Реже гематома может занимать раковину или область вокруг наружного слухового прохода. Важно знать, что гематома ушной раковины также может возникать на задней поверхности уха или, возможно, на обеих поверхностях, хотя это встречается реже (1). Риск некроза выше, если гематомы присутствуют как на передней, так и на задней поверхности (6).
Вышележащая кожа может иметь нормальный цвет, может быть эритематозной или экхимотической. Механизм травмы будет определять наличие язвы или порезов: они чаще встречаются при травмах от резкой силы (например, травмы, нанесенные стеклом). Кожа обычно не повреждена, а гематома при пальпации кажется мягкой. Примерно через 24 часа после травмы кровь свернется, и опухоль может стать более плотной.
Для лечащего врача важно исключить другие серьезные травмы у пациентов с гематомой ушной раковины, в частности, травмы головы и / или шеи.Анамнез должен уточнить любую потерю сознания, амнезию и прием антикоагулянтов. Важно помнить, что пациент мог подвергнуться насилию. Также необходимо выполнить отоскопию на обоих ушах, чтобы исключить перфорацию барабанной перепонки и гематотимпанума (7).
Лечение
При всех гематомах ушной раковины требуется экстренная эвакуация (4, 5). Аспирацию иглой или разрез и дренаж может выполнить терапевт / врач неотложной помощи. Важно, чтобы это произошло как можно быстрее, чтобы хрящ не омертвел.
Альтернативный подход требуется, если возраст гематомы превышает семь дней. Такие гематомы часто бывают более организованными, и их труднее дренировать. Также может быть изъязвление и / или некроз кожи, в этом случае пациента следует направить к оториноларингологу или пластическому хирургу.
Эвакуация гематомы
Операция проводится под регионарной блокадой ушной раковины (5). Мы рекомендуем ксилокаин 1% с адреналином. Хороших результатов также можно добиться с помощью инфильтрационной анестезии, но ее следует применять для самых маленьких гематом (менее 2 см).Дополнительный адреналин рекомендуется при регионарной блокаде ушной раковины, но не должен применяться при инфильтрационной анестезии (5).
Важно сначала продезинфицировать ухо и окружающую кожу. Стерильные губки следует смочить спиртом хлоргексидина 5 мг / мл (0,5%) и приложить не менее двух минут. Перед перфорацией кожи спирту необходимо дать высохнуть на воздухе. На рисунке 2 показано, как выполнить региональную блокаду ушной раковины.
Рисунок 2 Регионарная блокада ушной раковины показана для эвакуации больших гематом предсердия.Это обеспечивает хорошую анестезию, избегая введения дополнительного объема в уже напряженную и травмированную ткань. Ксилокаин с дополнительным адреналином вводится через тонкую канюлю в кожу, как показано здесь. Обычно достаточно двух мест инъекции. Анестетик вводится в форме буквы V под ухом и в форме перевернутой буквы V над ухом. Оптимальный эффект достигается через десять минут. Блокада нерва анестезирует переднюю и заднюю поверхности уха в целом, за исключением области внутри и вокруг наружного слухового прохода, которая иннервируется ветвями блуждающего нерва
Рекомендуемое лечение будет зависеть от размера и возраста гематомы ушной раковины (5).Как указано выше, если возраст гематомы превышает семь дней, пациента необходимо направить к оториноларингологу или пластическому хирургу для ревизии и, при необходимости, реконструкции.
Аспирация с помощью иглы рекомендуется, если гематома ушной раковины <2 см в диаметре и возраст <48 часов. Подходят зеленые (21 г) или розовые (18 г) канюли. Место введения в идеале должно находиться у основания гематомы. Нет необходимости вводить иглу в хрящ или через него.Если аспирация гематомы оказывается затруднительной, вероятно, это связано с тем, что кровь полностью или частично свернулась. Затем следует рассмотреть возможность разреза и дренирования.
Рекомендуется разрез и дренирование, если гематома ушной раковины ≥ 2 см в диаметре или старше 48 часов (5, 8). Надрез следует сделать у основания гематомы. Если гематома расположена в области ладони и / или треугольной ямки, разрез должен быть непосредственно над контуром антиспирали. Такие разрезы часто дают хорошие косметические результаты.В качестве альтернативы разрез можно сделать прямо под краем спирали, чтобы шрам был хотя бы частично скрыт. Разрез должен быть достаточно большим, чтобы можно было эвакуировать сгусток. На рисунке 3 показана анатомия поверхности уха и типичная гематома ушной раковины.
Рис. 3 Иллюстрация анатомии поверхности уха и типичного расположения ушной гематомы (в краниальной части ладони и переходящей в треугольную ямку).Жирными черными линиями обозначены разрезы вдоль антиспирали и спирали
.Следует избегать разрезов хряща: если гематома опорожняется, разрез будет достаточно глубоким. При необходимости разрез можно немного увеличить с помощью небольших ножниц или тканевых щипцов. После дренирования гематомы необходимо промыть эту область стерильным физиологическим раствором, пока жидкость не станет прозрачной. Затем разрез можно закрыть, например, 5–0 нерассасывающимися нейлоновыми швами.Рекомендуется матрасная строчка. Хирургическая игла должна проходить через кожу, надхрящницу и хрящ с обеих сторон от разреза. Цель состоит в том, чтобы добиться хорошего контакта между слоями. Небольшой край разреза остается открытым для дренажа.
После операции накладывается давящая повязка с пропитанной вазелином марлей до внутренней стороны, затем стерильная повязка с физиологическим раствором и сухая повязка. Часто необходимо наматывать эластичную повязку на голову, чтобы обеспечить достаточное давление на поверхность уха.
Антибиотикопрофилактика
Область с ограниченным кровоснабжением уязвима для инфекции. Всем пациентам рекомендуется проводить антибиотикопрофилактику в течение 7–10 дней (5). Один из вариантов — диклоксациллин (капсулы) по 500 мг три-четыре раза в день до снятия швов; это касается стафилококков, продуцирующих пенициллиназу, которые вызывают многочисленные раневые инфекции.
Послепродажное обслуживание
Мы рекомендуем проверять рану два или три раза в течение первых пяти дней, чтобы оценить повторное накопление гематомы и / или инфекции.Давящую повязку следует менять каждый раз при осмотре раны. Если произошло повторное скопление крови, аспирацию и / или разрез можно повторить. Если процесс разреза и дренажа завершен, давящую повязку можно снять через три дня. Швы снимают через 7-10 дней.
Если пациент активно участвует в рискованных занятиях (например, в борьбе), мы рекомендуем ему или ей воздерживаться от таких занятий в течение недели после лечения. Также следует поощрять использование защиты головы (шапочка для схватки) или повязки на уши (часто используемой в регби).
Реконструкция уха цветной капусты
Многие из тех, кто занимается боксом, борьбой, боевыми искусствами и регби, не считают уши цветной капусты некрасивыми — как раз наоборот. Мы поддерживали контакт с членами этого сообщества в Осло, и, похоже, многие люди избегают дренирования гематом. Уши цветной капусты могут составлять часть изображения и рассматриваться как почетный знак. У нас сложилось впечатление, что лишь небольшая часть этих пациентов обращается за медицинской помощью и консультациями.
Многие спортсмены и участники контактных видов спорта действительно меняют свое мнение в более позднем возрасте, однако часто в связи с выбором / сменой карьеры. Некоторые также сообщают о боли / дискомфорте при попытке заснуть или при надавливании на ухо. Эти люди иногда обращаются за хирургической коррекцией (9).
Хирургическая коррекция манифестного уха цветной капусты — сложная реконструкция. Методы реконструкции, при которых деформированная соединительная ткань и хрящ иссекаются и / или ремоделируются с помощью подходящих разрезов, описаны в литературе (9-11).
В тяжелых случаях, когда большая часть ушного хряща потеряна, реберный хрящ можно использовать для восстановления хрящевых компонентов уха. Этот тип реконструкции регулярно проводится в Rikshospitalet в связи с врожденными пороками развития уха (анотия / микротия), но еще не проводился у пациента с ухом из цветной капусты.
Заключение
врачей общей практики и персонал отделения неотложной помощи / отделения неотложной помощи должны знать о гематомах ушной раковины и о важности быстрого лечения.Гематома ушной раковины может привести к некрозу хряща, что подвергнет пациента риску образования язв и уха цветной капусты. Врач, осматривающий пациента, должен попытаться удалить гематому (а не направлять пациента дальше), поскольку своевременное лечение снижает риск необратимой деформации.
Оптимальный метод удаления гематомы зависит от размера и возраста гематомы. Если врачу неудобно наложить региональную блокаду ушной раковины и / или сделать разрез в ухе, вместо этого может быть предпринята аспирация иглой в стерильных условиях.Игольная аспирация может быть выполнена без блокады ушной раковины или инфильтрационной анестезии. Если пациент соглашается, такое лечение лучше, чем ждать и потенциально позволить хрящу стать некротизированным.
Пациентов с более старыми гематомами ушной раковины или явными проявлениями ушей из цветной капусты следует направлять к оториноларингологу или пластическому хирургу для лечения и оценки вариантов реконструкции.
Предыстория, История процедуры, Проблема
Автор
Джозеф Л. Лич-младший, доктор медицины Доцент кафедры отоларингологии Юго-западной медицинской школы Техасского университета
Джозеф Л. Лич-младший, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия косметической хирургии, триологическая Общество, Американская академия лицевой пластической и реконструктивной хирургии, Американская академия отоларингологии — хирургия головы и шеи, Техасская медицинская ассоциация
Раскрытие: Ничего не разглашать.
Соавтор (ы)
Майкл Дж. Биавати, доктор медицины, FACS, FAAP Доцент кафедры отоларингологии, Юго-западный медицинский центр Техасского университета в Далласе, Юго-западная медицинская школа; Частная практика, ЛОР-уход для детей, Даллас, Техас
Майкл Дж. Биавати, доктор медицинских наук, FACS, FAAP является членом следующих медицинских обществ: Американской академии отоларингологии — хирургии головы и шеи, Американского общества детской отоларингологии, Общества уха. , Достижения носа и горла у детей, Американская педиатрическая академия, Американская ассоциация черепно-лицевых травм неба, Американский колледж хирургов, Триологическое общество, Техасская медицинская ассоциация
Раскрытие: Ничего не разглашать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Dominique Dorion, MD, MSc, FRCSC, FACS Декан, профессор хирургии, отделение отоларингологии — хирургия головы и шеи, медицинский факультет, Université de Sherbrooke, Канада
Dominique Dorion, MD, MSc, FRCSC, FACS — это член следующих медицинских обществ: Канадское общество отоларингологии — хирургии головы и шеи
Раскрытие информации: Ничего не разглашать.
Главный редактор
Арлен Д. Мейерс, доктор медицинских наук, магистр делового администрирования Профессор отоларингологии, стоматологии и инженерии, Медицинская школа Университета Колорадо
Арлен Д. Мейерс, доктор медицинских наук, магистр делового администрирования является членом следующих медицинских обществ: Американской академии лицевой пластики и реконструктивной хирургии. Хирургия, Американская академия отоларингологии — хирургия головы и шеи, Американское общество головы и шеи
Раскрытие информации: служить (d) в качестве директора, должностного лица, партнера, сотрудника, советника, консультанта или попечителя для: Cerescan; Cliexa, eMedevents, Neosoma, MI10
Получил доход в размере 250 долларов США от:, Cliexa ;; Neosoma
Получил акции от RxRevu; Получена доля владения от Cerescan за консультацию; для: Neosoma, eMedevents, MI10.
Дополнительные участники
Джон Си Ли, доктор медицины Частная практика в отологии и невротологии; Медицинский директор, Balance Center
Джон Си Ли, доктор медицины, является членом следующих медицинских обществ: Американская академия отоларингологии — хирургия головы и шеи, Американский колледж хирургов, Американская медицинская ассоциация, Американское общество невротологов, Американская ассоциация тиннитуса, Флорида Медикал. Ассоциация, Североамериканское общество основания черепа
Раскрытие: Ничего не разглашать.
Пластическая хирургия уха Северная Вирджиния | Fairfax
ВАРИАНТЫ КОСМЕТИЧЕСКОЙ ХИРУРГИИ УША
Помимо того, что это инструменты, с помощью которых мы слышим и обрабатываем звуки, внешние структуры ушей также вносят вклад в симметрию, баланс и эстетические пропорции лица в целом. Анатомия наружной части уха состоит из ушной раковины и наружного слухового прохода. Ушная раковина выступает со стороны головы и собирает колебания воздуха, производящие звук, в то время как внешний слуховой проход ведет внутрь от дна ушной раковины и направляет колебания в барабанную полость.Уши состоят из нежной ткани и хряща, которые очень уязвимы для травм. Косметическая хирургия уха проводится для устранения и исправления врожденных или связанных с травмой деформаций уха, которые могут быть причиной социальной тревожности и низкой самооценки как у детей, так и у взрослых.
Структурные аномалии уха, которые можно исправить с помощью косметической хирургии уха, включают:
- Микротия: врожденная деформация, связанная с недоразвитием наружной части уха (также называемой ушной раковиной или ушной раковиной)
- Макротия: чрезмерно большие уши
- Анотия : редкая врожденная деформация, при которой вся наружная выступающая часть уха (ушная раковина / ушная раковина) полностью отсутствует
- Разорванная или разорванная мочка уха после травмы или травмы
- «Вислоухая деформация»: врожденный дефект, при котором складка ушного хряща, отвечающая за придание формы верхней части уха, не формируется должным образом, в результате чего ухо выступает или «шлепается» вниз
Хирургические процедуры для улучшения эстетического вида ушей должны выполняться опытным лицевым пластическим хирургом, обладающим высокой степенью клинических навыков, необходимых для выявления и устранения деформаций уха без негативного воздействия на слух пациента, например Dr.Транг Во-Нгуен (доктор В). Доктор Ви является основателем Института хирургического искусства Вирджинии, современной медицинской практики, расположенной в красивом Шантильи, штат Вирджиния, где она сейчас работает ведущим пластическим хирургом лица.
Доктор В. рада предложить варианты косметической хирургии уха, которые разработаны для безопасного и эффективного исправления структурных дефектов уха, при этом уши находятся в идеальном пропорциональном балансе с остальными структурами лица, тем самым улучшая общую эстетику лица пациента. внешний вид:
СВЯЗАТЬСЯ С ИНСТИТУТОМ ХИРУРГИИ ВИРДЖИНИИ
Чтобы добиться оптимальных результатов от косметической хирургии уха, важно, чтобы вы выбрали врача с глубокими практическими знаниями анатомии лица и сложных структур уха, такого как доктор.Транг Туи Во-Нгуен (доктор В). Доктор В. обладает опытом, клиническим опытом и набором хирургических навыков для создания индивидуальных планов лечения, разработанных для безопасного и эффективного улучшения внешнего вида ваших ушей с помощью косметических процедур улучшения ушей.
Доктор В. имеет двойной сертификат в области пластической хирургии лица и реконструктивной хирургии. Благодаря своему обширному обучению, исследованиям и достижениям она заработала репутацию одного из ведущих лицевых пластических хирургов в стране.Если вы хотите узнать больше о косметической хирургии уха, проводимой доктором В., пожалуйста, свяжитесь с Институтом хирургических искусств Вирджинии сегодня. Мы с нетерпением ждем возможности поговорить с вами и назначить вашу первую консультацию с доктором В.
Позвоните по телефону 703-327-8200 или щелкните здесь, чтобы назначить консультацию.
Дополнительные пальцы и дополнительные ушные раковины. Реконструкция и детская пластическая хирургия. Процедуры
.Что такое лишние пальцы и дополнительные ушные раковины?
Из-за сложности эмбриологического процесса, который формирует ребенка в утробе матери, часто возникают незначительные ошибки, которые оставляют остатки процесса.Чаще всего это лишние пальцы на руках, ногах или ушные «бугорки» (неровности).
Какие нехирургические и хирургические варианты доступны для операций на дополнительных пальцах и дополнительных ушных раковинах?
Не всегда необходимо удалять эти эмбриологические остатки хирургическим путем, и иногда они отпадают естественным путем, особенно если их прикрепление к ребенку небольшое — для облегчения этого можно использовать небольшие швы. Если вмешательства проводятся в возрасте до 3–4 месяцев, часто используется метод «кормления и укутывания», при котором ребенку вводят местный анестетик, а затем кормят его молоком, чтобы он уснул, после чего проводится операция.Младенцы старше этого возраста начинают становиться сильнее и слишком сильно извиваются перед хирургической процедурой. В этих случаях рекомендуется общий наркоз, и по соображениям безопасности лучше подождать, пока ребенку не исполнится один год.
Как долго сохраняются результаты процедур на дополнительных пальцах и дополнительных ушных раковинах?
Результаты сохраняются на всю жизнь и не повторяются.
Каковы риски появления лишних пальцев и дополнительных ушных раковин?
Любой рубец может стать неблагоприятным, особенно если заживление сложное или длительное.Гипертрофические или келоидные рубцы чаще встречаются при определенных типах кожи, но почти никогда не встречаются у младенцев; в то время как инфекция и кровотечение являются риском любого хирургического вмешательства. Шрамы могут стать болезненными там, где раньше их не было, и всегда существует небольшой риск ухудшить положение или не оправдать ожиданий.
Каковы показатели успеха операций на дополнительных пальцах и дополнительных ушных раковинах?
Обычно они отличные.
Сколько стоят процедуры установки дополнительных пальцев и дополнительных ушных раковин?
Приведенные ниже ориентировочные цены включают плату за хирургическое вмешательство, любые использованные анестетики и связанные с ними гонорары консультанта, проводящего их, в дополнение к госпитализации, всем тестам и последующему наблюдению.Точная разбивка и подробное предложение будут предоставлены после первичной консультации.
От 250 фунтов стерлингов за наложение лигатуры
От 1000 фунтов стерлингов за удаление дополнительных «выступов»
Общие рекомендации по процедурам дополнительных пальцев и дополнительных ушных раковин?
Косметические отклонения у детей обычно лучше всего устранять до того, как они узнают о проблеме или когда ребенок выражает беспокойство по поводу пораженного участка, в зависимости от проблемы. Рекомендации по лечению рубцов важны для оптимизации результатов и полезны как минимум в течение года после операции.
Тканевая инженерия ушной раковины человека путем совместной имплантации хондроцитов и мезенхимальных стволовых клеток ушной раковины
Abstract
У детей, страдающих микротией, есть несколько вариантов реконструкции ушной раковины. Подходы тканевой инженерии пытаются воспроизвести сложную анатомию и структуру уха с аутологичным хрящом, но были ограничены доступом к клинически доступным источникам клеток. Здесь мы представляем полномасштабное человеческое ухо на основе пациента, полученное путем имплантации человеческих аурикулярных хондроцитов и человеческих мезенхимальных стволовых клеток в соотношении 1: 1.Дополнительные суррогаты дисковой конструкции были созданы с комбинациями 1: 0, 1: 1 и 0: 1 хондроцитов предсердия и мезенхимальных стволовых клеток. Через 3 месяца in vivo , одноклеточные диски ушных хондроцитов и конструкции дисков и ушей 1: 1 показали связанные коллагеновые волокна в перихондриальном слое, богатое отложение протеогликана и образование сети эластиновых волокон, аналогичное естественному человеческому хрящу ушной раковины, с белковым составом и механическая жесткость нативных тканей. Полноценные конструкции уха с комбинацией клеток 1: 1 поддерживали крупную структуру уха и после имплантации приобрели хрящевой вид.Эти исследования демонстрируют успешную инженерию индивидуальной ушной раковины человека с использованием исключительно человеческих источников клеток без обширной культуры ткани in vitro до имплантации, что является важным шагом на пути к клиническому применению тканевой инженерии для реконструкции ушной раковины.
Образец цитирования: Коэн Б. П., Бернштейн Дж. Л., Моррисон К. А., Спектор Дж. А., Бонассар Л. Дж. (2018) Тканевая инженерия ушной раковины человека путем совместной имплантации аурикулярных хондроцитов и мезенхимальных стволовых клеток.PLoS ONE 13 (10): e0202356. https://doi.org/10.1371/journal.pone.0202356
Редактор: Микко Юхани Ламми, Университет Умео, ШВЕЦИЯ
Поступила: 18 апреля 2018 г .; Одобрена: 1 августа 2018 г .; Опубликовано: 24 октября 2018 г.
Авторские права: © 2018 Cohen et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Финансирование предоставлено Грантом 5T35EB006732 Национальных институтов здравоохранения (BPC, JAS, LJB), Отделом науки, технологий и инноваций Empire State Development (JAS, LJB), Фондом стволовых клеток Empire State через Департамент штата Нью-Йорк контракта на здравоохранение № C30293GG (BPC), а также 3D BioCorp (LJB) и отделения патологии стволовых клеток для услуг сканирования (грант NYSTEM C029155).Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: LJB является соучредителем и держателем акций 3D BioCorp. Остальные авторы заявляют об отсутствии конкурирующих интересов. Это не влияет на нашу приверженность политике PLOS ONE в отношении обмена данными и материалами.
Введение
Более двух десятилетий тканевая инженерия ушной раковины человека или наружного уха рассматривается как альтернатива существующим методам реконструкции ушной раковины [1].В настоящее время золотым стандартом лечения пациентов со значительной деформацией или повреждением ушной раковины является аутологичная реконструкция с использованием реберного хряща. Это сложная хирургическая техника, применяемая относительно небольшим количеством хирургов из-за болезненности донорского участка реберного хряща и проблем с получением ушных раковин с приемлемыми эстетическими результатами [2–4]. Хотя есть сообщения об успешной реконструкции с использованием протезных каркасов, широкое распространение этого подхода было ограничено плохой биосовместимостью и возможностью экструзии [3].Эти проблемы стимулировали интерес к полномасштабной тканевой инженерии ушных раковин человека. Посев аурикулярных хондроцитов (AuCs) на естественные и синтетические каркасы сгенерировал ткань различных размеров in vivo , соответствующую структурным [3,5–8], биохимическим [3,5–7] и механическим [5,6] свойствам родной ушной хрящ. Ушные раковины с тканевой инженерией также могут точно воспроизводить анатомию ушной раковины конкретного пациента, сочетая неинвазивные методы визуализации с технологией компьютерного проектирования / автоматизированного производства (CAD / CAM) [5,6,9], предлагая оптимальные эстетические результаты.
Подобно аутологичной реконструкции, применяемой в настоящее время, тканевая инженерия использует аутологичные клетки пациента для формирования желаемой ткани, устраняя риск иммунного отторжения. В настоящее время аутологичные суставные хондроциты выделяют, расширяют и повторно имплантируют для восстановления очаговых дефектов суставного хряща, что требует образования менее 1 мл ткани [10]. Ушной хрящ можно сконструировать аналогичным образом, однако для полноразмерного детского уха требуется более 200 миллионов клеток, а его объем составляет ~ 10 мл [11].Расширение монослоя изолированных хондроцитов может привести к дедифференцировке, ограничивая способность генерировать прочный хрящ [2,12], и потенциально требует обширной культуры трехмерных конструктов перед имплантацией [9]. С другой стороны, мезенхимальные стволовые клетки (МСК) представляют собой мультипотентные клетки, способные дифференцироваться в хондроциты, и их можно легко получить из костного мозга и размножить [13-15]. Одним из методов использования МСК для образования хряща является совместное культивирование или совместная имплантация МСК с желаемым клеточным фенотипом [16].Совместное культивирование МСК с различными фенотипами хондроцитов генерировало хрящевую ткань, снижая при этом потребность в хондроцитах [17–20]. Однако мало что известно о поведении AuC в сочетании с MSC. Совместная имплантация AuC с МСК [21–23] или стволовыми клетками, полученными из жировой ткани [24], привела к образованию хряща in vivo , но влияние этих исследований ограничено из-за использования нечеловеческих клеток [21–2] 23,25], отсутствие маркеров, специфичных для эластичного хряща [21,22], или отсутствие механической оценки [22,24].
Здесь мы используем комбинацию полученных от пациентов AuC и MSC для создания ушного хряща человека, который соответствует анатомическим характеристикам, структуре, составу и механике нативного ушного хряща. Мы демонстрируем, что подходящее количество ушного хряща человека может быть получено с помощью стандартных процедур отопластики, и что достаточное количество AuC может быть выделено и размножено из этой ткани, чтобы сформировать полноразмерную конструкцию уха. Кроме того, мы оценили, могут ли расширенные AuC генерировать хрящ в ушной раковине in vivo , отдельно или в комбинации с человеческими МСК, и могут ли одни МСК дифференцироваться и продуцировать хрящ в подкожной среде.Наконец, мы сформировали ушные конструкции в форме человека, содержащие комбинацию 1: 1 AuC и MSC, и исследовали сохранение формы и развитие структуры ушного хряща после немедленной имплантации без обширного культивирования in vitro . Мы сообщаем о надежном и быстром процессе создания ушных раковин анатомической формы с использованием клеток исключительно человеческого происхождения, демонстрируя клинически значимую альтернативу тканевой инженерии аутологичной или аллопластической реконструкции ушной раковины.
Результаты
Создание полноразмерных ушных раковин человека из клинических остатков хряща
Чтобы продемонстрировать способность клеток, полученных от пациентов, генерировать ушной хрящ, мы объединили наши существующие методы инженерии ушного хряща с соответствующими клетками человеческого происхождения. Образцы хряща для выделения AuC были взяты из отбракованных образцов отопластики (рис. 1A и 1B). Остатки ушного хряща были получены от 8 здоровых пациентов (таблица S1) благодаря частной практике доктора.Чарльз Торн и Джон Шерман с информированного согласия, без одобрения IRB. Клетки выделяли в течение 24 часов после операции.
Рис. 1. Процесс конструирования ушного хряща человека.
( A ) Изображения детского уха с высоким разрешением были быстро сканированы, а ушной хрящ человека был получен от здоровых доноров. ( B ) Остатки процедур отопластики были очищены от перихондрия и поврежденных тканей перед перевариванием коллагеназой. ( C ) Человеческие AuC помещали в чашки и размножали через пассаж 3.Все данные показаны ± стандартное отклонение. ( D ) Изображения уха пациента были преобразованы в непрерывную цифровую поверхность и отредактированы для удаления шума и улучшения определения внешних особенностей. ( E ) Человеческие AuC объединяли в соотношении 1: 1 с человеческими МСК, инкапсулировали в коллаген I типа и вводили в формы для конкретных пациентов, которые были напечатаны на 3D-принтере на основе цифровых изображений. ( F ) Человеческие AuC и человеческие МСК были объединены в соотношениях 1: 0, 1: 1 и 0: 1 AuC: MSC, инкапсулированы в коллаген I типа и полимеризованы с образованием дисковых конструкций диаметром 8 мм и 2 мм. по толщине.
https://doi.org/10.1371/journal.pone.0202356.g001
Человеческие AuC были расширены через третий проход (P3) перед инкапсулированием в сконструированные конструкции. В среднем 0,83 ± 0,30 г (n = 8) ткани ушного хряща человека было получено из остатков отопластики (рис. 1B), из которых было выделено в среднем 8,3 ± 2,3 миллиона AuC / г ткани. К P3 количество AuC в 17,8 раз превышало исходное количество выделенных клеток ( P <0,05), в среднем более 115 миллионов клеток (рис. 1C).Параллельно мы приобрели и культивировали коммерчески доступные МСК человека (RoosterBio Inc., Frederick, MD).
AuC и MSC были инкапсулированы в сконструированные конструкции для двух связанных исследований. Во-первых, расширенные AuC были объединены с MSC для формирования дисковых конструкций для сравнения моноклеточной и комбинированной клеточной имплантации и для исследования прогрессивного развития с течением времени. Были сформированы диски, содержащие AuC: MSC в соотношении 1: 0, 1: 1 и 0: 1, чтобы действовать как суррогаты ушного хряща (рис. 1F). Во втором исследовании полномасштабные детские конструкции уха были сформированы путем комбинирования AuC и MSC в соотношении 1: 1.Экспансия человеческих AuC привела к образованию более 100 миллионов клеток из донорской ткани одного пациента через P3, достаточного количества клеток для создания конструкции уха человека в сочетании с человеческими МСК в соотношении клеток 1: 1. Чтобы воспроизвести индивидуальную морфологию пациента, мы использовали установленные методы, с помощью которых были получены сканированные изображения нормального детского уха и преобразованы в трехмерную цифровую поверхность (рис. 1D), которая обеспечила отрицательное пространство для ушной слепки [11]. Формы были спроектированы и напечатаны на 3D-принтере в виде нескольких частей, чтобы обеспечить простое удаление созданных конструкций, как описано ранее [11].Все конструкции были сформированы из коллагена типа I высокой плотности (10 мг / мл), который был выбран из-за его сильных механических свойств, ограниченного сокращения, а также высокой жизнеспособности и способности ремоделирования клеток [26,27]. Для ушей 1: 1 AuC объединяли с МСК, затем инкапсулировали в коллагеновый гидрогель перед инъекцией в детские ушные вкладыши для формирования конструкций (рис. 1E). Конструкции имплантировали подкожно бестимусным голым мышам (диски) или крысам (уши), чтобы обеспечить среду для созревания in vivo [1].Уход за животными и экспериментальные процедуры проводились в соответствии с руководящими принципами Комитета по уходу и использованию животных Медицинского колледжа Weill Cornell.
После имплантации конструкции, содержащие монокультуру AuC и комбинацию 1: 1 AuC и MSC, сохранили первоначальную морфологию и приобрели хрящоподобный вид и текстуру, в то время как диски, содержащие только MSC, продемонстрировали слабое развитие ткани и не сохранили свою форму (рис. 2A и 2B. ). Как через 1, так и через 3 месяца диски AuC и 1: 1 сохранили первоначальную цилиндрическую геометрию и имели блестящий, не совсем белый цвет, похожий на цвет ушного хряща.Качественно диски AuC и 1: 1 продемонстрировали эластичную гибкость в обращении. Напротив, диски МСК сужались, некоторые из них приближались к сферической морфологии, и имели грубую внешность с небольшой гибкостью, больше напоминающую фиброзную ткань, а не хрящ. Подобно суррогатам дисков 1: 1, полноразмерные конструкции уха 1: 1 генерировали здоровую хрящевую ткань и сохраняли общую морфологию уха через 3 месяца in vivo (фиг. 2B). Уши 1: 1 имели блестящую жесткую поверхность и демонстрировали эластичную гибкость при обращении и сгибании (фильм S1).Кроме того, поперечные сечения конструкций уха показали образование толстой, прочной хрящеподобной ткани по всему имплантату, с толщиной до 1 см (рис. 2B).
Рис. 2. Общий анализ инженерного хряща.
( A ) Ex vivo общий анализ сконструированных дисковых конструкций. Совместно имплантированные конструкции AuC и 1: 1 AuC: MSC сохранили цилиндрическую геометрию и приобрели белый хрящоподобный вид через 1 и 3 месяца, в то время как диски MSC значительно сократились.Масштабная линейка = 5 мм. ( B ) Ex vivo общий анализ полноразмерных конструкций уха человека, образованных комбинацией 1: 1 клеток AuC и MSC. Конструкции ушей сохраняли анатомическую точность после 3 месяцев in vivo и не демонстрировали признаков некроза по всей толщине ткани. Масштабная линейка = 1 см. ( C ) Диски AuC и 1: 1 были значительно больше по высоте по сравнению с дисками MSC, и высота значительно уменьшилась со временем для всех групп. Через 3 месяца диаметр дисков MSC был значительно меньше, чем у дисков AuC и 1: 1.* указывает на значительную разницу между группами клеток,% указывает на значительную разницу между группами клеток через 3 месяца, n = 8–9, P <0,05 ( D ) 1: 1 Полномасштабные конструкции уха AuC: MSC, сжатые по обеим длинам и ширина через 3 месяца in vivo . n = 7. Данные в (C) и (D) отображаются как среднее + SD.
https://doi.org/10.1371/journal.pone.0202356.g002
В то время как все конструкции были сокращены от начальных размеров, эксплантированные диски AuC и 1: 1 показали значительно лучшее сохранение высоты и диаметра конструкции по сравнению с дисками MSC.Все диски были созданы с высотой 2 мм и диаметром 8 мм. После эксплантации диски AuC и 1: 1 показали лучшее удерживание по высоте и диаметру диска по сравнению с дисками, содержащими только МСК (рис. 2С, P <0,05). Через 3 месяца диски AuC составили 71% и 57% от начальной высоты и диаметра, соответственно, тогда как диски 1: 1 составили 59% и 52%. Диски MSC показали крайнее сокращение до 34% и 26% от исходной высоты и диаметра диска через 3 месяца, что значительно больше, чем у групп AuC или 1: 1 ( P <0.05). Кроме того, высота всех дисков была ниже через 3 месяца по сравнению с 1 месяцем ( P <0,05). Точно так же конструкции уха 1: 1 испытывали сокращение во время созревания in vivo . Длина ушной конструкции, измеренная по оси спираль-долька, до имплантации составляла 4,6 мм. Ширина уха, измеренная по наибольшему измерению, перпендикулярному оси высоты [11], первоначально составляла 2,9 мм. Через 3 месяца in vivo длина и ширина полноразмерных ушных конструкций уменьшились на 54% и 52%, соответственно (рис. 2D), что было более серьезным, чем сокращение, наблюдаемое в ушах, ранее сформированных из бычьих клеток [11] .Несмотря на эти изменения в размерах, общая форма ушной раковины конструкции была сохранена, в частности такие важные особенности, как спиральный обод, антиспираль и долька.
Микроструктура ушного хряща в полноразмерных ушных раковинах человека
Основной проблемой при создании большого количества хряща является воспроизведение его биохимического состава и структуры. После оценки макроструктуры конструкции мы затем исследовали, отображают ли сконструированные ткани также микромасштабную структуру ушного хряща.Внеклеточный матрикс (ВКМ) хряща ушной раковины состоит в основном из коллагена, протеогликанов и специфической для эластичного хряща волокнистой эластиновой сети.
Спроектированные диски AuC, диски 1: 1 и конструкции уха 1: 1 показали микроструктуру ушного хряща, аналогичную нативной ткани через 3 месяца in vivo . Нативный человеческий ушной хрящ имел богатый коллагеном поверхностный слой перихондрия (рис. 3A), центральную богатую протеогликанами ткань, содержащую клеточные лакуны (рис. 3B), и плотную сеть эластиновых волокон, окружающих клетки и распространяющихся по всей ткани (рис. 3C). .Дисковые конструкции, содержащие AuC или комбинацию 1: 1, имели аналогичную структуру, включая формирование перихондриального слоя (рис. 3D и 3G), отложение протеогликанов и образование клеточных лакун (рис. 3E и 3H) и развитие эластинового волокна. сеть (рис. 3F и 3I). Для сравнения, на дисках МСК полностью отсутствует образование ушного хряща. Диски МСК были лишены протеогликанов (рис. 3K) или эластина (рис. 3L), и только фиброзный коллаген оставался через 3 месяца (рис. 3J), что указывает на ограниченное ремоделирование исходного коллагенового матрикса.Диски AuC и 1: 1 через 1 месяц показали образование перихондриальных слоев и отложение протеогликанов, хотя образование эластиновых волокон было ограниченным (S1 Рис.). Диски МСК через 1 месяц не показали развития хряща.
Рис. 3. Повторение микроструктуры ушного хряща.
Гистологическое окрашивание нативного ушного хряща человека ( A-C ), дисковых конструкций ( D-L ) и ушных конструкций ( M-R ) через 3 месяца in vivo .Окрашивание пикросириусом красным ( A, D, G, J, M, P ) показало образование перихондрия (ПК), состоящего из коллагеновых волокон по периметру AuC и 1: 1 диска и 1: 1 конструкций уха, аналогичных нативным. хрящ, в то время как диски МСК полностью состояли из фиброзного коллагена. Окрашивание сафранином О с контрастным окрашиванием Fast Green ( B, E, H, K, N, Q ) показало отложение протеогликана и образование клеточных лакун в AuC, а также в дисковых конструкциях 1: 1 и ушных конструкциях 1: 1, подобных нативному хрящу, без протеогликана. осаждение в дисках MSC.Окраска Верхоффа ( C, F, I, L, O, R ) показала образование сети созревающих эластиновых волокон (EF) в AuC и дисках 1: 1, подобных нативному хрящу, с менее зрелыми волокнами, появляющимися в соотношении 1: 1. ушные конструкции. В дисках МСК эластина не наблюдалось. Масштабная линейка = 100 мкм для ( A-O ) и 4 мм для ( P-R ).
https://doi.org/10.1371/journal.pone.0202356.g003
Полномасштабные ушные конструкции, содержащие 1: 1 комбинацию AuC и MSC, также через 3 месяца развили микроструктурные компоненты, очень похожие на нативный ушной хрящ, с доказательствами того, что здоровое развитие во всей ткани толщиной около 1 см.Конструкции ушей отличались богатым коллагеном перихондриальным слоем (рис. 3M) и окрашиванием протеогликанов клеточными лакунами (рис. 3N), сходными по структуре с нативной тканью, дисками AuC и конструкциями дисков 1: 1. Через 3 месяца in vivo конструкции уха 1: 1 демонстрировали окрашивание на образование эластиновых волокон, однако оно не было таким плотным, как нативный хрящ или конструкции меньшего размера (фиг. 30). Поскольку полные конструкции ушей были намного больше дисков, мы проанализировали полное поперечное сечение ушей.Конструкции уха продемонстрировали последовательное формирование фиброзного перихондриального слоя вокруг всего уха (рис. 3P). Окрашивание протеогликанов (рис. 3Q) и эластина (рис. 3R) было неоднородным по всей ткани.
Состав и механические свойства полноразмерных ушей соответствуют натуральным ушным хрящам
Ухо подвергается механической нагрузке в виде растяжения, сжатия и изгиба в нормальных физиологических условиях. Таким образом, очень важно продемонстрировать механические свойства и стабильность сконструированного ушного хряща, которые напрямую связаны с составом ECM ткани.Сконструированные конструкции были проанализированы на содержание ДНК, представляющее концентрацию клеток [28], и протеогликанов компонентов ЕСМ, измеренных с помощью сульфатированных гликозаминогликанов (ГАГ) [29], и коллагена и эластина, измеренных с помощью гидроксипролина [30,31]. Содержание ДНК было выше для всех сконструированных тканей по сравнению с нативным хрящом, хотя это различие не было значительным (S2 Фиг., P = 0,39). Состав воды значительно различается между конструкциями, при этом диски MSC значительно менее гидратированы через 3 месяца по сравнению с AuC или дисками 1: 1 или ушами 1: 1 (S2 Рис, P <0.05). Мы также измерили модуль равновесия и гидравлическую проницаемость ткани при ограниченном сжатии [23,32].
Моноклеточные диски AuC и комбинированные клеточные диски 1: 1 и уши показали содержание ГАГ, подобное нативному человеческому хрящу уха через 3 месяца in vivo . Диски AuC и диски 1: 1 генерировали значительно больше GAG, чем диски MSC (рис. 4A, P <0,001). Содержание ГАГ в AuC и 1: 1 дисках со временем увеличивалось, хотя статистической разницы между 1 и 3 месяцами не наблюдалось ( P = 0.13). Через 3 месяца диски AuC содержали 158% ГАГ нативного хряща предсердия, а диски 1: 1 содержали 125% нативного ГАГ. Однако диски МСК содержали только 15% ГАГ нативного хряща, что указывает на почти отсутствие хондрогенного потенциала изолированных стволовых клеток. Полномасштабные конструкции уха 1: 1 показали содержание ГАГ через 3 месяца, подобное AuC и дискам 1: 1, содержащее 76% от такового в собственном ушном хряще, которое существенно не отличалось (рис. 4A, P = 0.998).
Рис. 4. Состав и биомеханика хряща.
( A ) Отложение гликозаминогликанов (GAG) было значительно выше для дисков AuC и 1: 1 по сравнению с дисками MSC. Количество ГАГ в AuC и 1: 1 дисках через 3 месяца и 1: 1 ушных конструкциях было таким же, как в естественном ушном хряще человека. ( B ) Содержание гидроксипролина, представляющего как коллаген, так и эластин, было значительно ниже для дисков AuC и 1: 1 по сравнению с дисками MSC и аналогично для дисков AuC и 1: 1 через 3 месяца с конструкциями уха 1: 1 и нативным хрящом. .Для обоих (A) и (B) n = 6–9, и все данные нормированы на влажную массу ткани (ww). ( C ) Модуль равновесия был сходным для всех конструкций диска и уха по сравнению с естественным человеческим ушным хрящом. ( D ) Гидравлическая проницаемость для всех дисковых конструкций была аналогичной по сравнению с нативным хрящом, но была значительно выше для ушных конструкций 1: 1 по сравнению со всеми другими образцами. Для обоих (C) и (D) n = 2–4 † указывает на то, что трехмесячные образцы MSC были слишком малы для тестирования.Для всех данных сплошная серая линия указывает на естественный ушной хрящ человека, пунктирная серая линия указывает на ± одно стандартное отклонение, * указывает на значительную разницу в типе клеток и указывает на значительную разницу с диском AuC, диском 1: 1 и ухом 1: 1 при 3 месяцев, # указывает на существенное отличие от диска AuC (3 месяца), диска 1: 1 (3 месяца) и нативной ткани, P <0,05. Данные отображаются как среднее + одно стандартное отклонение. В это исследование не были включены конструкции уха 1: 1 1: 1.
https: // doi.org / 10.1371 / journal.pone.0202356.g004
После 3 месяцев имплантации содержание гидроксипролина в дисках AuC, 1: 1 дисках и 1: 1 ушах было аналогично нативному ушному хрящу. Диски AuC через 3 месяца содержали 104% гидроксипролина в нативном хряще, в то время как диски 1: 1 через 3 месяца содержали 79% от содержания гидроксипролина в нативном хряще (рис. 4B). Напротив, диски МСК, которые не смогли генерировать эластин или протеогликаны, содержали 257% нативного гидроксипролина через 3 месяца, что значительно выше, чем в других группах дисков ( P > 0.05). Более высокая концентрация гидроксипролина соответствует плотным коллагеновым волокнам, наблюдаемым в тканях диска МСК при гистологии (рис. 3J). Никаких различий во времени не наблюдалось ( P = 0,23). Конструкции ушей, содержащие соотношение клеток 1: 1, не демонстрировали существенно отличающееся содержание гидроксипролина от AuC или дисков 1: 1 ( P = 0,83, P = 0,99, соответственно). Конструкции уха содержали 61% гидроксипролина в нативном ушном хряще, что незначительно отличалось и могло быть результатом менее развитой эластиновой сети, присутствующей в этих тканях (рис. 4B, P = 0.94).
Модуль равновесия всех конструкций диска и уха был аналогичен модулю естественного хряща. Модуль равновесия существенно не различался между дисками AuC, 1: 1 и MSC ( P = 0,14), и никаких различий между временными точками не наблюдалось (рис. 4C, P = 0,41). Диски МСК через 1 месяц имели более низкие модули равновесия, чем другие конструкции дисков или нативный хрящ, но это различие не было значимым. Через три месяца после имплантации диски MSC сократились до диаметров менее 3 мм, как минимум для используемой камеры сжатия, и поэтому не могли быть механически оценены.Полномасштабные конструкции уха 1: 1 показали модули равновесия, которые существенно не отличались от AuC, конструкции дисков 1: 1 или нативного хряща (рис. 4C, P <0,74). В дополнение к ограниченному сжатию, общая гибкость всей конструкции уха была исследована путем изгиба. Сгибание конструкций вручную после объяснения продемонстрировало эластичные свойства сконструированных ушей 1: 1 (фильм S1).
ДискиAuC, 1: 1 и MSC показали гидравлическую проницаемость, аналогичную проницаемости нативного ушного хряща, в то время как уши 1: 1 были значительно больше.Гидравлическая проницаемость — это мера легкости, с которой вода движется через ткань, и показатель плотности протеогликановой сети. Гидравлическая проницаемость дисковых конструкций не показала значительных различий между временными точками (рис. 4D, P = 0,20), но значительно различалась между AuC и дисками 1: 1 ( P = 0,02). Все дисковые конструкции имели проницаемость в пределах 26% от естественного хряща. Полномасштабные ушные конструкции показали значительно более высокую гидравлическую проницаемость, чем диски или нативный ушной хрящ, с проницаемостью на 261% выше, чем у нативной ткани через 3 месяца in vivo (рис. 4D, P <0.05).
Обсуждение
Целью этого исследования было создание полномасштабного имплантата ушного хряща человека с использованием клеток, полученных из клинически доступного количества хряща донорского уха, путем использования человеческих МСК в дополнение к человеческим АУ. Данные этого исследования показывают, что сконструированные конструкции, изготовленные с использованием соотношения 1: 1 человеческих AuC и MSC, генерировали хрящ in vivo , который был эквивалентен нативному ушному хрящу и конструкциям, содержащим только AuC, тогда как конструкции, содержащие только MSC, не могли образовывать хрящевую ткань. .Основываясь на этих многообещающих результатах, мы создали полномасштабные конструкции уха, используя исключительно человеческие клетки в соотношении AuC: MSC 1: 1, которые генерировали нативный ушной хрящ после 3 месяцев подкожной имплантации.
В настоящее время одним из основных препятствий на пути внедрения крупномасштабной тканевой и органной инженерии в клинику является получение достаточного количества аутологичных клеточных компонентов. Наша предыдущая работа успешно продемонстрировала потенциал сочетания технологии CAD / CAM и литья под давлением с использованием коллагена высокой плотности для создания ушных раковин с тканевой инженерией, ориентированной на конкретного пациента [5,11].Однако трансляционное влияние этих исследований было ограничено использованием неонатального бычьего хряща в качестве источника клеток. Оптимальным клиническим источником клеток являются аутологичные AuC, выделенные либо из остатка микротического хряща [9,21,33], либо из недеформирующей биопсии контралатерального уха, дающей примерно 1 г эластичного хряща [34], аналогично тем, которые используются в эта учеба. Образцы такого размера предоставили ~ 10 миллионов клеток, аналогично предыдущим результатам [35], но все еще недостаточны для заполнения уха педиатрического размера, требующего> 200 миллионов клеток [5,11].Человеческие AuCs пролиферируют in vitro , но, как и другие хондроциты, могут дедифференцироваться при культивировании в монослое [2]. Расширение через третий проход, как здесь показано, обеспечило ~ 115 миллионов AuC, что составляет лишь половину потребности в человеческом ухе. Таким образом, существует потребность в альтернативном, клинически доступном источнике клеток для замены или дополнения AuC в инженерии ушного хряща.
Бремя приобретения большого количества AuCs может быть уменьшено путем комбинирования их с MSCs, которые легко доступны из костного мозга и увеличиваются до большого количества в культуре [14,15].Почти 40 исследований использовали МСК для клинического восстановления хряща, в первую очередь суставного [36]. Совместное культивирование МСК с суставными хондроцитами [19], фиброхондроцитами мениска [17,18] и клетками пульпозного ядра [20] привело к усилению развития хряща. Совместное культивирование и совместная имплантация МСК с AuC также была продемонстрирована с клетками животных [23,25] и гибридами клеток человека и животных [21,22]. Только одно предыдущее исследование совместной имплантации объединило как AuC, так и стволовые клетки человеческого происхождения, при совместной имплантации AuC со стволовыми клетками, полученными из жировой ткани [24].Подобно предыдущим исследованиям совместной имплантации, мы наблюдали сопоставимое образование ушного хряща между одноклеточными AuC и комбинированными клеточными имплантированными дисками, в то время как мы также продемонстрировали, что совместная имплантация человеческих клеток может быть расширена до полномасштабной конструкции уха.
Важно отметить, что это исследование продемонстрировало, что ушной хрящ, образованный в дисках 1: 1, был подобен по структуре, биохимическому развитию и механическим свойствам как дискам, содержащим 100% AuC, так и естественному человеческому ушному хрящу всего через 3 месяца in vivo .На основании этих исследований мы изготовили полноразмерные ушные конструкции, содержащие исключительно человеческие клетки, с использованием соотношения коимплантатов 1: 1. Гистологический анализ конструкции уха 1: 1 продемонстрировал образование ушного хряща in vivo , включая развитие ключевых структур, таких как перихондриальный слой, интерстиций, богатый протеогликанами, и образование клеточных лакун. Хотя эластиновая сеть не была так хорошо развита, как сеть дисковых конструкций через 3 месяца, появление ранних эластиновых волокон является критическим индикатором фенотипа ушного хряща.Уровень развития эластина также согласуется с результатами других исследований, в которых изучались полномасштабные инженерные конструкции уха с не 100% человеческими клеточными источниками в аналогичные моменты времени [7,23]. Что наиболее важно, конструкции уха 1: 1 имели биохимические и механические свойства, аналогичные естественным ушным хрящам.
По сравнению с другими исследованиями совместной имплантации ушного хряща, наша работа улучшила клеточную эффективность и продемонстрировала потенциал для долгосрочной стабильности сконструированного хряща.Предыдущие исследования были сосредоточены на увеличении соотношения МСК, используемых для дополнения AuC, с соотношением до 3: 7 AuC к МСК, образующим хрящ [24]. Однако для этих конструкций также требовалась начальная концентрация клеток 50 миллионов клеток / мл, что вдвое превышает плотность конструкций в настоящем исследовании. Полномасштабные конструкции уха, представленные здесь, требовали только 12,5 миллионов AuC / мл, меньше, чем 25 миллионов AuC / мл, необходимых для моноклеточных имплантатов [11], или 15 миллионов AuC / мл [24], достигаемых при других совместных имплантатах.В течение жизни хрящ ушной раковины не подвергается такой же механической нагрузке, как гиалиновый или фиброзный хрящ, но ушная раковина все еще подвергается деформации в виде изгиба, сжатия и растяжения. Инженерные конструкции также подвергаются натяжению кожи во время имплантации и развития. В отличие от предыдущих исследований совместной имплантации [22,24], это исследование дополнительно охарактеризовало сжимающие свойства сконструированного хряща, обнаружив, что ткань механически подобна естественному хрящу уха, и подвергло конструкции уха изгибу, при этом уши упруго возвращались в их первоначальное соответствие.Эти данные демонстрируют, что сконструированные конструкции остаются механически стабильными при механическом воздействии в течение периода развития in vivo и что они обладают достаточной жесткостью, чтобы выдерживать механическое воздействие после реконструкции.
Насколько нам известно, только одно предыдущее исследование объединило AuC и MSC для формирования ушной раковины [21], и ни одна группа ранее не сообщала об использовании как хондроцитов, так и стволовых клеток из человеческих источников для создания ушного хряща человека в форме уха. .Эти данные демонстрируют клиническую жизнеспособность источников клеток человека и каркаса коимплантата для изготовления тканевой инженерии ушной раковины. Мы выделили человеческие AuC из образцов ушного хряща весом менее 1 грамма, взятых у разнообразной популяции доноров, все из которых были расширены через три прохода без потери способности генерировать ушной хрящ in vivo . Напротив, предыдущие исследования показали, что увеличенные человеческие AuC неспособны генерировать хрящ in vivo при культивировании с первичными клетками или в среде, кондиционированной первичными клетками [37], и неспособны вырабатывать эластин при культивировании с сывороткой или без нее [34].Пеллетные культуры производных микротий AuC на P3 также демонстрировали снижение хондрогенного фенотипа во время культивирования in vitro [21]. Дисковые конструкции, содержащие только человеческие AuC на P3, в этом исследовании сформировали ткань, подобную нативному ушному хрящу, без необходимости лечения факторами роста во время размножения или культивирования in vitro . Однако диски, содержащие исключительно человеческие МСК, не смогли образовать ушной хрящ во время подкожной имплантации, что дополнительно подтверждает выводы о том, что формирование неокрящевой ткани и хондрогенная дифференцировка МСК в конструкции соимплантатов управляются включением AuC [23,24].
Процесс тканевой инженерии ушной раковины человека, описанный здесь, во многом соответствует современным клиническим методам восстановления очаговых дефектов суставного хряща, которые применялись в клинической практике в течение двух десятилетий. Первоначальные процедуры имплантации аутологичных хондроцитов (ACI), разработанные для лечения крупных дефектов, изолированных и культивированных аутологичных суставных хондроцитов перед их имплантацией в место повреждения пациенту [10]. Этот процесс был дополнительно усилен за счет посева или встраивания аутологичных клеток в мембрану или каркас, такой как коллаген, до имплантации, и сейчас он проходит клинические испытания в Соединенных Штатах и доступен клинически в Европе [10,38,39].Как и ACI, мы изолировали хондроциты из здорового хряща, затем увеличили эти хондроциты, прежде чем инкапсулировать их в коллагеновую матрицу и имплантировать полную конструкцию. Однако процесс формирования полноразмерного ушного имплантата требует значительно большего образования ткани по сравнению с ACI. В педиатрических предсердиях 1: 1 через 3 месяца образовалось ~ 5 мл хряща in vivo , что намного больше, чем 0,5–2 мл ткани, необходимой для заполнения больших дефектов суставной поверхности [40,41].Еще одно исследование создало ушную раковину аналогичного размера с использованием клинической биопсии ушного хряща в качестве исходного источника клеток, в результате чего была получена ткань со структурой ушного хряща после имплантации у 5 педиатрических пациентов [9]. Процесс создания конструкции потребовал 12-недельного периода культуры in vitro перед имплантацией, чтобы засеянные клетки прикрепились, проникли и расширились внутри синтетического полимерного каркаса, что значительно замедлило время доставки пациенту. Напротив, используя гидрогель коллагена высокой плотности с гомогенно инкапсулированными клетками, мы можем перейти непосредственно от создания конструкции к имплантации без необходимости длительного культивирования.Кроме того, клиническое применение метода совместной имплантации поддерживается растущим использованием МСК в клинических испытаниях восстановления суставного хряща, демонстрируя доступность и безопасность МСК для конструирования и регенерации хряща [42].
Хотя успешное создание ушного хряща в этом исследовании обнадеживает, некоторые ограничения все же необходимо устранить. Ушная раковина — это внешний орган, который направляет звук в слуховой проход, и деформация может привести к кондуктивной тугоухости [43].Кроме того, аномальный внешний вид, связанный с деформацией ушной раковины, может вызывать значительный психологический стресс у педиатрических пациентов [43]. Все конструкции дисков и ушей в этом исследовании показали значительное сокращение от исходных размеров во время подкожной имплантации, при этом диски показали большее уменьшение в размере по сравнению с аналогичными конструкциями, содержащими клетки бычьего происхождения [23]. Конструкции уха уменьшились почти до половины размера до имплантации, и это сокращение также могло способствовать потере некоторых специфичных для пациента морфологических деталей.Сокращение обычно наблюдается в засеянных клетками коллагеновых конструкциях [5,27,44], и с ним можно бороться несколькими способами. Возможные решения включают увеличение размеров исходных конструкций для учета сокращения или добавление сшивающего агента, такого как рибофлавин [44,45], который, как было продемонстрировано, снижает сокращение, не влияя на жизнеспособность клеток. Кроме того, культура in vitro конструкций перед имплантацией может позволить раннее созревание конструкции без воздействия сжатия или растяжения со стороны кожи.Было показано, что культивирование в условиях гипоксии увеличивает синтез протеогликана и коллагена типа II и увеличивает сшивание лизилоксидазой, что может улучшить начальные механические свойства и предотвратить дальнейшее сокращение [12,46–48].
Кроме того, имплантация на более длительные сроки и увеличенное количество образцов могут повысить значимость этого исследования. Эластиновая сеть для сконструированных дисков была не такой плотной через 3 месяца, как в нативной ткани. Однако волокна окрашивались намного сильнее, чем диски спустя всего 1 месяц in vivo , в то время как перихондриальный слой и протеогликаны уже были заметны в это время.Это соответствует медленному времени оборота эластина относительно других молекул матрикса [49], и эластиновые волокна могут развиваться дальше с увеличением времени in vivo . Конструкции уха 1: 1 показали гетерогенное отложение протеогликанов и эластина с более низким содержанием ГАГ по сравнению с нативной тканью хряща ушной раковины, что может быть результатом увеличения толщины ткани, ограничивающей диффузию и доступ к питательным веществам. Однако присутствие здоровых клеток в ткани и тенденция развития, наблюдаемая от 1 до 3 месяцев в дисковых конструкциях, указывает на то, что эти ткани могут генерировать больше ткани, богатой протеогликанами, со зрелыми эластиновыми волокнами с течением времени.Мы ранее наблюдали аналогичные результаты в долгосрочных исследованиях имплантации ушных конструкций, содержащих бычьи клетки, где к 6 месяцам уши имели микроструктуру ушного хряща по всей ткани [5,6]. Имплантации на более длительные сроки также важны для демонстрации стабильности этих тканевых ушей. Наконец, другие исследования совместной имплантации изучали до 1: 4 AuC к MSC для образования ушного хряща [21,22,24], хотя соотношение AuC 1: 9 к MSC не способствовало образованию хрящевой ткани [25].Успех конструкции 1: 1 в этом исследовании может распространяться на более низкие соотношения, что дает возможность более значительного добавления клинически доступных МСК.
Начиная с небольшого клинически значимого образца ушного хряща пациента, было выделено и размножено большое количество AuC без потери хондрогенного фенотипа. Затем они были объединены с МСК, которые можно получить у пациента с помощью минимально инвазивной хирургии. Объединив эти источники клеток, мы воссоздали ухо в форме человека, подходящее для конкретного пациента, из которого после имплантации образовался ушной хрящ человека.Результаты этого исследования демонстрируют возможность тканевой инженерии ушных раковин человека в качестве превосходного клинического варианта реконструкции ушной раковины.
Материалы и методы
Опытный образец
Это исследование было разработано для изучения гипотезы о том, что человеческие мезенхимальные стволовые клетки (МСК) могут быть объединены с человеческими ушными хондроцитами (AuC) для образования хрящевой ткани ушной раковины in vivo . Полноразмерные конструкции уха для детей были созданы с использованием комбинации AuC и MSC, чтобы продемонстрировать образование ткани в клинически значимом масштабе и сохранение эстетики человеческого уха после созревания.Цилиндрические дисковые конструкции были созданы и имплантированы в качестве суррогатов полноразмерных ушных конструкций для сравнения образования тканевых комбинаций клеток с одноклеточными конструкциями, включающими либо человеческие AuC, либо человеческие MSC. Образование ткани определялось общей морфологией, структурным, композиционным и механическим развитием. Размер образца для дисковых конструкций был основан на предыдущих исследованиях [23], а размер образца для ушных конструкций был основан на доступности хрящевой ткани человека. Сбор данных через 1 и 3 месяца имплантации был предопределен.Конструкции, осложненные раневой инфекцией или образованием серомы, исключались из анализа. Никакие выбросы не были исключены из анализа, но биохимические данные были преобразованы в квадратный корень, а данные гидравлической проницаемости были преобразованы в логарифмический журнал перед статистическим анализом. Для дисковых конструкций каждый образец тестировали один раз на биохимические и механические данные. Конструкции ушей были отобраны и протестированы по крайней мере в трех экземплярах на биохимические и механические данные. Ткань человеческого уха была получена у 3 отдельных пациентов для дисковых конструкций и у 5 отдельных пациентов для ушных конструкций с использованием одной исходной линии человеческих МСК для всех конструкций.Статистический анализ учитывал животное-хозяина как случайную переменную. В этом исследовании исследователи не были ослеплены.
Заявление об этике
Все процедуры по уходу за животными и экспериментальные процедуры соответствовали Руководству по уходу и использованию лабораторных животных [50] и были одобрены Комитетом по уходу и использованию животных Медицинского колледжа Weill Cornell (протокол № 2011–0036). Животных хранили в одобренном помещении для ксенотрансплантатов для животных с иммунодефицитом и содержали в прозрачных плексигласовых / вентилируемых ящиках с гранулированным кормом и водой, подаваемыми ad libitum.Перед операцией животных содержали вместе (по 3-4 на клетку), а затем поодиночке после имплантации. В помещении поддерживали температуру 21 ° C с 12-часовым циклом свет / темнота. Всем животным давали обогащение окружающей среды бумажной подстилкой и нейлоном. Остатки ушного хряща человека были получены доктором. Чарльз Торн и Джон Шерман на частной практике. Использованные образцы тканей не собирались для целей исследования и считались клиническими отходами. На основе консультации с Программой защиты исследований человека и отделом целостности исследований Weill Cornell Medicine было установлено, что использование этой ткани не считается исследованием на людях и не требует рассмотрения IRB.
Выделение и распространение хондроцитов предсердия человека
Человеческие ушные хондроциты были выделены на основе ранее описанных методов [11]. Вкратце, остатки ушного хряща от процедур отопластики были получены в Нью-Йорке и получены в Итаке, штат Нью-Йорк, в тот же день, что и хирургическое удаление (таблица S1). Хрящ ушной раковины отделяли от надхрящницы в стерильных условиях. Образцы хряща от группы пациентов фиксировали для гистологического окрашивания или замораживали для биохимических и механических анализов.Хрящ для экстракции хондроцитов разрезали на 1 мм 3 частей и расщепляли в течение ночи в 0,2% коллагеназе (Worthington Biochemicals Corp., Лейквуд, штат Нью-Джерси), 100 мкг / мл пенициллина и 100 мкг / мл стрептомицина в среде Игла, модифицированной Дульбекко (DMEM ) (MediaTech Inc., Манассас, Вирджиния).
AuC фильтровали, промывали 1x фосфатно-солевым буфером (PBS) (MediaTech) со 100 мкг / мл пенициллина и 100 мкг / мл стрептомицина и подсчитывали на следующий день. AuC высевали при плотности примерно 10000 клеток / см 2 и культивировали в среде DMEM, содержащей 10% фетальной бычьей сыворотки (FBS) (Gemini Bio-Products, Сакраменто, Калифорния), 100 мкг / мл пенициллина, 100 мкг / мл стрептомицина и 0 .1 мМ заменимых аминокислот при 5% pCO 2 и 37 ° C. AuC размножали через третий пассаж (P3), используя 0,25% трипсин (MediaTech) для высвобождения клеток между пассажами.
Расширение мезенхимальных стволовых клеток человека
Линия мезенхимальных стволовых клеток человека (Lot 0017, RoosterBio Inc., Frederick, MD) была увеличена при 5% pCO 2 и 37 ° C до уровня удвоения популяции 14-15. Клетки размножали в hBM-MSC High Performance Media (RoosterBio Inc.). MSC были выпущены с 0.25% трипсина и промывают PBS со 100 мкг / мл пенициллина и 100 мкг / мл стрептомицина между пассажами.
Изготовление гидрогелевой дисковой конструкции
Коллаген был извлечен и восстановлен, как описано ранее [51,52]. Во время изготовления исходный раствор коллагена доводили до pH 7,0 и поддерживали на уровне 300 мОсм путем смешивания с соответствующими объемами 1 н. NaOH (Sigma-Aldrich, Сент-Луис, Миссури), 10x PBS и 1x PBS, как описано ранее [26 ]. Раствор коллагена немедленно смешивали с клетками, суспендированными в PBS, и формировали дисковые конструкции, как описано ранее [17,23].Вкратце, суспензии клеток были сформированы с соотношениями AuC: MSC 1: 0, 1: 1 и 0: 1. Затем нейтрализованный коллаген гомогенно смешивали с суспензиями клеток до конечной концентрации клеток 25 × 10 6 клеток / мл и плотности коллагена 10 мг / мл. Гидрогель коллагена экструдировали между двумя стеклянными пластинами, расположенными на расстоянии 2 мм друг от друга, и позволяли подвергнуться термическому гелеобразованию при 37 ° C в течение 1 часа. После гелеобразования были сформированы дисковые конструкции диаметром 8 мм с использованием дермальной биопсии и помещены в ту же среду, которая использовалась для размножения клеток.Конструкции были имплантированы в течение 48 часов.
Изготовление конструкции уха для педиатрии
Детская ушная форма и ушные конструкции из коллагенового гидрогеля были сформированы, как описано ранее [11]. Вкратце, нейтрализованный раствор коллагена немедленно смешивали с суспензией клеток, содержащей AuC и MSC в соотношении 1: 1. Гидрогель коллагена с конечной концентрацией клеток 25 × 10 6 клеток / мл и плотностью коллагена 10 мг / мл вводили в ушные вкладыши и оставляли для термического гелеобразования при 37 ° C в течение 1 часа.После гелеобразования ушные конструкции извлекали из форм и культивировали в течение максимум 1 недели в среде, состоящей из DMEM, 10% FBS, 100 мкг / мл пенициллина, 100 мкг / мл стрептомицина и 0,1 мМ заменимых аминокислот до имплантация.
Имплантация и эксплантация конструкции
Дисковые конструкции имплантировали, как описано ранее [23]. Вкратце, 10-недельных самцов бестимусных голых мышей (NU / NU; Charles River, Wilmington, MA) массой 20-25 г анестезировали и готовили.На спине каждой мыши делали три разреза по 1 см для создания подкожного кармана, и один из дисков с соотношением AuC: MSC 1: 0, 1: 1 и 0: 1 имплантировали в каждый карман для каждой мыши. Животных умерщвляли через 1 или 3 месяца после имплантации. Диски собирали, взвешивали, визуализировали и измеряли окончательную высоту и диаметр. Репрезентативный набор образцов фиксировали в 10% нейтральном забуференном формалине на 48 часов и переносили в 70% этанол перед гистологическим анализом. Остальные были мгновенно заморожены в жидком азоте для биохимических и биомеханических анализов.Всего было извлечено 77 дисков (24 1: 0, 27 1: 1 и 26 0: 1 AuC: MSC). Имплантаты, осложненные образованием серомы, были исключены из анализов.
Конструкции ушей были имплантированы, как описано ранее [5,11]. Вкратце, 10-недельных самцов бестимусных голых крыс (RNU; Charles River, Wilmington, MA) массой 300–400 г анестезировали и готовили. Подкожный карман над спиной рассекали и имплантировали одну ушную конструкцию с соотношением клеток AuC: MSC 1: 1. Животных умерщвляли через 3 месяца после имплантации.Конструкции были собраны, взвешены, визуализированы, измерены и разделены пополам. Измерения конструкции были выполнены, как описано ранее [11]. Вкратце, длину измеряли по оси долька-спираль, а ширину определяли как наибольшее расстояние, измеренное перпендикулярно оси долька-спираль. Половину каждого образца фиксировали в 10% нейтральном забуференном формалине в течение 48 часов и переносили в 70% этанол перед гистологическим анализом. Остальное мгновенно замораживали в жидком азоте для биохимических и биомеханических анализов.Всего было извлечено 6 ушных конструкций. Имплантаты, осложненные образованием серомы, были исключены из анализов.
Всего в этом исследовании было задействовано 27 мышей и 8 крыс, все не подвергались воздействию наркотиков и не подвергались испытаниям. Не было никаких указаний на то, что животные испытывали проблемы с восстановлением после имплантации, а также у животных не было признаков болезни. За животными наблюдали ежедневно в течение первых 3 дней после имплантации, затем три раза в неделю до умерщвления. Ни одно животное не умерло без эвтаназии в результате экспериментальных процедур.И мышей, и крыс умерщвляли удушением CO 2 . Крысы также получили создание пневмоторакса. Анестезия вводилась внутрибрюшинно и состояла из коктейля кетамина и ксилазина, дозированных по весу, и обезболивания с помощью бупренорфина и мелоксикама, дозированных по весу. Кетамин / ксилазиновый коктейль был выбран, чтобы обеспечить достаточно времени для хирургических процедур с ограниченными побочными эффектами, и вводился для быстрого начала. Дозировка для мышей составляла 80–100 мг / кг IP (кетамин) и 10–12,5 мг / кг IP (ксилазин.Дозировка для крыс составляла 40–100 мг / кг IP (кетамин) и 5–13 мг / кг IP (ксилазин). Во время операции у животных наблюдались видимые признаки дистресса, включая учащенное дыхание, мигательный рефлекс или реакцию на защемление пальца и хвоста. Если уровень анестезии был недостаточным, давалась бустерная доза, равная половине первоначального количества, и животное повторно оценивалось. Жизненно важные показатели и состояние животных регистрировались в анестезиологическом журнале каждые 15 минут. Хирургическая подготовка включала бритье и приготовление с использованием бетадина и спирта.Продолжительность операции составила около 30 минут. Операции проводились во второй половине дня в кабинете биобезопасности в комнате для ксенотрансплантатов, контролируемой для животных с повышенными потребностями в стерильности. Швы сняты через 11 дней после операции.
Гистологические анализы
Фиксированные образцы обезвоживали последовательными промывками в этаноле, заливали парафином и разрезали на срезы 5 мкм. Срезы окрашивали Safranin O / Fast green для оценки распределения протеогликанов, Picrosirius red для оценки организации коллагена и Verhoeff’s / Van Gieson для оценки присутствия эластиновых волокон.Изображения были получены в ярком поле при 100x, 200x и 400x с использованием микроскопа Nikon Eclipse TE2000-S (Nikon Instruments, Мелвилл, Нью-Йорк), оснащенного камерой SPOT RT (Diagnostic Instruments, Sterling Heights, MI). Сканы 1: 1 полных конструкций уха также были сделаны с использованием Aperio ScanScope CS2 при 20-кратном увеличении (Leica Biosystems Inc, Buffalo Grove, IL).
Биохимические анализы
Биохимические анализы были выполнены, как описано ранее [53]. Вкратце, были собраны полные диски для дисковых конструкций или три образца, взятые из каждого уха для полноразмерных конструкций уха.Также были собраны и проанализированы образцы остатков ушного хряща человека. Образцы взвешивали, замораживали, лиофилизировали и снова взвешивали. Затем образцы обрабатывали раствором 1,25 мг / мл папаина (Sigma-Aldrich) в течение ночи при 60 ° C и анализировали на содержание ДНК с помощью анализа ДНК Hoechst [28], содержание сульфатированного гликозаминогликана (GAG) с помощью модифицированного 1,9-диметилметиленового синего. (DMMB) [29], а коллаген и эластин — с помощью гидроксипролина [30,31]. Биохимические свойства приведены в норме по сырому весу образца (WW).
Механический анализ
Цилиндры диаметром три мм и высотой один мм были вырезаны из центральной части каждой конструкции диска, или три образца были взяты из каждой конструкции уха с использованием пробойников для кожной биопсии. Цилиндры были взяты также из остатков ушного хряща человека. Испытания на ограниченное сжатие были выполнены, как описано ранее [23,32]. Вкратце, образцы размораживали в PBS, содержащем ингибиторы протеаз (Roche Diagnostics, Indianapolis, IN), и помещали в цилиндрическую ограничивающую камеру, установленную в испытательной раме ELF 3200 (Enduratec, Eden Prarie, MN).Образцы были сжаты до 50% от их исходной высоты за 10 шагов по 50 мкм каждый, с 5-минутным перерывом между шагами, чтобы обеспечить полное расслабление напряжений. Результирующие напряжения регистрировались с частотой 1 Гц, а временные профили напряжения соответствовали пороупругой модели поведения ткани с использованием специального кода MATLAB (MathWorks, Natick, MA) для расчета модуля равновесия и гидравлической проницаемости [53].
Статистический анализ
Весь статистический анализ был выполнен с использованием RStudio (RStudio, Бостон, Массачусетс).Данные расширения AuC анализировали с помощью однофакторного дисперсионного анализа рангов с попарным множественным сравнением по методу Данна. Сконструированные дисковые конструкции анализировали с использованием модели смешанного эффекта со случайными (мышь) и фиксированными (время, группа клеток) эффектами с помощью апостериорного теста Тьюки. Условие взаимодействия с фиксированным эффектом было удалено, когда оно не значимо, чтобы упростить модель. Дисковые конструкции через 3 месяца также сравнивали с полными ушными конструкциями через 3 месяца и естественным ушным хрящом человека с помощью однофакторного дисперсионного анализа с апостериорным тестом Тьюки.Все данные представлены как среднее плюс одно стандартное отклонение. Значения P <0,05 считаются статистически значимыми.
Дополнительная информация
S1 Рис. Спроектированная микроструктура ушного хряща через 1 месяц.
Гистологическое окрашивание сконструированных дисковых конструкций, содержащих отношения AuC: MSC 1: 0 ( A-C ), 1: 1 ( D-L ) и 0: 1 ( M-O ) через 1 месяц in vivo . Окрашивание пикросириусом красным ( A, D, G ) показало образование перихондрия (ПК), состоящего из коллагеновых волокон по периметру AuC и дисков 1: 1, в то время как диски МСК состояли из волокнистого коллагена по всему периметру.Окрашивание сафранином O контрастным окрашиванием Fast Green ( B, E, H ) показало отложение протеогликана и образование клеточных лакун в дисках AuC и 1: 1 без отложения протеогликанов в дисках МСК. Окраска Верхоффа ( C, F, I ) показала ограниченное образование эластичных волокон (EF) в дисках AuC, в то время как диски 1: 1 и MSC не показали эластиновых волокон через 1 месяц. Масштабная линейка = 100 мкм.
https://doi.org/10.1371/journal.pone.0202356.s001
(TIF)
S2 Рис.Сконструированная хрящевая вода и клеточное содержимое.
( A ) Содержание ДНК, представляющее клеточное содержимое ткани, существенно не различалось между дисковыми конструкциями, а также между дисками и конструкциями полного уха из нативного человеческого уха. Содержание ДНК нормализовали по сырому весу ткани (ww). ( B ) Содержание воды было значительно выше для дисков AuC и 1: 1 по сравнению с дисками MSC. Через 3 месяца гидратация дисков МСК была значительно меньше, чем у других конструкций дисков и конструкций полного уха, но конструкции существенно не отличались от нативного ушного хряща.Для всех данных n = 6–9, сплошная серая линия указывает на естественный человеческий ушной хрящ, пунктирная серая линия указывает на ± одно стандартное отклонение, * указывает на значительную разницу в типе клеток, & указывает на значительную разницу с диском AuC, диском 1: 1 и 1: 1 ухо в 3 месяца, P <0,05. Данные отображаются как среднее + одно стандартное отклонение. В это исследование не были включены конструкции уха 1: 1 1: 1.
https://doi.org/10.1371/journal.pone.0202356.s002
(TIF)
Благодарности
Мы благодарим докторов наук.Кэтрин Хадсон и Мэри Клэр МакКорри за советы по использованию стволовых клеток, докторам. Чарльзу Торну и Джону Шерману за помощь в получении образцов ушного хряща человека, Статистическому консалтинговому отделу Корнелла (CSCU) за консультации по статистическому анализу и отделу патологии стволовых клеток для услуг Scanscope (грант NYSTEM C029155).
Ссылки
- 1. Cao Y, Vacanti JP, Пейдж К.Т., Аптон Дж., Vacanti CA. Трансплантация хондроцитов с использованием конструкции полимер-клетки для производства тканевого хряща в форме человеческого уха.Plast Reconstr Surg. 1997; 100: 297–302. pmid: 9252594
- 2. Анджела Р., Цао Ю.Л., Клементе И., Пап С., Ваканти М., Иви Р.Д. и др. Характеристики хряща, созданного из хряща ушной раковины человека. Plast Reconstr Surg. 1999; 103: 1111–1119. pmid: 10088494
- 3. Шие С, Терада С, Vacanti JP. Тканевая инженерия реконструкция ушной раковины: исследования in vitro и in vivo. Биоматериалы. 2004. 25: 1545–1557. pmid: 14697857
- 4. Бичара Д.А., О’Салливан Н.А., Померанцева И., Чжао Х, Сундбэк КА, Vacanti JP, et al.Ушная раковина с тканевой инженерией: прошлое, настоящее и будущее. Tissue Eng Часть B Ред. 2012; 18: 51–61. pmid: 21827281
- 5. Коэн Б.П., Хупер Р.К., Пютцер Дж. Л., Нордберг Р., Асанбе О., Эрнандес К. А. и др. Долговременная морфологическая и микроархитектурная стабильность ткане-инженерных, специфичных для пациента ушных раковин in vivo. Tissue Eng Часть A. 2016; 22: 461–468. pmid: 26847742
- 6. Ляо Х.Т., Чжэн Р., Лю В., Чжан В.Дж., Цао Й., Чжоу Г. Конструирование сборных ушных хрящевых тканей с помощью свиной хондроцитарной мембраны без каркасов.Plast Reconstr Surg. 2015; 135: 313–321.
- 7. Zhou L, Pomerantseva I, Bassett EK, Bowley CM, Zhao X, Bichara DA, et al. Инженерные конструкции ушей с композитным каркасом для сохранения размеров. Tissue Eng Часть A. 2011; 17: 1573–1581. pmid: 21284558
- 8. Камил С.Х., член парламента от Vacanti, Аминуддин Б.С., Джексон М.Дж., Vacanti CA, Eavey RD. Тканевая инженерия ушной раковины человеческого размера и формы с использованием формы. Ларингоскоп. 2004. 114: 867–870. pmid: 15126746
- 9.Чжоу Г., Цзян Х., Инь З., Лю И, Чжан К., Чжан С. и др. Регенерация ушного хряща, характерного для пациента, in vitro и ее первое клиническое применение для реконструкции ушной раковины. EBioMedicine. Elsevier B.V; 2018; pmid: 29396297
- 10. Бриттберг М. Клеточные носители как новое поколение клеточной терапии для восстановления хряща: обзор процедуры имплантации аутологичных хондроцитов, индуцированной матрицей. Am J Sports Med. 2010; 38: 1259–1271. pmid: 19966108
- 11.Reiffel AJ, Kafka C, Hernandez KA, Popa S, Perez JL, Zhou S и др. Высокоточная тканевая инженерия ушных раковин для конкретных пациентов для реконструкции детской микротии и других деформаций ушной раковины. PLoS One. 2013; 8: e56506. pmid: 23437148
- 12. Domm C, Schünke M, Christesen K, Kurz B. Повторная дифференцировка дедифференцированных суставных хондроцитов крупного рогатого скота в альгинатной культуре при низком давлении кислорода. Osteoarthr Cartil. 2002; 10: 13–22. pmid: 11795979
- 13.Питтенгер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Д.Д. и др. Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека. Наука (80-). 1999; 284: 143–147.
- 14. Маккей А.М., Бек СК, Мерфи Дж.М., Барри Ф.П., Чичестер Колорадо, Питтенгер М.Ф. Хондрогенная дифференцировка культивируемых мезенхимальных стволовых клеток человека из костного мозга. Tissue Eng. 1998. 4: 415–28. pmid: 9916173
- 15. Каплан А.И., Деннис Дж. Э. Мезенхимальные стволовые клетки как трофические медиаторы.J Cell Biochem. 2006; 98: 1076–84. pmid: 16619257
- 16. Хендрикс Дж., Рисле Дж., Ван Блиттерсвейк, Калифорния. Совместное культивирование в инженерии хрящевой ткани. J Tissue Eng Regen Med. 2007; 1: 170–178. pmid: 18038408
- 17. McCorry MC, Puetzer JL, Bonassar LJ. Характеристика мезенхимальных стволовых клеток и фиброхондроцитов в трехмерной совместной культуре: анализ формы клеток, продукции матрикса и механических характеристик. Stem Cell Res Ther. Исследование стволовых клеток и терапия; 2016; 7: 39.pmid: 26971202
- 18. McCorry MC, Bonassar LJ. Развитие волокна и производство матрикса в тканеинженерных менисках с использованием мезенхимальных стволовых клеток крупного рогатого скота и фиброхондроцитов. Connect Tissue Res. Тейлор и Фрэнсис; 2016; 0: 1–13. pmid: 27925474
- 19. Меретоя В. В., Далин Р. Л., Каспер Ф. К., Микос АГ. Усиление хондрогенеза в совместных культурах с суставными хондроцитами и мезенхимальными стволовыми клетками. Биоматериалы. 2012; 33: 6362–9. pmid: 22695067
- 20.Ямамото Й., Мочида Дж., Сакаи Д., Накаи Т., Нисимура К., Кавада Х. и др. Повышение жизнеспособности клеток пульпозного ядра с помощью стромальных клеток костного мозга: значение прямого межклеточного контакта в системе сокультивирования. Позвоночник (Phila Pa 1976). 2004; 29: 1508–14.
- 21. Zhang L, He A, Yin Z, Yu Z, Luo X, Liu W и др. Биоматериалы Регенерация хряща в форме уха человека путем совместного культивирования хондроцитов микротия человека с BMSC. Биоматериалы. 2014; 35: 4878–4887.
- 22. Pleumeekers MM, Nimeskern L, Koevoet WLM, Karperien M, Stok KS, van Osch GJVM. Регенерация хряща в области головы и шеи: сочетание ушных или носовых хондроцитов и мезенхимальных стволовых клеток улучшает производство хряща. Plast Reconstr Surg. 2015; 136: 762e – 74e. pmid: 26267395
- 23. Моррисон К.А., Коэн Б.П., Асанбе О, Донг Х, Харпер А., Бонассар Л.Дж. и др. Оптимизация источников клеток для клинического перевода ушей, созданных тканевой инженерией. Биофабрикация.IOP Publishing; 2016; 9: 15004. pmid: 27917821
- 24. Цай З., Пан Б., Цзян Х., Чжан Л. Хондрогенез стволовых клеток, полученных из жировой ткани, путем совместного трансплантата in vivo с аурикулярными хондроцитами из микротии. Эстетическая Пласт Сург. Springer US; 2015; 39: 431–439. pmid: 25861768
- 25. Кан Н, Лю X, Гуань Y, Ван Дж, Гонг Ф, Ян X и др. Влияние совместного культивирования BMSC и хондроцитов предсердия на модуль упругости и гипертрофию тканевого хряща.Биоматериалы. Elsevier Ltd; 2012; 33: 4535–4544. pmid: 22440049
- 26. Cross VL, Zheng Y, Won Choi N, Verbridge SS, Sutermaster BA, Bonassar LJ и др. Плотные коллагеновые матрицы типа I, которые поддерживают клеточное ремоделирование и микротехнологию для исследований ангиогенеза и васкулогенеза опухоли in vitro. Биоматериалы. 2010. 31: 8596–8607. pmid: 20727585
- 27. Puetzer JL, Bonassar LJ. Коллагеновые гели высокой плотности типа I для тканевой инженерии целых менисков.Acta Biomater. Acta Materialia Inc .; 2013; 9: 7787–7795. pmid: 23669622
- 28. Ким Й.Дж., Сах Р.Л., Дун Дж.Й., Гродзинский А.Дж. Флуорометрический анализ ДНК в эксплантатах хряща с использованием Hoechst 33258. Anal Biochem. 1988. 174: 168–176. pmid: 2464289
- 29. Энобахаре Б.О., Бадер Д.Л., Ли Д.А. Количественное определение сульфатированных гликозаминогликанов в культурах хондроцитов / альгинатов с использованием 1,9-диметилметиленового синего. Анальная биохимия. 1996; 243: 189–191. pmid: 8954546
- 30.Нойман Р. Э., Логан М. А.. Определение коллагена и эластина в тканях. J Biol Chem. 1950; 186: 549–556. pmid: 14794650
- 31. Нойман Р. Э., Логан М. А.. Определение гидроксипролина. J Biol Chem. 1950; 184: 299–306. pmid: 15421999
- 32. Chang SCN, Rowley JA, Tobias G, Genes NG, Roy AK, Mooney DJ и др. Литье хондроцитов / альгинатных конструкций в форме лицевых имплантатов. J Biomed Mater Res. 2001; 55: 503–511. pmid: 11288078
- 33.бин Исхак М.Ф., см. Г.Б., Хуэй К.К., бин Абдулла А., бин Саим Л., бин Саим А. и др. Формирование ушного хряща человека из микроткани: исследование in vivo. Int J Pediatr Otorhinolaryngol. Elsevier Ireland Ltd; 2015; 79: 1634–1639. pmid: 26250439
- 34. Ван Ош GJVM, Мандл Э.В., Яр Х., Коевет В., Нолст-Трените Г, Верхаар Дж. Н. Соображения по использованию ушных хондроцитов в качестве донорских хондроцитов для инженерии хрящевой ткани. Биореология. 2004; 41: 411–21. Доступно: http: // www.ncbi.nlm.nih.gov/pubmed/15299273 pmid: 15299273
- 35. Saadeh PB, Brent B, Mehrara BJ, Steinbrech DS, Ting V, Gittes GK, et al. Инженерия хряща человека: извлечение хондроцитов, пролиферация и характеристика для развития конструкции. Ann Plast Surg. 1998. 42: 509–513.
- 36. Baugé C, Boumédiene K. Использование взрослых стволовых клеток для инженерии хрящевой ткани: текущее состояние и будущие разработки. Stem Cells Int. 2015; Идентификатор статьи 438026 Обзор. pmid: 26246809
- 37.Ценг А., Померанцева И., Кронсе М.Дж., Кимура А.М., Невилл С.М., Рэндольф М.А. и др. Обширно расширенные аурикулярные хондроциты образуют неокрящевую ткань in vivo. Хрящ. 2014; 5: 241–251. pmid: 26069703
- 38. Миддендорф Дж. М., Гриффин Д. Д., Шорткрофф С., Дугопольски С., Кеннеди С., Семяткоски Дж. И др. Механические свойства и взаимосвязь между структурой и функцией хрящевых конструкций, засеянных хондроцитами человека, после культивирования in vitro. J Orthop Res. 2017; 1–9. pmid: 28169453
- 39.Энеа Д., Чеккони С., Бусилакки А., Манзотти С., Джезуита Р., Гиганте А. Матрично-индуцированная имплантация аутологичных хондроцитов (MACI) в колено. Хирургия коленного сустава, Sport Traumatol Arthrosc. 2012; 20: 862–869. pmid: 21837476
- 40. Пастух ДЭТ, Сидхом ББ. Толщина суставного хряща человека в суставах нижней конечности. Ann Rheum Dis. 1999. 58: 27–34. pmid: 10343537
- 41. Basad E, Wissing FR, Fehrenbach P, Rickert M, Steinmeyer J, Ishaque B. Матрично-индуцированная имплантация аутологичных хондроцитов (MACI) в колено: клинические результаты и проблемы.Хирургия коленного сустава, Sport Traumatol Arthrosc. Springer Berlin Heidelberg; 2015; 23: 3729–3735. pmid: 25218576
- 42. Ли В.Й., Ван Б. Восстановление хряща мезенхимальными стволовыми клетками: обновление клинических испытаний и перспективы. J Orthop Transl. Elsevier Ltd; 2017; 9: 76–88. pmid: 29662802
- 43. Люкетти Д. В., Хайке С. Л., Хинг А. В., Каннингем М. Л., Кокс ТС. Микротия: эпидемиология и генетика. Am J Med Genet A. 2012; 158A: 124–139. pmid: 22106030
- 44. Ибусуки С., Халбесма Г.Дж., Рэндольф Ма, Редмонд Р.В., Кочевар И.Е., Джилл Т.Дж..Фотохимически сшитые коллагеновые гели в качестве трехмерных каркасов для тканевой инженерии. Tissue Eng. 2007; 13: 1995–2001. pmid: 17518705
- 45. Grunert P, Borde BH, Towne SB, Moriguchi Y, Hudson KD, Bonassar LJ, et al. Сшитый рибофлавином коллагеновый гель высокой плотности для восстановления кольцевых дефектов межпозвонковых дисков: исследование in vivo. Acta Biomater. Acta Materialia Inc .; 2015; 26: 215–224. pmid: 26116448
- 46. Schrobback K, Klein TJ, Crawford R, Upton Z, Malda J, Leavesley DI.Влияние кислорода и культуральной системы на размножение in vitro и повторную дифференцировку суставных хондроцитов человека, страдающих остеоартритом. Cell Tissue Res. 2012; 347: 649–663. pmid: 21638206
- 47. Markway BD, Cho H, Johnstone B. Гипоксия способствует повторной дифференцировке и подавляет маркеры гипертрофии и дегенерации как в здоровых, так и в остеоартрозных хондроцитах. Arthritis Res Ther. БиоМед Централ Лтд; 2013; 15: R92. pmid: 23965235
- 48. Макрис Е.А., Responte DJ, Пашос Н.К., Ху Дж.С., Атанасиу К.А.Развитие функциональных скелетно-мышечных тканей посредством гипоксии и индуцированного лизилоксидазой образования перекрестных связей коллагена. Proc Natl Acad Sci. 2014; 111: E4832 – E4841. pmid: 25349395
- 49. Mithieux BSM, Weiss AS. Эластин. Adv Protein Chem. 2006; 70: 437–461.
- 50. Комитет по исследованию лабораторных животных. Руководство по уходу и использованию лабораторных животных: восьмое издание. Руководство по уходу и использованию лабораторных животных. Вашингтон, округ Колумбия: Пресса национальных академий; 2011 г.п. 118.
- 51. Элсдейл Т., Бард Дж. Коллагеновый субстрат для исследований клеточного поведения. J Cell Biol. 1972; 54: 626–637. pmid: 4339818
- 52. Боулз Р. Д., Уильямс Р. М., Зипфель В. Р., Бонассар Л. Дж.. Самосборка выровненного тканеинженерного композита фиброзного кольца и межпозвоночного диска посредством сокращения коллагенового геля.


 В рамках операции хирургу удается придать раковинам более привлекательный внешний вид. Такое вмешательство назначается при желании самого пациента скорректировать внешние недостатки
В рамках операции хирургу удается придать раковинам более привлекательный внешний вид. Такое вмешательство назначается при желании самого пациента скорректировать внешние недостатки Цена на пластику ушных раковин (отопластику) в Санкт-Петербурге не завышается нами. Это позволяет обращаться за помощью всем категориям пациентов
Цена на пластику ушных раковин (отопластику) в Санкт-Петербурге не завышается нами. Это позволяет обращаться за помощью всем категориям пациентов
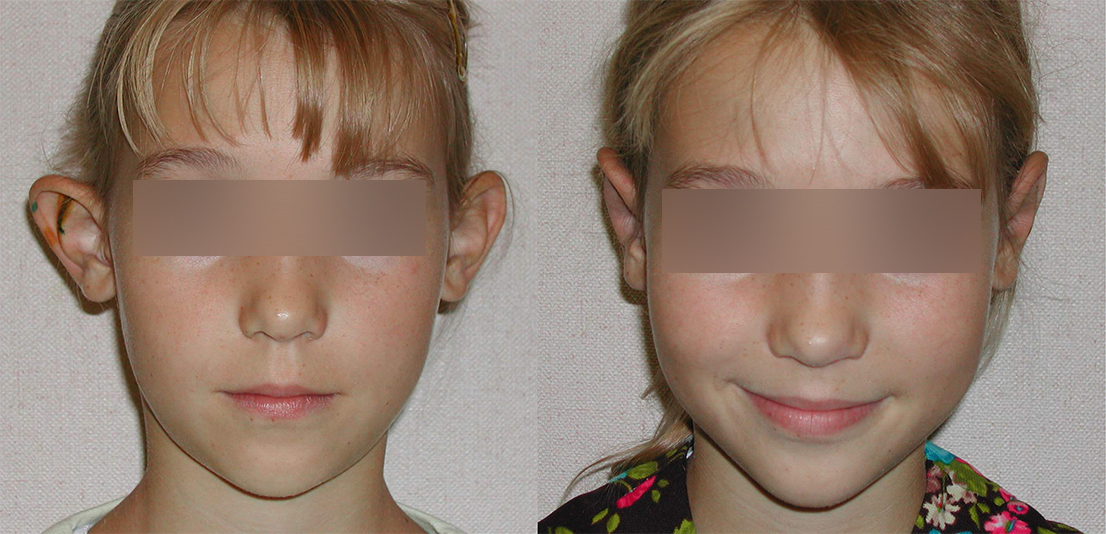
 Они легко снимаются приемом анальгетиков;
Они легко снимаются приемом анальгетиков;