Из ребенка во взрослого: что нужно знать родителям о пубертатном периоде
https://ria.ru/20210119/pubertat-1593744376.html
Из ребенка во взрослого: что нужно знать родителям о пубертатном периоде
Из ребенка во взрослого: что нужно знать родителям о пубертатном периоде — РИА Новости, 20.01.2021
Из ребенка во взрослого: что нужно знать родителям о пубертатном периоде
Пубертатный период — это этап жизни человека, во время которого происходит половое созревание. Об изменениях тела и «кризисе перехода» — в материале РИА… РИА Новости, 20.01.2021
2021-01-19T20:30
2021-01-19T20:30
2021-01-20T09:06
общество
подростки
здоровье — общество
россия
детские вопросы
социальный навигатор
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e5/01/13/1593741779_0:257:3072:1985_1920x0_80_0_0_3278212bf5b65beac064632b988e4aea.jpg
МОСКВА, 19 янв — РИА Новости. Пубертатный период — это этап жизни человека, во время которого происходит половое созревание. Об изменениях тела и «кризисе перехода» — в материале РИА Новости. Что такое пубертатВо время пубертатного периода, который в среднем начинается с 9-10 лет у девочек и с 10-11 у мальчиков, организм сталкивается с физиологическими и психическими изменениями, способствующими наступлению половой и физической зрелости. Мозг посылает сигнал, который поступает к яичникам у девочек и семенникам у мальчиков, при этом вырабатываются гормоны, ускоряющие рост тела, развитие мозга и организма, а также работу репродуктивной системы. У женского пола пубертат начинается раньше, чем у мужского. В 46% случаев у девочек-подростков половое созревание наступает в том же возрасте, что и у их матерей. Что происходит с подростковым теломУ человека период созревания делится на три фазы:Также во время пубертата у мальчиков-подростков «ломается» голос, увеличивается мышечная масса, изменяется телосложение, плечи и челюсти растут быстрее.
Пубертатный период — это этап жизни человека, во время которого происходит половое созревание. Об изменениях тела и «кризисе перехода» — в материале РИА Новости. Что такое пубертатВо время пубертатного периода, который в среднем начинается с 9-10 лет у девочек и с 10-11 у мальчиков, организм сталкивается с физиологическими и психическими изменениями, способствующими наступлению половой и физической зрелости. Мозг посылает сигнал, который поступает к яичникам у девочек и семенникам у мальчиков, при этом вырабатываются гормоны, ускоряющие рост тела, развитие мозга и организма, а также работу репродуктивной системы. У женского пола пубертат начинается раньше, чем у мужского. В 46% случаев у девочек-подростков половое созревание наступает в том же возрасте, что и у их матерей. Что происходит с подростковым теломУ человека период созревания делится на три фазы:Также во время пубертата у мальчиков-подростков «ломается» голос, увеличивается мышечная масса, изменяется телосложение, плечи и челюсти растут быстрее. У девушек под влиянием эстрогенов бедра становятся шире, нарастает жировая ткань в области плечевого пояса, молочных желез, ягодиц, лобка. Подросток — это кто?Пубертат означает изменения, которые касаются физических признаков взросления. Для социальных, культурных аспектов чаще применяется термин «подростковый период». Некоторые исследователи полагают, что он начинается с 12 лет и заканчивается в 17, однако Всемирная организация здравоохранения называет цифры с 10 до 19 лет. Подростковый возраст — это переходный этап между ребенком и взрослым. Что такое «кризис перехода»В период взросления подростки сталкиваются с кризисом юности, который предполагает психологическую, эмоциональную и социальную перестройку. «Кризис перехода» — это этап перехода человека из статуса ребенка в статус взрослой личности внутри определенного социума. В этот период личность лишается определенных привилегий и ограничений и получает ряд обязанностей и прав. Из-за этого у подростка возникает сильный внутренний кризис в вопросе своей роли.
У девушек под влиянием эстрогенов бедра становятся шире, нарастает жировая ткань в области плечевого пояса, молочных желез, ягодиц, лобка. Подросток — это кто?Пубертат означает изменения, которые касаются физических признаков взросления. Для социальных, культурных аспектов чаще применяется термин «подростковый период». Некоторые исследователи полагают, что он начинается с 12 лет и заканчивается в 17, однако Всемирная организация здравоохранения называет цифры с 10 до 19 лет. Подростковый возраст — это переходный этап между ребенком и взрослым. Что такое «кризис перехода»В период взросления подростки сталкиваются с кризисом юности, который предполагает психологическую, эмоциональную и социальную перестройку. «Кризис перехода» — это этап перехода человека из статуса ребенка в статус взрослой личности внутри определенного социума. В этот период личность лишается определенных привилегий и ограничений и получает ряд обязанностей и прав. Из-за этого у подростка возникает сильный внутренний кризис в вопросе своей роли.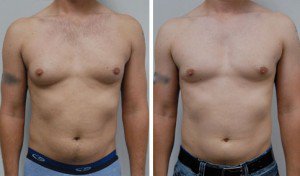 Это выливается в подростковый бунт, отрицание и сложное социальное поведение. Для успешного прохождения данного кризиса родителям важно вводить четкие условия прав и обязанностей для подростка начиная с 8-10 лет. У ребенка должны формироваться четкие границы переходов, и понимание, где заканчивается попечительство и начинается ответственность и привилегии свободы. Эти правила должны быть однозначны как для подростка, так и для родителей, а не меняться от настроения или обстоятельств. Тогда подросток научится нести ответственность за себя и пользоваться своими правами, а также обретет уверенность в своем статусе через признание родителей», — порекомендовал Станислав Иванов. Физический ростНа период полового созревания приходится самый активный рост тела. У девочек он начинается с 10-11 лет, а мальчиков позже — после 14-ти. На этот процесс воздействует гормон соматотропин, который вызывает деление клеток в организме, за счет чего он увеличивается в размерах. На то, какого роста будет человек, влияет, в основном, генетика.
Это выливается в подростковый бунт, отрицание и сложное социальное поведение. Для успешного прохождения данного кризиса родителям важно вводить четкие условия прав и обязанностей для подростка начиная с 8-10 лет. У ребенка должны формироваться четкие границы переходов, и понимание, где заканчивается попечительство и начинается ответственность и привилегии свободы. Эти правила должны быть однозначны как для подростка, так и для родителей, а не меняться от настроения или обстоятельств. Тогда подросток научится нести ответственность за себя и пользоваться своими правами, а также обретет уверенность в своем статусе через признание родителей», — порекомендовал Станислав Иванов. Физический ростНа период полового созревания приходится самый активный рост тела. У девочек он начинается с 10-11 лет, а мальчиков позже — после 14-ти. На этот процесс воздействует гормон соматотропин, который вызывает деление клеток в организме, за счет чего он увеличивается в размерах. На то, какого роста будет человек, влияет, в основном, генетика.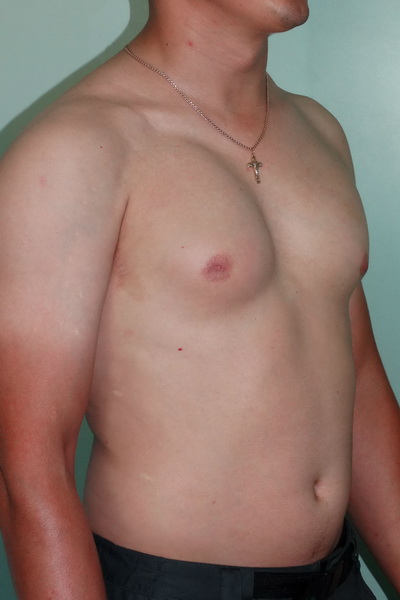 Активный рост завершается в возрасте 16-18 лет у женского пола и до 18-ти — у мужского. Половое созреваниеНа протекание созревания наибольшее влияние оказывает характер питания, а также условия, в которых человек развивается. В этом возрасте крайне важно, чтобы организм получал все необходимые витамины и минералы, а в рационе были жиры, белки, клетчатка и углеводы с низким гликемическим индексом. Все это помогает укреплению мышц и нормальному развитию. В некоторых случаях возможно так называемое преждевременное половое развитие. У девочек оно происходит до 8 лет и характеризуется увеличением молочных желез, появлением волос на теле. У мальчиков до 9 лет может изменяться голос, также происходит оволосение, иногда возникает угревая сыпь. У обоих полов тело растет в ускоренном темпе. Случается это из-за преждевременной активации гормонов — эстрогенов у девочек и андрогенов у мальчиков. Такое раннее развитие может стать причиной стресса у ребенка из-за его отличия от окружающих детей. Дополнительная информацияСчитается, что средний возраст начала полового созревания уменьшается со временем.
Активный рост завершается в возрасте 16-18 лет у женского пола и до 18-ти — у мужского. Половое созреваниеНа протекание созревания наибольшее влияние оказывает характер питания, а также условия, в которых человек развивается. В этом возрасте крайне важно, чтобы организм получал все необходимые витамины и минералы, а в рационе были жиры, белки, клетчатка и углеводы с низким гликемическим индексом. Все это помогает укреплению мышц и нормальному развитию. В некоторых случаях возможно так называемое преждевременное половое развитие. У девочек оно происходит до 8 лет и характеризуется увеличением молочных желез, появлением волос на теле. У мальчиков до 9 лет может изменяться голос, также происходит оволосение, иногда возникает угревая сыпь. У обоих полов тело растет в ускоренном темпе. Случается это из-за преждевременной активации гормонов — эстрогенов у девочек и андрогенов у мальчиков. Такое раннее развитие может стать причиной стресса у ребенка из-за его отличия от окружающих детей. Дополнительная информацияСчитается, что средний возраст начала полового созревания уменьшается со временем. По некоторым данным, с 1840 года он сокращался на 4 месяца в десятилетие. Также пубертатный возраст различается в разных странах, при этом раньше всего он наступает у негроидной расы, позже — у азиатов, которые проживают в районах высокогорья.
По некоторым данным, с 1840 года он сокращался на 4 месяца в десятилетие. Также пубертатный возраст различается в разных странах, при этом раньше всего он наступает у негроидной расы, позже — у азиатов, которые проживают в районах высокогорья.
https://radiosputnik.ria.ru/20201119/podrostki-1585338478.html
https://ria.ru/20201228/mgppu-1591169832.html
https://ria.ru/20210119/rost-1593737233.html
https://radiosputnik.ria.ru/20201015/molodost-1579886576.html
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e5/01/13/1593741779_187:0:2918:2048_1920x0_80_0_0_b6dd72359cdfb0ad0632408f18e61fbc.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
общество, подростки, здоровье — общество, россия, детские вопросы, социальный навигатор
МОСКВА, 19 янв — РИА Новости. Пубертатный период — это этап жизни человека, во время которого происходит половое созревание. Об изменениях тела и «кризисе перехода» — в материале РИА Новости.
Что такое пубертат
Во время пубертатного периода, который в среднем начинается с 9-10 лет у девочек и с 10-11 у мальчиков, организм сталкивается с физиологическими и психическими изменениями, способствующими наступлению половой и физической зрелости. Мозг посылает сигнал, который поступает к яичникам у девочек и семенникам у мальчиков, при этом вырабатываются гормоны, ускоряющие рост тела, развитие мозга и организма, а также работу репродуктивной системы. У женского пола пубертат начинается раньше, чем у мужского. В 46% случаев у девочек-подростков половое созревание наступает в том же возрасте, что и у их матерей.
Мозг посылает сигнал, который поступает к яичникам у девочек и семенникам у мальчиков, при этом вырабатываются гормоны, ускоряющие рост тела, развитие мозга и организма, а также работу репродуктивной системы. У женского пола пубертат начинается раньше, чем у мужского. В 46% случаев у девочек-подростков половое созревание наступает в том же возрасте, что и у их матерей.«В этот период у подростков может возникнуть неуклюжесть, так как им сложно контролировать быстро меняющееся тело и его габариты, — рассказал РИА Новости психолог Станислав Иванов. — Также может появиться ломота и зуд в мышцах и костях, гипертонус мышц. В связи с тем, что гормоны начинают бурно «атаковать» организм, возникает частая усталость, перепады настроения, головные боли, трудности с сосредоточенностью и усвоением материала. Обычно в период 12-14 лет проседает учеба, но это нормально».
Что происходит с подростковым телом
У человека период созревания делится на три фазы:
—
Допубертатная. Начинается с 9-13 лет. В это время появляются первые признаки полового созревания — волосы на теле, увеличение яичек, боли молочных желез.
Начинается с 9-13 лет. В это время появляются первые признаки полового созревания — волосы на теле, увеличение яичек, боли молочных желез.—
Пубертатная фаза наступает у девочек в 12-16 лет, а у мальчиков в 13-17 лет. Для нее характерны такие признаки как поллюция и менструация.—
Постпубертатная фаза завершает цикл подростковых изменений. У мальчиков появляются волосы на лице, возможно возникновение юношеских угрей, акне у девочек.
Также во время пубертата у мальчиков-подростков «ломается» голос, увеличивается мышечная масса, изменяется телосложение, плечи и челюсти растут быстрее. У девушек под влиянием эстрогенов бедра становятся шире, нарастает жировая ткань в области плечевого пояса, молочных желез, ягодиц, лобка.
19 ноября 2020, 13:26
Исследование: большинство подростков в РФ начинают работать неофициальноПодросток — это кто?
Пубертат означает изменения, которые касаются физических признаков взросления. Для социальных, культурных аспектов чаще применяется термин «подростковый период». Некоторые исследователи полагают, что он начинается с 12 лет и заканчивается в 17, однако Всемирная организация здравоохранения называет цифры с 10 до 19 лет.
Некоторые исследователи полагают, что он начинается с 12 лет и заканчивается в 17, однако Всемирная организация здравоохранения называет цифры с 10 до 19 лет.
Подростковый возраст — это переходный этап между ребенком и взрослым.
«Первая фаза в период 10-12 лет заключается в том, что подростки определяют свое место в социуме, — отмечает специалист. — В этом возрасте на первое место начинает выходить коллектив, и на второй план отодвигается учеба. В этот период важно, чтобы у ребенка была стабильная опора на родителей и право на ошибку. Вторая фаза — 12-16 лет — характеризуется конкуренцией за внимание противоположного пола и новым осознание своего полоролевого поведения. Подростки учатся быть конкурентными, осознавать свои сильные и слабые стороны в отношении с противоположным полом. В этот период начинают возникать комплексы, неуверенность в себе и в своей внешности. Третий этап начинается с 16 лет. Это фаза внутреннего поиска себя и сбора ресурсов для вхождения во взрослую жизнь. Именно тут наиболее актуальны вопросы профориентирования, активных хобби. На данной фазе у подростка очень много страхов и постоянной тревоги перед предстоящей самостоятельной жизнью. Чем лучше у подростка контакт с родителями и опора на них, тем проще ему пройти этот период».
Именно тут наиболее актуальны вопросы профориентирования, активных хобби. На данной фазе у подростка очень много страхов и постоянной тревоги перед предстоящей самостоятельной жизнью. Чем лучше у подростка контакт с родителями и опора на них, тем проще ему пройти этот период».
Что такое «кризис перехода»
В период взросления подростки сталкиваются с кризисом юности, который предполагает психологическую, эмоциональную и социальную перестройку.
«Кризис перехода» — это этап перехода человека из статуса ребенка в статус взрослой личности внутри определенного социума. В этот период личность лишается определенных привилегий и ограничений и получает ряд обязанностей и прав. Из-за этого у подростка возникает сильный внутренний кризис в вопросе своей роли. Это выливается в подростковый бунт, отрицание и сложное социальное поведение. Для успешного прохождения данного кризиса родителям важно вводить четкие условия прав и обязанностей для подростка начиная с 8-10 лет.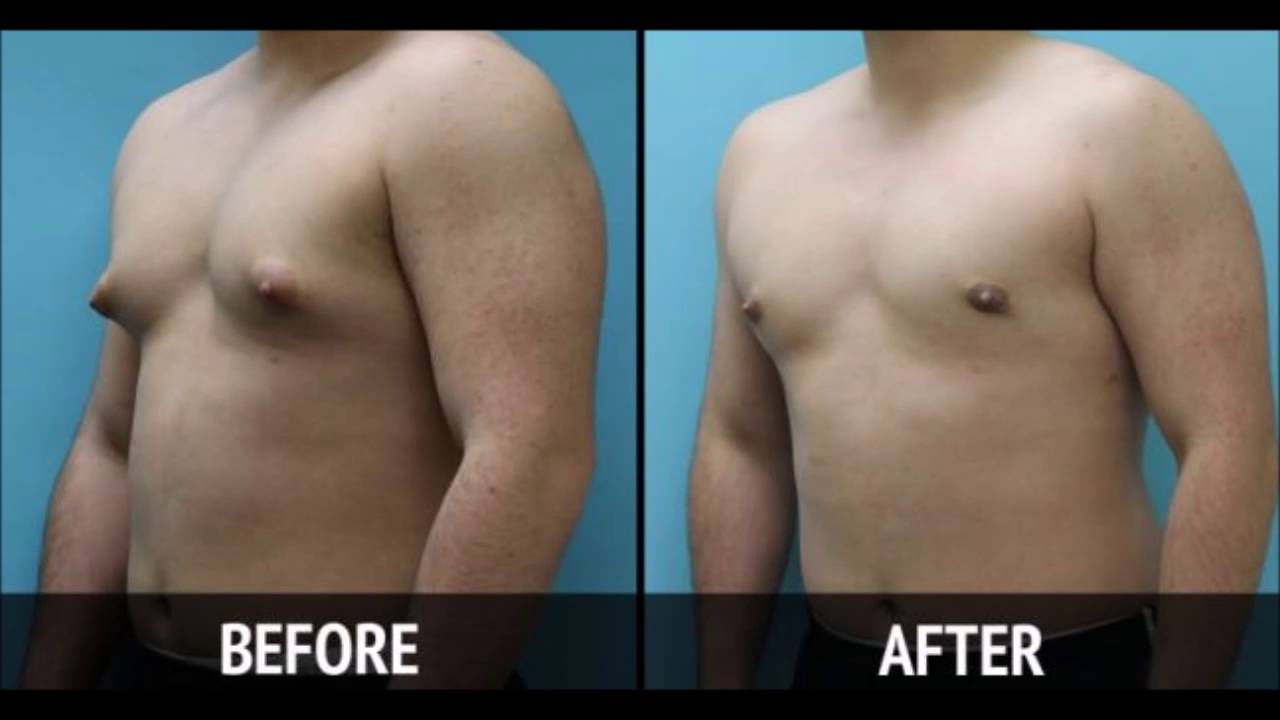 У ребенка должны формироваться четкие границы переходов, и понимание, где заканчивается попечительство и начинается ответственность и привилегии свободы. Эти правила должны быть однозначны как для подростка, так и для родителей, а не меняться от настроения или обстоятельств. Тогда подросток научится нести ответственность за себя и пользоваться своими правами, а также обретет уверенность в своем статусе через признание родителей», — порекомендовал Станислав Иванов.
У ребенка должны формироваться четкие границы переходов, и понимание, где заканчивается попечительство и начинается ответственность и привилегии свободы. Эти правила должны быть однозначны как для подростка, так и для родителей, а не меняться от настроения или обстоятельств. Тогда подросток научится нести ответственность за себя и пользоваться своими правами, а также обретет уверенность в своем статусе через признание родителей», — порекомендовал Станислав Иванов.
Физический рост
На период полового созревания приходится самый активный рост тела. У девочек он начинается с 10-11 лет, а мальчиков позже — после 14-ти. На этот процесс воздействует гормон соматотропин, который вызывает деление клеток в организме, за счет чего он увеличивается в размерах. На то, какого роста будет человек, влияет, в основном, генетика. Активный рост завершается в возрасте 16-18 лет у женского пола и до 18-ти — у мужского.19 января 2021, 20:08
До скольких лет растет человек — ответы на главные вопросыПоловое созревание
На протекание созревания наибольшее влияние оказывает характер питания, а также условия, в которых человек развивается. В этом возрасте крайне важно, чтобы организм получал все необходимые витамины и минералы, а в рационе были жиры, белки, клетчатка и углеводы с низким гликемическим индексом. Все это помогает укреплению мышц и нормальному развитию.
В этом возрасте крайне важно, чтобы организм получал все необходимые витамины и минералы, а в рационе были жиры, белки, клетчатка и углеводы с низким гликемическим индексом. Все это помогает укреплению мышц и нормальному развитию.
В некоторых случаях возможно так называемое преждевременное половое развитие. У девочек оно происходит до 8 лет и характеризуется увеличением молочных желез, появлением волос на теле. У мальчиков до 9 лет может изменяться голос, также происходит оволосение, иногда возникает угревая сыпь. У обоих полов тело растет в ускоренном темпе. Случается это из-за преждевременной активации гормонов — эстрогенов у девочек и андрогенов у мальчиков. Такое раннее развитие может стать причиной стресса у ребенка из-за его отличия от окружающих детей.
Дополнительная информация
Считается, что средний возраст начала полового созревания уменьшается со временем. По некоторым данным, с 1840 года он сокращался на 4 месяца в десятилетие. Также пубертатный возраст различается в разных странах, при этом раньше всего он наступает у негроидной расы, позже — у азиатов, которые проживают в районах высокогорья.
15 октября 2020, 09:38
Россиянам узаконят продление молодостипочему у мальчиков увеличивается грудь — Рамблер/доктор
Узнайте, почему у мальчиков-подростков может происходить увеличение молочных желез.
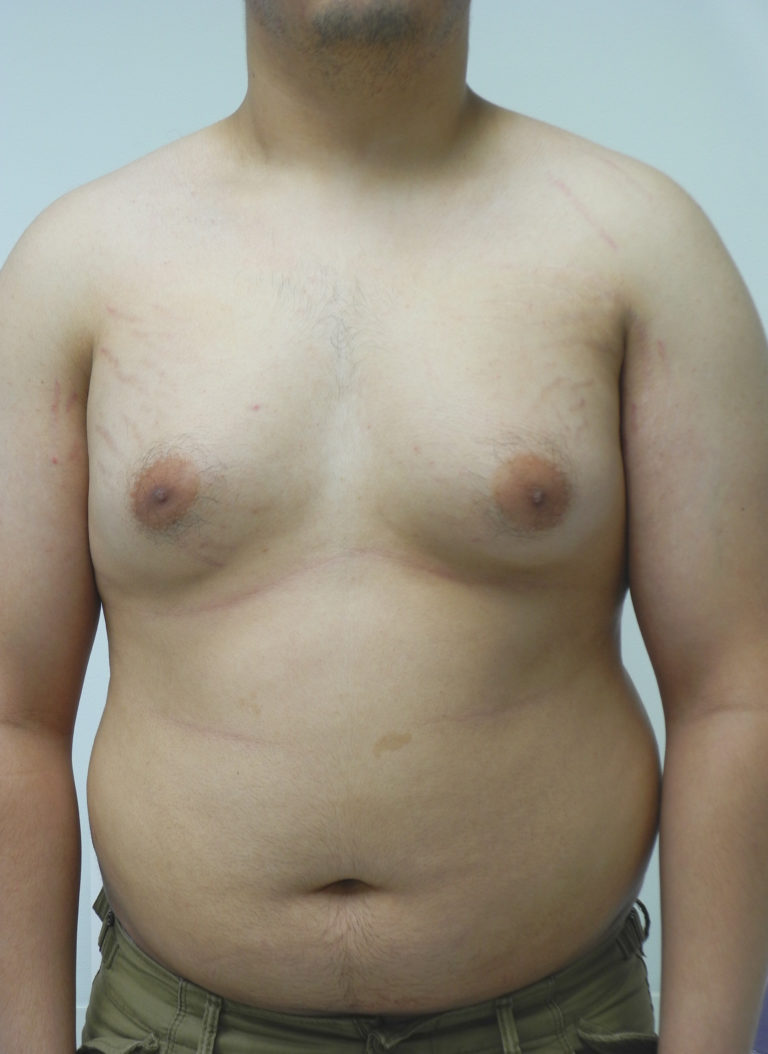
Родители могут наблюдать, как в разные возрастные периоды у их сыновей вдруг увеличиваются молочные железы. Такое состояние врачи называют гинекомастией. Чаще всего гинекомастия – не является проблемой и проходит самостоятельно. Однако есть случаи, когда потребуется медикаментозное лечение, а иногда и операционное вмешательство.
Аркадий Геннадьевич Погосов, главный врач Клиники Экспертных Медицинских Технологий, врач онколог-маммолог, хирург, рассказал «Летидору», почему у мальчиков может увеличиваться грудь, как ставят диагноз и какие методы помогут решить проблему у подростка.
Три возрастных периода гинекомастии
Есть три пиковых периода в жизни мужчин, когда у них наблюдается «всплеск» гинекомастии.
Первый период – это новорожденность: от 60% до 90% мальчиков первых дней жизни имеют увеличенные, набухшие молочные железы из-за трансплацентарного воздействия материнских эстрогенов. Это так называемая транзиторная гинекомастия новорожденных, которая проходит без каких-либо медицинских вмешательств.
Это так называемая транзиторная гинекомастия новорожденных, которая проходит без каких-либо медицинских вмешательств.
Второй пик – это пубертатный период, когда почти у 70% мальчиков уплотняется ткань молочной железы , вплоть до заметного глазом выбухания. Как правило, пубертатная гинекомастия встречается у мальчиков 13-14 лет, но описаны случаи возникновения ее и в возрасте 10 лет.
К 17 годам у 90% молодых людей молочные железы приходят в норму без лишних вмешательств.
Третий, и последний, пик встречаемости гинекомастии – в возрасте 50-80 лет, когда изменения в молочной железе выявляются у 70-90% мужчин.
Что такое гинекомастия
Очень важно определиться с терминологией: большинство исследователей предлагают называть гинекомастией увеличение ткани молочной железы у мальчиков любого возраста размером более 1 см, если оно ощущается при пальпации (прощупывается) или видно на УЗИ.
Нужно отличать истинную гинекомастию – разрастание железистой ткани молочной железы, и ложную – избыточное отложение жировой ткани в области молочных желез.
Гинекомастия возникает из-за нарушения баланса мужских (андрогенов, андрос = мужчина) и женских (эстрогенов) половых гормонов, причем часто не просто нарушена концентрация этих веществ в крови, а наблюдается их недостаточная активность. Например, андрогенов много, но ткань молочной железы к ним не чувствительна или, наоборот, избыточно чувствительна к эстрогенам.
Дело в том, что молочная железа у мальчиков и девочек до 10 лет имеет одинаковое строение.
Эстрогены и андрогены тоже присутствуют в одинаковом количестве (до поры, до времени) и у тех, и у других. Эстрогены среди прочих эффектов вызывают рост молочной железы, а андрогены, наоборот – обратное развитие или инволюцию.
В пубертатном периоде раньше стартует избыточная продукция эстрогенов: у мальчиков и девочек после 10 лет начинает расти грудь, только в норме, у молодых людей взрывное увеличение количества андрогенов (в частности, тестостерона) приводит к быстрому торможению этого процесса и инволюции того, что успело вырасти.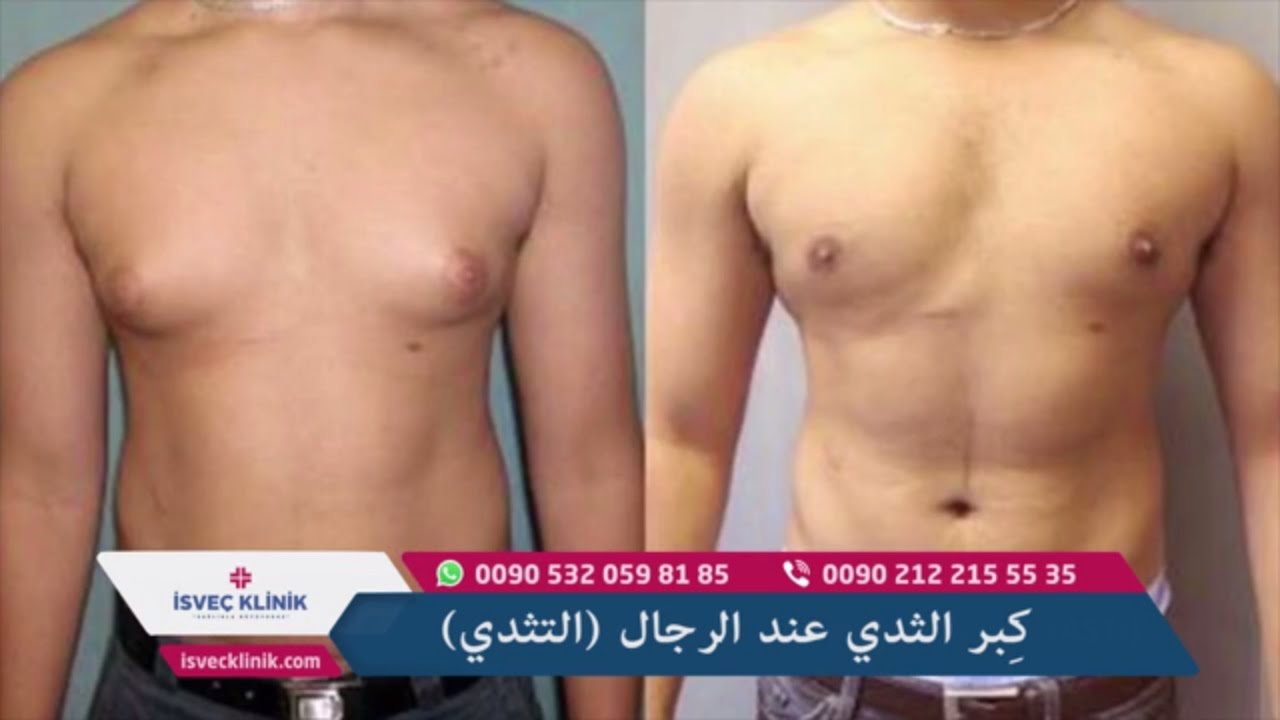 В случае если этого не происходит, говорят о патологической гинекомастии.
В случае если этого не происходит, говорят о патологической гинекомастии.
Причины патологической гинекомастии
Причины ее очень многообразны и, считается, что они связаны с нарушением баланса андрогенов и эстрогенов. Это состояние может быть вызвано избыточным синтезом эстрогенов, внешним приемом препаратов их содержащих или (часто) вторичным превращением андрогенов в эстрогены, например, в жировой ткани.
Перечисленные механизмы возникновения гинекомастии свойственны:- побочному действию анаболических стероидов, марихуаны, некоторых лекарственных препаратов,
- опухолям надпочечников или яичек,
- синдромам Клайнфельтера и Пейтца-Егерса,
- тиреотоксикозу,
- первичному гипогонадизму (снижение выработки мужских половых гормонов),
- циррозу печени и многим другим заболеваниям.
Однако, большая часть из патологических гинекомастий не связана с подобными тяжелыми расстройствами, а возникают вследствие ожирения и избыточного синтеза эстрогенов жировой тканью.
Как ставят диагноз
Большое количество сопутствующих заболеваний требует тщательного обследования каждого случая гинекомастии у ребенка. Краеугольным камнем, как и всегда, оказывается сбор анамнеза (как давно появилось? что смущает? болит ли?) и непосредственный осмотр. На осмотре обращают внимание на выраженность половых признаков у юноши – ломка голоса, оволосение в подмышках и на лобке, растительность на лице, маскулинизация мышц, размеры пениса и яичек.
Тревожный знак, если гинекомастия существует более года или сопровождается болью, выделениями из сосков, избыточным похудением или признаками системного заболевания (печени или почек – не так важно в данном случае).
Тогда обследуют долго и с пристрастием: сдают кровь на гормональный профиль (эстрадиол, фолликулостимулирующий гормон, пролактин, тестостерон, гонадоторпин, Т3 и Т4, ТТГ), выполняют ультразвуковое исследование молочной железы, а иногда рентгенографию или даже КТ (компьютерная томография).
Как лечат гинекомастию
В зависимости от выявленных причин лечение может сильно различаться.
Помните, что транзиторная гинекомастия проходит сама по себе в течение 1-2 лет.
Из 10% мальчиков, кому не повезло и гинекомастия осталась после 17 лет, львиную долю составляют ребята с ожирением разной степени выраженности, иногда, сопровождающаяся гормональными нарушениями.
Разрешение основной проблемы приведет к ликвидации гинекомастии. При выявлении злоупотребления лекарственными препаратами, например, стероидами, необходимо прекратить их прием. При выявлении серьезного расстройства здоровья – следует разбираться с первичной причиной.
С другой стороны, гинекомастия возникает в самый сложный период жизни мальчика – подростковый, когда юноша только начинает познавать себя и определять свое место в жизни.
Нередко гинекомастия приводит к психологической дезадаптации и появлению комплексов.
Поэтому европейские и американские протоколы лечения гинекомастии предполагают при шестимесячной неэффективности консервативной терапии проведение миниинвазвной операции – пункционной липосакции или косметической мастэктомии.
Каждый случая гинекомастии у подростка уникален. Необходим комплексный анализ всех причин и факторов риска с целью выработки оптимальной тактики и метода лечения. Как правило, гинекомастия, даже патологическая, затянувшаяся хорошо поддается лечению и не возникает повторно. Особое внимание нужно уделять поиску предрасполагающих причин и сопутствующей патологии.
Когда обращаться к врачу — маммологу?
Желательно с целью профилактики — раз в год!
Чаще пациенты обращаются с жалобами:
- боли в молочных железах или подмышечных областях
- уплотнения в области молочных желез
- выделения из сосков
- изменение размера
- асимметрия молочных желез
- появились покраснение, отек
- втянутость/выбухание кожи в области соска
а также если:
- вы почувствовали какие-то необычные, неприятные ощущения, появилось чувство дискомфорта, распирания в молочных железах
- вы травмировали свои молочные железы
- вы подвергались длительному стрессовому воздействию, как психологическому, так и физическому
- вы имеете наследственную предрасположенность к заболеваниям молочных желез (например, если кто-то из ваших прямых родственников страдал раком молочной железы)
- у вас имеются сопутствующие заболевания, связанные с приемом гормональных препаратов, а также, заболевания половых органов или гормональные нарушения
Какие состояния молочных желез могут быть у детей и подростков?
У детей и подростков могут быть следующие состояния:
Временные отклонения от нормального состояния
- Физиологическое нагрубание молочных желез у новорожденных
- Изолированное преждевременное телархе
- Ювенильная гинекомастия
- Галакторея (наведенная – мамины гормоны, во время грудного вскармливания)
Аномалии развития
- Атрофия
- Ателия
- Амастия
- Полителия
- Полимастия
- Асимметрия молочных желез (до 100мл; и более 100мл.
 разница)
разница) - Макромастия
- Микромастия
- Койломастия
Патологические состояния
- Преждевременное телархе (выявление дополнительных признаков преждевременного полового созревания)
- Гинекомастия (появление протоковой системы)
- Масталгия
- Мастопатия
- Киста молочной железы (до 0,5см и более 0,5см)
- Фиброаденома
- Внутрипротоковая патология
- Инфекции и воспаление (нелактационный мастит)
- Патология соска ( миллиум, атерома, телит)
- Кистозные трансформации тканей
- Галакторея
- Травма
А так же НОРМА (отсутствие молочных желез до 8 лет у девочек и телархе (начало роста молочных желез в подростковом возрасте; у мальчиков – отсутствие м/ж.).
На ультразвуковое исследование молочных желез в детском возрасте направляют эндокринологи, гинекологи, хирурги при наличии следующих клинических симптомов:
— ассиметрия и изменения размеров молочных желёз — пальпируемые уплотнения (подозрение на мастопатию, кистозные и узловые образования)
— нарушения менструального цикла (нерегулярные, обильные месячные или их отсутствие, маточные кровотечения)
— травмы железы
— боль
— увеличение грудных желёз у мальчиков и подростков
— отставание роста и развития молочных желёз соответственно возрасту (подозрение на задержку полового созревания) и др.

Ультразвуковой метод исследования позволяет дифференцировать естественные возрастные изменения молочных желёз от патологических:
(дисплазии, гинекомастии, объёмных образований, карманных расширений протоков, мастопатий и маститов.
Начало формирования молочных желёз у девочки начинается в 8 лет.
Рост одной железы может опережать рост другой на протяжении 2–х лет. Это физиологическая ассиметрия развития молочных желёз препубертатного периода. К 9-10 годам размеры обеих желёз сравниваются. Период начала формирования молочных желёз характеризуется появлением в околососковой области железы болезненности, припухлости, иногда уплотнения, покраснений и повышения температуры кожи. Эти проявления связаны с усилением кровоснабжения, отёком, сопровождающим процессы развития главных млечных протоков (элементы железистой ткани) в позадисосковой области.
В норме молочная железа состоит из железистой, соединительной и жировой тканей, выраженность которых зависит от возраста и гормонального фона.
Несоответствия типа ультразвуковой структуры молочных желез возрасту является одним из эхографических признаков мастопатии.
Преждевременное увеличение желёз (гинекомастия) может развиться у детей разного возраста, в том числе и до 8 лет. Происходит это за счёт разрастания железистой ткани (истинная гинекомастия) или жировой (ложная гинекомастия).
Развитие грудных желёз у девочек до 3-х лет связано с повышением в организме уровня половых гормонов.
В препубертатный период (8 -10 лет) одностороннее или двухстороннее увеличение молочных желёз имеет чаще семейный характер, но могут быть и результатом индивидуальной чувствительности к собственным половым гормонам.
УЗИ молочных желез | Поликлиника Медицинский Комплекс
Онкологические заболевания молочной железы в наше время приобрели угрожающие масштабы. Всемирной организацией здравоохранения рекомендовано ежегодное проведение профилактических обследований. А для женщин старше 50 лет – дважды в году. Для наиболее точной диагностики назначаются ультразвуковые исследования (ультразвуковая маммография) как наиболее эффективный способ изучения состояния молочных желез.
Поликлиника «Медицинский комплекс» располагает аппаратурой новейшего типа с высокочастотными датчиками для детального определения состояния поверхностных глубинных тканей железы. В поликлинике осуществляются платные услуги по самостоятельной УЗИ-диагностике и в комплексе с маммографией (по возрастным показателям и рекомендации врача). Для молодых женщин, молочные железы которых обладают более плотной структурой, ультразвуковая диагностика более эффективна, чем маммография. Превосходства УЗИ в информативности отмечаются при определении кисты и исследовании мастопатии фиброзно-кистозного характера.
Ультразвуковые исследования молочной железы назначают для диагностики кисты и других новообразований, выявленных при пальпации и маммографии. С помощью этих процедур контролируется состояние молочных желез у беременных и кормящих грудью матерей, а также при протезировании. Проводятся изучения желез у детей и подростков (и мальчиков, и девочек). Существует множество других показателей, которые врач посчитает основанием для назначения УЗИ молочной железы.
Специальная подготовка к исследованию не потребуется. Существуют лишь рекомендации относительно менструального цикла. Наиболее оптимальным специалисты считают период с пятого по четырнадцатый день цикла. Женщины в менопаузе обследуются в любой день.
Пациенты раздеваются до пояса. Как правило, процедура выполняется в положении лежа на спине. При больших размерах желез исследование проводится сидя, стоя или на боку. Затем исследуются другие зоны (надключичная, подключичная, подмышечная, переднегрудная) на предмет изменений состояния лимфоузлов.
В поликлинике «Медицинский комплекс» вы можете получить максимально точные результаты диагностики молочных желез, мгновенную их обработку и соответствующую консультацию специалиста. Оплата услуг гарантирует внимательное отношение персонала, прием в удобное время, обеспечение необходимыми одноразовыми принадлежностями.
Гинекомастия у подростков мужского пола
Semin Plast Surg. 2013 февраль; 27(1): 56–61.
, MD, MPH, FRCSC, 1 , MD, 1 , MD, 2 и, MD 1Valerie Lemaine
1 Отдел пластической хирургии, Департамент хирургии, Клиника MAYO , Rochester, Minnesota
Cenk Cayci
1 Отделение пластической хирургии, Отделение хирургии, Mayo Clinic, Rochester, Minnesota
Patricia S.Simmons
2 Отделение детской и подростковой гинекологии, отделение детской и подростковой медицины, клиника Майо, Рочестер, Миннесота
Paul Petty
1 Отделение пластической хирургии, отделение хирургии, клиника Майонес, Ротачестер
1 Отделение пластической хирургии, отделение хирургии, клиника Мэйо, Рочестер, Миннесота
2 Отделение детской и подростковой гинекологии, отделение детской и подростковой медицины, клиника Мэйо, Рочестер, Миннесота
Адрес для корреспонденции Валери Лемейн, доктор медицины, магистр здравоохранения, отделение пластической хирургии FRCSC, отделение хирургии, клиника Майо, 200, First Street SW, Rochester, MN, 55905, ude. [email protected]Эта статья цитировалась другими статьями в PMC.
[email protected]Эта статья цитировалась другими статьями в PMC.Abstract
Гинекомастия определяется как увеличение мужской груди. Часто оно доброкачественное и может быть источником значительного смущения и психологического стресса. Общий анамнез и тщательное физикальное обследование необходимы для того, чтобы отличить нормальные варианты развития от патологических причин. Лечение направлено на конкретную этиологию при ее выявлении. В большинстве случаев пубертатной гинекомастии наблюдение и заверение являются основой терапии, поскольку состояние обычно проходит естественным путем.Фармакологическое лечение и хирургическое вмешательство рекомендуются только в отдельных случаях.
Ключевые слова: Гинекомастия у подростков, хирургическое лечение, ультразвуковая липосакция
Гинекомастия, разрастание желез в молочной железе у мужчин, является распространенным клиническим состоянием, которое может встречаться у мужчин любого возраста. «Гинекомастия» происходит от греческих терминов gynec (женщина) и mastos (грудь) и впервые была введена Галеном во втором веке нашей эры. Это состояние может быть случайной находкой при обычном физикальном обследовании или может проявляться в виде впервые появившейся пальпируемой массы молочной железы с масталгией или без нее.Он может быть односторонним, двусторонним и/или асимметричным. Псевдогинекомастия (жировая грудь) обычно наблюдается у мужчин с ожирением и отличается от гинекомастии тем, что увеличение груди связано с повышенным отложением жира без пролиферации желез. Гинекомастия может вызвать значительное смущение и психологический стресс у больных мужчин. В этой статье авторы сосредотачиваются на пубертатной гинекомастии и рассматривают медицинские и хирургические подходы к лечению подростков мужского пола с этим заболеванием.
Это состояние может быть случайной находкой при обычном физикальном обследовании или может проявляться в виде впервые появившейся пальпируемой массы молочной железы с масталгией или без нее.Он может быть односторонним, двусторонним и/или асимметричным. Псевдогинекомастия (жировая грудь) обычно наблюдается у мужчин с ожирением и отличается от гинекомастии тем, что увеличение груди связано с повышенным отложением жира без пролиферации желез. Гинекомастия может вызвать значительное смущение и психологический стресс у больных мужчин. В этой статье авторы сосредотачиваются на пубертатной гинекомастии и рассматривают медицинские и хирургические подходы к лечению подростков мужского пола с этим заболеванием.
Распространенность
В течение жизни наблюдались три фазы возникновения гинекомастии, соответствующие периодам гормональных изменений. Первый пик приходится на неонатальный период, когда, по оценкам, у 60–90% новорожденных появляется преходящая пальпируемая ткань молочной железы из-за трансплацентарного проникновения эстрогенов. 1 , 2 Гинекомастия у новорожденных почти всегда спонтанно и полностью регрессирует в течение первого года жизни.Второй пик приходится на период полового созревания, когда сообщается о диапазоне заболеваемости от 4 до 69% пальпируемой ткани молочной железы и увеличении размера груди. 1 Гинекомастия может проявиться уже в возрасте 10 лет, с пиком заболеваемости в возрасте 13–14 лет, с последующим снижением заболеваемости в позднем подростковом возрасте. 1 К 17 годам только у 10% мальчиков обнаруживается стойкая гинекомастия. 3 В крупнейшем перекрестном исследовании гинекомастии у подростков, проведенном на сегодняшний день, было обнаружено, что распространенность среди мужчин в возрасте от 10 до 19 лет составляет 4%. 4 Третий и последний пик заболеваемости приходится на более поздний возраст, с наибольшей распространенностью среди взрослых в возрасте от 50 до 80 лет. 5 , 6 При сравнении результатов исследований распространенности важно отметить, какие критерии исследователи использовали для определения гинекомастии.
1 , 2 Гинекомастия у новорожденных почти всегда спонтанно и полностью регрессирует в течение первого года жизни.Второй пик приходится на период полового созревания, когда сообщается о диапазоне заболеваемости от 4 до 69% пальпируемой ткани молочной железы и увеличении размера груди. 1 Гинекомастия может проявиться уже в возрасте 10 лет, с пиком заболеваемости в возрасте 13–14 лет, с последующим снижением заболеваемости в позднем подростковом возрасте. 1 К 17 годам только у 10% мальчиков обнаруживается стойкая гинекомастия. 3 В крупнейшем перекрестном исследовании гинекомастии у подростков, проведенном на сегодняшний день, было обнаружено, что распространенность среди мужчин в возрасте от 10 до 19 лет составляет 4%. 4 Третий и последний пик заболеваемости приходится на более поздний возраст, с наибольшей распространенностью среди взрослых в возрасте от 50 до 80 лет. 5 , 6 При сравнении результатов исследований распространенности важно отметить, какие критерии исследователи использовали для определения гинекомастии.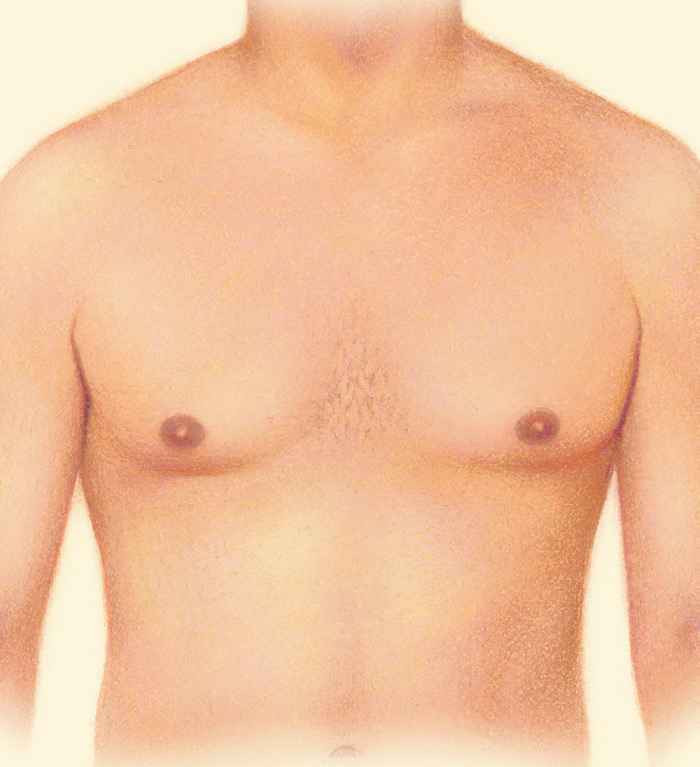 Диагностический критерий был определен различными исследователями как пальпируемое образование субареолярной ткани молочной железы размером не менее 0,5 см, 1 см или 2 см. 4 , 7
Диагностический критерий был определен различными исследователями как пальпируемое образование субареолярной ткани молочной железы размером не менее 0,5 см, 1 см или 2 см. 4 , 7
Гистопатогенез
Рецепторы эстрогена и андрогена присутствуют как в мужской, так и в женской груди.Эстрогены сильно стимулируют молочную железу, тогда как андрогены оказывают слабое тормозящее действие. При рождении мужские и женские молочные железы гистологически идентичны, в основном образованы крупными млечными протоками. 8 В детстве ткань молочной железы остается неподвижной до полового созревания. В период полового созревания у обоих полов происходит дальнейшая дифференциация. У мужчин происходит транзиторная пролиферация протоков и окружающей мезенхимальной ткани, предположительно из-за более выраженного физиологического воздействия эстрогенов на ткань молочной железы, вторичного по отношению к временному дисбалансу соотношения андроген/эстроген. 9 , 10 По мере полового созревания уровень циркулирующих андрогенов повышается, что приводит к инволюции и атрофии протоков.
9 , 10 По мере полового созревания уровень циркулирующих андрогенов повышается, что приводит к инволюции и атрофии протоков.
Этиология
Этиология гинекомастии остается неясной. Считается, что в большинстве случаев гинекомастия возникает из-за дисбаланса между эстрогенами и андрогенами. 1 , 11 Тем не менее, в пубертатной гинекомастии, большинство подростков имеют нормальный уровень эстрогена, хотя несколько исследований показали повышенный уровень у некоторых пациентов. 12 , 13 , 14 Пубертатная гинекомастия считается физиологическим явлением и чаще всего наблюдается в середине полового созревания с лобковым оволосением 3–4 стадии по Таннеру и объемом яичек от 5 до 10 мл с обеих сторон. 3 В 3-летнем продольном исследовании гормональных изменений в период полового созревания сравнивали участников исследования с гинекомастией и без нее. 15 Никакой связи с расой обнаружено не было, и не было обнаружено существенной разницы в сывороточном эстрадиоле, тестостероне, соотношении эстроген/тестостерон или уровнях дегидроэпиандростерон-сульфата. 15
15 Никакой связи с расой обнаружено не было, и не было обнаружено существенной разницы в сывороточном эстрадиоле, тестостероне, соотношении эстроген/тестостерон или уровнях дегидроэпиандростерон-сульфата. 15
Патологическая гинекомастия редко встречается у подростков и мальчиков препубертатного возраста. Это связано с состояниями, при которых присутствует абсолютный или относительный избыток эстрогена: (1) при экзогенном поступлении, (2) при эндогенной выработке или (3) при повышенной периферической конверсии андрогенов в эстрогены вследствие обильной активности ароматазы, дефицита андрогенов, или нечувствительность к андрогенам. 3 Это общие механизмы гинекомастии, вторичной по отношению к лекарствам, новообразованиям надпочечников и яичек, синдрому Клайнфельтера, синдрому Пейтца-Егерса, тиреотоксикозу, циррозу печени, первичному гипогонадизму, врожденной гиперплазии надпочечников, нечувствительности к андрогенам, недоеданию и старению. 3 , 14 Кроме того, имеются противоречивые результаты относительно наличия корреляции между гинекомастией и ожирением. 4 , 15 , 16 Хотя связь между этими двумя состояниями не была подтверждена, известно, что жировая ткань является важным местом ароматизации и образования эстрогена, что теоретически может подтверждать наблюдение. что у молодых мужчин с более высоким процентным содержанием жира в организме часто развивается гинекомастия.В большинстве случаев патологической гинекомастии конкретную причину редко выявляют даже после всестороннего и тщательного обследования.
4 , 15 , 16 Хотя связь между этими двумя состояниями не была подтверждена, известно, что жировая ткань является важным местом ароматизации и образования эстрогена, что теоретически может подтверждать наблюдение. что у молодых мужчин с более высоким процентным содержанием жира в организме часто развивается гинекомастия.В большинстве случаев патологической гинекомастии конкретную причину редко выявляют даже после всестороннего и тщательного обследования.
Клиническая оценка
История болезни и физикальное обследование являются наиболее важными компонентами оценки пациента с гинекомастией. Подробный анамнез должен быть сосредоточен на времени возникновения и продолжительности гинекомастии, сопутствующих симптомах (например, масталгии, кровотечении или выделениях из сосков), наличии системных заболеваний (особенно печени, почек, надпочечников, щитовидной железы, гипофиза, яичек и предстательной железы). , недавнее изменение веса в анамнезе, наличие факторов риска рака молочной железы 17 (e. например, носители BRCA2), а также использование лекарств и рекреационных наркотиков (например, безрецептурных лекарств, анаболических стероидов, пищевых добавок, марихуаны).
например, носители BRCA2), а также использование лекарств и рекреационных наркотиков (например, безрецептурных лекарств, анаболических стероидов, пищевых добавок, марихуаны).
Физикальное обследование должно включать пубертатную стадию развития, включая оценку изменений голоса, увеличение роста, размер яичек, рост волос на лице и теле, размер и развитие полового члена, увеличение мышечной массы и наличие любых тестикулярных масс. Молочные железы следует тщательно осмотреть и пропальпировать на наличие необычной плотности, асимметрии, выделений из сосков, подмышечной лимфаденопатии, а также дифференцировать истинную гинекомастию от псевдогинекомастии.Нормальная мужская грудь относительно плоская с определенной степенью полноты вокруг сосково-ареолярного комплекса (NAC). 18 , 19 Это может варьироваться в зависимости от степени гипертрофии грудных мышц, часто наблюдаемой у спортсменов и бодибилдеров. В среднем сосок располагается на расстоянии 20 см от вырезки грудины у самцов, а размер САК составляет 28 мм._20080715110943751.jpg)
После тщательного сбора анамнеза и результатов медицинского осмотра, соответствующего возрасту физического и полового развития, дальнейшее расследование не требуется.Наблюдение и успокоение должны быть основой лечения. Если гинекомастия присутствует у мальчиков препубертатного возраста, необходимо провести дальнейшее обследование для выявления эндокринопатии. У подростков мужского пола с гинекомастией, если физикальное обследование выявляет признаки, указывающие на основное заболевание, могут быть полезны диагностические анализы крови для оценки сывороточных уровней лютеинизирующего гормона, фолликулостимулирующего гормона, тестостерона, эстрадиола, пролактина, дегидроэпиандростерона и хорионического гонадотропина человека. 2 , 3
Классификация
Bannayan et al. 20 описали три гистологических типа гинекомастии: ярко выраженную, фиброзную и промежуточную. Флоридный тип характеризуется гиперплазией и пролиферацией протоков с рыхлой и отечной стромой. Фиброзный тип содержит больше стромального фиброза и меньше протоков. Как следует из названия, промежуточный тип гинекомастии представляет собой черты обоих. В большинстве случаев, если продолжительность гинекомастии превышает один год, фиброзный тип преобладает и является необратимым, что может ограничивать успех медикаментозного лечения.
Фиброзный тип содержит больше стромального фиброза и меньше протоков. Как следует из названия, промежуточный тип гинекомастии представляет собой черты обоих. В большинстве случаев, если продолжительность гинекомастии превышает один год, фиброзный тип преобладает и является необратимым, что может ограничивать успех медикаментозного лечения.
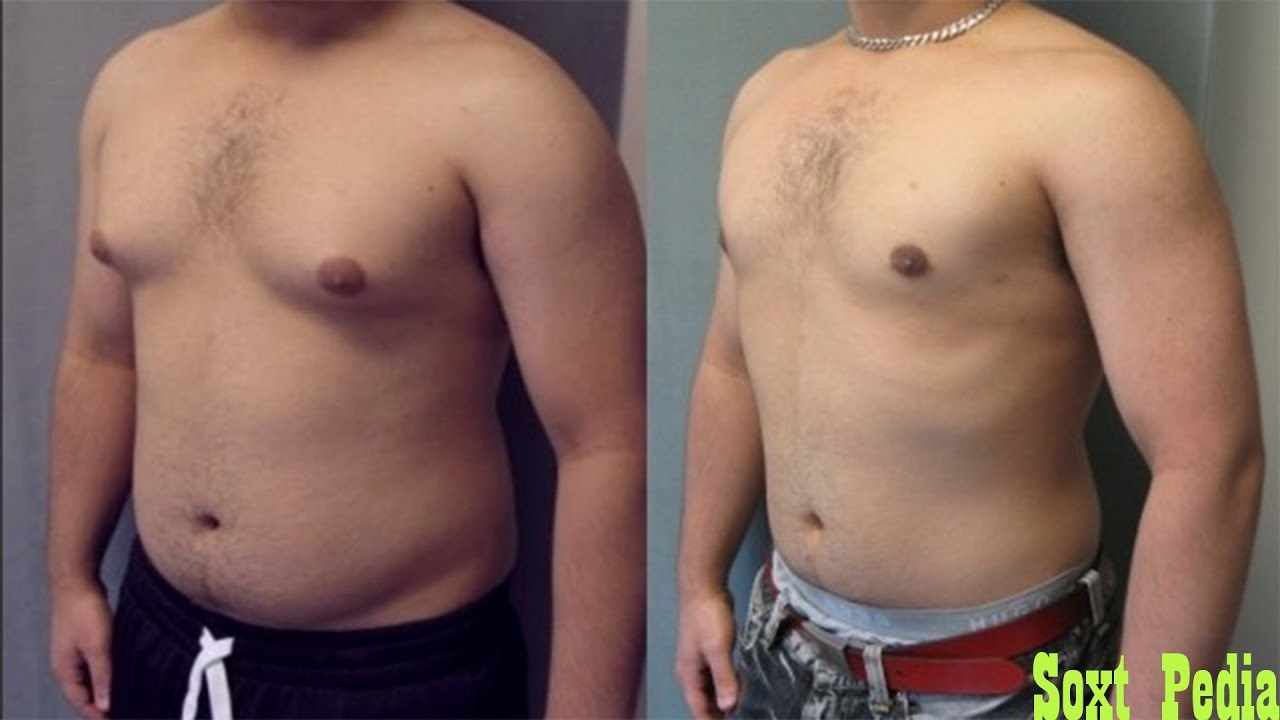
Лечение
Если в качестве причины гинекомастии установлено фоновое гормональное нарушение, соответствующего лечения должно быть достаточно, чтобы вызвать регрессию увеличения ткани молочной железы. В случаях гинекомастии, вызванной лекарственными препаратами, прекращение приема препарата обычно вызывает регрессию. Чаще всего к врачу обращаются мальчики-подростки с гинекомастией полового созревания. Пубертатная гинекомастия проходит самостоятельно у 75–90% подростков и регрессирует в течение 1–3 лет.Наблюдение и успокоение считаются наиболее безопасным и разумным методом лечения. Однако, поскольку гинекомастия у подростков возникает в деликатное время, когда мальчики все больше осознают свое представление о себе, пациент и/или его семья могут задать медицинским работникам вопросы о роли фармакологических или хирургических методов лечения.
Фармакологическое лечение
Медикаментозное лечение гинекомастии направлено на исправление эстроген-андрогенного дисбаланса тремя возможными путями: (1) блокирование действия эстрогенов на грудь (напр.например, кломифен, тамоксифен, ралоксифен), (2) введение андрогенов (например, даназол) и (3) ингибирование выработки эстрогенов (например, анастрозол, тестолактон). 3 , 21
Данные об эффективности фармакологического лечения гинекомастии у подростков в основном ограничены небольшими сериями случаев и описаниями случаев без контрольных групп, что затрудняет выводы. 22 , , 23 , , , , , 25 , 25 , 26 , 27 Рандомизированное двойное слепое контролируемое исследование Plourde et al 28 не нашел никаких существенных разница в уменьшении объема груди у подростков мужского пола с пубертатной гинекомастией, получавших анастрозол, по сравнению с плацебо один раз в день в течение 6 месяцев.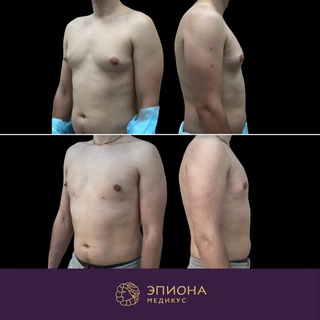 В небольшом неконтролируемом ретроспективном когортном исследовании, посвященном оценке эффективности тамоксифена и ралоксифена при лечении стойкой гинекомастии полового созревания, Lawrence et al. 29 пришли к выводу, что ралоксифен и, в меньшей степени, тамоксифен могут успешно использоваться для лечения этого состояния. Однако препятствием в изучении фармакологического лечения пубертатной гинекомастии является трудность количественной оценки эффекта лечения из-за естественного течения спонтанной регрессии у большинства подростков.В свете имеющейся информации текущие данные недостаточны для поддержки фармакологической терапии стойкой пубертатной гинекомастии. В таких случаях хирургическое вмешательство может быть рассмотрено, если после периода наблюдения не менее одного года не наблюдается регресса.
В небольшом неконтролируемом ретроспективном когортном исследовании, посвященном оценке эффективности тамоксифена и ралоксифена при лечении стойкой гинекомастии полового созревания, Lawrence et al. 29 пришли к выводу, что ралоксифен и, в меньшей степени, тамоксифен могут успешно использоваться для лечения этого состояния. Однако препятствием в изучении фармакологического лечения пубертатной гинекомастии является трудность количественной оценки эффекта лечения из-за естественного течения спонтанной регрессии у большинства подростков.В свете имеющейся информации текущие данные недостаточны для поддержки фармакологической терапии стойкой пубертатной гинекомастии. В таких случаях хирургическое вмешательство может быть рассмотрено, если после периода наблюдения не менее одного года не наблюдается регресса.
Хирургическое лечение
Хирургическое лечение пубертатной гинекомастии может быть рассмотрено у подростков мужского пола без ожирения, у которых наблюдается стойкое увеличение груди после периода наблюдения не менее 12 месяцев, непреодолимая боль или болезненность молочных желез и/или значительный психосоциальный дистресс.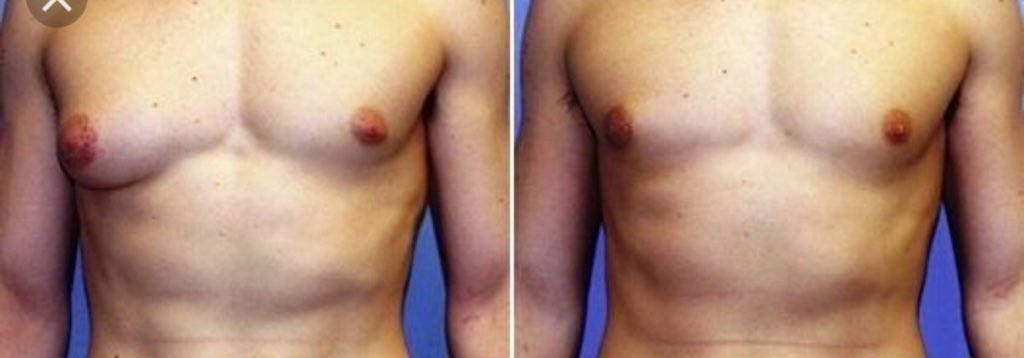 Существует несколько систем классификации, основанных на клинических особенностях гинекомастии, которые могут определять выбор хирургической процедуры.
Существует несколько систем классификации, основанных на клинических особенностях гинекомастии, которые могут определять выбор хирургической процедуры.
в 1973 году, Simon et al
30 идентифицировали четыре сорта Gynecomastia:
класс I: небольшое увеличение без кожи
сорт IIA: умеренное увеличение без кожи
класс IIB: умеренное увеличение с незначительным избытком кожи
Степень III: Заметное увеличение с избытком кожи, имитирующее птоз женской груди
Rohrich et al. : Минимальная гипертрофия (< 250 г) без птоза
Степень II: Умеренная гипертрофия (250–500 г) без птоза
Степень III: Выраженная гипертрофия (> 500 г) с птозом I степени
3
- 4 Степень IV: Тяжелая гипертрофия с птозом II или III степени
Первое сообщение о хирургическом лечении гинекомастии da восходит к Пауласу Эгинете (625–690 гг. н.э.), византийскому греческому врачу, который провел редукционную маммопластику через полулунный разрез под грудью. 32 В 1946 г. Webster первым отказался от экстраареолярных кожных разрезов в пользу полукруглого внутриареолярного разреза. 32 , 33 Современные хирургические методы отдают предпочтение стандартной аспирационной липэктомии (SAL) и ультразвуковой липосакции (UAL) 31 по сравнению с эксцизионными методами, с преимуществом создания меньших рубцов. В 1996 г. Morselli et al. 34 впервые описали технику протяжки, которая сочетает SAL в подкожной и поджелезистой плоскостях, а также субареолярную паренхиматозную резекцию.В серии случаев 2012 г., включавшей 260 пациентов в возрасте от 10 до 59 лет, авторы сообщили о хороших общих хирургических результатах с низкой частотой осложнений. Хотя авторы не предоставляют методы измерения результатов, они сообщают о высокой степени удовлетворенности пациентов этим методом. 35 Другие хирурги успешно применяли технику протягивания с помощью UAL 36 или липосакцию с электроприводом (PAL).
32 В 1946 г. Webster первым отказался от экстраареолярных кожных разрезов в пользу полукруглого внутриареолярного разреза. 32 , 33 Современные хирургические методы отдают предпочтение стандартной аспирационной липэктомии (SAL) и ультразвуковой липосакции (UAL) 31 по сравнению с эксцизионными методами, с преимуществом создания меньших рубцов. В 1996 г. Morselli et al. 34 впервые описали технику протяжки, которая сочетает SAL в подкожной и поджелезистой плоскостях, а также субареолярную паренхиматозную резекцию.В серии случаев 2012 г., включавшей 260 пациентов в возрасте от 10 до 59 лет, авторы сообщили о хороших общих хирургических результатах с низкой частотой осложнений. Хотя авторы не предоставляют методы измерения результатов, они сообщают о высокой степени удовлетворенности пациентов этим методом. 35 Другие хирурги успешно применяли технику протягивания с помощью UAL 36 или липосакцию с электроприводом (PAL). 37 В 2010 г. Petty et al. 22 сообщили о своем опыте использования UAL и артроскопического шейвера для резекции субареолярного фиброзного компонента.
37 В 2010 г. Petty et al. 22 сообщили о своем опыте использования UAL и артроскопического шейвера для резекции субареолярного фиброзного компонента.
Поскольку в клинической практике встречаются различные формы гинекомастии, пластические хирурги, занимающиеся лечением гинекомастии, должны понимать, когда необходимы методы иссечения и липосакции. Цели хирургического лечения гинекомастии, независимо от выбранной хирургической техники, должны включать приятную форму грудной клетки с ограниченным распространением рубца. В целом, I или IIa степени по Симону/железистый тип можно лечить с помощью липосакции (SAL, PAL или UAL), хотя степень I или IIa по Симону/фиброзный тип лучше лечить с помощью комбинации UAL и хирургического иссечения (1).Пациентов со степенью тяжести IIb/железистым типом по Симону можно лечить так же, как пациентов со степенью тяжести I или IIa по шкале Симона, и подождать от 6 до 12 месяцев, прежде чем рассматривать возможность удаления кожи (12). Симон IIb/фиброзный тип, иссечение кожи может быть выполнено немедленно или отсрочено. Наконец, у пациентов с III степенью по Симону любая форма липосакции обычно сочетается с резекцией кожи. В этих тяжелых случаях сообщалось о нескольких типах разрезов (например, околоареолярный разрез, охватывающий верхнюю или нижнюю половину ареолы, омега-разрез, разрез по концентрической окружности, подгрудной разрез).В некоторых случаях сосково-ареолярный комплекс может быть транспонирован на кожно-железистой ножке или, редко, в виде полнослойного кожного трансплантата.
Симон IIb/фиброзный тип, иссечение кожи может быть выполнено немедленно или отсрочено. Наконец, у пациентов с III степенью по Симону любая форма липосакции обычно сочетается с резекцией кожи. В этих тяжелых случаях сообщалось о нескольких типах разрезов (например, околоареолярный разрез, охватывающий верхнюю или нижнюю половину ареолы, омега-разрез, разрез по концентрической окружности, подгрудной разрез).В некоторых случаях сосково-ареолярный комплекс может быть транспонирован на кожно-железистой ножке или, редко, в виде полнослойного кожного трансплантата.
Предоперационные снимки 16-летнего мальчика с гинекомастией I степени Симона с плотной тканью молочной железы (, верхний ряд ). Послеоперационный результат через 15 месяцев ( нижний ряд ) после ультразвуковой липосакции и артроскопического удаления ткани молочной железы с помощью шейвера.
( A–C ) Дооперационный снимок 15-летнего мальчика с ожирением и пубертатной гинекомастией. Наблюдается умеренное увеличение груди и незначительный избыток кожи (класс Симона IIb). ( D – F ) Виды после операции через день после ультразвуковой липосакции и удаления ткани молочной железы с помощью артроскопического шейвера без иссечения кожи. ( G–I ) Послеоперационный результат через 10 месяцев.
Наблюдается умеренное увеличение груди и незначительный избыток кожи (класс Симона IIb). ( D – F ) Виды после операции через день после ультразвуковой липосакции и удаления ткани молочной железы с помощью артроскопического шейвера без иссечения кожи. ( G–I ) Послеоперационный результат через 10 месяцев.
Наиболее частым ранним осложнением хирургического лечения гинекомастии является гематома. Также наблюдаются серома, гиперрезекция с блюдцевидной деформацией, недорезекция, неэстетичные рубцы и инфекции.Пациенты и их родители или опекуны должны быть хорошо информированы о возможных рисках, поскольку некоторые осложнения устраняются хирургическим путем.
Заключение
Пубертатная гинекомастия обычно проходит самостоятельно. При обследовании подростков с гинекомастией необходимо собрать исчерпывающий анамнез и провести тщательное физикальное обследование. В большинстве случаев достаточно наблюдения и заверения. Случаи патологической гинекомастии у подростков и препубертатной гинекомастии встречаются редко. В этих двух сценариях всегда следует проводить дальнейшее обследование, чтобы исключить эндокринное заболевание. Когда гинекомастия у подростков сохраняется более одного года, можно рассмотреть возможность хирургического лечения. Хирург сталкивается с рядом методов эксцизии и липосакции, и выбор разреза и процедуры зависит от степени увеличения груди, наличия избытка кожи и предпочтений хирурга и пациента. Метод выбора восстановит мужскую форму груди и устранит избыток кожи с короткими незаметными шрамами.В целом хирургическое лечение гинекомастии, по-видимому, дает удовлетворительные результаты, хотя официальные данные о результатах, о которых сообщают пациенты, отсутствуют. Фармакологическое лечение не рекомендуется подросткам, страдающим гинекомастией, из-за недостатка данных о рисках и преимуществах.
В этих двух сценариях всегда следует проводить дальнейшее обследование, чтобы исключить эндокринное заболевание. Когда гинекомастия у подростков сохраняется более одного года, можно рассмотреть возможность хирургического лечения. Хирург сталкивается с рядом методов эксцизии и липосакции, и выбор разреза и процедуры зависит от степени увеличения груди, наличия избытка кожи и предпочтений хирурга и пациента. Метод выбора восстановит мужскую форму груди и устранит избыток кожи с короткими незаметными шрамами.В целом хирургическое лечение гинекомастии, по-видимому, дает удовлетворительные результаты, хотя официальные данные о результатах, о которых сообщают пациенты, отсутствуют. Фармакологическое лечение не рекомендуется подросткам, страдающим гинекомастией, из-за недостатка данных о рисках и преимуществах.
Литература
2. Бембо С.А., Карлсон Х.Е. Гинекомастия: особенности, когда и как лечить. Клив Клин J Med. 2004;71(6):511–517. [PubMed] [Google Scholar]3. Ma N S, Geffner M E. Гинекомастия у мужчин препубертатного и пубертатного возраста.Curr Opin Педиатр. 2008;20(4):465–470. [PubMed] [Google Scholar]4. Куманов П., Дипиндер Ф., Робева Р., Томова А., Ли Дж., Агарвал А. Связь подростковой гинекомастии с варикоцеле и соматометрическими параметрами: поперечное исследование 6200 здоровых мальчиков. Дж Адолеск Здоровье. 2007;41(2):126–131. [PubMed] [Google Scholar]5. Nuttall F Q. Гинекомастия как физическое явление у нормальных мужчин. J Clin Endocrinol Metab. 1979;48(2):338–340. [PubMed] [Google Scholar]6. Niewoehner CB, Nuttal F Q. Гинекомастия у госпитализированного мужского населения.Am J Med. 1984;77(4):633–638. [PubMed] [Google Scholar]7. Nydick M, Bustos J, Dale JH Jr, Rawson RW. Гинекомастия у мальчиков-подростков. ДЖАМА. 1961; 178: 449–454. [PubMed] [Google Scholar]8. Лемейн В., Симмонс П.С. Девочка-подросток: грудь и репродуктивная эмбриология и анатомия. Клин Анат. 2013;26(1):22–28. [PubMed] [Google Scholar]9. Абаци А., Буюкгебиз А. Гинекомастия: обзор.
Гинекомастия у мужчин препубертатного и пубертатного возраста.Curr Opin Педиатр. 2008;20(4):465–470. [PubMed] [Google Scholar]4. Куманов П., Дипиндер Ф., Робева Р., Томова А., Ли Дж., Агарвал А. Связь подростковой гинекомастии с варикоцеле и соматометрическими параметрами: поперечное исследование 6200 здоровых мальчиков. Дж Адолеск Здоровье. 2007;41(2):126–131. [PubMed] [Google Scholar]5. Nuttall F Q. Гинекомастия как физическое явление у нормальных мужчин. J Clin Endocrinol Metab. 1979;48(2):338–340. [PubMed] [Google Scholar]6. Niewoehner CB, Nuttal F Q. Гинекомастия у госпитализированного мужского населения.Am J Med. 1984;77(4):633–638. [PubMed] [Google Scholar]7. Nydick M, Bustos J, Dale JH Jr, Rawson RW. Гинекомастия у мальчиков-подростков. ДЖАМА. 1961; 178: 449–454. [PubMed] [Google Scholar]8. Лемейн В., Симмонс П.С. Девочка-подросток: грудь и репродуктивная эмбриология и анатомия. Клин Анат. 2013;26(1):22–28. [PubMed] [Google Scholar]9. Абаци А., Буюкгебиз А. Гинекомастия: обзор. Pediatr Endocrinol Rev. 2007;5(1):489–499. [PubMed] [Google Scholar] 10. Мур Д.С., Шлепфер Л.В., Понье Л., Сизоненко П.С.Гормональные изменения в период полового созревания: V. Транзиторная пубертатная гинекомастия: нарушение соотношения андрогенов и эстрогенов. J Clin Endocrinol Metab. 1984;58(3):492–499. [PubMed] [Google Scholar] 11. Матур Р., Браунштейн Г. Д. Гинекомастия: патомеханизмы и стратегии лечения. Горм Рез. 1997;48(3):95–102. [PubMed] [Google Scholar] 12. Lee PA. Отношение концентраций сывороточных гормонов к пубертатной гинекомастии. J Педиатр. 1975;86(2):212–215. [PubMed] [Google Scholar] 13. ЛаФранчи С.Х., Парлоу А.Ф., Липпе Б.М., Койотупа Дж., Каплан С.А.Пубертатная гинекомастия и преходящее повышение уровня эстрадиола в сыворотке. Am J Dis Чайлд. 1975;129(8):927–931. [PubMed] [Google Scholar] 14. Bidlingmaier F, Knorr D. Плазменный тестостерон и эстрогены при пубертатной гинекомастии. Z Kinderheilkd. 1973; 115(1):89–94. [PubMed] [Google Scholar] 15. Биро Ф. М., Лаки А.
Pediatr Endocrinol Rev. 2007;5(1):489–499. [PubMed] [Google Scholar] 10. Мур Д.С., Шлепфер Л.В., Понье Л., Сизоненко П.С.Гормональные изменения в период полового созревания: V. Транзиторная пубертатная гинекомастия: нарушение соотношения андрогенов и эстрогенов. J Clin Endocrinol Metab. 1984;58(3):492–499. [PubMed] [Google Scholar] 11. Матур Р., Браунштейн Г. Д. Гинекомастия: патомеханизмы и стратегии лечения. Горм Рез. 1997;48(3):95–102. [PubMed] [Google Scholar] 12. Lee PA. Отношение концентраций сывороточных гормонов к пубертатной гинекомастии. J Педиатр. 1975;86(2):212–215. [PubMed] [Google Scholar] 13. ЛаФранчи С.Х., Парлоу А.Ф., Липпе Б.М., Койотупа Дж., Каплан С.А.Пубертатная гинекомастия и преходящее повышение уровня эстрадиола в сыворотке. Am J Dis Чайлд. 1975;129(8):927–931. [PubMed] [Google Scholar] 14. Bidlingmaier F, Knorr D. Плазменный тестостерон и эстрогены при пубертатной гинекомастии. Z Kinderheilkd. 1973; 115(1):89–94. [PubMed] [Google Scholar] 15. Биро Ф. М., Лаки А. В., Хастер Г. А., Моррисон Дж. А. Гормональные исследования и физическое созревание при подростковой гинекомастии. J Педиатр. 1990;116(3):450–455. [PubMed] [Google Scholar] 16. Шер Э С, Мигеон С Дж, Берковиц Г Д.Оценка мальчиков с заметным развитием груди в период полового созревания. Клин Педиатр (Фила) 1998; 37 (6): 367–371. [PubMed] [Google Scholar] 17. Evans DG, Bulman M, Young K. et al. Анализ мутаций BRCA1/2 в семьях мужчин с раком молочной железы из Северо-Западной Англии. Фам Рак. 2008;7(2):113–117. [PubMed] [Google Scholar] 18. Бекенштейн М.С., Виндл Б.Х., Строуп Р.Т. мл. Анатомические параметры положения сосков и диаметра ареол у мужчин. Энн Пласт Сург. 1996;36(1):33–36. [PubMed] [Google Scholar] 19. Мерфи Т.П., Эрлихман Р.Дж., Секкель Б.Р.Размещение соска при простой мастэктомии со свободной пластикой соска при тяжелой гинекомастии. Plast Reconstr Surg. 1994; 94(6):818–823. [PubMed] [Google Scholar] 20. Баннаян Г.А., Хайду С.И. Гинекомастия: клинико-патологическое исследование 351 случая.
В., Хастер Г. А., Моррисон Дж. А. Гормональные исследования и физическое созревание при подростковой гинекомастии. J Педиатр. 1990;116(3):450–455. [PubMed] [Google Scholar] 16. Шер Э С, Мигеон С Дж, Берковиц Г Д.Оценка мальчиков с заметным развитием груди в период полового созревания. Клин Педиатр (Фила) 1998; 37 (6): 367–371. [PubMed] [Google Scholar] 17. Evans DG, Bulman M, Young K. et al. Анализ мутаций BRCA1/2 в семьях мужчин с раком молочной железы из Северо-Западной Англии. Фам Рак. 2008;7(2):113–117. [PubMed] [Google Scholar] 18. Бекенштейн М.С., Виндл Б.Х., Строуп Р.Т. мл. Анатомические параметры положения сосков и диаметра ареол у мужчин. Энн Пласт Сург. 1996;36(1):33–36. [PubMed] [Google Scholar] 19. Мерфи Т.П., Эрлихман Р.Дж., Секкель Б.Р.Размещение соска при простой мастэктомии со свободной пластикой соска при тяжелой гинекомастии. Plast Reconstr Surg. 1994; 94(6):818–823. [PubMed] [Google Scholar] 20. Баннаян Г.А., Хайду С.И. Гинекомастия: клинико-патологическое исследование 351 случая.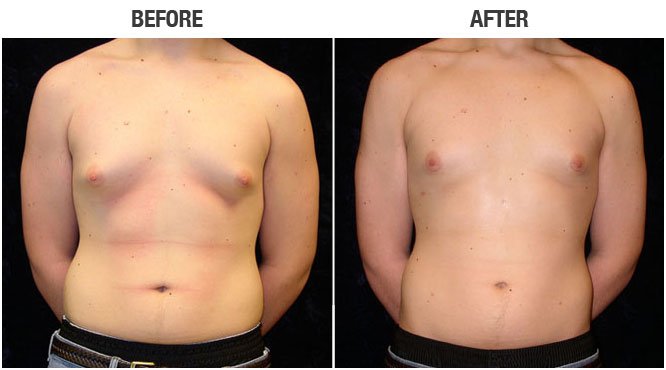 Ам Джей Клин Патол. 1972;57(4):431–437. [PubMed] [Google Scholar] 21. Мейдмент С. Л. Вопрос 2. Какие препараты эффективно уменьшают пубертатную гинекомастию? Арч Дис Чайлд. 2010;95(3):237–239. [PubMed] [Google Scholar] 22. Петти П. М., Соломон М., Бухель Э. В., Тран Н. В. Гинекомастия: развивающаяся парадигма лечения и сравнение методов.Plast Reconstr Surg. 2010;125(5):1301–1308. [PubMed] [Google Scholar] 23. Бакл Р. Терапия даназолом при гинекомастии; Недавний опыт и показания к терапии. Postgrad Med J. 1979; 55 05:71–78. [PubMed] [Google Scholar] 24. Buckle R. Исследования по лечению гинекомастии даназолом (Danol) J Int Med Res. 1977;5 03:114–123. [PubMed] [Google Scholar] 25. Захманн М., Эйхольцер У., Муритано М., Вердер Э.А., Манелла Б. Лечение гинекомастии полового созревания тестолактоном. Acta Endocrinol Suppl (Копенг) 1986; 279:218–226.[PubMed] [Google Scholar] 26. Дерман О., Канбур Н. О., Кутлук Т. Лечение тамоксифеном пубертатной гинекомастии. Int J Adolesc Med Health. 2003;15(4):359–363.
Ам Джей Клин Патол. 1972;57(4):431–437. [PubMed] [Google Scholar] 21. Мейдмент С. Л. Вопрос 2. Какие препараты эффективно уменьшают пубертатную гинекомастию? Арч Дис Чайлд. 2010;95(3):237–239. [PubMed] [Google Scholar] 22. Петти П. М., Соломон М., Бухель Э. В., Тран Н. В. Гинекомастия: развивающаяся парадигма лечения и сравнение методов.Plast Reconstr Surg. 2010;125(5):1301–1308. [PubMed] [Google Scholar] 23. Бакл Р. Терапия даназолом при гинекомастии; Недавний опыт и показания к терапии. Postgrad Med J. 1979; 55 05:71–78. [PubMed] [Google Scholar] 24. Buckle R. Исследования по лечению гинекомастии даназолом (Danol) J Int Med Res. 1977;5 03:114–123. [PubMed] [Google Scholar] 25. Захманн М., Эйхольцер У., Муритано М., Вердер Э.А., Манелла Б. Лечение гинекомастии полового созревания тестолактоном. Acta Endocrinol Suppl (Копенг) 1986; 279:218–226.[PubMed] [Google Scholar] 26. Дерман О., Канбур Н. О., Кутлук Т. Лечение тамоксифеном пубертатной гинекомастии. Int J Adolesc Med Health. 2003;15(4):359–363. [PubMed] [Google Scholar] 27. Дерман О., Канбур Н. О., Токур Т. Е. Влияние тамоксифена на глобулин, связывающий половые гормоны, у подростков с пубертатной гинекомастией. J Pediatr Endocrinol Metab. 2004;17(8):1115–1119. [PubMed] [Google Scholar] 28. Plourde PV, Reiter EO, Jou HC и др. Безопасность и эффективность анастрозола для лечения пубертатной гинекомастии: рандомизированное двойное слепое плацебо-контролируемое исследование.J Clin Endocrinol Metab. 2004;89(9):4428–4433. [PubMed] [Google Scholar] 29. Лоуренс С.Э., Фут К.А., Ветамуту Дж., Лоусон М.Л. Благоприятные эффекты ралоксифена и тамоксифена при лечении пубертатной гинекомастии. J Педиатр. 2004;145(1):71–76. [PubMed] [Google Scholar] 30. Саймон Б.Е., Хоффман С., Кан С. Классификация и хирургическая коррекция гинекомастии. Plast Reconstr Surg. 1973; 51 (1): 48–52. [PubMed] [Google Scholar] 31. Rohrich RJ Ha R Y Kenkel J M Adams W P Jr Классификация и лечение гинекомастии: определение роли ультразвуковой липосакции Plast Reconstr Surg 20031112909–923.
[PubMed] [Google Scholar] 27. Дерман О., Канбур Н. О., Токур Т. Е. Влияние тамоксифена на глобулин, связывающий половые гормоны, у подростков с пубертатной гинекомастией. J Pediatr Endocrinol Metab. 2004;17(8):1115–1119. [PubMed] [Google Scholar] 28. Plourde PV, Reiter EO, Jou HC и др. Безопасность и эффективность анастрозола для лечения пубертатной гинекомастии: рандомизированное двойное слепое плацебо-контролируемое исследование.J Clin Endocrinol Metab. 2004;89(9):4428–4433. [PubMed] [Google Scholar] 29. Лоуренс С.Э., Фут К.А., Ветамуту Дж., Лоусон М.Л. Благоприятные эффекты ралоксифена и тамоксифена при лечении пубертатной гинекомастии. J Педиатр. 2004;145(1):71–76. [PubMed] [Google Scholar] 30. Саймон Б.Е., Хоффман С., Кан С. Классификация и хирургическая коррекция гинекомастии. Plast Reconstr Surg. 1973; 51 (1): 48–52. [PubMed] [Google Scholar] 31. Rohrich RJ Ha R Y Kenkel J M Adams W P Jr Классификация и лечение гинекомастии: определение роли ультразвуковой липосакции Plast Reconstr Surg 20031112909–923. , обсуждение 924–925 [PubMed] [Google Scholar]32. Фрухсторфер Б.Х., Малата С.М. Систематический подход к хирургическому лечению гинекомастии. Бр Дж Пласт Хирург. 2003;56(3):237–246. [PubMed] [Google Scholar] 34. Морселли П. Г. «Вытягивание»: новая техника уменьшения груди при гинекомастии. Plast Reconstr Surg. 1996;97(2):450–454. [PubMed] [Google Scholar] 35. Морселли П. Г., Мореллини А. Изменение формы груди при гинекомастии с помощью «метода протягивания»: соображения после 15 лет. Eur J Plast Surg.2012;35(5):365–371. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Хаммонд Д. К. Арнольд Дж. Ф. Саймон А. М. Капраро П. А. Комбинированное использование ультразвуковой липосакции с методом протягивания для лечения гинекомастии Plast Reconstr Surg 20031123891–895., обсуждение 896–897 [PubMed] [Google Scholar]37. Листа Ф., Ахмад Дж. Липосакция с электроприводом и метод протягивания для лечения гинекомастии. Plast Reconstr Surg. 2008;121(3):740–747. [PubMed] [Google Scholar]
, обсуждение 924–925 [PubMed] [Google Scholar]32. Фрухсторфер Б.Х., Малата С.М. Систематический подход к хирургическому лечению гинекомастии. Бр Дж Пласт Хирург. 2003;56(3):237–246. [PubMed] [Google Scholar] 34. Морселли П. Г. «Вытягивание»: новая техника уменьшения груди при гинекомастии. Plast Reconstr Surg. 1996;97(2):450–454. [PubMed] [Google Scholar] 35. Морселли П. Г., Мореллини А. Изменение формы груди при гинекомастии с помощью «метода протягивания»: соображения после 15 лет. Eur J Plast Surg.2012;35(5):365–371. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Хаммонд Д. К. Арнольд Дж. Ф. Саймон А. М. Капраро П. А. Комбинированное использование ультразвуковой липосакции с методом протягивания для лечения гинекомастии Plast Reconstr Surg 20031123891–895., обсуждение 896–897 [PubMed] [Google Scholar]37. Листа Ф., Ахмад Дж. Липосакция с электроприводом и метод протягивания для лечения гинекомастии. Plast Reconstr Surg. 2008;121(3):740–747. [PubMed] [Google Scholar]гинекомастия | патология | Британика
гинекомастия , увеличение молочных желез у мужчин, обычно из-за гормонального дисбаланса.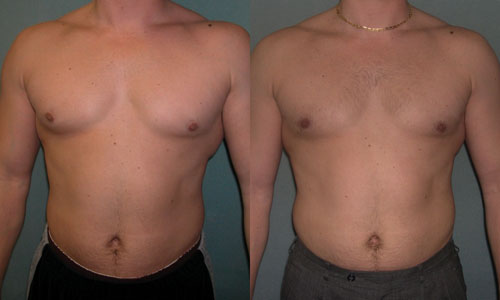 Рост и развитие мужской груди происходит так же, как у женской до полового созревания. Затем мужские репродуктивные органы (яички) начинают выделять мужские гормоны (андрогены), которые обычно подавляют дальнейшее развитие груди. Грудь женщины продолжает расти из-за присутствия женского гормона эстрогена. Гинекомастия может развиться в любом возрасте у мужчин, но чаще встречается в подростковом или старческом возрасте. Обычно поражается только одна грудь. В некоторых случаях только сосок и окружающие его ткани (ареолы) опухают до пуговичного увеличения; реже вся грудь может принимать размеры нормального женского органа.
Рост и развитие мужской груди происходит так же, как у женской до полового созревания. Затем мужские репродуктивные органы (яички) начинают выделять мужские гормоны (андрогены), которые обычно подавляют дальнейшее развитие груди. Грудь женщины продолжает расти из-за присутствия женского гормона эстрогена. Гинекомастия может развиться в любом возрасте у мужчин, но чаще встречается в подростковом или старческом возрасте. Обычно поражается только одна грудь. В некоторых случаях только сосок и окружающие его ткани (ареолы) опухают до пуговичного увеличения; реже вся грудь может принимать размеры нормального женского органа.
Увеличение в результате роста соединительной ткани. В ткани могут образовываться молочные протоки и ложные молочные полости. Жидкость может выделяться из соска либо спонтанно, либо в результате манипуляций; жидкости не содержат молока. Состояния, называемые псевдогинекомастией, вызваны избыточным содержанием жира в организме, воспалительными заболеваниями, зернистыми поражениями или ростом опухолей.
Британская викторина
44 вопроса из самых популярных викторин Britannica о здоровье и медицине
Как много вы знаете об анатомии человека? Как насчет медицинских условий? Мозг? Вам нужно много знать, чтобы ответить на 44 самых сложных вопроса самых популярных викторин Britannica о здоровье и медицине.
Истинная гинекомастия связана с гормональным дисбалансом или повышением уровня эстрогенных гормонов у мужчин. Опухоли, расположенные в других частях мужского тела, могут вызывать аномалии эстрогена; в этих случаях гинекомастия является вторичным заболеванием по отношению к другим заболеваниям. Опухоли яичек или гипофиза обычно являются причиной гинекомастии. У пожилых мужчин наблюдается более высокая частота этой аномалии из-за снижения секреции андрогенов в результате старения.
Thelarche — обзор | ScienceDirect Topics
Эмбриология и развитие
Развитие молочной железы начинается на пятой неделе внутриутробного развития, когда происходит ряд строго упорядоченных событий, включающих взаимодействие между несколькими различными типами клеток.Множество системных и местных факторов, таких как факторы роста и гормоны, регулируют эти сложные взаимодействия. Развитие органа изначально идентично у самцов и самок одного и того же вида.
На пятой неделе беременности остатки эктодермы грудного гребня начинают пролиферировать. Этот первичный зачаток молочной железы впоследствии начинает расти вниз в виде твердого дивертикула в подлежащую дерму в течение седьмой недели. Первоначально на вентральной поверхности плода появляется пара молочных прожилок или молочных линий , примитивное утолщение эктодермы, идущее от подмышечных впадин к паху.
Первоначально на вентральной поверхности плода появляется пара молочных прожилок или молочных линий , примитивное утолщение эктодермы, идущее от подмышечных впадин к паху.
При нормальном развитии человека молочные линии исчезают, за исключением уровня четвертого межреберья на передней части грудной клетки, где впоследствии развивается молочная железа. Отсутствие регрессии молочных линий в областях, отличных от грудной, может привести к эктопии тканей молочной железы, включая лишние соски в любом месте вдоль молочной линии. 1, 2 Первичный зачаток молочной железы впоследствии начинает расти вниз в виде твердого дивертикула в подлежащую дерму в течение седьмой недели.К 10-й неделе первичная почка начинает ветвиться, давая к 12-й неделе вторичные почки, которые в конечном итоге развиваются в молочные дольки взрослой груди.
Было показано, что этот начальный рост и последующее ветвление происходят в результате индуктивного влияния внеклеточного матрикса мезодермы на первичный зачаток молочной железы. Эта эпителиально-мезенхимальная передача сигналов, вероятно, осуществляется через паракринные и юкстакринные механизмы, когда нижележащая мезодерма продуцирует факторы роста и гормоны, которые взаимодействуют с рецепторами на вышележащих эктодермальных клетках первичного зачатка молочной железы.Жировая ткань в нижележащей мезодерме представляет собой значительный запас липидов для производства гормонов и факторов роста, которые затем становятся доступными для стимуляции и регуляции роста развивающейся молочной железы.
Эта эпителиально-мезенхимальная передача сигналов, вероятно, осуществляется через паракринные и юкстакринные механизмы, когда нижележащая мезодерма продуцирует факторы роста и гормоны, которые взаимодействуют с рецепторами на вышележащих эктодермальных клетках первичного зачатка молочной железы.Жировая ткань в нижележащей мезодерме представляет собой значительный запас липидов для производства гормонов и факторов роста, которые затем становятся доступными для стимуляции и регуляции роста развивающейся молочной железы.
В течение оставшейся части беременности эти зачатки продолжают удлиняться и ветвиться. В течение 20-й недели в почках развиваются небольшие просветы, которые сливаются и удлиняются, образуя млечные протоки. Канализация зачатков молочных желез с образованием млечных протоков индуцируется попаданием в кровоток плода плацентарных гормонов.Эти гормоны включают прогестерон, гормон роста, инсулиноподобный фактор роста, эстроген, пролактин, кортикоиды надпочечников и трийодтиронин. В срок формируется от 15 до 20 долей железистой ткани, каждая из которых содержит млечный проток. Поддерживающая волокнистая соединительная ткань, связки Купера и жир молочной железы развиваются из окружающей мезодермы. 3
В срок формируется от 15 до 20 долей железистой ткани, каждая из которых содержит млечный проток. Поддерживающая волокнистая соединительная ткань, связки Купера и жир молочной железы развиваются из окружающей мезодермы. 3
До периода полового созревания молочные железы состоят из млечных протоков без признаков альвеолярной дифференцировки, хотя некоторые развитые рудиментарные дольчатые структуры могут сохраняться. 4
У женщин начало менструального цикла и секреция половых гормонов в период полового созревания стимулируют пролиферацию протоков и формирование долек. В строме накапливается жировая ткань. 5
Жировая ткань и молочные протоки растут в ответ на эстроген. Стимуляция прогестроном приводит к дольковому росту и альвеолярному отпочкованию. Телархе, или начало пубертатного развития груди, происходит в возрасте от 11 до 11,5 лет. Аномалии развития груди включают амастию (отсутствие груди), избыточную грудь/полителию (добавочные соски) и полимастию (добавочная грудь), гипомастию (чрезмерно маленькая грудь) и макромастию (чрезмерно большая грудь). 6
6
Гинекомастия — Консервативное и хирургическое лечение — Полный текст — Уход за грудью 2018, Vol. 13, № 6
Гинекомастия определяется как одностороннее или двустороннее стойкое доброкачественное увеличение молочной железы у мужчин. Распространенность бессимптомной гинекомастии достигает 65%. Истинную гинекомастию следует отличать от псевдогинекомастии. Как правило, при истинной гинекомастии под сосково-ареолярным комплексом пальпируется солидная ткань. Злокачественные изменения, такие как рак молочной железы у мужчин, всегда должны быть исключены.Причины гинекомастии разнообразны. Дисбаланс женских и мужских гормонов провоцирует начало заболевания. Этот дисбаланс может быть вызван эндогенными заболеваниями, такими как гипертиреоз, хронические заболевания печени, первичная или вторичная недостаточность половых желез, синдромы резистентности к андрогенам, прием лекарств и злоупотребление наркотиками. Ряд лекарств от сердца или гипертонии также может вызвать гинекомастию.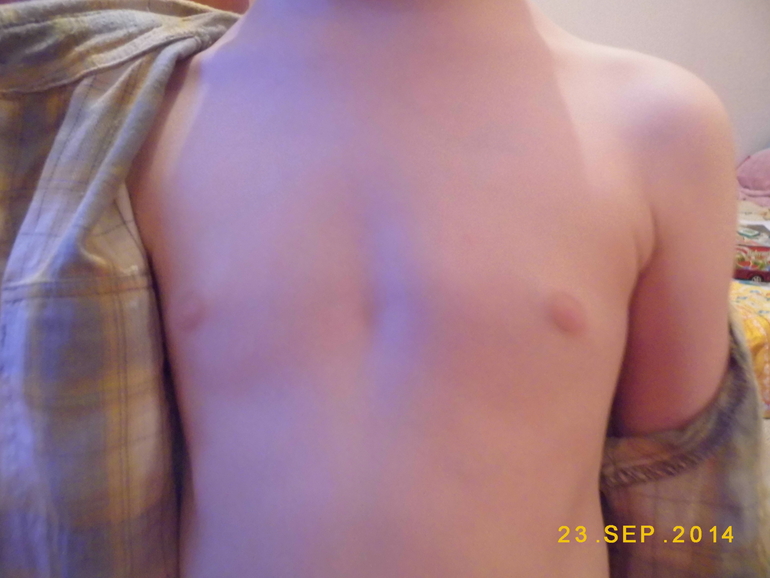 Основным требованием для правильного планирования терапии является знание триггеров и возможных вариантов лекарственной терапии. Очень важно узнать об образе жизни пациента и истории болезни.Лекарственная терапия тамоксифеном может быть рассмотрена на ранней стадии. При гинекомастии, сохраняющейся более 12 месяцев, хирургическое иссечение является методом выбора, и существует несколько хирургических вариантов, доступных в зависимости от степени гинекомастии. Вдумчивый подход к управлению этим состоянием может привести к высокой степени удовлетворенности пациентов.
Основным требованием для правильного планирования терапии является знание триггеров и возможных вариантов лекарственной терапии. Очень важно узнать об образе жизни пациента и истории болезни.Лекарственная терапия тамоксифеном может быть рассмотрена на ранней стадии. При гинекомастии, сохраняющейся более 12 месяцев, хирургическое иссечение является методом выбора, и существует несколько хирургических вариантов, доступных в зависимости от степени гинекомастии. Вдумчивый подход к управлению этим состоянием может привести к высокой степени удовлетворенности пациентов.
© 2018 S. Karger GmbH, Фрайбург
Введение
Супернатант ткани мужской молочной железы является частой находкой и появляется одно- или двусторонне у 32-65% всех мужчин [1,2,3,5] (рис. .1, 2, 3, 4). Термин гинекомастия происходит от греческих слов gyne (женщина) и mastos (грудь) и описывает феминизацию мужской груди [4]. Истинная гинекомастия обусловлена разрастанием молочных желез с появлением плотной субареолярной железистой ткани [5] и должна быть дифференцирована от псевдогинекомастии из-за жировых отложений при ожирении.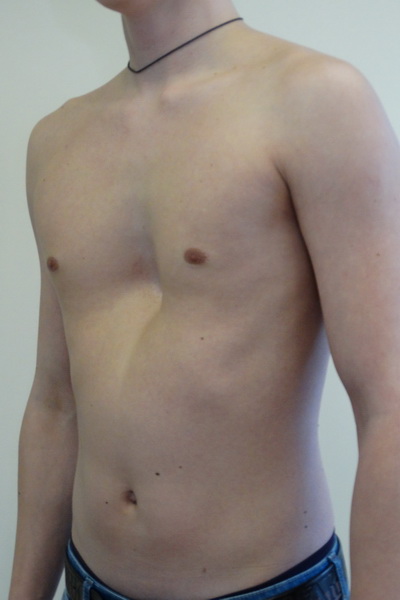 Классификация гинекомастии основана на клиническом обследовании с измерением объема и степени птоза железистой ткани [6] (табл. 1).В большинстве случаев гинекомастия протекает бессимптомно; однако это может быть связано с болью и болезненностью молочной железы. Психологические нарушения, связанные с нарушением образа тела, распространены и особенно затрагивают подростков [7].
Классификация гинекомастии основана на клиническом обследовании с измерением объема и степени птоза железистой ткани [6] (табл. 1).В большинстве случаев гинекомастия протекает бессимптомно; однако это может быть связано с болью и болезненностью молочной железы. Психологические нарушения, связанные с нарушением образа тела, распространены и особенно затрагивают подростков [7].
Таблица 1
Классификация гинекомастии [6]
Рис. 1
Гинекомастия до операции, фронтальная.
Рис. 2
Гинекомастия до операции, вид сбоку справа.
Рис. 3
Гинекомастия до операции, вид сбоку слева.
Рис. 4
Этиология
Причины гинекомастии многофакторны, и 25% всех случаев проявляются идиопатически. Среди основных причин выделяют 3 группы триггеров: физиологические, патологические и фармакологические/токсические. Было показано, что патофизиологически дисбаланс женских гормонов вызывает рост желез. Этот дисбаланс, в свою очередь, также может иметь патологическое или физиологическое/идиопатическое происхождение. Имеются убедительные доказательства стимулирующего действия эстрогена на развитие ткани молочной железы.Любое расстройство или лекарство, приводящее к дисбалансу женских гормонов, может вызвать гинекомастию. Эндогенные заболевания, такие как гипертиреоз, хронические заболевания печени, первичная или вторичная гонадная недостаточность, синдромы резистентности к андрогенам, лекарственные препараты и факторы образа жизни, такие как злоупотребление наркотиками, представляют собой типичные причины гинекомастии [8] (таблица 2). В большинстве случаев гинекомастия обусловлена кратковременными гормональными колебаниями, ограничивающими себя физиологически, что может возникать в неонатальном периоде, в период полового созревания и у мужчин пожилого возраста.В неонатальном периоде предварительный физиологический двусторонний отек молочных желез вызывается материнскими плацентарными эстрогенами и проходит в течение нескольких недель после рождения. В подростковом возрасте может развиться физиологическая пубертатная гинекомастия, которая может длиться до 6 месяцев.
Имеются убедительные доказательства стимулирующего действия эстрогена на развитие ткани молочной железы.Любое расстройство или лекарство, приводящее к дисбалансу женских гормонов, может вызвать гинекомастию. Эндогенные заболевания, такие как гипертиреоз, хронические заболевания печени, первичная или вторичная гонадная недостаточность, синдромы резистентности к андрогенам, лекарственные препараты и факторы образа жизни, такие как злоупотребление наркотиками, представляют собой типичные причины гинекомастии [8] (таблица 2). В большинстве случаев гинекомастия обусловлена кратковременными гормональными колебаниями, ограничивающими себя физиологически, что может возникать в неонатальном периоде, в период полового созревания и у мужчин пожилого возраста.В неонатальном периоде предварительный физиологический двусторонний отек молочных желез вызывается материнскими плацентарными эстрогенами и проходит в течение нескольких недель после рождения. В подростковом возрасте может развиться физиологическая пубертатная гинекомастия, которая может длиться до 6 месяцев.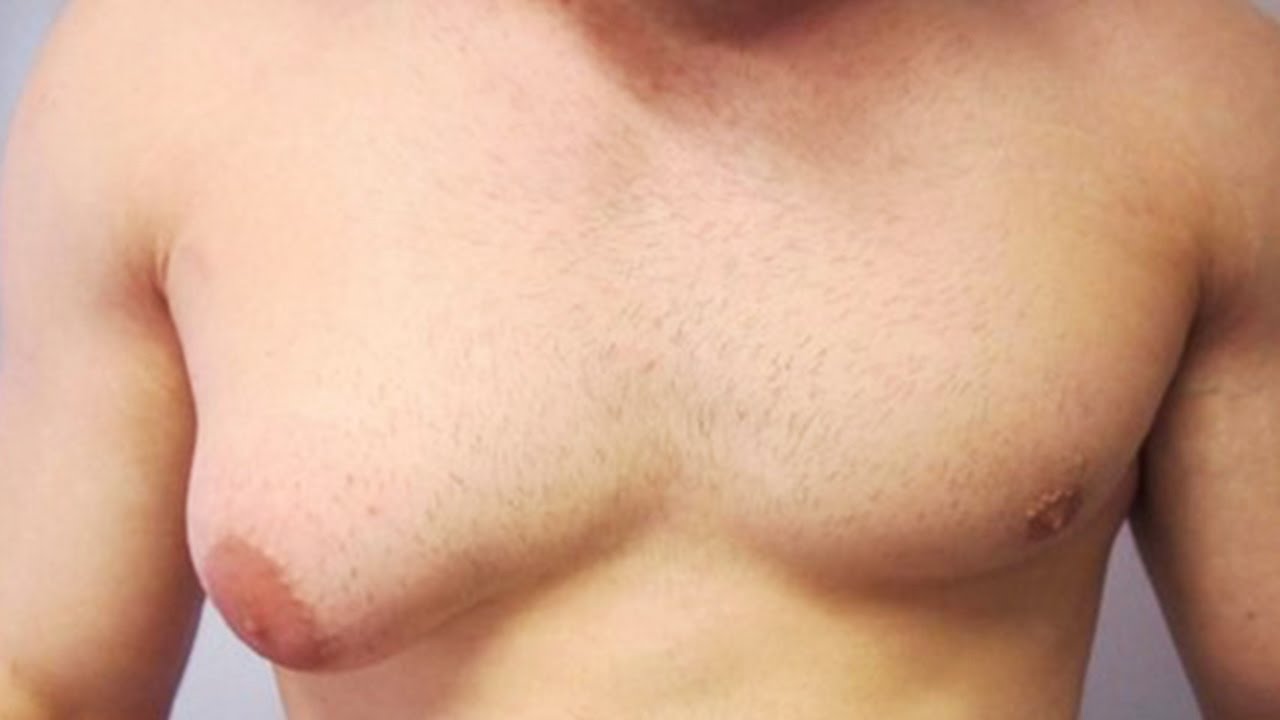 Это вызвано относительным избытком эстрогенов, в основном из-за периферической ароматизации андрогенов яичек и надпочечников. Продукция тестикулярного тестостерона увеличивается в конце полового созревания и приводит к спонтанной регрессии гинекомастии [9].Из-за снижения выработки тестостерона и повышения уровня глобулина, связывающего половые гормоны, гинекомастия также часто встречается у пожилых мужчин.
Это вызвано относительным избытком эстрогенов, в основном из-за периферической ароматизации андрогенов яичек и надпочечников. Продукция тестикулярного тестостерона увеличивается в конце полового созревания и приводит к спонтанной регрессии гинекомастии [9].Из-за снижения выработки тестостерона и повышения уровня глобулина, связывающего половые гормоны, гинекомастия также часто встречается у пожилых мужчин.
Таблица 2
Причины гинекомастии [3, 6, 8]
Диагностика
Первым шагом в диагностике гинекомастии является дифференциация псевдогинекомастии и истинной гинекомастии. В случае истинной гинекомастии проводят клиническое обследование путем пальпации с последующим ультразвуковым исследованием (рис. 5) и, при необходимости, маммографией (рис.6) обнажают железистую ткань. Пальпация груди уже должна клинически отличить жировую ткань от железистой ткани и должна включать более подробную оценку груди, такую как птоз, избыток кожи и ретракция соска. Физикальное обследование должно также включать пальпацию яичек, чтобы выявить изменения и атрофию яичек на ранней стадии и подготовить почву для дальнейших диагностических мероприятий. В частности, у юношей с негативным анамнезом и двусторонней гинекомастией значительно возрастает частота эндокринных опухолей яичек [10].
В частности, у юношей с негативным анамнезом и двусторонней гинекомастией значительно возрастает частота эндокринных опухолей яичек [10].
Рис. 5
УЗИ молочных желез с обеих сторон.
Рис. 6
Диагноз гинекомастии должен быть подтвержден гистологически с помощью сонографически коррелированной основной биопсии для исключения злокачественного новообразования (рис. 7), демонстрирующей чувствительность и специфичность 90% [11]. Для постановки диагноза необходим тщательный сбор анамнеза, особенно в отношении привычек образа жизни, наркотиков и медикаментов. Следует узнать о недавних изменениях, например о начале антигипертензивной лекарственной терапии.Стандартная диагностика включает лабораторные тесты, такие как хориальный гонадотропин человека, лютеинизирующий гормон, тиреотропный гормон, тестостерон и эстрадиол [12]. В связи с циркадным ритмом секреции гормонов лабораторный мониторинг необходимо проводить утром в момент максимального выброса гормона [13].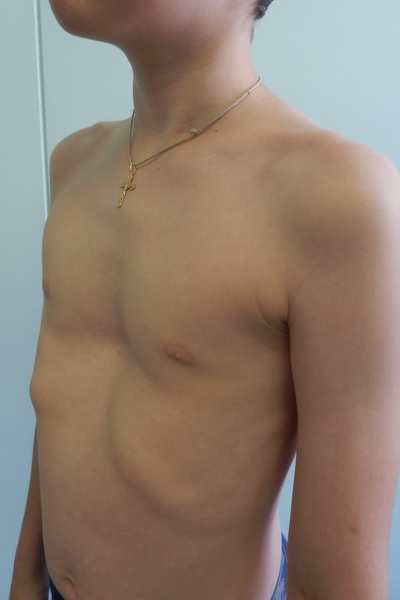
Рис. 7
Гематоксилин/эозин, ×2; увеличенные железистые элементы погружены в богатую клетками, частично отечную рыхлую строму и окружены обильной жировой тканью.
Консервативное и хирургическое лечение
В зависимости от основной причины лечение гинекомастии может быть консервативным или хирургическим.Самокупирующиеся физиологические формы гинекомастии следует наблюдать до разрешения. В случае персистенции или прогрессирования при необходимости следует повторить лабораторные диагностические исследования для скорейшего выявления гормональных процессов. Консервативная терапия должна основываться на причине гинекомастии.
При наличии гипогонадизма рекомендуется симптоматическая терапия тестостероном.
В случае медикаментозно индуцированной гинекомастии следует рассмотреть вопрос о прекращении приема препарата или переходе на другой препарат; однако в этих случаях не всегда возможно изменить или отменить лекарство.В то время как многие антигипертензивные препараты вызывают гинекомастию как побочный эффект, спиронолактон имеет самую сильную связь с гинекомастией [14].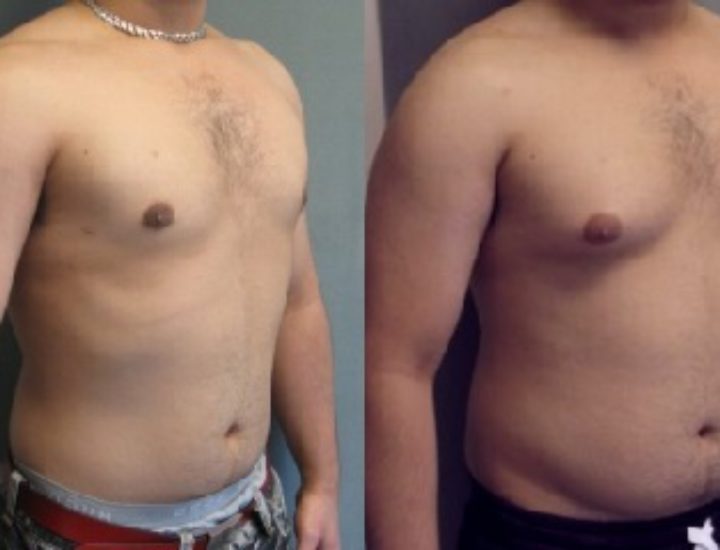 Меньшая частота гинекомастии была показана для селективного антагониста альдостерона эплеренона [15]. Если в анамнезе есть триггеры, такие как самостоятельный прием гормонов для бодибилдинга или наркотиков, их следует прекратить.
Меньшая частота гинекомастии была показана для селективного антагониста альдостерона эплеренона [15]. Если в анамнезе есть триггеры, такие как самостоятельный прием гормонов для бодибилдинга или наркотиков, их следует прекратить.
Вариантом консервативной терапии является введение модуляторов сывороточных рецепторов эстрогена, таких как тамоксифен. Тамоксифен в суточной пероральной дозе 20 мг на срок до 3 месяцев показал хорошие результаты в рандомизированных и нерандомизированных исследованиях.Регресс гинекомастии наблюдается у 80% пациентов [16]. Однако имеющиеся данные о тамоксифене получены из нескольких исследований с очень небольшим числом случаев [17]. Неблагоприятные побочные эффекты, в том числе эпигастральный дистресс и посттравматический тромбоз глубоких вен, отмечаются редко [18]. Использование анастрозола, ингибитора ароматазы, не рекомендуется, поскольку он не показал большей эффективности, чем плацебо, у мальчиков с пубертатной гинекомастией [19].
Больные раком предстательной железы представляют собой особую группу, получающую антиандрогенную терапию, с высоким риском развития ятрогенной гинекомастии..jpg) Тамоксифен или даже лучевая терапия могут уменьшить гинекомастию у этих пациентов [20,21].
Тамоксифен или даже лучевая терапия могут уменьшить гинекомастию у этих пациентов [20,21].
Облучение в малых дозах, в основном отдельными фракциями (12–15 Гр), можно использовать в качестве профилактики для снижения риска гинекомастии, вызванной антиандрогенами [22].
При рассмотрении попыток консервативной фармакологической терапии следует учитывать, что гипертрофированная железистая ткань становится необратимо фиброзной путем ремоделирования не более чем через 12 мес. Эта фиброзная ткань не может быть удалена консервативно, и необходимо рассмотреть возможность хирургического лечения [23].
Показание к хирургическому лечению основано на страдании пациента, включая психосоциальный стресс и боль, а также косметическую деформацию [24]. Целью всех хирургических вмешательств является удаление гипертрофированной фиброзной железистой ткани и восстановление мужской формы груди. Терапевтические методы включают резекцию ткани молочной железы, липосакцию и комбинированные методы. Начиная со стадии III, редукционная маммопластика должна рассматриваться с учетом протяженности гипертрофированной ткани и опыта хирурга (таблица 3) [25].При более легких формах может быть достаточно разреза периареолярного края до мастэктомии (рис. 8, рис. 9). В случае избытка кожи следует уменьшить кожную оболочку с помощью таких методов, как процедура уменьшения кожи, разработанная Benelli [26] (рис. 10), или мастэктомия с репозицией соска, разработанная Kornstein [27] (рис. 11). . Поскольку открытые хирургические процедуры могут привести к появлению неприглядных рубцов, Bailey et al. разработали технику уменьшения рубцов. [28]. Липосакция используется с методом «вытягивания» для удаления железистой ткани без дополнительного разреза; с помощью зажима Кохера ткань захватывают и вытягивают [29].Избыток кожи является ограничивающим фактором для этой техники. Из-за слабых данных невозможно дать рекомендации в отношении наилучшего хирургического доступа [30].
Начиная со стадии III, редукционная маммопластика должна рассматриваться с учетом протяженности гипертрофированной ткани и опыта хирурга (таблица 3) [25].При более легких формах может быть достаточно разреза периареолярного края до мастэктомии (рис. 8, рис. 9). В случае избытка кожи следует уменьшить кожную оболочку с помощью таких методов, как процедура уменьшения кожи, разработанная Benelli [26] (рис. 10), или мастэктомия с репозицией соска, разработанная Kornstein [27] (рис. 11). . Поскольку открытые хирургические процедуры могут привести к появлению неприглядных рубцов, Bailey et al. разработали технику уменьшения рубцов. [28]. Липосакция используется с методом «вытягивания» для удаления железистой ткани без дополнительного разреза; с помощью зажима Кохера ткань захватывают и вытягивают [29].Избыток кожи является ограничивающим фактором для этой техники. Из-за слабых данных невозможно дать рекомендации в отношении наилучшего хирургического доступа [30].
Таблица 3
Хирургическое лечение гинекомастии [24]
Рис.
 8
8Послеоперационная гинекомастия, периареолярная подкожная мастэктомия, фронтальная.
Рис. 9
Послеоперационная гинекомастия, периареолярная подкожная мастэктомия, вид сбоку слева.
Рис. 10
Оперативная процедура по Бенелли [25].
Рис. 11
Операция по Корнштейну [26].
В целом, хорошее предоперационное планирование приводит к хорошим косметическим результатам с высокой степенью удовлетворенности пациентов и низким уровнем осложнений (рис. 12).
Рис. 12
Алгоритм оценки и лечения гинекомастии (с изменениями из [6,11,28,30]).
Заявление о раскрытии информации
У автора нет конфликта интересов.
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
.
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности.Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам. Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Развитие молочной железы у трансгенных самцов мышей, экспрессирующих ароматазу P450 человека | Эндокринология
Аннотация
Недавно мы создали трансгенную линию мышей, которая экспрессирует ген ароматазы человека под промотором убиквитина С (AROM+).Ранее мы показали, что у этих мышей концентрация эстрадиола в сыворотке сильно повышена, тогда как концентрация тестостерона снижена. В настоящем исследовании мы изучали развитие молочных желез у самцов мышей AROM+ в разном возрасте и обнаружили, что молочные железы самцов AROM+ претерпевают протоковое и альвеолярное развитие, морфологически напоминающее терминально дифференцированные молочные железы самок, экспрессируя мРНК гена молочного белка (β- казеин). Мужские молочные железы также экспрессируют множественные гормональные рецепторы, типичные для женской молочной железы: рецептор эстрогена α и β, рецептор прогестерона и рецептор ПРЛ. Кроме того, данные показали активацию сигнального пути Stat5 (преобразователь сигнала и активатор транскрипции 5) в мужской молочной железе AROM+. Интересно, что наблюдаемый фенотип частично обратим. Лечение финрозолом, специфическим ингибитором ароматазы, вызвало инволюцию дифференцированного фенотипа молочной железы, характеризующуюся исчезновением альвеолярных структур и большинства третичных боковых ветвей протоков. Настоящая животная модель является ценным инструментом для лучшего понимания клеточных и молекулярных механизмов, участвующих в развитии гинекомастии.
Кроме того, данные показали активацию сигнального пути Stat5 (преобразователь сигнала и активатор транскрипции 5) в мужской молочной железе AROM+. Интересно, что наблюдаемый фенотип частично обратим. Лечение финрозолом, специфическим ингибитором ароматазы, вызвало инволюцию дифференцированного фенотипа молочной железы, характеризующуюся исчезновением альвеолярных структур и большинства третичных боковых ветвей протоков. Настоящая животная модель является ценным инструментом для лучшего понимания клеточных и молекулярных механизмов, участвующих в развитии гинекомастии.
АНДРОГЕНЫ И Эстрогены оказывают противоположное действие на молочную железу во время эмбриогенеза; эстрогены оказывают стимулирующее, а андрогены тормозящее действие на его рост. У взрослых влияние андрогенов менее изучено, и результаты все еще противоречивы. Однако увеличение груди у мужчин, гинекомастия, может быть результатом несбалансированного действия андрогенов и эстрогенов либо из-за снижения продукции и/или действия тестостерона, либо из-за увеличения продукции и/или действия эстрогенов.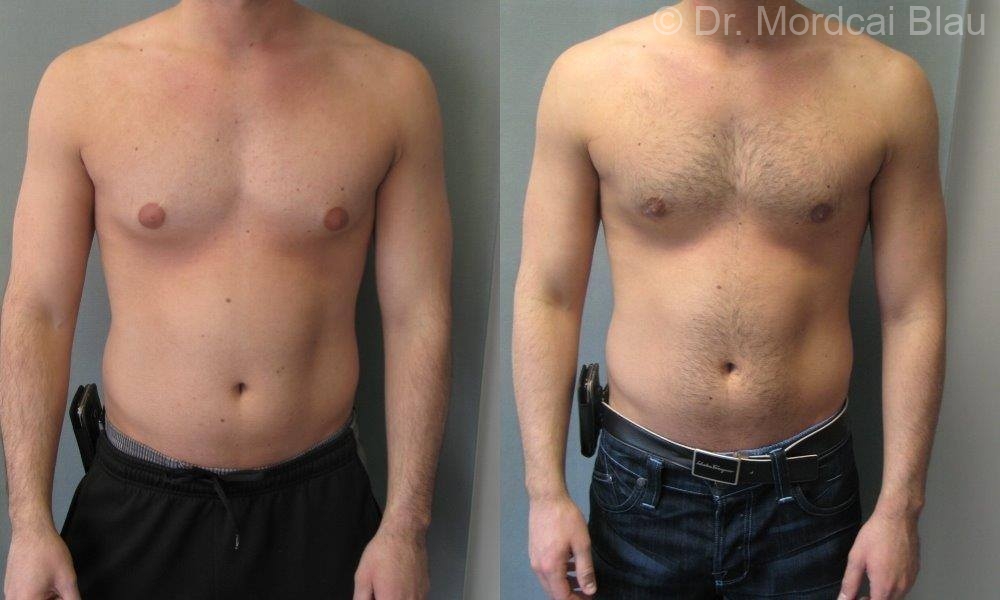 В ситуациях, когда концентрация андрогенов и эстрогенов в сыворотке не изменяется, предполагается, что гинекомастия связана с избыточным локальным образованием эстрогенов в молочной железе (1). Гинекомастия часто развивается как следствие антиандрогенной терапии, что дополнительно подтверждает роль андрогенов в развитии гинекомастии. Однако механизм антиандрогенного действия до конца не изучен (2). Антиандрогены, такие как флутамид, нарушают механизм тестикулярно-гипоталамической обратной связи и впоследствии стимулируют выработку андрогенов, но одновременно блокируют связывание рецепторов андрогенов в молочной железе.
В ситуациях, когда концентрация андрогенов и эстрогенов в сыворотке не изменяется, предполагается, что гинекомастия связана с избыточным локальным образованием эстрогенов в молочной железе (1). Гинекомастия часто развивается как следствие антиандрогенной терапии, что дополнительно подтверждает роль андрогенов в развитии гинекомастии. Однако механизм антиандрогенного действия до конца не изучен (2). Антиандрогены, такие как флутамид, нарушают механизм тестикулярно-гипоталамической обратной связи и впоследствии стимулируют выработку андрогенов, но одновременно блокируют связывание рецепторов андрогенов в молочной железе.
Большинство недавних исследований были сосредоточены на распространенности и клиническом лечении гинекомастии, но гормональные причины все еще плохо изучены, особенно прямые и возможные антагонистические действия андрогенов на действие эстрогенов или андроген-независимое действие эстрогенов. в мужской молочной железе. Животная модель с состоянием, напоминающим гинекомастию, могла бы стать ценным инструментом для лучшего понимания клеточных и молекулярных механизмов, участвующих в развитии гинекомастии, а также для проведения доклинических исследований эффективных гормональных препаратов, влияющих на баланс андрогенов и эстрогенов, таких как ингибиторы ароматазы. .Сообщалось, что у трансгенных самцов мышей со сверхэкспрессией ароматазы P450 [вирус опухоли молочной железы мыши (MMTV)-arom+] в возрасте 3 месяцев развиваются изменения, подобные гинекомастии (3). Сообщается, что под контролем полного MMTV-длинного терминального повтора трансген ароматазы активируется в начале полового созревания и экспрессируется в молочной железе, что приводит к локальному перепроизводству эстрогенов. У этих трансгенных мышей периферические концентрации эстрогенов были лишь слегка повышены. Недавно мы создали еще одну линию трансгенных мышей, которая экспрессирует ген ароматазы человека Р450 под промотором человеческого убиквитина С (AROM+) (4).Известно, что промотор убиквитина С активируется в пренатальный день 15 (5). Экспрессия трансгена была продемонстрирована в нескольких тканях взрослых, таких как яички и печень (4), а концентрация эстрадиола в сыворотке крови у взрослых (в возрасте 4 месяцев) сильно повышена, тогда как концентрация тестостерона снижена (4).
.Сообщалось, что у трансгенных самцов мышей со сверхэкспрессией ароматазы P450 [вирус опухоли молочной железы мыши (MMTV)-arom+] в возрасте 3 месяцев развиваются изменения, подобные гинекомастии (3). Сообщается, что под контролем полного MMTV-длинного терминального повтора трансген ароматазы активируется в начале полового созревания и экспрессируется в молочной железе, что приводит к локальному перепроизводству эстрогенов. У этих трансгенных мышей периферические концентрации эстрогенов были лишь слегка повышены. Недавно мы создали еще одну линию трансгенных мышей, которая экспрессирует ген ароматазы человека Р450 под промотором человеческого убиквитина С (AROM+) (4).Известно, что промотор убиквитина С активируется в пренатальный день 15 (5). Экспрессия трансгена была продемонстрирована в нескольких тканях взрослых, таких как яички и печень (4), а концентрация эстрадиола в сыворотке крови у взрослых (в возрасте 4 месяцев) сильно повышена, тогда как концентрация тестостерона снижена (4).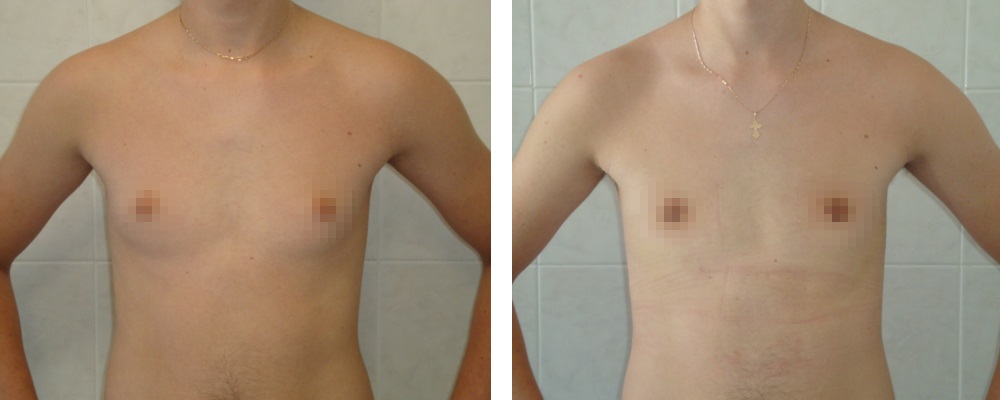 Кроме того, концентрация пролактина у этих мышей повышена.
Кроме того, концентрация пролактина у этих мышей повышена.
В настоящем исследовании мы изучили развитие молочных желез у самцов мышей AROM+ в разном возрасте. Данные показали, что эти молочные железы претерпевают развитие протоков и альвеол, морфологически напоминающее развитие молочных желез женщин того же возраста, и экспрессируют мРНК молочного белка (β-казеина).Интересно, что фенотип молочной железы у мышей AROM+ был частично обратимым. Эти результаты значительно отличаются от описанных для мышей MMTV-arom+, у которых структуры молочных желез гораздо менее развиты.
Материалы и методы
Конструирование трансгена
Получение трансгенных мышей, экспрессирующих кДНК ароматазы человека под контролем промотора убиквитина С (AROM+), было описано ранее (4). Самок мышей AROM+ содержали в стандартной колонии и использовали в качестве производителей. У них был бесплатный доступ к пищевым гранулам без сои (SDS, Witham, UK) и водопроводной воде. Со всеми мышами обращались в соответствии с политикой учреждения по уходу за животными Университета Турку (Турку, Финляндия). Генотипирование мышей AROM+ проводили, как описано ранее (4).
У них был бесплатный доступ к пищевым гранулам без сои (SDS, Witham, UK) и водопроводной воде. Со всеми мышами обращались в соответствии с политикой учреждения по уходу за животными Университета Турку (Турку, Финляндия). Генотипирование мышей AROM+ проводили, как описано ранее (4).
Морфологическое и гистологическое исследование молочной железы
Для препаратов цельного препарата четвертую паховую молочную железу удаляли у самцов мышей AROM+ в возрасте 20 и 45 дней и 4–9 месяцев, а также у самок дикого типа (WT) того же возраста.Молочные железы самок мышей также удаляли на ранних и поздних сроках беременности. Целые препараты молочной железы готовили, как описано ранее (6). Выделенные железы раскладывали на предметных стеклах и фиксировали фиксатором Карнуа (уксусная кислота-этанол). Предметные стекла с препаратом промывали в дистиллированной воде и окрашивали карминовыми квасцами в течение ночи. Железы были обесцвечены серией промывок 70-100% этанолом, очищены ксилолом и помещены в Permount. Для гистологического анализа четвертую молочную железу, взятую у самцов мышей AROM+ в возрасте 4 мес, фиксировали 4% параформальдегидом не менее 24 ч и заливали в парафин.Были приготовлены пятимикронные срезы образцов молочной железы и окрашены гематоксилин-эозином.
Для гистологического анализа четвертую молочную железу, взятую у самцов мышей AROM+ в возрасте 4 мес, фиксировали 4% параформальдегидом не менее 24 ч и заливали в парафин.Были приготовлены пятимикронные срезы образцов молочной железы и окрашены гематоксилин-эозином.
ОТ-ПЦР
Суммарная РНК была выделена из жирового тела молочной железы с паренхимой с использованием кисло-фенольного метода и проведена ОТ-ПЦР. Четыре микрограмма тотальной РНК инкубировали с 10 МЕ обратной транскриптазы вируса миелобластоза птиц (Finnzymes, Espoo, Финляндия) при 43°С в течение 20 мин. Затем кДНК денатурировали при 95°С в течение 5 мин и амплифицировали с помощью 25 циклов ПЦР, используя следующие условия: 94°С в течение 1 мин, 50°С в течение 1 мин и 72°С в течение 1 мин, и аликвоту ОТ-ПЦР. продукт подвергали электрофорезу в агарозном геле и визуализировали окрашиванием бромистым этидием.Для контроля общего количества используемой РНК амплифицировали фрагмент гена рибосомного белка β-актина длиной 200 п. н. Праймеры, используемые для различных анализов ОТ-ПЦР, описаны в таблице 1 (7–10).
н. Праймеры, используемые для различных анализов ОТ-ПЦР, описаны в таблице 1 (7–10).
, использованные в анализе ОТ-ПЦР в мышиной модели AROM +
| . | Генная последовательность пар праймеров . | Арт. нет. . |
|---|---|---|
| L19 5′-GAAATCGCCAATGCCAACT-3 ‘ | ||
| 5′-TCTTAGACCTGCGAGCCTCA-3′ | ||
| β-казеин | 5′-ACTACATTTACTGTATCCTCTGAC-3 ‘ | |
| 5′-GTGCTACTTGCTGCAGAAAGRACAG-3 ‘ | ||
| PrlR 5′-CCCCAAATCCCCAAAATAACAC-3′ | ||
| 5′-ACAGCCACTTCTTCCTCTCC-3 ‘ | ||
| Stat5a 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-GGAGCTTCTGGCAGAAGTGAAG-3′ | ||
| Stat5b 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-CACGACTAGTATTAACACTTCAC-3′ | 8 | |
| NKCC1 | 5′-GGCTGGATCAAGGGTGTATTA | |
| 5′-ATCGGGCCCAAAGTTCTCATT | ||
| Npt2b 5′-TGCCCAGGTTGGCACGAAGC-3 ‘ | ||
| 5′-AGTCCTGTCCCCTGCCTGCA-3′ | 10 |
. | Генная последовательность пар праймеров . | Арт. нет. . |
|---|---|---|
| L19 5′-GAAATCGCCAATGCCAACT-3 ‘ | ||
| 5′-TCTTAGACCTGCGAGCCTCA-3′ | ||
| β-казеин | 5′-ACTACATTTACTGTATCCTCTGAC-3 ‘ | |
| 5′-GTGCTACTTGCTGCAGAAAGRACAG-3 ‘ | ||
| PrlR 5′-CCCCAAATCCCCAAAATAACAC-3′ | ||
| 5′-ACAGCCACTTCTTCCTCTCC-3 ‘ | ||
| Stat5a 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-GGAGCTTCTGGCAGAAGTGAAG-3′ | ||
| Stat5b 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-CACGACTAGTATTAACACTTCAC-3′ | 8 | |
| NKCC1 | 5′-GGCTGGATCAAGGGTGTATTA | |
| 5′-ATCGGGCCCAAAGTTCTCATT | ||
| Npt2b 5′-TGCCCAGGTTGGCACGAAGC-3 ‘ | ||
| 5′-AGTCCTGTCCCCTGCCTGCA-3′ | 10 |
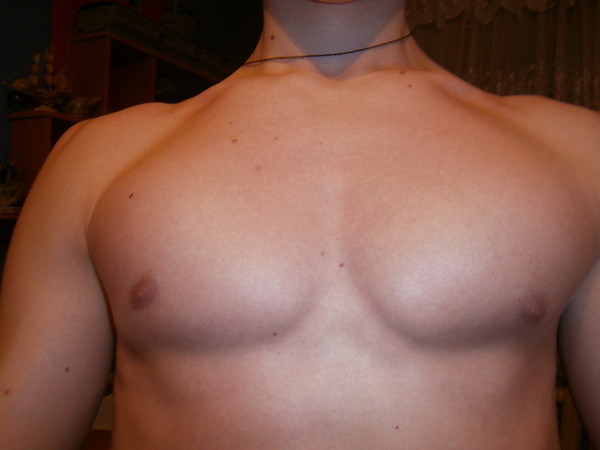
Пары праймеров, используемые в анализе ОТ-ПЦР в мышиной модели AROM +
| . | Генная последовательность пар праймеров . | Арт. нет. . |
|---|---|---|
| L19 5′-GAAATCGCCAATGCCAACT-3 ‘ | ||
| 5′-TCTTAGACCTGCGAGCCTCA-3′ | ||
| β-казеин | 5′-ACTACATTTACTGTATCCTCTGAC-3 ‘ | |
| 5′-GTGCTACTTGCTGCAGAAAGRACAG-3 ‘ | ||
| PrlR 5′-CCCCAAATCCCCAAAATAACAC-3′ | ||
| 5′-ACAGCCACTTCTTCCTCTCC-3 ‘ | ||
| Stat5a 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-GGAGCTTCTGGCAGAAGTGAAG-3′ | ||
| Stat5b 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-CACGACTAGTATTAACACTTCAC-3′ | 8 | |
| NKCC1 | 5′-GGCTGGATCAAGGGTGTATTA | |
| 5′-ATCGGGCCCAAAGTTCTCATT | ||
| Npt2b 5′-TGCCCAGGTTGGCACGAAGC-3 ‘ | ||
| 5′-AGTCCTGTCCCCTGCCTGCA-3′ | 10 |
.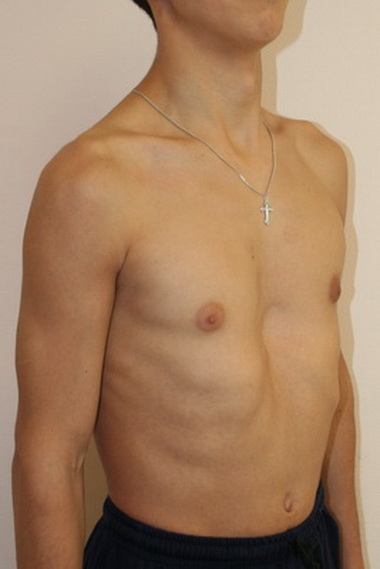 | Генная последовательность пар праймеров . | Арт. нет. . |
|---|---|---|
| L19 5′-GAAATCGCCAATGCCAACT-3 ‘ | ||
| 5′-TCTTAGACCTGCGAGCCTCA-3′ | ||
| β-казеин | 5′-ACTACATTTACTGTATCCTCTGAC-3 ‘ | |
| 5′-GTGCTACTTGCTGCAGAAAGRACAG-3 ‘ | ||
| PrlR 5′-CCCCAAATCCCCAAAATAACAC-3′ | ||
| 5′-ACAGCCACTTCTTCCTCTCC-3 ‘ | ||
| Stat5a 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-GGAGCTTCTGGCAGAAGTGAAG-3′ | ||
| Stat5b 5′-GGGCATCACCATTGCTTGGAAG-3 ‘ | ||
| 5′-CACGACTAGTATTAACACTTCAC-3′ | 8 | |
| NKCC1 | 5′-GGCTGGATCAAGGGTGTATTA | |
| 5′-ATCGGGCCCAAAGTTCTCATT | ||
| Npt2b 5′-TGCCCAGGTTGGCACGAAGC-3 ‘ | ||
| 5′-AGTCCTGTCCCCTGCCTGCA-3′ | 10 |
Иммуногистохимия
Из тканей молочной железы, залитых в парафин, вырезали срезы толщиной пять микрометров и помещали на предметные стекла. После депарафинизации и регидратации в ксилоле и этаноле их помещали в 10 мМ цитратный буфер (рН 6,0) с последующим прогревом в микроволновой печи для выделения антигена. Для этого использовали три периода по 5 мин каждый, после чего срезы обрабатывали 3% H 2 O 2 в PBS (рН 7,6) в течение 20 мин. Затем срезы инкубировали в течение ночи при 4°С в PBS, содержащем 3% BSA и одно из следующих антител: 1) антитело к рецептору эстрогена α (ERα; поликлональный IgG кролика; Santa Cruz Biotechnology, Inc., Санта-Крус, Калифорния) использовали в разведении 1:200, 2) антитело к ERβ (куриный поликлональный IgG; предоставлено проф. J. A. Gustafsson, Отделение лечебного питания, Каролинский институт NOVUM, Худдинге, Швеция), использовали в разведение 1:500, 3) антитело к рецептору прогестерона (PR; кроличий поликлональный IgG; Santa Cruz Biotechnology, Inc.), используемое в разведении 1:500, 4) антитело к ядерному антигену пролиферирующих клеток (PCNA; мышиный моноклональный IgG; NovoCastra, Ньюкасл, Великобритания) использовали в разведении 1:200, 5) антитело для активированного преобразователя сигнала и активатора транскрипции 5 (Stat5; мышиный моноклональный IgG; Advantex Bioregents, Conroe, TX) использовали в разведении 1:500, и 6) антитело для PRL (поликлональная антисыворотка кролика; NIDDK, NIH, Bethesda, MD) использовали в разведении 1:1000.
После депарафинизации и регидратации в ксилоле и этаноле их помещали в 10 мМ цитратный буфер (рН 6,0) с последующим прогревом в микроволновой печи для выделения антигена. Для этого использовали три периода по 5 мин каждый, после чего срезы обрабатывали 3% H 2 O 2 в PBS (рН 7,6) в течение 20 мин. Затем срезы инкубировали в течение ночи при 4°С в PBS, содержащем 3% BSA и одно из следующих антител: 1) антитело к рецептору эстрогена α (ERα; поликлональный IgG кролика; Santa Cruz Biotechnology, Inc., Санта-Крус, Калифорния) использовали в разведении 1:200, 2) антитело к ERβ (куриный поликлональный IgG; предоставлено проф. J. A. Gustafsson, Отделение лечебного питания, Каролинский институт NOVUM, Худдинге, Швеция), использовали в разведение 1:500, 3) антитело к рецептору прогестерона (PR; кроличий поликлональный IgG; Santa Cruz Biotechnology, Inc.), используемое в разведении 1:500, 4) антитело к ядерному антигену пролиферирующих клеток (PCNA; мышиный моноклональный IgG; NovoCastra, Ньюкасл, Великобритания) использовали в разведении 1:200, 5) антитело для активированного преобразователя сигнала и активатора транскрипции 5 (Stat5; мышиный моноклональный IgG; Advantex Bioregents, Conroe, TX) использовали в разведении 1:500, и 6) антитело для PRL (поликлональная антисыворотка кролика; NIDDK, NIH, Bethesda, MD) использовали в разведении 1:1000. Связанное первичное антитело определяли с помощью биотинилированного козьего антикроличьего, антимышиного или антикуриного IgG с последующей инкубацией с авидин-биотин-пероксидазным комплексом (Vector Laboratories, Inc., Берлингейм, Калифорния) и визуализировали с помощью 3′,3′- диаминобензидина тетрагидрохлорид. Срезы слегка контрастировали гематоксилином Майера и монтировали.
Связанное первичное антитело определяли с помощью биотинилированного козьего антикроличьего, антимышиного или антикуриного IgG с последующей инкубацией с авидин-биотин-пероксидазным комплексом (Vector Laboratories, Inc., Берлингейм, Калифорния) и визуализировали с помощью 3′,3′- диаминобензидина тетрагидрохлорид. Срезы слегка контрастировали гематоксилином Майера и монтировали.
Для иммуноокрашивания Npt2b и NKCC1 замороженные срезы толщиной 7 мкм фиксировали метанолом (5 мин) и ацетоном (2 мин) при -20°С. После этого срезы инкубировали в течение 1 ч с кроличьей поликлональной антисывороткой к Npt2b ( Разведение 1:200; предоставлено Dr.Jurg Biber, кафедра физиологии, Цюрихский университет, Цюрих, Швейцария) и для NKCC1 (разведение 1:1000; предоставлено доктором Джимом Тернером, Национальный институт стоматологических и черепно-лицевых исследований, NIH). Комплексы антиген-антитело визуализировали с использованием биотинилированного антикроличьего антитела (Vector Laboratories, Inc. ) в сочетании с комплексом стрептавидин-флуоресцеинизотиоцианат (DAKO Corp., Glostrup, Дания). Установка конфокального лазерного микроскопа (сканер модели TCS SP и микроскоп DMRE, Lasertechnik, Leica Corp., Гейдельберг, Германия) использовали для обнаружения эмиссионного света, испускаемого изотиоцианатом флуоресцеина. Срезы подвергались воздействию длины волны возбуждения 488 нм, а эмиссия была получена при 495–540 нм. Четыре изображения с интервалом 2 мкм по оси Z были получены с помощью конфокального сканера, оснащенного аргонно-криптоновой ионно-лазерной системой (Omnichrome, Chino, CA) в сочетании с программой SCANware 4.2a (Leica Corp.).
) в сочетании с комплексом стрептавидин-флуоресцеинизотиоцианат (DAKO Corp., Glostrup, Дания). Установка конфокального лазерного микроскопа (сканер модели TCS SP и микроскоп DMRE, Lasertechnik, Leica Corp., Гейдельберг, Германия) использовали для обнаружения эмиссионного света, испускаемого изотиоцианатом флуоресцеина. Срезы подвергались воздействию длины волны возбуждения 488 нм, а эмиссия была получена при 495–540 нм. Четыре изображения с интервалом 2 мкм по оси Z были получены с помощью конфокального сканера, оснащенного аргонно-криптоновой ионно-лазерной системой (Omnichrome, Chino, CA) в сочетании с программой SCANware 4.2a (Leica Corp.).
Измерение прогестерона
Сыворотку мыши и стандартные пробирки дважды экстрагировали 2 мл диэтилового эфира и выпаривали в атмосфере азота.Остатки ресуспендировали в 3% PBS-BSA и измеряли уровень прогестерона с помощью RIA, как описано ранее (11).
Исследуемые лекарственные средства и контрольные вещества
Носитель готовили следующим образом: 0,25 г (карбоксиметилцеллюлоза; партия 939512, Tamro Ltd. , Вантаа, Финляндия) взвешивали и растворяли в 50 мл деионизированной (Milli-Q, Millipore, Bedford, MA) воды. Раствор готовили один раз в неделю и хранили при 4°С. Соответствующее количество ингибитора ароматазы, финрозола (MPV-2213ad, Hormos Medical Ltd., Турку, Финляндия), взвешивали в прозрачной стеклянной ступке. Добавляли несколько капель носителя и смесь тщательно перемешивали. После этого в раствор добавляли треть конечного объема носителя и помещали в ультразвуковой инкубатор на 5 мин. Эта процедура была завершена в общей сложности три раза, чтобы достичь конечного объема. Доза финрозола составляла 10 мг/кг массы тела и вводилась мышам ежедневно через зонд по 0,2 мл в течение 6 нед.
, Вантаа, Финляндия) взвешивали и растворяли в 50 мл деионизированной (Milli-Q, Millipore, Bedford, MA) воды. Раствор готовили один раз в неделю и хранили при 4°С. Соответствующее количество ингибитора ароматазы, финрозола (MPV-2213ad, Hormos Medical Ltd., Турку, Финляндия), взвешивали в прозрачной стеклянной ступке. Добавляли несколько капель носителя и смесь тщательно перемешивали. После этого в раствор добавляли треть конечного объема носителя и помещали в ультразвуковой инкубатор на 5 мин. Эта процедура была завершена в общей сложности три раза, чтобы достичь конечного объема. Доза финрозола составляла 10 мг/кг массы тела и вводилась мышам ежедневно через зонд по 0,2 мл в течение 6 нед.
Результаты
Анализ структуры молочной железы с помощью цельных препаратов
Различий в структуре молочных желез между самками мышей WT и AROM+ в течение 4-месячного периода наблюдения обнаружено не было (данные не представлены). Однако анализ полных препаратов жировых комков молочных желез, содержащих паренхиму трансгенных и нетрансгенных однопометников, выявил значительные морфологические изменения в молочных железах самцов мышей AROM+, вызванные гормональным дисбалансом, присутствующим у трансгенных самцов мышей. Как и ожидалось, жировые тела молочных желез самцов дикого типа были полностью лишены протоковых структур (рис. 1А). Напротив, хорошо организованные протоковые и лобуло-альвеолярные структуры присутствовали у самцов AROM+. Молочные протоки были видны в препубертатном периоде уже через 20 дней после рождения (рис.1F). У половозрелых самцов мышей AROM+ (в возрасте 40 дней; рис. 1G) молочные протоки начали расти и были хорошо организованы; дерево протоков напоминало дерево девственных самок мышей нормального возраста (Fig. 1B). Первичные протоки самцов AROM+ содержали примерно 10–15 боковых ответвлений. На концах молочных протоков были отчетливо видны концевые зачатки (TEB), указывающие на активное удлинение протоков.
Однако анализ полных препаратов жировых комков молочных желез, содержащих паренхиму трансгенных и нетрансгенных однопометников, выявил значительные морфологические изменения в молочных железах самцов мышей AROM+, вызванные гормональным дисбалансом, присутствующим у трансгенных самцов мышей. Как и ожидалось, жировые тела молочных желез самцов дикого типа были полностью лишены протоковых структур (рис. 1А). Напротив, хорошо организованные протоковые и лобуло-альвеолярные структуры присутствовали у самцов AROM+. Молочные протоки были видны в препубертатном периоде уже через 20 дней после рождения (рис.1F). У половозрелых самцов мышей AROM+ (в возрасте 40 дней; рис. 1G) молочные протоки начали расти и были хорошо организованы; дерево протоков напоминало дерево девственных самок мышей нормального возраста (Fig. 1B). Первичные протоки самцов AROM+ содержали примерно 10–15 боковых ответвлений. На концах молочных протоков были отчетливо видны концевые зачатки (TEB), указывающие на активное удлинение протоков.
Рисунок 1.
Анализ цельных препаратов молочных желез самцов мышей WT и AROM+ на разных стадиях развития.Лимфатический узел служит точкой отсчета для оценки разрастания протоков. A, жировая ткань молочных желез самцов мышей дикого типа лишена протоковых структур. B и C, молочная железа девственной самки мыши WT в возрасте 40 дней (B) и в возрасте 4 месяцев (C). D и E, молочная железа самки мыши дикого типа на 12,5-й день беременности (D) и на 16,5-й день беременности (E). F — молочная железа самца мыши AROM+. В возрасте 20 дней несколько рудиментарных протоков, выходящих из соска, располагаются проксимальнее лимфатического узла.G, Выдающиеся TEB видны в возрасте 40 дней ( стрелка ). H, В возрасте 4 месяцев протоки достигли границы жирового тела. На этом этапе ТЭБы исчезли. I. В возрасте 6 месяцев в железе наблюдается усиленное развитие альвеол ( стрелки ), напоминающее структуры, присутствующие в молочных железах самок мышей на 12,5-й день беременности. J, В возрасте 9 месяцев происходит экстенсивное лобуло-альвеолярное развитие, которое напоминает структуры, присутствующие в женской молочной железе на поздних сроках беременности (на 16-й день.5 беременности). На этой стадии жировое тело молочной железы полностью заполнено секреторными лобуло-альвеолярными структурами.
J, В возрасте 9 месяцев происходит экстенсивное лобуло-альвеолярное развитие, которое напоминает структуры, присутствующие в женской молочной железе на поздних сроках беременности (на 16-й день.5 беременности). На этой стадии жировое тело молочной железы полностью заполнено секреторными лобуло-альвеолярными структурами.
Рисунок 1.
Анализ молочных желез самцов мышей WT и AROM+ на разных стадиях развития. Лимфатический узел служит точкой отсчета для оценки разрастания протоков. A, жировая ткань молочных желез самцов мышей дикого типа лишена протоковых структур. B и C, молочная железа девственной самки мыши WT в возрасте 40 дней (B) и в возрасте 4 месяцев (C).D и E, молочная железа самки мыши дикого типа на 12,5-й день беременности (D) и на 16,5-й день беременности (E). F — молочная железа самца мыши AROM+. В возрасте 20 дней несколько рудиментарных протоков, выходящих из соска, располагаются проксимальнее лимфатического узла. G, Выдающиеся TEB видны в возрасте 40 дней ( стрелка ).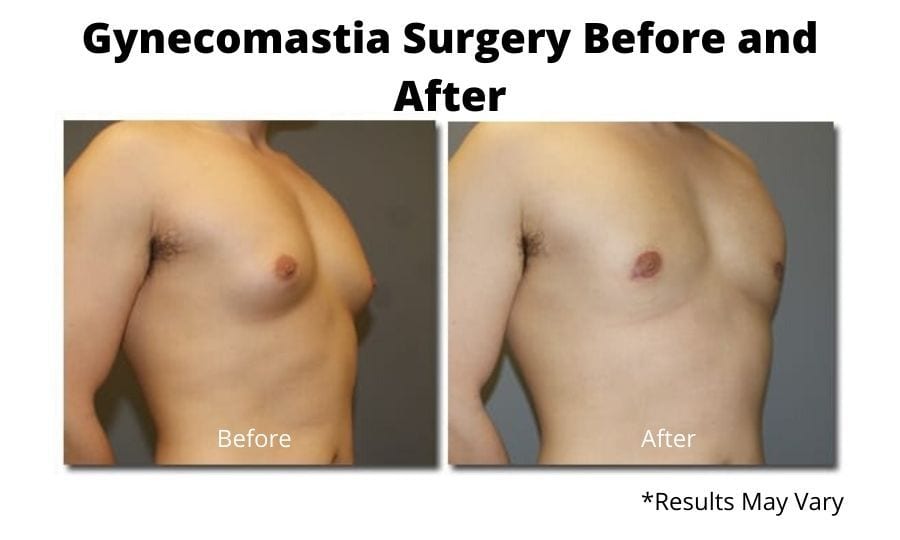 H, В возрасте 4 месяцев протоки достигли границы жирового тела. На этом этапе ТЭБы исчезли. I. В возрасте 6 месяцев железа демонстрировала усиленное развитие альвеол ( стрелки ), напоминающее структуры, присутствующие в молочных железах самок мышей на 12-й день.5 гестации. J. В возрасте 9 месяцев происходит экстенсивное лобуло-альвеолярное развитие, напоминающее структуры, имеющиеся в женской молочной железе на поздних сроках беременности (на 16,5 день беременности). На этой стадии жировое тело молочной железы полностью заполнено секреторными лобуло-альвеолярными структурами.
H, В возрасте 4 месяцев протоки достигли границы жирового тела. На этом этапе ТЭБы исчезли. I. В возрасте 6 месяцев железа демонстрировала усиленное развитие альвеол ( стрелки ), напоминающее структуры, присутствующие в молочных железах самок мышей на 12-й день.5 гестации. J. В возрасте 9 месяцев происходит экстенсивное лобуло-альвеолярное развитие, напоминающее структуры, имеющиеся в женской молочной железе на поздних сроках беременности (на 16,5 день беременности). На этой стадии жировое тело молочной железы полностью заполнено секреторными лобуло-альвеолярными структурами.
Протоки молочных желез завершили удлинение у половозрелых самцов мышей AROM+ в возрасте 4 месяцев (рис. 1H) и полностью заполнили жировые тела молочных желез, как и у девственных самок мышей WT того же возраста (рис.1С). В этом возрасте были видны лобуло-альвеолярные структуры, и TEB больше не обнаруживались, что указывает на прекращение удлинения протоков в возрасте, когда это происходит у нормальных самок мышей. Гистологические срезы показали, что протоки имели один слой эпителиальных клеток, окруженных стромальными клетками (рис. 2А). В просвете протоков часто обнаруживали окрашиваемый материал, что позволяет предположить, что эпителиальные клетки дифференцировались и активно секретировали (рис. 2Б). В возрасте 6 месяцев в молочных железах AROM+ можно было обнаружить повышенное третичное боковое ветвление и лобуло-альвеолярное развитие (рис.1I), а железы по структуре напоминали молочные железы самок мышей дикого типа на второй неделе беременности (рис. 1D).
Гистологические срезы показали, что протоки имели один слой эпителиальных клеток, окруженных стромальными клетками (рис. 2А). В просвете протоков часто обнаруживали окрашиваемый материал, что позволяет предположить, что эпителиальные клетки дифференцировались и активно секретировали (рис. 2Б). В возрасте 6 месяцев в молочных железах AROM+ можно было обнаружить повышенное третичное боковое ветвление и лобуло-альвеолярное развитие (рис.1I), а железы по структуре напоминали молочные железы самок мышей дикого типа на второй неделе беременности (рис. 1D).
Рис. 2.
Гистологический анализ молочной железы самца AROM+ в возрасте 4 мес. А. Протоки и дольково-альвеолярные структуры наблюдаются у самцов мышей AROM+. B, альвеола с большим увеличением. Богатый липидами секреторный продукт присутствует в альвеолах ( стрелка ). C – E, RT-PCR показал, что мРНК для β-казеина, NKCC1 и Npt2b, соответственно, экспрессируется в ткани молочной железы самцов мышей AROM+.F, Иммуногистохимическое окрашивание Npt2b в эпителии молочных желез мышей AROM+. G, лактирующая самка d 1, используемая в качестве положительного контроля для окрашивания Npt2b. H, Иммуногистохимическое окрашивание на NKCC1 эпителия молочной железы мышей AROM+. I, лактирующая самка d 1, используемая в качестве отрицательного контроля для окрашивания NKCC1.
G, лактирующая самка d 1, используемая в качестве положительного контроля для окрашивания Npt2b. H, Иммуногистохимическое окрашивание на NKCC1 эпителия молочной железы мышей AROM+. I, лактирующая самка d 1, используемая в качестве отрицательного контроля для окрашивания NKCC1.
Рисунок 2.
Гистологический анализ молочной железы самца AROM+ в возрасте 4 мес. А. Протоки и дольково-альвеолярные структуры наблюдаются у самцов мышей AROM+. B, альвеола с большим увеличением.Богатый липидами секреторный продукт присутствует в альвеолах ( стрелка ). C – E, RT-PCR показал, что мРНК для β-казеина, NKCC1 и Npt2b, соответственно, экспрессируется в ткани молочной железы самцов мышей AROM+. F, Иммуногистохимическое окрашивание Npt2b в эпителии молочных желез мышей AROM+. G, лактирующая самка d 1, используемая в качестве положительного контроля для окрашивания Npt2b. H, Иммуногистохимическое окрашивание на NKCC1 эпителия молочной железы мышей AROM+. I, лактирующая самка d 1, используемая в качестве отрицательного контроля для окрашивания NKCC1.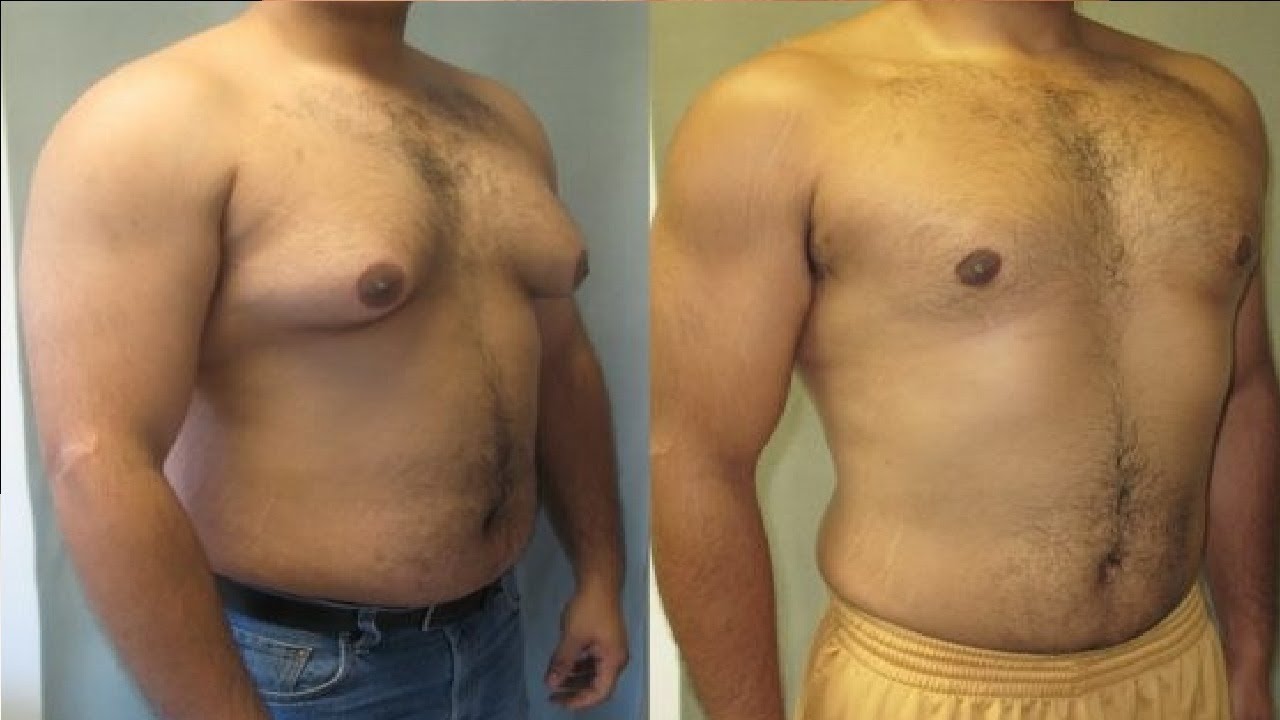
В возрасте 9 месяцев мужские молочные железы AROM+ (рис. 1J) подверглись дальнейшей дифференциации и напоминали окончательно дифференцированные женские железы, обычно присутствующие на поздних сроках беременности (16,5 d; рис. 1E). Железы содержали секреторные продукты в просвете. Для дальнейшего определения секреторной активности эпителия молочных желез анализировали экспрессию мРНК β-казеина в молочных железах самцов мышей AROM+ в возрасте 4 мес. Данные показали, что мРНК β-казеина экспрессировалась у самцов AROM+, тогда как у самцов мышей дикого типа экспрессия не обнаруживалась (рис.2С). Экспрессия молочного белка является еще одним признаком развития молочных желез, подобных женским, у самцов AROM+. Стадию дифференцировки молочной железы AROM+ дополнительно изучали путем анализа экспрессии белков, характерных для эпителия протоков (котранспортер Na-K-Cl, NKCCl) и для секреторной функции лактирующих самок (изоформа котранспортера фосфата натрия, Npt2b). Данные иммуногистохимии и ОТ-ПЦР показали, что оба этих белка экспрессировались на низком уровне в нескольких эпителиальных структурах молочной железы самца AROM+ в возрасте 4 месяцев (рис. 2, Д-И). Однако большинство эпителиальных структур не окрашивались ни на один из этих маркеров.
2, Д-И). Однако большинство эпителиальных структур не окрашивались ни на один из этих маркеров.
Иммуноцитохимическое окрашивание ERα, ERβ, PR, PCNA и эпителиальных маркеров в молочной железе самцов AROM+
Для анализа гормональных факторов, предположительно участвующих в развитии молочных желез у самцов AROM+, мы провели иммуногистохимический анализ ключевых рецепторов стероидных гормонов. Иммуногистохимическое окрашивание на ERα в молочной железе AROM+ выявило положительное окрашивание ядер эпителиальных клеток как в протоках, так и в альвеолах в возрасте 4 месяцев (рис.3А). Аналогичное клеточное распределение наблюдалось для ERβ. Однако ERβ-положительные клетки были более многочисленными, чем положительные по ERα (рис. 3B).
Рисунок 3.
Иммуногистохимическое окрашивание стероидных рецепторов и маркера пролиферации в AROM+ мужских молочных железах. Срезы 4-месячных самцов мышей AROM+ окрашивали антителами против ERα (A), ERβ (B), PR (C) и PCNA (D). Коричневый цвет в ядрах указывает на положительное окрашивание соответствующего белка. Стрелки указывают на густо окрашенные ядра.
Коричневый цвет в ядрах указывает на положительное окрашивание соответствующего белка. Стрелки указывают на густо окрашенные ядра.
Рис. 3.
Иммуногистохимическое окрашивание стероидных рецепторов и маркера пролиферации в AROM+ мужских молочных железах. Срезы 4-месячных самцов мышей AROM+ окрашивали антителами против ERα (A), ERβ (B), PR (C) и PCNA (D). Коричневый цвет в ядрах указывает на положительное окрашивание соответствующего белка. Стрелки указывают на густо окрашенные ядра.
Как показано на рис. 3C, PR также часто выявляли в ядрах альвеолярных и протоковых эпителиальных клеток.Положительные и отрицательные клетки могут располагаться рядом друг с другом. Концентрации прогестерона в сыворотке у самцов мышей AROM+ были слегка повышены (среднее значение ± стандартная ошибка, 1,156 ± 0,161 и 0,660 ± 0,167 нМ/л у самцов мышей AROM+ и WT соответственно), но разница между двумя группами не была статистически значимой.
Окрашивание эпителия молочной железы самцов AROM+ маркером пролиферации клеток (PCNA) в возрасте 4 мес выявило положительные клетки не только в развивающихся альвеолах, но и в протоках (рис.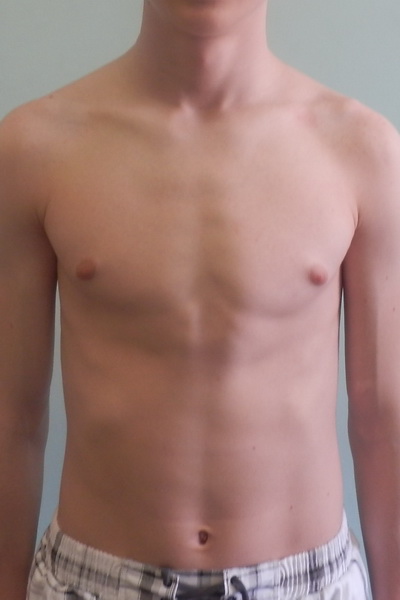 3Д). Большинство эпителиальных клеток в альвеолах и несколько эпителиальных клеток в протоках подвергались пролиферации, по оценке иммуноокрашивания PCNA. В соответствии с пролиферативным статусом молочных желез, анализ мечения концов дезокси-UTP, опосредованный терминальной дезоксинуклеотидилтрансферазой, показал, что только несколько эпителиальных клеток подвергались апоптозу (данные не показаны).
3Д). Большинство эпителиальных клеток в альвеолах и несколько эпителиальных клеток в протоках подвергались пролиферации, по оценке иммуноокрашивания PCNA. В соответствии с пролиферативным статусом молочных желез, анализ мечения концов дезокси-UTP, опосредованный терминальной дезоксинуклеотидилтрансферазой, показал, что только несколько эпителиальных клеток подвергались апоптозу (данные не показаны).
Продуцирующие ПРЛ клетки гипофиза и действие ПРЛ в AROM+ молочной железе
Было показано, что у самцов AROM+ были сильно повышены концентрации ПРЛ в сыворотке (4).Чтобы подтвердить происхождение циркулирующего ПРЛ, лактотропные клетки гипофиза окрашивали специфическими антителами против ПРЛ. Количество и плотность клеток, продуцирующих ПРЛ, были резко увеличены у самцов AROM+ по сравнению с животными дикого типа, а положительные клетки были распределены по всей передней доле гипофиза (рис. 4, А и В). Кроме того, обнаруживаемая экспрессия мРНК рецептора PRL (PRLR) была обнаружена в молочных железах самцов AROM+ (Fig. 4E). Следовательно, вполне вероятно, что высокая концентрация ПРЛ в сыворотке, присутствующая у самцов мышей AROM +, напрямую способствует дифференцировке молочной железы.Это было дополнительно проверено путем анализа присутствия и активации Stat5a и Stat5b, известных медиаторов действия ПРЛ в клетках-мишенях. Анализ показал, что мРНК как для Stat5a, так и для 5b присутствовала в мужской молочной железе AROM+ (рис. 4F), и на основании анализа RT-PCR экспрессия Stat5b была особенно обильной. Чтобы дополнительно продемонстрировать, что эти преобразователи сигнала PRL активировались при стимуляции PRL, фосфорилирование белков Stat5 было продемонстрировано иммуногистохимически в молочных железах AROM + в возрасте 4 месяцев.Данные показали интенсивное положительное окрашивание в ядрах эпителиальных клеток, особенно в альвеолах (рис. 4C), аналогичное тому, которое было обнаружено в молочных железах беременных самок мышей WT, использованных в качестве положительного контроля (рис. 4D).
4E). Следовательно, вполне вероятно, что высокая концентрация ПРЛ в сыворотке, присутствующая у самцов мышей AROM +, напрямую способствует дифференцировке молочной железы.Это было дополнительно проверено путем анализа присутствия и активации Stat5a и Stat5b, известных медиаторов действия ПРЛ в клетках-мишенях. Анализ показал, что мРНК как для Stat5a, так и для 5b присутствовала в мужской молочной железе AROM+ (рис. 4F), и на основании анализа RT-PCR экспрессия Stat5b была особенно обильной. Чтобы дополнительно продемонстрировать, что эти преобразователи сигнала PRL активировались при стимуляции PRL, фосфорилирование белков Stat5 было продемонстрировано иммуногистохимически в молочных железах AROM + в возрасте 4 месяцев.Данные показали интенсивное положительное окрашивание в ядрах эпителиальных клеток, особенно в альвеолах (рис. 4C), аналогичное тому, которое было обнаружено в молочных железах беременных самок мышей WT, использованных в качестве положительного контроля (рис. 4D).
Рисунок 4.
Локализация клеток, продуцирующих ПРЛ, в гипофизе и обнаружение сигнального пути ПРЛ в молочной железе мышей AROM+. Срезы гипофиза, полученные от самцов мышей AROM+ (А) и мышей дикого типа (В) в возрасте 4 мес, окрашивали антителом к крысиному ПРЛ.Окрашивание Brown указывает на клетки, продуцирующие ПРЛ. C и D, срезы ткани, залитые парафином, были иммуноокрашены моноклональным антителом против фосфотирозина-Stat5, и в эпителиальных клетках молочных желез AROM+ самцов было обнаружено интенсивное положительное ядерное окрашивание (C). Молочная железа лактирующей мыши использовалась в качестве положительного контроля (D). Стрелки указывают на густо окрашенные ядра. Анализы ОТ-ПЦР показали экспрессию PRLR (E) и экспрессию Stat5a и Stat5b (F) в мужской молочной железе AROM+.
Рисунок 4.
Локализация клеток, продуцирующих ПРЛ, в гипофизе и обнаружение сигнального пути ПРЛ в молочной железе мышей AROM+. Срезы гипофиза, полученные от самцов мышей AROM+ (А) и мышей дикого типа (В) в возрасте 4 мес, окрашивали антителом к крысиному ПРЛ. Окрашивание Brown указывает на клетки, продуцирующие ПРЛ. C и D, срезы ткани, залитые парафином, были иммуноокрашены моноклональным антителом против фосфотирозина-Stat5, и в эпителиальных клетках молочных желез AROM+ самцов было обнаружено интенсивное положительное ядерное окрашивание (C).Молочная железа лактирующей мыши использовалась в качестве положительного контроля (D). Стрелки указывают на густо окрашенные ядра. Анализы ОТ-ПЦР показали экспрессию PRLR (E) и экспрессию Stat5a и Stat5b (F) в мужской молочной железе AROM+.
Окрашивание Brown указывает на клетки, продуцирующие ПРЛ. C и D, срезы ткани, залитые парафином, были иммуноокрашены моноклональным антителом против фосфотирозина-Stat5, и в эпителиальных клетках молочных желез AROM+ самцов было обнаружено интенсивное положительное ядерное окрашивание (C).Молочная железа лактирующей мыши использовалась в качестве положительного контроля (D). Стрелки указывают на густо окрашенные ядра. Анализы ОТ-ПЦР показали экспрессию PRLR (E) и экспрессию Stat5a и Stat5b (F) в мужской молочной железе AROM+.
Инверсия фенотипа молочной железы у мышей AROM+, получавших ингибитор ароматазы (финрозол)
Интересно, что 6-недельное лечение самцов мышей AROM+ финрозолом, специфическим ингибитором ароматазы, в возрасте 4–6 месяцев вызывало инволюцию дифференцированного фенотипа молочной железы (рис.5). Альвеолярные структуры и большинство третичных боковых ветвей протоков исчезли. Это свидетельствует о том, что повышенная активность ароматазы P450 у самцов мышей AROM+ была основной причиной наблюдаемого фенотипа молочной железы.
Рисунок 5.
Анализ цельных препаратов молочных желез самцов мышей AROM+, получавших плацебо (A и C) и получавших финрозол (B и D) в возрасте 4 месяцев. Лимфатический узел служит точкой отсчета для оценки разрастания протоков.Самцам мышей AROM+ вводили перорально финрозол (10 мг/кг массы тела) в течение 6 недель перед аутопсией. Альвеолярные структуры и большинство третичных боковых ветвей протоков исчезли у мышей AROM+, получавших финрозол.
Рисунок 5.
Анализ цельных препаратов молочных желез самцов мышей AROM+, получавших плацебо (A и C) и получавших финрозол (B и D) в возрасте 4 месяцев. Лимфатический узел служит точкой отсчета для оценки разрастания протоков. Самцам мышей AROM+ вводили перорально финрозол (10 мг/кг массы тела) в течение 6 недель перед аутопсией.Альвеолярные структуры и большинство третичных боковых ветвей протоков исчезли у мышей AROM+, получавших финрозол.
Обсуждение
Недавно были описаны два разных штамма мышей со сверхэкспрессией ароматазы P450 (4, 12). Самцы мышей обеих линий имеют изменения в развитии молочных желез, но изменения, наблюдаемые у двух линий, значительно отличаются друг от друга, как показано в настоящем исследовании. Сверхэкспрессия ароматазы Р450 человека под промотором убиквитина С (AROM+) приводила к пролиферации протоков, боковым ветвлениям, лобуло-альвеолярному развитию и экспрессии мРНК β-казеина, что является характеристиками развития женской молочной железы и соответствует участие эстрогена в развитии молочной железы также у мужчин (13, 14).Молочные протоки были видны уже на 20-й день после рождения. В дополнение к повышенным уровням эстрогена и сниженным уровням андрогенов, у самцов мышей AROM+ была гиперпролактинемия, что, вероятно, вносит свой вклад в фенотип молочной железы у самцов мышей AROM+, способствуя терминальной дифференцировке (15). Однако трансгенные самцы мышей MMTV-arom+ (3) обнаруживали одиночные протоки с гиперпластическим эпителием молочной железы в возрасте 3 месяцев. У них был слегка повышенный уровень циркулирующего эстрадиола и неизмененный уровень пролактина.
Самцы мышей обеих линий имеют изменения в развитии молочных желез, но изменения, наблюдаемые у двух линий, значительно отличаются друг от друга, как показано в настоящем исследовании. Сверхэкспрессия ароматазы Р450 человека под промотором убиквитина С (AROM+) приводила к пролиферации протоков, боковым ветвлениям, лобуло-альвеолярному развитию и экспрессии мРНК β-казеина, что является характеристиками развития женской молочной железы и соответствует участие эстрогена в развитии молочной железы также у мужчин (13, 14).Молочные протоки были видны уже на 20-й день после рождения. В дополнение к повышенным уровням эстрогена и сниженным уровням андрогенов, у самцов мышей AROM+ была гиперпролактинемия, что, вероятно, вносит свой вклад в фенотип молочной железы у самцов мышей AROM+, способствуя терминальной дифференцировке (15). Однако трансгенные самцы мышей MMTV-arom+ (3) обнаруживали одиночные протоки с гиперпластическим эпителием молочной железы в возрасте 3 месяцев. У них был слегка повышенный уровень циркулирующего эстрадиола и неизмененный уровень пролактина.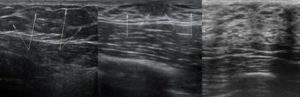 Различия в железистых структурах между двумя линиями мышей со сверхэкспрессией ароматазы могут быть в первую очередь связаны с более ранним началом избыточной продукции эстрогена у мышей AROM+, тогда как промотор MMTV не активируется до полового созревания.
Различия в железистых структурах между двумя линиями мышей со сверхэкспрессией ароматазы могут быть в первую очередь связаны с более ранним началом избыточной продукции эстрогена у мышей AROM+, тогда как промотор MMTV не активируется до полового созревания.
Эстрогены, по-видимому, не требуются для нормального пренатального развития молочной железы. Напротив, известно, что тестостерон, вырабатываемый развивающимися гонадами плода мужского пола, вызывает конденсацию мезенхимы вокруг шейки железы, и, следовательно, зачаток молочной железы у мужчин начинает регрессировать на 13-й гестационный день (16).Таким образом, избыточная продукция эстрогена, начинающаяся предположительно на 15-й гестационный день у эмбрионов мужского пола AROM+, будет мешать нормальному действию тестостерона, необходимому для регрессии. Известно, что в отсутствие индуцированной тестостероном регрессии молочные зачатки сохраняют свою полную способность к развитию молочных желез у самцов мышей (17, 18). Из-за позднего начала гиперпродукции эстрогена у мышей MMTV-arom+ у них отсутствует это противодействие эстрогена. Хорошо известно, что молочная железа достигает полной дифференциации, определяемой экспрессией генов, специфичных для молока, у взрослой самки после полового созревания и беременности.Критический период перехода от несостоятельности к лактогенной способности наступает примерно через 4 недели после рождения (16). Несмотря на то, что факторы, ответственные за лактогенную компетентность, неизвестны, этот период также может привести к различию развития молочной железы у двух штаммов со сверхэкспрессией ароматазы.
Хорошо известно, что молочная железа достигает полной дифференциации, определяемой экспрессией генов, специфичных для молока, у взрослой самки после полового созревания и беременности.Критический период перехода от несостоятельности к лактогенной способности наступает примерно через 4 недели после рождения (16). Несмотря на то, что факторы, ответственные за лактогенную компетентность, неизвестны, этот период также может привести к различию развития молочной железы у двух штаммов со сверхэкспрессией ароматазы.
Наши результаты согласуются с концепцией о том, что эстрогены играют важную роль в удлинении молочных протоков (19, 20). Вместе с прогестероном эстрогены необходимы для развития третичных протоков и поддержания протоков и дольково-альвеолярных структур (21).Полный анализ препарата показал, что молочные железы самцов мышей AROM+ претерпевают морфогенез, подобный тому, который обычно имеет место у самок. Оба подтипа ER присутствовали в альвеолярном и протоковом эпителии молочной железы самцов AROM+, в соответствии с предыдущими находками у самок мышей (22).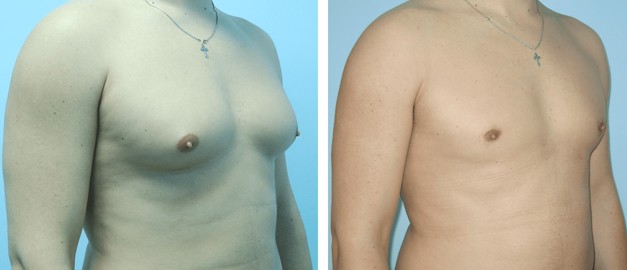 Однако иммуногистохимически ERβ-положительные эпителиальные клетки выявлялись чаще, чем положительные по ERα. Интересно, что фенотип молочной железы самцов мышей AROM+ был обратимым, и 6-недельное лечение финрозолом, новым и специфическим ингибитором ароматизации (23), вызывало инволюцию молочной железы, i.е . исчезновение альвеолярных структур и большинства третичных боковых ветвей протоков. Это еще раз подтверждает первичную роль эстрогена в развитии молочной железы у самцов мышей.
Однако иммуногистохимически ERβ-положительные эпителиальные клетки выявлялись чаще, чем положительные по ERα. Интересно, что фенотип молочной железы самцов мышей AROM+ был обратимым, и 6-недельное лечение финрозолом, новым и специфическим ингибитором ароматизации (23), вызывало инволюцию молочной железы, i.е . исчезновение альвеолярных структур и большинства третичных боковых ветвей протоков. Это еще раз подтверждает первичную роль эстрогена в развитии молочной железы у самцов мышей.
Молочные железы самцов мышей AROM+ также экспрессировали PRLR и PR, которые необходимы для нормальной дифференцировки и функционирования молочных желез самок. Экспрессия PR в мужском эпителии молочной железы AROM+ согласуется с продемонстрированной индукцией экспрессии гена PR эстрогенами в эпителии женской молочной железы после 7-недельного возраста (24, 25).Это говорит о том, что эстрадиол может также играть роль стимулятора действия прогестерона в молочной железе AROM+. Ряд исследований предоставил данные, свидетельствующие о том, что реакции, приписываемые эстрогену, предположительно могут быть связаны с комбинированным действием эстрогена и прогестерона на молочную железу (26, 27). Например, отсутствие PR оказывает сильное влияние на развитие молочной железы. У PR-дефицитных мышей структура протоков имеет менее обширное боковое ветвление и ацинарное развитие и лишена межпротоковых лобуло-альвеолярных структур (28-30).Концентрации прогестерона у самцов мышей AROM+ не были значительно повышены по сравнению с таковыми у самцов мышей WT, но были достаточными для эффективной активации PR-опосредованных сигнальных систем в молочной железе AROM+.
Например, отсутствие PR оказывает сильное влияние на развитие молочной железы. У PR-дефицитных мышей структура протоков имеет менее обширное боковое ветвление и ацинарное развитие и лишена межпротоковых лобуло-альвеолярных структур (28-30).Концентрации прогестерона у самцов мышей AROM+ не были значительно повышены по сравнению с таковыми у самцов мышей WT, но были достаточными для эффективной активации PR-опосредованных сигнальных систем в молочной железе AROM+.
Имеются многочисленные доказательства того, что длительное лечение эстрогенами вызывает гиперпролактинемию и развитие пролактином у грызунов (31, 32). Это также наблюдалось у самцов мышей AROM+, у которых были высокие концентрации циркулирующего пролактина и гипофиз с повышенным количеством гипофизарных лактотропов.С помощью ОТ-ПЦР мы продемонстрировали, что PRLR также экспрессируется в молочной железе самцов мышей AROM+. Следовательно, вполне вероятно, что, как и у самок мышей, PRL-зависимые сигнальные системы участвуют в терминальной дифференцировке молочной железы у самцов мышей AROM+.
Янус-киназа 2-Stat5 является основным сигнальным путем для действия ПРЛ (33). Первоначально Stat5 был описан как фактор молочной железы, стимулируемый ПРЛ (34), и было показано, что в развитии ветвления протоков и лобуло-альвеолярных структур участвует активированный Stat5.Два белка Stat5, Stat5a и Stat5b, обнаруживают высокую консервативность последовательностей, указывая на то, что они выполняют родственные или идентичные функции (33). Сообщалось, что Stat5a особенно важен для дифференцировки молочных желез и лактации (35). У Stat5a-нулевых мышей рост лобуло-альвеолярных структур молочной железы прекращался во время беременности, и самки не могли кормить грудью после родов из-за нарушения терминальной дифференцировки молочной железы (35). Однако развитие молочных желез нарушено у мышей с нулевым Stat5b, и хотя гены молочного белка экспрессируются, мыши производят недостаточное количество молока для кормления своих детенышей (35).Настоящее исследование показало, что PRL индуцирует фосфорилирование Stat5 (Stat5a и Stat5b) и ядерную транслокацию в молочной железе самцов мышей AROM+, что согласуется с предыдущими наблюдениями у самок (9, 10, 36, 37). Сходным образом, Stat5-опосредованное действие ПРЛ необходимо для полной дифференциации молочных желез у самок (35, 38). Наши данные, кроме того, показывают, что особенно мРНК Stat5b обильно экспрессируется в мужской молочной железе AROM+. Интересно, что в возрасте 4 месяцев молочный белок, β-казеин, мРНК также экспрессировался в AROM+ молочных железах.Недавние открытия показали, что β-казеин не экспрессируется в молочных железах самок с отсутствием PRLR и Stat5 (10), что дополнительно указывает на активацию PRLR-зависимой сигнальной системы у самцов AROM+. Было показано, что два маркерных белка различают эпителий протоков и альвеол (10). NKCC1 экспрессируется на высоких уровнях у девственных мышей, но резко снижается в развивающихся альвеолах, тогда как Npt2b не экспрессируется у девственных или ранних беременных мышей, но обнаруживается на поздних сроках беременности и в середине лактации (d 5).В 4-месячных AROM+ молочных железах как Npt2b, так и NKCC1 экспрессировались в некоторых эпителиальных клетках, образующих протоки и альвеолоподобные структуры.
Сходным образом, Stat5-опосредованное действие ПРЛ необходимо для полной дифференциации молочных желез у самок (35, 38). Наши данные, кроме того, показывают, что особенно мРНК Stat5b обильно экспрессируется в мужской молочной железе AROM+. Интересно, что в возрасте 4 месяцев молочный белок, β-казеин, мРНК также экспрессировался в AROM+ молочных железах.Недавние открытия показали, что β-казеин не экспрессируется в молочных железах самок с отсутствием PRLR и Stat5 (10), что дополнительно указывает на активацию PRLR-зависимой сигнальной системы у самцов AROM+. Было показано, что два маркерных белка различают эпителий протоков и альвеол (10). NKCC1 экспрессируется на высоких уровнях у девственных мышей, но резко снижается в развивающихся альвеолах, тогда как Npt2b не экспрессируется у девственных или ранних беременных мышей, но обнаруживается на поздних сроках беременности и в середине лактации (d 5).В 4-месячных AROM+ молочных железах как Npt2b, так и NKCC1 экспрессировались в некоторых эпителиальных клетках, образующих протоки и альвеолоподобные структуры.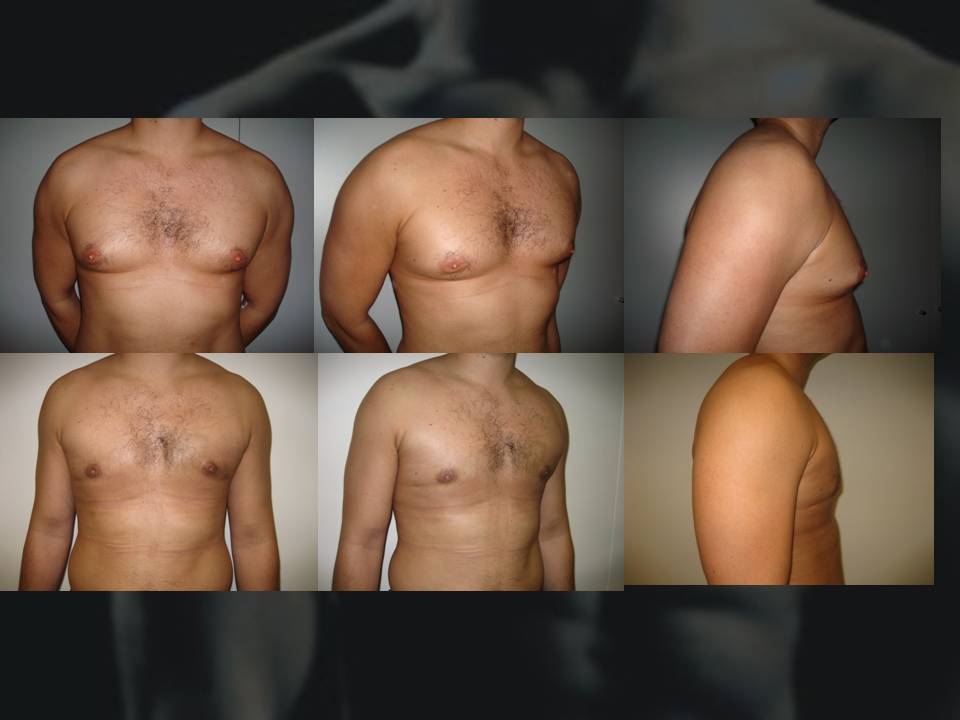 Это еще одно доказательство женской дифференцировки эпителия молочной железы у самцов AROM+. Однако необходимо провести дополнительные анализы, чтобы сделать вывод, насколько близко развитие протоков похоже на развитие самок.
Это еще одно доказательство женской дифференцировки эпителия молочной железы у самцов AROM+. Однако необходимо провести дополнительные анализы, чтобы сделать вывод, насколько близко развитие протоков похоже на развитие самок.
Остатки молочных протоков с атрофированными эпителиальными клетками могут быть обнаружены микроскопически у мужчин. На ранних стадиях идиопатической гинекомастии человека молочная железа характеризуется пролиферацией как стромы, так и эпителия протоков, когда протоки удлиняются и разветвляются (39).ER и PR, а также PRLR присутствуют в молочных железах мужчин с гинекомастией (40–42). При прогрессировании состояния строма становится более коллагеновой и менее отечной, а эпителий регрессирует (39). У мышей MMTV-arom+ были обнаружены одиночные протоки с эпителиальной гиперплазией (3), но альвеолярные структуры не были описаны. Морфологически эти структуры напоминают структуры, наблюдаемые при идиопатической гинекомастии человека. Было продемонстрировано, что небольшое увеличение отношения концентраций эстрогенов в плазме к концентрациям андрогенов мало влияет на внутрижелезистые уровни гормонов и, в конечном счете, на индукцию ацинарных и дольковых образований в мужской груди (43). Это согласуется с гистологическими изменениями, наблюдаемыми у мышей MMTV-arom+, у которых наблюдаются менее глубокие изменения соотношения эстроген/андроген в сыворотке по сравнению с самцами мышей AROM+. Общая структура молочной железы у мышей AROM+ очень похожа на таковую у самок нормального возраста и стадии развития. Интересно, что длительный прием прогестинов и эстрогенов приводит к аналогичному полному развитию и сохранению молочных желез по женскому типу у транссексуалов мужского и женского пола (43). В дополнение к более ранней активации промотора убиквитина С более обширная ароматизация у мышей AROM+ может объяснить различия между двумя линиями мышей со сверхэкспрессией ароматазы.
Это согласуется с гистологическими изменениями, наблюдаемыми у мышей MMTV-arom+, у которых наблюдаются менее глубокие изменения соотношения эстроген/андроген в сыворотке по сравнению с самцами мышей AROM+. Общая структура молочной железы у мышей AROM+ очень похожа на таковую у самок нормального возраста и стадии развития. Интересно, что длительный прием прогестинов и эстрогенов приводит к аналогичному полному развитию и сохранению молочных желез по женскому типу у транссексуалов мужского и женского пола (43). В дополнение к более ранней активации промотора убиквитина С более обширная ароматизация у мышей AROM+ может объяснить различия между двумя линиями мышей со сверхэкспрессией ароматазы.
Некоторые гормоны, участвующие в нормальном развитии молочной железы, включая эстрогены, прогестерон и ПРЛ, также участвуют в канцерогенезе молочной железы у женщин. Особенно известно, что женские половые стероиды связаны с повышенным риском рака молочной железы у женщин (19), и предполагается, что перекрестное взаимодействие между стероидами и ПРЛ-зависимыми путями действует синергическим образом для активации канцерогенеза молочной железы (26). ). Однако, хотя у трансгенных самок мышей со сверхэкспрессией ПРЛ развиваются опухоли молочной железы в возрасте 11-15 месяцев (44), предполагаемая роль ПРЛ в развитии рака молочной железы человека все еще обсуждается (15).Несмотря на то, что сигнальные пути как для женских половых стероидов, так и для ПРЛ присутствуют в мужской молочной железе AROM+, никаких признаков канцерогенеза не было обнаружено в течение 9-месячного периода наблюдения, что позволяет предположить, что пролиферативное давление измененной гормональной среды было недостаточно для инициации иммортализации протокового эпителия в мужской молочной железе AROM+.
). Однако, хотя у трансгенных самок мышей со сверхэкспрессией ПРЛ развиваются опухоли молочной железы в возрасте 11-15 месяцев (44), предполагаемая роль ПРЛ в развитии рака молочной железы человека все еще обсуждается (15).Несмотря на то, что сигнальные пути как для женских половых стероидов, так и для ПРЛ присутствуют в мужской молочной железе AROM+, никаких признаков канцерогенеза не было обнаружено в течение 9-месячного периода наблюдения, что позволяет предположить, что пролиферативное давление измененной гормональной среды было недостаточно для инициации иммортализации протокового эпителия в мужской молочной железе AROM+.
В заключение, модель трансгенной мыши дает нам новый инструмент для лучшего понимания нормального развития молочной железы и для подробного анализа патологических событий, происходящих в молочных железах мужчин, у которых развивается гинекомастия.Наши исследования на самцах мышей AROM+ показывают, что хроническая стимуляция эстрогеном активирует ряд гормональных изменений, приводящих к изменению паттерна экспрессии генов, включая гены, участвующие в морфогенезе молочной железы. Точная роль этих факторов в развитии гинекомастии еще предстоит выяснить. Скрещивание мышей AROM+ с нокаутными мышами, дефицитными по сигнальным системам различных гормонов, будет иметь важное значение в дальнейших исследованиях. Также следует провести исследования с использованием специфических антагонистов рецепторов.Тем не менее, молочная железа AROM+ представляет собой чувствительную модель для доклинических исследований эффективных гормональных препаратов, влияющих на баланс андрогенов/эстрогенов, таких как ингибиторы ароматазы.
Точная роль этих факторов в развитии гинекомастии еще предстоит выяснить. Скрещивание мышей AROM+ с нокаутными мышами, дефицитными по сигнальным системам различных гормонов, будет иметь важное значение в дальнейших исследованиях. Также следует провести исследования с использованием специфических антагонистов рецепторов.Тем не менее, молочная железа AROM+ представляет собой чувствительную модель для доклинических исследований эффективных гормональных препаратов, влияющих на баланс андрогенов/эстрогенов, таких как ингибиторы ароматазы.
Благодарности
Мы благодарим г-жу Джоанну Веса и г-жу Туулу Таннер за техническую помощь в микроскопических исследованиях, г-жу Кати Раепало за техническую помощь в генотипировании мышей и г-на Рамина Шариатмадари за помощь в проведении конфокального микроскопического анализа. Анса Оджанлатва внесла лингвистические предложения.
Работа выполнена при поддержке Национального технологического агентства Финляндии (контракт 40021/00) и Академии Финляндии.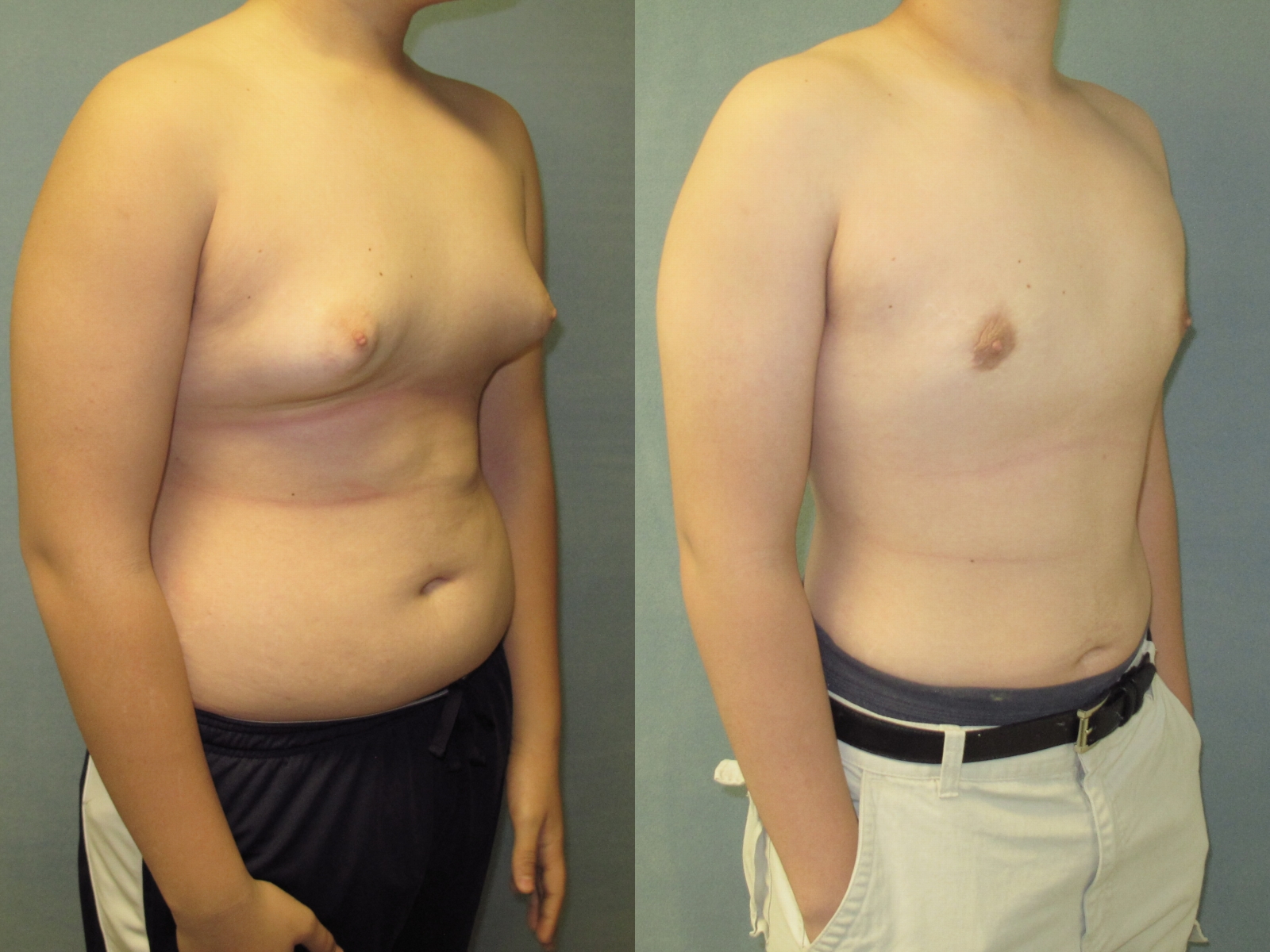
Сокращения
ER
MMTV
Meam Mambary опухоль опухоли
PCNA
Пролиферирующий ядерный антиген
PR
TEB
WT
Аффольтер М., Беллуски С., Ито Н., Шило Б., Тьери Дж. П., Верб З.: Трубка или не трубка: ремоделирование эпителиальных тканей путем морфогенеза ветвления, Dev Cell, 2003, 4: 11-18, 10.
 1016/S1534-5807(02)00410-0,
1016/S1534-5807(02)00410-0,CAS Статья пабмед Google Scholar
Дэвис Дж.А.: Наблюдение за свечением и разветвлением канальцев.Curr Opin Genet Dev. 2005, 15: 364-370. 10.1016/ж.где.2005.06.003.
КАС Статья пабмед Google Scholar
Любарский Б., Краснов М.А.: Морфогенез трубок: изготовление и формирование биологических трубок. Клетка. 2003, 112: 19-28. 10.1016/S0092-8674(02)01283-7.
КАС Статья пабмед Google Scholar
O’Brien LE, Zegers MMP, Mostov KE: Построение эпителиальной архитектуры: понимание трехмерных моделей культуры.Nat Rev Mol Cell Biol. 2002, 3: 531-537. 10.1038/nrm859.
Артикул пабмед Google Scholar
Хенс Дж.
 Р., Высолмерски Дж. Дж.: Ключевые этапы развития молочной железы: молекулярные механизмы, участвующие в формировании эмбриональной молочной железы. Рак молочной железы Res. 2005, 7: 220-224. 10.1186/bcr1306.
Р., Высолмерски Дж. Дж.: Ключевые этапы развития молочной железы: молекулярные механизмы, участвующие в формировании эмбриональной молочной железы. Рак молочной железы Res. 2005, 7: 220-224. 10.1186/bcr1306.КАС Статья пабмед ПабМед Центральный Google Scholar
Хинк Л., Зильберштейн Г.Б.: Ключевые этапы развития молочной железы: концевой зачаток молочной железы как подвижный орган.Рак молочной железы Res. 2005, 7: 245-251. 10.1186/bcr1331.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ховард Б.А., Гастерсон Б.А.: Развитие груди человека. J Биол. неоплазия молочной железы. 2000, 5: 119-137. 10.1023/А:1026487120779.
КАС Статья пабмед Google Scholar
Curtis Hewitt S, Couse JF, Korach KS: Транскрипция и трансактивация рецептора эстрогена: мыши с нокаутом рецептора эстрогена: что их фенотипы говорят о механизмах действия эстрогена.
 Рак молочной железы Res. 2000, 2: 345-352. 10.1186/bcr79.
Рак молочной железы Res. 2000, 2: 345-352. 10.1186/bcr79.КАС Статья пабмед ПабМед Центральный Google Scholar
Bocchinfuso WP, Lindzey JK, Hewitt SC, Clark JA, Myers PH, Cooper R, Korach KS: Индукция развития молочной железы у мышей с нокаутом альфа-рецептора эстрогена. Эндокринология. 2000, 141: 2982-2994. 10.1210/ан.141.8.2982.
КАС пабмед Google Scholar
Sakakura T, Nishizuka Y, Dawe CJ: Зависимый от мезенхимы морфогенез и специфичная для эпителия цитодифференцировка в молочной железе мыши.Наука. 1976, 194: 1439-1441.
КАС Статья пабмед Google Scholar
Cunha GR, Young P, Christov K, Guzman R, Nandi S, Talamantes F, Thordarson G: Фенотипическая экспрессия молочной железы, индуцированная в эпидермальных клетках эмбриональной мезенхимой молочной железы.
 Акта Анат (Базель). 1995, 152: 195-204.
Акта Анат (Базель). 1995, 152: 195-204.КАС Статья Google Scholar
Naylor MJ, Ormandy CJ: Специфические для линии мышей паттерны бокового ветвления протоков эпителия молочных желез вызываются стромальными факторами.Дев Дин. 2002, 225: 100-105. 10.1002/двды.10133.
КАС Статья пабмед Google Scholar
Daniel CW, Silberstein GB, Strickland P: прямое действие 17-бета-эстрадиола на молочные протоки мышей, проанализированное с помощью имплантатов с замедленным высвобождением и стероидной авторадиографии. Рак рез. 1987, 47: 6052-6057.
КАС пабмед Google Scholar
Клейнберг Д.Л., Фельдман М., Руан В.: IGF-I: существенный фактор в формировании концевых зачатков и морфогенезе протоков.J Биол. неоплазия молочной железы. 2000, 5: 7-17.
 10.1023/А:1009507030633.
10.1023/А:1009507030633.КАС Статья пабмед Google Scholar
Gallego MI, Binart N, Robinson GW, Okagaki R, Coschigano KT, Perry J, Kopchick JJ, Oka T, Kelly PA, Hennighausen L: Пролактин, гормон роста и эпидермальный фактор роста активируют Stat5 в различных отделах молочной железы ткани и оказывают различные и перекрывающиеся эффекты развития. Дев биол. 2001, 229: 163-175.10.1006/dbio.2000.9961.
КАС Статья пабмед Google Scholar
Fisher CR, Graves KH, Parlow AF, Simpson ER: Характеристика мышей с дефицитом ароматазы (ArKO) из-за целенаправленного нарушения гена cyp19. Proc Natl Acad Sci USA. 1998, 95: 6965-6970. 10.1073/пнас.95.12.6965.
КАС Статья пабмед ПабМед Центральный Google Scholar
Richards RG, Klotz DM, Walker MP, Diaugustine RP: Морфогенез ветвления молочной железы снижен у мышей с дефицитом инсулиноподобного фактора роста-I (IGF-I), но не у мышей с печеночно-специфическим удаление IGF-I.
 Эндокринология. 2004, 145: 3106-3110. 10.1210/en.2003-1112.
Эндокринология. 2004, 145: 3106-3110. 10.1210/en.2003-1112.КАС Статья пабмед Google Scholar
Bonnette SG, Hadsell DL: Направленное разрушение гена рецептора IGF-I снижает клеточную пролиферацию в терминальных зачатках молочных желез. Эндокринология. 2001, 142: 4937-4945. 10.1210/ан.142.11.4937.
КАС Статья пабмед Google Scholar
Mueller SO, Clark JA, Myers PH, Korach KS: Развитие молочных желез у взрослых мышей требует эпителиального и стромального рецептора эстрогена альфа.Эндокринология. 2002, 143: 2357-2365. 10.1210/ан.143.6.2357.
КАС пабмед Google Scholar
Ruan W, Monaco ME, Kleinberg DL: Прогестерон стимулирует морфогенез протоков молочной железы путем синергизма и усиления действия инсулиноподобного фактора роста-I.
 Эндокринология. 2005, 146: 1170-1178. 10.1210/en.2004-1360.
Эндокринология. 2005, 146: 1170-1178. 10.1210/en.2004-1360.КАС Статья пабмед Google Scholar
Soyal S, Ismail PM, Li J, Mulac-Jericevic B, Conneely OM, Lydon JP: Роль прогестерона в развитии молочной железы и онкогенезе, как показано экспериментальной генетикой мышей.Рак молочной железы Res. 2002, 4: 191-196. 10.1186/bcr451.
КАС Статья пабмед ПабМед Центральный Google Scholar
Brisken C, Park S, Vass T, Lydon JP, O’Malley BW, Weinberg RA: Паракринная роль эпителиального рецептора прогестерона в развитии молочной железы. Proc Natl Acad Sci USA. 1998, 95: 5076-5081. 10.1073/пнас.95.9.5076.
КАС Статья пабмед ПабМед Центральный Google Scholar
Humphreys RC, Lydon J, O’Malley BW, Rosen JM: Развитие молочной железы опосредуется как стромальными, так и эпителиальными рецепторами прогестерона.Мол Эндокринол. 1997, 11: 801-811. 10.1210/ме.11.6.801.
КАС Статья пабмед Google Scholar
Brisken C, Heineman A, Chavarria T, Elenbaas B, Tan J, Dey SK, McMahon JA, McMahon AP, Weinberg RA: важная функция Wnt-4 в развитии молочной железы после передачи сигналов прогестерона. Гены Дев. 2000, 14: 650-654.
КАС пабмед ПабМед Центральный Google Scholar
Conneely OM, Jericevic BM, Lydon JP: Рецепторы прогестерона в развитии молочной железы и онкогенезе.J Биол. неоплазия молочной железы. 2003, 8: 205-214. 10.1023/А:1025952
4.Артикул пабмед Google Scholar
Fata JE, Kong YY, Li J, Sasaki T, Irie-Sasaki J, Moorehead RA, Elliott R, Scully S, Voura EB, Lacey DL и др.: Фактор дифференцировки остеокластов остеопротегерин-лиганд необходим для молочной железы развитие железы. Клетка. 2000, 103: 41-50. 10.1016/S0092-8674(00)00103-3.
КАС Статья пабмед Google Scholar
Coleman S, Silberstein GB, Daniel CW: Морфогенез протоков в молочной железе мыши: доказательства, подтверждающие роль эпидермального фактора роста.Дев биол. 1988, 127: 304-315. 10.1016/0012-1606(88)
Kenney NJ, Bowman A, Korach KS, Barrett JC, Salomon DS: Влияние экзогенных эпидермоподобных факторов роста на развитие и дифференцировку молочной железы у мышей с нокаутом рецептора эстрогена-альфа (ERKO). Лечение рака молочной железы. 2003, 79: 161-173. 10.1023/А:1023938510508.
КАС Статья пабмед Google Scholar
Sebastian J, Richards RG, Walker MP, Wiesen JF, Werb Z, Derynck R, Hom YK, Cunha GR, DiAugustine RP: Активация и функция рецептора эпидермального фактора роста и erbB-2 во время морфогенеза молочной железы.Рост клеток отличается. 1998, 9: 777-785.
КАС пабмед Google Scholar
Luetteke NC, Qiu TH, Fenton SE, Troyer KL, Riedel RF, Chang A, Lee DC: Направленная инактивация генов EGF и амфирегулина выявляет различные роли лигандов рецепторов EGF в развитии молочной железы мыши. Разработка. 1999, 126: 2739-2750.
КАС пабмед Google Scholar
Sternlicht MD, Sunnarborg SW, Kouros-Mehr H, Yu Y, Lee DC, Werb Z: Морфогенез протоков молочных желез требует паракринной активации стромального EGFR посредством ADAM17-зависимого выделения эпителиального амфирегулина.Разработка. 2005, 132: 3923-3933. 10.1242/dev.01966.
КАС Статья пабмед ПабМед Центральный Google Scholar
Wiseman BS, Sternlicht MD, Lund LR, Alexander CM, Mott J, Bissell MJ, Soloway P, Itohara S, Werb Z: Сайт-специфическая индуктивная и ингибирующая активность MMP-2 и MMP-3 оркестрируют разветвления молочной железы морфогенез. Джей Селл Биол. 2003, 162: 1123-1133. 10.1083/jcb.200302090.
КАС Статья пабмед ПабМед Центральный Google Scholar
Kheradmand F, Rishi K, Werb Z: Передача сигналов через рецептор EGF частично контролирует морфогенез легких путем регуляции опосредованной MT1-MMP активации желатиназы A/MMP2.Дж. Клеточные науки. 2002, 115: 839-848.
КАС пабмед ПабМед Центральный Google Scholar
Лу П., Эвальд А., Мартин Г., Верб З.: Существенная функция сигнального пути FGF во время морфогенеза ветвления молочной железы (аннотация № 515). Дев биол. 2005, 283: 680-681.
Google Scholar
Jackson-Fisher AJ, Bellinger G, Ramabhadran R, Morris JK, Lee KF, Stern DF: ErbB2 необходим для морфогенеза протоков молочной железы.Proc Natl Acad Sci USA. 2004, 101: 17138-17143. 10.1073/пнас.0407057101.
КАС Статья пабмед ПабМед Центральный Google Scholar
Andrechek ER, White D, Muller WJ: Направленное разрушение ErbB2/Neu в эпителии молочных желез приводит к нарушению роста протоков. Онкоген. 2005, 24: 932-937. 10.1038/sj.onc.1208230.
КАС Статья пабмед Google Scholar
Tidcombe H, Jackson-Fisher A, Mathers K, Stern DF, Gassmann M, Golding JP: Дефекты нервной и молочной желез у мышей с нокаутом ErbB4, генетически спасенных от эмбриональной летальности.Proc Natl Acad Sci USA. 2003, 100: 8281-8286. 10.1073/пнас.1436402100.
КАС Статья пабмед ПабМед Центральный Google Scholar
Dunbar ME, Dann P, Brown CW, Van Houton J, Dreyer B, Philbrick WP, Wysolmerski JJ: Временно регулируемая избыточная экспрессия белка, связанного с паратиреоидным гормоном, в молочной железе выявляет различные фетальные и пубертатные фенотипы. J Эндокринол. 2001, 171: 403-416. 10.1677/Джо.0.1710403.
КАС Статья пабмед Google Scholar
Srinivasan K, Strickland P, Valdes A, Shin GC, Hinck L: Взаимодействие нетрин-1/неогенин стабилизирует мультипотентные клетки-предшественники во время морфогенеза молочной железы. Ячейка Дев. 2003, 4: 371-382. 10.1016/С1534-5807(03)00054-6.
КАС Статья пабмед Google Scholar
Льюис М.Т.: Передача сигналов Hedgehog в развитии и неоплазии молочной железы мыши.J Биол. неоплазия молочной железы. 2001, 6: 53-66. 10.1023/А:1009516515338.
КАС Статья пабмед Google Scholar
Radisky DC, Hirai Y, Bissell MJ: Доставка сообщения: эпиморфин и морфогенез эпителия молочной железы. Тенденции клеточной биологии. 2003, 13: 426-434. 10.1016/С0962-8924(03)00146-6.
КАС Статья пабмед ПабМед Центральный Google Scholar
Гуон-Эванс В., Лин Э.Ю., Поллард Дж.В.: Требование макрофагов и эозинофилов и их цитокинов/хемокинов для развития молочной железы.Рак молочной железы Res. 2002, 4: 155-164. 10.1186/bcr441.
Артикул пабмед ПабМед Центральный Google Scholar
Daniel CW, Robinson S, Silberstein GB: Роль TGF-β в формировании паттерна и росте дерева протоков молочной железы. J Биол. неоплазия молочной железы. 1996, 1: 331-341. 10.1007/BF02017389.
КАС Статья пабмед Google Scholar
Эван К.Б., Шьямала Г., Равани С.А., Танг Ю., Акхерст Р., Уэйкфилд Л., Барселлос-Хофф М.Х. Активация латентного трансформирующего фактора роста-бета в молочной железе: регуляция гормонами яичников влияет на пролиферацию протоков и альвеол.Ам Джей Патол. 2002, 160: 2081-2093.
КАС Статья пабмед ПабМед Центральный Google Scholar
Sternlicht MD, Werb Z: Как матриксные металлопротеиназы регулируют поведение клеток. Annu Rev Cell Dev Biol. 2001, 17: 463-516. 10.1146/annurev.cellbio.17.1.463.
КАС Статья пабмед ПабМед Центральный Google Scholar
Fata JE, Werb Z, Bissell MJ: Регуляция морфогенеза ветвления молочной железы внеклеточным матриксом и ферментами его ремоделирования.Рак молочной железы Res. 2004, 6: 1-11.
КАС пабмед Google Scholar
Чен Дж., Дьяково Т.Г., Гренаш Д.Г., Санторо С.А., Зуттер М.М. Мыши с дефицитом субъединиц α 2 интегрина: многогранный фенотип, включающий дефекты морфогенеза ветвления и гемостаза. Ам Джей Патол. 2002, 161: 337-344.
КАС Статья пабмед ПабМед Центральный Google Scholar
Klinowska TC, Soriano JV, Edwards GM, Oliver JM, Valentijn AJ, Montesano R, Streuli CH: Ламинин и β 1 интегрины имеют решающее значение для нормального развития молочной железы у мышей.Дев биол. 1999, 215: 13-32. 10.1006/dbio.1999.9435.
КАС Статья пабмед Google Scholar
Klinowska TC, Alexander CM, Georges-Labouesse E, Van der Neut R, Kreidberg JA, Jones CJ, Sonnenberg A, Streuli CH: Эпителиальное развитие и дифференцировка в молочной железе не зависит от α 3 или α 6 интегриновые субъединицы. Дев биол. 2001, 233: 449-467. 10.1006/dbio.2001.0204.
КАС Статья пабмед Google Scholar
Vogel WF, Aszodi A, Alves F, Pawson T: Тирозинкиназа рецептора 1 домена дискоидина играет важную роль в развитии молочной железы.Мол Селл Биол. 2001, 21: 2906-2917. 10.1128/МКБ.21.8.2906-2917.2001.
КАС Статья пабмед ПабМед Центральный Google Scholar
Hathaway HJ, Shur BD: Морфогенез молочной железы подавляется у трансгенных мышей, которые сверхэкспрессируют β1,4-галактозилтрансферазу клеточной поверхности. Разработка. 1996, 122: 2859-2872.
КАС пабмед Google Scholar
Мюшлер Дж., Леви Д., Будро Р., Генри М., Кэмпбелл К., Бисселл М.Дж.: Роль дистрогликана в эпителиальной поляризации: потеря функции в опухолевых клетках молочной железы.Рак рез. 2002, 62: 7102-7109.
КАС пабмед Google Scholar
Сакаи Т., Ларсен М., Ямада К.М. Потребность в фибронектине при морфогенезе ветвления. Природа. 2003, 423: 876-881. 10.1038/природа01712.
КАС Статья пабмед Google Scholar
- Разное
PRLR
PRLR
Stat5
Сигнал преобразователь и активатор транскрипции 5
WT
40002
Biro
FM
,Lucky
AW
,
HUster
GA
,
Morrison
JA
1990
Гормональные исследования и физическое созревание при подростковой гинекомастии
.J Pediamtr
116
:450
—455
2455
2Hedlund
PO
PO
2000
2000
Побочные эффекты эндокринного лечения и их механизмов: желудка, антианхогены и эстрогены
.простата
10
(CAL
):32
—37
3GILL
K
,
KIRMA
K
N
,
TEKMAL
RR
2001 RR
Переключение ароматазы в трансгенных самцов мышей приводит к индукции гинекомастии и другим биохимическим изменениям в молочных железах
.
J стероид биохим моль биол
77
:13
—18
4Li
LI
x
,Nokkala
E
W
,STRENG
T
,Saarinen
N
,N
,WARRI
A
,Huhtaniemi
I
,Santti
R
,
Makela
R
S
,
Poutanen
M
M
2001
Измененная структура и функция репродуктивных органов у трансгенных самцов мышей со сверхэкспрессией ароматазы человека
.Эндокринология
142
:2435
—2435
—2442
5Schorpp
M
,Jager
R
,
Schellander
K
,
Schenkel
J
,Wagner
EF
,Weiher
H
,Angel
P
1996
Промотор убиквитина С человека направляет высокую повсеместную экспрессию трансгенов у мышей
.Нуклеиновые кислоты RES
24
:1787
—1788
6Rasmussen
SB
,LJT
,SMITH
GH
2000
2000
Подготовка молочной железы Все крепления из мышей
. В:
В:Ip
MM
,Asch
BB
, ред.Методы биологии молочной железы и исследования рака молочной железы
.Нью-Йорк
:Kluwer Academic/Plenum Press
;75
—85
70002Gallego
MI
,BinArt
N
,Robinson
GW
,Okagaki
R
,Coschigano
KT
,Perry
J
,KOPCHICK
JJ
,OKA
T
,
KELLY
T
,KELLY
PA
,HENNIGHASEN
L
2001
2001
Пролактин, гормон роста и фактор эпидермального роста Активируйте Stat5 в разных отсеках ткани молочной железы и оказывать различные и перекрывающиеся эффекты развития
.dev biol
229
:163
—175
8Prigent-Tessier
A
,BARKAI
U
,
Tessier
C
,Cohen
H
,Gibori
G
2001
Характеристика клеточной линии матки крысы, клетки U III : экспрессия пролактина (ПРЛ) и эндогенная регуляция ПРЛ-зависимых генов; рецептор эстрогена, β 2 -макроглобулин и децидуальный ПРЛ, включающий пути Jak2 и Stat5
.
Эндокринология
142
:1242
—1250
1250
NG
,NG
E
,
Gibori
G
,
RAO
MC
2000
Janus Kinase 2 (JAK2) регулирует опосредованный пролактином транспорт хлоридов в эпителиальных клетках молочной железы мышей посредством тирозинового фосфорилирования Na + -K + -2Cl — котранспортера
.моль эндокринол
14
:2054
—2054
—2065
10K
,Shillingford1
JM
,SMITH
GH
,GRIMM
SL
,WAGNER
KU
,OKA
T
,ROSEN
JM
,JM
,Robinson
GW
,Hennighausen
L
2001
2001
Датчик сигнала и активатор транскрипции (статистика) 5 контролирует пролиферацию и дифференциацию альвеолярный эпителий молочной железы
.
J Cell Biol
155
:531
—542
11Vuorento
T
,
LAHTI
A
,
Hovatta
O
,Huhtaniemi
I
1989
Ежедневные измерения прогестерона в слюне показывают высокий уровень ановуляции у здоровых студентов
.Scand J Clin Lab Invest
49
:395
—401
12Tekmal
RR
,Ramachandra
N
,GUBBA
N
S
,
Durgam
VR
,Mantione
J
,J
,TODA
K
,K
,Shizuta
y
,Dilhhay
DL
DL
1996
1996
1996
Переметка INT-5 / ароматаза в молочных железах трансгенных мышей приводит к индукции гиперплазии и ядерные аномалии
.Рак Рез
56
:3180
–3185
13Браунштейн
GD
2 3.
Gnecomastia 1993 N Engl J MED
28
: 490
— 495
140002 495 140002 Braunstein
GD
1999
Aromatase и Gynecomastia
.
Эндорец рак рела 2
6
: 315
— 324
15 000 0002 324 15 Vonderhaar
BK
1998
1998
Пролактин: забытый гормон рака молочной железы человека
. Pharmacol Thracol
79
: 169
— 1789
— 1702 Robinson
Robinson
GW
,
KARPF
ABC
, Kratochwil
K
1999
Регулирование развития молочной железы по взаимодействию тканей
. J MAMMARAY GLAND BIOL NEOPLASIA
4
: 4
: 4
19 000 20003 17
Kratochwill
K
1971
1971
in vivo Анализ гормональной основы для сексуального диморфизма в эмбриональном развитии мыши Mammary сальник
. J EmbryOL EXP Morphol
25
: 141
— 153
180003 — 153
18 20002 лес
мг
мг
1983
Роль андрогенов в феталь и развитие Pubertal
.
HORM RES
18
: 69
— 83
1 — 83
1 — RUSSO
IH
,
IH
, RUSSO
J
J
1998
1998
Роль гормонов в начале рака молочнике и прогрессирование
. J Memary Gland Biol Neoplasia
3
: 49
— 61
20 Bocchinfuso
WP
, WP
, WP
KS
KS
1997
1997
MAMMARAY GLAND Разработка и туманогенез в эстрогеном рецепторе для нокаута мышей
. J MAMMARAY GLAND BIOL NEOPLASIA
2
: 323
— 334
21 334
21 Silberstein
GB
, ван рога
K
, Shyamala
G
, Daniel
CW
1994
Существенная роль эндогенного эстрогена в непосредственной стимуляции роста молочных желез продемонстрирована с помощью имплантатов, содержащих чистые антиэстрогены
.
Эндокринология
134
: 84
— 90
22 22 S
,
Jensen
EV
, Nilsson
S
, RILANDER
T
, Warner
M
, Gustafsson
JA
2000
Рецепторы эстрогена α и β в молочной железе грызунов
. Proc Natl Acqu Sci USA
97
: 337
— 342
23 Ahokoski
O
, IRJALA
K
, Huupponen
R
, Halonen
K
, Salminen
E
, Scheinin
H
1998
Гормональные эффекты MPV-2213ad, нового селективного ингибитора ароматазы, у здоровых мужчин. Фаза I исследования
. BR J Clin Pharmacol
45
: 140002 45
: 140002
— 146
240003 WP
, WP
, Lindzey
JK
, Hewitt
SC
, CLARK
JA
, Myers
PH
, Cooper
R
, Korach
KS
2000
Индукция развития молочной железы у мышей с нокаутом рецептора эстрогена-α3 9000.
Эндокринология
141
: 2982
— 2982
— 2994
— 25, JL
, Raafat
AM
, AM
SZ
1998
1998
Молодная железа Рост и разработка из постнатального периода до постменопаузы: онтогенез и регуляция стероидных рецепторов яичников у мышей
. J MAMMARAY GLAND BIOL NEOPLASIA
3
: 70002 3
22
7
— 22
26 22
26, Richer
JK
,
HORWITZ
KB
1999
Гипотеза: Progesterone Preams раковые клетки для перекрестной связи с пролиферативными или антипролиферативными сигналами
. моль эндокринол
13
: 829
— 829
— 27,
Maple
K
,,
,
R
, GINSBURT
E
,
VONDERHAAR
B
1999
Progesterone стимулирует синтез ДНК и лобуло-альвеолярное развитие в молочных железах у мышей с удаленными яичниками
.
J Cell Physiol
180
: 298
— 304
28 Lydon
JP
,
Demayo
FJ
,
Funk
CR
,
Mani
SK
, Hughes
AR
, MONTGOMERY JR
CA
, Shyamala
G
,,
G
,
,
G
OM
,
O’Malley
BW
1995
Мышей, не имеющие рецептора прогестерона, проявляют плейотропные репродуктивные нарушения
. генов dev
9
: 2266
— 2278
— 2278
2 CUNHA
GR
,,
HOM
P
, HOM
YK
, Cooke
PS
, Taylor
JA
, Lubahn
DB
1997
Выяснение роли стромальных рецепторов стероидных гормонов в росте и развитии молочной железы с использованием тканевых рекомбинантов
. J Mambary Gland Biol Neoplasia
2
: 393
— 402
30 30 Shyamala
G
г
1999
Сигнализация прогестерона и молочная железа Morphogenesis
.
J Mambary Gland Biol Neoplasia
4
: 89
— 104
31 Nagasawa
H
, MORII
S
, Furuichi
R
, Iwai
Y
, Iwai
M
, Mori
T
, Goto
Y
1993
Индукция опухоли молочной железы у самцов мышей путем пересадки гипофиза.
Лаборатория Anim
27
: 358
— 363
— 363
32 Spady
TJ
, Harvell
DM
,
Snyder
MC
, Pennington
KL
, MCComb
Rd
, Shull
JD
1998
Эстроген-индуцированный онкогенез у крыс Copenhagen: несоизмеримая предрасположенность к развитию пролактинпродуцирующих опухолей гипофиза и карцином молочной железы
. Рак Lett
124
: 9000
— 103
33 LIU
LIU
,
GW
,
Gouilleux
F
, Groner
B
, Hennighausen
L
1995
Клонирование и экспрессия Stat5 и дополнительного гомолога (Stat5b), участвующих в передаче сигнала пролактина в ткани молочной железы мыши
.
Proc Natl Acqu SCI USA
92
: 8831
— 8835
— 8835
— 34 Wakao
H
,
Gouilleux
F
,
Groner
F
,
Groner
B
1994
MAMMARY GANTE (MGF ) является новым членом семейства генов факторов транскрипции, регулируемых цитокинами, и обеспечивает пролактиновый ответ
. EMBO J
13
: 2182
— 2192
— 2191
35 LIU
,
GW
,
VAGNER
KU
, Garrett
L
, Wynshaw-Boris
A
, Hennighausen
L
1997
Stat5a обязателен для развития молочной железы и лактогенеза у взрослых
. ГЕНЫ DEV
11
: — ALI
— ALI
360002 S S
S
1998
1998
1998
Пролактин рецептор регулирует статус 5 тирозинафосфорилирования и ядерную транслокацию двумя отдельными путями
.
J Biol Chem
273
: 7709
— 7716
— 7716
37 Ahonen
TJ
, Härkonen
PL
, RUI
H
, Nevalainen
MT
2002
Трансдукция сигнала ПРЛ в эпителиальном компартменте предстательной железы крысы, сохраняемой в виде длительных культур органов in vitro
. Эндокринология
143
: 228
— 228
— 238
38 Ormandy
CJ
, Camus
A
,
Barra
J
,
DAMOTTE
D
, LUCAS
B
, BUTEAU
H
, H
, EDERY
M
, BROSSE
N
, BABINET
N
,,
BINART
C
, BINART
N
,
и KELLY
PA
1997
NULL MUTATION гена рецептора пролактина вызывает множественные репродуктивные дефекты у мышей
. Гены dev
11
: 167
— 177
39 Andersen
JA
, JA
, GRAM
JB
JB
1982
Мужская грудка в Autopsy
.
ACHA Pathol Microboiol Immunol Scand A
90
: 191
— 1979
40 BURGESS
HE
,
Shousha
S
1993
Иммуногистохимическое исследование долгосрочных эффектов андрогена введение в транссексуальную грудь от женщины к мужчине: сравнение с нормальной женской грудью и мужской грудью, демонстрирующей гинекомастию
. J Pathol
170
: 37
— 43
41 Pensler
JM
, Silverman
BL
, SANGHAVI
J
, Goolsby
C
, Speck
G
, Brizio-Molteni
L
, Molteni
A
2000
Рецепторы эстрогена и прогестерона при гинекомастии
. Plast Reconnran Surg
106
: 1011
— 1013
42 42 Mertani
HC
, Garcia-Caballero
T
, Lambert
T
A
,
Gerard
F
, Palayer
C
, C
, BUTIN
JM
, VONDERHAAR
BK
, WTOR
MJ
,
LOBEI
PE
,
MOREL
G
1998
Клеточное выражение гормона роста и рецепторы пролактина при заболеваниях груди у человека
.
INT J Cancer
79
: 202
— 211
43 Kanhai
RC
, HAGE
JJ
, VAN Diest
PJ
, BLOEMENA
E
, Mulder
JW
2000
Краткосрочные и долгосрочные гистологические эффекты кастрации и лечения эстрогенами на ткани молочной железы 14 мужчин-транссексуалов в женщин по сравнению с двумя химически кастрированными мужчинами
. AM J Surg Pathol
24
: 74
— 80
44 Wennbo
H
, Gebre-Medhin
M
, Gritli-Linde
A
, Ohlsson
C
, Isaksson
OG
, Tornell
J
1997
Активация рецептора пролактина, но не рецептора гормона роста важна для индукции опухолей молочной железы у трансгенных мышей3 90.
J Clin Invest
100
: 2744
– 2751
Copyright © 2002 Эндокринное общество
%PDF-1. 4
%
5 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
6 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
7 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
13 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
1 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
8 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
к.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
12 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
4 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.
4
%
5 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
6 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
7 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
13 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
1 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
8 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
к.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
12 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
4 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k. 7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
11 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
3 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
10 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
9 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
15 0 объект
>поток
x뒛ȶ0BUK6?&P\v’bzJV.2seJ?Mjg䟿?o’h4 }W
~v|n4&smQ38w=\
.Y7hHNDp)3GW »@]
7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
11 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
3 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
10 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
9 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
15 0 объект
>поток
x뒛ȶ0BUK6?&P\v’bzJV.2seJ?Mjg䟿?o’h4 }W
~v|n4&smQ38w=\
.Y7hHNDp)3GW »@]
Ключевые стадии развития молочной железы: сигналы, которые регулируют морфогенез ветвления протоков | Исследования рака молочной железы
-Х.
 4
%
5 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
6 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
7 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
13 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
1 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
8 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
к.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
12 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
4 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.
4
%
5 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
6 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
7 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
13 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
1 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
8 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
к.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
12 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
4 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k. 7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
11 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
3 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
10 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
9 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
15 0 объект
>поток
x뒛ȶ0BUK6?&P\v’bzJV.2seJ?Mjg䟿?o’h4 }W
~v|n4&smQ38w=\
.Y7hHNDp)3GW »@]
7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
11 0 объект
>>>/BBox[0 0 603 783]/длина 169>>поток
хU
0DY´\wHӪ%QCTWnfgEqPXBעDMMrFЭ8yǦ-RJ{wVrhpIK\(GIw9`*[ponOā:»{6\qYD.c =dVks;H
конечный поток
эндообъект
3 0 объект
>>>/BBox[0 0 603.36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
10 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
9 0 объект
>>>/BBox[0 0 603,36 783,36]/длина 168>>поток
xUM0D=,ua%+Hj()HnoѕI&yyŒB`U+46G;Oζp
k.7\fDDr*oBri|!ƿRulV猪g>L;
конечный поток
эндообъект
15 0 объект
>поток
x뒛ȶ0BUK6?&P\v’bzJV.2seJ?Mjg䟿?o’h4 }W
~v|n4&smQ38w=\
.Y7hHNDp)3GW »@]КАС Статья пабмед Google Scholar

 Начинается с 9-13 лет. В это время появляются первые признаки полового созревания — волосы на теле, увеличение яичек, боли молочных желез.
Начинается с 9-13 лет. В это время появляются первые признаки полового созревания — волосы на теле, увеличение яичек, боли молочных желез. разница)
разница)



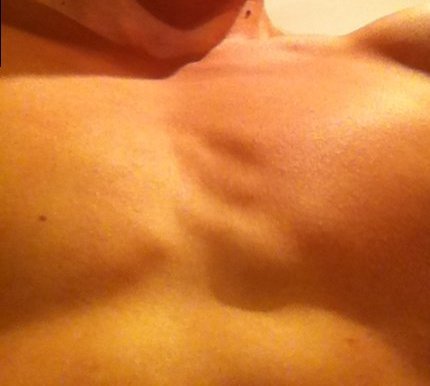
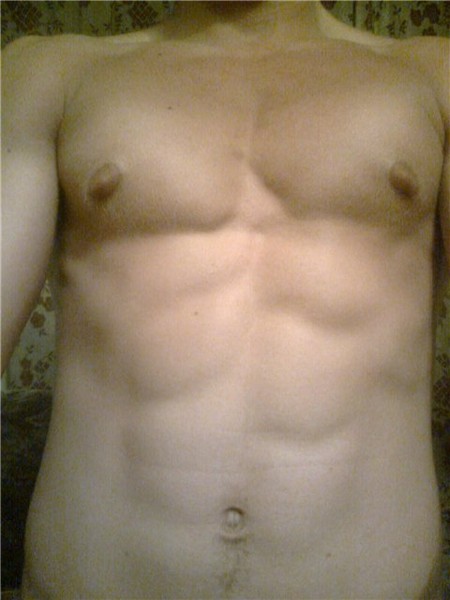
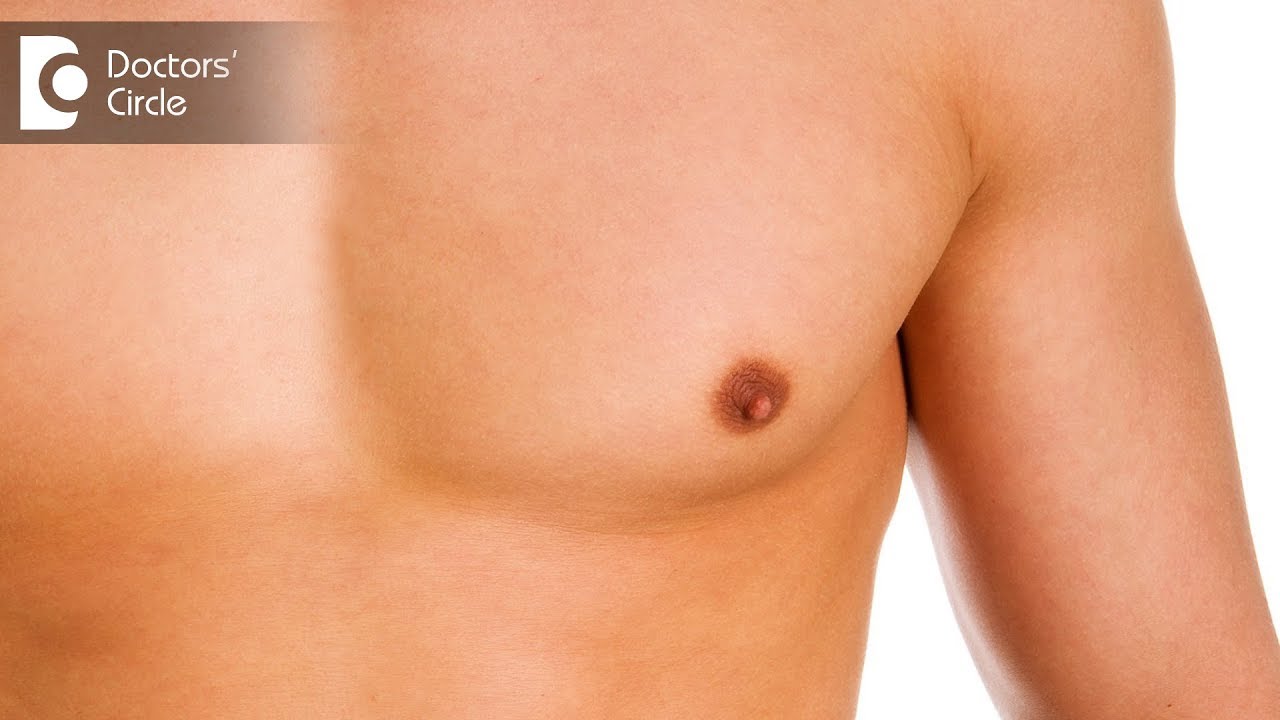


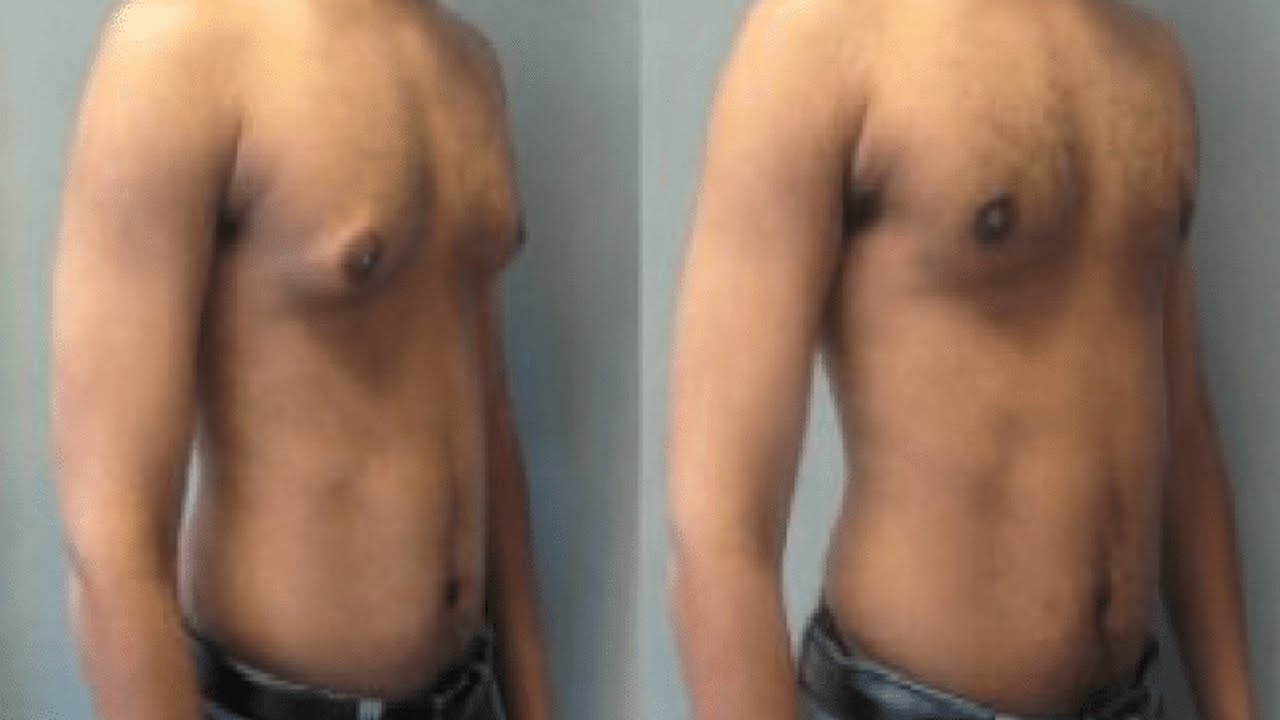 1016/S1534-5807(02)00410-0,
1016/S1534-5807(02)00410-0, Р., Высолмерски Дж. Дж.: Ключевые этапы развития молочной железы: молекулярные механизмы, участвующие в формировании эмбриональной молочной железы. Рак молочной железы Res. 2005, 7: 220-224. 10.1186/bcr1306.
Р., Высолмерски Дж. Дж.: Ключевые этапы развития молочной железы: молекулярные механизмы, участвующие в формировании эмбриональной молочной железы. Рак молочной железы Res. 2005, 7: 220-224. 10.1186/bcr1306. Акта Анат (Базель). 1995, 152: 195-204.
Акта Анат (Базель). 1995, 152: 195-204. 10.1023/А:1009507030633.
10.1023/А:1009507030633. Эндокринология. 2004, 145: 3106-3110. 10.1210/en.2003-1112.
Эндокринология. 2004, 145: 3106-3110. 10.1210/en.2003-1112. Эндокринология. 2005, 146: 1170-1178. 10.1210/en.2004-1360.
Эндокринология. 2005, 146: 1170-1178. 10.1210/en.2004-1360.