Общий наркоз — последствия для организма. Как влияет общий и местный наркоз на организм человека (на отдельные органы) Влияние общего наркоза на организм человека
Те, кто ранее испытал на себе наркоз, никогда не будут употреблять наркотики. Это вывод можно сделать, повидав однажды наркозную галлюцинацию. После одного оперативного вмешательства люди начинают опасаться не процедуру, а действие наркоза. К чему стоит готовиться, отправляясь на операционный стол? Как обеспечить максимально быстрое и положительное выздоровление? Как избежать негативных последствий? Подробно об этом читайте в статье на estet.portal.com.
Наркоз и его разновидности
Действие наркоза классифицируют на четыре вида:
- Поверхностный
- Легкий
- Полный
- Сверхглубокий
Поверхностный наркоз является местным, он временно останавливает действие сенсорных рефлексов.
Остальные три вида относятся к общему наркозу.
Действие общей анестезии заключается в том, что организм помещается в сон, все мышцы расслабляются, нервные рефлексы отключаются.
Для каждого человека состав наркоза подбирается в индивидуальном порядке. Его основными ингредиентами является небольшая доля спирта, наркотических веществ и медицинских препаратов. На протяжении всей операции пациент может получить дополнительные дозы наркоза в том случае, если нервная система продолжает проявлять реакции на вмешательство. Объём вводимой анестезии зависит от соотношения роста к массе человека. По этой причине, перед началом операции проходит замер роста и взвешивание пациента.
Общий (полный и глубокий) наркоз является опасным. Для проведения таких операций, организм должен быть подготовленным. Если к операции готовится курильщик, необходимо прекратить курение за шесть недель до оперативного вмешательства. В случае, если пациент питает пристрастие к алкоголю или наркотикам, нужно предупредить об этом врача-анестезиолога.
Операция не проводится в следующих случаях:
- Повышенный уровень сахара в крови;
- Наличие гормонозависимых недугов
- Тяжелая форма бронхиальной астмы
- Острое алкогольное или наркотическое опьянение
- Постинфарктное состояние или после острого нарушения мозгового кровообращения
- Сердечная аритмия
- Декомпенсированная патология эндокринной системы
- Декомпенсированная патология внутренних органов (сердечно-сосудистой системы, паренхиматозных органов)
Для проведения операции, необходимо устранить эти факторы либо минимизировать воздействие на здоровье организма.
Наркоз и его последствия. Как устранить непередаваемые ощущения?
После принудительного угнетения некоторых функций центральной нервной системы, организму необходимо около трёх дней для их восстановления. Самым неприятным является третий день, после чего тело постепенно приходит в порядок.
Чтобы восстановление после операции было максимально простым и скорым, необходимо поддерживать свое тело в здоровом тонусе: заниматься спортом и соблюдать правильный рацион. Перед операцией следует очистить кишечник, не пить много воды и не употреблять пищу. Полный желудок может усугубить постоперационное состояние после возращение в сознание.
Чем крепче организм, тем меньше побочных эффектов наркоза. Далее приведены некоторые из наиболее популярных последствий.
Воздействие анестезии на головной мозг, вызывает галлюцинации. Они начинают посещать разум после пробуждения от наркозного сна. Видения могут быть самыми различными. Чаще всего, после полученного организмом шока, галлюцинации имеют негативный характер. Чтобы избежать этого, нужно настраиваться на позитивные мысли перед получением анестезии. Впрочем, современный наркоз облегчает послеоперационное состояние, в том числе блокирует возникновение галлюцинаций. Такие препараты пока доступны не во всех регионах восточной Европы. Поэтому, готовясь к хирургическому вмешательству, стоит уточнить у анестезиолога наличие препарата, предотвращающего побочные действия анестезии, и по возможности обеспечить себя таковым.
Чтобы избежать этого, нужно настраиваться на позитивные мысли перед получением анестезии. Впрочем, современный наркоз облегчает послеоперационное состояние, в том числе блокирует возникновение галлюцинаций. Такие препараты пока доступны не во всех регионах восточной Европы. Поэтому, готовясь к хирургическому вмешательству, стоит уточнить у анестезиолога наличие препарата, предотвращающего побочные действия анестезии, и по возможности обеспечить себя таковым.
Другим популярным последствием являются кратковременные судороги, которые сопровождаются слезоточивостью. Судороги проходят безболезненно для пациента. В большинстве случаев, тот даже не понимает, что его конечности непроизвольно подёргиваются.
Нередко больного беспокоит рвотный рефлекс. Чтобы предотвратить его, не нужно употреблять пищу или воду после операции. Многих пациентов мучает жажда, это может быть связанно с повреждением глотки дыхательной трубкой. В таком случае стоит ограничиться несколькими мелкими глотками воды или смочить губы больного. В число последствий входит головокружение и головные боли, постепенно начинают проявляться болевые ощущения по всему телу и в частности в зоне оперативного вмешательства. Не стоит терпеть эти боли, необходимо попросить у медицинского персонала подходящее обезболивающее.
В число последствий входит головокружение и головные боли, постепенно начинают проявляться болевые ощущения по всему телу и в частности в зоне оперативного вмешательства. Не стоит терпеть эти боли, необходимо попросить у медицинского персонала подходящее обезболивающее.
Нередко наблюдается спутанность сознания. Это более характерно для пожилых пациентов. Возможна кратковременная частичная потеря памяти и поведенческие изменения. Эти отклонения пройдут в течение трёх дней. Если в этот срок состояние больного не улучшиться, необходимо обратиться к врачу.
Боли в мышцах и в спине считаются нормальным явлением, вызванным в результате длительного лежания на жёстком операционном столе. Кроме этого возможно появление анемии, частичной потери чувствительности, вялости или паралича отдельной конечности либо ее части. Это вызвано тем, что в процессе операции хирургу пришлось вступать в контакт с нервами, ответственными за работу этой части тела. Это последствие также начнет проходить спустя три дня. Полное восстановление может потребовать несколько месяцев, поэтому стоит находиться под медицинским контролем. Второй причиной дисфункций отдельных частей тела может быть опухоль. Функции будут восстановлены, как только пройдет опухоль.
Полное восстановление может потребовать несколько месяцев, поэтому стоит находиться под медицинским контролем. Второй причиной дисфункций отдельных частей тела может быть опухоль. Функции будут восстановлены, как только пройдет опухоль.
После операции возможно ощущение озноба. Это — реакция нервной системы, которую можно облегчить теплой одеждой и одеялом. Перед операцией также не рекомендуется мерзнуть или перегреваться.
Повышенная температура тела может быть вызвана внутренним воспалением, поэтому к такому последствию нужно отнестись с особым вниманием.
В период послеоперационного возобновления, необходимо соблюдать специальную диету, которая исключает тяжёлую пищу.
Впрочем, чтобы любая медицинская процедура прошла успешно и не влекла негативные последствия, нужно быть позитивно настроенным. Быть позитивным означает быть здоровым!
Используя обезболивающие при хирургических вмешательствах, невозможно предугадать, какими будут последствия общего наркоза для организма.
Что такое общая анестезия
Общий наркоз – разновидность обезболивания, искусственное введение человека в бессознательное состояние с возможностью возврата сознания . Применяется с целью блокировки болезненных синдромов при оперативных вмешательствах и различных медицинских процедурах. Добиться потери болевых ощущений можно с помощью специальных медикаментов, подобранных в определенной дозировке.
Препараты способны погружать корковые центры мозга в наркотический сон различной глубины. Проникать в организм медикаменты могут различными способами: ингаляционным путем – с помощью вдыхания различных веществ, а также неингаляционным – в виде парентерального введения.
Воздействие анестетиков на организм человека проходит несколько этапов:
- Аналгезия – постепенная утрата сознания, сопровождающаяся отсутствием чувствительности.
- Стадия возбуждения, которую вызывают некоторые средства. Этап характеризуется кратковременной возбудимостью мозговых центров.
- Хирургический этап – полная потеря возбудимости и всех видов чувствительности.
- Пробуждение. Возвращение болезненных синдромов, сознания, двигательных способностей.
Степень интенсивности каждой стадии имеет связь с видом конкретного препарата, используемого для обезболивания .
Вреден или нет наркоз для организма? Все виды анестезии, как общий, так и местный наркоз, могут спровоцировать некоторые изменения в состоянии.
Разновидности наркоза
Вред наркоза зависит от его разновидности. Чаще всего разовое применение обезболивающих средств не представляет особой угрозы для человека.
Ввести больного в состояние сна могут различные препараты, включающие в себя наркотические и ненаркотические анальгетики, анестезирующие лекарства, нейролептики
. Существует несколько видов общего наркоза. В зависимости от способа проникновения в тело человека выделяют:
Существует несколько видов общего наркоза. В зависимости от способа проникновения в тело человека выделяют:
- Ингаляционный вид – поступление медикаментозных веществ в кровеносную систему через легкие путем вдыхания газообразных средств. Используется в стоматологии.
- Неингаляционный метод. Введение лекарств внутримышечно или внутривенно, применяется реже, чем первый метод. Данный способ обезболивания можно разделить:
- классическое введение средств – рекофола, тиопетала, кетамина, – в венозную кровь, приводящее к глубокому сну с сохранением дыхательной способности и небольшим расслаблением мышц;
- нейролептаналгезия осуществляется с помощью дроперидола, фентанила. Поверхностный способ обезболивания, вызывающий сонливость и заторможенность;
- атаралгезия. Потеря болезненности с помощью транквилизаторов диазепама и фентанила;
- комбинированная анестезия. Представляет собой постепенное поступление лекарств из различных фармакологических групп: анестетиков, наркотических анальгетиков, нейролептиков, средств для ингаляций совместно с релаксантами дитилин, ардуан.
 При применении данные вещества блокируют нервно-мышечные импульсы, что приводит к полной утрате дыхательной способности
. Такое состояние представляет опасность для детей и взрослых.
При применении данные вещества блокируют нервно-мышечные импульсы, что приводит к полной утрате дыхательной способности
. Такое состояние представляет опасность для детей и взрослых.
Подобное обезболивание проводят с интубированием трахеи и аппаратной ИВЛ.
Опасность общей анестезии
Риск не проснуться во время операции существует. Обезболивание работает в 99% случаев, однако в 1% может случиться непредвиденное. Во время проведения хирургического вмешательства самочувствие больного контролируют анестезиологи , которые, заподозрив неладное, предпринимают меры первой помощи.
Еще один актуальный вопрос, который задают многие пациенты: можно ли умереть от действия анестезирующих препаратов? Реакция на наркоз может стать смертельной, однако с развитием современных технологий вероятность летального исхода понизилась в несколько раз.
В настоящее время медицинские учреждения используют различные методики, ориентированные на сохранение жизни больных, однако не исключены опасные последствия наркоза, при которых возможно значительное ухудшение самочувствия.
Чаще всего возникают следующие осложнения после перенесенной операции:
- тошнота;
- болезненные ощущения в горле;
- легкие судорожные синдромы;
- дезориентация в пространстве;
- головная боль;
- ощущение зуда;
- боли в районе спины и поясницы;
- мышечная ломота;
- небольшое помутнение сознания.
Наиболее часто такие проявления возникают непродолжительное время и исчезают в течение первых 24 часов после хирургических манипуляций .
При обезболивании у больных могут возникать некоторые состояния, продолжающиеся длительное время:
- панические атаки, способные нарушать привычный ритм жизни в виде ежедневных неконтролируемых приступов страха;
- нарушение памяти. Установлено несколько случаев потери памяти у детей, которые не могли вспомнить элементарный школьный материал;
- расстройство сердечной системы, учащение пульса, тахикардия;
- увеличение давления;
- сбой функции печени и почек вследствие воздействия медикаментов, применяемых при операции.

Расстройство функционирования печени и почек встречается реже, чем остальные последствия.
Около 50 лет назад негативное воздействие анестезии наблюдалось в 70% случаев. В настоящее время всего в 1-2% зафиксированы случаи летального исхода, что составляет 1 случай на 3-4 тысячи операций.
Влияние на организм
Перед осуществлением хирургических вмешательств специалист определяет способ анестезии, в зависимости от особенностей конкретного человека . У взрослых могут наблюдаться следующие состояния:
- ухудшение сна;
- нарушение слуха и речи;
- болевые синдромы в голове;
- нарушение запоминания элементарных вещей;
- галлюцинации.
Данные проявления могут исчезать в течение 3-5 часов после применения анестетиков .
Негативные последствия после наркоза могут возникать в виде:
- удушья;
- отечности дыхательных путей;
- рвоты, при которой рвотные массы могут проникнуть в дыхательную систему;
- воспалительных процессов;
- отека головного мозга;
- почечной недостаточности;
- нарушения мозгового кровообращения;
- астении.

Как влияет наркоз на организм человека, нельзя сказать однозначно: все зависит от вида обезболивания, длительности применения, способа использования, а также индивидуальной чувствительности к веществам.
Воздействие на мозг
Обезболивание во время оперативных вмешательств влияет на мозг: ряд больных отмечают ухудшение памяти, снижение концентрации внимания, расстройство умственных способностей . Подобные осложнения проявляются постепенно, носят временный характер и продолжаются примерно год.
Одним из самых опасных последствий является астенический синдром, сопровождающийся изменениями в работе ЦНС.
К первичным симптомам относятся:
- нарушение сна, возникающее в виде бессонницы или, напротив, беспробудного сна;
- депрессивные состояния, колебания настроения;
- снижение работоспособности, частая усталость.
К вторичным, слабовыраженным признакам, относятся:
- чувство рассеянности;
- ухудшение сосредоточения;
- трудности с запоминанием;
- снижение способности к обучению.

Чаще всего такие проявления возникают в первые 3 месяца со дня операции.
Существуют предположения, из-за чего возникают данные симптомы:
- способность препаратов снижать артериальное давление. Лекарства для анестезии вызывают микроинсульт, который чаще всего протекает незаметно для человека;
- дисбаланс, спровоцированный лекарствами, провоцируют отмирание нервных клеток ;
- взаимодействие иммунной системы и воспалительного процесса. Данное состояние появляется после операции при отказе больного от спазмолитических средств.
Вероятность астенического синдрома увеличивается при следующих факторах:
- детский или пожилой возраст;
- увеличенная доза анестетика;
- наличие некоторых хронических заболеваний;
- пониженные интеллектуальные способности пациента;
- продолжительное применение обезболивающих;
- тяжелая послеоперационная травма.
Положительно настроенные пациенты легче переносят утрату сознания, поэтому врачам следует морально поддерживать пациентов, не допуская появления панических состояний.
Влияние на сердце
В большинстве случаев отрицательное влияние наркоза на организм человека отмечается у людей, имеющих сердечные заболевания.
Перед использованием общего обезболивания людям, страдающим сердечными заболеваниями, необходимо пройти полную диагностику , по результатам которой специалист оценит общее состояние здоровья и определит вид анестетика.
Средства и способы их введения по-разному могут повлиять на сердце: многие сердечники легко переносят анестезию, другие – испытывают значительные неприятные симптомы, такие как:
- сжимание грудной клетки;
- учащенный пульс;
- болезненность и колющие ощущения в сердце ;
- чувство жара;
- замедленное сердцебиение.
Анестетики воздействуют на проводящую систему сердца, вызывая аритмию. К счастью, такие явления кратковременные, и через некоторое время способны регрессировать. Однако в некоторых случаях патология может остаться надолго или даже навсегда.
Влияние на организм женщины
Применять анестезию во время беременности врачи не рекомендуют: обезболивающие вещества очень токсичны, и могут отрицательно отразиться на состоянии будущего ребенка .
Запрещено использование анестетиков в 1 и 2 триместрах вынашивания ребенка: на этих этапах закладываются внутренние органы плода.
Препараты способны затормозить развитие внутренних органов, ухудшить питание, что может спровоцировать различные внешние и внутренние дефекты ребенка. Также не применяют наркоз в середине 3 триместра: это может привести к выкидышу, преждевременным родам, маточным кровотечениям, а также общему отравлению беременной женщины.
Общее обезболивание во время кесарева сечения приводит к появлению:
- тошноты;
- болевых симптомов в голове;
- головокружения;
- спазмов мышц;
- ухудшения концентрации внимания;
- мутности сознания;
- судорожных синдромов.
Отрицательные последствия наркоза на организм женщины возникают под влиянием следующих факторов:
- Перенапряжение.
 Любой анестетик приводит к увеличению нагрузки на организм, замедляет работу всех органов.
Любой анестетик приводит к увеличению нагрузки на организм, замедляет работу всех органов. - Изменение привычной диеты. Некоторые виды хирургических операций требуют соблюдения лечебного рациона, влияющего на периодичность менструации и обилие выделений во время месячных.
- Вмешательство в работу органов малого таза нередко приводит к их сбою . При этом женщине необходимо время для восстановления их функционирования.
- Во время и после хирургических вмешательств ослабленный организм подвергается повышенному риску заражения инфекцией.
Воздействие на детский организм
Чаще всего дети легче переносят анестезию и быстро забывают негативные последствия, сопровождающие операцию, что является особенностью их психологии
. Реакция детского организма на введение обезболивающих также индивидуальна, как и у взрослых. Любое вмешательство может отразиться на росте и развитии ребенка. Из отрицательных последствий можно отметить появление аллергических реакций на медикаменты, нарушение работы сердца.
Кроме того, анестезия воздействует на скорость развития детей и ухудшает работу ЦНС, поэтому перед проведением обезболивания специалист сопоставляет необходимость его осуществления с риском осложнений.
Чем опасен наркоз при операции в детском возрасте? Частыми последствиями являются:
- анафилаксия;
- отек Квинке;
- сердечные нарушения;
- кома.
Подобные симптомы наблюдаются в редких случаях. Из поздних последствий можно отметить когнитивные расстройства в виде:
- гиперактивности;
- хронических головных болей, приступов мигрени, которые не способны устранить анальгетики;
- медленно прогрессирующих расстройств функционирования печени и почек;
- склонности к головокружениям;
- судорожных сокращений мышц голеней.
Из когнитивных нарушений можно отметить ухудшение памяти, логического мышления, трудности с концентрацией внимания, импульсивное поведение. У детей раннего возраста, до 3 лет, наблюдается отставание психического развития, сложности с обучением, эпилептический синдром
.
Чтобы избежать негативных последствий общей анестезии, необходимо перед операцией полностью обследовать организм, а после оперативного вмешательства применять лекарства, улучшающие мозговое кровообращение, а также витаминные комплексы.
Многих интересует, сколько наркозов может перенести человек? Врачи утверждают, что общую анестезию следует проводить столько раз, сколько потребуется. Если возникает вопрос о жизни и смерти, медики принимают решение о применении обезболивания, несмотря на возможные негативные последствия в будущем.
Многие задаются вопросом, чем вреден наркоз для человека и какие последствия будут после применения. Медики считают, что анестезия вредна для организма. Однако представить операцию без обезболивающего средства просто невозможно. Так, чем опасен наркоз?
Наркоз — искусственно вызванное обратимое состояние торможения центральной нервной системы
Немного из истории
Первый метод обезболивания применял еще Авиценна, он охлаждал конечности до потери ими чувствительности. Амруаз Паре сдавливал сосуды и нервы. В Древнем Египте применяли сонные трубки, которые пропитывали наркотическими травами.
Амруаз Паре сдавливал сосуды и нервы. В Древнем Египте применяли сонные трубки, которые пропитывали наркотическими травами.
Настоящий анестетик стали применять в конце девятнадцатого века, это был кокаин гидрохлорид. Но препарат был очень токсичный и приводил к большой смертности, от его применения отказались.
Доводили до обморочного состояния путем пускания крови. Такой метод был жестоким и не получил развития. В период военных действий использовали даже алкоголь до введения в сильное состояние опьянения.
Анестезия и её действие
Анестезия — это состояние искусственной потери памяти, которое имеет обратимость. Она блокирует чувство боли во время проведения хирургических операций. Используют специальные анестетики, которые подбирает врач анестезиолог. Он рассчитывает оптимальную норму лекарства и комбинирует с другими препаратами. При этом учитываются индивидуальные показатели пациента.
При общем наркозе пациент не может руководить телом
Имеется два вида анестезии: общая и местная. Общий наркоз используется для блокировки боли. Такая анестезия приводит к неподвижности, и пациент не может руководить телом. Применяется два метода введение препарата через вену и подача газообразного анестетика через маску.
Общий наркоз используется для блокировки боли. Такая анестезия приводит к неподвижности, и пациент не может руководить телом. Применяется два метода введение препарата через вену и подача газообразного анестетика через маску.
Местная анестезия заключается в том, что обезболивающее средство вводится туда, где будет проводиться хирургическое вмешательство. Например, для удаления зуба укол делают в ротовой полости в десну. Это место начинает неметь и не чувствовать прикосновений. Опасен ли местный обезболиватель? Пациент находится в полном сознании, боль блокируется локально. Особые опасения такие манипуляции не вызывают.
Влияние общего наркотика исследуется давно. Но известно, что анестетик действует на подкорковое образование мозга, которое снабжается энергией. Общий наркотик затормаживает эту функцию, она постепенно угасает, головной мозг перестает быть активным и засыпает.
Можно сказать, что пациент находится в искусственном сне. При анестезии могут сохраняться рефлекторные функции на раздражители уколы или прикосновения. Медики считают это нормальным.
Медики считают это нормальным.
Почему люди опасаются общей анестезии
Людям страшна не сама хирургическая операция, а воздействие анестезии, потому что каждый человек индивидуально реагирует на анестетик.
История располагает многими фактами, когда организм не поддавался влиянию наркотиков, а дополнительная доза приводила к летальному исходу.
Знаменитый русский полководец красной армии М.В. Фрунзе умер под воздействием анестетика. Но это лишь одна из версий. К легендарной личности применили общий наркоз при операции с помощью эфира, он долго не мог уснуть. Тогда анестезиолог добавил дозу хлороформа. После этого произошла остановка сердца.
Вторая причина страха перед подобными препаратами это невосприимчивость организма. Человек может получить анестетик, но не впасть в искусственный сон. Так он может быть обездвижен, но чувствовать физическую боль. Это может привести к смерти от болевого синдрома или будет ощущение ужасной боли. Такие случаи крайне редки и на 1000 человек такими больными могут оказаться двое.
Такие случаи крайне редки и на 1000 человек такими больными могут оказаться двое.
Влияние анестетиков на организм
Вопрос, вреден ли общий наркоз для человека не будет оспаривать ни один медик. Так чем опасен общий наркоз?
Влияние наркоза на организм человека, прежде всего, отражается на деятельности головного мозга. Самое опасное последствие когнитивная дисфункция, ведущая к нарушениям ЦНС. Наркоз для организма имеет следующие последствия:
Одним из последствий действия наркоза является бессонница
- потеря сна или частые пробуждения по ночам;
- снижение трудоспособности и быстрое утомление;
- рассеянность и неспособность сосредоточиться;
- ухудшение памяти и способности к запоминанию;
- дезориентация в пространстве;
- болевые ощущения в мышцах и горле;
- лёгкое помутнение сознания;
- зуд или раздражение кожного покрова.
Причинами возникновения таких симптомов служит:
- Кратковременная потеря сознания провоцирует микро инсульт из-за снижения кровяного давления.

- Отмирание нейронов головного мозга.
Риски развития астенического синдрома повышают такие факторы:
- хронические болезни;
- возрастная категория;
- большая норма наркоза;
- низкое интеллектуальное развитие.
Последствия анестезии могут проявляться продолжительное время в виде:
- паники страха;
- локальной утраты памяти;
- изменения сердечного ритма, росте артериального давления;
- изменений функций печёночной железы и почек, анестетик сильный токсин и оказывает отрицательное действие на организм.
Чем опасен общий наркоз для сердечной и сосудистой системы.
Показатели сердца играют большую роль при использовании анестезии.
Если пациент страдает ишемией, тахикардией, аритмией, то его отправляют на диагностику. Только затем определяется, возможно, ли хирургическое вмешательство с анестетиками.
Последствия общей анестезии
Действие общего наркоза влияет на деятельность всех органов и характеризуется признаками:
Общий наркоз влияет на деятельность всех органов
- удушье, отёчность и болезни дыхательных органов;
- аритмия;
- отёк мозга и ухудшение кровяного снабжения;
- рвота;
- почечная недостаточность;
- астеничный синдром.

Влияние анестетика на женщин
Организм женщин особенный, он проходит несколько этапов развития. Действие наркоза на организм женщины зависит от периодов жизни: половое формирование, беременность, период климакса и менструации.
Беременным женщинам вреден общий наркоз, так как будет иметь негативные последствия на здоровье будущего ребёнка.
Искусственные роды или кесарево сечение с применением анестетиков имеет для женщины следующие последствия:
- головная боль;
- отвращение;
- рвота;
- нарушение концентрации;
- спазмы мышц спины.
Действие анестезии на детей
Вреден ли наркоз для детей. Влияние анестезии на организм ребенка отражается на деятельности головного мозга. Медики считают, что наркоз для ребёнка до двухлетнего возраста влияет на его развитии. В таком раннем возрасте детский мозг находится в стадии формирования и имеет наибольшую вероятность такого последствия как разрушения нейронов. В результате дети испытывают трудности: ухудшается память, им трудно сосредоточиться, снижается активность, уменьшается способность к запоминанию.
В результате дети испытывают трудности: ухудшается память, им трудно сосредоточиться, снижается активность, уменьшается способность к запоминанию.
Однозначно анестетики негативно отражается на организме. Но если задуматься, сколько человеческих жизней было спасено анестезией, то риск вполне оправдан. Наркотическое состояние даёт возможность проводить сложные операции, которые длятся по несколько часов. Наука не стоит на месте, и анестетики совершенствуются. Опасность умереть от наркотика существует, но она значительно ниже, чем оказаться в автокатастрофе.
Видео
Правда и мифы о наркозе.
Как влияет наркоз на организм? Подобным вопросом задаются люди, которым предстоит хирургическое вмешательство. Последствия общей анестезии для организма разные, переносимость обезболивания зависит от многих факторов. Осложнения способны развиться спустя некоторое время, что представляет опасность для человека. Как общий наркоз влияет на пациента?
Что такое общий наркоз
Общим наркозом называют способ обезболивания организма, при котором сознание отсутствует, но присутствует возможность его возврата. Используется при хирургических вмешательствах для устранения болезненных синдромов. Для этого подбирают специальные медикаменты, соединяют их в необходимой пропорции.
Используется при хирургических вмешательствах для устранения болезненных синдромов. Для этого подбирают специальные медикаменты, соединяют их в необходимой пропорции.
Медикаменты воздействуют на различные центры в мозгу, вызывая крепкий наркотический сон. Вводится общий наркоз разными способами – через дыхательную систему либо с помощью введения в вену специальным шприцем.
Действие наркоза на организм разделяется на четыре этапа.
Этапы:
- Для первой стадии характерно постепенное исчезновение сознания и чувствительности,
- На второй стадии в организме диагностируется стадия возбуждения, которая нередко возникает при использовании некоторых медикаментов,
- Для третьей стадии характерна полная потеря чувствительности и возбудимости,
- Четвертый этап считается стадией пробуждения, к человеку возвращаются все ощущения.
В зависимости от применяемого лекарства эффект от этого бывает разнообразным.
Выделяют несколько видов общего наркоза. Последствия и возможное отравление зависят от вида медикамента либо состава лекарственной смеси, используемых для обезболивания организма.
Последствия и возможное отравление зависят от вида медикамента либо состава лекарственной смеси, используемых для обезболивания организма.
Разновидность:
- Ингаляция. Лекарственное средство вводится при помощи специальной маски в газообразном виде. Применяется в стоматологии.
- Введение препаратов через вены либо мышечную ткань. Подобные способы применяются нечасто.
Второй способ введения наркоза условно разделяют на несколько типов.
Типы:
- Введенные в кровь лекарства слегка расслабляют мышечные волокна, дыхательная способность сохраняется в полной мере.
- Использование средств для поверхностного обезболивания. Средства приводят к появлению сонливости и заторможенного состояния.
- Для потери ощущения боли используют Феназепам и Диазепам. Считается, что использование сильных обезболивающих и седативных средств помогает достичь необходимого эффекта.
- Комбинация разных методов. Использование подобной методики представляет опасность из-за полного отсутствия дыхания у человека.
 Совместно применяются искусственная вентиляция легких и интубация трахеи.
Совместно применяются искусственная вентиляция легких и интубация трахеи.
Выбор методики лечения обсуждается с анестезиологом вместе с пациентом для выявления возможных аллергических реакций и негативных последствий.
Опасность общей анестезии
Почему общий наркоз представляет опасность для организма человека? В большинстве случаев проблем не возникает, однако исключать вероятность невыхода из анестезии нельзя. В период проведения операции состояние пациента постоянно контролируется медицинским персоналом.
При необходимости сразу же проводятся действия, приводящие в норму все показатели жизнедеятельности человеческого организма, оказывают первую медицинскую помощь.
Риск летального исхода при отравлении повышается при неправильном подборе анестезирующих веществ. Однако в настоящее время используются современные технологии и препараты, снижающие риск неблагоприятных последствий в несколько раз.
У человека после перенесенного обезболивания возможно появление некоторых неприятных явлений. Проходят они быстро.
Проходят они быстро.
Явления:
- Тошнота, рвотные позывы,
- Небольшие судороги,
- Нарушение координации, проблемы с ориентацией в пространстве,
- Зуд кожных покровов,
- Неприятные ощущения в мышцах,
- Боли в спине,
- Плохое самочувствие.
Подобные явления проходят быстро, но не исключено развитие более длительных отклонений.
Что возможно:
- Чувство страха, панические атаки,
- Проблемы с памятью, невозможность вспомнить элементарные вещи,
- Увеличенные показатели давления,
- Сбои функциональности сердечной мышцы, изменение пульса и ритма,
- В редких случаях проблемы в работе почек и печени.
Вероятность летального исхода при анестезии существенно снизилась при использовании современных технологий.
Наркоз оказывает влияние на весь организм. Однако однозначного ответа о действии анестезии нет. Для каждого человека последствия индивидуальны и зависят от многих факторов. Нередко последствия выражаются в ухудшении состояния организма, нарушении кровообращения мозга, развитии воспалительных процессов в организме. В тяжелых случаях не исключено развитие отека мозга, недостаточности почек. ()
Нередко последствия выражаются в ухудшении состояния организма, нарушении кровообращения мозга, развитии воспалительных процессов в организме. В тяжелых случаях не исключено развитие отека мозга, недостаточности почек. ()
Большую роль играет чувствительность организма к обезболивающим веществам. На что влияет наркоз?
Влияние наркоза на деятельность мозга разнообразно. Пострадавшие спустя период времени отмечают проблемы с памятью, вниманием. У некоторых происходит расстройство интеллектуальных способностей. Последствия проходят со временем, сохраняются на протяжении года после применения общего наркоза.
Опасным считается изменение работы нервной системы, сопровождающееся неприятными симптомами.
Признаки:
- Проблемы со сном, бессонница,
- Постоянное депрессивное состояние, резкая смена настроения,
- Постоянная усталость, нарушение работоспособности,
- Плохое самочувствие,
- Нарушение умственных способностей, проблемы с памятью.

Выделяют несколько причин, провоцирующих подобное состояние.
Причины:
- Резкое снижение давления, риск возникновения микроинсульта,
- Лекарственные препараты способны спровоцировать некроз клеток мозга,
- Прекращение приема спазмолитиков приводит к определенному взаимодействию воспаления и иммунитета.
Появлению негативных последствий подвержены дети, люди в возрасте, пациенты со сниженным интеллектом, хроническими болезнями, при длительном употреблении обезболивающих препаратов.
Как влияет наркоз на сердце
Как наркоз влияет на сердце? Использование общего наркоза требует внимательного отношения к людям, имеющим патологии в работе сердечной системы. У некоторых пациентов наркоз не вызывает негативных последствий, другие переносят его тяжело.
Последствия:
- Учащение либо замедление биения пульса,
- Усиленное отделение пота, постоянный жар,
- Болевые ощущения в сердце,
- Неприятные чувства в грудной клетке,
- Нарушение сердечного ритма.

Патологические процессы в организме длятся недолго, проходят в течение полугода. В редких случаях последствия сохраняются длительное время.
Как влияет наркоз на память
Влияет ли наркоз на память? Интеллектуальные способности и память также нередко страдают при общем наркозе. Нарушение кровообращения в мозге неблагоприятно сказывается на всех функциях организма.
У пациента могут наблюдаться провалы в памяти. Как правило, они кратковременные и проходят быстро. Умственные способности восстанавливаются спустя некоторое время, в редких случаях негативные симптомы сохраняются в течение года.
Раздражение, ощущение песка в глазах, краснота — лишь небольшие неудобства при нарушенном зрении. Ученые доказали: снижение зрения в 92% случаев заканчивается слепотой.
Crystal Eyes — лучшее средство для восстановления зрения в любом возрасте.
Использование общего наркоза у женщин при проведении кесарева сечения также способно привести к появлению неприятных признаков в организме. Анестезия не благоприятно влияет на организм женщины, приводит к нарушению работы органов малого таза. При правильном применении последствий возможно избежать. Влияет ли наркоз на месячные? Возможно изменение цикла и характера выделений, однако постепенно все приходит в норму.
Анестезия не благоприятно влияет на организм женщины, приводит к нарушению работы органов малого таза. При правильном применении последствий возможно избежать. Влияет ли наркоз на месячные? Возможно изменение цикла и характера выделений, однако постепенно все приходит в норму.
Влияние на организм ребенка
Как влияет наркоз на организм ребенка? Что происходит у детей после применения общей анестезии?
Детский организм воспринимает наркоз легче, чем это происходит у взрослых людей. Реакция на препараты индивидуальны, зависит от разных показателей.
У деток возможно нарушение работы нервной системы, аллергические реакции, сбои в работе сердечной системы. В тяжелых случаях возможно появление отека Квинке, анафилактический шок, коматозное состояние.
Спустя некоторый срок не исключено появление судорожных проявлений, нарушение функциональности почек и печени, постоянные головные боли.
У детей младше трех лет возможно отставание в развитии, проблемы в обучении, развитие эпилептических синдромов. Перед применением наркоза у детей требуется провести тщательную диагностику организма, учитывать противопоказания.
Перед применением наркоза у детей требуется провести тщательную диагностику организма, учитывать противопоказания.
Видео: анестезия для ребенка
Последствия
После выхода из наркоза не исключено развитие у пациента негативных осложнений. Возможно нарушение работы нервной системы, сердца, органов слуха и зрения. При появлении неприятных симптомов в организме требуется обратиться к врачу, предпринять действия для восстановления нормальной жизни.
Влияние наркоза на организм различается в зависимости от здоровья человека, используемых лекарственных средств, степени восприятия анестезии. Не исключено развитие негативных последствий, однако они быстро проходят и не нарушают нормальный образ жизни.
Видео: чем опасен наркоз на организм человека
Самый важный вопрос у любого пациента перед операцией — как наркоз влияет на мозг человека. Ведь общее обезболивание отключает сознание, но порой без него не обойтись.
Что происходит с мозгом во время наркоза: последствия
Анестезиолог индивидуально подбирает препараты для обезболивания. Их действие направлено на введение пациента в режим глубокого сна, когда абсолютно не чувствуется боль, при этом происходит расслабление мышц, что дает возможность проводить оперативные вмешательства.
Их действие направлено на введение пациента в режим глубокого сна, когда абсолютно не чувствуется боль, при этом происходит расслабление мышц, что дает возможность проводить оперативные вмешательства.
Пагубное влияние общего наркоза на деятельность головного мозга не сможет отрицать ни один анестезиолог. Более чем у 82% пациентов наблюдается послеоперативная когнитивная дисфункция. Обезболивание влияет на сосуды головного мозга, что порой приводит к таким последствиям:
- Потеря концентрации.
- Провалы в памяти.
- Трудности в обучении.
- Бессвязная речь.
- Расплывчатое зрение.
Все это – когнитивная дисфункция после оперативного вмешательства. Такое состояние может продлиться до полугода. Особенно анестезия опасна для стариков и маленьких детей. У пожилых людей уже рушатся нейронные связи сами по себе, а удар тяжелыми препаратами может привести к тяжелейшим последствия, даже к слабоумию. У детей же только формируется нервная система, поэтому обезболивание может затормозить развитие ребенка на неопределенный срок. В большинстве случаев дети потом нагоняют, но такое осложнение может длиться несколько лет.
В большинстве случаев дети потом нагоняют, но такое осложнение может длиться несколько лет.
Как восстановить мозг после наркоза?
Одинаковой тактики в подобной ситуации нет. Если самочувствие не налаживается само по себе за полгода, то стоит обратиться к невропатологу. Он сможет точно определить, что в организме идет не так, и назначит целенаправленное лечение. После которого улучшится память и концентрация.
Я создал этот проект, чтобы простым языком рассказать Вам о наркозе и анестезии. Если Вы получили ответ на вопрос и сайт был полезен Вам, я буду рад поддержке, она поможет дальше развивать проект и компенсировать затраты на его обслуживание.
Читайте также…
Седация — что важно знать
Медикаментозная седация — один из видов общего наркоза. Седация применяется при краткосрочных операциях или диагностических манипуляциях и, в отличие от общего наркоза, не требует введения большой дозы сильных анестетиков. Во время применения наркоза врач-анестезиолог постепенно погружает человека в глубокий сон, при котором пациент находится в бессознательном состоянии.
Во время применения наркоза врач-анестезиолог постепенно погружает человека в глубокий сон, при котором пациент находится в бессознательном состоянии.При погружении в наркоз пациент проходит через три стадии:
- Аналгезия. На этом этапе снижается чувствительность, наблюдается нарушение дикции. Специалист может проводить только простые, не провоцирующие острую боль, операции.
- Возбуждение нервной системы. Этап, на котором учащается пульс, заметно ускоряется сердцебиение, появляется легкая дыхательная аритмия, тонус в мышцах повышается, наблюдается расширение зрачков.
- Хирургическая стадия. На этом этапе человек пребывает в состоянии глубокого сна, отсутствует восприимчивость к боли любого уровня интенсивности.
Подготовка к процедуре общего наркоза
Наша задача – обеспечить вам безопасность и комфорт при проведении операции, исследования или лечения.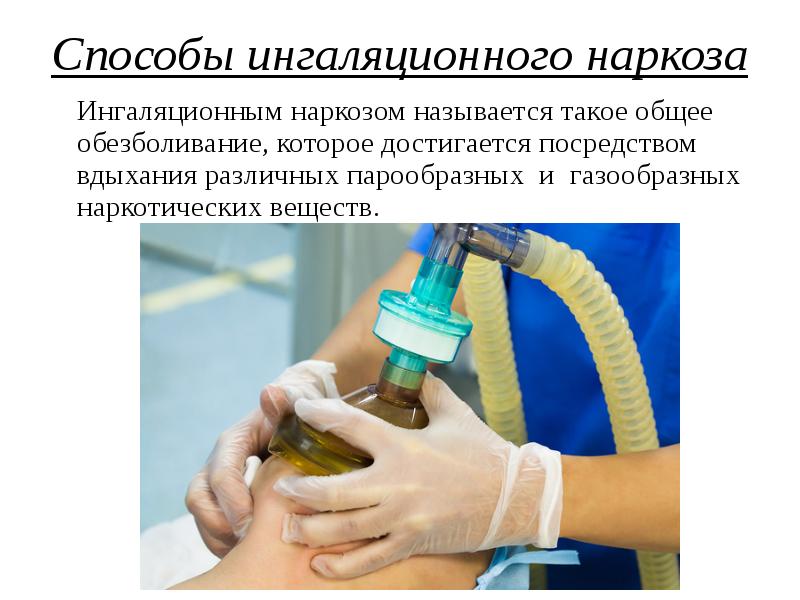 Перед процедурой следует проконсультироваться со специалистом-анестезиологом.
Перед процедурой следует проконсультироваться со специалистом-анестезиологом.Наши врачи внимательно изучат вашу ситуацию: наличие хронических и инфекционных заболеваний, аллергий, последние вакцинации и наличие беременности, а при необходимости направят на дополнительные обследования, которые можно пройти в каждой из наших поликлиник в Сергиевом Посаде, Хотьково, Пушкино и Королёве. Если к применению общей анестезии противопоказаний не обнаружится, доктор расскажет об особенностях подготовки к процедуре.
За 6 часов до применения общего наркоза принятие пищи и жидкости рекомендуется ограничить.
Соблюдение рекомендаций врача позволит специалистам провести процедуру анестезии и операцию наиболее комфортно для вас. После лечения вы будете находиться под контролем наших высококвалифицированных специалистов в течение двух часов.
Седация – это вредно?
В медицинском сообществе считается, что применение современных анестетиков (а именно они используются в Сети Семейных Поликлиник) – один из самых безопасных видов анестезии (в сравнении, например, с спинальной или эпидуральной анестезией). В некоторых случаях, по показаниям, врачи могут использовать сочетанную анестезию. К такой анестезии относится, например закись азота и пропофола.
В некоторых случаях, по показаниям, врачи могут использовать сочетанную анестезию. К такой анестезии относится, например закись азота и пропофола.Сны во время наркоза
Если вы пациент, готовящийся к анестезии, наверняка вас волнует вопрос о том, что с вами будет происходить во время наркоза. Будете Вы видеть галлюцинации, кошмары или свет в конце тоннеля?Смеем вас разубедить. Врачи-анестезиологи Сети Семейных Поликлиник, имеющие опыт работы более 29 лет, утверждают, что при использовании общего наркоза с применением современных анестетиков, пациенты, как правило, видят приятные сны, а процесс пробуждения от наркоза не вызывает головных болей и других побочных явлений. Главное – прийти к врачу в спокойствии и без лишних страхов, а остальное сделает за вас врач.
Наркоз — все статьи и новости
Наркоз (от др.-греч. νάρκωσις — «онемение», «оцепенение») — искусственно вызванное состояние, характеризующееся торможением центральной нервной системы (часто с погружением в сон) и расслаблением скелетных мышц, что ведет к снижению болевого порога. Данное состояние возникает после введения общих анестетиков в организм. Цель наркоза — замедлить реакцию организма на хирургическое вмешательство, которое вызывает болевые ощущения.
Данное состояние возникает после введения общих анестетиков в организм. Цель наркоза — замедлить реакцию организма на хирургическое вмешательство, которое вызывает болевые ощущения.
Существует несколько способов общего обезболивания организма: фармакодинамический наркоз (с применением специальных препаратов) и электронаркоз (под действием электрических полей). Наркоз также классифицируется по количеству используемых препаратов: мононаркоз, смешанный и комбинированный. Степень анестезии варьируется в зависимости от тяжести оперативного вмешательства: может быть сделан вводный наркоз, быстро действующий, кратковременный, поддерживающий (общая анестезия, которая длится на протяжении всей операции). Самый сильный эффект дает базис-наркоз: чтобы ограничить его действие, в организм необходимо ввести дополнительную дозу анестетика для снижения эффекта основного.
Процесс введения в состояние наркоза занимает четыре стадии. На первой стадии — анальгезии — постепенно снижается чувствительность. После введения в организм дозы обезболивающего наступает стадия возбуждения: кровяное давление повышается, зрачок расширяется. Операцию можно проводить на третьей стадии, когда наркоз полностью редуцирует болевые ощущения и чувствительность. После прекращения введения анестетиков наступает финальная стадия — пробуждение.
После введения в организм дозы обезболивающего наступает стадия возбуждения: кровяное давление повышается, зрачок расширяется. Операцию можно проводить на третьей стадии, когда наркоз полностью редуцирует болевые ощущения и чувствительность. После прекращения введения анестетиков наступает финальная стадия — пробуждение.
Первые обезболивающие средства начали появляться еще в древности, в виде настоев или отваров растений. Больные вдыхали пары, после чего погружались в сон. В XIII веке Раймунд Луллий открыл эфир, анестетические свойства которого были описаны лишь в 1540 году Парацельсом. В 1845 году Хорас Уэллс изобрел метод ингаляции «веселящего газа» (оксид азота), после применения которого снижалась болевая чувствительность. В России первую операцию под эфирным наркозом провели Фёдор Иноземцев и Николай Пирогов в феврале 1847 года.
Источник картинки: http://bit.ly/2deDC2Z
Влияние анестезии на развивающийся мозг: младенец и плод — Полный текст — Диагностика и терапия плода 2018, Vol.
 43, № 1
43, № 1Аннотация
Способность широко используемых анестетиков и седативных средств вызывать нейроапоптоз и другие нейродегенеративные изменения в развивающемся мозге млекопитающих стала очевидной в исследованиях на животных за последние 15 лет. Эта озабоченность привела к ряду ретроспективных исследований у младенцев и детей раннего возраста, и в некоторых из этих исследований наблюдалась связь между воздействием общей анестезии в младенчестве и последующими нейроповеденческими проблемами в детстве.Эта связь особенно очевидна при длительном или многократном воздействии. Из-за значительного роста фетальных вмешательств, требующих седации и анальгезии для плода, или из-за материнских анестезирующих эффектов, эта озабоченность по поводу нейротоксичности анестетиков актуальна для плода. Потенциальная нейротоксичность анестетиков является наиболее важной клинической и исследовательской проблемой в области детской анестезиологии. В этом обзоре сначала будет кратко изложен быстрый рост и развитие головного мозга у плода и новорожденного.Далее будут представлены модельные данные о нейротоксичности анестетиков у плода и новорожденного, а также обзор недавних клинических испытаний нейротоксичности анестетиков на людях. Наконец, будет рассмотрено обоснование изучения дексмедетомидина в качестве потенциального нейропротекторного агента при нейротоксичности анестетиков, а также дизайн двух клинических испытаний дексмедетомидина на людях.
В этом обзоре сначала будет кратко изложен быстрый рост и развитие головного мозга у плода и новорожденного.Далее будут представлены модельные данные о нейротоксичности анестетиков у плода и новорожденного, а также обзор недавних клинических испытаний нейротоксичности анестетиков на людях. Наконец, будет рассмотрено обоснование изучения дексмедетомидина в качестве потенциального нейропротекторного агента при нейротоксичности анестетиков, а также дизайн двух клинических испытаний дексмедетомидина на людях.
© 2017 S. Karger AG, Базель
Введение
Способность широко используемых анестетиков и седативных средств вызывать нейроапоптоз и другие нейродегенеративные изменения в развивающемся мозге млекопитающих стала очевидной в исследованиях на животных за последние 15 лет [1,2,3,4,5].Это беспокойство привело к ряду ретроспективных исследований у младенцев и детей раннего возраста, и в некоторых из этих исследований наблюдалась связь между воздействием общей анестезии в младенчестве и последующими нейроповеденческими проблемами в детстве [6,7]. Эта связь особенно очевидна при длительном или многократном воздействии. Из-за значительного роста фетальных вмешательств, требующих седации и анальгезии для плода, или из-за материнских анестезирующих эффектов, эта озабоченность по поводу нейротоксичности анестетиков актуальна для плода.Потенциальная нейротоксичность анестетиков является наиболее важной клинической и исследовательской проблемой в области детской анестезиологии [8,9,10,11,12]. В этом обзоре сначала будет кратко изложен быстрый рост и развитие головного мозга у плода и новорожденного. Далее будут представлены модельные данные о нейротоксичности анестетиков у плода и новорожденного, а также обзор недавних клинических испытаний нейротоксичности анестетиков на людях. Наконец, будет рассмотрено обоснование изучения дексмедетомидина в качестве потенциального нейропротекторного агента при нейротоксичности анестетиков, а также дизайн двух клинических испытаний дексмедетомидина на людях.
Эта связь особенно очевидна при длительном или многократном воздействии. Из-за значительного роста фетальных вмешательств, требующих седации и анальгезии для плода, или из-за материнских анестезирующих эффектов, эта озабоченность по поводу нейротоксичности анестетиков актуальна для плода.Потенциальная нейротоксичность анестетиков является наиболее важной клинической и исследовательской проблемой в области детской анестезиологии [8,9,10,11,12]. В этом обзоре сначала будет кратко изложен быстрый рост и развитие головного мозга у плода и новорожденного. Далее будут представлены модельные данные о нейротоксичности анестетиков у плода и новорожденного, а также обзор недавних клинических испытаний нейротоксичности анестетиков на людях. Наконец, будет рассмотрено обоснование изучения дексмедетомидина в качестве потенциального нейропротекторного агента при нейротоксичности анестетиков, а также дизайн двух клинических испытаний дексмедетомидина на людях.
Рост и развитие головного мозга у плода и новорожденного
Нейрогенез начинается в первые недели беременности после зачатия, а миграция нейронов происходит между 12 и 20 неделями беременности после развития в зародышевой матрице и субвентрикулярной зоне [13]. Корковые нейроны следуют за каркасом из глиальных клеток к месту назначения. После миграции нейроапоптоз, или запрограммированная гибель клеток, происходит с высокой частотой от 24 недель беременности до 4 недель после рождения.Другим важным процессом развития нервной системы является пролиферация нейронных синапсов, которая начинается примерно на 20-й неделе беременности и быстро продолжается, при этом количество синапсов достигает пика примерно в возрасте 1-2 лет, причем количество синапсов на 50% выше, чем у взрослых. Впоследствии некоторые синапсы подвергаются процессу обрезки, при котором происходит потеря синаптических связей. Четвертым основным процессом развития нервной системы является миелинизация, которая начинается к концу второго триместра и продолжается более медленными темпами в течение всего детства.Рисунок 1 представляет собой графическое изображение времени и относительной интенсивности каждого из этих процессов.
Корковые нейроны следуют за каркасом из глиальных клеток к месту назначения. После миграции нейроапоптоз, или запрограммированная гибель клеток, происходит с высокой частотой от 24 недель беременности до 4 недель после рождения.Другим важным процессом развития нервной системы является пролиферация нейронных синапсов, которая начинается примерно на 20-й неделе беременности и быстро продолжается, при этом количество синапсов достигает пика примерно в возрасте 1-2 лет, причем количество синапсов на 50% выше, чем у взрослых. Впоследствии некоторые синапсы подвергаются процессу обрезки, при котором происходит потеря синаптических связей. Четвертым основным процессом развития нервной системы является миелинизация, которая начинается к концу второго триместра и продолжается более медленными темпами в течение всего детства.Рисунок 1 представляет собой графическое изображение времени и относительной интенсивности каждого из этих процессов.
Рис. 1
Время и интенсивность ключевых процессов развития нервной системы в мозге человека. Воспроизведено с разрешения Тимофиевой и др. [13].
Воспроизведено с разрешения Тимофиевой и др. [13].
Значительные успехи в методах магнитно-резонансной томографии (МРТ) применительно к мозгу плода открыли окно в сложное, быстрое развитие отдельных путей волокон белого вещества с модификацией методов диффузионно-тензорной визуализации (DTI) [14].DTI описывает поведение и движение молекул воды в мозге с помощью магнитного поля МРТ. Сложная обработка пост-изображения может визуализировать отдельные тракты волокон, а затем компьютерная трактография волокон используется для очерчивания коннектома головного мозга плода. Коннектом — это мозговая сеть нейронных связей между областями мозга, и в недавних публикациях описывалось расположение мозговых связей, то, как эти связи развиваются, и эффективность этих связей. Изображения с цветовой кодировкой наглядно изображают огромное количество волоконных путей и огромную скорость, с которой они развиваются в мозгу человеческого плода (рис.2).
Рис. 2
Коннектом головного мозга плода. Магнитно-резонансная томография развития отдельных волокнистых трактов белого вещества, полученная с использованием диффузионно-тензорной визуализации, визуализированная на сроке от 10 до 42 недель беременности (wg). Обратите внимание на быструю пролиферацию волокнистых путей на всех сроках беременности. Ориентация волоконных трактов обозначена цветом: красный — левый/правый; синий — передний/задний; зеленый — дорсальная/вентральная ориентация. Воспроизведено с разрешения Хуанга и Васунга [14].
Магнитно-резонансная томография развития отдельных волокнистых трактов белого вещества, полученная с использованием диффузионно-тензорной визуализации, визуализированная на сроке от 10 до 42 недель беременности (wg). Обратите внимание на быструю пролиферацию волокнистых путей на всех сроках беременности. Ориентация волоконных трактов обозначена цветом: красный — левый/правый; синий — передний/задний; зеленый — дорсальная/вентральная ориентация. Воспроизведено с разрешения Хуанга и Васунга [14].
Системы γ-аминомасляной кислоты (ГАМК) и глутамата нейротрансмиттера и рецептора играют важную роль в развитии нервной системы. Мало того, что эти системы являются фундаментальными для нейронной связи и связи, но в отсутствие нейронной передачи и связывания ГАМК и глутамата нейроны подвергаются нейроапоптозу, процессу, при котором «ненужные» нейроны подвергаются клеточной гибели [15]. Нейроапоптоз — это естественный процесс, который затрагивает до 1% нейронов в день в пиковый период на поздних сроках беременности и в начале постнатальной жизни [16].
Интенсивная активность, связанная с нейроапоптозом и синаптогенезом у плода во втором и третьем триместре беременности, достигает своего пика на этой стадии развития нервной системы, замедляясь в ближайшем будущем и в первые недели после рождения. Эффекты анестетиков и седативных средств на синаптогенез и нейроапоптоз, описанные ниже, делают мозг плода особенно чувствительным к действию этих препаратов; вероятно, в большей степени, чем у новорожденных и детей младшего возраста.
Нейротоксичность анестетика на животных моделях развивающегося мозга ) оказывать обезболивающее и седативное действие.Агенты, связывающие ГАМК, включают летучие анестезирующие газы, пропофол, бензодиазепины, барбитураты, этомидат и хлоралгидрат. Агенты, связывающие NMDA, включают закись азота и кетамин [17] (табл. 1). Из-за их механизма действия, взаимодействия и влияния на нормальную нейротрансмиссию можно предположить, что эти агенты могут оказывать влияние на нейроапоптоз и синаптогенез в быстро развивающемся незрелом мозге.
 Действительно, Ikonomidou et al. [2] опубликовали основополагающую статью в 1999 г., описывающую 15-40-кратное увеличение нейроапоптоза в нескольких областях мозга после воздействия кетамина у новорожденных крыс P7.В 2003 г. Евтович-Тодорович и соавт. [3] подвергали новорожденных крыс воздействию закиси азота, изофлурана и мидазолама в клинических концентрациях в течение 6 часов и обнаружили 20–60-кратное увеличение нейроапоптоза во многих областях мозга. В когорте выживших животных были продемонстрированы долгосрочные нейроповеденческие нарушения обучения, памяти и пространственного различения. Этой знаменательной статье приписывают начало интенсивного интереса к определению того, может ли проблема нейротоксичности анестетиков повлиять на новорожденных и младенцев.В последующие годы было опубликовано несколько сотен исследований на животных моделях, и практически во всех были воспроизведены результаты острых нейродегенеративных изменений и долгосрочных нейроповеденческих изменений со всеми распространенными агентами, связывающими ГАМК и NMDA [1].
Действительно, Ikonomidou et al. [2] опубликовали основополагающую статью в 1999 г., описывающую 15-40-кратное увеличение нейроапоптоза в нескольких областях мозга после воздействия кетамина у новорожденных крыс P7.В 2003 г. Евтович-Тодорович и соавт. [3] подвергали новорожденных крыс воздействию закиси азота, изофлурана и мидазолама в клинических концентрациях в течение 6 часов и обнаружили 20–60-кратное увеличение нейроапоптоза во многих областях мозга. В когорте выживших животных были продемонстрированы долгосрочные нейроповеденческие нарушения обучения, памяти и пространственного различения. Этой знаменательной статье приписывают начало интенсивного интереса к определению того, может ли проблема нейротоксичности анестетиков повлиять на новорожденных и младенцев.В последующие годы было опубликовано несколько сотен исследований на животных моделях, и практически во всех были воспроизведены результаты острых нейродегенеративных изменений и долгосрочных нейроповеденческих изменений со всеми распространенными агентами, связывающими ГАМК и NMDA [1]. Модели на животных были распространены на нечеловеческих приматов, определив, что воздействие кетамина и летучих анестетиков приводит к долгосрочным проблемам с обучением [4]. Недавнее исследование Coleman et al. [18] подвергали новорожденных макак-резусов 5-часовой анестезии изофлураном один или три раза, чтобы проверить дозозависимую реакцию при многократном воздействии.По сравнению с контрольными животными, неонатальные обезьяны, подвергшиеся 3-кратному воздействию изофлурана, имели дефицит двигательных рефлексов в возрасте 1 месяца и повышенное тревожное поведение. Однократное воздействие не влияло на эти параметры. На этих животных было проведено более подробное нейрокогнитивное тестирование, данные в настоящее время анализируются.
Модели на животных были распространены на нечеловеческих приматов, определив, что воздействие кетамина и летучих анестетиков приводит к долгосрочным проблемам с обучением [4]. Недавнее исследование Coleman et al. [18] подвергали новорожденных макак-резусов 5-часовой анестезии изофлураном один или три раза, чтобы проверить дозозависимую реакцию при многократном воздействии.По сравнению с контрольными животными, неонатальные обезьяны, подвергшиеся 3-кратному воздействию изофлурана, имели дефицит двигательных рефлексов в возрасте 1 месяца и повышенное тревожное поведение. Однократное воздействие не влияло на эти параметры. На этих животных было проведено более подробное нейрокогнитивное тестирование, данные в настоящее время анализируются.Таблица 1
Анестетики, седативные и обезболивающие средства и связывание с рецепторами
Предлагаемый механизм индуцированного анестетиками нейроапоптоза в развивающемся мозге показан на рисунке 3.Связывание агентов ГАМК и NMDA блокирует нормальную нейротрансмиссию в ГАМК- и глутаматной системах, что приводит к синаптической депривации [15]. Это, в свою очередь, приводит к активации внутреннего нейроапоптотического каскада из-за отсутствия стимуляции нейронов. Разрушение митохондрий происходит как часть этого процесса и может наблюдаться в электронно-микроскопических исследованиях воздействия анестетиков. Каспаза 9 высвобождается из митохондрий, что приводит к увеличению концентрации каспазы 3 (стандарт для измерения апоптоза), вызывая завершение процесса нейроапоптоза.Другие механизмы нейродегенерации включают снижение образования дендритов и шипиков, а также снижение миграции нейронов.
Это, в свою очередь, приводит к активации внутреннего нейроапоптотического каскада из-за отсутствия стимуляции нейронов. Разрушение митохондрий происходит как часть этого процесса и может наблюдаться в электронно-микроскопических исследованиях воздействия анестетиков. Каспаза 9 высвобождается из митохондрий, что приводит к увеличению концентрации каспазы 3 (стандарт для измерения апоптоза), вызывая завершение процесса нейроапоптоза.Другие механизмы нейродегенерации включают снижение образования дендритов и шипиков, а также снижение миграции нейронов.
Рис. 3
Предлагаемый механизм нейродегенерации, вызванной анестезией. Подробности смотрите в тексте. Воспроизведено с разрешения Sanders et al. [15].
Помимо исследований воздействия анестетика на новорожденных, был опубликован ряд исследований воздействия анестетика на плод на грызунах, овцах и приматах; нейроапоптоз и другие нейродегенеративные изменения описаны при воздействии на плод кетамина, пропофола, летучих анестетиков, барбитуратов и бензодиазепинов [19,20,21,22].
Несмотря на стабильные и воспроизводимые результаты воздействия анестетика на модели эмбрионов и новорожденных животных, такие модели имеют ряд недостатков [1]. К ним относится отсутствие хирургической стимуляции во всех исследованиях, кроме нескольких. Это проблематично, потому что вклад хирургического стресса, боли, воспаления и травмы тканей в нейродегенерацию полностью не выяснен. Невылеченная боль на животных моделях также приводит к усилению нейроапоптоза и нейродегенерации [1].Межвидовые различия в развитии мозга и недостаточные данные о продолжительности и количестве воздействий анестезии также являются недостатками этих животных моделей. Тем не менее, последовательные и воспроизводимые неблагоприятные нейродегенеративные и нейроповеденческие эффекты в этих моделях оправдывают интенсивное исследование того, может ли эта проблема повлиять на человеческий плод, младенца и ребенка раннего возраста.
Нейротоксичность анестезирующих и седативных средств у младенцев, детей и плода
Ежегодно в США анестезию получают приблизительно 6 миллионов детей; с 2-3 миллионами этих анестетиков у детей в возрасте до 36 месяцев и 1. 5 миллионов детей в возрасте до 12 месяцев [23]. По данным North American Fetal Therapy Network, в 2014 г. в США было проведено около 1500 фетальных вмешательств и операций [24]. Это растущее население, учитывая увеличение числа программ и случаев внутриутробного вмешательства. Особое беспокойство вызывают более длительные процедуры, при которых мать получает общую анестезию со значительными концентрациями летучих анестетиков для поддержания покоя матки и анестезии как матери, так и плода [25].Значительные уровни этих ГАМКергических агентов будут достигнуты в мозге плода, что потенциально подвергает мозг плода значительному риску нейродегенеративных изменений. Кроме того, плоду, подвергающемуся хирургическим вмешательствам (например, при диафрагмальной грыже, миеломенингоцеле), в постнатальном периоде часто проводят повторную анестезию.
5 миллионов детей в возрасте до 12 месяцев [23]. По данным North American Fetal Therapy Network, в 2014 г. в США было проведено около 1500 фетальных вмешательств и операций [24]. Это растущее население, учитывая увеличение числа программ и случаев внутриутробного вмешательства. Особое беспокойство вызывают более длительные процедуры, при которых мать получает общую анестезию со значительными концентрациями летучих анестетиков для поддержания покоя матки и анестезии как матери, так и плода [25].Значительные уровни этих ГАМКергических агентов будут достигнуты в мозге плода, что потенциально подвергает мозг плода значительному риску нейродегенеративных изменений. Кроме того, плоду, подвергающемуся хирургическим вмешательствам (например, при диафрагмальной грыже, миеломенингоцеле), в постнатальном периоде часто проводят повторную анестезию.
В 2009 г. Wilder et al. [6] опубликовали первое крупномасштабное ретроспективное исследование воздействия анестетиков в возрасте до 4 лет и оценили частоту более поздних поведенческих, обучающих или связанных с развитием проблем в школьном возрасте. При длительном или многократном воздействии анестезии частота выявления этих проблем увеличивалась примерно в 2 раза по сравнению с субъектами, не подвергавшимися воздействию анестезии. С тех пор был опубликован ряд ретроспективных исследований со смешанными результатами относительно связи воздействия анестетика с последующими нейроповеденческими проблемами и проблемами развития [7]. Исследования в Европе, которые ставят диагноз проблем с обучением на основе стандартизированного академического тестирования в школьном возрасте, в значительной степени не обнаружили связи с воздействием анестезии и этими проблемами [26].С другой стороны, такие исследования, как Raine Cohort в Западной Австралии, где применялось прямое формальное тестирование развития нервной системы, задокументировали повышенный риск языковых проблем у подвергшихся воздействию субъектов [27]. Стратманн и др. [28] использовали уникальный тест на опознавательную память, проводимый в возрасте 6-11 лет после общей анестезии в возрасте <4 лет, и у субъектов, подвергшихся воздействию анестетика, задокументировали значительный дефицит в этой области.
При длительном или многократном воздействии анестезии частота выявления этих проблем увеличивалась примерно в 2 раза по сравнению с субъектами, не подвергавшимися воздействию анестезии. С тех пор был опубликован ряд ретроспективных исследований со смешанными результатами относительно связи воздействия анестетика с последующими нейроповеденческими проблемами и проблемами развития [7]. Исследования в Европе, которые ставят диагноз проблем с обучением на основе стандартизированного академического тестирования в школьном возрасте, в значительной степени не обнаружили связи с воздействием анестезии и этими проблемами [26].С другой стороны, такие исследования, как Raine Cohort в Западной Австралии, где применялось прямое формальное тестирование развития нервной системы, задокументировали повышенный риск языковых проблем у подвергшихся воздействию субъектов [27]. Стратманн и др. [28] использовали уникальный тест на опознавательную память, проводимый в возрасте 6-11 лет после общей анестезии в возрасте <4 лет, и у субъектов, подвергшихся воздействию анестетика, задокументировали значительный дефицит в этой области. Опубликованные несколько десятков ретроспективных когортных исследований, несмотря на их непоследовательность, свидетельствуют о том, что может существовать реальная проблема с исходами развития нервной системы у младенцев, подвергшихся воздействию анестезии, особенно при длительном или повторном воздействии.Дальнейшие ретроспективные исследования, вероятно, будут очень ограничены новой информацией о реальных эффектах воздействия анестетиков. На сегодняшний день нет опубликованных исследований воздействия анестетиков на плод человека и исходов развития нервной системы.
Опубликованные несколько десятков ретроспективных когортных исследований, несмотря на их непоследовательность, свидетельствуют о том, что может существовать реальная проблема с исходами развития нервной системы у младенцев, подвергшихся воздействию анестезии, особенно при длительном или повторном воздействии.Дальнейшие ретроспективные исследования, вероятно, будут очень ограничены новой информацией о реальных эффектах воздействия анестетиков. На сегодняшний день нет опубликованных исследований воздействия анестетиков на плод человека и исходов развития нервной системы.
Недавно были опубликованы два клинических исследования с превосходным дизайном, которые предоставили важную новую информацию об этой важной проблеме. В исследовании GAS (общая анестезия в сравнении со спинальной анестезией) приняли участие 722 ребенка в возрасте <60 недель после зачатия, которым была проведена пластика паховой грыжи в 28 центрах Северной Америки, Европы, Австралии и Новой Зеландии [29].Субъекты были рандомизированы для общей анестезии севофлураном и спинальной анестезии бупивакаином. Первичным результатом исследования является полномасштабный коэффициент интеллекта (IQ) в возрасте 5 лет с разницей в 5 баллов (100 — популяционная норма), которая считается клинически и статистически значимой. Вторичным результатом была когнитивная оценка по шкале развития младенцев и малышей Бейли-III в возрасте 2 лет, опять же с популяционной нормой 100, при значимой разнице между группами в 5 баллов.В возрасте 2 лет баллы по шкале Бейли-III для когнитивной области, а также языковой и моторной области были практически идентичны между группами. Из-за 20% перехода к общей анестезии в группе спинальной анестезии из-за субоптимальных условий операции, авторы проанализировали результаты как в группах, где проводилось лечение, так и в группах, где проводилось реальное лечение, и не обнаружили различий. Приблизительно 11% субъектов в обеих группах подвергались последующей общей анестезии в возрасте до 2 лет. Среднее время анестезии составило 54 минуты, и обе группы в целом были идентичны по исходным клиническим и демографическим характеристикам.
Первичным результатом исследования является полномасштабный коэффициент интеллекта (IQ) в возрасте 5 лет с разницей в 5 баллов (100 — популяционная норма), которая считается клинически и статистически значимой. Вторичным результатом была когнитивная оценка по шкале развития младенцев и малышей Бейли-III в возрасте 2 лет, опять же с популяционной нормой 100, при значимой разнице между группами в 5 баллов.В возрасте 2 лет баллы по шкале Бейли-III для когнитивной области, а также языковой и моторной области были практически идентичны между группами. Из-за 20% перехода к общей анестезии в группе спинальной анестезии из-за субоптимальных условий операции, авторы проанализировали результаты как в группах, где проводилось лечение, так и в группах, где проводилось реальное лечение, и не обнаружили различий. Приблизительно 11% субъектов в обеих группах подвергались последующей общей анестезии в возрасте до 2 лет. Среднее время анестезии составило 54 минуты, и обе группы в целом были идентичны по исходным клиническим и демографическим характеристикам. Первичный результат через 5 лет будет проверять более обширный набор нейрокогнитивных доменов, поэтому окончательный результат исследования GAS еще предстоит определить. Исследование GAS является первым полностью проспективным рандомизированным контролируемым исследованием техники анестезии и исходов развития нервной системы и, как таковое, приобрело статус важной вехи в решении проблемы.
Первичный результат через 5 лет будет проверять более обширный набор нейрокогнитивных доменов, поэтому окончательный результат исследования GAS еще предстоит определить. Исследование GAS является первым полностью проспективным рандомизированным контролируемым исследованием техники анестезии и исходов развития нервной системы и, как таковое, приобрело статус важной вехи в решении проблемы.
В исследовании PANDA (Оценка нейроразвития в педиатрической анестезии) приняли участие 105 пар братьев и сестер; У 1 брата или сестры в прошлом была анестезия в возрасте 3 лет или младше для пластики паховой грыжи [30].Средняя продолжительность анестезии составляла 80 минут с диапазоном от 20 до 240 минут. Другой брат не подвергался анестезии и был в возрасте не более 3 лет от подвергшегося воздействию брата или сестры. Оба брата и сестры вернулись в возрасте 8-15 лет для обширного набора нейрокогнитивных тестов. Этот инновационный дизайн исследования минимизировал генетические и социально-экономические различия между группами. Первичным результатом была полная шкала, вербальный и исполнительский IQ. Баллы между группами по этим исходам были практически одинаковыми. Вторичные тесты памяти, языка, внимания и исполнительной функции также не отличались.Были некоторые незначительные различия в поведении по родительскому опроснику, но эффект (т. е. анестезия хуже, чем отсутствие анестезии) не был последовательным.
Первичным результатом была полная шкала, вербальный и исполнительский IQ. Баллы между группами по этим исходам были практически одинаковыми. Вторичные тесты памяти, языка, внимания и исполнительной функции также не отличались.Были некоторые незначительные различия в поведении по родительскому опроснику, но эффект (т. е. анестезия хуже, чем отсутствие анестезии) не был последовательным.
Оба этих исследования имеют важное значение для изучения нейротоксичности анестетиков. Они подразумевают, что однократное относительно короткое воздействие анестезии не связано с увеличением частоты нейроповеденческих побочных эффектов. Многие исследователи считают, что фокус этой области исследований должен сместиться на длительные или повторяющиеся воздействия анестезии или на влияние анестезии на уязвимый мозг, т.е.е. плода, младенцев с врожденными пороками сердца или младенцев с другими сложными неонатальными хирургическими состояниями, такими как диафрагмальная грыжа. Кроме того, в будущих исследованиях следует оценить эффект продолжительной седации, например, у тяжелобольных младенцев в отделениях интенсивной терапии.
Дексмедетомидин в качестве нейропротектора при нейротоксичности анестетиков
Дексмедетомидин является новым седативным/снотворным средством, которое действует на центральную нервную систему α 2 -адренергические рецепторы связываются как высокоселективный агонист.Дексмедетомидин вызывает гипноз и анксиолиз путем связывания пресинаптических α 2 -рецепторов в голубом пятне в головном мозге и обезболивание путем связывания с α 2 -рецепторами в спинном мозге [31] (таблица 1). Он был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 1999 г. для использования в качестве седативного средства в отделениях интенсивной терапии у взрослых, находящихся на искусственной вентиляции легких, а второе показание было одобрено в 2007 г. для процедурной седации у взрослых, находящихся на спонтанной вентиляции [32]. Дексмедетомидин не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для использования у пациентов младше 18 лет; однако он получил широкое распространение в педиатрической анестезиологии и интенсивной терапии. Он используется для послеоперационной седации, как компонент схем тотальной внутривенной анестезии, для опиоид-сберегающего лечения при тонзиллэктомии, а также для премедикации, процедурной седации, предотвращения возбуждения после операции и как компонент сбалансированной общей анестезиологической техники [33]. . Среди желательных свойств дексмедетомидина — его способность поддерживать нормальный респираторный паттерн, снижать частоту посткардиальных хирургических тахиаритмий [34] и снижать дозы летучих анестетиков и опиоидов при использовании в качестве компонента сбалансированной техники анестезии [33].Дексмедетомидин имеет значительный объем исследований и клинических публикаций у детей; недавний поиск в PubMed выявил более 500 публикаций для детей в возрасте 0–18 лет и 200 публикаций для детей в возрасте от рождения до 2 лет.
Он используется для послеоперационной седации, как компонент схем тотальной внутривенной анестезии, для опиоид-сберегающего лечения при тонзиллэктомии, а также для премедикации, процедурной седации, предотвращения возбуждения после операции и как компонент сбалансированной общей анестезиологической техники [33]. . Среди желательных свойств дексмедетомидина — его способность поддерживать нормальный респираторный паттерн, снижать частоту посткардиальных хирургических тахиаритмий [34] и снижать дозы летучих анестетиков и опиоидов при использовании в качестве компонента сбалансированной техники анестезии [33].Дексмедетомидин имеет значительный объем исследований и клинических публикаций у детей; недавний поиск в PubMed выявил более 500 публикаций для детей в возрасте 0–18 лет и 200 публикаций для детей в возрасте от рождения до 2 лет.
Поскольку дексмедетомидин не взаимодействует ни с рецепторами ГАМК, ни с NMDA, а также из-за его широкого применения и известности в клинической педиатрии и хирургии, он является привлекательным средством для изучения нейротоксичности анестетиков. Сандерс и его коллеги подвергали новорожденных крыс воздействию дексмедетомидина в значительных концентрациях и не продемонстрировали увеличения нейроапоптоза по сравнению с исходным уровнем при применении только дексмедетомидина [35].Затем они подвергли другую группу воздействию изофлюрана и воспроизвели сильное увеличение нейроапоптоза после 6-часового воздействия. Когда дексмедетомидин добавляли к воздействию изофлюрана, наблюдалось дозозависимое снижение нейроапоптоза до тех же исходных уровней, которые наблюдались у контрольных новорожденных крыс, не подвергавшихся воздействию какого-либо агента (рис. 4). Важно отметить, что в когортах выживших крыс, протестированных во взрослом возрасте на память и пространственную ориентацию, воздействие только дексмедетомидина не приводило к дефициту по сравнению с крысами, не подвергавшимися воздействию.Воздействие только изофлурана, как и ожидалось, привело к значительному снижению производительности в этих тестах. Когда к изофлурану добавляли дексмедетомидин, показатели в тестах были равны исходным показателям у не подвергавшихся воздействию животных.
Сандерс и его коллеги подвергали новорожденных крыс воздействию дексмедетомидина в значительных концентрациях и не продемонстрировали увеличения нейроапоптоза по сравнению с исходным уровнем при применении только дексмедетомидина [35].Затем они подвергли другую группу воздействию изофлюрана и воспроизвели сильное увеличение нейроапоптоза после 6-часового воздействия. Когда дексмедетомидин добавляли к воздействию изофлюрана, наблюдалось дозозависимое снижение нейроапоптоза до тех же исходных уровней, которые наблюдались у контрольных новорожденных крыс, не подвергавшихся воздействию какого-либо агента (рис. 4). Важно отметить, что в когортах выживших крыс, протестированных во взрослом возрасте на память и пространственную ориентацию, воздействие только дексмедетомидина не приводило к дефициту по сравнению с крысами, не подвергавшимися воздействию.Воздействие только изофлурана, как и ожидалось, привело к значительному снижению производительности в этих тестах. Когда к изофлурану добавляли дексмедетомидин, показатели в тестах были равны исходным показателям у не подвергавшихся воздействию животных. Это исследование породило концепцию, что дексмедетомидин сам по себе не вызывает нейроапоптоз, а при добавлении к стандартным клиническим дозам летучих анестетиков может улучшать острое нейродегенеративное повреждение и последующие нейроповеденческие расстройства. После публикации статьи Сандерса в 2009 году было опубликовано 9 дополнительных исследований на моделях эмбрионов или новорожденных животных, в которых оценивалось влияние дексмедетомидина на нейроапоптоз.Из этих 10 исследований в 8 не было продемонстрировано нейроапоптоза, и во всех 3 исследованиях, в которых проводилось последующее нейроповеденческое тестирование у выживших животных, дексмедетомидин уменьшал дефицит, связанный с введением изофлурана [19, 20, 21, 22, 36, 37, 38, 39, 40] (табл. 2). В исследовании Pancaro et al. [40], дексмедетомидин в очень высоких дозах вызывал нейроапоптоз в сенсорной коре и таламусе. Лю и др. [39] подвергали новорожденных крысят возрастающим кумулятивным дозам дексмедетомидина, введенным в виде 5 внутрибрюшинных инъекций в течение 6 ч, включая 50, 125 и 250 мкг/кг.
Это исследование породило концепцию, что дексмедетомидин сам по себе не вызывает нейроапоптоз, а при добавлении к стандартным клиническим дозам летучих анестетиков может улучшать острое нейродегенеративное повреждение и последующие нейроповеденческие расстройства. После публикации статьи Сандерса в 2009 году было опубликовано 9 дополнительных исследований на моделях эмбрионов или новорожденных животных, в которых оценивалось влияние дексмедетомидина на нейроапоптоз.Из этих 10 исследований в 8 не было продемонстрировано нейроапоптоза, и во всех 3 исследованиях, в которых проводилось последующее нейроповеденческое тестирование у выживших животных, дексмедетомидин уменьшал дефицит, связанный с введением изофлурана [19, 20, 21, 22, 36, 37, 38, 39, 40] (табл. 2). В исследовании Pancaro et al. [40], дексмедетомидин в очень высоких дозах вызывал нейроапоптоз в сенсорной коре и таламусе. Лю и др. [39] подвергали новорожденных крысят возрастающим кумулятивным дозам дексмедетомидина, введенным в виде 5 внутрибрюшинных инъекций в течение 6 ч, включая 50, 125 и 250 мкг/кг. Более низкая доза соответствует клинически значимой дозе, а высокая доза является значительно сверхтерапевтической, вызывая уровни в плазме, намного превышающие клинически значимые концентрации у людей. Дозы 50 и 125 мкг/кг не вызывали нейроапоптоза, превышающего контрольные уровни; доза 250 мкг/кг значительно увеличивала нейроапоптоз. Нейродегенеративные эффекты высоких доз дексмедетомидина были обращены вспять агентами, блокирующими α 1 -рецептор, что позволяет предположить, что высокие дозы имеют значительное связывание с этим рецептором, который, как известно, вызывает нейродегенерацию.Авторы пришли к выводу, что клинические дозы для человека не должны быть нейротоксичными и потенциально могут оказывать нейропротекторное действие. Исследования дексмедетомидина на модели плода и новорожденного представлены в таблице 2.
Более низкая доза соответствует клинически значимой дозе, а высокая доза является значительно сверхтерапевтической, вызывая уровни в плазме, намного превышающие клинически значимые концентрации у людей. Дозы 50 и 125 мкг/кг не вызывали нейроапоптоза, превышающего контрольные уровни; доза 250 мкг/кг значительно увеличивала нейроапоптоз. Нейродегенеративные эффекты высоких доз дексмедетомидина были обращены вспять агентами, блокирующими α 1 -рецептор, что позволяет предположить, что высокие дозы имеют значительное связывание с этим рецептором, который, как известно, вызывает нейродегенерацию.Авторы пришли к выводу, что клинические дозы для человека не должны быть нейротоксичными и потенциально могут оказывать нейропротекторное действие. Исследования дексмедетомидина на модели плода и новорожденного представлены в таблице 2.
Таблица 2
a Нейроапоптоз в гиппокампе (окрашивание каспазой 3). Левая панель: слева направо — воздействие воздуха плюс физиологический раствор, контроль воздуха плюс дексмедетомидин 25 мкг/кг внутрибрюшинно и воздух плюс дексмедетомидин 75 мкг/кг. p < 0,001 по сравнению с изофлюран + физиологический раствор; § p < 0,05 по сравнению с изофлюран + дексмедетомидин 25 мкг/кг; + p < 0,01 по сравнению с изофлюран + физиологический раствор. Дексмедетомидин обеспечивал дозозависимое снижение окрашивания каспазы 3 для нейроапоптоза в гиппокампе, коре головного мозга (не показано) и таламусе (не показано). Частичное устранение нейропротекции дексмедетомидином под действием α 2 -антагониста атипамезола предполагает, по крайней мере, частичное опосредование этого механизма. b Когнитивная функция, оцениваемая с помощью условного рефлекса страха (время замирания; меньшее время = худшая работа). * p < 0,05 по сравнению с другими группами. Сам по себе дексмедетомидин не влиял на когнитивные функции и устранял дефицит когнитивных функций, вызванный изофлураном. Воспроизведено с разрешения Sanders et al. [35].
p < 0,001 по сравнению с изофлюран + физиологический раствор; § p < 0,05 по сравнению с изофлюран + дексмедетомидин 25 мкг/кг; + p < 0,01 по сравнению с изофлюран + физиологический раствор. Дексмедетомидин обеспечивал дозозависимое снижение окрашивания каспазы 3 для нейроапоптоза в гиппокампе, коре головного мозга (не показано) и таламусе (не показано). Частичное устранение нейропротекции дексмедетомидином под действием α 2 -антагониста атипамезола предполагает, по крайней мере, частичное опосредование этого механизма. b Когнитивная функция, оцениваемая с помощью условного рефлекса страха (время замирания; меньшее время = худшая работа). * p < 0,05 по сравнению с другими группами. Сам по себе дексмедетомидин не влиял на когнитивные функции и устранял дефицит когнитивных функций, вызванный изофлураном. Воспроизведено с разрешения Sanders et al. [35]. Особого упоминания заслуживают два исследования дексмедетомидина на плодах. Олутойе и др. [22] изучили 9 плодов овец на 118-120-й день беременности, которые подверглись 2-3-часовой анестезии изофлураном для модели окклюзии трахеи фетальным баллоном на животных.Через две недели животных подвергали 6-часовой анестезии изофлураном для извлечения баллона, а 5 из 9 плодов также получали дексмедетомидин. Изофлуран вызывал усиление нейроапоптоза, особенно в зубчатой извилине; при добавлении дексмедетомидина наблюдалось снижение апоптоза, хотя и не совсем до исходного контрольного уровня. Это исследование продемонстрировало возможность использования модели крупных животных овец для изучения нейротоксичности анестетиков для плода. К преимуществам этой модели относятся возможность тщательного наблюдения за гемодинамическими изменениями у плода и возможность получения уровней дексмедетомидина в плазме, что технически чрезвычайно сложно в неонатальных моделях грызунов.Наконец, Ку и соавт. [21] изучали 20 эмбрионов яванских макаков на 120-й день беременности. Матери подвергались воздействию кетамина в высокой дозе в течение 12 ч или дексмедетомидина в низкой дозе (нагрузочная доза 3 мкг/кг, 3 мкг/кг/ч в течение 12 ч) или высокой дозе (30 мкг/кг нагрузочная доза, 30 мкг/кг).
Олутойе и др. [22] изучили 9 плодов овец на 118-120-й день беременности, которые подверглись 2-3-часовой анестезии изофлураном для модели окклюзии трахеи фетальным баллоном на животных.Через две недели животных подвергали 6-часовой анестезии изофлураном для извлечения баллона, а 5 из 9 плодов также получали дексмедетомидин. Изофлуран вызывал усиление нейроапоптоза, особенно в зубчатой извилине; при добавлении дексмедетомидина наблюдалось снижение апоптоза, хотя и не совсем до исходного контрольного уровня. Это исследование продемонстрировало возможность использования модели крупных животных овец для изучения нейротоксичности анестетиков для плода. К преимуществам этой модели относятся возможность тщательного наблюдения за гемодинамическими изменениями у плода и возможность получения уровней дексмедетомидина в плазме, что технически чрезвычайно сложно в неонатальных моделях грызунов.Наконец, Ку и соавт. [21] изучали 20 эмбрионов яванских макаков на 120-й день беременности. Матери подвергались воздействию кетамина в высокой дозе в течение 12 ч или дексмедетомидина в низкой дозе (нагрузочная доза 3 мкг/кг, 3 мкг/кг/ч в течение 12 ч) или высокой дозе (30 мкг/кг нагрузочная доза, 30 мкг/кг). /ч в течение 12 часов). Через 6 ч после инфузии оценивали гистохимию головного мозга в лобной коре; не было увеличения по сравнению с исходным уровнем нейроапоптоза ни при низких, ни при высоких дозах дексмедетомидина; напротив, кетамин приводил к 9-кратному увеличению нейроапоптоза.
/ч в течение 12 часов). Через 6 ч после инфузии оценивали гистохимию головного мозга в лобной коре; не было увеличения по сравнению с исходным уровнем нейроапоптоза ни при низких, ни при высоких дозах дексмедетомидина; напротив, кетамин приводил к 9-кратному увеличению нейроапоптоза.
Растущий объем данных на моделях эмбрионов и новорожденных животных о том, что дексмедетомидин не вызывает нейродегенеративных изменений в клинических дозах и может улучшать эти изменения, вызванные обычными анестетиками, такими как изофлуран, пропофол и кетамин, делает его привлекательным агентом для изучения в клинические испытания нейротоксичности анестетиков.
Клинические исследования дексмедетомидина
В настоящее время проводятся два пилотных исследования дексмедетомидина в качестве компонента техники анестезии для определения безопасности и целесообразности использования препарата в значительных дозах в качестве первого шага в планировании будущих рандомизированных контролируемых испытаний. Во-первых, это пилотное исследование T-REX (токсичность ремифентанила и дексмедетомина). [41]. Поскольку не было продемонстрировано, что опиоиды, и в частности ремифентанил [42], вызывают нейроапоптоз, эта комбинация препаратов представляет собой наиболее правдоподобный подход к изучению по сравнению со стандартной техникой анестезии, т.е. севофлюран, чтобы оценить, существуют ли какие-либо различия в исходах развития нервной системы. Поскольку кратковременная анестезия с меньшей вероятностью будет проблемой для развития нервной системы, в пилотном исследовании T-REX приняли участие 60 младенцев в возрасте от 1 до 12 месяцев, перенесших операцию на нижних отделах брюшной полости или нижних конечностях продолжительностью более 120 минут с добавлением каудальной блокады. для обезболивания операционного поля.Первичным результатом исследования является осуществимость техники, определяемая как отсутствие необходимости отказываться от техники из-за нарушения гемодинамики (брадикардия, гипотензия) или субоптимальных хирургических условий из-за движения пациента.
Во-первых, это пилотное исследование T-REX (токсичность ремифентанила и дексмедетомина). [41]. Поскольку не было продемонстрировано, что опиоиды, и в частности ремифентанил [42], вызывают нейроапоптоз, эта комбинация препаратов представляет собой наиболее правдоподобный подход к изучению по сравнению со стандартной техникой анестезии, т.е. севофлюран, чтобы оценить, существуют ли какие-либо различия в исходах развития нервной системы. Поскольку кратковременная анестезия с меньшей вероятностью будет проблемой для развития нервной системы, в пилотном исследовании T-REX приняли участие 60 младенцев в возрасте от 1 до 12 месяцев, перенесших операцию на нижних отделах брюшной полости или нижних конечностях продолжительностью более 120 минут с добавлением каудальной блокады. для обезболивания операционного поля.Первичным результатом исследования является осуществимость техники, определяемая как отсутствие необходимости отказываться от техники из-за нарушения гемодинамики (брадикардия, гипотензия) или субоптимальных хирургических условий из-за движения пациента. Также будет оцениваться безопасность режима. Шестьдесят субъектов регистрируются в 11 центрах в США, Европе, Австралии и Новой Зеландии. Если> 90% субъектов завершают протокол без отказа, метод будет считаться выполнимым. Пилотное исследование будет представлять собой предварительные данные для планирования проспективного рандомизированного контролируемого исследования дексмедетомидин-ремифентанила в сравнении со стандартным методом анестезии, т.е.е. севофлуран. Последующее наблюдение за развитием нервной системы, вероятно, будет таким же, как и в исследовании GAS, с первой оценкой в возрасте 2 лет.
Также будет оцениваться безопасность режима. Шестьдесят субъектов регистрируются в 11 центрах в США, Европе, Австралии и Новой Зеландии. Если> 90% субъектов завершают протокол без отказа, метод будет считаться выполнимым. Пилотное исследование будет представлять собой предварительные данные для планирования проспективного рандомизированного контролируемого исследования дексмедетомидин-ремифентанила в сравнении со стандартным методом анестезии, т.е.е. севофлуран. Последующее наблюдение за развитием нервной системы, вероятно, будет таким же, как и в исследовании GAS, с первой оценкой в возрасте 2 лет.
Вторым проводимым исследованием является «Исследование I фазы болюсного и инфузионного введения дексмедетомидина в коррекционной кардиохирургии младенцев: безопасность и фармакокинетика» [43]. В этом исследовании принимают участие 116 младенцев в возрасте от 0 до 6 месяцев, перенесших корригирующую операцию на сердце с искусственным кровообращением для операции артериального переключения или транспозиции магистральных сосудов, или восстановления дефекта межжелудочковой перегородки или тетрады Фалло. Используя подход с повышением дозы, дексмедетомидин добавляют к стандартному анестетику, состоящему из фентанила и изофлурана, и к стандартному режиму седации в отделении интенсивной терапии с использованием опиоидов и бензодиазепинов. События безопасности, в первую очередь узловая брадикардия, атриовентрикулярная блокада и гипотензия, оцениваются как первичные исходы. Создается фармакокинетическая модель, которая будет проверена во второй части исследования. Как и в случае с исследованием T-REX, эти данные будут использоваться в качестве предварительных данных для планирования проспективного, рандомизированного, плацебо-контролируемого исследования дексмедетомидина по сравнению с плацебо с физиологическим раствором, добавленным к стандартному режиму анестезии и седативного действия.Первичным исходом будет исход развития нервной системы, вероятно, в возрасте 2 лет.
Используя подход с повышением дозы, дексмедетомидин добавляют к стандартному анестетику, состоящему из фентанила и изофлурана, и к стандартному режиму седации в отделении интенсивной терапии с использованием опиоидов и бензодиазепинов. События безопасности, в первую очередь узловая брадикардия, атриовентрикулярная блокада и гипотензия, оцениваются как первичные исходы. Создается фармакокинетическая модель, которая будет проверена во второй части исследования. Как и в случае с исследованием T-REX, эти данные будут использоваться в качестве предварительных данных для планирования проспективного, рандомизированного, плацебо-контролируемого исследования дексмедетомидина по сравнению с плацебо с физиологическим раствором, добавленным к стандартному режиму анестезии и седативного действия.Первичным исходом будет исход развития нервной системы, вероятно, в возрасте 2 лет.
В случае успешного проведения эти рандомизированные испытания будут иметь оптимизированный дизайн исследования в соответствующей популяции младенцев, подвергающихся длительной анестезии, а в случае пациентов с врожденными операциями на сердце, мозг которых уязвим для травм и неблагоприятных исходов развития нервной системы. Достаточный размер выборки сведет к минимуму систематическую ошибку из-за существовавших ранее сопутствующих заболеваний или различий в социально-экономических или генетических факторах.
Достаточный размер выборки сведет к минимуму систематическую ошибку из-за существовавших ранее сопутствующих заболеваний или различий в социально-экономических или генетических факторах.
Коммюнике FDA США по безопасности лекарственных средств
В декабре 2016 года FDA США выпустило Коммюнике по безопасности лекарственных средств (DSC), предупреждая, что «повторяющееся или длительное использование общих анестетиков и седативных препаратов во время операций или процедур у детей в возрасте до 3 лет и старше». у беременных женщин в третьем триместре может повлиять на развитие детского мозга» [44]. «Продолжительный» определяется как >3 ч; это предупреждение было выпущено из-за обзора FDA доклинических и клинических данных и привело к изменению маркировки всех распространенных анестетиков, связывающихся с рецепторами ГАМК и NMDA, включая летучие анестетики.DSC направляет анестезиологов, хирургов и других процедурных специалистов обсудить с родителями этот потенциальный эффект, и можно ли безопасно отложить процедуру, ожидаемую продолжительность и необходимость повторных анестетиков. Это предупреждение явно имеет значение для вмешательств на плод и детей младшего возраста и было выпущено FDA без новых или касающихся доказательств на людях [45]. Тем не менее, проблема потенциальной нейротоксичности анестетиков приобретает еще большую актуальность после выпуска предупреждения FDA.В предупреждении также говорится: «…необходимы дополнительные высококачественные исследования для изучения последствий многократного и длительного воздействия анестезии на детей, включая уязвимые группы населения» [44].
Это предупреждение явно имеет значение для вмешательств на плод и детей младшего возраста и было выпущено FDA без новых или касающихся доказательств на людях [45]. Тем не менее, проблема потенциальной нейротоксичности анестетиков приобретает еще большую актуальность после выпуска предупреждения FDA.В предупреждении также говорится: «…необходимы дополнительные высококачественные исследования для изучения последствий многократного и длительного воздействия анестезии на детей, включая уязвимые группы населения» [44].
Заключение
Потенциальная нейротоксичность анестетиков у новорожденных, детей раннего возраста и плода является наиболее актуальным вопросом, стоящим перед детской и фетальной анестезией [46]. Очень быстрое развитие мозга плода потенциально делает эту группу пациентов наиболее уязвимой для нейротоксического действия анестезии.Растущее число вмешательств на плод, требующих анестезии, делает это очень важной областью научных исследований. Кроме того, два недавних хорошо спланированных «отрицательных» исследования кратковременного однократного воздействия анестетика в раннем детстве должны сместить акцент клинических исследований на пациентов, подвергающихся длительным процедурам, или на пациентов с известной уязвимостью в развитии нервной системы, например. врожденный порок сердца, другие сложные неонатальные операции и плод.
врожденный порок сердца, другие сложные неонатальные операции и плод.
Ссылки
- Раппапорт Б.А., Суреш С., Герц С., Эверс А.С., Орсер Б.А.: Нейротоксичность анестетика — клинические последствия моделей на животных.N Engl J Med 2015; 372: 796-797.
- Икономиду С., Бош Ф., Микса М., Биттигау П., Фёклер Дж., Дикранян К., Тенкова Т.И., Стефовска В., Турски Л., Олни Дж.В.: Блокада рецепторов NMDA и апоптотическая нейродегенерация в развивающемся мозге. Наука 1999;283:70-74.
- Jevtovic-Todorovic V, Hartman RE, Izumi Y, Benshoff ND, Dikranian K, Zorumski CF, Olney JW, Wozniak DF: Раннее воздействие обычных анестетиков вызывает широко распространенную нейродегенерацию в развивающемся мозге крысы и стойкий дефицит обучения.
 J Neurosci 2003; 23:876-882.
J Neurosci 2003; 23:876-882. - Пол М.Г., Ли М., Аллен Р.Р., Лю Ф., Зоу Х., Хотчкисс С., Ханиг Дж.П., Паттерсон Т.А., Сликкер В.-младший, Ван С.: Кетаминовая анестезия в течение первой недели жизни может вызвать длительный когнитивный дефицит у макак-резусов. Нейротоксикол Тератол 2011;33:220-230.
- Крили К.Э., Дикранян К.Т., Диссен Г.А., Бэк С.А., Олни Дж.В., Брамбринк А.М.: Изофлуран-индуцированный апоптоз нейронов и олигодендроцитов в мозге плода макаки-резус. Анестезиология 2014;120:626-638.
- Wilder RT, Flick RP, Sprung J, Katusic SK, Barbaresi WJ, Mickelson C, Gleich SJ, Schroeder DR, Weaver AL, Warner DO: Раннее воздействие анестезии и трудности с обучением в популяционной когорте новорожденных.
 Анестезиология 2009;110:796-804.
Анестезиология 2009;110:796-804. - DiMaggio C, Sun LS, Ing C, Li G: Детская анестезия и нарушения развития нервной системы: байесовский метаанализ. J Neurosurg Anesthesiol 2012;24:376-381.
- Псати Б.М., Платт Р., Альтман Р.Б.: Нейротоксичность генерических анестезирующих средств у младенцев и детей: вопрос исследования сирот в поисках спонсора.ДЖАМА 2015; 313:1515-1516.
- Лин Э.П.
 , Сориано С.Г., Лепке А.В.: Нейротоксичность анестетика. Anesthesiol Clin 2014;32:133-155.
, Сориано С.Г., Лепке А.В.: Нейротоксичность анестетика. Anesthesiol Clin 2014;32:133-155. - Олсен Э.А., Брамбринк А.М.: Нейротоксичность анестетиков у новорожденных и младенцев.Curr Opin Anaesthesiol 2013; 26: 535-542.
- Дэвидсон А., Флик Р.П.: Последствия использования седации и обезболивания у новорожденных для развития нервной системы. Клин Перинатол 2013;40:559-573.
- Дэвидсон А.
 Дж., Бекке К., де Грааф Дж., Гирибальди Г., Хабре В., Хансен Т., Хант Р.В., Инг С., Лепке А., Макканн М.Е., Ормонд Г.Д., Пини Прато А., Сальво И., Сан Л., Вутскиц Л., Уокер С., Disma N: Анестезия и развивающийся мозг: путь вперед для клинических исследований.Педиатр Анаст 2015; 25: 447-452.
Дж., Бекке К., де Грааф Дж., Гирибальди Г., Хабре В., Хансен Т., Хант Р.В., Инг С., Лепке А., Макканн М.Е., Ормонд Г.Д., Пини Прато А., Сальво И., Сан Л., Вутскиц Л., Уокер С., Disma N: Анестезия и развивающийся мозг: путь вперед для клинических исследований.Педиатр Анаст 2015; 25: 447-452. - Тимофиева О., Хесс К.П., Сюй Д., Баркович А.Дж.: Структурный коннектом МРТ в развитии: проблемы изменяющегося мозга. Бр Дж Радиол 2014;87:20140086.
- Хуанг Х., Васунг Л.: Изучение развития мозга плода с помощью диффузионной МРТ и гистологии.Int J Dev Neurosci 2014; 32:11-22.
- Сандерс Р.
 Д., Хасселл Дж., Дэвидсон А.Дж., Робертсон Н.Дж., Ма Д.: Влияние анестетиков и хирургии на развитие нервной системы: обновление. Br J Anaesth 2013; 110 (дополнение 1): i53-i72.
Д., Хасселл Дж., Дэвидсон А.Дж., Робертсон Н.Дж., Ма Д.: Влияние анестетиков и хирургии на развитие нервной системы: обновление. Br J Anaesth 2013; 110 (дополнение 1): i53-i72. - Istaphanous GK, Ward CG, Nan X, Hughes EA, McCann JC, McAuliffe JJ, Danzer SC, Loepke AW: Характеристика и количественная оценка индуцированной изофлураном апоптотической гибели клеток в коре головного мозга мыши.Анест Аналг 2013; 116: 845-854.
- Istaphanous GK, Ward CG, Loepke AW: Влияние периоперационного периода на нейрокогнитивное развитие с акцентом на фармакологические проблемы. Best Pract Res Clin Anaesthesiol 2010; 24: 433-449.

- Коулман К., Робертсон Н.Д., Диссен Г.А., Нойрингер М.Д., Мартин Л.Д., Карлсон В.К., Кроенке С., Фэйр Д., Брамбринк А.М.: Анестезия изофлураном имеет долгосрочные последствия для двигательного и поведенческого развития у детенышей макак-резусов.Анестезиология 2017;126:74-84.
- Li J, Xiong M, Nadavaluru PR, Zuo W, Ye JH, Eloy JD, Bekker A: Дексмедетомидин ослабляет нейротоксичность, вызванную пренатальным воздействием пропофола. J Neurosurg Anesthesiol 2016;28:51-64.
- Duan X, Li Y, Zhou C, Huang L, Dong Z: Дексмедетомидин обеспечивает нейропротекцию: влияние на индуцированный кетамином нейроапоптоз в развивающемся мозге крысы.
 Acta Anaesthesiol Scand 2014;58:1121-1126.
Acta Anaesthesiol Scand 2014;58:1121-1126. - Koo E, Oshodi T, Meschter C, Ebrahimnejad A, Dong G: Нейротоксические эффекты дексмедетомидина в мозге плода яванского макака. J Toxicol Sci 2014; 39: 251-262.
- Олутойе О.А., Лазар Д.А., Акинкуоту А.С., Адесина А., Олутойе О.О.: Потенциал овечьего мозга как модели нейроапоптоза, вызванного анестезией.Pediatr Surg Int 2015;31:865-869.
- Sun L: Воздействие общей анестезии в раннем детстве и нейрокогнитивное развитие.
 Br J Anaesth 2010; 105 (дополнение 1): i61-i68.
Br J Anaesth 2010; 105 (дополнение 1): i61-i68. - Североамериканская сеть фетальной терапии.https://www.naftnet.org/.
- Роллинз, М.Д., Розен, М.А.: Анестезия при внутриутробном вмешательстве и хирургии; in Gregory GA, Andropoulos DB (eds): Детская анестезия, изд. 5. Oxford, Wiley-Blackwell, 2012, стр. 444-474.
- Хансен Т.Г., Педерсен Дж.К., Хеннеберг С.В., Педерсен Д.А., Мюррей Дж.
 К., Мортон Н.С., Кристенсен К. Успеваемость в подростковом возрасте после пластики паховой грыжи в младенчестве: общенациональное когортное исследование.Анестезиология 2011;114:1076-1085.
К., Мортон Н.С., Кристенсен К. Успеваемость в подростковом возрасте после пластики паховой грыжи в младенчестве: общенациональное когортное исследование.Анестезиология 2011;114:1076-1085. - Инг С., ДиМаджио С., Уайтхаус А., Хегарти М.К., Брэди Дж., фон Унгерн-Штернберг Б.С., Дэвидсон А., Вуд А.Дж., Ли Г., Сан Л.С.: Долгосрочные различия в языке и когнитивных функциях после воздействия анестезии в детстве. Педиатрия 2012;130:e476-e485.
- Стратманн Г., Ли Дж., Салл Дж.В., Ли Б.Х., Алви Р.С., Ши Дж., Роу А.М., Рэймидж Т.М., Чанг Ф.Л., Александр Т.Г., Лемперт Д.К., Лин Н., Сиу К.Х., Эльфик С.А., Вонг А., Шнаир К.И., Ву А.Ф. , Чан Дж.Т., Зай Х., Вонг М.К., Энтони А.М.
 , Барбур К.С., Бен-Цур Д., Казарян Н.Э., Ли Д.Ю., Шен Дж.Р., Лю Э., Бенивал Г.С., Ламмерс Ч.Р., Хиноны З., Аггарвал А., Седарс Э., Йонелинас А.П. , Ghetti S: Влияние общей анестезии в младенчестве на долговременную память распознавания у людей и крыс.Нейропсихофармакология 2014;39:2275-2287.
, Барбур К.С., Бен-Цур Д., Казарян Н.Э., Ли Д.Ю., Шен Дж.Р., Лю Э., Бенивал Г.С., Ламмерс Ч.Р., Хиноны З., Аггарвал А., Седарс Э., Йонелинас А.П. , Ghetti S: Влияние общей анестезии в младенчестве на долговременную память распознавания у людей и крыс.Нейропсихофармакология 2014;39:2275-2287. - Дэвидсон А.Дж., Дисма Н., де Грааф Дж.К., Витингтон Д.Э., Доррис Л., Белл Г., Старгатт Р., Беллинджер Д.С., Шустер Т., Арнуп С.Дж., Харди П., Хант Р.В., Такаги М.Дж., Гирибальди Г., Хартманн П.Л., Сальво И., Мортон Н.С., фон Унгерн Штернберг Б.С., Локателли Б.Г., Уилтон Н., Линн А., Томас Дж.Дж., Поланер Д., Бэгшоу О., Шмук П., Абсалом А.Р., Фроули Г., Берде К., Ормонд Г.Д., Мармор Дж., Макканн М.Е.; Консорциум GAS: Исход развития нервной системы в возрасте 2 лет после общей анестезии и регионарной анестезии в состоянии бодрствования в младенчестве (GAS): международное многоцентровое рандомизированное контролируемое исследование.
 Ланцет 2016; 387: 239-250.
Ланцет 2016; 387: 239-250. - Sun LS, Li G, Miller TL, Salorio C, Byrne MW, Bellinger DC, Ing C, Park R, Radcliffe J, Hays SR, DiMaggio CJ, Cooper TJ, Rauh V, Maxwell LG, Youn A, McGowan FX: связь между однократное воздействие общей анестезии в возрасте до 36 месяцев и нейрокогнитивные исходы в более позднем детстве.ДЖАМА 2016; 315:2312-2320.
- Su F, Nicolson SC, Gastonguay MR, Barrett JS, Adamson PC, Kang DS, Godinez RI, Zuppa AF: Популяционная фармакокинетика дексмедетомидина у младенцев после операции на открытом сердце. Анест Аналг 2010; 110: 1383-1392.
- Информация о назначении Precedex™.
 https://www.hospira.com/en/images/EN-4271_tcm81-92504.pdf.
https://www.hospira.com/en/images/EN-4271_tcm81-92504.pdf. - Махмуд М., Мейсон К.П.: Дексмедетомидин: обзор, обновление и будущие соображения относительно педиатрического периоперационного и перипроцедурного применения и ограничений. Бр Дж. Анаст 2015; 115:171–182.
- Хризостому С., Санчес-де-Толедо Дж., Уэрден П., Йоост Э.Х., Лихтенштейн С.Е., Каллахан П.М., Суреш Т., О’Мэлли Э., Шидерли Д., Хейни Дж., Йошида М., Орр Р., Муньос Р., Морелл В.О.: Периоперационное использование Применение дексмедетомидина связано со снижением частоты желудочковых и наджелудочковых тахиаритмий после врожденных операций на сердце.
 Энн Торак Сург 2011; 92: 964-972.
Энн Торак Сург 2011; 92: 964-972. - Sanders RD, Xu J, Shu Y, Januszewski A, Halder S, Fidalgo A, Sun P, Hossain M, Ma D, Maze M: Дексмедетомидин ослабляет индуцированные изофлураном нейрокогнитивные нарушения у новорожденных крыс. Анестезиология 2009;110:1077-1085.
- Сандерс Р.Д., Сан П., Патель С., Ли М., Мейз М., Ма Д.: Дексмедетомидин обеспечивает корковую нейропротекцию: влияние на вызванный анестезией нейроапоптоз в развивающемся мозге крыс.Acta Anaesthesiol Scand 2010;54:710-716.
- Liao Z, Cao D, Han X, Liu C, Peng J, Zuo Z, Wang F, Li Y: пути JNK и P38 MAPK участвуют в защите дексмедетомидином от индуцированного изофлураном нейроапоптоза в гиппокампе новорожденных крыс.
 Brain Res Bull 2014; 107: 69-78.
Brain Res Bull 2014; 107: 69-78. - Li Y, Zeng M, Chen W, Liu C, Wnag F, Han F, Zuo Z, Peng S: Дексмедетомидин частично снижает индуцированный изофлураном нейроапоптоз за счет сохранения пути PI3K/Akt в гиппокампе новорожденных крыс. ПЛоС Один 2014; е93639.
- Liu JR, Yuki K, Baek C, Han XH, Soriano SG: нейроапоптоз, вызванный дексмедетомидином, зависит от его кумулятивной дозы.Анест Аналг 2016; 123:1008-1017.
- Pancaro C, Segal BS, Sikes RW, Almeer Z, Schumann R, Azocar RJ, Marchand JE: Дексмедетомидин и кетамин демонстрируют различные модели клеточной дегенерации и апоптоза в развивающемся мозге новорожденных крыс.
 J Matern Fetal Neonatal Med 2016;29:3827-3833.
J Matern Fetal Neonatal Med 2016;29:3827-3833. - Пилотное исследование T REX: исследование использования альтернативного анестетика у младенцев. Клинические испытания.gov. https://clinicaltrials.gov/ct2/show/NCT02353182?term= TREX&rank=4; NCT02353182.
- Tourrel F, de Lendeu PK, Abily-Donval L, Chollat C, Marret S, Dufrasne F, Compagnon P, Ramdani Y, Dureuil B, Laudenbach V, Gonzalez BJ, Jégou S: Антиапоптотическое действие ремифентанила на незрелый мозг мыши: исследование ex vivo.Анест Аналг 2014; 118:1041-1051.
- Фаза I исследования болюса и инфузии дексмедетомидина в корригирующей детской кардиохирургии: безопасность и фармакокинетика.
 Клинические испытания.gov. https://clinicaltrials.gov/ct2/show/NCT01915277?term=andropoulos&rank=2; NCT01915277.
Клинические испытания.gov. https://clinicaltrials.gov/ct2/show/NCT01915277?term=andropoulos&rank=2; NCT01915277. - Веб-сайт Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США: http://www.fda.gov/Drugs/DrugSafety/ucm532356.htm; по состоянию на 23 декабря 2016 г.
- Андропулос Д.Б., Грин М.Ф.: Анестезия и развивающийся мозг: последствия предупреждения FDA. N Engl J Med 2017; 376: 905-907.
- Бони О.
 , Белл М., Белл Н., Конквест А., Камберс М., Дрейк С., Голсуорси М., Гат Дж., Грокотт М.П., Харрис Э., Хауэлл С., Ингольд А., Натансон М.Х., Пинкни Т., Меткалф Л.: Определение приоритетов исследований в области анестезии и периоперационный уход: окончательный отчет совместного партнерства Национального института академической анестезии и Альянса Джеймса Линда.BMJ Open 2015;5:e010006.
, Белл М., Белл Н., Конквест А., Камберс М., Дрейк С., Голсуорси М., Гат Дж., Грокотт М.П., Харрис Э., Хауэлл С., Ингольд А., Натансон М.Х., Пинкни Т., Меткалф Л.: Определение приоритетов исследований в области анестезии и периоперационный уход: окончательный отчет совместного партнерства Национального института академической анестезии и Альянса Джеймса Линда.BMJ Open 2015;5:e010006.
Автор Контакты
Dean B. Andropoulos, MD, MHCM
Кафедра анестезиологии, Медицинский колледж Бейлора
6621 Fannin, W 17417
Houston, TX 77030 (США)
Электронная почта dra@bcm005u
Информация о статье / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 07 июня 2017 г.
Дата выпуска выпуска: январь 2018 г.
Количество печатных страниц: 11
Количество фигурок: 4
Количество столов: 2
ISSN: 1015-3837 (печать)
eISSN: 1421-9964 (онлайн)
Для получения дополнительной информации: https://www.karger.com/FDT
Авторское право / Дозировка препарата / Отказ от ответственности
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам.Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Общая анестезия
Состояние седации, анальгезии, амнезии и мышечного паралича называется общей анестезией.Другими словами, общая анестезия представляет собой индуцированную, обратимую и контролируемую потерю сознания. Это состояние необходимо для выполнения хирургических процедур, которые в противном случае вызвали бы мучительную боль и потенциально вызвали бы стрессовую реакцию организма. Это, в свою очередь, может препятствовать попыткам хирургического лечения пациента и чаще всего приводит к травмирующим воспоминаниям пациента.
Анестезиолог делает ингаляционную анестезию в маске. Изображение предоставлено: Фаустасян / Shutterstock
Механизм действия общей анестезии не совсем ясен.Однако известно, что сигналы по нервам, ответственным за прохождение стимулов, прерываются и не обрабатываются центральной нервной системой после введения общего анестетика.
Пациенты, находящиеся под общей анестезией, не могут вспомнить, что происходило во время операции, и их не возбуждают болевые раздражители. Проще говоря, пациенты погружаются в глубокий сон, не осознавая, что происходит вокруг них или происходит с ними. Кроме того, им требуется защита дыхательных путей и/или искусственная вентиляция легких, поскольку паралич мышц препятствует адекватной спонтанной вентиляции.Гемодинамические процессы — еще одна группа ключевых клинических параметров, которая изменяется при введении больного в наркоз. Обычно это вторичный эффект препаратов, используемых для индукции или поддержания общей анестезии, которые могут вызывать депрессивные или стимулирующие сердечно-сосудистые последствия.
Процесс
Общая анестезия начинается с премедикации пациента. Это лекарство, которое вводят перед операцией с целью расслабить пациента и, возможно, вызвать амнезию, чтобы у него не осталось воспоминаний о том, что он даже вошел в операционную.Бензодиазепины чаще всего используются для премедикации. Другие агенты используются в зависимости от потребностей, которые являются уникальными для пациента. Например, пациент с риском гастроэзофагеального рефлюкса может получать антациды как часть премедикации.
После премедикации пациенту вводится индукционная анестезия, которая, как можно сказать в просторечии, отвечает за усыпление пациента. Анестезиолог (то есть врач-специалист, ответственный за введение анестезии) следит за тем, чтобы у пациента были безопасные дыхательные пути, все физиологические мониторы работали должным образом, а поддерживающие и реанимационные средства были под рукой.Внутривенные (IV) агенты, такие как пропофол, пары анестетиков или их комбинация, могут использоваться для индукции анестезии. Анальгетики (обезболивающие) также назначаются в большинстве случаев в дополнение к индуктору.
Как только действие препаратов, применяемых для индукции анестезии, начинает ослабевать, необходимы поддерживающие препараты. Эта поддерживающая фаза является стабильной во время анестезии, и препараты можно вводить теми же путями, что и препараты для индукции (т. е. внутривенно или ингаляционно).К концу операции анестезиолог начинает уменьшать вводимую дозу этих поддерживающих препаратов или может полностью отменить их. Для отмены мышечно-расслабляющих препаратов используются специальные препараты, а пациенту вводят анальгетики для уменьшения послеоперационной боли. Искусственная поддержка дыхательных путей удаляется после того, как пациент продемонстрировал адекватную спонтанную вентиляцию легких.
Анестезия — Общий наркоз Игра
Преимущества и недостатки общей анестезии
Наиболее очевидным преимуществом является устранение сенсорной способности чувствовать боль во время хирургической процедуры, которая в противном случае была бы невыносимой.Это полезно не только для пациента, но и для хирурга, которому в противном случае было бы трудно справиться с физиологической реакцией организма на стресс. Эта реакция может вызвать значительную заболеваемость и смертность, если не будет превентивно проведена общая анестезия. Амнезия необходима для уменьшения и/или устранения интраоперационных воспоминаний, потому что средний человек не в состоянии выдержать мысль о том, что его разрезают или разрезают, несмотря на то, что он этого не чувствует и не видит. Этот опыт может впоследствии стать источником очень неприятных воспоминаний.
Общая анестезия легко и быстро вводится, является обратимой и может использоваться при операциях непредсказуемого масштаба.
С другой стороны, некоторые недостатки общей анестезии заключаются в том, что она может вызывать побочные эффекты, такие как тошнота, рвота, головная боль и задержка восстановления нормального функционирования памяти. Анестезиологам иногда приходится иметь дело с резкими колебаниями физиологических параметров, когда пациент находится под общей анестезией. Одним из наиболее серьезных, но, к счастью, редких осложнений, связанных с общей анестезией, является злокачественная гипертермия (наследственное заболевание, вызывающее гиперкалиемию, метаболический ацидоз, гиперкарбию и летальное повышение температуры тела в ответ на реакцию на анестетик).
Ссылки
Дополнительное чтение
Общий наркоз | healthdirect
Что такое общий наркоз?
Общая анестезия используется для того, чтобы вы потеряли сознание, чтобы вы не чувствовали боли, не двигались и не осознавали во время операции.
Каковы преимущества общей анестезии?
Общие анестетики используются для более крупных операций. Вы спите, чтобы хирург мог оперировать дольше или оперировать разные части тела одновременно.Они могут быть даны быстро и могут быть обращены вспять. Однако не всем можно делать общий наркоз.
Альтернативой общему анестетику является местная анестезия, которая вызывает онемение только на небольшой части тела, или регионарная анестезия, которая вызывает онемение в определенной области или области тела.
Лучший анестетик для вас зависит от предстоящей вам процедуры и ваших индивидуальных обстоятельств. Вы можете обсудить это со своим врачом или анестезиологом перед операцией.
Как делается общий наркоз?
Обычно перед операцией вы встречаетесь с анестезиологом.Это может быть за несколько дней до операции или за час до операции.
Ваш анестезиолог спросит вас о вашем здоровье и о том, как вы справлялись с анестезией в прошлом. Они также могут спросить о лекарствах, которые вы принимаете, есть ли у вас аллергия и курите ли вы.
Вы должны предоставить любую медицинскую информацию, которую вы можете получить от предыдущего анестезиолога.
Ваш анестезиолог может объяснить вам операцию, а также то, что может пойти не так.Они могут попросить вас подписать форму, известную как форма согласия, в которой говорится, что вы согласны на операцию и понимаете все о ней. Если да, то сейчас самое время задать все вопросы, которые вас, возможно, интересовали.
Ваш анестезиолог может также назначить анализы, чтобы подготовить вас к операции.
Вам могут посоветовать:
- какие лекарства следует и не следует принимать до и в день операции
- что можно есть и пить перед операцией
Любые вопросы или опасения следует обсуждать со своим врачом или анестезиологом.
Во время операции
Общий анестетик обычно вводят в вену, обычно на тыльной стороне ладони, через тонкую пластиковую трубку, называемую канюлей. В качестве альтернативы его можно давать в виде газа, который вы вдыхаете через маску.
Во время операции анестезиолог будет контролировать уровень вашего сознания, температуру, дыхание и кровяное давление. При необходимости количество анестетика можно отрегулировать.
После операции
Когда вы проснетесь от анестезии, вы почувствуете сонливость.Вас может тошнить. Вероятно, вы окажетесь в помещении, известном как комната восстановления. Медсестра будет следить за вами. Вам могут понадобиться лекарства, чтобы уменьшить тошноту или боль.
Если вы находитесь в больнице, вас переведут обратно в вашу кровать, как только вы полностью проснетесь.
Если вы отправляетесь домой после дневной операции, вы должны подождать, пока не придете в полное сознание и не будете готовы. Вы не должны ехать домой после анестезии. Лучше договориться с кем-нибудь, чтобы забрать вас или помочь добраться до дома.Лучше всего, если вы будете с кем-то в течение следующих 24 часов после операции, чтобы они могли присматривать за вами.
Каковы риски и побочные эффекты общей анестезии?
Возможные риски и побочные эффекты включают тошноту и рвоту, телесные повреждения, такие как повреждение зубов или нервов, боль в горле или реакции на лекарства. В крайне редких случаях пациенты могут потерять зрение или умереть из-за общей анестезии.
Некоторые люди боятся, что во время операции могут быть в сознании или чувствовать боль.Ваш анестезиолог будет следить за вами на протяжении всей операции, чтобы этого не произошло.
Если вас беспокоят риски и побочные эффекты, поговорите со своим анестезиологом перед операцией.
Искусство анестезии | Science Museum
Когда химики 19-го века исследовали традиционные растения, используемые для успокоения, они обнаружили, что многие активные ингредиенты происходят из одной и той же группы химических веществ, которые они назвали алкалоидами.
Морфин был одним из первых алкалоидов, выделенных из опийного мака.Belladonna и Mandragora содержали нервно-паралитическое вещество под названием атропин, а листья коки давали кокаин.
К концу 19 века аптекари и врачи использовали очищенные алкалоиды в качестве сильных седативных средств и местных анестетиков. Очищенный кокаин был одним из первых местных анестетиков, использовавшихся, в частности, для глазных операций.
Синтетический наркотик Прокаин был получен из кокаина в 1905 году в качестве местного анестетика без эйфорического и вызывающего привыкание эффекта кокаина. Он был более известен под торговой маркой новокаин и широко применялся в стоматологии.
«Веронал» использовался для лечения психических заболеваний и в качестве снотворного. Байер, Германия, 1903-1950 гг.
В начале 20 века был разработан другой класс соединений, названных барбитуратами. «Веронал» был первым коммерчески доступным барбитуратом, продаваемым с 1903 года,
. В 1934 году был синтезирован барбитурат, названный тиопенталом натрия. Это был кратковременный, но быстродействующий анестетик, который широко использовался на начальном этапе общей анестезии, чтобы привести пациента в бессознательное состояние.Во время Второй мировой войны его использовали в качестве сыворотки правды из-за его гипнотических свойств. Это также часть коктейля из наркотиков, используемых для смертной казни в Соединенных Штатах и для эвтаназии в Европе.
Кураре — это вещество на растительной основе, традиционно используемое коренными жителями Южной Америки для отравленных стрел. Это также основа препарата, используемого в хирургии.
В 1942 году два канадских исследователя, Гриффит и Хон, использовали его для разработки миорелаксанта для мышц живота и диафрагмы, чтобы хирурги могли выполнять сложные операции на грудной и брюшной полости.Без него потребовались бы опасно высокие уровни общей анестезии с сопутствующим риском ухудшения кровообращения и дыхания.
Общая анестезия у детей
Фарм США . 2006;8:HS15-HS27.
Педиатрическая популяция очень динамической группы больных, поскольку физиологические процессы, определяющие Характер претерпевает быстрые изменения по мере взросления и взросления детей. Следовательно Применение фармакологических препаратов у детей требует особого внимания. соображения. 1,2 При проведении общей анестезии лекарства детям, четкое понимание физиологических, фармакологические и психологические различия между детьми и взрослыми неотъемлемая часть хорошего ухода за больными. 3 В этой статье обсуждается принципы, риски и осложнения, связанные с общим педиатрическим анестезия. Большое внимание уделяется различным фармакологическим агентам. используется для анестезии педиатрических больных.
Педиатрическая фармакокинетика
По сравнению со взрослыми, младенцы и маленькие дети по-разному реагируют на
препараты для анестезии из-за многих факторов, включая состав тела,
связывание белков, температуру тела, распределение сердечного выброса и
функциональной зрелости печени и почек. 3,4
Компоненты тела (жир, мышцы и вода) меняется с возрастом. Общее количество воды в организме значительно выше у недоношенных у доношенных детей, чем у доношенных, и выше у доношенных, чем у детей ясельного возраста.Кроме того, с возрастом увеличивается содержание жира и мышц. Эти изменения могут существенно влияет на фармакокинетику некоторых лекарственных средств. Следовательно, водорастворимые препараты, имеющие большие объемы распределения (например, сукцинилхолин) требуют больших начальных доз у новорожденных. Так же, препараты, которые зависят от перераспределения в жир для прекращения действия (например, тиопентал) имеют более длительный клинический эффект у новорожденных.
У новорожденных снижены показатели печени и функцию почек и связывание с белками по сравнению с детьми более старшего возраста, которые обычно имеют зрелую функцию почек и печени и нормальные значения белка для взрослых.В Кроме того, большая часть сердечного выброса направляется в печень и почки. у детей старшего возраста, чем у младенцев. Следовательно, метаболизм и экскреция действие многих лекарств, таких как морфин, замедляется у новорожденных, что приводит к длительному период полувыведения. 3 Большинство лекарств имеют пролонгированное действие период полувыведения у недоношенных и доношенных детей, укороченный период полувыведения у дети старше 2 лет до раннего подросткового возраста и удлиненный период полувыведения у подростков, приближающихся к взрослой жизни. 3
Температурный режим важен в детской анестезии. Маленькие дети имеют непропорционально большое тело площади поверхности, и потери тепла преувеличены во время анестезии, особенно во время индукции анестезии, если это активно не предотвращается. 4 Гипотермия, особенно у новорожденных, замедляет метаболизм и выведение анестетиков, а также может усиливать нервно-мышечную блокаду. 5
Общая анестезия
Периоперационный период (непосредственно до, во время и после операции)
особенно критическое время для педиатрических пациентов.При общей анестезии,
Лекарства притупляют физиологические реакции и делают пациентов неосведомленными о том, что
делается с ними или вокруг них. Повышенный риск заболеваемости и смертности
в периоперационном периоде требует максимальной бдительности. Такие риски могут быть
повышается при некоторых болезненных состояниях. 5 В таблице 1 перечислены конкретные
состояния и их анестезиологические осложнения. 5-7
Целью общей анестезии является подавлять сознательное восприятие и физиологический ответ на вредные раздражения и привести пациента в бессознательное состояние.Это делается с помощью обезболивания (уменьшение боли), амнезия (притупление сознания), акинезия (предотвращение движения), физиологическая поддержка (поддержание сердечно-сосудистой функции, управление, электролитный контроль и терморегуляция) и бдительность. 5
Перед анестезией все дети должны пройти преданестезиологическое обследование, включающее краткий анамнез, запись о медицинской аллергии и физикальное обследование с акцентом на дыхательных путей, легких и сердечной деятельности.Кроме того, семейный анамнез относительно реакции на анестетики, аллергию на лекарства и случаи внезапной смерти интраоперационно или послеоперационная гипертермия должны быть получены. У детей которые ранее получали общую анестезию, следует задать вопросы относительно осложнений. 5 Во время этой оценки клиницисты следует приложить все усилия, чтобы ребенок придерживался рекомендуемых рекомендации по предоперационному голоданию. См. Таблица 2 для обсуждения этих методические рекомендации. 5,6
Преднаркозная фаза: Основное внимание на этом этапе уделяется обеспечению того, чтобы пациент прибыл в операционной в спокойной/расслабленной манере, без нарушения дыхания и/или нарушение сердечно-сосудистого статуса. 2,5 Различные классы лекарств можно назначать детям (например, седативные средства, анальгетики, антихолинергические средства, блокаторы гистамина) в преданестезиологической фазе. 2
Индукционная фаза: Общая анестезия может быть вызвана либо ингаляционно, либо внутривенно (в/в). лекарства. В большинстве случаев предпочтительны летучие анестетики. у детей старше IV лекарства, потому что они не требуют доступа IV. IV Медикаменты для индукции анестезии у детей используются только в редких случаях. обстоятельств (например, пациент подвержен риску злокачественной гипертермии [ЗГ]). Однако, как только ребенок заснет и будет установлен внутривенный доступ, дети обычно получают препараты для анестезии внутривенно. 5,7
Индукция вдоха начинается с пациент вдыхает через лицевую маску большой поток газа (от 5 до 7 л/мин кислород), который обычно смешивают с закисью азота. Однажды состояние эйфории достигается (от 60 до 90 секунд), обычно добавляется летучий ингаляционный агент во вдыхаемую газовую смесь. Эта комбинация, приводящая к бессознательному в течение 30–60 секунд позволяет ребенку продолжить самостоятельное дыхание. 5
Фаза технического обслуживания: Эта фаза является периодом между индукцией и появлением.В течение этого времени, ребенок должен спать, не ощущая боли, не реагируя ни на движения или гемодинамические ответы на болевые раздражители и гомеостатически поддерживаемые. Анестезия обычно поддерживается закисью азота, ингаляционным анестетик и наркоз для интраоперационной анальгезии. Бензодиазепин может быть добавлены к режиму либо во время премедикации, либо во время операции для дополняют гипноз и амнезию. Мышечные блокаторы применяют при мышечной нужен паралич. 5
В некоторых случаях анестезия можно поддерживать только летучими анестетиками. Однако это безопасно только тогда, когда дыхательные пути безопасны и проходимы, желудок пуст, ребенок старше 6 месяцев, а продолжительность процедуры менее один час. 5
Обратный этап: летучие ингаляционные агенты быстро покидают легкие во время вентиляции и, таким образом, не требуют от других продуктов обратного действия.Однако некоторые нервно-мышечные блокаторы обычно необходимо отменить с помощью ингибитор ацетилхолинэстеразы. 5 Как правило, последствия других агенты (например, наркотики, бензодиазепины, внутривенные снотворные), используемые в целом анестезия может быть продлена, но обычно ее не нужно отменять. 2
Летучие ингаляционные агенты
Пять летучих ингаляционных агентов коммерчески доступны в США.
Состояния: десфлуран, севофлуран, изофлуран, энфлуран и галотан.Десфлуран, севофлуран и изофлуран чаще всего используются в
педиатрическая клиническая практика. 1,2 Галотан является прототипом
педиатрический ингаляционный агент; однако его использование резко сократилось
с появлением изофлурана и севофлурана. Энфлуран используется редко.
у детей. 5
Преимущества летучих анестетики включают быстрое начало действия, быстрое прекращение действия и удобный путь введения. Доставка.Кроме того, летучие анестетики обеспечивают обезболивание и амнезия. Однако все эти продукты (в той или иной степени) являются дыхательными путями. раздражители и могут вызвать ларингоспазм, задержку дыхания, кашель и слюноотделение у детей. 5,8
Все летучие вдохи препараты угнетают вентиляцию и расширяют суженную бронхиальную мускулатуру. 2,5 Они также часто вызывают апноэ и гипоксию у недоношенных детей и новорожденные; таким образом, эти анестетики обычно не используются у детей младшего возраста. чем 6 месяцев.Наконец, летучие продукты вдыхания могут вызывать нежелательные сердечно-сосудистые эффекты (например, снижение сердечного выброса, снижение содержания кислорода родоразрешение, периферическая вазодилатация, цереброваскулярная дилатация и снижение выброса фракция), которые могут негативно повлиять на анестезию. 5
Галотан хорошо растворяется в тканей и, следовательно, связано с медленным началом и окончанием Эффект и восстановление. Пациенты, получающие галотан, имеют повышенный риск аритмии и гепатотоксичности.Следовательно, галотан редко используется в педиатрия сегодня. 9 Агенты, более приятные для дыхания и которые быстрее вызывают анестезию, заменили галотан в клинической практике. упражняться. 2
Изофлуран поддерживает сердечный выброс и церебральная перфузия лучше, чем галотан. Это также меньше респираторного депрессант, чем галотан. Выход из анестезии изофлураном довольно гладко и быстрее, чем с галотаном.Изофлуран обладает острым и значительным раздражитель дыхательных путей с недопустимо высокой частотой ларингоспазма; поэтому его не следует использовать для индукции анестезии. Поскольку изофлуран не подходит для индукции, индукция севофлураном и поддерживающая терапия с изофлураном, является обычной практикой педиатрической анестезии. 5
Десфлуран имеет самый низкий уровень газов в крови. коэффициент растворимости (0,42) всех летучих анестетиков; следовательно, десфлуран связан с быстрым началом и прекращением эффекта и восстановление. 2 К сожалению, десфлуран (как и изофлуран) является сильнодействующим раздражает дыхательные пути и не может быть использован для индукции анестезии. 5 Потому что десфлуран имеет низкую растворимость в жире/крови, он в основном используется для поддержания анестезии при более длительных процедурах, потому что меньше препарата накапливается в толстый. 2
Севофлуран гораздо менее едкий. чем изофлуран и десфлуран, и имеет низкий коэффициент распределения газов крови, как десфлуран. 2 Кроме того, севофлуран, по-видимому, меньше гемодинамических эффектов, чем у галотана, и профиль дыхательной эффекты при 1 минимальной альвеолярной концентрации (МАК), по-видимому, аналогичны. (См. Таблица 3 для обсуждения MAC.) Появление севофлурана довольно стремительный. Основное применение севофлурана — индукция анестезии у детей. Метаболизм севофлурана приводит к образованию свободного фторида, который может вызвать повреждение почек; поэтому FDA ограничило использование севофлюрана менее чем двумя ПДК. часов, желательно со скоростью потока свежего газа более 2 л/мин. 5
В/в анестетики
Анестезия может быть вызвана и поддерживаться как болюсами, так и
непрерывные инфузии внутривенных анестетиков. Внутривенные анестетики включают
барбитураты, опиоидные наркотики, бензодиазепины и другие продукты
(например, кетамин, пропофол). Внутривенные анестетики вызывают анестезию больше
быстрее, чем ингаляционные препараты, и с меньшим количеством осложнений. С другой стороны,
должен быть установлен внутривенный катетер, и, если доступ к внутривенному доступу уже не получен,
Ингаляционная индукция может оставаться предпочтительным путем.Для детей, прибывающих в
операционной с внутривенным доступом, внутривенная индукция должна быть рутинной, потому что это
быстро переводит ребенка из состояния бодрствования в состояние наркоза с меньшим гемодинамическим и
кардиореспираторный компромисс. 5
Барбитураты обычно назначают детям для премедикации и индукции анестезия. 10 Важно отметить, что барбитураты не обеспечить обезболивание. 5 Как правило, новорожденным требуются более низкие дозы в мг/кг барбитуратов, чем дети старшего возраста; а детям старшего возраста требуется больше мг/кг дозы барбитуратов, чем у взрослых. 10 Тиопентал, пентобарбитал и метогекситал являются наиболее часто используемыми барбитуратами в детская анестезия. 3,5,10
Тиопентал, наиболее часто используемый барбитуратов в педиатрической анестезии, также угнетает дыхание, вызывает апноэ и может вызвать гипотензию у пациентов с гиповолемией. Тиопентал обычно мало влияет на функцию миокарда и при эуволемическом, хорошо ребенок является полезным анестезирующим агентом индукции.Индукция от 3 до 5 мг/кг тиопентал обычно вызывает 5-10-минутную потерю сознания в течение секунды. 5
Пентобарбитал также можно использовать для седативный эффект у детей. Это мощный респираторный депрессант, особенно в в сочетании с наркотиками и бензодиазепинами. Пентобарбитал не идеал препарат для седации при непродолжительных процедурах из-за его длительного действия действие. 5
Метогекситал похож на тиопентал и имеет сходный с тиопенталом спектр угнетения дыхания. 5 Проблемы, связанные с внутривенным введением метогекситала, жжение, икота, апноэ и экстрапирамидоподобные движения. Следовательно, IV метогекситал редко используется для индукции анестезии. Метогекситал больше обычно вводится ректально для индукции анестезии. 10
Опиоиды широко используются в практика детской анестезии и педиатрической периоперационной медицины; Oни обеспечивают обезболивание болезненных процедур и снижают частоту постпроцедурная боль. 5,11 Поскольку опиоиды подавляют диоксида углерода, вызывают апноэ и являются респираторными депрессантами, их использование должны тщательно контролироваться, особенно когда они применяются с другими средства, угнетающие дыхание (например, ингаляционные анестетики, барбитураты, бензодиазепины). 5 Морфин и фентанил являются наиболее часто используемыми Опиоиды в педиатрической анестезии. 11
Морфин является анальгетиком длительного действия. препараты, обеспечивающие эффективное обезболивание. 11 Потому что морфин может вызвать бронхоспазм (вторичный по отношению к высвобождению гистамина), его следует использовать с осторожностью у детей, страдающих бронхиальной астмой. 5 Обычная внутривенная доза морфина составляет от 0,1 до 0,2 мг/кг. 8,11 Эквивалентные дозы мг/кг Морфин обеспечивает гораздо более высокие концентрации в крови у новорожденных, чем у детей старшего возраста. детей, при этом концентрация в плазме примерно в три раза выше, чем у Взрослые. Это связано с длительным периодом полувыведения (14 часов) у новорожденных по сравнению со взрослыми (два часа). 5 К 2-месячному возрасту, значения клиренса для морфина достигают значений для взрослых. 11 Из-за длительная активность и гемодинамическая нестабильность, индуцированная морфином, фентанилом в значительной степени заменил морфин в общей анестезии. 5
Фентанил (который в 80-100 раз выше более мощный, чем морфин) считается наиболее часто используемым опиоидом в педиатрии. анестезия. 3,5,11 Обладает меньшей продолжительностью действия и более стабильный гемодинамический профиль, чем у морфина. 3,5 Эффективное обезболивание анестезию фентанилом можно обеспечить болюсно от 2 до 3 мкг/кг. с последующей непрерывной инфузией от 1 до 3 мкг/кг/час. 5
Другие синтетические опиоиды — суфентанил, также доступны альфентанил и ремифентанил. Суфентанил (от восьми до в 10 раз сильнее, чем фентанил) используется в основном в педиатрической кардиологии. случаи. Ремифентанил (по эффективности аналогичен фентанилу) считается опиоид ультракороткого действия. 5,11,12 Используется при необходимости анестезии быстро индуцироваться. 5 Поскольку основное наркотическое действие ремифентанил заканчивается так быстро, что необходимо использовать дополнительные анальгетики, чтобы обеспечить послеоперационное обезболивание. 12 Альфентанил (что в 5-10 раз больше менее эффективен, чем фентанил, но имеет более быстрое начало действия) повышенная частота мышечной ригидности, судорог и длительной дыхательной недостаточности. депрессии по сравнению с фентанилом и поэтому редко используется в педиатрии. анестезия. 5,11
Бензодиазепины вызывают гипноз, анксиолиза, седации и амнезии и обладают противосудорожной активностью. В большем дозах они вызывают угнетение дыхания и апноэ; они синергичны с наркотики и барбитураты в их угнетающем дыхании действии. Большинство обычно используемым бензодиазепином в педиатрической анестезии является мидазолам. Это мощное снотворное-анксиолитическое-противосудорожное средство и примерно в четыре раза больше сильнее, чем диазепам.В анксиолитических дозах мидазолам внутривенно (0,15 мг/кг) не оказывает влияет на частоту дыхания, частоту сердечных сокращений или артериальное давление и обеспечивает отличная предоперационная седация, часто сопровождающаяся амнезией. 5 Мидазолам можно вводить перорально, назально, ректально и внутримышечно. Применение перорального мидазолама в дозе от 0,5 до 1 мг/кг (максимально 20 мг), смешанный со сладким сиропом, вызывает анксиолиз примерно в 90% случаев. детей. 5,8
Пропофол имеет очень быстрое начало действия и связано с уменьшением частоты послеоперационной тошноты и рвоты.Пропофол считается наиболее часто используемым средством для внутривенной индукции в педиатрии. анестезия. 2,5,13 Как и в случае тиопентала, индукционная доза уровень пропофола выше у более молодых пациентов (2,9 мг/кг для детей младше 2 лет). лет), чем у пожилых пациентов (2,2 мг/кг для пациентов от 6 до 12 лет). возраст). Пропофол связан с болью при внутривенном введении, особенно при мелкие вены. Всего 0,2 мг/кг лидокаина (в смеси с пропофолом) был эффективен в уменьшении этого дискомфорта. 3 После индукции анестезии, пропофол считается полезным средством для поддержания гипноза и амнезия. Его можно использовать в качестве единственного анестетика при безболезненных процедурах. В сочетании с наркотиками пропофол обеспечивает превосходную кратковременную анестезию для болезненные процедуры. Пропофол не следует применять у детей младше 12 лет. лет для длительной седации из-за риска серьезных последствия (например, гемодинамический коллапс, метаболический ацидоз, сердечная недостаточность, глубокий шок и смерть).Кроме того, применение пропофола в течение длительного седация в условиях интенсивной терапии также не рекомендуется. 5
Кетамин, который имеет быстрое начало и короткая продолжительность действия, вызывает центральную диссоциацию, оказывая анальгезии и амнезии. 3,5,10 Индукция 2 мг/кг кетамина обычно вызывает от 15 до 30 минут потери сознания в течение нескольких секунд. 5 Кетамин также можно вводить ректально в дозе 10 мг/кг или перорально в дозе 6–10 мг/кг. мг/кг или интраназально в дозе от 3 до 6 мг/кг для индукции анестезии. 3,5 Кетамин существенно не влияет на артериальное давление и/или сердечный выброс. Поскольку кетамин увеличивает секрецию, антихолинергические обычно необходимы лекарства (например, атропин, гликопирролат). 2,5 Сны и галлюцинации являются наиболее распространенными побочными эффектами, связанными с кетамин: от 5% до 10% детей препубертатного возраста и от 30% до 50% детей старшего возраста испытать на себе этот неблагоприятный эффект. 2,10 Управление бензодиазепин одновременно с кетамином снижает частоту сновидений и галлюцинации. 2,5 Противопоказания к применению кетамина при детей включают наличие активной инфекции верхних дыхательных путей, повышенное внутричерепное давление, открытое повреждение глазного яблока и наличие психические или судорожные расстройства. 5
Нервно-мышечные блокаторы
Миорелаксанты используются главным образом в качестве дополнения к общему лечению.
анестезия для облегчения эндотрахеальной интубации и поддержания мышц
расслабление во время операции. 2,5 Важно отметить, что
нервно-мышечные блокаторы не оказывают известного влияния на сознание или боль
порог. Миорелаксанты классифицируют по типу действия.
производимые блокады (деполяризующие по сравнению с недеполяризующими) и их продолжительность
действия (например, ультракороткое, короткое, среднее, длинное). 2 Таблица 4 предоставляет информацию о нервно-мышечных блокаторах, которые
чаще всего используется в педиатрии.
Действия недеполяризующих миорелаксанты прекращают свое действие спонтанно по мере повышения концентрации в плазме крови. снижение или купирование ингибиторами антихолинэстеразы (например, неостигмином). К сожалению, ингибиторы антихолинэстеразы могут вызывать нежелательные холинергические побочные эффекты, включая брадикардию, бронхоконстрикцию и слюноотделение. Следовательно, антихолинергические средства (например, атропин, гликопирролат) обычно назначают вместе с ингибиторами антихолинэстеразы. чтобы свести к минимуму холинергические побочные эффекты. 2
В декабре 2005 года Институт Организация Safe Medication Practices (ISMP) выпустила предупреждение о безопасности под названием «Парализован Ошибки», в котором предупреждалось о непреднамеренном назначении нервно-мышечной блокады. агентов для пациентов, которые не получают поддержку вентилятора. В предупреждении отмечено что некоторые пациенты умерли или получили необратимые травмы в результате эти ошибки. Чтобы уменьшить этот тип ошибок, ISMP предлагает, чтобы здравоохранение средства обеспечивают:
• Ограниченный доступ к
миорелаксанты, допускающие использование напольного покрытия только в операционной,
отделение неотложной помощи и отделения интенсивной терапии;
• Раздельное хранение, хранение коробок с этими агентами отдельно друг от друга.
холодильники и на полках;
• Обязательные предупреждающие этикетки на флаконах, шприцах, инфузионных пакетах и коробках.
это состояние: «Предупреждение: парализующее вещество — вызывает остановку дыхания»;
• процесс двойной проверки перед введением; и
• Немедленное удаление агентов после экстубации пациента. 14
Осложнения, связанные с
Общая анестезия
Осложнения, связанные с общей анестезией, можно разделить на четыре
основные категории: послеоперационная тошнота и рвота (ПОТР), травма полости рта,
нарушения терморегуляции и кардиореспираторные осложнения. 5,6
ПОНВ является наиболее распространенной проблемой связанных с общей анестезией. По оценкам, от 40% до 50% детей опыт ПОТР после получения общей анестезии.ПОТР может возникать в ближайший послеоперационный период, через один-два часа после операции или несколько часов после операции. Стресс и травма хирургии и рвота воздействие анестетиков и наркотических анальгетиков, скорее всего, вызывает ПОНВ. 5 Существует множество продуктов, которые могут предотвращать и/или лечить ПОТР. Антагонисты серотонина (например, ондансетрон, доласетрон, гранисетрон) считаются препаратами первой линии при ПОТР. Их можно использовать для лечения и/или для предотвращения ПОНВ.Исследования показывают, что добавление дексаметазона к серотонину антагонист еще больше снижает частоту ПОТР. метоклопрамид в/в (от 0,1 до 0,2 мг/кг до 10 мг) также является эффективным и безопасным противорвотным средством как для профилактика и лечение ПОТР. Применение дроперидола, который когда-то был считается золотым стандартом в лечении ПОТР, снизилась значительно в последние годы из-за того, что продукт, даже при низком уровне дозы, может вызвать удлинение интервала QTc (скорректированный QT) и/или желудочковую тахикардию пуанты. 3
Травмы полости рта встречаются относительно часто. после общей анестезии. Введение или удаление эндотрахеальной трубки может раздражать горло, вызывая боль в горле и/или охриплость. В редких В некоторых случаях травма зубов может также произойти из-за введения и/или удаления трубка. 6
ЗГ – это наследственное заболевание, которое вызван летучими анестетиками и/или сукцинилхолином. Обычно это возникает в течение первых двух часов после анестезии, но может продолжаться до 24 часов. позже.ЗГ характеризуется развитием внезапной и быстрой высокой лихорадки. (от 38,5°C до 46°C, повышение на 1°C каждые пять минут), мышечная ригидность, ацидоз, и сердечные аритмии. Поскольку ЗГ может привести к летальному исходу, агрессивная терапия гарантировано. Лечение ЗГ включает прекращение вдыхания всех летучих веществ. препараты, коррекция метаболического ацидоза и лечение внутривенным введением дантролена (от 2,5 мг/кг до 10 мг/кг). Все фармацевты, особенно работающие в отделения интенсивной терапии и операционные, должны быть знакомы с восстановление и введение дантролена внутривенно.
По словам Дональда Дэвиса, доктора медицины, Анестезиолог Детского центра здравоохранения Атланты, «Пациенты, испытывающие ЗГ часто требуют очень больших доз дантролена внутривенно в течение короткого времени. период времени. Это может быть очень сложно с точки зрения времени и рабочей силы. поскольку восстановление дантролена внутривенно может быть очень трудоемким». Дэвис отмечает, что во время таких кризисных ситуаций фармацевты должны немедленно начать воссоздание дантролена внутривенно и продолжать, пока не будет указано иное. 15 После того, как у человека диагностирован ЗГ, его родственники должны быть проверены на предмет определить, есть ли у них расстройство. 2,3,5
Кардиореспираторные осложнения (например, угнетение дыхания, гипертония, аритмии, сердечные приступы, инсульт) также может быть результатом общей анестезии. К счастью, эти проблемы встречаются крайне редко и чаще всего связаны с хирургическими осложнениями. 3,5,6
Предотвращение передозировки
Американец
Комитет Академии педиатрии по наркотикам (COD) отмечает, что дети, как правило,
особенно чувствителен к передозировке при анестезии.( Таблица 5 перечислены рекомендации ХПК по предотвращению чрезмерной седации у детей. 16 ) Следовательно, обеспечение безопасной седации у детей требует навыков
и организация ресурсов для предотвращения тяжелых негативных исходов у пациентов.
Пульсоксиметрия считается единственным наиболее полезным прибором для мониторинга
обнаружение надвигающихся опасных для жизни событий. Пульсоксиметрия, в частности
тип, обеспечивающий слышимое изменение тона при изменении насыщенности, должен
быть обязательным для каждого пациента седация перед процедурой, потому что это обеспечивает
раннее предупреждение о развитии кислородной десатурации.Кроме того, оба врача
при проведении анестезии и в послеоперационном периоде всегда следует
иметь соответствующие реверсивные агенты (например, налоксон, флумазенил) в их
утилизация. 17
Заключение
Фармацевты должны
поощряться к активному подходу к управлению «наименьшими из
больных» в периоперационном периоде, особенно при наблюдении за побочными
эффектов и побочных реакций на лекарства.Чтобы сделать это более эффективно,
Фармацевты должны иметь представление о физиологических, фармакологических и
психологические различия между детьми и взрослыми в отношении
фармакология анестезии.
ССЫЛКИ
1. Блахо К., Уинбери
S, Merigian K. Фармакологические соображения для педиатрического пациента. Оптом Клин . 1996;5:61-90.
2. Кода-Кимбл М.А.,
Янг Л.И. и соавт. Прикладная терапия: клиническое использование лекарств .8 изд.
Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 2005.
3. Миллер Р.Д., Куккьяра
РФ и др. Анестезия. 6-е изд. Филадельфия, Пенсильвания: Черчилль Ливингстон; 2005.
4. Мотояма Э.К., Дэвис
Пи Джей. Анестезия Смита для младенцев и детей . 7-е изд.
Филадельфия, Пенсильвания: Mosby Elsevier Science; 2006.
5. Берман Р.Е., Клигман
РМ, Дженсон HB. Учебник педиатрии Нельсона . 17-е изд. Филадельфия,
PA: Elsevier Science; 2004.
6. Американская академия
Педиатрия. Обследование и подготовка педиатрических пациентов, перенесших
анестезия. Педиатрия . 1996; 98 (3 pt 1): 502-508.
7. Эттингер А.Б.,
Девинский О. Лечение эпилепсии и сопутствующих заболеваний . Бостон:
Баттерворт-Хайнеманн; 2002: 155-173.
8. Такетомо К.К., Ходдинг
JH, Краус ДМ. Справочник по дозированию для детей . 10-е изд. Хадсон, Огайо: Лекси
Комп, Инк.; 2003.
9.Голембиевский Я.
Соображения по выбору ингаляционного анестетика: тематические исследования. Ам Дж
Здоровье-Сист Фарм . 2004;61(доп.4):S10-S17.
10. Григорий Г.А. Детская анестезия . 4-е изд. Филадельфия, Пенсильвания: Черчилль Ливингстон;
2002.
11. Яблонка Д. Х., Дэвис
Пи Джей. Опиоды в педиатрической анестезии. Anesthesiol Clin Северная Америка. 2005; 23:621-634.
12. Холлингер И.
Современные тенденции детской анестезии. Гора Синай J Med . 2002;69:51-54.
13. Соединение AANA-ASA
заявление о приеме пропофола. 14 апреля 2004 г. Доступно по адресу:
www.asahq.org/news/propofolstatement.htm.
14. Парализован
ошибки: предотвращение ошибок с помощью миорелаксантов. ISMP
Предупреждение о безопасности лекарств. 22 сентября 2005 г. Доступно по адресу:
www.ismp.org/Newsletters/acutecare/articles/20050922.asp. Доступ 14 апреля,
2006.
15. Интервью с
Дональд Дэвис, MD.14 апреля 2006 г.
16. Анон. Методические рекомендации
для наблюдения и ведения пациентов детского возраста во время и после седации
для диагностических и лечебных процедур: Доп. Педиатрия .
2002; 110:836-838.
17. Кот СиДжей, Ноттерман
Д.А. и др. Нежелательные явления седации в педиатрии: критический анализ инцидентов
способствующих факторов. Педиатрия . 2000;105:805-814.
Чтобы прокомментировать эту статью, свяжитесь с редактор@usфармацевт.ком.
.
 При применении данные вещества блокируют нервно-мышечные импульсы, что приводит к полной утрате дыхательной способности
. Такое состояние представляет опасность для детей и взрослых.
При применении данные вещества блокируют нервно-мышечные импульсы, что приводит к полной утрате дыхательной способности
. Такое состояние представляет опасность для детей и взрослых.




 Любой анестетик приводит к увеличению нагрузки на организм, замедляет работу всех органов.
Любой анестетик приводит к увеличению нагрузки на организм, замедляет работу всех органов.

 Совместно применяются искусственная вентиляция легких и интубация трахеи.
Совместно применяются искусственная вентиляция легких и интубация трахеи.

 J Neurosci 2003; 23:876-882.
J Neurosci 2003; 23:876-882. Анестезиология 2009;110:796-804.
Анестезиология 2009;110:796-804. , Сориано С.Г., Лепке А.В.: Нейротоксичность анестетика. Anesthesiol Clin 2014;32:133-155.
, Сориано С.Г., Лепке А.В.: Нейротоксичность анестетика. Anesthesiol Clin 2014;32:133-155. Дж., Бекке К., де Грааф Дж., Гирибальди Г., Хабре В., Хансен Т., Хант Р.В., Инг С., Лепке А., Макканн М.Е., Ормонд Г.Д., Пини Прато А., Сальво И., Сан Л., Вутскиц Л., Уокер С., Disma N: Анестезия и развивающийся мозг: путь вперед для клинических исследований.Педиатр Анаст 2015; 25: 447-452.
Дж., Бекке К., де Грааф Дж., Гирибальди Г., Хабре В., Хансен Т., Хант Р.В., Инг С., Лепке А., Макканн М.Е., Ормонд Г.Д., Пини Прато А., Сальво И., Сан Л., Вутскиц Л., Уокер С., Disma N: Анестезия и развивающийся мозг: путь вперед для клинических исследований.Педиатр Анаст 2015; 25: 447-452.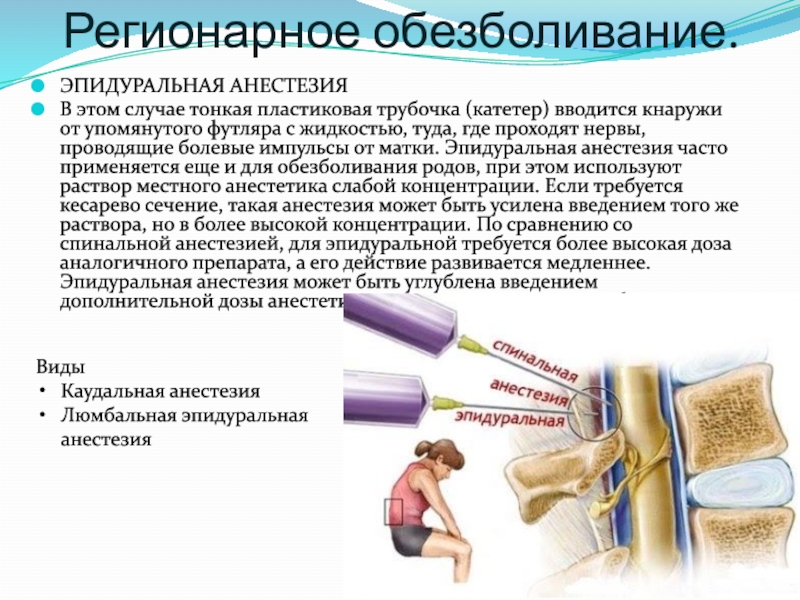 Д., Хасселл Дж., Дэвидсон А.Дж., Робертсон Н.Дж., Ма Д.: Влияние анестетиков и хирургии на развитие нервной системы: обновление. Br J Anaesth 2013; 110 (дополнение 1): i53-i72.
Д., Хасселл Дж., Дэвидсон А.Дж., Робертсон Н.Дж., Ма Д.: Влияние анестетиков и хирургии на развитие нервной системы: обновление. Br J Anaesth 2013; 110 (дополнение 1): i53-i72.
 Acta Anaesthesiol Scand 2014;58:1121-1126.
Acta Anaesthesiol Scand 2014;58:1121-1126. Br J Anaesth 2010; 105 (дополнение 1): i61-i68.
Br J Anaesth 2010; 105 (дополнение 1): i61-i68. К., Мортон Н.С., Кристенсен К. Успеваемость в подростковом возрасте после пластики паховой грыжи в младенчестве: общенациональное когортное исследование.Анестезиология 2011;114:1076-1085.
К., Мортон Н.С., Кристенсен К. Успеваемость в подростковом возрасте после пластики паховой грыжи в младенчестве: общенациональное когортное исследование.Анестезиология 2011;114:1076-1085. , Барбур К.С., Бен-Цур Д., Казарян Н.Э., Ли Д.Ю., Шен Дж.Р., Лю Э., Бенивал Г.С., Ламмерс Ч.Р., Хиноны З., Аггарвал А., Седарс Э., Йонелинас А.П. , Ghetti S: Влияние общей анестезии в младенчестве на долговременную память распознавания у людей и крыс.Нейропсихофармакология 2014;39:2275-2287.
, Барбур К.С., Бен-Цур Д., Казарян Н.Э., Ли Д.Ю., Шен Дж.Р., Лю Э., Бенивал Г.С., Ламмерс Ч.Р., Хиноны З., Аггарвал А., Седарс Э., Йонелинас А.П. , Ghetti S: Влияние общей анестезии в младенчестве на долговременную память распознавания у людей и крыс.Нейропсихофармакология 2014;39:2275-2287. Ланцет 2016; 387: 239-250.
Ланцет 2016; 387: 239-250. https://www.hospira.com/en/images/EN-4271_tcm81-92504.pdf.
https://www.hospira.com/en/images/EN-4271_tcm81-92504.pdf. Энн Торак Сург 2011; 92: 964-972.
Энн Торак Сург 2011; 92: 964-972. Brain Res Bull 2014; 107: 69-78.
Brain Res Bull 2014; 107: 69-78. J Matern Fetal Neonatal Med 2016;29:3827-3833.
J Matern Fetal Neonatal Med 2016;29:3827-3833. Клинические испытания.gov. https://clinicaltrials.gov/ct2/show/NCT01915277?term=andropoulos&rank=2; NCT01915277.
Клинические испытания.gov. https://clinicaltrials.gov/ct2/show/NCT01915277?term=andropoulos&rank=2; NCT01915277.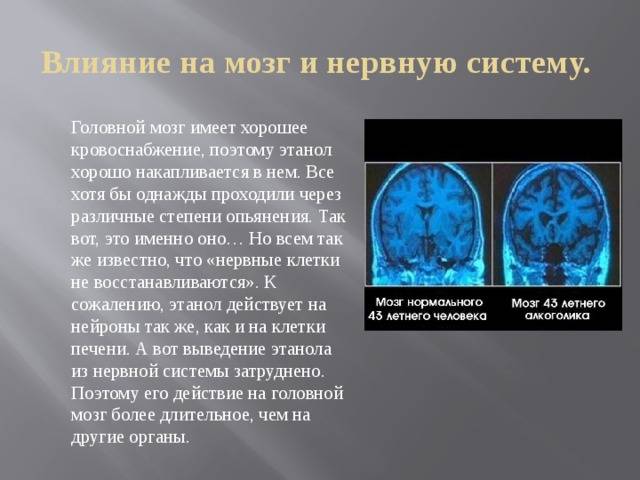 , Белл М., Белл Н., Конквест А., Камберс М., Дрейк С., Голсуорси М., Гат Дж., Грокотт М.П., Харрис Э., Хауэлл С., Ингольд А., Натансон М.Х., Пинкни Т., Меткалф Л.: Определение приоритетов исследований в области анестезии и периоперационный уход: окончательный отчет совместного партнерства Национального института академической анестезии и Альянса Джеймса Линда.BMJ Open 2015;5:e010006.
, Белл М., Белл Н., Конквест А., Камберс М., Дрейк С., Голсуорси М., Гат Дж., Грокотт М.П., Харрис Э., Хауэлл С., Ингольд А., Натансон М.Х., Пинкни Т., Меткалф Л.: Определение приоритетов исследований в области анестезии и периоперационный уход: окончательный отчет совместного партнерства Национального института академической анестезии и Альянса Джеймса Линда.BMJ Open 2015;5:e010006.