Липолитики для живота. Мед. центр Ланта.
Каждая женщина мечтает иметь стройную, подтянутую фигуру. И не всегда удается самостоятельно с помощью диет, физических упражнений достичь желаемых результатов. А порой в силу бешеного ритма современной жизни, на спорт, просто нет времени. И тут за помощью можно обратиться к косметологам, у которых сегодня в арсенале имеется еще одно оружие в вечном бою за стройность — инъекции липолитиков! С помощью липолитической терапии можно быстрее и эффективней приближаться к поставленной вами цели – красивая, подтянутая фигура! Чтобы не разочароваться в методике, необходимо понимать, что применение липолитиков, это не замена диете и не способ похудеть. Это метод коррекции контуров тела, и работает он локально, к примеру, там, где никак не худеется.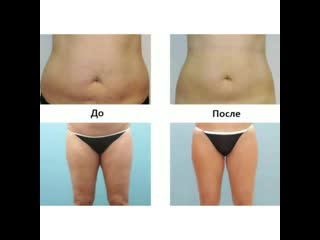
В организме человека постоянно происходят процессы синтеза и распада. В норме они находятся в состоянии равновесия, но в некоторых случаях один из процессов может преобладать над другим. Под воздействием липолитиков происходит активизация процесса липолиза-распада жиров до жирных кислот. Чтобы образовавшиеся продукты обмена не вернулись в изначальное состояние, в состав липолитиков входят вещества, активизирующие микроциркуляцию и стимулирующие выведение жирных кислот с помощью кровеносной и лимфатической систем. Применение липолитиков может помочь уменьшить слой жировой ткани на 4-6 см.
Перечислим липолитики, которые используют специалисты м. ц Ланта:
Акваликс (Aqualyx).
Препарат в виде геля, в состав которого входит дезоксихолат натрия (основное вещество) и трехмерный полимер галактозы (носитель). Полимер галактозы связывает молекулы основного вещества, но после введения препарата в организме происходит постепенное растворение носителя и освобождение дезоксихолата натрия. Это вещество растворяет жир и клеточную мембрану жировой клетки. Гелевая структура способствует равномерному распределению действующего вещества под кожей, что исключает появление бугорков и неровностей. Курс состоит из 2-3 процедур (количество сеансов зависит от зоны коррекции). Повторяют его по показаниям.
Полимер галактозы связывает молекулы основного вещества, но после введения препарата в организме происходит постепенное растворение носителя и освобождение дезоксихолата натрия. Это вещество растворяет жир и клеточную мембрану жировой клетки. Гелевая структура способствует равномерному распределению действующего вещества под кожей, что исключает появление бугорков и неровностей. Курс состоит из 2-3 процедур (количество сеансов зависит от зоны коррекции). Повторяют его по показаниям.
Дермастабилон.
В состав препарата входят соли желчной кислоты (дезоксихолат, который выполняет функции детергента) и фосфатидилхолин. Детергент разрушает оболочку жировой клетки, а фосфатидилхолин расщепляет жир и преобразует его в эмульсию. За один курс делают 7-10 процедур, между инъекциями должен быть перерыв 8-10 дней.
INNO-TDS Draining PPC.
Препарат содержит такие вазоактивные компоненты, как экстракт мелилота и артишока, а также рутин, нормализует нарушенное периферическое кровообращение и микроциркуляцию.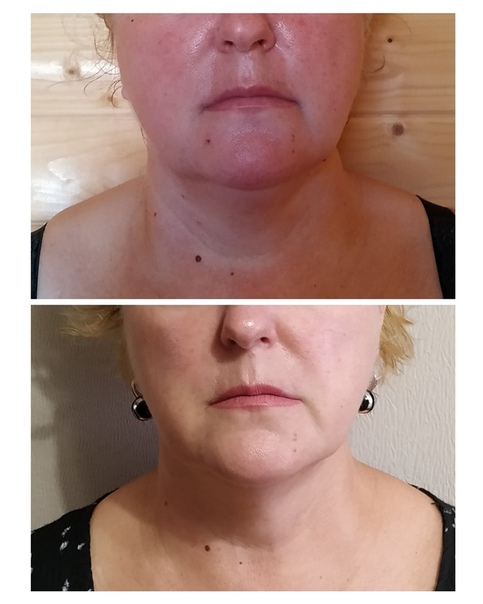 Входящий в его состав органический кремний обладает выраженным дефиброзирующим действием, восстанавливает структуру соединительной ткани, устраняет эффект «апельсиновой корки». За один курс делают 3-5 процедур, в редких случаях может понадобиться 8-10 сеансов между инъекциями должен быть перерыв в 3-4 недели.
Входящий в его состав органический кремний обладает выраженным дефиброзирующим действием, восстанавливает структуру соединительной ткани, устраняет эффект «апельсиновой корки». За один курс делают 3-5 процедур, в редких случаях может понадобиться 8-10 сеансов между инъекциями должен быть перерыв в 3-4 недели.
INNO-TDS Anti-Cellulite.
Препарат представляет собой сочетание активных липоактивных ингредиентов. Он влияет на мобилизацию свободных жирных кислот, что способствует их метаболизму и приводит к увеличению липолиза в связи с увеличением циклических аденозинмонофосфатов (АМФц). За один курс делают 4 процедуры раз в неделю.
Slimming
Препарат содержит L-карнитин который, способствует утилизации жиров, Дезоксихолевую кислоту которая обеспечивает липолиз, клеточной мембраны жировой клетки, фосфатидилхолин растворяет жир с образованием эмульсии. Такая комбинация активных ингредиентов помогает добиться наиболее быстрого эффекта похудения и устранения целлюлита. Препарат так же улучшает состояние кожи: тонизирует, увлажняет. За один курс делают 4 процедуры раз в неделю.
Препарат так же улучшает состояние кожи: тонизирует, увлажняет. За один курс делают 4 процедуры раз в неделю.
Липолитик: худеем от уколов | Блог о косметологии BUYBEAUTY
Процесс похудения мало у кого вызывает приятные эмоции. Мы знаем что для того, чтобы сбросить жир, нужно много потеть в спортзале и правильно питаться. Это проверенный рабочий вариант. А что, если он не единственный? Может быть есть способ попроще?
Конечно же есть. И называется он — инъекции липолитиков. Что это такое и как работает сейчас мы вам и расскажем.
Что такое липолитики?
Это вещества, запускающие процесс липолиза (расщепления жировых клеток). Когда вещество контактирует с жировой клетчаткой, она распадается на более простые структуры, которые потом выводятся из организма через лимфатическую систему.
Уколы липолитики выпускают в двух формах: прямые и непрямые. Первые — мощные вещества, которые способны растворить мембрану жировых клеток. Их применяют чаще всего. Непрямые обычно используют для закрепления результата, так как жировые клетки они не растворяют. Обычно в их состав входят растительные компоненты, которые мягко расщепляют жир.
Их применяют чаще всего. Непрямые обычно используют для закрепления результата, так как жировые клетки они не растворяют. Обычно в их состав входят растительные компоненты, которые мягко расщепляют жир.
*Чаще всего в состав непрямых липолитиков входят экстракт артишока или же кофеин.
Где применяться липолитики?
Чаще всего данные препараты используют для похудения лица. Обычно их колют в подбородок и вокруг овала, а также в лоб или щеки. Этого достаточно для того, чтобы добиться хорошего эффекта.
Липолитики часто применяют для похудения живота, бедер и ног. В этом случае одних инъекций мало. Обычно методику сочетают с другими процедурами, спортом и правильным питанием. Ну и еще очень популярные ягодицы. В эту зону колют непрямые компоненты. Этого достаточно чтобы улучшить состояние кожи, и уменьшить проявления целлюлита. Очень редко запускают процесс липолиза на руках, в области декольте, икрах и шеи.
Лучше всего колоть липолитики в несколько зон сразу, чтобы достичь равномерного похудения. Это одна из немногих процедур, которая действует локально.
Это одна из немногих процедур, которая действует локально.
Преимущества липолитиков для похудения
- Безболезненность: по ощущениям процедура практически так же переноситься, как мезотерапия.
- Быстрый результат: результат виден уже через неделю после сеанса.
- Короткий реабилитационный период: после процедуры в местах уколов обычно появляются небольшие синяки, которые проходят через пару дней.
- Отсутствие сезонности: липолитики можно колоть в любое время года. Только летом нужно тщательно защищать кожу от ультрафиолета.
*Еще часто можно прочесть, что у процедуры нет рисков. Это не так. Подробнее о возможных последствиях ниже.
Как проходит процедура?
Чаще всего перед процедурой кожу просто очищают, а затем делают укол. При желании клиента могут сделать аппликационную анестезию. Саму процедуру проводят курсов из 3-10 сеансов с интервалом 10-14 дней. Мы рекомендуем немножко увеличить интервал, чтобы снизить нагрузку на печень.
Спустя 3-7 дней после сеанса можно провести лимфодренажный массаж, чтобы улучшить лимфоток.
Реабилитационный период
- После процедуры неделю нужно тщательно следить за водным балансом: пить не менее 2 -2.5 л. воды.
- Первые несколько дней лучше отказаться от спиртных напитков, кофе и газированных вод.
- С целью предотвращения отечности нужно делать холодные компрессы.
- Первые несколько дней нужно отказаться от посещения сауны, бассейна, физических нагрузок беречь кожу от УФ излучения. Также, не стоит долго пребывать на холоде, если лимфолитики кололись зимой.
- Если лимфолиики кололи в лицо, то в первый день лучше отказаться от косметики.
Процедура не очень хорошо сочетается с активным образом жизни. Если вы привыкли много ходить, то первые несколько дней после сеанса придется немножко сбавить темп.
Лимфолитики — результат
С помощью лимфолитиков вполне реально похудеть на несколько килограмм, избавиться от 2-4 лишних сантиметров.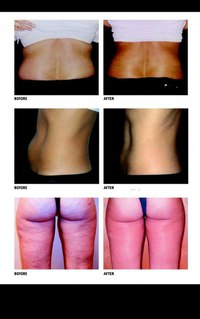
На терапию точно не стоит рассчитывать как на основную. Эффект скорее всего вас разочарует. Но вот в сочетании с другими методиками, лимфолитики вполне могут дать хороший эффект.
*Лучше всего вообще не доверять фото «до — после», так как в большинстве случаев результат преувеличен.
Важные нюансы о лимфолитиках для похудения
1. Отказаться от спорта не получиться
Инъекции разрушают жировые клетки, но они никак не влияют на мышцы. Если вы не занимаетесь спортом, то кожа обвиснет. Это произойдет потому, что мышечный каркас слишком слабый, чтобы поддерживать кожу. Ну и жир сжигается слишком быстро, чтобы кожа могла стянуться до нужных параметров.
2. Риски есть
Кроме противопоказаний есть еще и индивидуальная непереносимость. Или же как ваш организм отреагирует на вводимое вещество(а оно достаточно сильное).
Получается, что риски довольно большие и прежде, чем делать процедуру, нужно все хорошенько взвесить.
3. Процедуру должен проводить врач
Такие препараты должен колоть врач, после ознакомления с анамнезом. Перед процедурой нужно обязательно пройти полное обследование организма + сдать тест на аллергическую реакцию на предполагаемые вещества, которые будут колоть.
4. Результат непредсказуемый
Вполне возможно, что реакцией организма на липолитик будет отторжение. Следовательно, ни о каком похудении не может быть и речи. Этот вариант вполне реален для людей с сильной иммунной системой.
ВЫВОД
Можно ли худеть без боли? Конечно, липолитики дают эффект несмотря на некоторые нюансы. Однако насколько безопасны подобные методики мы не можем ничего сказать. Поэтому, если сомневаетесь — делайте проверенные процедуры. Может быть они и действуют медленно, зато абсолютно безопасные.
Поэтому, если сомневаетесь — делайте проверенные процедуры. Может быть они и действуют медленно, зато абсолютно безопасные.
Липолиптики Prostrolane – инновационные инъекционные препараты нового поколения
Prostrolane – инновационные инъекционные липолитические препараты нового поколения с уникальным составом – пептидами и гиалуроновой кислотой
Коррекция формы тела самым простым и простым способом!
Стимулирует липолиз, омолаживает и восстанавливает упругость кожи.
Пептиды и гиалурон – уникальный состав способствует естественному уменьшению жировых клеток, выводу из организма расслабленных липидов и одновременно стимулирует выработку коллагена, восстанавливает здоровый внешний вид кожи – возникает эффект подтяжки, лифтинга.
- Пептиды нового поколения ингибируют липогенез и способствуют липолизу;
- Продукт не разрушает жировые клетки, как другие липолитики, но эффективно уменьшает количество жировых клеток;
- Уменьшает накопление жировых отложений без каких-либо побочных эффектов на организм;
- После процедуры пептиды оказывают активное действие на жировые клетки – пролонгированную технологию в течение 2 недель.

Липолиптик Prostrolane Inner B – препарат нового поколения с технологией длительного воздействия, содержит 4 биомиметических пептида и гиалуроновую кислоту:
- активные ингредиенты сжигают жир и улучшают состояние кожи, т.е. уменьшают локальные жировые отложения и в то же время восстанавливают кожу, препарат стимулирует фибробласты – происходит выработка нового коллагена;
- улучшает эластичность кожи лица, подчеркивает форму контуров лица, которые вследствие старения кожи потеряли четкие очертания, эластичность и внешний вид. Уменьшает средние и глубокие морщины, иначе называемые «морщинами смеха»;
- расщепляет жиры – уменьшает назолабиальные скопления жира, контурирует линию челюсти, уменьшает двойной подбородок и жир на подбородке, эффективное средство для уменьшения жировых отложений в области плеч, живота, бедер, коленей и ягодиц;
- инъекционный препарат расщепляет жир, активирует синтез коллагена, лечит целлюлит.

На каких проблемных участках тела проводятся процедуры по уменьшению жировых отложений?
Результаты:
Как действует комплекс из 4-х биомиметических пептидов?
Нонапептид-32: стимулирует метаболические процессы гликолиза и глюконеогенеза, смягчает неровности кожи, вызванные целлюлитом;
Пентапептид-43: уменьшает липогенез и способствует липолизу. Уменьшает накопление жировых отложений;
Трипептид-41: стимулирует липолиз и регенерацию тканей, укрепляет кожу;
Октапептид-11: активирует регенерацию клеток, улучшает внешний вид и тонус кожи.
Это липолитики нового поколения, они уменьшают объемы жировой ткани в проблемных зонах и стимулируют синтез коллагена, восстанавливают здоровый внешний вид и упругость кожи. По сравнению с содержащими фосфатидилхолин липолитиками предыдущих поколений, которые не обладали свойствами укрепления кожи и вызвали различные компликации – фиброз и даже некроз тканей, современные липолитики нового поколения Prostrolane не содержат фосфатидилхолина, в их состав входят только активные натуральные ингредиенты – пептиды и гиалуроновая кислота, они не только решают проблему жировых отложений, но также обновляют, укрепляют кожу и не имеют побочных эффектов.
Как действует Prostrolane Inner B?
Соединение пептидов с рецепторами адипоцитарных клеток в препарате Prostrolane Inner B стимулирует каскад, активируя ферментные киназы (AMPK, PKA, ERK). После активации эти ферменты начинают воздействовать на субстраты, активируют липолиз запасов триглицеридов, безопасно снижают размер адипоцитов, тем самым уменьшая жировые отложения в проблемных зонах.
Безопасны ли эти инъекции пептидов и гиалурона?
Пептиды и гиалуроновая кислота, входящие в состав препарата, способствуют липолизу, стимулируют синтез естественного коллагена, при этом непосредственно не влияя на апоптоз клеток и не затрагивая, не повреждая окружающие клетки.
Естественным образом стимулируют метаболизм в проблемных местах, увеличивают окисидацию глюкозы, способствуют движению жиров, превращая их в энергию.
Инъекционный препарат стимулирует регенерацию клеток кожи, улучшает тонус и внешний вид кожи, подтягивает кожу и придает ей упругость.
Как выполняется процедура, это не болезненно?
Инъекция проводится как мезотерапия. После курса процедур явно уменьшатся жировые отложения, и кожа станет более упругой. Уже после первой процедуры видны эффективные результаты.
Процедура не является болезненной, перед ее проведением на кожу наносится обезболивающий крем. Во время процедуры используются специальные маленькие тонкие иглы, препарат вводится небольшими количествами в проблемную жировую ткань, которая должна быть уменьшена.
Сколько процедур потребуется выполнить?
Обычно проводится 3-4 процедуры. Процедура проводится один раз в две недели.
Преимущество – более высокое содержание препарата – в одном шприце 2 мл.
Есть ли постпроцедурный период?
Инъекции биомиметических пептидов не вызывают воспаления, аллергии или боли, нет постпроцедурного периода – вы можете сразу выполнять ежедневную работу, отправляться на встречи или уезжать в планируемый отпуск.
Инъекции PROSTROLANE INNER B Se уменьшают мешки под глазами.
Oбладает липолитическими и лифтинговыми свойствами.
Какова методика проведения процедуры с пептидами и гиалуроном, и каков рекомендуемый курс процедуры?
Шприц содержит препарат гелевой текстуры с пептидами и гиалуроновой кислотой, эффективно уменьшающий мешки и отеки под глазами.
Сколько процедур потребуется провести?
Выполняется 1 процедура каждые две недели. Уже после первой процедуры виден результат. Рекомендуется лечебный курс только из 2 процедур!
Стоимость процедур и количество инъекций зависят от объема проблемной зоны (жировых отложений).
Инъекции Prostrolane Inner воздействуют на процесс естественного липолиза в жировой ткани организма пациента, безопасно и естественно уменьшают количество жира и явно улучшают состояние кожи. Препарат также стимулирует липолиз и подавляет липогенез, тем самым защищая от возвратного эффекта.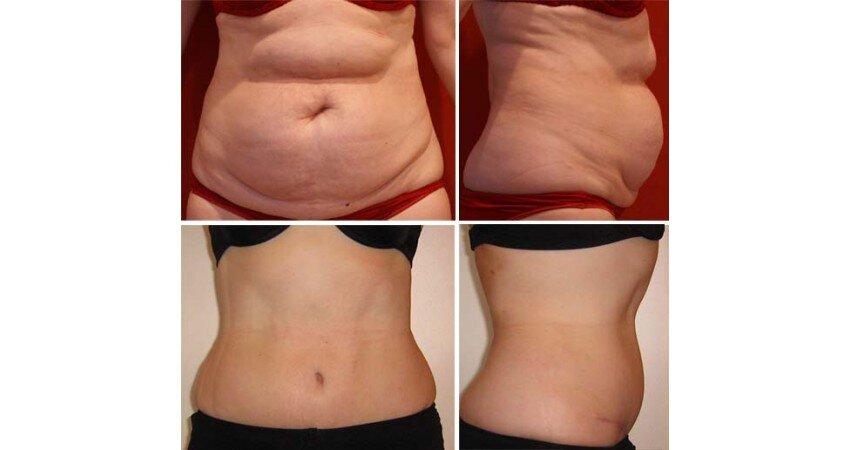
Естественный процесс, который происходит под воздействием пептидов, абсолютно безопасен для Вас. Нет какого-либо побочного эффекта, только небольшой дискомфорт во время процедуры!
Липолитики для лица: все о липолитических растворах!
Инъекционная липосакция: как проходит процедура
Начинается инъекционная липосакция с обработки кожи в области введения препарата антисептическими средствами. Затем на кожу наносится крем или гель с местно-анестезирующим веществом, который уменьшает степень дискомфорта во время процедуры (людям с низким болевым порогом инъекции липолитических растворов могут показаться болезненными).
Для устранения локальных жировых отложений в области лица и шеи (второго подбородка) используется специальная веерная техника инъекций. Веерная техника позволяет равномерно распределить активные компоненты раствора в тканях, добиться равномерного разрушения жировых клеток, получать максимально естественный результат.
Глубина инъекций — важнейший фактор успеха процедуры. Если липолитический раствор используется для коррекции эстетических проблем в области живота или ягодиц, игла обычно вводится на глубину от 10 до 15 миллиметров. При омоложении лица глубина введения препарата всегда определяется индивидуально! Опыт врача косметолога играет здесь решающую роль.
Непосредственно введение липолитического раствора в жировую ткань проблемной зоны продолжается около 20 минут. После завершения инъекций врач-косметолог еще раз обрабатывает кожу лица антисептиком, а затем наносит успокаивающие средства, которые помогут уменьшить воспаление в первые дни после инъекционного липолиза.
Для достижения оптимального результата сеанс инъекционной липосакции нужно повторить от 3 до 8 раз. Каким будет интервал между сеансами, вам скажет врач-косметолог (это зависит от используемого липолитика, зоны коррекции, индивидуальных особенностей пациента).
После процедуры
В первые часы и дни после интралипотерапии может сохраняться воспаление и отек кожи лица в зоне инъекций.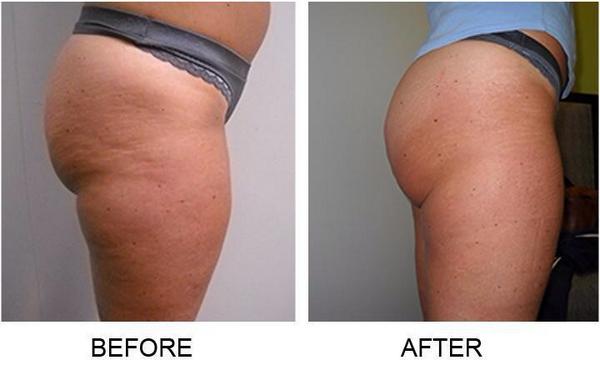 Это нормальная реакция на уколы, не требующая специальной коррекции. Через несколько дней эти симптомы восстановительного периода бесследно исчезнут.
Это нормальная реакция на уколы, не требующая специальной коррекции. Через несколько дней эти симптомы восстановительного периода бесследно исчезнут.
В период проведения курса инъекционного липолиза желательно придерживаться сбалансированного питания. Показаны легкие физические нагрузки, например, длительные прогулки, а вот тепловые процедуры — под запретом. Нельзя загорать в солярии. Следует воздерживаться от спиртного. Ускорить выведение жировой эмульсии из корректируемой зоны поможет массаж, в частности, лимфодренажный.
Противопоказания и ограничения
Интралипотерапия противопоказана при беременности и в лактационном периоде. Ограничением является ожирение третьей или четвертой степени, поскольку у людей с ожирением имеет место общее утолщение подкожной клетчатки; локальное «жиросжигание» приведет к дисгармоничным и неестественным результатам. При наличии на коже лица признаков воспаления (сыпь, покраснение) процедура переносится на другую дату.
Абсолютные противопоказания к процедуре:
- Сахарный диабет 1 и 2 типа, другие заболевания эндокринной системы.

- Онкологическая патология, вне зависимости от локализации новообразования.
- Нарушение свертываемости крови.
- Аутоиммунные заболевания соединительной ткани.
- Хроническая печеночная недостаточность.
- Острые заболевания гепатобилиарной системы, в том числе вирусный гепатит.
- Патология поджелудочной железы (хронический панкреатит).
Узнать больше о процедуре инъекционной липосакции вы можете на консультации врача-косметолога медицинского центра «Галактика» (Москва).
Записаться на приемMезотерапия липолитическим коктейлем в Эс Класс Клиник Саратов по доступной цене
АКЦИЯ! Консультация косметолога БЕСПЛАТНО!
Звоните сейчас по тел. (8452) 33 88 99 или запишитесь на сайте
Многие люди мечтают об идеальной фигуре и прикладывают для достижения цели огромные усилия. Тренажерный зал, сбалансированное питание, активный образ жизни – все это требует не только времени, но и немалых капиталовложений, а ждать результатов можно годами.
Между тем, существует методика коррекции фигуры с помощью мезотерапии, которая позволяет добиться желаемого эффекта в рекордно короткие сроки при минимуме затрат. Достаточно лишь обратиться в косметологический центр, где оказываются подобные услуги.
Что такое мезотерапия тела, и для чего она нужна?Из-за нарушений метаболизма в организме человека начинается процесс формирования лишней жировой ткани. Чтобы избавиться от подобных проблем, можно прибегнуть к услугам тренера по фитнесу либо пластического хирурга, однако в обоих случаях рассчитывать на безупречный результат не приходится. Между тем, мезотерапия, представляющая собой курс инъекций, направлена на то, чтобы сжечь жировые отложения изнутри благодаря активным веществам, которые входят в состав используемых препаратов.
В настоящее время для коррекции фигуры подобным способом используются липолитики – вещества, которые расщепляют жировые отложения и помогают обрести стройность фигуры.
Сама процедура является абсолютно безопасной и при соблюдении всех предписаний специалистов уже после нескольких сеансов дает видимые результаты. Какие проблемы позволяет решить мезотерапия липолитическим коктейлем? Жирорасщепляющая смесь, в состав которой входят натуральные активные вещества, помогает бороться с жировыми отложениями и целлюлитом.
Курс омоложения с помощью мезотерапии: на что можно рассчитывать?Для того, чтобы достичь желаемого результата, необходимо пройти в среднем 5-10 сеансов мезотерапии липолитическим коктейлем. Инъекции выполняются раз в 10-14 дней в наиболее проблемные зоны тела – бедра, ягодицы, живот и спину.
Сама по себе процедура практически безболезненна, а побочные эффекты в виде покраснения и припухлости кожи быстро проходят. При этом уже через 2-3 сеанса слой подкожных жировых отложений заметно истончается, кожа в области инъекций подтягивается, становится более гладкой и ровной.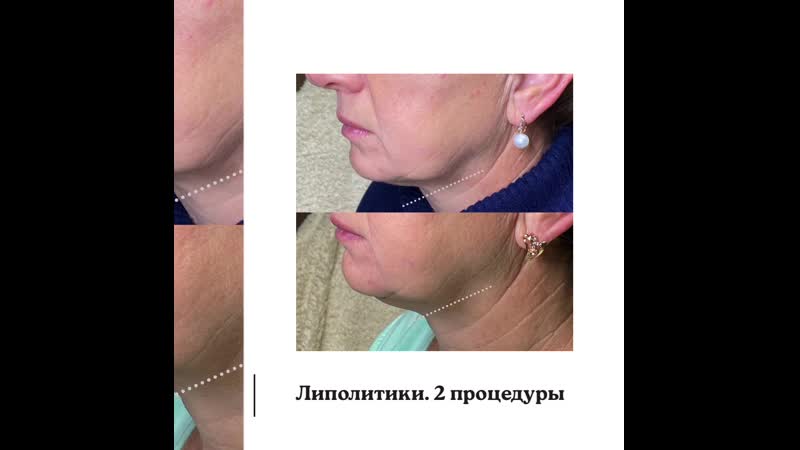 Примечательно, что использование липолитического коктейля не вызывает аллергической реакции и не предусматривает каких-либо ограничений. Вы можете по-прежнему заниматься спортом и использовать дополнительные средства для коррекции фигуры.
Примечательно, что использование липолитического коктейля не вызывает аллергической реакции и не предусматривает каких-либо ограничений. Вы можете по-прежнему заниматься спортом и использовать дополнительные средства для коррекции фигуры.
Более того, специалисты советуют сочетать мезотерапию с миостимуляцией, благодаря чему эффективность инъекций значительно возрастает, а результаты коррекции превосходят все ожидания.
Липолитическая терапия
Под липолитической терапией понимают косметологические инъекции специальными препаратами на основе липолитиков, которые обладают уникальной способностью быстро разрушать клетки жировой ткани. Подкожное введение липолитиков в области лица или тела вызывает интенсивное расщепление жировой ткани, продукты распада которой в течение 7-10 дней естественным образом выводятся из организма. Таким образом, данная процедура позволяет относительно легко, быстро, доступно, а главное, атравматично корректировать проблемные зоны лица и тела.
Избыточная жировая ткань может накапливаться в организме по целому ряду причин. Ее скопления заставляют кожу растягиваться и образуют не эстетичные жировые складки на лице и разных частях тела. Во время проведения инъекционного липолиза именно жировые складки подвергаются микроуколам липолитиками. Введенные под кожу препараты буквально сразу начинают разрушать мембраны жировых клеток, вызывая тем самым их гибель. Это прекрасный метод быстрой и безопасной локальной коррекции контуров лица и фигуры.
В результате липолитической терапии:
- в проблемной зоне исчезают жировые отложения и целлюлит;
- значительно уменьшается ее объем;
- кожа подтягивается и приобретает эластичность и упругость.
Близжайший конкурент инъекционного липолиза — это хирургическая липосакция. Конечно, лилолитическая терапия не позволяет разом избавиться от большого объема жировых отложений, как хирургическая липосакция. Зато ее выгодно отличает полная безопасность, отсутствие серьезных побочных эффектов и достаточно легкая реабилитация.
Не смотря на кажущуюся простору, данная процедура представляет собой хоть и атравматичные, но достаточно серьезные инвазивные манипуляции. Поэтому проводить инъекционный липолиз должен исключительно квалифицированный врач-косметолог, прошедший соответствующую подготовку и знакомый с протоколом использования тех или иных липолитиков. Процедура должна проводиться в условиях специально оборудованного, лицензированного и стерильного кабинета.
Липолитическая терапия противопоказана пациентам с:
- желчнокаменной болезнью;
- онкологическими образованиями;
- любыми хроническими заболевания в стадии обострения;
- аллергией на используемые препараты;
- нарушениями свертываемости крови;
- во время беременности и грудного вскармливания.
Инъекционный липолиз не требует особой подготовки к процедуре. Единственное требование — пациенты, которые принимают антикоагулянты, за две недели до процедуры должны прекратить их прием. А пациенты, которые, наоборот, склонны к образованию гематом и кровоподтеков, за две недели до процедуры должны начать прием препаратов, для укрепления сосудистой стенки.
А пациенты, которые, наоборот, склонны к образованию гематом и кровоподтеков, за две недели до процедуры должны начать прием препаратов, для укрепления сосудистой стенки.
В зависимости от индивидуальных особенностей пациентов и области введения инъекции липолитики вызывают разную чувствительность. Как правило, из-за того, что препарат вводят быстро и на достаточно большой площади, процедура не требует даже местной анестезии. В общей сложности процедура длится не более получаса.
Количество процедур, которые потребуются для достижения желаемого результата врач-косметолог определяет индивидуально, исходя из ряда факторов, основной из которые — это объем жировой ткани, от которой пациент желает избавиться. Эффект от курса липолитической терапии сохраняется от нескольких месяцев до нескольких лет и сильно зависит от индивидуальных особенностей пациента и его образа жизни.
После введения липолитиков в месте проведения инъекции в норме может сохраняться болезненность, покраснение и отек.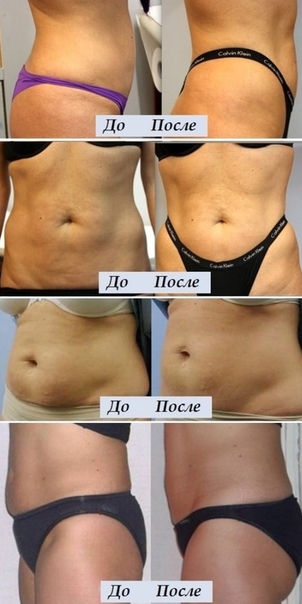 Допустимо появление синяков и гематом. Эти симптомы связаны с механическим повреждением жировой ткани в ходе процедуры, а также с действие препарата внутри ткани. Симптомы постепенно сами сходят на нет в среднем за 1-2 недели.
Допустимо появление синяков и гематом. Эти симптомы связаны с механическим повреждением жировой ткани в ходе процедуры, а также с действие препарата внутри ткани. Симптомы постепенно сами сходят на нет в среднем за 1-2 недели.
К сожалению, редко, но все же встречаются случаи, когда у пациентов после процедуры развиваются: болезненность уплотнений, зуд, нарастающие боль и покраснение, а также повышение температуры. Причиной таких осложнений могут быть аллергическая реакция или внесение инфекции. Появление таких симптомов требует немедленного обращения к врачу, который прописывает прием антигистаминных препаратов или антибиотиков.
Биохимия, липолиз — StatPearls — NCBI Bookshelf
Введение
Липолиз — это метаболический процесс, посредством которого триацилглицеролы (ТАГ) расщепляются посредством гидролиза на составляющие их молекулы: глицерин и свободные жирные кислоты (СЖК). Хранение жира в организме осуществляется за счет жировых ТАГ и используется для получения тепла, энергии и изоляции. Организм использует запасы жира в качестве основного источника энергии во время голодания, сохраняя белок. В целом жиры в количественном отношении являются наиболее важным топливом в организме, и продолжительность времени, в течение которого человек может прожить без пищи, зависит в основном от количества жира, хранящегося в жировой ткани.Таким образом, липолиз особенно важен при метаболизме натощак, когда уровень глюкозы в крови снижается. Однако это также происходит при нестимулированных (базальных условиях) [1].
Организм использует запасы жира в качестве основного источника энергии во время голодания, сохраняя белок. В целом жиры в количественном отношении являются наиболее важным топливом в организме, и продолжительность времени, в течение которого человек может прожить без пищи, зависит в основном от количества жира, хранящегося в жировой ткани.Таким образом, липолиз особенно важен при метаболизме натощак, когда уровень глюкозы в крови снижается. Однако это также происходит при нестимулированных (базальных условиях) [1].
Глицерин, образующийся в результате липолиза, является источником углерода для глюконеогенеза в печени. СЖК транспортируются кровью в связанном виде с альбумином и либо окисляются в тканях в процессе, называемом бета-окислением, либо превращаются в кетоновые тела. Побочные продукты бета-окисления, АТФ и НАДН, способствуют глюконеогенезу.СЖК превращаются в кетоновые тела в печени, которая служит источником энергии для мозга, тем самым снижая дальнейшее потребление уже истощенной глюкозы в крови. СЖК используются во всем организме для производства энергии или путей биосинтеза, за исключением белой жировой ткани (WAT), где они хранятся. В метаболическом «голодном» состоянии, когда организм лишен питательных веществ, WAT высвобождает свободные жирные кислоты и глицерин для снабжения нежировых тканей.[2] Основными ферментами, участвующими в липолизе, являются жировая триглицеридлипаза (ATGL), гормончувствительная липаза (HSL) и моноглицеридлипаза (MGL).
СЖК используются во всем организме для производства энергии или путей биосинтеза, за исключением белой жировой ткани (WAT), где они хранятся. В метаболическом «голодном» состоянии, когда организм лишен питательных веществ, WAT высвобождает свободные жирные кислоты и глицерин для снабжения нежировых тканей.[2] Основными ферментами, участвующими в липолизе, являются жировая триглицеридлипаза (ATGL), гормончувствительная липаза (HSL) и моноглицеридлипаза (MGL).
Основы
Синтез триацилглицеринов
ТАГ, которые обеспечивают организм значительным источником энергии, поступают с пищей или синтезируются эндогенно, в основном в печени. Они транспортируются кровью в виде липопротеинов и запасаются в жировой ткани. Основные классы вовлеченных липопротеинов крови включают липопротеины высокой плотности (ЛПВП), липопротеины промежуточной плотности (ЛПНП), липопротеины низкой плотности (ЛПНП), липопротеины очень низкой плотности (ЛПОНП) и хиломикроны.Хиломикроны подвергаются синтезу в тонком кишечнике и транспортируют пищевые ТАГ из тонкого кишечника в такие ткани, как мышцы и жировая ткань. Печень синтезирует ЛПОНП в печени и таким же образом транспортирует ТАГ из печени в ткани. ЛПВП выполняют множество функций, связанных с метаболизмом липидов, в том числе играют неотъемлемую роль в превращении ЛПОНП в ЛПНП. ЛПВП также служит резервуаром для незаменимых апопротеинов, таких как Аро C-II. Apo C-II активирует липопротеинлипазу, фермент, ответственный за переваривание и расщепление ТАГ.Синтез запасов ТАГ в жировой ткани происходит в сытом состоянии после еды.
Печень синтезирует ЛПОНП в печени и таким же образом транспортирует ТАГ из печени в ткани. ЛПВП выполняют множество функций, связанных с метаболизмом липидов, в том числе играют неотъемлемую роль в превращении ЛПОНП в ЛПНП. ЛПВП также служит резервуаром для незаменимых апопротеинов, таких как Аро C-II. Apo C-II активирует липопротеинлипазу, фермент, ответственный за переваривание и расщепление ТАГ.Синтез запасов ТАГ в жировой ткани происходит в сытом состоянии после еды.
Гидролиз триацилглицерина
Во время лишения энергии WAT стимулируется посредством гомеостатического контроля, чтобы сместиться в сторону более высоких чистых скоростей липолиза. Это изменение состояния питания объясняет этот компенсаторный процесс и регулируется гормональными и биохимическими сигналами. Липолиз протекает упорядоченно и контролируемо, на каждом этапе действуют разные ферменты. Катехоламины являются основными активаторами липолиза, на него также влияют другие гормоны и пищевые соединения. Каждое из этих веществ связывается с соответствующими мембранными рецепторами и воздействует на них, вызывая сигнальный каскад с единственной целью активации HSL. ATGL выполняет первую стадию гидролиза TAG (таким образом, он ограничивает скорость), образуя диацилглицеролы и FFAs. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и свободных жирных кислот. MGL селективен в отношении MG и продуцирует глицерин и третью FFA.
Каждое из этих веществ связывается с соответствующими мембранными рецепторами и воздействует на них, вызывая сигнальный каскад с единственной целью активации HSL. ATGL выполняет первую стадию гидролиза TAG (таким образом, он ограничивает скорость), образуя диацилглицеролы и FFAs. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и свободных жирных кислот. MGL селективен в отношении MG и продуцирует глицерин и третью FFA.
Вопросы, вызывающие озабоченность
Дефектный липолиз в нежировых тканях нарушает их нормальную функцию, приводя к избыточному накоплению ТАГ и болезни накопления липидов.[2] И наоборот, переизбыток СЖК из-за нерегулируемого липолиза приводит к липотоксичности в нежировых тканях. Неспособность упаковать СЖК в липидные капли вызывает хроническое повышение уровня циркулирующих СЖК, что может привести к хроническому воспалению, митохондриальной дисфункции и гибели клеток.[3]
Клеточный
Как описано ранее, гормоны связываются с рецепторами клеточной поверхности (т. е. норадреналин связывается с бета-адренорецепторами) для стимуляции липолиза в адипоцитах. Известно, что ряд белков, связанных с липидными каплями, модулируют скорость базального (нестимулированного) и стимулированного липолиза.Эти белки включают CGI-58 и перилипин. Перилипин является основным белком, обнаруженным в ассоциации с липидными каплями в адипоцитах.[4] В WAT есть два важных механизма, регулирующих липолиз: активация ATGL с помощью CGI-58 и опосредованное протеинкиназой A (PKA) фосфорилирование HSL и перилипина.
е. норадреналин связывается с бета-адренорецепторами) для стимуляции липолиза в адипоцитах. Известно, что ряд белков, связанных с липидными каплями, модулируют скорость базального (нестимулированного) и стимулированного липолиза.Эти белки включают CGI-58 и перилипин. Перилипин является основным белком, обнаруженным в ассоциации с липидными каплями в адипоцитах.[4] В WAT есть два важных механизма, регулирующих липолиз: активация ATGL с помощью CGI-58 и опосредованное протеинкиназой A (PKA) фосфорилирование HSL и перилипина.
В исходном состоянии CGI-58 связан с перилипином, что делает его неспособным связываться с ATGL или активировать его. И ATGL, и HSL находятся в цитозоле.
В состоянии стимуляции β-адренорецепторы сигнализируют аденилатциклазе о выработке цАМФ.Затем цАМФ связывает ПКА, что приводит к повышению активности фермента. Затем PKA фосфорилирует HSL и перилипин, что вызывает перемещение HSL из цитозоля на поверхность липидной капли. Теперь фосфорилированный перилипин высвобождает CGI-58, чтобы он мог связываться с ATGL и активировать его. Подобно HSL, ATGL также должен перемещаться из цитозоля на поверхность липидной капли. Важно отметить, что МГЛ локализуется на поверхности липидной капли, в цитозоле и ЭР независимо от метаболического состояния.[5]
Подобно HSL, ATGL также должен перемещаться из цитозоля на поверхность липидной капли. Важно отметить, что МГЛ локализуется на поверхности липидной капли, в цитозоле и ЭР независимо от метаболического состояния.[5]
Молекулярные
Липиды имеют различную структуру, но все они схожи в том, что они нерастворимы в воде. Жирные кислоты обычно содержат четное число атомов углерода, имеют длину от 16 до 20 атомов углерода и могут быть насыщенными или ненасыщенными (последнее относится к содержанию двойных связей). Они описываются количеством атомов углерода, которые они содержат, и положениями двойных связей, если таковые имеются. Например, арахидоновая кислота имеет 20 атомов углерода и четыре двойные связи и записывается как 20:4, Δ5,8,11,14 или 20:4(ω-6).
Все встречающиеся в природе жирные кислоты имеют двойные связи в цис-конфигурации. Классификация полиненасыщенных жирных кислот часто осуществляется в соответствии с положением первой двойной связи от омега-конца (углерод, наиболее удаленный от карбоксильной группы). Типичными примерами из них являются омега-3 и омега-6 жирные кислоты. Моноацилглицеролы (моноглицериды), диацилглицеролы (диглицериды) и триацилглицеролы (триглицериды) содержат одну, две и три жирные кислоты, этерифицированные в глицерин, соответственно.
Типичными примерами из них являются омега-3 и омега-6 жирные кислоты. Моноацилглицеролы (моноглицериды), диацилглицеролы (диглицериды) и триацилглицеролы (триглицериды) содержат одну, две и три жирные кислоты, этерифицированные в глицерин, соответственно.
Функция
Жирные кислоты переносятся альбумином крови. В таких тканях, как мышцы и почки, жирные кислоты окисляются для получения энергии. В печени жирные кислоты превращаются в кетоновые тела, которые окисляются тканями, такими как мышцы и почки. Во время голодания (после того, как голодание длилось около трех и более дней) мозг использует кетоновые тела для получения энергии. Источником топлива служат кетоновые тела, ацетоацетат и β-гидроксибутират. Печень использует глицерин в качестве источника углерода для глюконеогенеза, который производит глюкозу для тканей, включая мозг и эритроциты.
Механизм
Синтез триацилглицеринов
Они синтезируются двумя способами: (1) из СЖК, образующихся в качестве побочного продукта действия липопротеинлипазы на хиломикроны и ЛПОНП, и (2) из глицериновой части, полученной из глюкозы. В печени и жировой ткани глицерин-3-фосфат (G3P) обеспечивает глицериновую часть. Печень может преобразовывать глицерин в G3P через промежуточное соединение или напрямую, потому что она имеет фермент глицеролкиназу. В жировых клетках отсутствует этот фермент, и они должны продуцировать G3P исключительно через промежуточное соединение.Хранение ТАГ в жировой ткани опосредуется инсулином, который стимулирует жировые клетки к секреции липопротеинлипазы и поглощению глюкозы, которая превращается в глицерин (через промежуточное соединение ДГАП) для синтеза триацилглицерина. В этом процессе глюкоза превращается в DHAP, который восстанавливается NADH с образованием G3P. В конечном итоге G3P реагирует с двумя молекулами жирного ацил-КоА с образованием фосфатидной кислоты. Фосфатная группа отщепляется с образованием диацилглицерина, который реагирует с другим жирным ацил-КоА с образованием триацилглицерина.
В печени и жировой ткани глицерин-3-фосфат (G3P) обеспечивает глицериновую часть. Печень может преобразовывать глицерин в G3P через промежуточное соединение или напрямую, потому что она имеет фермент глицеролкиназу. В жировых клетках отсутствует этот фермент, и они должны продуцировать G3P исключительно через промежуточное соединение.Хранение ТАГ в жировой ткани опосредуется инсулином, который стимулирует жировые клетки к секреции липопротеинлипазы и поглощению глюкозы, которая превращается в глицерин (через промежуточное соединение ДГАП) для синтеза триацилглицерина. В этом процессе глюкоза превращается в DHAP, который восстанавливается NADH с образованием G3P. В конечном итоге G3P реагирует с двумя молекулами жирного ацил-КоА с образованием фосфатидной кислоты. Фосфатная группа отщепляется с образованием диацилглицерина, который реагирует с другим жирным ацил-КоА с образованием триацилглицерина.
Гидролиз триацилглицерина
Как указывалось ранее, во время дефицита энергии WAT стимулируется гормональными и биохимическими сигналами для увеличения липолиза. Липолиз протекает упорядоченно и контролируемо, на каждом этапе действуют разные ферменты. Текущая модель липолиза идентифицирует три основных вовлеченных фермента: ATGL, HSL и MGL. Катехоламины, особенно норадреналин, являются основными активаторами липолиза, вызванного голоданием, в то время как другие гормоны также оказывают влияние.К ним относятся кортизол, глюкагон, гормон роста (GH) и адренокортикотропный гормон (АКТГ).
Липолиз протекает упорядоченно и контролируемо, на каждом этапе действуют разные ферменты. Текущая модель липолиза идентифицирует три основных вовлеченных фермента: ATGL, HSL и MGL. Катехоламины, особенно норадреналин, являются основными активаторами липолиза, вызванного голоданием, в то время как другие гормоны также оказывают влияние.К ним относятся кортизол, глюкагон, гормон роста (GH) и адренокортикотропный гормон (АКТГ).
Пищевые соединения, такие как кофеин и кальций, также стимулируют липолиз. Каждое из этих веществ связывается и действует на свои соответствующие мембранные рецепторы и вызывает сигнальный каскад с использованием общего вторичного мессенджера, циклического АМФ. Затем циклический АМФ связывается с протеинкиназой А (ПКА) и активирует ее. Как только PKA становится ферментативно активным, он фосфорилирует HSL, самый важный из трех ферментов, участвующих в инициировании липолиза, поскольку он ферментативно активируется на всех стадиях гидролиза.ATGL выполняет первую стадию гидролиза ТАГ, образуя диацилглицеролы и ЖК.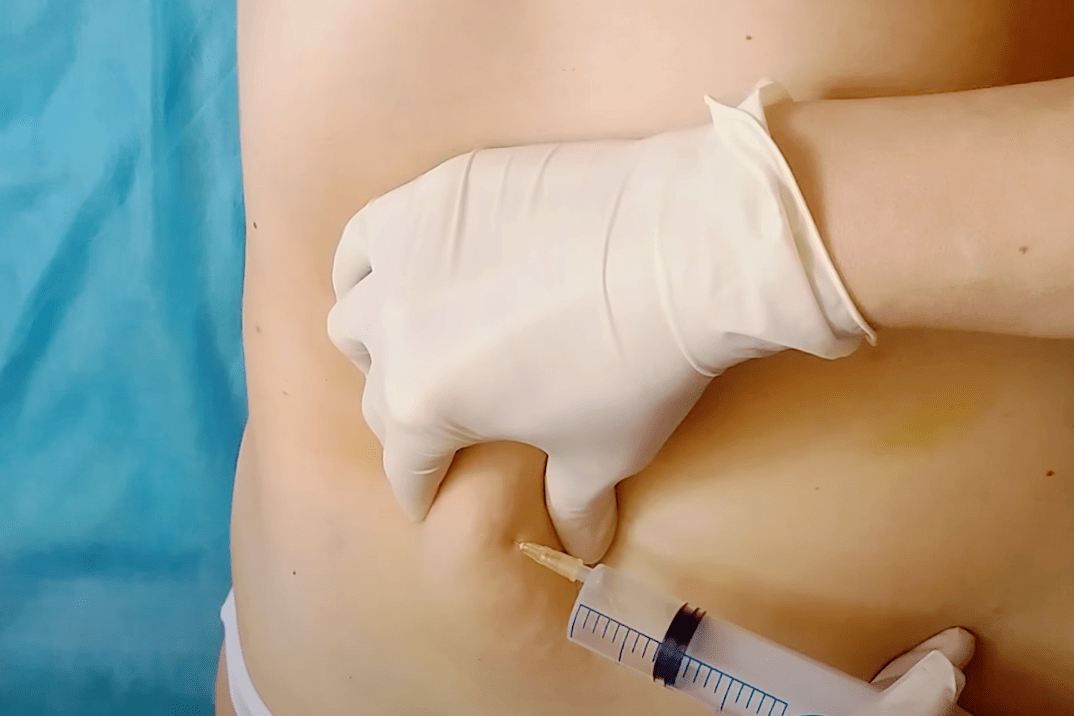 Его активность жестко регулируется двумя вспомогательными белками: CGI-58 и G0S2. CGI-58 коактивирует гидролазную активность ATGL, а G0S2 инактивирует гидролазную активность ATGL. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и ЖК. MGL селективен в отношении MG и образует глицерин и третью ЖК.
Его активность жестко регулируется двумя вспомогательными белками: CGI-58 и G0S2. CGI-58 коактивирует гидролазную активность ATGL, а G0S2 инактивирует гидролазную активность ATGL. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и ЖК. MGL селективен в отношении MG и образует глицерин и третью ЖК.
Метаболизм жирных кислот
Коротко- и среднецепочечные жирные кислоты свободно диффундируют в цитозоль и митохондрии клеток.Жирные кислоты с длинной цепью должны подвергаться опосредованному белком транспорту через клеточную мембрану в цитозоль с помощью транслоказы жирных кислот (FAT) или белка, связывающего жирные кислоты (FABP). Затем ацил-КоА-синтаза превращает жирные кислоты в жирный ацил-КоА. Жирный ацил-КоА теперь должен транспортироваться в митохондрии через внешнюю митохондриальную мембрану, и это делается карнитин-пальмитоилтрансферазой-I (CPT-I), где он превращается в жирный ацил-карнитин. Затем жирный ацил-карнитин транспортируется через внутреннюю мембрану в митохондриальный матрикс с помощью карнитинацил-транслоказы (CAT) и превращается обратно в жирный ацил-КоА с помощью пальмитоилтрансферазы-II (CPT-II), где он теперь готов к окислению.
Бета-окисление
Бета-окисление — это расщепление жирных кислот путем одновременного удаления двух атомов углерода. Это основной путь катаболизма жирных кислот, происходящий в митохондриальном матриксе тканей, таких как печень, мышцы и жировая ткань. Двухуглеродные фрагменты последовательно удаляются с карбоксильного конца жирного ацил-КоА, образуя НАДН, ФАДН и ацетил-КоА, который используется в цикле трикарбоновых кислот для образования АТФ. Жирные кислоты с нечетным числом атомов углерода в конечном итоге дают один моль пропионил-КоА, который превращается в сукцинил-КоА, чтобы его можно было использовать в цикле трикарбоновых кислот.Бета-окисление также важно как первичный регулятор движения через комплекс пируватдегидрогеназы (ПДГ). При высоких скоростях окисления жирных кислот активность ПДГ снижается, что ограничивает гликолиз, что важно, поскольку у пациентов с дефицитом окисления жирных кислот наблюдается компенсаторное увеличение окисления глюкозы и нарушение глюконеогенеза.
Синтез кетона
Уровень кетона низкий при нормальном кормлении и физиологическом состоянии. Они используются сердцем и скелетными мышцами для сохранения ограниченного количества глюкозы для использования мозгом и эритроцитами.Во время голодания жирные кислоты окисляются в печени до ацетил-КоА, который превращается в ацетоацетат и бета-гидроксибутират кетоновых тел. Эти высокие уровни кетонов также ингибируют активность PDH и окисление жирных кислот, чтобы сохранить глюкозу и обеспечить проникновение в мозг, где они могут служить источниками энергии. Обычно во время голодания мышцы метаболизируют кетоновые тела так же быстро, как их высвобождает печень, предотвращая их накопление в крови. Если в крови достаточно кетонов, это может привести к кетоацидозу, который особенно распространен у людей с диабетом I типа и требует тщательного наблюдения.
Тестирование
В настоящее время существует несколько стратегий оценки липолиза, которые обычно делятся на две категории: методы, не основанные на активности, и методы, основанные на активности. Методы, не основанные на активности, включают определение количества связанных ферментов и регуляторных белков. Методы, основанные на активности, включают непосредственное измерение активности ассоциированных ферментов.[2]
Методы, не основанные на активности, включают определение количества связанных ферментов и регуляторных белков. Методы, основанные на активности, включают непосредственное измерение активности ассоциированных ферментов.[2]
За последние несколько лет появилась новая и обновленная информация, и взгляды на липолиз изменились.В настоящее время известно, что измерения экспрессии мРНК или белка, используемого в методах, не основанных на активности, часто недостаточно для оценки способности липолиза. Необходима комбинация методов.[2]
Патофизиология
Болезнь накопления нейтральных липидов с миопатией (NLSDM) – редкое наследственное заболевание, возникающее в результате мутаций в гене ATGL, которое приводит к системному накоплению ТАГ, миопатии, аномалиям сердца и гепатомегалии.[6]
Синдром Чанарина-Дорфмана или NLSD с ихтиозом (NLSD-I) возникает в результате мутаций в CGI-58, активаторе ATGL.Они также проявляют системное накопление ТАГ, легкую миопатию и гепатомегалию, а также ихтиоз, кожное заболевание, характеризующееся сухой, утолщенной, шелушащейся кожей. [6]
[6]
Семейная частичная липодистрофия (FPLD) 4 типа связана с мутацией в гене PLIN1 , кодирующем перилипин 1. Фенотипически она характеризуется потерей подкожного жира на конечностях. Гистологически шесть пациентов с этой мутацией имеют небольшие адипоциты с повышенной инфильтрацией макрофагов и обильным фиброзом.[7]
Семейная парциальная липодистрофия (FPLD) 6 типа возникает из-за мутации в гене LIPE , кодирующем гормончувствительную липазу. Он характеризуется аномальным распределением подкожного жира и, следовательно, осложнениями, обычно связанными с ним. К ним относятся нарушение регуляции липолиза, резистентность к инсулину, сахарный диабет, повышенное накопление жира в органах тела и дислипидемия; у других может даже развиться мышечная дистрофия, на что указывает повышенный уровень креатинфосфокиназы в сыворотке.[8]
Существует множество нарушений метаболизма жиров, которые проявляются серьезными и специфическими характеристиками, но здесь не обсуждаются, поскольку они выходят за рамки липолиза, в частности. К ним относятся, помимо прочего, нарушения окисления жирных кислот (FAOD), такие как дефицит MCAD или первичный дефицит карнитина, и пероксисомальные расстройства, такие как синдром Зеллвегера и адренолейкодистрофия.
К ним относятся, помимо прочего, нарушения окисления жирных кислот (FAOD), такие как дефицит MCAD или первичный дефицит карнитина, и пероксисомальные расстройства, такие как синдром Зеллвегера и адренолейкодистрофия.
Клиническое значение
Изменения липолиза часто связаны с ожирением.Эти изменения включают повышение базальной скорости липолиза, что может способствовать развитию резистентности к инсулину, а также снижение реакции на стимулированный липолиз.[9] Сочетание повышенного липолиза и нарушенного липогенеза в конечном итоге способствует резистентности к инсулину из-за высвобождения цитокинов и липидных метаболитов. Кроме того, в жировой ткани инсулинорезистентных людей наблюдается недостаток белков, участвующих в митохондриальной функции. Митохондриальные источники энергии участвуют в липогенезе в жировой ткани.[10]
Ожирение характеризуется в первую очередь избытком WAT из-за гипертрофии адипоцитов, возникающей в результате повышенного накопления ТАГ.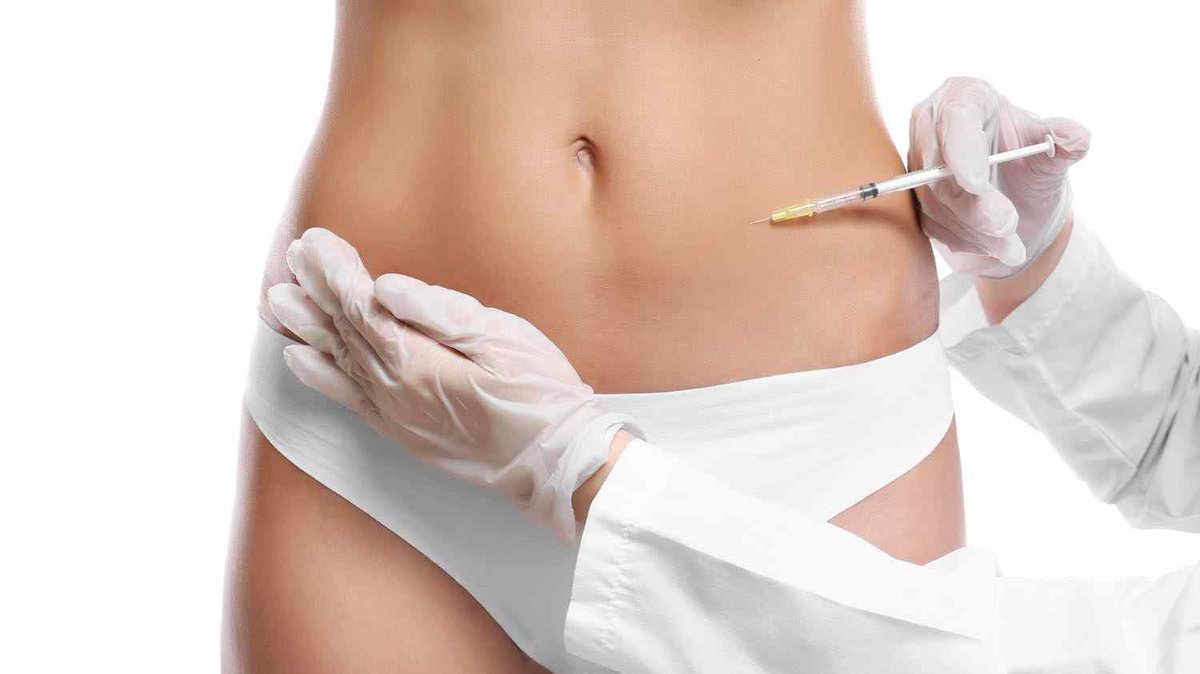 Ожирение является безудержной проблемой здравоохранения во всем мире из-за его связи с рядом заболеваний, включая резистентность к инсулину, диабет II типа, гипертонию и атеросклероз.
Ожирение является безудержной проблемой здравоохранения во всем мире из-за его связи с рядом заболеваний, включая резистентность к инсулину, диабет II типа, гипертонию и атеросклероз.
Ссылки
- 1.
- Bolsoni-Lopes A, Alonso-Vale MI. Липолиз и липазы в белой жировой ткани — обновление. Arch Endocrinol Metab.2015 авг; 59 (4): 335-42. [PubMed: 26331321]
- 2.
- Швайгер М., Эйхманн Т.О., Ташлер У., Циммерманн Р., Цехнер Р., Ласс А. Измерение липолиза. Методы Энзимол. 2014;538:171-93. [Бесплатная статья PMC: PMC4018506] [PubMed: 24529439]
- 3.
- Энгин А.Б. Что такое липотоксичность? Adv Exp Med Biol. 2017;960:197-220. [PubMed: 28585200]
- 4.
- Tansey JT, Sztalryd C, Hlavin EM, Kimmel AR, Londos C. Центральная роль перилипина a в метаболизме липидов и липолизе адипоцитов.Жизнь ИУБМБ. 2004 г., июль; 56 (7): 379–85. [PubMed: 15545214]
- 5.
- Zechner R, Zimmermann R, Eichmann TO, Kohlwein SD, Haemmerle G, Lass A, Madeo F.
 FAT SIGNALS — липазы и липолиз в липидном метаболизме и передаче сигналов. Клеточный метаб. 2012 07 марта; 15 (3): 279-91. [Бесплатная статья PMC: PMC3314979] [PubMed: 22405066]
FAT SIGNALS — липазы и липолиз в липидном метаболизме и передаче сигналов. Клеточный метаб. 2012 07 марта; 15 (3): 279-91. [Бесплатная статья PMC: PMC3314979] [PubMed: 22405066] - 6.
- Ahmadian M, Wang Y, Sul HS. Липолиз в адипоцитах. Int J Biochem Cell Biol. 2010 май; 42(5):555-9. [Бесплатная статья PMC: PMC2835819] [PubMed: 20025992]
- 7.
- Гандотра С., Ле Дур С., Боттомли В., Сервера П., Хирал П., Резник Ю., Шарпантье Г., Оклер М., Делепин М., Баррозу И., Семпл Р.К., Латроп М., Ласколс О., Капо Дж., О’Рахилли С., Magré J, Savage DB, Vigouroux C. Дефицит перилипина и аутосомно-доминантная частичная липодистрофия. N Engl J Med. 2011 24 февраля; 364 (8): 740-8. [Бесплатная статья PMC: PMC3773916] [PubMed: 21345103]
- 8.
- Albert JS, Yerges-Armstrong LM, Horenstein RB, Pollin TI, Sreenivasan UT, Chai S, Blaner WS, Snitker S, O’Connell JR, Gong Д. В., Брейер Р. Дж., Райан А. С., Макленитан Дж. К., Шулдинер А. Р., Шталрид С., Дамкотт К.
 М.Нулевая мутация в гене гормоночувствительной липазы и риск диабета 2 типа. N Engl J Med. 2014 12 июня; 370 (24): 2307-2315. [Бесплатная статья PMC: PMC4096982] [PubMed: 24848981]
М.Нулевая мутация в гене гормоночувствительной липазы и риск диабета 2 типа. N Engl J Med. 2014 12 июня; 370 (24): 2307-2315. [Бесплатная статья PMC: PMC4096982] [PubMed: 24848981] - 9.
- Duncan RE, Ahmadian M, Jaworski K, Sarkadi-Nagy E, Sul HS. Регуляция липолиза в адипоцитах. Анну Рев Нутр. 2007;27:79-101. [Статья бесплатно PMC: PMC2885771] [PubMed: 17313320]
- 10.
- Бодис К., Роден М. Энергетический метаболизм белой жировой ткани и резистентность к инсулину у людей.Евро Джей Клин Инвест. 2018 ноябрь;48(11):e13017. [PubMed: 30107041]
Биохимия, липолиз — StatPearls — NCBI Bookshelf
Introduction
Липолиз — это метаболический процесс, посредством которого триацилглицеролы (ТАГ) расщепляются путем гидролиза на составляющие их молекулы: глицерин и свободные жирные кислоты (СЖК). Хранение жира в организме осуществляется за счет жировых ТАГ и используется для получения тепла, энергии и изоляции. Организм использует запасы жира в качестве основного источника энергии во время голодания, сохраняя белок. В целом жиры в количественном отношении являются наиболее важным топливом в организме, и продолжительность времени, в течение которого человек может прожить без пищи, зависит в основном от количества жира, хранящегося в жировой ткани. Таким образом, липолиз особенно важен при метаболизме натощак, когда уровень глюкозы в крови снижается. Однако это также происходит при нестимулированных (базальных условиях) [1].
В целом жиры в количественном отношении являются наиболее важным топливом в организме, и продолжительность времени, в течение которого человек может прожить без пищи, зависит в основном от количества жира, хранящегося в жировой ткани. Таким образом, липолиз особенно важен при метаболизме натощак, когда уровень глюкозы в крови снижается. Однако это также происходит при нестимулированных (базальных условиях) [1].
Глицерин, образующийся в результате липолиза, является источником углерода для глюконеогенеза в печени. СЖК транспортируются кровью в связанном виде с альбумином и либо окисляются в тканях в процессе, называемом бета-окислением, либо превращаются в кетоновые тела.Побочные продукты бета-окисления, АТФ и НАДН, способствуют глюконеогенезу. СЖК превращаются в кетоновые тела в печени, которая служит источником энергии для мозга, тем самым снижая дальнейшее потребление уже истощенной глюкозы в крови. СЖК используются во всем организме для производства энергии или путей биосинтеза, за исключением белой жировой ткани (WAT), где они хранятся. В метаболическом состоянии «натощак», когда организм лишен питательных веществ, WAT высвобождает свободные жирные кислоты и глицерин для снабжения нежировых тканей.[2] Основные ферменты, участвующие в липолизе, представляют собой жировую триглицеридлипазу (ATGL), гормоночувствительную липазу (HSL) и моноглицеридлипазу (MGL).
В метаболическом состоянии «натощак», когда организм лишен питательных веществ, WAT высвобождает свободные жирные кислоты и глицерин для снабжения нежировых тканей.[2] Основные ферменты, участвующие в липолизе, представляют собой жировую триглицеридлипазу (ATGL), гормоночувствительную липазу (HSL) и моноглицеридлипазу (MGL).
Основы
Синтез триацилглицеринов
ТАГ, которые обеспечивают организм значительным источником энергии, поступают с пищей или синтезируются эндогенно, в основном в печени. Они транспортируются кровью в виде липопротеинов и запасаются в жировой ткани. Основные классы вовлеченных липопротеинов крови включают липопротеины высокой плотности (ЛПВП), липопротеины промежуточной плотности (ЛПНП), липопротеины низкой плотности (ЛПНП), липопротеины очень низкой плотности (ЛПОНП) и хиломикроны.Хиломикроны подвергаются синтезу в тонком кишечнике и транспортируют пищевые ТАГ из тонкого кишечника в такие ткани, как мышцы и жировая ткань. Печень синтезирует ЛПОНП в печени и таким же образом транспортирует ТАГ из печени в ткани. ЛПВП выполняют множество функций, связанных с метаболизмом липидов, в том числе играют неотъемлемую роль в превращении ЛПОНП в ЛПНП. ЛПВП также служит резервуаром для незаменимых апопротеинов, таких как Аро C-II. Apo C-II активирует липопротеинлипазу, фермент, ответственный за переваривание и расщепление ТАГ.Синтез запасов ТАГ в жировой ткани происходит в сытом состоянии после еды.
ЛПВП выполняют множество функций, связанных с метаболизмом липидов, в том числе играют неотъемлемую роль в превращении ЛПОНП в ЛПНП. ЛПВП также служит резервуаром для незаменимых апопротеинов, таких как Аро C-II. Apo C-II активирует липопротеинлипазу, фермент, ответственный за переваривание и расщепление ТАГ.Синтез запасов ТАГ в жировой ткани происходит в сытом состоянии после еды.
Гидролиз триацилглицерина
Во время лишения энергии WAT стимулируется посредством гомеостатического контроля, чтобы сместиться в сторону более высоких чистых скоростей липолиза. Это изменение состояния питания объясняет этот компенсаторный процесс и регулируется гормональными и биохимическими сигналами. Липолиз протекает упорядоченно и контролируемо, на каждом этапе действуют разные ферменты. Катехоламины являются основными активаторами липолиза, на него также влияют другие гормоны и пищевые соединения.Каждое из этих веществ связывается с соответствующими мембранными рецепторами и воздействует на них, вызывая сигнальный каскад с единственной целью активации HSL. ATGL выполняет первую стадию гидролиза TAG (таким образом, он ограничивает скорость), образуя диацилглицеролы и FFAs. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и свободных жирных кислот. MGL селективен в отношении MG и продуцирует глицерин и третью FFA.
ATGL выполняет первую стадию гидролиза TAG (таким образом, он ограничивает скорость), образуя диацилглицеролы и FFAs. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и свободных жирных кислот. MGL селективен в отношении MG и продуцирует глицерин и третью FFA.
Вопросы, вызывающие озабоченность
Дефектный липолиз в нежировых тканях нарушает их нормальную функцию, приводя к избыточному накоплению ТАГ и болезни накопления липидов.[2] И наоборот, переизбыток СЖК из-за нерегулируемого липолиза приводит к липотоксичности в нежировых тканях. Неспособность упаковать СЖК в липидные капли вызывает хроническое повышение уровня циркулирующих СЖК, что может привести к хроническому воспалению, митохондриальной дисфункции и гибели клеток.[3]
Клеточный
Как описано ранее, гормоны связываются с рецепторами клеточной поверхности (т. е. норадреналин связывается с бета-адренорецепторами) для стимуляции липолиза в адипоцитах. Известно, что ряд белков, связанных с липидными каплями, модулируют скорость базального (нестимулированного) и стимулированного липолиза.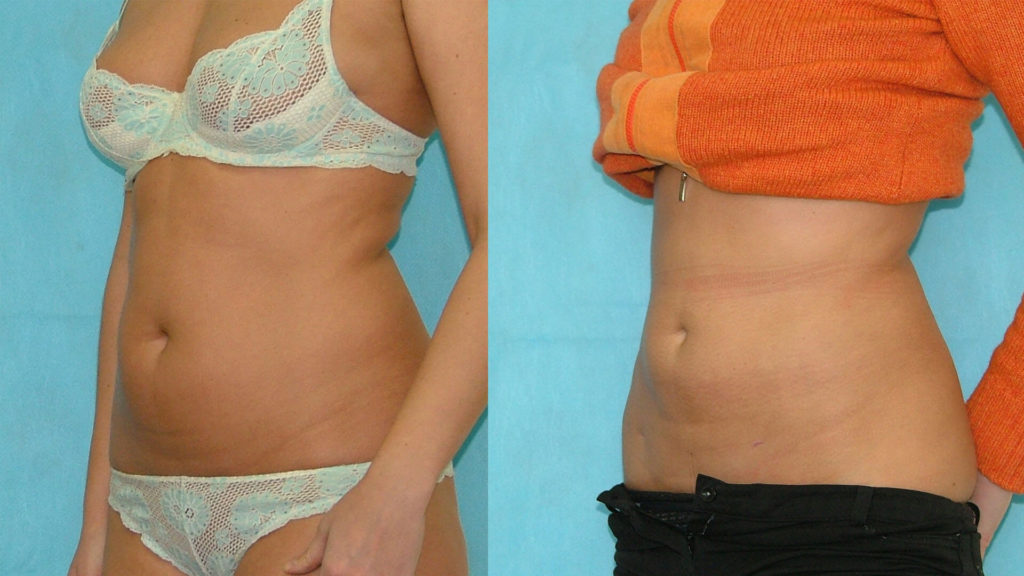 Эти белки включают CGI-58 и перилипин. Перилипин является основным белком, обнаруженным в ассоциации с липидными каплями в адипоцитах.[4] В WAT есть два важных механизма, регулирующих липолиз: активация ATGL с помощью CGI-58 и опосредованное протеинкиназой A (PKA) фосфорилирование HSL и перилипина.
Эти белки включают CGI-58 и перилипин. Перилипин является основным белком, обнаруженным в ассоциации с липидными каплями в адипоцитах.[4] В WAT есть два важных механизма, регулирующих липолиз: активация ATGL с помощью CGI-58 и опосредованное протеинкиназой A (PKA) фосфорилирование HSL и перилипина.
В исходном состоянии CGI-58 связан с перилипином, что делает его неспособным связываться с ATGL или активировать его. И ATGL, и HSL находятся в цитозоле.
В состоянии стимуляции β-адренорецепторы сигнализируют аденилатциклазе о выработке цАМФ.Затем цАМФ связывает ПКА, что приводит к повышению активности фермента. Затем PKA фосфорилирует HSL и перилипин, что вызывает перемещение HSL из цитозоля на поверхность липидной капли. Теперь фосфорилированный перилипин высвобождает CGI-58, чтобы он мог связываться с ATGL и активировать его. Подобно HSL, ATGL также должен перемещаться из цитозоля на поверхность липидной капли. Важно отметить, что МГЛ локализуется на поверхности липидной капли, в цитозоле и ЭР независимо от метаболического состояния.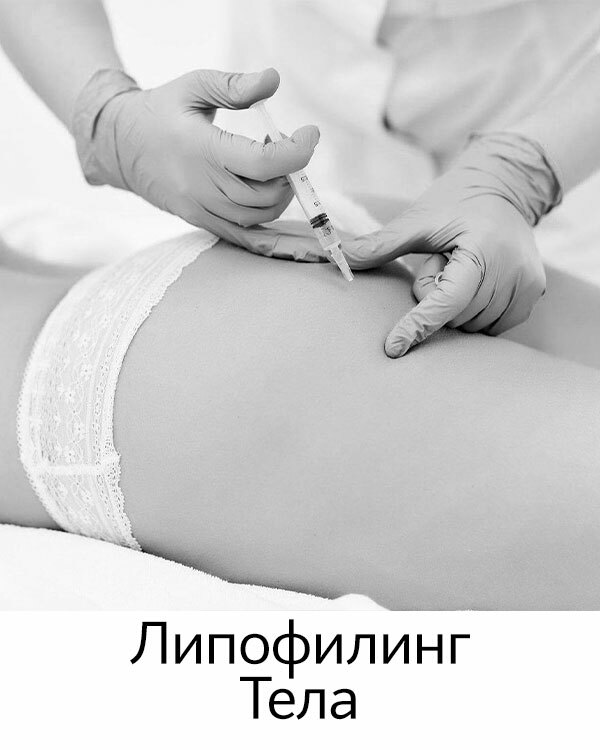 [5]
[5]
Молекулярные
Липиды имеют различную структуру, но все они схожи в том, что они нерастворимы в воде. Жирные кислоты обычно содержат четное число атомов углерода, имеют длину от 16 до 20 атомов углерода и могут быть насыщенными или ненасыщенными (последнее относится к содержанию двойных связей). Они описываются количеством атомов углерода, которые они содержат, и положениями двойных связей, если таковые имеются. Например, арахидоновая кислота имеет 20 атомов углерода и четыре двойные связи и записывается как 20:4, Δ5,8,11,14 или 20:4(ω-6).
Все встречающиеся в природе жирные кислоты имеют двойные связи в цис-конфигурации. Классификация полиненасыщенных жирных кислот часто осуществляется в соответствии с положением первой двойной связи от омега-конца (углерод, наиболее удаленный от карбоксильной группы). Типичными примерами из них являются омега-3 и омега-6 жирные кислоты. Моноацилглицеролы (моноглицериды), диацилглицеролы (диглицериды) и триацилглицеролы (триглицериды) содержат одну, две и три жирные кислоты, этерифицированные в глицерин, соответственно.
Функция
Жирные кислоты переносятся альбумином крови. В таких тканях, как мышцы и почки, жирные кислоты окисляются для получения энергии. В печени жирные кислоты превращаются в кетоновые тела, которые окисляются тканями, такими как мышцы и почки. Во время голодания (после того, как голодание длилось около трех и более дней) мозг использует кетоновые тела для получения энергии. Источником топлива служат кетоновые тела, ацетоацетат и β-гидроксибутират. Печень использует глицерин в качестве источника углерода для глюконеогенеза, который производит глюкозу для тканей, включая мозг и эритроциты.
Механизм
Синтез триацилглицеринов
Они синтезируются двумя способами: (1) из СЖК, образующихся в качестве побочного продукта действия липопротеинлипазы на хиломикроны и ЛПОНП, и (2) из глицериновой части, полученной из глюкозы. В печени и жировой ткани глицерин-3-фосфат (G3P) обеспечивает глицериновую часть. Печень может преобразовывать глицерин в G3P через промежуточное соединение или напрямую, потому что она имеет фермент глицеролкиназу. В жировых клетках отсутствует этот фермент, и они должны продуцировать G3P исключительно через промежуточное соединение.Хранение ТАГ в жировой ткани опосредуется инсулином, который стимулирует жировые клетки к секреции липопротеинлипазы и поглощению глюкозы, которая превращается в глицерин (через промежуточное соединение ДГАП) для синтеза триацилглицерина. В этом процессе глюкоза превращается в DHAP, который восстанавливается NADH с образованием G3P. В конечном итоге G3P реагирует с двумя молекулами жирного ацил-КоА с образованием фосфатидной кислоты. Фосфатная группа отщепляется с образованием диацилглицерина, который реагирует с другим жирным ацил-КоА с образованием триацилглицерина.
Гидролиз триацилглицерина
Как указывалось ранее, во время дефицита энергии WAT стимулируется гормональными и биохимическими сигналами для увеличения липолиза. Липолиз протекает упорядоченно и контролируемо, на каждом этапе действуют разные ферменты. Текущая модель липолиза идентифицирует три основных вовлеченных фермента: ATGL, HSL и MGL. Катехоламины, особенно норадреналин, являются основными активаторами липолиза, вызванного голоданием, в то время как другие гормоны также оказывают влияние.К ним относятся кортизол, глюкагон, гормон роста (GH) и адренокортикотропный гормон (АКТГ).
Пищевые соединения, такие как кофеин и кальций, также стимулируют липолиз. Каждое из этих веществ связывается и действует на свои соответствующие мембранные рецепторы и вызывает сигнальный каскад с использованием общего вторичного мессенджера, циклического АМФ. Затем циклический АМФ связывается с протеинкиназой А (ПКА) и активирует ее. Как только PKA становится ферментативно активным, он фосфорилирует HSL, самый важный из трех ферментов, участвующих в инициировании липолиза, поскольку он ферментативно активируется на всех стадиях гидролиза.ATGL выполняет первую стадию гидролиза ТАГ, образуя диацилглицеролы и ЖК. Его активность жестко регулируется двумя вспомогательными белками: CGI-58 и G0S2. CGI-58 коактивирует гидролазную активность ATGL, а G0S2 инактивирует гидролазную активность ATGL. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и ЖК. MGL селективен в отношении MG и образует глицерин и третью ЖК.
Метаболизм жирных кислот
Коротко- и среднецепочечные жирные кислоты свободно диффундируют в цитозоль и митохондрии клеток.Жирные кислоты с длинной цепью должны подвергаться опосредованному белком транспорту через клеточную мембрану в цитозоль с помощью транслоказы жирных кислот (FAT) или белка, связывающего жирные кислоты (FABP). Затем ацил-КоА-синтаза превращает жирные кислоты в жирный ацил-КоА. Жирный ацил-КоА теперь должен транспортироваться в митохондрии через внешнюю митохондриальную мембрану, и это делается карнитин-пальмитоилтрансферазой-I (CPT-I), где он превращается в жирный ацил-карнитин. Затем жирный ацил-карнитин транспортируется через внутреннюю мембрану в митохондриальный матрикс с помощью карнитинацил-транслоказы (CAT) и превращается обратно в жирный ацил-КоА с помощью пальмитоилтрансферазы-II (CPT-II), где он теперь готов к окислению.
Бета-окисление
Бета-окисление — это расщепление жирных кислот путем одновременного удаления двух атомов углерода. Это основной путь катаболизма жирных кислот, происходящий в митохондриальном матриксе тканей, таких как печень, мышцы и жировая ткань. Двухуглеродные фрагменты последовательно удаляются с карбоксильного конца жирного ацил-КоА, образуя НАДН, ФАДН и ацетил-КоА, который используется в цикле трикарбоновых кислот для образования АТФ. Жирные кислоты с нечетным числом атомов углерода в конечном итоге дают один моль пропионил-КоА, который превращается в сукцинил-КоА, чтобы его можно было использовать в цикле трикарбоновых кислот.Бета-окисление также важно как первичный регулятор движения через комплекс пируватдегидрогеназы (ПДГ). При высоких скоростях окисления жирных кислот активность ПДГ снижается, что ограничивает гликолиз, что важно, поскольку у пациентов с дефицитом окисления жирных кислот наблюдается компенсаторное увеличение окисления глюкозы и нарушение глюконеогенеза.
Синтез кетона
Уровень кетона низкий при нормальном кормлении и физиологическом состоянии. Они используются сердцем и скелетными мышцами для сохранения ограниченного количества глюкозы для использования мозгом и эритроцитами.Во время голодания жирные кислоты окисляются в печени до ацетил-КоА, который превращается в ацетоацетат и бета-гидроксибутират кетоновых тел. Эти высокие уровни кетонов также ингибируют активность PDH и окисление жирных кислот, чтобы сохранить глюкозу и обеспечить проникновение в мозг, где они могут служить источниками энергии. Обычно во время голодания мышцы метаболизируют кетоновые тела так же быстро, как их высвобождает печень, предотвращая их накопление в крови. Если в крови достаточно кетонов, это может привести к кетоацидозу, который особенно распространен у людей с диабетом I типа и требует тщательного наблюдения.
Тестирование
В настоящее время существует несколько стратегий оценки липолиза, которые обычно делятся на две категории: методы, не основанные на активности, и методы, основанные на активности. Методы, не основанные на активности, включают определение количества связанных ферментов и регуляторных белков. Методы, основанные на активности, включают непосредственное измерение активности ассоциированных ферментов.[2]
За последние несколько лет появилась новая и обновленная информация, и взгляды на липолиз изменились.В настоящее время известно, что измерения экспрессии мРНК или белка, используемого в методах, не основанных на активности, часто недостаточно для оценки способности липолиза. Необходима комбинация методов.[2]
Патофизиология
Болезнь накопления нейтральных липидов с миопатией (NLSDM) – редкое наследственное заболевание, возникающее в результате мутаций в гене ATGL, которое приводит к системному накоплению ТАГ, миопатии, аномалиям сердца и гепатомегалии.[6]
Синдром Чанарина-Дорфмана или NLSD с ихтиозом (NLSD-I) возникает в результате мутаций в CGI-58, активаторе ATGL.Они также проявляют системное накопление ТАГ, легкую миопатию и гепатомегалию, а также ихтиоз, кожное заболевание, характеризующееся сухой, утолщенной, шелушащейся кожей.[6]
Семейная частичная липодистрофия (FPLD) 4 типа связана с мутацией в гене PLIN1 , кодирующем перилипин 1. Фенотипически она характеризуется потерей подкожного жира на конечностях. Гистологически шесть пациентов с этой мутацией имеют небольшие адипоциты с повышенной инфильтрацией макрофагов и обильным фиброзом.[7]
Семейная парциальная липодистрофия (FPLD) 6 типа возникает из-за мутации в гене LIPE , кодирующем гормончувствительную липазу. Он характеризуется аномальным распределением подкожного жира и, следовательно, осложнениями, обычно связанными с ним. К ним относятся нарушение регуляции липолиза, резистентность к инсулину, сахарный диабет, повышенное накопление жира в органах тела и дислипидемия; у других может даже развиться мышечная дистрофия, на что указывает повышенный уровень креатинфосфокиназы в сыворотке.[8]
Существует множество нарушений метаболизма жиров, которые проявляются серьезными и специфическими характеристиками, но здесь не обсуждаются, поскольку они выходят за рамки липолиза, в частности. К ним относятся, помимо прочего, нарушения окисления жирных кислот (FAOD), такие как дефицит MCAD или первичный дефицит карнитина, и пероксисомальные расстройства, такие как синдром Зеллвегера и адренолейкодистрофия.
Клиническое значение
Изменения липолиза часто связаны с ожирением.Эти изменения включают повышение базальной скорости липолиза, что может способствовать развитию резистентности к инсулину, а также снижение реакции на стимулированный липолиз.[9] Сочетание повышенного липолиза и нарушенного липогенеза в конечном итоге способствует резистентности к инсулину из-за высвобождения цитокинов и липидных метаболитов. Кроме того, в жировой ткани инсулинорезистентных людей наблюдается недостаток белков, участвующих в митохондриальной функции. Митохондриальные источники энергии участвуют в липогенезе в жировой ткани.[10]
Ожирение характеризуется в первую очередь избытком WAT из-за гипертрофии адипоцитов, возникающей в результате повышенного накопления ТАГ. Ожирение является безудержной проблемой здравоохранения во всем мире из-за его связи с рядом заболеваний, включая резистентность к инсулину, диабет II типа, гипертонию и атеросклероз.
Ссылки
- 1.
- Bolsoni-Lopes A, Alonso-Vale MI. Липолиз и липазы в белой жировой ткани — обновление. Arch Endocrinol Metab.2015 авг; 59 (4): 335-42. [PubMed: 26331321]
- 2.
- Швайгер М., Эйхманн Т.О., Ташлер У., Циммерманн Р., Цехнер Р., Ласс А. Измерение липолиза. Методы Энзимол. 2014;538:171-93. [Бесплатная статья PMC: PMC4018506] [PubMed: 24529439]
- 3.
- Энгин А.Б. Что такое липотоксичность? Adv Exp Med Biol. 2017;960:197-220. [PubMed: 28585200]
- 4.
- Tansey JT, Sztalryd C, Hlavin EM, Kimmel AR, Londos C. Центральная роль перилипина a в метаболизме липидов и липолизе адипоцитов.Жизнь ИУБМБ. 2004 г., июль; 56 (7): 379–85. [PubMed: 15545214]
- 5.
- Zechner R, Zimmermann R, Eichmann TO, Kohlwein SD, Haemmerle G, Lass A, Madeo F. FAT SIGNALS — липазы и липолиз в липидном метаболизме и передаче сигналов. Клеточный метаб. 2012 07 марта; 15 (3): 279-91. [Бесплатная статья PMC: PMC3314979] [PubMed: 22405066]
- 6.
- Ahmadian M, Wang Y, Sul HS. Липолиз в адипоцитах. Int J Biochem Cell Biol. 2010 май; 42(5):555-9. [Бесплатная статья PMC: PMC2835819] [PubMed: 20025992]
- 7.
- Гандотра С., Ле Дур С., Боттомли В., Сервера П., Хирал П., Резник Ю., Шарпантье Г., Оклер М., Делепин М., Баррозу И., Семпл Р.К., Латроп М., Ласколс О., Капо Дж., О’Рахилли С., Magré J, Savage DB, Vigouroux C. Дефицит перилипина и аутосомно-доминантная частичная липодистрофия. N Engl J Med. 2011 24 февраля; 364 (8): 740-8. [Бесплатная статья PMC: PMC3773916] [PubMed: 21345103]
- 8.
- Albert JS, Yerges-Armstrong LM, Horenstein RB, Pollin TI, Sreenivasan UT, Chai S, Blaner WS, Snitker S, O’Connell JR, Gong Д. В., Брейер Р. Дж., Райан А. С., Макленитан Дж. К., Шулдинер А. Р., Шталрид С., Дамкотт К. М.Нулевая мутация в гене гормоночувствительной липазы и риск диабета 2 типа. N Engl J Med. 2014 12 июня; 370 (24): 2307-2315. [Бесплатная статья PMC: PMC4096982] [PubMed: 24848981]
- 9.
- Duncan RE, Ahmadian M, Jaworski K, Sarkadi-Nagy E, Sul HS. Регуляция липолиза в адипоцитах. Анну Рев Нутр. 2007;27:79-101. [Статья бесплатно PMC: PMC2885771] [PubMed: 17313320]
- 10.
- Бодис К., Роден М. Энергетический метаболизм белой жировой ткани и резистентность к инсулину у людей.Евро Джей Клин Инвест. 2018 ноябрь;48(11):e13017. [PubMed: 30107041]
Биохимия, липолиз — StatPearls — NCBI Bookshelf
Introduction
Липолиз — это метаболический процесс, посредством которого триацилглицеролы (ТАГ) расщепляются путем гидролиза на составляющие их молекулы: глицерин и свободные жирные кислоты (СЖК). Хранение жира в организме осуществляется за счет жировых ТАГ и используется для получения тепла, энергии и изоляции. Организм использует запасы жира в качестве основного источника энергии во время голодания, сохраняя белок.В целом жиры в количественном отношении являются наиболее важным топливом в организме, и продолжительность времени, в течение которого человек может прожить без пищи, зависит в основном от количества жира, хранящегося в жировой ткани. Таким образом, липолиз особенно важен при метаболизме натощак, когда уровень глюкозы в крови снижается. Однако это также происходит при нестимулированных (базальных условиях) [1].
Глицерин, образующийся в результате липолиза, является источником углерода для глюконеогенеза в печени. СЖК транспортируются кровью в связанном виде с альбумином и либо окисляются в тканях в процессе, называемом бета-окислением, либо превращаются в кетоновые тела.Побочные продукты бета-окисления, АТФ и НАДН, способствуют глюконеогенезу. СЖК превращаются в кетоновые тела в печени, которая служит источником энергии для мозга, тем самым снижая дальнейшее потребление уже истощенной глюкозы в крови. СЖК используются во всем организме для производства энергии или путей биосинтеза, за исключением белой жировой ткани (WAT), где они хранятся. В метаболическом состоянии «натощак», когда организм лишен питательных веществ, WAT высвобождает свободные жирные кислоты и глицерин для снабжения нежировых тканей.[2] Основные ферменты, участвующие в липолизе, представляют собой жировую триглицеридлипазу (ATGL), гормоночувствительную липазу (HSL) и моноглицеридлипазу (MGL).
Основы
Синтез триацилглицеринов
ТАГ, которые обеспечивают организм значительным источником энергии, поступают с пищей или синтезируются эндогенно, в основном в печени. Они транспортируются кровью в виде липопротеинов и запасаются в жировой ткани. Основные классы вовлеченных липопротеинов крови включают липопротеины высокой плотности (ЛПВП), липопротеины промежуточной плотности (ЛПНП), липопротеины низкой плотности (ЛПНП), липопротеины очень низкой плотности (ЛПОНП) и хиломикроны.Хиломикроны подвергаются синтезу в тонком кишечнике и транспортируют пищевые ТАГ из тонкого кишечника в такие ткани, как мышцы и жировая ткань. Печень синтезирует ЛПОНП в печени и таким же образом транспортирует ТАГ из печени в ткани. ЛПВП выполняют множество функций, связанных с метаболизмом липидов, в том числе играют неотъемлемую роль в превращении ЛПОНП в ЛПНП. ЛПВП также служит резервуаром для незаменимых апопротеинов, таких как Аро C-II. Apo C-II активирует липопротеинлипазу, фермент, ответственный за переваривание и расщепление ТАГ.Синтез запасов ТАГ в жировой ткани происходит в сытом состоянии после еды.
Гидролиз триацилглицерина
Во время лишения энергии WAT стимулируется посредством гомеостатического контроля, чтобы сместиться в сторону более высоких чистых скоростей липолиза. Это изменение состояния питания объясняет этот компенсаторный процесс и регулируется гормональными и биохимическими сигналами. Липолиз протекает упорядоченно и контролируемо, на каждом этапе действуют разные ферменты. Катехоламины являются основными активаторами липолиза, на него также влияют другие гормоны и пищевые соединения.Каждое из этих веществ связывается с соответствующими мембранными рецепторами и воздействует на них, вызывая сигнальный каскад с единственной целью активации HSL. ATGL выполняет первую стадию гидролиза TAG (таким образом, он ограничивает скорость), образуя диацилглицеролы и FFAs. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и свободных жирных кислот. MGL селективен в отношении MG и продуцирует глицерин и третью FFA.
Вопросы, вызывающие озабоченность
Дефектный липолиз в нежировых тканях нарушает их нормальную функцию, приводя к избыточному накоплению ТАГ и болезни накопления липидов.[2] И наоборот, переизбыток СЖК из-за нерегулируемого липолиза приводит к липотоксичности в нежировых тканях. Неспособность упаковать СЖК в липидные капли вызывает хроническое повышение уровня циркулирующих СЖК, что может привести к хроническому воспалению, митохондриальной дисфункции и гибели клеток.[3]
Клеточный
Как описано ранее, гормоны связываются с рецепторами клеточной поверхности (т. е. норадреналин связывается с бета-адренорецепторами) для стимуляции липолиза в адипоцитах. Известно, что ряд белков, связанных с липидными каплями, модулируют скорость базального (нестимулированного) и стимулированного липолиза.Эти белки включают CGI-58 и перилипин. Перилипин является основным белком, обнаруженным в ассоциации с липидными каплями в адипоцитах.[4] В WAT есть два важных механизма, регулирующих липолиз: активация ATGL с помощью CGI-58 и опосредованное протеинкиназой A (PKA) фосфорилирование HSL и перилипина.
В исходном состоянии CGI-58 связан с перилипином, что делает его неспособным связываться с ATGL или активировать его. И ATGL, и HSL находятся в цитозоле.
В состоянии стимуляции β-адренорецепторы сигнализируют аденилатциклазе о выработке цАМФ.Затем цАМФ связывает ПКА, что приводит к повышению активности фермента. Затем PKA фосфорилирует HSL и перилипин, что вызывает перемещение HSL из цитозоля на поверхность липидной капли. Теперь фосфорилированный перилипин высвобождает CGI-58, чтобы он мог связываться с ATGL и активировать его. Подобно HSL, ATGL также должен перемещаться из цитозоля на поверхность липидной капли. Важно отметить, что МГЛ локализуется на поверхности липидной капли, в цитозоле и ЭР независимо от метаболического состояния.[5]
Молекулярные
Липиды имеют различную структуру, но все они схожи в том, что они нерастворимы в воде. Жирные кислоты обычно содержат четное число атомов углерода, имеют длину от 16 до 20 атомов углерода и могут быть насыщенными или ненасыщенными (последнее относится к содержанию двойных связей). Они описываются количеством атомов углерода, которые они содержат, и положениями двойных связей, если таковые имеются. Например, арахидоновая кислота имеет 20 атомов углерода и четыре двойные связи и записывается как 20:4, Δ5,8,11,14 или 20:4(ω-6).
Все встречающиеся в природе жирные кислоты имеют двойные связи в цис-конфигурации. Классификация полиненасыщенных жирных кислот часто осуществляется в соответствии с положением первой двойной связи от омега-конца (углерод, наиболее удаленный от карбоксильной группы). Типичными примерами из них являются омега-3 и омега-6 жирные кислоты. Моноацилглицеролы (моноглицериды), диацилглицеролы (диглицериды) и триацилглицеролы (триглицериды) содержат одну, две и три жирные кислоты, этерифицированные в глицерин, соответственно.
Функция
Жирные кислоты переносятся альбумином крови. В таких тканях, как мышцы и почки, жирные кислоты окисляются для получения энергии. В печени жирные кислоты превращаются в кетоновые тела, которые окисляются тканями, такими как мышцы и почки. Во время голодания (после того, как голодание длилось около трех и более дней) мозг использует кетоновые тела для получения энергии. Источником топлива служат кетоновые тела, ацетоацетат и β-гидроксибутират. Печень использует глицерин в качестве источника углерода для глюконеогенеза, который производит глюкозу для тканей, включая мозг и эритроциты.
Механизм
Синтез триацилглицеринов
Они синтезируются двумя способами: (1) из СЖК, образующихся в качестве побочного продукта действия липопротеинлипазы на хиломикроны и ЛПОНП, и (2) из глицериновой части, полученной из глюкозы. В печени и жировой ткани глицерин-3-фосфат (G3P) обеспечивает глицериновую часть. Печень может преобразовывать глицерин в G3P через промежуточное соединение или напрямую, потому что она имеет фермент глицеролкиназу. В жировых клетках отсутствует этот фермент, и они должны продуцировать G3P исключительно через промежуточное соединение.Хранение ТАГ в жировой ткани опосредуется инсулином, который стимулирует жировые клетки к секреции липопротеинлипазы и поглощению глюкозы, которая превращается в глицерин (через промежуточное соединение ДГАП) для синтеза триацилглицерина. В этом процессе глюкоза превращается в DHAP, который восстанавливается NADH с образованием G3P. В конечном итоге G3P реагирует с двумя молекулами жирного ацил-КоА с образованием фосфатидной кислоты. Фосфатная группа отщепляется с образованием диацилглицерина, который реагирует с другим жирным ацил-КоА с образованием триацилглицерина.
Гидролиз триацилглицерина
Как указывалось ранее, во время дефицита энергии WAT стимулируется гормональными и биохимическими сигналами для увеличения липолиза. Липолиз протекает упорядоченно и контролируемо, на каждом этапе действуют разные ферменты. Текущая модель липолиза идентифицирует три основных вовлеченных фермента: ATGL, HSL и MGL. Катехоламины, особенно норадреналин, являются основными активаторами липолиза, вызванного голоданием, в то время как другие гормоны также оказывают влияние.К ним относятся кортизол, глюкагон, гормон роста (GH) и адренокортикотропный гормон (АКТГ).
Пищевые соединения, такие как кофеин и кальций, также стимулируют липолиз. Каждое из этих веществ связывается и действует на свои соответствующие мембранные рецепторы и вызывает сигнальный каскад с использованием общего вторичного мессенджера, циклического АМФ. Затем циклический АМФ связывается с протеинкиназой А (ПКА) и активирует ее. Как только PKA становится ферментативно активным, он фосфорилирует HSL, самый важный из трех ферментов, участвующих в инициировании липолиза, поскольку он ферментативно активируется на всех стадиях гидролиза.ATGL выполняет первую стадию гидролиза ТАГ, образуя диацилглицеролы и ЖК. Его активность жестко регулируется двумя вспомогательными белками: CGI-58 и G0S2. CGI-58 коактивирует гидролазную активность ATGL, а G0S2 инактивирует гидролазную активность ATGL. HSL выполняет вторую стадию и гидролизует DAG с образованием моноацилглицеролов и ЖК. MGL селективен в отношении MG и образует глицерин и третью ЖК.
Метаболизм жирных кислот
Коротко- и среднецепочечные жирные кислоты свободно диффундируют в цитозоль и митохондрии клеток.Жирные кислоты с длинной цепью должны подвергаться опосредованному белком транспорту через клеточную мембрану в цитозоль с помощью транслоказы жирных кислот (FAT) или белка, связывающего жирные кислоты (FABP). Затем ацил-КоА-синтаза превращает жирные кислоты в жирный ацил-КоА. Жирный ацил-КоА теперь должен транспортироваться в митохондрии через внешнюю митохондриальную мембрану, и это делается карнитин-пальмитоилтрансферазой-I (CPT-I), где он превращается в жирный ацил-карнитин. Затем жирный ацил-карнитин транспортируется через внутреннюю мембрану в митохондриальный матрикс с помощью карнитинацил-транслоказы (CAT) и превращается обратно в жирный ацил-КоА с помощью пальмитоилтрансферазы-II (CPT-II), где он теперь готов к окислению.
Бета-окисление
Бета-окисление — это расщепление жирных кислот путем одновременного удаления двух атомов углерода. Это основной путь катаболизма жирных кислот, происходящий в митохондриальном матриксе тканей, таких как печень, мышцы и жировая ткань. Двухуглеродные фрагменты последовательно удаляются с карбоксильного конца жирного ацил-КоА, образуя НАДН, ФАДН и ацетил-КоА, который используется в цикле трикарбоновых кислот для образования АТФ. Жирные кислоты с нечетным числом атомов углерода в конечном итоге дают один моль пропионил-КоА, который превращается в сукцинил-КоА, чтобы его можно было использовать в цикле трикарбоновых кислот.Бета-окисление также важно как первичный регулятор движения через комплекс пируватдегидрогеназы (ПДГ). При высоких скоростях окисления жирных кислот активность ПДГ снижается, что ограничивает гликолиз, что важно, поскольку у пациентов с дефицитом окисления жирных кислот наблюдается компенсаторное увеличение окисления глюкозы и нарушение глюконеогенеза.
Синтез кетона
Уровень кетона низкий при нормальном кормлении и физиологическом состоянии. Они используются сердцем и скелетными мышцами для сохранения ограниченного количества глюкозы для использования мозгом и эритроцитами.Во время голодания жирные кислоты окисляются в печени до ацетил-КоА, который превращается в ацетоацетат и бета-гидроксибутират кетоновых тел. Эти высокие уровни кетонов также ингибируют активность PDH и окисление жирных кислот, чтобы сохранить глюкозу и обеспечить проникновение в мозг, где они могут служить источниками энергии. Обычно во время голодания мышцы метаболизируют кетоновые тела так же быстро, как их высвобождает печень, предотвращая их накопление в крови. Если в крови достаточно кетонов, это может привести к кетоацидозу, который особенно распространен у людей с диабетом I типа и требует тщательного наблюдения.
Тестирование
В настоящее время существует несколько стратегий оценки липолиза, которые обычно делятся на две категории: методы, не основанные на активности, и методы, основанные на активности. Методы, не основанные на активности, включают определение количества связанных ферментов и регуляторных белков. Методы, основанные на активности, включают непосредственное измерение активности ассоциированных ферментов.[2]
За последние несколько лет появилась новая и обновленная информация, и взгляды на липолиз изменились.В настоящее время известно, что измерения экспрессии мРНК или белка, используемого в методах, не основанных на активности, часто недостаточно для оценки способности липолиза. Необходима комбинация методов.[2]
Патофизиология
Болезнь накопления нейтральных липидов с миопатией (NLSDM) – редкое наследственное заболевание, возникающее в результате мутаций в гене ATGL, которое приводит к системному накоплению ТАГ, миопатии, аномалиям сердца и гепатомегалии.[6]
Синдром Чанарина-Дорфмана или NLSD с ихтиозом (NLSD-I) возникает в результате мутаций в CGI-58, активаторе ATGL.Они также проявляют системное накопление ТАГ, легкую миопатию и гепатомегалию, а также ихтиоз, кожное заболевание, характеризующееся сухой, утолщенной, шелушащейся кожей.[6]
Семейная частичная липодистрофия (FPLD) 4 типа связана с мутацией в гене PLIN1 , кодирующем перилипин 1. Фенотипически она характеризуется потерей подкожного жира на конечностях. Гистологически шесть пациентов с этой мутацией имеют небольшие адипоциты с повышенной инфильтрацией макрофагов и обильным фиброзом.[7]
Семейная парциальная липодистрофия (FPLD) 6 типа возникает из-за мутации в гене LIPE , кодирующем гормончувствительную липазу. Он характеризуется аномальным распределением подкожного жира и, следовательно, осложнениями, обычно связанными с ним. К ним относятся нарушение регуляции липолиза, резистентность к инсулину, сахарный диабет, повышенное накопление жира в органах тела и дислипидемия; у других может даже развиться мышечная дистрофия, на что указывает повышенный уровень креатинфосфокиназы в сыворотке.[8]
Существует множество нарушений метаболизма жиров, которые проявляются серьезными и специфическими характеристиками, но здесь не обсуждаются, поскольку они выходят за рамки липолиза, в частности. К ним относятся, помимо прочего, нарушения окисления жирных кислот (FAOD), такие как дефицит MCAD или первичный дефицит карнитина, и пероксисомальные расстройства, такие как синдром Зеллвегера и адренолейкодистрофия.
Клиническое значение
Изменения липолиза часто связаны с ожирением.Эти изменения включают повышение базальной скорости липолиза, что может способствовать развитию резистентности к инсулину, а также снижение реакции на стимулированный липолиз.[9] Сочетание повышенного липолиза и нарушенного липогенеза в конечном итоге способствует резистентности к инсулину из-за высвобождения цитокинов и липидных метаболитов. Кроме того, в жировой ткани инсулинорезистентных людей наблюдается недостаток белков, участвующих в митохондриальной функции. Митохондриальные источники энергии участвуют в липогенезе в жировой ткани.[10]
Ожирение характеризуется в первую очередь избытком WAT из-за гипертрофии адипоцитов, возникающей в результате повышенного накопления ТАГ. Ожирение является безудержной проблемой здравоохранения во всем мире из-за его связи с рядом заболеваний, включая резистентность к инсулину, диабет II типа, гипертонию и атеросклероз.
Ссылки
- 1.
- Bolsoni-Lopes A, Alonso-Vale MI. Липолиз и липазы в белой жировой ткани — обновление. Arch Endocrinol Metab.2015 авг; 59 (4): 335-42. [PubMed: 26331321]
- 2.
- Швайгер М., Эйхманн Т.О., Ташлер У., Циммерманн Р., Цехнер Р., Ласс А. Измерение липолиза. Методы Энзимол. 2014;538:171-93. [Бесплатная статья PMC: PMC4018506] [PubMed: 24529439]
- 3.
- Энгин А.Б. Что такое липотоксичность? Adv Exp Med Biol. 2017;960:197-220. [PubMed: 28585200]
- 4.
- Tansey JT, Sztalryd C, Hlavin EM, Kimmel AR, Londos C. Центральная роль перилипина a в метаболизме липидов и липолизе адипоцитов.Жизнь ИУБМБ. 2004 г., июль; 56 (7): 379–85. [PubMed: 15545214]
- 5.
- Zechner R, Zimmermann R, Eichmann TO, Kohlwein SD, Haemmerle G, Lass A, Madeo F. FAT SIGNALS — липазы и липолиз в липидном метаболизме и передаче сигналов. Клеточный метаб. 2012 07 марта; 15 (3): 279-91. [Бесплатная статья PMC: PMC3314979] [PubMed: 22405066]
- 6.
- Ahmadian M, Wang Y, Sul HS. Липолиз в адипоцитах. Int J Biochem Cell Biol. 2010 май; 42(5):555-9. [Бесплатная статья PMC: PMC2835819] [PubMed: 20025992]
- 7.
- Гандотра С., Ле Дур С., Боттомли В., Сервера П., Хирал П., Резник Ю., Шарпантье Г., Оклер М., Делепин М., Баррозу И., Семпл Р.К., Латроп М., Ласколс О., Капо Дж., О’Рахилли С., Magré J, Savage DB, Vigouroux C. Дефицит перилипина и аутосомно-доминантная частичная липодистрофия. N Engl J Med. 2011 24 февраля; 364 (8): 740-8. [Бесплатная статья PMC: PMC3773916] [PubMed: 21345103]
- 8.
- Albert JS, Yerges-Armstrong LM, Horenstein RB, Pollin TI, Sreenivasan UT, Chai S, Blaner WS, Snitker S, O’Connell JR, Gong Д. В., Брейер Р. Дж., Райан А. С., Макленитан Дж. К., Шулдинер А. Р., Шталрид С., Дамкотт К. М.Нулевая мутация в гене гормоночувствительной липазы и риск диабета 2 типа. N Engl J Med. 2014 12 июня; 370 (24): 2307-2315. [Бесплатная статья PMC: PMC4096982] [PubMed: 24848981]
- 9.
- Duncan RE, Ahmadian M, Jaworski K, Sarkadi-Nagy E, Sul HS. Регуляция липолиза в адипоцитах. Анну Рев Нутр. 2007;27:79-101. [Статья бесплатно PMC: PMC2885771] [PubMed: 17313320]
- 10.
- Бодис К., Роден М. Энергетический метаболизм белой жировой ткани и резистентность к инсулину у людей.Евро Джей Клин Инвест. 2018 ноябрь;48(11):e13017. [PubMed: 30107041]
Медицинский совет штата Орегон: Мезотерапия и инъекционный липолиз: Заявления философии: Штат Орегон
История вопроса
Методы лечения, наиболее правильно называемые «инъекционный липолиз», обычно ассоциируются с термином «мезотерапия» для уменьшения или устранить нежелательные локальные скопления жира. Различные термины для лечения, направленного на «растворение» жира, кажутся взаимозаменяемыми, хотя «мезотерапия» приобрела известность в народном обиходе.
Инъекционный липолиз обычно проводится с использованием продуктов с торговыми наименованиями, таких как Lipodissolve™ и Lipostabil™, или с использованием запатентованных рецептур, поставляемых в аптеках. Единственным общим ингредиентом всех инъекционных препаратов для липолиза является фосфатидилхолин (PPC).
В Соединенных Штатах дезоксихолат натрия (DC), компонент желчи, является вторым основным ингредиентом, используемым для поддержания растворимости PPC и в форме для инъекций без осаждения из раствора.
Фосфатидилхолин (PPC) и дезоксихолат натрия (DC) являются фосфолипидами, эмульгаторами и поверхностно-активными веществами.PPC является наиболее распространенным фосфолипидным компонентом клеточных мембран, предшественником ацетилхолина и составной частью липопротеинов. ДК входит в состав желчи. Оба вещества естественным образом присутствуют в организме человека.
В отличие от инъекций в мезодерму, процедуры инъекционного липолиза доставляются в подкожно-жировую клетчатку. В обоих случаях глубина инъекции имеет решающее значение для предотвращения повреждения фасции. Было высказано предположение, что лечение PPC и DC уменьшает количество подкожного жира за счет некроза адипоцитов из-за прямого токсического воздействия или действия сурфактанта.
Фосфатидилхолин (PPC) и дезоксихолат натрия (DC) одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для использования в качестве поверхностно-активных веществ и носителей лекарств, среди прочего, но ни один из них не одобрен для подкожной инъекции. Lipodissolve™ и Lipostabil™ не одобрены FDA.
Запатентованные рецептуры PPC/DC и других лекарственных средств производятся в аптеках, однако такие составы не стандартизированы с точки зрения надлежащей производственной практики и стерильности.
FDA хорошо известно, что инъекции для уменьшения жировых отложений выполняются, но агентство до сих пор не использовало свои правоприменительные полномочия, чтобы ограничить использование составных PPC / DC.
Безопасность и эффективность инъекционного липолиза
На сегодняшний день сообщения о безопасности и эффективности инъекционного липолиза были единичными. Любое клиническое исследование, включающее подкожную инъекцию этих препаратов, требует одобрения FDA заявки на получение нового исследуемого препарата (IND) плюс одобрение IRB.
Сообщалось о нежелательных явлениях, включая инфекции кожи, вызванные микобактериями, после инъекции составных препаратов для инъекционного липолиза.
Рекомендации относительно инъекционного липолиза
Пациенты должны быть проинформированы о том, что в этой процедуре используются лекарственные препараты, не одобренные FDA для инъекций.
Использование комбинации PPC/DC разрешено в контексте клинических испытаний, проводимых в соответствии с одобренным FDA протоколом исследования IND (исследуемый новый препарат).
Врачи могут заказывать в аптеке рецептуры по индивидуальным рецептам, разработанным для конкретного пациента с целью инъекционного липолиза. «Оптовые» закупки составных препаратов будут невозможны. Существует риск расследования FDA и санкций в отношении составных лекарств, не одобренных FDA.
Lipodissolve™ и Lipostabil™ не одобрены FDA. Их ввоз или использование является незаконным.
— Принято в октябре 2007 г.
Механизм усиления липолиза при раковой кахексии
Резюме
Потеря жировой массы является ключевым признаком раковой кахексии и объясняется усилением липолиза адипоцитов.Механизм этого изменения неизвестен и в настоящее время исследуется. Мы изучали зрелые пк. жировые клетки и дифференцированные преадипоциты от 26 онкологических больных с кахексией и без нее. Гормон-индуцированный липолиз и экспрессию генов, регулирующих липолиз, определяли вместе с составом тела и липолитической активностью in vivo (глицерин плазмы натощак или жирные кислоты, связанные с жировыми отложениями). Жир тела уменьшился на 40%, а липолитическая активность in vivo увеличилась в 2 раза при кахексии ( P = 0.001). В зрелых адипоцитах липолитические эффекты катехоламинов и натрийуретического пептида усиливались в 2-3 раза при кахексии ( P < 0,001). Этому полностью противодействовало ингибирование гормоночувствительной липазы, ограничивающей скорость липолиза. При кахексии уровни экспрессии мРНК и белка HSL увеличивались на 50% и 100% соответственно ( P = 0,005–0,03), что сильно коррелировало с липолитической стимуляцией in vitro ( r = 0.7–0,9). Антилиполитический эффект инсулина в зрелых жировых клетках и стимулированный липолитический эффект в дифференцированных преадипоцитах не изменялись при кахексии. У пациентов, похудевших за счет других факторов, кроме раковой кахексии, не было изменений в липолизе адипоцитов. В заключение, липолиз адипоцитов увеличивается при раковой кахексии не из-за неэпигенных факторов или потери веса как таковой, а, скорее всего, из-за усиленной экспрессии и функции HSL адипоцитов. Избирательное ингибирование этого фермента может предотвратить потерю жира у больных раком.[Cancer Res 2007; 67 (11): 5531–7]
- Адипоциты
- Катехоламины
- Инсулин
- Натрийуретические пептиды
- Гормоночувствительная липаза
- Жировая триглицеридлипаза
Введение
Многие онкологические больные имеют синдром истощения, называемый кахексией, который характеризуется потерей скелетных мышц и жировой ткани. Хотя механизмы атрофии мышц интенсивно изучались, гораздо меньше известно о факторах, способствующих потере жировой ткани у больных раком. 1, 2).Однако считается, что усиление липолиза жировых клеток, приводящее к потере липидов из жировой ткани, не зависит от недоедания, как было указано в обзоре ( 1– 4). Действительно, многие исследования показали, что повышенный липолиз in vivo является ключевым фактором жировой кахексии у больных раком, теряющих вес. 5– 8).
Повышенное производство липолитических факторов из жировой ткани, таких как интерлейкин 6 (IL-6) и фактор некроза опухоли α (TNFα), или липолитических факторов опухолевого происхождения, таких как гликопротеин цинка α 2 (ZAG), может объяснить повышенный липолиз в раковая кахексия ( 4, 9).Кроме того, важное значение может иметь измененное действие основных гормонов, регулирующих липолиз, катехоламинов (стимулирующее), натрийуретических пептидов (стимулирующее) и инсулина (ингибирующее). 4). Эти гормоны регулируют липолиз с помощью отдельных механизмов, которые все сходятся на последней лимитирующей стадии активации липолиза [т. 10). Недавно описанная система натрийуретических пептидов опосредована циклическим гуанозин-3′,5′-монофосфатным путем (цГМФ), который стимулирует протеинкиназу G, так что HSL активируется. 11).
Механизм липолиза адипоцитов до сих пор не был продемонстрирован при раковой кахексии человека. Настоящее исследование in vitro было проведено для выяснения того, изменяется ли гормональная регуляция липолиза в жировых клетках инсулином, катехоламинами и натрийуретическими пептидами при раковой кахексии. Раковая кахексия определялась как непреднамеренная потеря веса у пациентов с аденокарциномой желудочно-кишечного тракта. Для контроля неспецифических эффектов рака и потери веса мы включили две контрольные группы.Один состоял из пациентов со стабильным весом, тогда как второй состоял из пациентов с раком, теряющих вес с признаками недоедания (анорексия и/или желудочно-кишечная непроходимость). Причины потери веса в последней группе могут быть иными, чем в группе с кахексией.
Материалы и методы
Больные. Все пациенты, которым была назначена операция по поводу рака желудочно-кишечного тракта в период с января 2004 г. по декабрь 2005 г. (~300 пациентов), были оценены для участия в исследовании, и все пациенты, которые ( a ) были пригодны, несмотря на их раковое заболевание ( b ), не получали предшествующее противораковое лечение, и ( c ) были готовы участвовать ( n = 26).Исследование было одобрено Этическим комитетом Каролинского института. После подробного разъяснения каждому пациенту сути исследования было получено их информированное согласие. Пациенты были разделены на три группы на основании диагноза, поставленного перед операцией одним из ответственных хирургов (Т.А., Дж.П., Б.И.), который не принимал участия в анализах жировой ткани. Диагноз каждого пациента был ослеплен для лиц, ответственных за исследования липолиза (P.A.), исследования экспрессии генов (J.H.), исследования экспрессии белков (M.R.), и исследования преадипоцитов (V.v-H., J.L., A.D.) до получения всех данных. Ни у одного из больных не было желтухи. Раковая кахексия ( n = 7) определялась как предварительно диагностированный рак желудочно-кишечного тракта без признаков желудочно-кишечной непроходимости или анорексии с тошнотой и/или болями в животе в сочетании с непреднамеренной потерей веса более чем на 5% от обычного веса в течение последних 3 месяцев. или> 10% потеря веса в течение последних 6 месяцев. Одна контрольная группа ( n = 11) состояла из субъектов с предварительно диагностированным раком желудочно-кишечного тракта, которые не сообщали о значительных изменениях веса в течение последнего года.Вторая контрольная группа ( n = 8) состояла из субъектов с предварительно диагностированным раком желудочно-кишечного тракта, которые сообщали о потере веса, как определено выше для группы раковой кахексии, в сочетании с симптомами анорексии, дисфагии и/или признаками обструктивного рака, которые предположительно вызвало недоедание. Исследование было разработано как «намерение лечить». Таким образом, все включенные пациенты были оставлены в первичном анализе, несмотря на послеоперационную реклассификацию. Ни один из пациентов с кахексией не был переклассифицирован.У этих пациентов была аденокарцинома поджелудочной железы ( n = 5), толстой кишки ( n = 1) или кардии желудка ( n = 1). Два контрольных пациента со стабильным весом не имели рака, но имели хронический панкреатит. Остальные пациенты имели аденокарциному поджелудочной железы ( n = 3), аденокарциному желудочка ( n = 1), аденокарциному толстой кишки ( n = 3) или дисплазию пищевода ( n = 1). У двух пациентов контрольной группы с потерей веса не было рака, но был хронический панкреатит или хронический холецистит, но не было желтухи.У остальных пациентов контрольной группы с потерей веса был обструктивный рак пищевода ( n = 5) или обструктивный рак поджелудочной железы, связанный с болью в животе при приеме пищи ( n = 1).
Клиническое обследование. Пациенты пришли в лабораторию после ночного голодания. Рост, вес, соотношение талии и бедер и состав тела определяли с помощью биоимпеданса с помощью Bodystat Quad Scand 4000 (Bodystat Ltd.). Образец венозной крови был получен для определения липидов, глицерина, жирных кислот, альбумина, С-реактивного белка, инсулиноподобного фактора роста I (IGF-I), лептина, норадреналина, адреналина и инсулина с помощью аккредитованного в больнице рутинного биохимического анализа. лаборатории, а предсердный натрийуретический пептид измеряли с использованием набора RIA (Phoenix Peptides).Нутритивный статус оценивали с помощью стандартизированного онкологического опросника, называемого субъективной общей оценкой (SGA; ссылка 12). Стадию опухоли после операции классифицировали в соответствии с TNM-классификацией злокачественных опухолей Международного союза борьбы против рака, 6-е издание ( 13).
Жировая биопсия. После клинического осмотра п/к брюшной полости. жировая биопсия (0,5–1 г) была получена пункционной биопсией, как описано ( 14). Кусочки ткани (≈5 мг каждый) быстро промывали физиологическим раствором и подвергали исследованию липолиза.Одну порцию собранной жировой ткани массой 300 мг замораживали в жидком азоте и хранили при температуре -70°C для последующего изучения экспрессии генов. Это было сделано для всех испытуемых, за исключением трех контролей с потерей веса. Другую порцию 300 мг оставляли таким же образом для последующего вестерн-блоттинга. Это было сделано для шести пациентов с кахексией, восьми контролей со стабильным весом и двух контролей с потерей веса. Ранее мы показали, что кусочки ткани, удаленные и замороженные таким образом, не содержат поврежденных клеток и крови ( 15).
Липолиз. Оставшуюся ткань пункционной биопсии (500–600 мг) немедленно обработали дополнительно. Изолированные жировые клетки получали путем обработки жировой ткани коллагеназой; определяли размер жировых клеток; и эксперименты по липолизу были проведены на изолированных жировых клетках, как описано ( 16). Вкратце, разбавленные суспензии жировых клеток (2% по объему) инкубировали в альбуминовом буфере (pH 7,4), дополненном глюкозой, аскорбиновой кислотой и, для экспериментов с инсулином, аденозиндезаминазой и 10 -3 моль/л. 8-бромциклического АМФ (8-Br-цАМФ).Клетки инкубировали при 37°С в течение 2 ч без (базового) или с возрастающими концентрациями (10 -16 -10 -5 моль/л, в зависимости от используемого гормона) норадреналина, предсердного натрийуретического пептида, инсулина вместе. с 10 -2 моль/л 8-Br-цАМФ, 8-Br-цАМФ (10 -2 моль/л) отдельно или 10 -2 моль/л 8-бром-цГМФ (8-Br -цГМФ). После этого определяли высвобождение глицерина в инкубационную среду (индекс липолиза). В дополнительных экспериментах по липолизу в буфер, содержащий 8-Br-цАМФ плюс аденозиндезаминазу, также добавляли максимально эффективную концентрацию (10 -5 моль/л) высокоселективного ингибитора гормоночувствительной липазы 4-изопропил-3- метил-2-[1-(3-(S)-метил-пиперидин-1-ил)метаноил]-2H-изоксазол-5-он, называемый BAY ( 17).
Для пяти пациентов с раковой кахексией и восьми контролей со стабильным весом было получено достаточное количество стромальной фракции жировой ткани для выделения преадипоцитов. Эти клетки были дифференцированы точно так, как описано ( 17) в течение 2 недель, а эксперименты по липолизу без (базового) или с 10 -5 моль/л норадреналина проводили, как описано ( 16).
Данные липолиза выражали двумя способами: первым было высвобождение глицерина на грамм липидов в исследованиях зрелых жировых клеток или на грамм белка в исследованиях преадипоцитов.Второй был связан с базальным (не стимулированным гормонами) высвобождением глицерина. Последний определяли как индуцированные инсулином значения, деленные на индуцированные 8-Br-цАМФ значения в антилиполитических экспериментах, и значения, индуцированные норадреналином или предсердным натрийуретическим пептидом, деленные на исходные значения в липолитических экспериментах. Максимальный эффект определяли как значение, полученное при максимальной эффективной концентрации гормона. Приоритет был отдан экспрессии липолиза в зависимости от базальной скорости, поскольку существует сильная связь между этим способом экспрессии липолиза и экспрессией гена HSL или белка в организме человека.в. жировые клетки ( 18).
Экспрессия генов. Тотальную РНК экстрагировали из 300 мг жировой ткани с использованием мини-набора RNeasy (Qiagen GmbH). Биоанализатор Agilent 2100 (Agilent Technologies) использовали для подтверждения целостности РНК. Один микрограмм тотальной РНК из каждого образца был обратно транскрибирован в кДНК с использованием набора Omniscript RT (Qiagen) и случайных гексамерных праймеров (Invitrogen). Синтез кДНК проводили одновременно для всех субъектов с использованием одной и той же смеси праймеров и набора RT.В конечном объеме 25 мкл 5 нг кДНК смешивали с 2× SYBR green PCR master mix (Bio-Rad Laboratories, Inc.) и праймерами (Invitrogen). Пары праймеров были выбраны для получения одного ампликона на основании кривых диссоциации и анализа с помощью электрофореза в агарозном геле. Используемые праймеры: 5′-GTGTCAGACGGCGAGAATG-3′ (смысловой) и 5′-TGGAGGGAGGGAGGGATG-3′ (антисмысловой) для жировой триглицеридлипазы, 5′-GGAAGTGCTATCGTCTCTGG-3′ (смысловой) и 5′-GGCAGTCAGTGGCATCTC-3′ (антисмысловой ) для HSL и 5′-TGACTCAACACGGGAAACC-3′ (смысловой) и 5′-TCGCTCCACCAACTAAGAAC-3′ (антисмысловой) для 18S.Количественную ПЦР в реальном времени проводили с помощью iCycler IQ (Bio-Rad Laboratories). Уровни мРНК определяли сравнительным методом C t . Субъект с самым высоким значением C t использовался в качестве эталона, из которого все другие значения C t для гена-мишени и эталонного гена, соответственно, вычитались из этого значения C t . Значения C t затем нормализовали к рРНК для 18S с использованием формулы 2 ΔCt-целевой ген /2 ΔCt-эталонный ген .
Экспрессия белка. Приблизительно 300 мг белой жировой ткани измельчали и лизировали в буфере для лизиса белка [1% Triton-X 100, Tris-HCl (pH 7,6) и 150 ммоль/л NaCl, 4°C] с добавлением ингибиторов протеаз [1 ммоль/л фенилметилсульфонилфторида и Complete (Boehringer Mannheim)] и гомогенизировали. Гомогенат центрифугировали, а инфранантант собирали и сохраняли. Содержание белка анализировали с использованием набора реагентов для анализа белка BCA (Pierce). Сто микрограммов общего клеточного белка загружали в полиакриламидные гели и разделяли с помощью стандартного 12% SDS-PAGE.Гели переносили на поливинилидинфторидные мембраны (Amersham Pharmacia). Блоты блокировали в течение 1 ч при комнатной температуре в трис-буферном солевом растворе с 0,1% Tween 20 и 5% обезжиренного сухого молока. Затем следовала инкубация в течение ночи при 4°C в присутствии антител, направленных против HSL ( 19) или контрольный белок β-актин (Sigma). Вторичные α-кроличьи антитела, конъюгированные с пероксидазой хрена, были получены от Sigma. Комплексы антиген-антитело обнаруживали с помощью хемилюминесценции с использованием набора для обнаружения (SuperSignal) от Pierce, а специфические полосы определяли и количественно определяли с использованием системы Chemidoc XRS и программного обеспечения Quantity One от Bio-Rad и выражали как отношение HSL/β-актина.
Статистический анализ. Сообщаемые значения являются средними ± стандартное отклонение или медианой и диапазоном. Значения с жировой тканью считались нормально распределенными, поскольку ретроспективный анализ ранее исследованных больших когорт с использованием тех же методов липолиза и экспрессии генов или белков показал нормальное распределение данных ( 18, 20, 21). Результаты сравнивали с использованием ANOVA и соответствующих апостериорных тестов, непарного или парного критерия Стьюдента t или линейной регрессии методом наименьших квадратов.Тесты Крускала-Уоллиса и Манна-Уитни использовались для сравнения значений SGA и оценки опухоли. Расчет мощности производился до отбора пациентов и основывался на ранее известном распределении максимального высвобождения глицерина, индуцированного норадреналином, деленного на базальное высвобождение глицерина ( 22). Мы ожидали, что набор пациентов со стабильным весом будет проще, и предполагалось, что относительное соотношение между тремя группами будет 2:3:2. Основываясь на этих оценках, а также среднем значении и стандартном отклонении норадреналина/базального липолиза, мы подсчитали, что нам пришлось набрать 7 пациентов с кахексией, 11 пациентов из контрольной группы со стабильным весом и 7 пациентов из контрольной группы с потерей веса, чтобы обнаружить 70%-ную разницу между кахексией и двумя контрольные группы при P < 0.05 (ANOVA) с мощностью 80% с использованием Sample Power (SPSS, Inc.).
Результаты
Результаты in vivo . Что касается клинических данных ( Таблица 1 ), группы были сопоставимы по среднему возрасту, а распределение по полу существенно не различалось. Индекс массы тела (ИМТ) и количество жира в организме были одинаковыми в контрольных группах с кахексией и потерей веса, но ниже по сравнению с группой со стабильным весом. Ни общее содержание воды в организме, ни безжировая масса тела не различались между тремя группами.Объем жировых клеток был одинаковым в двух группах с потерей веса, но намного меньше, чем в группе со стабильным весом. Кроме того, уровни инсулина, лептина, триглицеридов и сывороточного альбумина в плазме были одинаковыми в двух группах с потерей веса, но ниже, чем в группе со стабильным весом. Уровни IGF-I были снижены наполовину в контрольной группе с потерей веса по сравнению с двумя другими группами. Липолитическая активность in vivo, измеренная как концентрация жирных кислот в плазме или глицерина в плазме, деленная на общее количество жира в организме, была примерно в два раза выше у пациентов с кахексией по сравнению с пациентами в двух контрольных группах.Артериальное давление, частота пульса и концентрация катехоламинов или предсердного натрийуретического пептида в плазме были одинаковыми во всех группах. Показатели SGA были повышены у пациентов с кахексией и с потерей веса в контрольной группе. В последней группе этот показатель был значительно выше, чем в группе с кахексией ( P = 0,027, критерий Манна-Уитни). Различий в степени тяжести опухоли не было. Средний балл составил 3.
Таблица 1.Характеристики учебных групп
Липолиз in vitro. Инсулин ингибировал липолиз сходным образом в зависимости от концентрации в трех группах ( рисунок 1 ). Максимальное ингибирование липолиза варьировало от 55% до 60% в этих группах ( Рисунок 1).
Рисунок 1.Липолиз в зрелых жировых клетках пациентов с кахексией и контрольной группы. ANP, предсердный натрийуретический пептид.
Норадреналин и предсердный натрийуретический пептид стимулировали базальную скорость липолиза гораздо эффективнее ( P < 0.001, повторное измерение ANOVA) у больных с кахексией по сравнению с контрольными группами, которые не различались между собой ( Рисунок 1). В максимальной эффективной концентрации норадреналин стимулировал липолиз в 5, 3 и 2,5 раза в кахектичных, стабильных и худеющих группах соответственно ( P = 0,01; Рисунок 1). Соответствующие значения для натрийуретического пептида были 7-, 4- и 3-кратными ( P = 0,02; Рисунок 1).
Мы также выражали липолиз в виде абсолютных значений высвобождения глицерина (мкмоль/г липидов/2 ч).Как показано в Таблица 2 этот способ экспрессии дал такие же результаты, как и выше; однако некоторые из них не достигли уровня статистической значимости ( P = 0,06–0,07). Кроме того, базальный (негормональный) липолиз не различался между группами ( Таблица 2).
Таблица 2.Абсолютные значения базального и максимального гормон-индуцированного липолиза
Аналог цАМФ 8-Br-цАМФ вызывал 7-кратную стимуляцию липолиза в кахектичной группе по сравнению с 3-кратной стимуляцией в двух контрольных группах ( Инжир.2 ). Селективный ингибитор HSL BAY снижал липолитический эффект аналога цАМФ более чем на 90% без каких-либо различий между группами. Рис. 2). Наконец, 8-Br-цГМФ стимулировал липолиз в 10 ± 6 раз при кахексии и в 3,0 ± 1,6 и 2,7 ± 0,5 раза соответственно в двух контрольных группах ( P = 0,03).
Рисунок 2.Экспериментальные исследования. Вверху слева, Липолитический эффект аналога цАМФ ( 8-bcAMP ) с ингибитором HSL BAY или без него. Вверху справа, экспрессия мРНК HSL и жировой триглицеридлипазы ( ATGL ). Внизу слева, взаимосвязь между экспрессией белка HSL (соотношение актина) и липолитическим эффектом норадреналина. Внизу справа, липолиз в преадипоцитах, дифференцировавшихся в адипоциты.
Экспрессия генов. В жировой ткани пациентов с кахексией экспрессия мРНК HSL была на ≈50% выше по сравнению с двумя контрольными группами, которые не различались между собой, но не было различий между тремя группами в экспрессии жировой триглицеридлипазы ( Инжир.2). Что касается максимального липолитического эффекта норадреналина или предсердного натрийуретического пептида, оба гормона показали сильную положительную корреляцию с экспрессией гена HSL ( r = 0,58; P = 0,005 для норадреналина и r = 0,50; P = 0,0051 предсердный натрийуретический пептид; графики не показаны). Для мРНК жировой триглицеридлипазы такой корреляции не наблюдалось ( r ≈ 0,15).
Экспрессия белка. Количество исследованных субъектов было слишком мало для анализа трех отдельных групп.Однако при кахексии экспрессия белка HSL увеличивалась в 2 раза по сравнению с двумя контрольными группами (0,23 ± 0,57 против 0,69 ± 0,34 условных единиц; P = 0,032; Рис. 2). Когда все данные о белках были собраны, была выявлена сильная положительная корреляция между экспрессией белка HSL и норадреналин-стимулированным липолизом. Рис. 2). До 50% вариаций липолиза (с поправкой х 2 ) можно объяснить вариациями HSL. Аналогичные корреляции были получены с предсердным натрийуретическим пептидом ( r = 0.67; P = 0,005) или 8-Br-цАМФ ( r = 0,85; P < 0,001). Результаты не изменились существенным образом, когда вместо соотношения HSL/актин использовали абсолютные значения экспрессии HSL ( r = 0,67–0,85; графики не показаны). Экспрессия β-актина не коррелировала с липолизом ( r = 0,03–0,07). Экспрессия мРНК и белка HSL показала очень сильную корреляцию ( r = 0,81; P = 0,001).
Преадипоциты. В преадипоцитах ( Рис. 2) дифференцированных в адипоциты, липолитический эффект норадреналина был одинаковым при кахексии и контроле со стабильной массой тела (≈8-кратная стимуляция базальной скорости). Аналогичные результаты были получены, когда липолиз преадипоцитов выражали как функцию содержания клеточного белка (значения не показаны).
Четыре контрольных субъекта были классифицированы неправильно, так как у них не было рака. При их исключении результаты анализа, представленные выше, оказались практически такими же, как и для всего материала.
Обсуждение
Контрольная группа с потерей веса имела нарушения приема пищи и/или признаки стриктуры желудочно-кишечного тракта, которые предположительно вызвали недоедание. Эти проблемы не были обнаружены в кахектической группе. Тяжесть опухоли была одинаковой во всех трех группах. Две группы с потерей веса имели сопоставимые значения ИМТ, жировой массы и уровней лептина, инсулина, триглицеридов и альбумина в плазме, все из которых были намного ниже, чем у больных раком со стабильным весом.Это предполагает сходное катаболическое состояние в двух первых группах. Тем не менее, было два четких различия в клинических характеристиках двух групп с потерей веса. Контрольная группа с потерей веса имела гораздо более высокие показатели SGA, чем пациенты с кахексией, и только первые пациенты демонстрировали более низкие значения IGF-I. Как SGA, так и IGF-I являются маркерами недостаточности питания, как обсуждалось ( 23, 24). Таким образом, наши клинические данные ясно указывают на то, что две группы с потерей веса, по крайней мере частично, имеют различную этиологию, лежащую в основе сообщаемой ими потери веса, при этом недоедание преобладает только в контрольной группе.
Мы не обнаружили различий в безжировой массе тела между группами. Однако ни один из наших пациентов не был очень худым (самый низкий ИМТ был 18,6 кг/м 2 ), что указывает на то, что мы могли изучать пациентов в ранней фазе кахексии, когда наблюдается преимущественно потеря жировой ткани. Это мнение подтверждается недавним большим исследованием, показывающим, что жировые отложения теряются быстрее, чем мышечная ткань, при прогрессирующей раковой кахексии. 25).
Только в группе с кахексией наблюдалось значительное повышение in vivo липолиза, хотя не было признаков повышенной активности симпатической нервной системы или повышенных уровней циркулирующего натрийуретического пептида.Что касается клеточного механизма, способствующего увеличению липолиза при кахексии человека, то антилиполитический эффект инсулина при кахексии существенно не изменился. Напротив, липолитические эффекты двух основных систем гормонов, регулирующих липолиз у человека (т. е. катехоламинов и натрийуретических пептидов), были заметно повышены у пациентов с кахексией по сравнению с двумя контрольными группами. Кроме того, стимуляция липолиза аналогами цАМФ или цГМФ также давала повышенный эффект в группе с кахексией.Норадреналин и натрийуретический пептид стимулируют липолиз адипоцитов посредством отдельных сигнальных путей (опосредованных либо цАМФ, либо цГМФ), которые сходятся в HSL, ферменте, который также является мишенью для цАМФ и цГМФ. Сходные результаты с двумя циклическими нуклеотидами указывают на то, что клеточный механизм повышенного липолиза при кахексии обусловлен усиленной липолитической передачей сигналов гормональными системами на пострецепторном уровне из-за усиленной функции HSL. Действительно, это, по-видимому, так, потому что липолиз может быть ингибирован в одинаковой степени во всех трех группах с использованием высокоселективного ингибитора HSL BAY.
В предыдущем исследовании экспрессия гена HSL в жировой ткани была увеличена у больных раком по сравнению с контрольными пациентами ( 26). Мы обнаружили избирательное увеличение экспрессии гена HSL на 50% в группе с кахексией и двукратное увеличение количества белка HSL в адипоцитах среди этой группы по сравнению с двумя другими группами вместе взятыми. Во всем материале экспрессия гена и белка HSL сильно коррелировала с липолитическим эффектом норадреналина или натрийуретического пептида и могла объяснить 50% различий между субъектами в липолитическом эффекте гормона.Кроме того, уровни мРНК и белка HSL были сильно взаимосвязаны, а избыточная экспрессия HSL приводит к заметному увеличению активности липазы адипоцитов. 27). Таким образом, если свести воедино имеющиеся и предыдущие данные, вполне вероятно, что повышенная продукция белка HSL из-за повышенной активности генов в жировых клетках является основной причиной усиленного липолиза при раковой кахексии.
Новая липаза – жировая триглицеридлипаза может быть важна для определения липолиза жировых клеток ( 28).В этом исследовании, однако, не наблюдалось влияния кахексии на экспрессию жировой триглицеридлипазы, и экспрессия этого фермента не коррелировала с липолизом. Кроме того, остаточная липолитическая активность адипоцитов была <10% во всех группах, когда HSL-индуцированный липолиз был ингибирован, что свидетельствует об отсутствии или незначительной роли жировой триглицеридлипазы в измененной регуляции липолиза при раковой кахексии.
Наши результаты показывают, что лечение раковой кахексии недавно разработанными селективными ингибиторами HSL может иметь клиническое значение для предотвращения потери жировой ткани. 29).Хотя потеря жировой ткани может быть менее опасной, чем потеря мышечной массы при раковой кахексии, первая, по-видимому, предшествует второй. Возможно, раннее лечение антилиполиза могло бы замедлить или предотвратить прогрессирующее истощение у больных раком.
Маловероятно, что повышенный липолиз при кахексии является вторичным по отношению к потере веса, потому что пациенты контрольной группы с потерей веса имели такую же липолитическую активность адипоцитов, как и пациенты контрольной группы со стабильным весом. Однако повышенный липолиз при кахексии не является эпигенетическим явлением, потому что разница в липолизе между контрольной группой со стабильным весом и кахексией исчезла в преадипоцитах, которые дифференцировались в жировые клетки.В этих клетках было исключено влияние внешних факторов. Эти факторы могут продуцироваться в жировой ткани или быть циркулирующими факторами, продуцируемыми некоторыми опухолями. Одним из таких неисследованных нами липолитических медиаторов мог быть ZAG ( 4, 9). Вполне возможно, что ZAG-индуцированный липолиз усиливается при раковой кахексии у человека, потому что этот белок стимулирует липолиз тем же путем, что и катехоламины. 30, 31). Было показано, что у грызунов с экспериментально индуцированной раковой кахексией фактор, полученный из опухоли, повышает чувствительность жировой ткани к липолитическим стимулам. 32).
Актуальны ли настоящие результаты для других липолитических регуляторов, таких как IL-6 и TFNα? Вероятно, нет, потому что базальный липолиз не влияет на раковую кахексию. В жировых клетках человека TNFα прежде всего увеличивает базальную скорость липолиза адипоцитов. 33). Кроме того, стимулирующий эффект ИЛ-6 на липолиз у человека столь же острый, что не согласуется с нашими наблюдениями за HSL ( 34).
Наши исследования проводились на относительно небольших группах. Очень трудно привлечь к этому типу исследований пациентов с раковой кахексией.Тем не менее, исследование было направлено на выявление наблюдаемых различий в липолизе.
В заключение мы предполагаем, что еще не идентифицированные факторы у некоторых больных раком увеличивают экспрессию генов и, таким образом, выработку белка HSL в жировых клетках. Это усиливает стимулирующий эффект липолитических гормонов и, возможно, специфических факторов кахексии, таких как ZAG. Поскольку гормоны всегда присутствуют в кровотоке, липолиз постоянно активируется, поскольку действие основного антилиполитического гормона, инсулина, не изменяется.Следовательно, ингибиторы HSL могут быть полезны при лечении или профилактике раковой кахексии.
Благодарности
Грантовая поддержка: Шведское онкологическое общество и Шведский исследовательский совет.
Затраты на публикацию этой статьи были частично покрыты оплатой страниц. Таким образом, эта статья должна иметь пометку реклама в соответствии с 18 U.S.C. Раздел 1734 исключительно для указания на этот факт.
Мы благодарим Керстин Волен, Еву Шолин, Габи Острём, Катарину Хертель и Бритт-Мари Лейонхуфвуд за квалифицированную техническую помощь; Bayer (West Haven, CT) за поставку BAY; С.Holm (медицинский факультет Лундского университета, Лунд, Швеция) для антител HSL; и Гансу Варенбергу за консультации по статистике.
Footnotes
- Получено 13 декабря 2006 г.
- Пересмотр получено 6 марта 2007 г.
- Принято 10 апреля 2007 г.
Каталожные номера
- ↵
Эспер, Д.Х., Харб, Вашингтон. Синдром раковой кахексии: обзор метаболических и клинических проявлений.Нутр Клин Практ 2005 г.; 20: 369–76.
- ↵
Тиерина А.Я. Биохимические основы метаболизма при раковой кахексии. Dimens Crit Care Nurs 2004 г.; 23: 237–43.
Zuijdgeest-van Leeuwen SD, van den Berg JW, Wattimena JL, et al. Липолиз и окисление липидов у больных раком с потерей веса и у здоровых людей. Метаболизм 2000 г.; 49: 931–6.
- ↵
Калра Пр., Тигас С.Регуляция липолиза: натрийуретические пептиды и развитие кахексии. Инт Джей Кардиол 2002 г.; 85: 125–32.
- ↵
Легаспи А., Дживанандам М., Старнес Х.Ф., мл., Бреннан М.Ф. Липидный и энергетический обмен всего тела у онкологического больного. Метаболизм 1987 год; 36: 958–63.
Шоу Дж.Х., Вулф Р.Р. Кинетика жирных кислот и глицерина у больных с сепсисом и у больных раком желудочно-кишечного тракта.Реакция на инфузию глюкозы и парентеральное питание. Энн Сург 1987 год; 205: 368–76.
Хилтандер А., Данерид П., Сандстром Р., Корнер У., Лундхольм К. Активность β-адренорецепторов и метаболизм энергии в покое у больных раком, теряющих вес. Евр Джей Рак 2000 г.; 36: 330–4.
- ↵
Кляйн С., Вулф Р.Р. Липолиз всего тела и цикл триглицеридов и жирных кислот у кахектичных пациентов с раком пищевода.Джей Клин Инвест 1990 г.; 86: 1403–8.
- ↵
Тисдейл М.Дж. Молекулярные пути, ведущие к раковой кахексии. Физиология (Бетесда) 2005 г.; 20: 340–8.
- ↵
Арнер П. Липолиз жировых клеток человека: биохимия, регулирование и клиническая роль. Best Pract Res Clin Endocrinol Metab 2005 г.; 19: 471–82.
- ↵
Сенгенес С., Булуми А., Хаунер Х. и др.Участие цГМФ-зависимого пути в опосредованном натрийуретиковым пептидом фосфорилировании гормоночувствительной липазы в адипоцитах человека. J Биол Хим 2003 г.; 278: 48617–26.
- ↵
Оттери ФД. Определение стандартизированной оценки питания и путей вмешательства в онкологии. Питание 1996 год; 12: С15–9.
- ↵
Собин Л., Виттекинд С. Международный союз по борьбе с раком (UICC). В кн.: Классификация злокачественных опухолей по TNM.6-е изд. Нью-Джерси: Джон Уайли и сыновья; 2002. с. 1–272.
- ↵
Колачински Дж. В., Моралес Л. М., Мур Дж. Х. мл. и др. Новая методика биопсии абдоминального жира человека под местной анестезией лидокаином. Int J Obes Relat Metab Disord 1994 год; 18: 161–6.
- ↵
Райден М., Элизальде М., ван Хармелен В. и др. Повышенная экспрессия белка eNOS в сальниковой по сравнению с подкожной жировой тканью у людей с ожирением.Int J Obes Relat Metab Disord 2001 г.; 25: 811–5.
- ↵
Lofgren P, Hoffstedt J, Naslund E, Wiren M, Arner P. Проспективные и контролируемые исследования действия инсулина и катехоламинов на жировые клетки женщин с ожирением после снижения веса. Диабетология 2005 г.; 48: 2334–42.
- ↵
Langin D, Dicker A, Tavernier G, et al. Липазы адипоцитов и дефект липолиза при ожирении человека.Сахарный диабет 2005 г.; 54: 3190–7.
- ↵
Большой В., Рейнисдоттир С., Лангин Д. и др. Снижение экспрессии и функции липазы, чувствительной к гормонам адипоцитов, в подкожно-жировых клетках у пациентов с ожирением. J липидный рез 1999 г.; 40: 2059–66.
- ↵
Faulds G, Ryden M, Ek I, Wahrenberg H, Arner P. Механизмы резистентности подкожно-жировых клеток к липолитическим катехоламинам при синдроме поликистозных яичников.J Clin Эндокринол Метаб 2003 г.; 88: 2269–73.
- ↵
Hoffstedt J, Naslund E, Arner P. Полиморфизм гена Calpain-10 связан со снижением функции β(3)-адренорецепторов в жировых клетках человека. J Clin Эндокринол Метаб 2002 г.; 87: 3362–7.
- ↵
Nordstrom EA, Ryden M, Backlund EC, et al. Специфическая для человека роль эффектора А, подобного DFFA (фактор фрагментации ДНК-α), индуцирующего гибель клеток (CIDEA), в липолизе адипоцитов и ожирении.Сахарный диабет 2005 г.; 54: 1726–34.
- ↵
Лофгрен П., Хоффштедт Дж., Райден М. и др. Основные гендерные различия в липолитической способности абдоминальных подкожно-жировых клеток при ожирении наблюдаются до и после длительного снижения массы тела. J Clin Эндокринол Метаб 2002 г.; 87: 764–71.
- ↵
Bauer J, Capra S, Ferguson M. Использование оцениваемой пациентом субъективной глобальной оценки (PG-SGA) в качестве инструмента оценки питания у больных раком.Евр Джей Клин Нутр 2002 г.; 56: 779–85.
- ↵
Bing C. Взгляд на ось гормон роста-инсулиноподобный фактор роста-I при раковой кахексии. Бр Дж Нутр 2005 г.; 93: 761–3.
- ↵
Фуладьюн М., Корнер Ю., Бозеус I и др. Состав тела и временные изменения в региональном распределении жировой и мышечной ткани у неотобранных больных раком, получающих паллиативную помощь, коррелируют с приемом пищи, метаболизмом, переносимостью физических упражнений и гормонами.Рак 2005 г.; 103: 2189–98.
- ↵
Томпсон М.П., Купер С.Т., Парри Б.Р., Таки Дж.А. Повышенная экспрессия мРНК гормоночувствительной липазы в жировой ткани онкологических больных. Биохим Биофиз Акта 1993 год; 1180: 236–42.
- ↵
Шталрид С, Комаромы МЦ, Кремер Ф.Б. Гиперэкспрессия гормоночувствительной липазы предотвращает накопление триглицеридов в адипоцитах. Джей Клин Инвест 1995 год; 95: 2652–61.
- ↵
Zechner R, Strauss JG, Haemmerle G, Lass A, Zimmermann R. Липолиз: путь в стадии разработки. Карр Опин Липидол 2005 г.; 16: 333–40.
- ↵
Кусуноки Дж., Канатани А., Моллер Д.Э. Модуляция метаболизма жирных кислот как потенциальный подход к лечению ожирения и метаболического синдрома. Эндокринный 2006 г.; 29: 91–100.
- ↵
Рассел С.Т., Хираи К., Тисдейл М.Дж.Роль β 3 -адренорецепторов в действии опухолевого липидмобилизующего фактора. Бр Дж Рак 2002 г.; 86: 424–8.
- ↵
Рассел С.Т., Циммерман Т.П., Домин Б.А., Тисдейл М.Дж. Индукция липолиза in vitro и потеря жира in vivo цинк-α 2 -гликопротеин. Биохим Биофиз Акта 2004 г.; 1636: 59–68.
- ↵
Ислам-Али Б., Хан С., Прайс С.А., Тисдейл М.Дж.Модуляция экспрессии G-белка адипоцитов при раковой кахексии с помощью фактора мобилизации липидов (LMF). Бр Дж Рак 2001 г.; 85: 758–63.
- ↵
Райден М., Дикер А., ван Хармелен В. и др. Картирование ранних сигнальных событий в липолизе, опосредованном фактором некроза опухоли-α, в жировых клетках человека. J Биол Хим 2002 г.; 277: 1085–91.
- ↵
Стаутхард Дж.М., Ромейн Дж.А., Ван дер Полл Т. и др. Эндокринологические и метаболические эффекты интерлейкина-6 у человека.Am J Physiol 1995 год; 268: Е813–9.
Границы | Влияние острых и хронических упражнений на липолиз брюшного жира: обновление
Введение
Физические упражнения являются одним из наиболее эффективных способов изменения образа жизни для борьбы со многими хроническими заболеваниями, в частности с ожирением и диабетом 2 типа. Польза для здоровья от физических упражнений достигается за счет улучшения энергетического обмена и гомеостаза глюкозы. Эти преимущества сохраняются в течение длительного времени за счет улучшения состава тела, вызванного гипертрофией мышц и потерей жировой массы (Ross and Bradshaw, 2009; Peterson et al., 2011; Стоунер и др., 2016; Эванс и др., 2019 г.; Хсу и др., 2019 г.; Виана и др., 2019). Важно отметить, что даже если тренировочные вмешательства обычно оказывают очень скромное влияние на массу тела, постоянное наблюдение показывает уменьшение окружности талии и массы висцеральной белой жировой ткани (ВЖТ), что, следовательно, является эффективной стратегией снижения кардиометаболического риска у людей с ожирением. Wewege и др., 2017).
Во время тренировки скелетные мышцы используют как жирные кислоты (ЖК), так и глюкозу в качестве топлива для поддержания сокращения мышечных волокон.Когда упражнения выполняются с высокой интенсивностью и в течение короткого времени, мышечные клетки в основном полагаются на глюкозу и мышечный гликоген в качестве топлива, которое в основном высвобождается из запасов гликогена в мышцах и печени. Однако, если упражнение выполняется с умеренной интенсивностью и в течение более длительного времени, ФА станет основным источником энергии для поддержания мышечного сокращения. Действительно, окисление жирных кислот в мышцах зависит от поступления жирных кислот из разных источников: жирные кислоты, высвобождаемые в результате липолиза триацилглицеролов (ТГ), хранящихся в WAT, из циркулирующих ТГ липопротеинов очень низкой плотности (ЛПОНП-ТГ), из внутримиоцеллюлярных триацилглицеролов (ВМТГ) и потенциально ТГ хранится в меж/внутримышечной жировой ткани (IMAT).Вклад ЛПОНП-ТГ в окисление липидов всего тела колеблется от 5 до 10% в состоянии покоя и, по-видимому, незначителен во время физической нагрузки (Wolfe et al., 1985; Kiens and Lithell, 1989). Таким образом, жирные кислоты, полученные из IMTG и периферической WAT, являются основными источниками липидного топлива во время упражнений (Horowitz, 2003). Их относительный вклад в расход энергии при выполнении упражнений зависит от ряда факторов, таких как интенсивность упражнений, их продолжительность и тренировочный статус (Horowitz and Klein, 2000). Упражнения низкой и средней интенсивности, в диапазоне от 25 до 65% от максимального потребления кислорода (VO 2 max), связаны с 5-10-кратным увеличением окисления липидов всего тела по сравнению с отдыхом (Romijn et al., 1993). Большая часть увеличения доступности ЖК обеспечивается липолизом ЖАТ, который увеличивается в 2–4 раза (Ромийн и др., 1993; Кляйн и др., 1994; Краузова и др., 2018). В этом обзоре мы обсудим влияние острых и хронических упражнений на липолиз абдоминальной жировой ткани у худых и тучных людей.
Влияние интенсивной физической нагрузки на липолиз жировой ткани
Основные источники ОС
Многочисленные исследования продемонстрировали тесную связь между липолизом и окислением жирных кислот во время физических упражнений.Действительно, наблюдалась положительная корреляция между скоростью липолиза, измеренной in vitro в изолированных адипоцитах, и окислением ЖК в состоянии покоя у здоровых людей (Imbeault et al., 2000). Кроме того, была описана сильная положительная взаимосвязь между подкожным абдоминальным липолизом WAT и окислением жирных кислот всего тела, измеренным во время тренировки у тренирующихся на выносливость субъектов (Moro et al., 2014). Кроме того, активность жировой триглицеридлипазы (ATGL) повышается во время упражнений в WAT у худых и тучных людей (Petridou et al., 2017).
Брюшной WAT состоит из двух основных жировых компартментов, подкожного WAT (SCAT) с одной стороны и висцерального WAT с другой стороны. Упражнения в основном активируют липолиз при SCAT, так как только 5–10% циркулирующих длинноцепочечных ЖК высвобождаются из висцеральной жировой ткани у худощавых людей (Horowitz, 2003; Nielsen et al., 2004). Липолитический ответ SCAT в брюшной полости зависит как от интенсивности, так и от продолжительности упражнений (Horowitz, 2003). Кроме того, было высказано предположение, что подкожный абдоминальный липолиз выше, чем глютео-феморальный липолиз как у мужчин, так и у женщин, и что мужчины имеют относительную «резистентность» к опосредованному норэпинефрином липолизу из-за более высокого содержания в адипоцитах альфа2-адренорецепторов, которые ингибируют липолиз (Leibel and Hirsch, 1987; Jensen and Johnson, 1996; Moro et al., 2007). Однако в этих исследованиях относительная скорость липолиза, измеренная in vitro на изолированных адипоцитах, in situ посредством микродиализа и in vivo с использованием различий A-V у мужчин и женщин, показала, что более высокая мобилизация липидов наблюдаемое при физических нагрузках у женщин в основном объясняется большей массой подкожного жира по сравнению с мужчинами.
Основные липолитические гормоны и факторы
Активация SCAT-липолиза во время физической нагрузки может быть связана с увеличением концентрации катехоламинов в плазме, которые стимулируют бета-адренорецепторы на плазматической мембране адипоцитов, что приводит к внутриклеточной активации гормоночувствительной липазы (HSL; Horowitz, 2003).Однако ранее мы показали, что местное введение бета-блокатора пропранолола в SCAT лишь частично ингибирует вызванный физической нагрузкой липолиз (Moro et al., 2004; Verboven et al., 2018). Было обнаружено, что остаточный липолиз на уровне 60–70% коррелирует с концентрацией предсердного натрийуретического пептида (ANP) в плазме (Moro et al., 2004, 2008). Затем роль ANP в липолизе, вызванном физическими упражнениями, была дополнительно подтверждена во время повторных упражнений на выносливость у худощавых здоровых людей и людей с ожирением (Moro et al., 2006; Коппо и др., 2010). Таким образом, помимо хорошо известной роли катехоламинов в индуцированном физической нагрузкой липолизе жировой ткани, повышение уровня ANP в плазме наряду со снижением уровня инсулина в плазме (Moro et al., 2007) в зависимости от интенсивности упражнений активно способствуют усилению липолиза адипоцитов. во время тренировки. Интересно, что когда упражнения выполняются на следующий день после тренировки, когда запасы мышечного гликогена все еще низки, липолиз увеличивается по сравнению с такими же упражнениями, выполняемыми после дня отдыха у элитных велосипедистов (Moro et al., 2014). Поразительно, но это наблюдение не может быть объяснено вышеупомянутыми классическими липолитическими агентами, что позволяет предположить, что другие факторы могут участвовать в активации липолиза WAT во время упражнений (Moro et al., 2014). Недавние данные указывают на то, что белки, секретируемые мышечными волокнами во время сокращения, так называемые миокины, могут активировать липолиз WAT у человека. Действительно, интерлейкин-6 (ИЛ-6) был первым обнаруженным миокином, и уровни ИЛ-6 в плазме повышались в ответ на острую физическую нагрузку (Pedersen et al., 2001; Рейхмане и Дела, 2014). Недавнее клиническое исследование показало, что ИЛ-6 необходим для уменьшения массы висцеральной жировой ткани в ответ на физические упражнения (Wedell-Neergaard et al., 2019). Тем не менее, роль IL-6 в активации липолиза WAT все еще является предметом дискуссий, поскольку острое лечение IL-6 не активирует липолиз адипоцитов in vitro (Trujillo et al., 2004). Кроме того, было описано, что резкое повышение уровня IL-6 in vivo увеличивает липолиз всего тела из-за повышения высвобождения жирных кислот в мышцах, в то время как липолиз WAT остается неизменным (Wolsk et al., 2010). Irisin является еще одним миокином, который, как было описано, увеличивает липолиз WAT посредством косвенного механизма, включающего потемнение WAT (Bostrom et al., 2012). Однако, хотя некоторые эксперименты, проведенные на грызунах, предполагают, что высвобождаемые при физической нагрузке миокины могут активировать потемнение WAT (Stanford et al., 2015), актуальность такого механизма у людей остается спорной (Norheim et al., 2014; Lehnig and Stanford, 2018). .
Совсем недавно мы идентифицировали новый миокин, секретируемый при сокращении первичных клеток скелетных мышц человека, названный фактором роста и дифференцировки 15 (GDF15), который усиливает липолиз адипоцитов in vitro (Laurens et al., 2020). Кроме того, GDF15 также секретировался после упражнений как высокой, так и средней интенсивности у людей in vivo , и рекомбинантный белок GDF15 был способен активировать липолиз в подкожных эксплантатах WAT (Laurens et al., 2020).
Также было описано, что белая жировая ткань вырабатывает растворимые факторы, которые могут действовать паракринным/аутокринным образом для поддержания липолиза во время физических упражнений, такие как интерлейкин-15 (IL-15). Было продемонстрировано, что ИЛ-15 может вырабатываться подкожно-жировой клетчаткой во время одночасового цикла упражнений, что, как известно, увеличивает липолиз WAT.Кроме того, секреция IL-15 в состоянии покоя коррелирует с липолизом SCAT, а инфузия IL-15 посредством микродиализа активирует липолиз SCAT у худощавых субъектов, в то время как он подавляет липолиз у лиц с ожирением (Pierce et al., 2015). Однако корреляции между секрецией ИЛ-15 и липолизом во время физической нагрузки не наблюдалось. Таким образом, вопрос о том, способствует ли IL-15 липолизу, вызванному физической нагрузкой, все еще обсуждается и требует дальнейших исследований.
Интенсивность упражнений
Относительный вклад использования ЖК во время тренировки зависит от ее интенсивности.Липолиз белой жировой ткани увеличивается от низкой до умеренной интенсивности и снижается при высокой интенсивности (Romijn et al., 1993). Действительно, когда упражнения выполняются с высокой интенсивностью, глюкоза является основным энергетическим субстратом для быстрого питания сокращающихся мышц. Однако по мере снижения интенсивности упражнений происходит переключение, и липиды становятся основным энергетическим субстратом (т. е. перекрестная концепция) (Brooks and Mercier, 1994). Затем Jeukendreup и его коллеги использовали концепцию «Fatmax» для описания интенсивности упражнений, выраженной в процентах от VO 2 max, что позволило максимально использовать жир в качестве топлива, окисляемого в скелетных мышцах (Jeukendrup and Wallis, 2005). ).При такой интенсивности половина ЖК, окисляемых мышечными волокнами, поступает за счет липолиза WAT, а оставшаяся часть обеспечивается внутриклеточно за счет пулов IMTG. Значение Fatmax отличается для каждого человека и в основном зависит от массы тела, диеты, пола и уровня подготовки (Jeukendrup and Wallis, 2005). Например, Fatmax был измерен на уровне 48% от VO 2 max у большой когорты худощавых людей, ведущих малоподвижный образ жизни, в то время как у тренированных на выносливость испытуемых он составлял около 65% (Achten et al., 2002; Jeukendrup and Wallis, 2005). .Интересно, что Fatmax оказался ниже у мужчин, чем у женщин (45% против 52% от VO 2 max соответственно) (Jeukendrup and Wallis, 2005). Как указывалось ранее, большее окисление липидов при заданной интенсивности упражнений у женщин объясняется более высокой мобилизацией липидов при той же относительной интенсивности упражнений из-за более высокой массы подкожного жира. Кроме того, Fatmax ниже у тучных людей, чем у худых (Perez-Martin et al., 2001). Однако, даже несмотря на то, что Fatmax широко использовался в программах по снижению веса, основанных на физических упражнениях, эта концепция также вызвала некоторую критику.Во-первых, Fatmax в значительной степени зависит от диеты и состояния питания, поскольку организм больше полагается на углеводы (CHO) в качестве топлива, когда они в высокой степени доступны, например, в постпрандиальных условиях. Во-вторых, скорость окисления жирных кислот одинакова в широком диапазоне интенсивности упражнений, обычно примерно от 45 до 75% максимальной аэробной способности, и, таким образом, не сильно отличается от пикового значения (т.е. значения Fatmax). В-третьих, количество жирных кислот, сжигаемых в течение 24 ч, зависит не только от жирных кислот, окисленных во время нагрузки, но и в период послетренировочного восстановления, особенно при выполнении упражнений с высокой интенсивностью.Наконец, Fatmax — это скорость окисления жирных кислот, но общее количество используемых жирных кислот зависит от расхода энергии, а упражнения высокой интенсивности вызывают самые большие затраты энергии. Таким образом, тренировка с интенсивностью Fatmax может не давать большего преимущества в снижении веса, чем другие тренировочные вмешательства, выполняемые с более высокой интенсивностью упражнений.
Продолжительность тренировки
Вклад ЖК в подпитку сокращающихся мышц также зависит от продолжительности упражнений. Исследования, проведенные различными группами, показали, что окисление жирных кислот постепенно увеличивается во время длительной физической нагрузки, в то время как окисление СНО снижается (Ravussin et al., 1986; Кляйн и др., 1994). Это сопровождается усилением липолиза по мере увеличения продолжительности упражнений (de Glisezinski et al., 2003; Lafontan et al., 2008). Интересно, что было показано, что активность HSL мышц снижается во время продолжительных упражнений (Watt et al., 2003). Это является следствием повышенного поглощения циркулирующих ЖК мышечными волокнами, что, в свою очередь, снижает липолиз и окисление запасов IMTG. Повышение липолиза WAT в основном связано с повышением уровня пролиполитических гормонов в плазме во время длительных физических упражнений.Действительно, секреция катехоламинов увеличивается в зависимости от продолжительности упражнений. Это увеличение более выражено для адреналина, чем для норадреналина, вероятно, из-за несколько более низкой гликемии (de Glisezinski et al., 2003) и того факта, что на секрецию норадреналина больше всего влияет интенсивность упражнений (Leuenberger et al., 1993). В соответствии с этим наблюдением мы ранее продемонстрировали, что адреналин является основным бета-адренергическим агентом, способствующим индуцированному физической нагрузкой липолизу при SCAT (de Glisezinski et al., 2009). Мы показали, что это усиление липолиза адипоцитов зависит не только от бета-адренергической стимуляции катехоламинами, но также от снижения уровня инсулина в плазме и увеличения ANP в плазме (Arner et al., 1990; Moro et al., 2004). ). Например, было обнаружено, что уровень ANP в плазме особенно высок после марафонского забега и может участвовать в активации липолиза WAT, чтобы компенсировать резкое повышение потребности в энергии во время бега на длинные дистанции (Niessner et al., 2003).
Наконец, общий расход энергии, вызванный физическими упражнениями, также необходимо учитывать при рассмотрении вклада жирных кислот, сожженных в ответ на физическую нагрузку, поскольку высокий процент не всегда отражает большое количество сжигаемых жирных кислот, если расход энергии, вызванный физическими упражнениями тренировочный бой низкий. Расход энергии при выполнении упражнений связан как с интенсивностью, так и с продолжительностью упражнений.
Воздействие осбесита
Важно отметить, что мы и другие исследователи наблюдали, что индуцированный физической нагрузкой липолиз SCAT ниже у лиц с ожирением, чем у лиц без ожирения (Stich et al., 2000; Миттендорфер и др., 2004 г.; Росс и Брэдшоу, 2009 г.). Это было связано с более высокой чувствительностью антилиполитических альфа2-адренорецепторов и более низкой чувствительностью пролиполитических бета-адренорецепторов у лиц с ожирением (Stich et al., 2000). Однако из-за более высокой жировой массы у людей с ожирением по сравнению с людьми без ожирения концентрация ЖК в плазме была выше у людей с ожирением как в состоянии покоя, так и во время физических упражнений (Stich et al., 2000). Кроме того, экспрессия рецептора клиренса ANP NPRC выше в адипоцитах тучных людей, чем у худощавых здоровых людей, и может участвовать в более низкой активации липолиза в ответ на секрецию ANP во время тренировки (Dessi-Fulgheri et al., 2003; Ковакова и др., 2016; Райден и др., 2016). Таким образом, в то время как базальная скорость липолиза выше у лиц с ожирением по сравнению с субъектами без ожирения, липолиз, вызванный физической нагрузкой, снижается у лиц с ожирением. Этот адаптивный ответ при ожирении можно рассматривать как защитный механизм, позволяющий избежать чрезмерного выброса жирных кислот в кровоток во время тренировки.
Увеличение липолиза во время восстановления после тренировки
Взаимосвязь между интенсивностью упражнений и окислением жирных кислот и, следовательно, высвобождением жирных кислот в результате липолиза WAT не так очевидна, как предполагалось изначально.Роль жирных кислот в качестве питательных веществ во время восстановления после тренировки была описана в недавнем обзоре группы Бенте Киенс (Lundsgaard et al., 2020). Вкратце, даже если высокоинтенсивные упражнения (т. е. выполняемые с интенсивностью более 75 % от максимальной аэробной мощности субъекта) вызывают низкую скорость окисления ЖК во время тренировки, послетренировочное использование ЖК выше, чем после упражнений низкой интенсивности. бой (Pillard et al., 2010). Это более сильное окисление жирных кислот после высокоинтенсивной тренировки в основном отражается снижением дыхательного коэффициента (Marion-Latard et al., 2003) и не зависит от расхода энергии в течение 6 часов после тренировки. Это является следствием предпочтительного использования CHO для пополнения запасов мышечного гликогена, которые были истощены во время высокоинтенсивной тренировки, что способствует использованию жирных кислот в качестве основного топлива в течение 24–48 часов после тренировки (Tremblay et al., 1994; Киенс и Рихтер, 1998). Ранее мы показали на изолированных адипоцитах, что после длительных упражнений WAT проявляет повышенную чувствительность к бета-адренергическим липолитическим агентам, которые могут способствовать повышению доступности ЖК в период восстановления (Harant et al., 2002). Поразительно, но это увеличение потребления жирных кислот после тренировки более выражено у мужчин, чем у женщин (Henderson et al., 2007). Кроме того, используя инфузию меченого стабильным изотопом пальмитата, Magkos et al. (2009) наблюдали, что вызванное физической нагрузкой увеличение использования ЖК в период восстановления после тренировки выше у субъектов с низкой доступностью ЖК в плазме покоя и больше после тренировки, приводящей к высокой потребности в энергии. Интересно, что было продемонстрировано, что липолиз после тренировки стимулируется в SCAT повышением уровня гормона роста в плазме, который секретируется соматотропными клетками во время тренировки (Enevoldsen et al., 2007). Недавнее исследование, проведенное на мышах, также выявило роль IL-6, миокина, секретируемого волокнами скелетных мышц во время упражнений, в регуляции метаболизма липидов WAT во время восстановления после физической нагрузки (Knudsen et al., 2017).
Таким образом, представляется важным рассмотреть период восстановления после тренировки, чтобы полностью оценить влияние различных модальностей упражнений на использование жирных кислот и, следовательно, на потерю массы тела.
Влияние физических упражнений на липолиз жировой ткани
Упражнения улучшают мобилизацию FA во время тренировки.Действительно, было показано, что частота появления FA (Ra) в крови выше у тренированных на выносливость субъектов по сравнению с контрольной группой, ведущих малоподвижный образ жизни (Coggan et al., 2000). Упражнения влияют как на чувствительность WAT к катехоламинам, так и на их секрецию во время упражнений, которая снижается в ответ на заданную абсолютную нагрузку после тренировки (Kjaer et al., 1987; Riviere et al., 1989; Arner, 1995). Поперечные исследования, проведенные на адипоцитах SCAT, показали, что бета-адренергическая чувствительность выше у тренированных субъектов, чем у лиц, ведущих малоподвижный образ жизни (Crampes et al., 1986; Crampes и др., 1989; Ривьер и др., 1989). Кроме того, лонгитюдные исследования показали, что тренировка на выносливость улучшает бета-адренергический липолитический ответ изолированных адипоцитов у людей с ожирением (De Glisezinski et al., 1998a; Moro et al., 2009).
Кроме того, физические упражнения улучшают реакцию ПНП у лиц с ожирением, но пока неясно, связано ли это с увеличением концентрации ПНП в плазме или увеличением количества рецепторов ПНП на поверхности клеток адипоцитов (Moro et al., 2005). Действительно, с помощью экспериментов по микродиализу in situ при SCAT молодых мужчин с избыточным весом мы смогли показать, что 4 месяца аэробных тренировок улучшают как бета-адренергические, так и липолитические реакции ANP (Stich et al., 1999; Moro et al., 2005). ). Наконец, концентрация инсулина снижается в зависимости от тренировочного статуса, но влияние на липолиз WAT частично уравновешивается улучшением чувствительности WAT к инсулину при физической нагрузке (Polak et al., 2005; Riis et al., 2019). Поразительно, даже если липолиз, вызванный физической нагрузкой, выше у тренированных субъектов, концентрация ЖК в плазме ниже как в покое, так и во время физической нагрузки (Crampes et al., 2003; де Глизезински и др., 2003). Это можно объяснить увеличением использования жирных кислот скелетными мышцами у тренированных лиц. Действительно, степень окисления жирных кислот как в состоянии покоя, так и в результате физической нагрузки выше после тренировочной программы, что приводит к повышенному потреблению кислорода (de Glisezinski et al., 2003). Улучшение липолиза, вызванного физической нагрузкой, наблюдаемое у тренирующихся на выносливость лиц с ожирением, также, по-видимому, частично связано со снижением антилиполитического эффекта альфа2-адренорецепторов в SCAT, что может быть следствием более низких уровней адреналина в плазме. основной альфа2-адренергический лиганд.Действительно, антилиполитическая активность альфа2-адренорецепторов снижалась после тренировки на выносливость у худых и тучных людей (De Glisezinski et al., 2001; Richterova et al., 2004). Интересно, что аналогичная адаптация липолитической реакции WAT была обнаружена после программы тренировок с отягощениями у людей с ожирением (Polak et al., 2005).
Наконец, было замечено, что интенсивность физических упражнений, вызывающих более высокую скорость липолиза, увеличивается при выполнении физических упражнений (Perez-Martin et al., 2001; Ахтен и др., 2002). Таким образом, в то время как максимальное использование FA достигается при интенсивности 30% от максимальной аэробной мощности у сидячих субъектов, оно достигается около 65% у тренированных людей. Это означает, что общее количество ЖК, мобилизуемое во время тренировки, выше у тренированных испытуемых, поскольку увеличиваются как расход энергии, так и процент используемого ЖК. Кроме того, высокоинтенсивные тренировки вызывают прирост мышечной массы, что влияет на скорость основного обмена и, таким образом, может увеличить расход энергии и, следовательно, повлиять на окисление жирных кислот во время периодов отдыха и потерю массы тела (Heydari et al., 2012; Осава и др., 2014 г.; Шуберт и др., 2017; Батракулис и др., 2018).
В целом, эти данные свидетельствуют о том, что программа тренировок, сочетающая упражнения высокой и средней интенсивности, может оптимизировать ежедневное использование жирных кислот и оптимизировать потерю массы тела у людей с избыточным весом или ожирением.
Влияние диеты и времени дня на липолиз, вызванный физической нагрузкой
Доступность углеводов влияет на липолиз, вызванный физической нагрузкой. Действительно, потребление глюкозы во время тренировки снижает липолиз SCAT и частично ингибирует окисление ЖК (De Glisezinski et al., 1998б). Было показано, что упражнения натощак увеличивают окисление жирных кислот и липолиз всего тела у здоровых людей (Vicente-Salar et al., 2015; Andersson Hall et al., 2016; Hansen et al., 2017). Это убедительный подход к максимальному использованию жира во время тренировки. Интересно, что недавнее исследование показало, что упражнения после завтрака с высоким содержанием белка оказывают такое же влияние на липолиз, как и упражнения натощак (Saghebjoo et al., 2020). Кроме того, у добровольцев, получавших в течение 5 дней диету с высоким содержанием жиров, наблюдалась более высокая скорость липолиза WAT во время упражнений, чем у людей, получавших диету, богатую CHO, что можно объяснить более высоким ответом на катехоламины и более низкой инсулинемией (Suljkovicova et al., 2002).
В многочисленных обзорных статьях описывается влияние времени суток на эффективность упражнений, но очень немногие из них посвящены метаболизму липидов и липолизу WAT (Chtourou and Souissi, 2012; Seo et al., 2013; Dollet and Zierath, 2019; Parr et al. ., 2020). Несколько исследований показали, что упражнения, выполняемые вечером, вызывают более высокую зависимость от липидов по сравнению с упражнениями, выполняемыми утром (Aoyama and Shibata, 2020). Кроме того, перекрестное исследование, проведенное с участием молодых мужчин, показало, что упражнения на выносливость, выполняемые вечером, повышают уровень адреналина в плазме, ИЛ-6 и ЖК в плазме по сравнению с теми же упражнениями, выполняемыми утром, что позволяет предположить, что вечерние упражнения являются наиболее эффективными. эффективен для достижения высокой скорости липолиза WAT (Kim et al., 2015). Однако данных по-прежнему недостаточно, и для полного решения этого вопроса необходимо провести будущие исследования.
Ограничение калорий и потеря веса, вызванная физическими упражнениями
Многие исследования показали, что ограничение калорий более эффективно снижает массу тела, чем физические упражнения, и что сочетание физических упражнений с ограничением калорий дает небольшое дополнительное преимущество в снижении веса по сравнению с одним ограничением калорий (Miller et al., 1997). ; Свифт и др., 2018). Тем не менее, физические упражнения играют важную роль в поддержании массы тела после потери веса (Swift et al., 2018). Действительно, потеря веса, вызванная ограничением калорий, увеличивает чувствительность WAT к липолитическим стимулам, возникающим во время физических упражнений (Mauriege et al., 1999). Кроме того, физические упражнения защищают от потери мышечной массы тела при ограничении калорий и предотвращают снижение скорости метаболизма в состоянии покоя (Chomentowski et al., 2009).
Таким образом, даже если сочетание упражнений с ограничением калорий не приводит к дальнейшему снижению веса, чем только ограничение калорий, упражнения потенцируют потерю массы висцерального жира и устойчивое улучшение состава тела (You et al., 2006), и предотвращает хорошо описанный эффект «йо-йо» диеты.
Текущие пробелы в исследованиях
Есть много дополнительных вопросов, на которые еще предстоит ответить, чтобы полностью понять влияние физических упражнений на липолиз WAT и состав тела. Действительно, будущие исследования должны быть направлены на выявление неизвестных липолитических факторов, секретируемых во время упражнений, таких как миокины и, возможно, микро-РНК, высвобождаемые во внеклеточных везикулах в ответ на сокращение мышц (Whitham et al., 2018). Понимание сложных межорганных взаимодействий во время упражнений проложит путь к новым областям исследований и может привести к открытию новых молекулярных игроков с потенциальной терапевтической ролью.
Наконец, исследовательские усилия должны быть также направлены на совершенствование методов тренировок для достижения максимального и устойчивого улучшения состава тела, особенно у людей с избыточным весом или ожирением. Оценка сочетания режимов питания, ограниченных по времени, с тренировками, выполняемыми во время голодания, может быть привлекательным подходом к потенцированию потери жировой массы.
Заключение
В целом мало кто спорит о том, что физические упражнения способствуют снижению веса в брюшной полости у людей с избыточным весом и ожирением. Постоянные физические упражнения в значительной степени продемонстрировали свою способность способствовать снижению веса при ограничении калорий и поддерживать долгосрочную потерю веса. Ряд исследований предполагает, что сочетание упражнений средней и высокой интенсивности может обеспечить дополнительные преимущества в снижении веса, по крайней мере, частично, за счет более высоких показателей расхода энергии во время упражнений и более высокой скорости окисления жирных кислот во время восстановления после упражнений.Хотя канонические липолитические системы и гормоны подробно изучались в течение последних 30 лет, более поздние исследования выявили перекрестные помехи между мышцами и жировой тканью, опосредованные миокинами, регулирующими липолиз WAT. Однако многое еще предстоит открыть. С открытием того, что сокращающиеся мышцы могут продуцировать миокины, способные удаленно нацеливаться на органы, включая WAT, наши текущие знания, вероятно, будут подвергнуты сомнению в ближайшие несколько лет.
Вклад авторов
CL и CM написали и отредактировали рукопись.IG, IH и DL отредактировали и переработали рукопись. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы очень благодарны д-ру François Crampes за его вклад в вышеупомянутые исследования, за активное обсуждение и критическое прочтение рукописи.
Ссылки
Ахтен, Дж., Глисон, М., и Йеукендруп, А.Е. (2002). Определение интенсивности упражнений, вызывающих максимальное окисление жира. Мед. науч. Спортивное упражнение. 34, 92–97. дои: 10.1097/00005768-200201000-00015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Андерссон Холл, У., Эдин, Ф., Педерсен, А., и Мэдсен, К. (2016). Окисление жира в организме увеличивается больше при предшествующих упражнениях, чем при голодании в течение ночи у элитных спортсменов, занимающихся выносливостью. Заяв. Физиол. Нутр. Метаб. 41, 430–437. doi: 10.1139/apnm-2015-0452
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Арнер, П. (1995). Влияние физических упражнений на метаболизм жировой ткани у человека. Междунар. Дж. Обес Релат. Метаб. Беспорядок. 19(Прил. 4), С18–С21.
Академия Google
Арнер П., Кригхольм Э., Энгфельдт П. и Болиндер Дж. (1990). Адренергическая регуляция липолиза in situ в покое и при физической нагрузке. Дж.клин. Вкладывать деньги. 85, 893–898. doi: 10.1172/jci114516
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Батракулис А., Джамуртас А.З., Георгакули К., Драганидис Д., Дели С.К., Папаниколау К. и др. (2018). Высокоинтенсивные интегрированные нервно-мышечные тренировки кругового типа изменяют энергетический баланс и уменьшают массу тела и жир у женщин с ожирением: 10-месячное рандомизированное контролируемое исследование «тренировка-детренировка». PLoS One 13:e0202390. doi: 10.1371/журнал.пон.0202390
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bostrom, P., Wu, J., Jedrychowski, M.P., Korde, A., Ye, L., Lo, J.C., et al. (2012). PGC1-альфа-зависимый миокин, который управляет образованием белого жира, подобным бурому жиру, и термогенезом. Природа 481, 463–468.
Академия Google
Брукс, Г. А., и Мерсье, Дж. (1994). Баланс использования углеводов и липидов во время тренировки: концепция «перехода». Дж.заявл. Физиол. 76, 2253–2261. doi: 10.1152/jappl.1994.76.6.2253
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chomentowski, P., Dube, J.J., Amati, F., Stefanovic-Racic, M., Zhu, S., Toledo, F.G., et al. (2009). Умеренные физические нагрузки уменьшают потерю массы скелетных мышц, которая происходит при преднамеренной потере веса, вызванной ограничением калорий, у пожилых людей с избыточным весом или ожирением. J. Gerontol A Biol. науч. Мед. науч. 64, 575–580. doi: 10.1093/gerona/glp007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Когган, А.Р., Рагузо, К.А., Гастальделли, А., Сидоссис, Л.С., и Йекель, К.В. (2000). Жировой обмен во время высокоинтенсивных упражнений у тренированных и нетренированных мужчин. Метаболизм 49, 122–128. doi: 10.1016/s0026-0495(00)-6
Полнотекстовая перекрестная ссылка | Академия Google
Crampes, F., Beauville, M., Riviere, D., и Garrigues, M. (1986). Влияние физических тренировок у людей на реакцию изолированных жировых клеток на адреналин. J. Appl. Физиол. 61, 25–29.doi: 10.1152/jappl.1986.61.1.25
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Crampes, F., Marion-Latard, F., Zakaroff-Girard, A., De Glisezinski, I., Harant, I., Thalamas, C., et al. (2003). Влияние продольной тренировочной программы на реакцию на физические нагрузки у мужчин с избыточным весом. Обес Рез. 11, 247–256. doi: 10.1038/oby.2003.38
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Крэмпс, Ф., Ривьер, Д., Бовиль, М., Марсерон, М., и Гарриг, М. (1989). Липолитический ответ адипоцитов на адреналин у сидячих и тренированных субъектов: половые различия. евро. Дж. Заявл. Физиол. Занять. Физиол. 59, 249–255. дои: 10.1007/bf02388324
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Де Глизезински И., Крампес Ф., Харант И., Берлан М., Хейнова Дж., Лангин Д. и соавт. (1998а). Тренировки на выносливость изменяют липолитическую реакцию жировой ткани с ожирением. утра. Дж. Физиол. 275, E951–E956.
Академия Google
De Glisezinski, I., Harant, I., Crampes, F., Trudeau, F., Felez, A., Cottet-Emard, J.M., et al. (1998б). Влияние приема углеводов на липолиз жировой ткани во время длительных упражнений у тренированных мужчин. J. Appl. Физиол. 84, 1627–1632. doi: 10.1152/jappl.1998.84.5.1627
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
де Глизезински И., Ларруи Д., Байзова М., Коппо, К., Полак, Дж., Берлан, М., и соавт. (2009). Адреналин, но не норадреналин, является определяющим фактором мобилизации липидов, вызванной физической нагрузкой, в подкожной жировой ткани человека. J. Physiol. 587 (часть 13), 3393–3404. doi: 10.1113/jphysiol.2009.168906
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
De Glisezinski, I., Marion-Latard, F., Crampes, F., Berlan, M., Hejnova, J., Cottet-Emard, J.M., et al. (2001). Отсутствие альфа(2)-адренергического антилиполитического эффекта при физической нагрузке в подкожно-жировой клетчатке тренированных мужчин. J. Appl. Физиол. 91, 1760–1765. doi: 10.1152/jappl.2001.91.4.1760
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
de Glisezinski, I., Moro, C., Pillard, F., Marion-Latard, F., Harant, I., Meste, M., et al. (2003). Аэробные тренировки улучшают вызванный физической нагрузкой липолиз при SCAT и утилизацию липидов у мужчин с избыточным весом. утра. Дж. Физиол. Эндокринол. Метаб. 285, E984–E990.
Академия Google
Десси-Фульгери, П., Сарзани, Р.и Раппелли, А. (2003). Роль системы натрийуретических пептидов в липогенезе/липолизе. Нутр. Метаб. Кардиовас. Дис. 13, 244–249. doi: 10.1016/s0939-4753(03)80018-2
Полнотекстовая перекрестная ссылка | Академия Google
Доллет, Л., и Зират, Дж. Р. (2019). Взаимодействие между диетой, физическими упражнениями и молекулярными циркадными часами в организации метаболической адаптации жировой ткани. J. Physiol. 597, 1439–1450. дои: 10.1113/jp276488
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эневолдсен, Л.Х., Полак Дж., Симонсен Л., Хаммер Т., Макдональд И., Крэмпс Ф. и соавт. (2007). Послетренировочный липолиз абдоминальной и подкожной жировой ткани у субъектов натощак ингибируется инфузией аналога соматостатина октреотида. клин. Физиол. Функц. Визуализация 27, 320–326. doi: 10.1111/j.1475-097x.2007.00754.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эванс, П.Л., Макмиллин, С.Л., Вейраух, Л.А., и Витчак, К.А. (2019). Регуляция транспорта глюкозы в скелетных мышцах и метаболизма глюкозы с помощью физических упражнений. Питательные вещества 11:2432. дои: 10.3390/nu11102432
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хансен, Д., Де Страйкер, Д., и Колдерс, П. (2017). Влияние тренировок на выносливость натощак на биохимию и метаболизм мышц у здоровых людей: могут ли эти эффекты быть особенно полезными для пациентов с сахарным диабетом 2 типа и инсулинорезистентными пациентами? Спорт Мед. 47, 415–428. doi: 10.1007/s40279-016-0594-x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Харант, И., Marion-Latard, F., Crampes, F., de Glisezinski, I., Berlan, M., Stich, V., et al. (2002). Влияние длительных физических упражнений на липолитическую реакцию жировых клеток на адренергические агенты и инсулин у мужчин с ожирением. Междунар. Дж. Обес Релат. Метаб. Беспорядок. 26, 1373–1378. doi: 10.1038/sj.ijo.0802072
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Henderson, G.C., Fattor, J.A., Horning, M.A., Faghihnia, N., Johnson, M.L., Mau, T.L., et al. (2007).Липолиз и метаболизм жирных кислот у мужчин и женщин в период послетренировочного восстановления. J. Physiol. 584 (часть 3), 963–981. doi: 10.1113/jphysiol.2007.137331
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хейдари, М., Фройнд, Дж., и Бутчер, С.Х. (2012). Влияние высокоинтенсивных прерывистых упражнений на состав тела молодых мужчин с избыточным весом. Дж. Обес 2012:480467.
Академия Google
Горовиц, Дж.Ф. (2003). Мобилизация жирных кислот из жировой ткани во время физических упражнений. Тенденции Эндокринол. Метаб. 14, 386–392. doi: 10.1016/s1043-2760(03)00143-7
Полнотекстовая перекрестная ссылка | Академия Google
Горовиц, Дж. Ф., и Кляйн, С. (2000). Липидный обмен во время упражнений на выносливость. утра. Дж. Клин. Нутр. 72 (2 Доп.), 558S–563S.
Академия Google
Хсу, К. Дж., Ляо, К. Д., Цай, М. В., и Чен, К. Н. (2019). Влияние физических упражнений и вмешательства в области питания на состав тела, метаболическое здоровье и физическую работоспособность у взрослых с саркопеническим ожирением: метаанализ. Питательные вещества 11:2163. дои: 10.3390/nu11092163
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Imbeault, P., Tremblay, A., Despres, J., и Mauriege, P. (2000). бета-адренорецептор-стимулированный липолиз подкожных абдоминальных адипоцитов как детерминанта окисления жиров у мужчин с ожирением. евро. Дж. Клин. Вкладывать деньги. 30, 290–296. doi: 10.1046/j.1365-2362.2000.00634.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дженсен, М.Д. и Джонсон С.М. (1996). Вклад кинетики свободных жирных кислот (СЖК) ног и внутренних органов в постабсорбционный поток СЖК у мужчин и женщин. Метаболизм 45, 662–666. doi: 10.1016/s0026-0495(96)
-2
Полнотекстовая перекрестная ссылка | Академия Google
Jeukendrup, A.E., and Wallis, G.A. (2005). Измерение окисления субстрата во время физической нагрузки посредством измерения газообмена. Междунар. Дж. Спорт Мед. 26(Прил. 1), С28–С37.
Академия Google
Киенс, Б.и Рихтер, Э.А. (1998). Использование триацилглицерина скелетных мышц во время восстановления после тренировки у людей. утра. Дж. Физиол. 275, E332–E337.
Академия Google
Kim, H.K., Konishi, M., Takahashi, M., Tabata, H., Endo, N., Numao, S., et al. (2015). Влияние упражнений на выносливость, выполняемых утром и вечером, на реакцию воспалительных цитокинов и метаболических гормонов. PLoS One 10:e0137567. doi: 10.1371/journal.pone.0137567
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кьер, М., Secher, N.H., and Galbo, H. (1987). Физический стресс и выброс катехоламинов. Байер Клиник. Эндокринол. Метаб. 1, 279–298. doi: 10.1016/s0950-351x(87)80064-2
Полнотекстовая перекрестная ссылка | Академия Google
Кляйн С., Койл Э. Ф. и Вулф Р. Р. (1994). Жировой обмен во время упражнений низкой интенсивности у тренированных и нетренированных мужчин. утра. Дж. Физиол. 267 (6 часть 1), E934–E940.
Академия Google
Кнудсен, Дж. Г., Гудиксен, А., Bertholdt, L., Overby, P., Villesen, I., Schwartz, C.L., et al. (2017). IL-6 скелетных мышц регулирует утилизацию мышечного субстрата и метаболизм жировой ткани во время восстановления после интенсивной физической нагрузки. PLoS One 12:e0189301. doi: 10.1371/journal.pone.0189301
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Коппо, К., Ларруи, Д., Маркес, М.А., Берлан, М., Байзова, М., Полак, Дж., и соавт. (2010). Мобилизация липидов в подкожной жировой ткани во время физических упражнений у худых и тучных людей.Роль инсулина и натрийуретических пептидов. утра. Дж. Физиол. Эндокринол. Метаб. 299, E258–E265.
Академия Google
Ковакова З., Тарп В. Г., Лю Д., Вэй В., Се Х., Коллинз С. и соавт. (2016). Экспрессия рецептора натрийуретического пептида в жировой ткани связана с чувствительностью к инсулину при ожирении и диабете. Ожирение 24, 820–828. doi: 10.1002/oby.21418
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Краузова Е., Тума П., де Глизезински И., Стич В. и Сиклова М. (2018). Метформин не ингибирует вызванный физической нагрузкой липолиз в жировой ткани у молодых здоровых худощавых мужчин. Фронт. Физиол. 9:604. doi: 10.3389/fphys.2018.00604
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лафонтан М., Моро К., Берлан М., Крампес Ф., Сенгенес К. и Галицкий Дж. (2008). Контроль липолиза натрийуретическими пептидами и циклическим GMP. Тенденции Эндокринол. Метаб. 19, 130–137.doi: 10.1016/j.tem.2007.11.006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лоренс, К., Пармар, А., Мерфи, Э., Карпер, Д., Лэр, Б., Мэйс, П., и др. (2020). Фактор роста и дифференцировки 15 секретируется скелетными мышцами во время физических упражнений и способствует липолизу у людей. JCI Insight 5:e131870.
Академия Google
Лейбель Р.Л. и Хирш Дж. (1987). Связанные с участком и полом различия в статусе адренорецепторов жировой ткани человека. Дж. Клин. Эндокринол. Метаб. 64, 1205–1210. doi: 10.1210/jcem-64-6-1205
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лойенбергер, У., Синовей, Л., Губин, С., Гал, Л., Дэвис, Д., и Зелис, Р. (1993). Влияние интенсивности и продолжительности упражнений на распространение и клиренс норадреналина у людей. J. Appl. Физиол. 75, 668–674. doi: 10.1152/jappl.1993.75.2.668
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Магкос, Ф., Мохаммед, Б.С., Паттерсон, Б.В., и Миттендорфер, Б. (2009). Кинетика свободных жирных кислот в поздней фазе восстановления после тренировки: важность метаболизма жирных кислот в состоянии покоя и дефицита энергии, вызванного физической нагрузкой. Метаболизм 58, 1248–1255. doi: 10.1016/j.metabol.2009.03.023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Марион-Латар Ф., Крампес Ф., Закарофф-Жирар А., Де Глизезински И., Харант И., Стич В. и др. (2003). Посттренировочное увеличение окисления липидов после умеренной физической нагрузки у нетренированных здоровых мужчин с ожирением. Горм. Метаб. Рез. 35, 97–103. doi: 10.1055/s-2003-39051
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Mauriege, P., Imbeault, P., Langin, D., Lacaille, M., Almeras, N., Tremblay, A., et al. (1999). Региональные и половые различия в липолизе жировой ткани в ответ на потерю веса. J. Lipid Res. 40, 1559–1571.
Академия Google
Миллер, В. К., Коцея, Д. М., и Гамильтон, Э. Дж. (1997). Метаанализ последних 25 лет исследований по снижению веса с использованием диеты, упражнений или диеты в сочетании с физическими упражнениями. Междунар. Дж. Обес Релат. Метаб. Беспорядок. 21, 941–947. doi: 10.1038/sj.ijo.0800499
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Миттендорфер, Б., Филдс, Д.А., и Кляйн, С. (2004). Избыток жира в организме у мужчин снижает доступность жирных кислот в плазме и их окисление во время упражнений на выносливость. утра. Дж. Физиол. Эндокринол. Метаб. 286, E354–E362.
Академия Google
Моро, К., Крампес, Ф., Сенгенес, К., Де Глизезински, И., Галицкий, Дж., Thalamas, C., et al. (2004). Предсердный натрийуретический пептид способствует физиологическому контролю мобилизации липидов у человека. FASEB J. 18, 908–910. doi: 10.1096/fj.03-1086fje
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Moro, C., Harant, I., Badin, P.M., Patarca, F.X., Guilland, J.C., Bourlier, V., et al. (2014). Влияние липолиза и доступности жирных кислот на выбор топлива во время тренировки. J. Physiol. Биохим. 70, 583–591.
Академия Google
Моро, К., Пасарика, М., Элкинд-Хирш, К., и Редман, Л.М. (2009). Аэробные упражнения улучшают предсердный натрийуретический пептид и катехоламин-опосредованный липолиз у женщин с ожирением и синдромом поликистозных яичников. Дж. Клин. Эндокринол. Метаб. 94, 2579–2586. doi: 10.1210/jc.2009-0051
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Моро К., Пиллард Ф., де Глизезински И., Крампес Ф., Таламас К., Харант И., и другие. (2007). Половые различия в механизмах регуляции липолиза у субъектов с избыточным весом: влияние интенсивности упражнений. Ожирение 15, 2245–2255. doi: 10.1038/oby.2007.267
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Моро, К., Пиллард, Ф., Де Глизезински, И., Харант, И., Ривьер, Д., Стич, В., и другие. (2005). Тренировки усиливают липидомобилизующее действие ПНП в жировой ткани мужчин с избыточным весом. Мед. науч. Спортивное упражнение. 37, 1126–1132. дои: 10.1249/01.mss.0000170124.51659.52
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Моро, К., Пиллард, Ф., де Глизезински, И., Климчакова, Э., Крампес, Ф., Таламас, С., и соавт. (2008). Мобилизация липидов в подкожной жировой ткани, вызванная физической нагрузкой, в основном связана с натрийуретическими пептидами у мужчин с избыточной массой тела. утра. Дж. Физиол. Эндокринол. Метаб. 295, Е505–Е513.
Академия Google
Моро, К., Полак, Дж., Хейнова, Дж., Климчакова, Е., Crampes, F., Stich, V., et al. (2006). Предсердный натрийуретический пептид стимулирует мобилизацию липидов во время повторных упражнений на выносливость. утра. Дж. Физиол. Эндокринол. Метаб. 290, E864–E869.
Академия Google
Нильсен С., Го З., Джонсон С. М., Хенсруд Д. Д. и Дженсен М. Д. (2004). Внутренний липолиз при ожирении человека. Дж. Клин. Вкладывать деньги. 113, 1582–1588. дои: 10.1172/jci21047
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нисснер, А., Циглер С., Слани Дж., Билленштейнер Э., Волощук В. и Гейер Г. (2003). Повышение уровня предсердных и мозговых натрийуретических пептидов в плазме после марафонского забега: частично ли их эффекты уравновешиваются адренокортикальными стероидами? евро. Дж. Эндокринол. 149, 555–559. doi: 10.1530/eje.0.14
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Norheim, F., Langleite, T.M., Hjorth, M., Holen, T., Kielland, A., Stadheim, H.K., et al. (2014).Влияние острых и хронических упражнений на PGC-1alpha, иризин и потемнение подкожной жировой ткани у людей. FEBS J. 281, 739–749. doi: 10.1111/февраль 12619
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Осава Ю., Адзума К., Табата С., Кацукава Ф., Исида Х., Огума Ю. и др. (2014). Влияние 16-недельной высокоинтенсивной интервальной тренировки с использованием эргометров для верхней и нижней частей тела на аэробную выносливость и морфологические изменения у здоровых мужчин: предварительное исследование. Открытый доступ J. Sports Med. 5, 257–265. doi: 10.2147/oajsm.s68932
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Педерсен, Б.К., Стенсберг, А., и Шерлинг, П. (2001). Упражнения и интерлейкин-6. Курс. мнение Гематол. 8, 137–141.
Академия Google
Перес-Мартин, А., Дюмортье, М., Рейно, Э., Брун, Дж. Ф., Феду, К., Брингер, Дж., и др. (2001). Баланс окисления субстрата при субмаксимальных нагрузках у худых и тучных людей. Диабет Метаб. 27 (4 ч. 1), 466–474.
Академия Google
Петерсон, М. Д., Сен, А., и Гордон, П. М. (2011). Влияние упражнений с отягощениями на безжировую массу тела у пожилых людей: метаанализ. Мед. науч. Спортивное упражнение. 43, 249–258. doi: 10.1249/mss.0b013e3181eb6265
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Петриду А., Чатзиниколау А., Авлонити А., Джамуртас А., Лулес Г., Папасотириу И. и др.(2017). Повышение активности триацилглицероллипазы в жировой ткани худощавых и тучных мужчин при выполнении упражнений на выносливость. Дж. Клин. Эндокринол. Метаб. 102, 3945–3952. doi: 10.1210/jc.2017-00168
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пирс, Дж. Р., Мэйплс, Дж. М., и Хикнер, Р. К. (2015). Концентрации ИЛ-15 в скелетных мышцах и подкожной жировой ткани у худых и тучных людей: локальные эффекты ИЛ-15 на липолиз жировой ткани. утра.Дж. Физиол. Эндокринол. Метаб. 308, E1131–E1139.
Академия Google
Pillard, F., Van Wymelbeke, V., Garrigue, E., Moro, C., Crampes, F., Guilland, J.C., et al. (2010). Окисление липидов у мужчин с избыточным весом после физической нагрузки и приема пищи. Метаболизм 59, 267–274. doi: 10.1016/j.metabol.2009.07.023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Полак Дж., Моро К., Климчакова Э., Хейнова Дж., Майерсик М., Вигери Н., и другие. (2005). Динамическая силовая тренировка улучшает чувствительность к инсулину и функциональный баланс между адренергическими альфа-2А и бета-путями в подкожной жировой ткани у людей с ожирением. Диабетология 48, 2631–2640. doi: 10.1007/s00125-005-0003-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Равуссин Э., Богардус К., Шайдеггер К., Лагранж Б., Хортон Э.Д. и Хортон Э.С. (1986). Влияние повышенного содержания свободных жирных кислот на окисление углеводов и липидов при длительных физических нагрузках у людей. J. Appl. Физиол. 60, 893–900. doi: 10.1152/jappl.1986.60.3.893
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рихтерова Б., Стич В., Моро К., Полак Дж., Климчакова Э., Майерсик М. и соавт. (2004). Влияние тренировок на выносливость на адренергический контроль липолиза в жировой ткани у женщин с ожирением. Дж. Клин. Эндокринол. Метаб. 89, 1325–1331. doi: 10.1210/jc.2003-031001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Риис, С., Christensen, B., Nellemann, B., Moller, A.B., Husted, A.S., Pedersen, S.B., et al. (2019). Молекулярные адаптации в подкожной жировой ткани человека после десяти недель тренировок на выносливость у здоровых мужчин. J. Appl Physiol. 126, 569–577. doi: 10.1152/japplphysiol.00989.2018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ривьер Д., Крампес Ф., Бовиль М. и Гарриг М. (1989). Липолитический ответ жировых клеток на катехоламины у женщин, ведущих малоподвижный образ жизни и занимающихся физическими упражнениями. J. Appl. Физиол. 66, 330–335. doi: 10.1152/jappl.1989.66.1.330
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ромейн, Дж. А., Койл, Э. Ф., Сидоссис, Л. С., Гасталделли, А., Горовиц, Дж. Ф., Эндерт, Э., и соавт. (1993). Регуляция эндогенного жирового и углеводного обмена в зависимости от интенсивности и продолжительности упражнений. утра. Дж. Физиол. 265 (3 часть 1), E380–E391.
Академия Google
Райден М., Бакдал Дж., Петрус П., Thorell, A., Gao, H., Coue, M., et al. (2016). Нарушение липолиза, опосредованного предсердным натрийуретическим пептидом, при ожирении. Междунар. Дж. Обес 40, 714–720. doi: 10.1038/ijo.2015.222
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сахебджу, М., Каргар-Акбария, Н., Мохаммадния-Ахмади, М., и Саффари, И. (2020). Как тренироваться для повышения липолиза и чувствительности к инсулину: натощак или после однократного завтрака с высоким содержанием белка. J. Sports Med. физ. Фитнес 60, 625–633.
Академия Google
Шуберт, М.М., Кларк, Х.Е., Сей, Р.Ф., и Спейн, К.К. (2017). Влияние 4-недельных интервальных тренировок на уровень метаболизма в покое, физическую форму и результаты, связанные со здоровьем. Заяв. Физиол. Нутр. Метаб. 42, 1073–1081. doi: 10.1139/apnm-2017-0268
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сео Д.Ю., Ли С., Ким Н., Ко К.С., Ри Б.Д., Парк Б.Дж. и др. (2013). Утренняя и вечерняя гимнастика. Интегр.Мед. Рез. 2, 139–144.
Академия Google
Стэнфорд, К. И., Мидделбек, Р. Дж., и Гудиер, Л. Дж. (2015). Воздействие физических упражнений на белую жировую ткань: беговые и метаболические адаптации. Диабет 64, 2361–2368. дои: 10.2337/db15-0227
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Stich, V., De Glisezinski, I., Crampes, F., Hejnova, J., Cottet-Emard, J.M., Galitzky, J., et al. (2000). Активация альфа(2)-адренорецепторов ухудшает индуцированный физической нагрузкой липолиз при SCAT у людей с ожирением. утра. Дж. Физиол. Регул. интегр. Комп. Физиол. 279, Р499–Р504.
Академия Google
Stich, V., de Glisezinski, I., Galitzky, J., Hejnova, J., Crampes, F., Riviere, D., et al. (1999). Тренировка на выносливость увеличивает бета-адренергическую липолитическую реакцию в подкожной жировой ткани у людей с ожирением. Междунар. Дж. Обес Релат. Метаб. Беспорядок. 23, 374–381. doi: 10.1038/sj.ijo.0800829
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Стоунер, Л., Rowlands, D., Morrison, A., Credeur, D., Hamlin, M., Gaffney, K., et al. (2016). Эффективность физических упражнений для снижения веса у подростков с избыточным весом и ожирением: метаанализ и последствия. Спорт Мед. 46, 1737–1751. doi: 10.1007/s40279-016-0537-6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Suljkovicova, H., Marion-Latard, F., Hejnova, J., Majercik, M., Crampes, F., De Glisezinski, I., et al. (2002). Влияние макронутриентного состава рациона на регуляцию липолиза в жировой ткани в покое и при физической нагрузке: микродиализное исследование. Метаболизм 51, 1291–1297. doi: 10.1053/meta.2002.35190
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Свифт, Д. Л., МакГи, Дж. Э., Эрнест, С. П., Карлайл, Э., Найгард, М., и Йоханнсен, Н. М. (2018). Влияние физических упражнений и физической активности на снижение и поддержание веса. Прог. Кардиовас. Дис. 61, 206–213.
Академия Google
Tremblay, A., Simoneau, J.A., and Bouchard, C. (1994). Влияние интенсивности упражнений на жировые отложения и метаболизм скелетных мышц. Метаболизм 43, 814–818. дои: 10.1016/0026-0495(94)
Полнотекстовая перекрестная ссылка | Академия Google
Трухильо, М.Е., Салливан, С., Хартен, И., Шнайдер, С.Х., Гринберг, А.С., и Фрид, С.К. (2004). Интерлейкин-6 регулирует метаболизм липидов в жировой ткани человека и выработку лептина in vitro. Дж. Клин. Эндокринол. Метаб. 89, 5577–5582. doi: 10.1210/jc.2004-0603
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вербовен, К., Stinkens, R., Hansen, D., Wens, I., Frederix, I., Eijnde, B.O., et al. (2018). Адренергически и неадренергически опосредованный липолиз жировой ткани человека во время острых физических упражнений и физических упражнений. клин. науч. 132, 1685–1698. дои: 10.1042/cs20180453
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Виана, Р. Б., Навс, Дж. П. А., Косвиг, В. С., де Лира, К. А. Б., Стил, Дж., Фишер, Дж. П., и соавт. (2019). Интервальные тренировки — волшебное средство для похудения? Систематический обзор и метаанализ, сравнивающие непрерывную тренировку средней интенсивности с интервальной тренировкой высокой интенсивности (HIIT). руб. Дж. Спорт Мед. 53, 655–664. дои: 10.1136/bjsports-2018-099928
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Висенте-Салар, Н., Урдампиллета Отеги, А., и Рош Колладо, Э. (2015). Тренировка выносливости в условиях голодания: биологическая адаптация и управление массой тела. Нутр. Хосп. 32, 2409–2420.
Академия Google
Watt, M.J., Heigenhauser, G.J., O’Neill, M., and Spriet, L.L. (2003). Активность гормоночувствительной липазы и содержание жирных ацил-КоА в скелетных мышцах человека при длительных физических нагрузках. J. Appl. Физиол. 95, 314–321. doi: 10.1152/japplphysiol.01181.2002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wedell-Neergaard, A.S., Lang Lehrskov, L., Christensen, R.H., Legaard, G.E., Dorph, E., Larsen, M.K., et al. (2019). Изменения массы висцеральной жировой ткани, вызванные физической нагрузкой, регулируются передачей сигналов IL-6: рандомизированное контролируемое исследование. Клеточный метаб. 29, 844.e3–855.e3.
Академия Google
Вевеге, М., ван ден Берг Р., Уорд Р. Э. и Кич А. (2017). Влияние высокоинтенсивных интервальных тренировок по сравнению с непрерывными тренировками средней интенсивности на состав тела у взрослых с избыточным весом и ожирением: систематический обзор и метаанализ. Obes Rev. 18, 635–646. doi: 10.1111/обр.12532
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Whitham, M., Parker, B.L., Friedrichsen, M., Hingst, J.R., Hjorth, M., Hughes, W.E., et al. (2018). Внеклеточные везикулы обеспечивают взаимодействие тканей во время упражнений. Клеточный метаб. 27, 237.e4–251.e4.
Академия Google
Вулф, Р. Р., Шоу, Дж. Х., и Дюркот, М. Дж. (1985). Влияние сепсиса на кинетику ЛПОНП: ответы в исходном состоянии и во время инфузии глюкозы. утра. Дж. Физиол. 248 (6 часть 1), E732–E740.
Академия Google
Вольск, Э., Майгинд, Х., Грондаль, Т.С., Педерсен, Б.К., и ван Холл, Г. (2010). ИЛ-6 избирательно стимулирует жировой обмен в скелетных мышцах человека. утра. Дж. Физиол.Эндокринол. Метаб. 299, E832–E840.
Академия Google
Ю Т., Мерфи К. М., Лайлс М. Ф., Демоны Дж. Л., Ленчик Л. и Никлас Б. Дж. (2006). Добавление аэробных упражнений к диете для похудения предпочтительно уменьшает размер абдоминальных адипоцитов. Междунар. Дж. Обес 30, 1211–1216. doi: 10.1038/sj.ijo.0803245
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Липолиз | Журнал клеточной биологии
Успешная адаптация млекопитающих к голоданию в значительной степени зависит от регулируемой мобилизации жирных кислот из триацилглицеролов, хранящихся в жировой ткани.Хотя уже давно признано, что циклический АМФ представляет собой важный вторичный мессенджер и гормон-чувствительную липазу (HSL) *
*Сокращения, используемые в этой статье: ADRP, белок, связанный с дифференцировкой адипоцитов; HSL, гормон-чувствительная липаза; PKA, протеинкиназа А; ТАГ, триацилглицерин.
фермент, определяющий скорость липолиза, простой активацией фермента не удалось объяснить сильное увеличение высвобождения жира в ответ на физиологические агонисты.В этом выпуске Sztalryd et al. (2003) обеспечивают убедительную поддержку представления о том, что субклеточная компартментализация липазы также регулирует липолиз и, что более важно, что белки, отличные от HSL, локализованы в липидной капле и необходимы для ее оптимального гидролиза.Триацилглицерин (TAG) существует как наиболее эффективная макромолекула для хранения калорий во время голодания или повышенного потребления энергии. В последние годы, однако, исследователи пришли к пониманию не только сложности регуляции мобилизации липидов и метаболизма, но и их важности для процессов, отличных от снабжения питательными веществами, в периоды скудного потребления пищи или повышенных физических нагрузок.Например, в результате липолиза ТАГ образуются глицерин и жирные кислоты. В результате повышенный уровень циркулирующих жирных кислот является исключительным кандидатом на роль этиологического фактора сахарного диабета 2 типа благодаря их способности стимулировать резистентность к инсулину в скелетных мышцах. Несмотря на свою важность, клеточной биологии мобилизации липидов в адипоцитах уделялось удивительно мало внимания, особенно с учетом обилия исследований, посвященных пониманию мобилизации гликогена, другого хранилища энергии.В качестве иллюстрации этого несоответствия интересно отметить, что, хотя Эдвин Кребс опубликовал основополагающую статью, демонстрирующую усиление липолиза и активности нейтральной липазы при воздействии ПКА в присутствии циклического АМФ, в его нобелевской лекции не упоминается гидролиза ТАГ (Corbin et al., 1970; Krebs, 1993).
Что же тогда объясняет это кажущееся пятно на метаболизме липидов? Конечно, трудно быть уверенным, хотя, вероятно, этому способствовали по крайней мере два фактора: (1) присущие трудности изучения ферментативных реакций на липофильных субстратах и (2) представление о том, что основные черты регуляции липолиз уже изучен.Более двадцати лет назад было получено множество данных в поддержку модели, в которой β-адренергические агенты приводят к увеличению внутриклеточной концентрации циклического АМФ, который активирует PKA, который, в свою очередь, фосфорилирует и стимулирует HSL. Даже точный модифицированный аминокислотный остаток был установлен в конце 1980-х годов как S563, хотя более современные анализы предполагают, что S659 и S660 являются более важными регуляторными сайтами фосфорилирования PKA (Garton et al., 1988; Anthonsen et al., 1998). . Тем не менее, более неприятным вопросом, который был широко признан, но не изучен в целом, было заметное отсутствие корреляции между активацией HSL in vitro фосфорилированием PKA, которая равнялась 1.5-2 раза, а увеличение высвобождения жирных кислот in vivo обычно превышает 50 раз. Такое несоответствие часто проявляется при сравнении процессов регуляции поврежденных и неповрежденных клеток. В этом случае важную подсказку дал отчет Хирша и Розена о том, что циклический АМФ-стимулированный липолиз в культивируемых адипоцитах сопровождался перераспределением триглицеридлипазы из растворимой в твердую фракцию, что неожиданно подтвердилось восемью годами позже иммунологической демонстрацией Релокализация HSL в жировую каплю в первичных адипоцитах крысы (Hirsch and Rosen, 1984; Egan et al., 1992). Из этих и других исследований возникла идея, что для максимального липолиза необходима не только активация HSL, но и ее транслокация на субстрат, липидную каплю. Однако самое простое объяснение, что экспонирования субстрат-связывающей поверхности фермента будет достаточно для стимуляции перераспределения HSL, оказывается неверным. Возможно, самой яркой демонстрацией этого является открытие в текущей работе Sztalryd et al. (2003), что HSL в жировых клетках, лишенных другого критического компонента, регуляторного белка перилипина, не способен транслоцироваться в липидную каплю после повышения уровня циклического АМФ.
Несколько лет назад появились данные, свидетельствующие о том, что граница между липидной каплей и цитоплазмой вовсе не была банальной, а характеризовалась сложной сетью, включающей филаменты и трубчатые структуры (Novikoff et al., 1980; Franke et al. ., 1987). Труднее установить функциональную сложность. Однако оказалось, что наиболее заметный фосфорилированный белок в адипоцитах, обработанных циклическим АМФ, перилипин локализуется на периферии липидной капли в базальном состоянии (Greenberg et al., 1991, 1993). Перилипин, который был обнаружен только вокруг внутриклеточных нейтральных липидов, экспрессируется исключительно в адипоцитах и стероидогенных клетках, в которых HSL служит для катализа циклического АМФ-управляемого гидролиза эфиров холестерина с образованием субстрата для биосинтеза стероидных гормонов. Сам перилипин содержит шесть канонических сайтов фосфорилирования циклического АМФ, из которых три амино-концевых участка, по-видимому, наиболее важны для функции (Tansey et al., 2003). Наглядной иллюстрацией важности перилипина является фенотип мышей с дефицитом его экспрессии (Martinez-Botas et al., 2000; Тэнси и др., 2001). Эти животные демонстрируют уменьшенную массу жировых клеток и поразительную устойчивость к ожирению, а также повышенный базальный липолиз. Тем не менее, их способность реагировать на β-адренергическую стимуляцию соответствующим повышением циркулирующих жирных кислот серьезно нарушена. Возможно, наиболее удивительным является то, что мыши, лишенные perilipin, более ограничены в отношении регуляции мобилизации жирных кислот, чем мыши, дефицитные по HSL (Osuga et al., 2000; Haemmerle et al., 2002).Объяснение этих наблюдений четко дается здесь с использованием нескольких систем культуры тканей. Во-первых, они подтверждают, что адипоциты, полученные от мышей с нулевым перилипином, действительно демонстрируют повышенный базальный липолиз в дополнение к устойчивости к β-адренергической стимуляции. Затем они используют клетки CHO, которые в норме не содержат ни HSL, ни perilipin, чтобы показать, что экспрессии первого недостаточно для обеспечения полного PKA-чувствительного липолиза, который вместо этого требует присутствия обоих белков.Более того, липолиз хорошо коррелировал с транслокацией HSL в липидную каплю, подчеркивая не только важность субклеточной локализации для разрушения TAG, но также и решающую роль фосфорилирования перилипина в перераспределении HSL. Интересно, что в отсутствие перилипина другой родственный белок, ADRP, покрывает липидную каплю, но это, по-видимому, неспособно ни ограничить липолиз до минимума, ни позволить HSL мигрировать к TAG в присутствии циклического AMP. Авторы по понятным причинам заключают, что перилипин наделен, по крайней мере, двумя уникальными свойствами: способностью предотвращать гидролиз внутриклеточных TAG в условиях покоя, а также реагировать на собственное фосфорилирование с помощью PKA, предоставляя нейтральной липазе доступ к капле.То, что последнее является, по крайней мере частично, следствием модификации перилипина, а не исключительно из-за фосфорилирования HSL, подтверждается остаточным циклическим AMP-стимулированным липолизом в нулевых клетках HSL и его зависимостью от фосфорилирования перилипина.
Тем не менее, все эти важные открытия оставляют неясным процесс, с помощью которого перилипин регулирует доступность ТАГ для липаз. Хотя простейшей идеей было бы то, что перилипин служит исходным сайтом стыковки для HSL, его способность приспосабливаться к другим липазам предлагает более элегантное объяснение.Шталрид и др. в качестве альтернативного механизма предполагают, что фосфорилированный перилипин каким-то образом модифицирует TAG, так что он более эффективно презентуется в качестве субстрата. Идея о том, что белок-фосфолипидные взаимодействия могут изменять форму плазматической мембраны, долгое время считалась правдоподобной, хотя то, как подобные изменения могут быть достигнуты для нейтральных липидов, остается неясным (Huttner and Schmidt, 2000). Одна из возможностей состоит в том, что фосфорилированный перилипин просто рассеивает ТАГ, облегчая контакт с липазой, хотя даже то, как это могло произойти, трудно представить.В конечном итоге представляется, что выяснению механизма действия перилипина будет препятствовать то же самое препятствие, которое замедлило работу по липолизу: трудность получения четкой картины липидного субстрата. Тем не менее, работа Sztalryd et al. приближают нас к пониманию того, как мобилизация жирных кислот регулируется в жировой клетке.
.
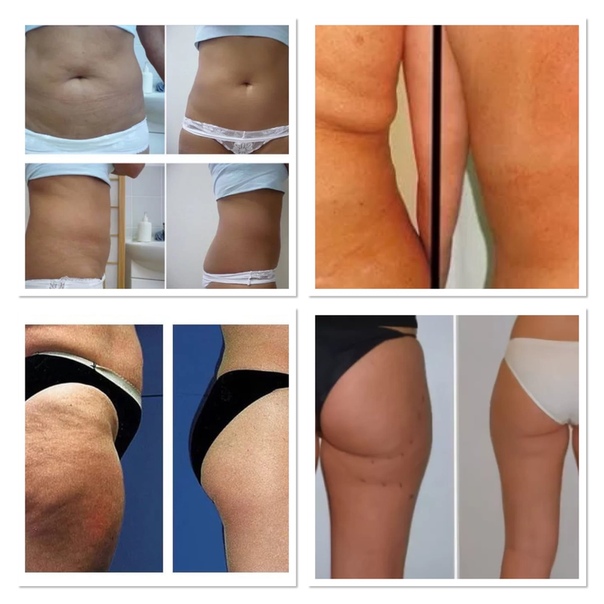
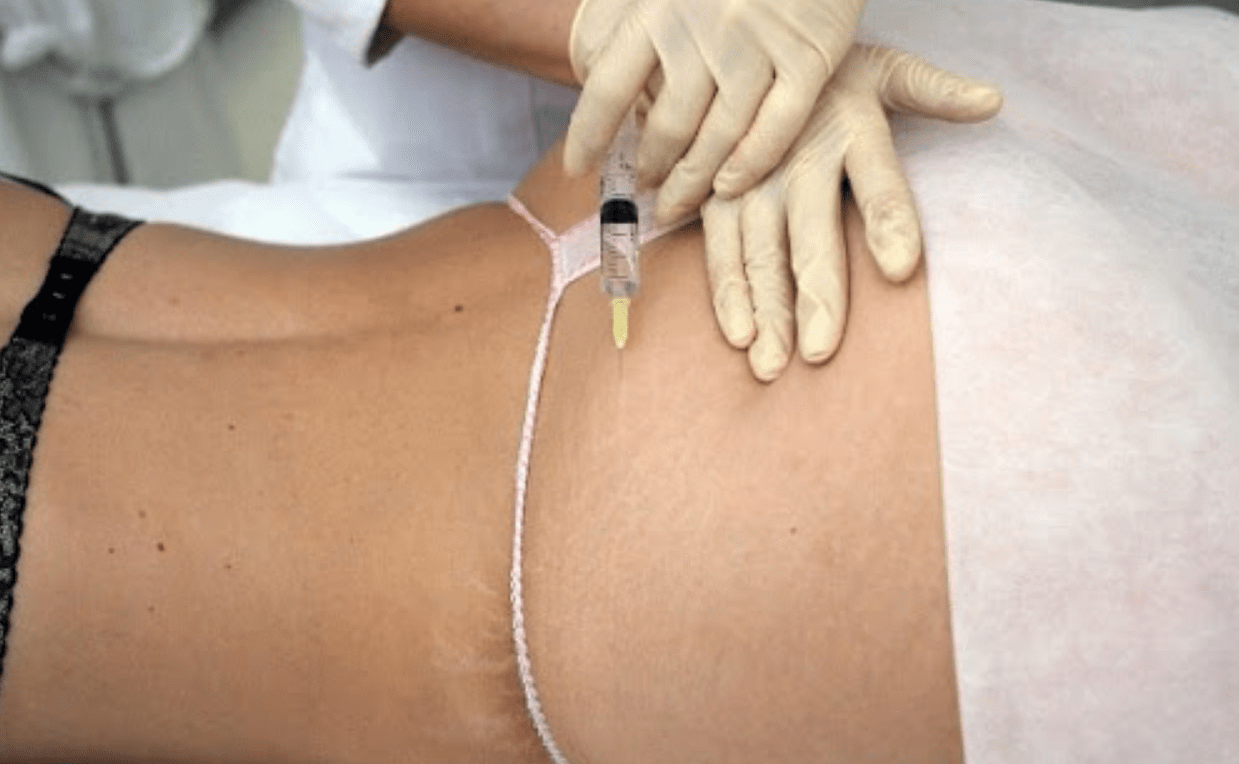

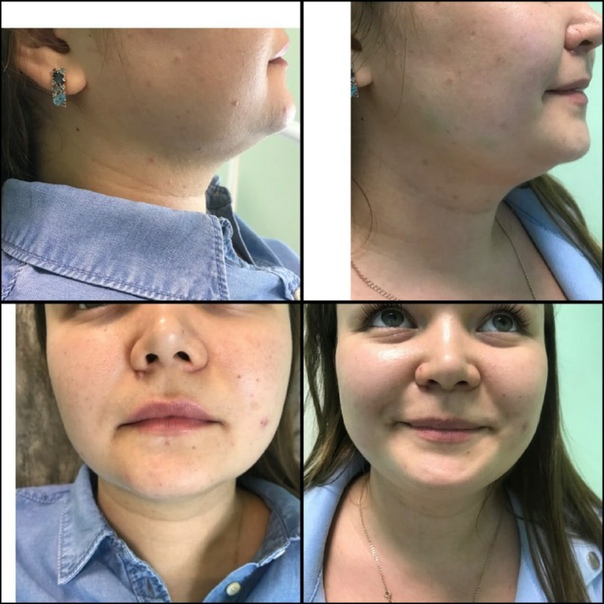 FAT SIGNALS — липазы и липолиз в липидном метаболизме и передаче сигналов. Клеточный метаб. 2012 07 марта; 15 (3): 279-91. [Бесплатная статья PMC: PMC3314979] [PubMed: 22405066]
FAT SIGNALS — липазы и липолиз в липидном метаболизме и передаче сигналов. Клеточный метаб. 2012 07 марта; 15 (3): 279-91. [Бесплатная статья PMC: PMC3314979] [PubMed: 22405066] М.Нулевая мутация в гене гормоночувствительной липазы и риск диабета 2 типа. N Engl J Med. 2014 12 июня; 370 (24): 2307-2315. [Бесплатная статья PMC: PMC4096982] [PubMed: 24848981]
М.Нулевая мутация в гене гормоночувствительной липазы и риск диабета 2 типа. N Engl J Med. 2014 12 июня; 370 (24): 2307-2315. [Бесплатная статья PMC: PMC4096982] [PubMed: 24848981]