Врожденные пороки молочной железы — операция в Noahklinik, Германия
Типология, диагностика эстетических и функциональных дефектов, лечебные мероприятия в Касселе
реконструкция груди
Врожденные дефекты груди проявляются в аномальном числе, положении и внешнем виде сосков, ареол и молочных желез. Подобные аномалии – это чаще всего следствие мутаций хромосом и генов, которые дают о себе знать на этапе эмбрионального развития.
Уже на шестой неделе роста ребенка-девочки внутри утробы матери происходит первичное формирование молочных желез. Изначально – молочные линии, далее они трансформируются в железы. Млечные протоки начинают формироваться где-то на 3-4 месяце, а сосково-ареолярный аппарат – уже ближе к концу беременности.
Дефекты формирования могут носить как одно-, так и двусторонний характер. На сегодняшний день лечение пороков осуществляется посредством реконструктивной маммопластики.
Классификация пороков молочной железы
Врожденные дефекты груди диагностируются довольно редко и составляют 1-3% всех патологий груди. Они формируются на этапе внутриутробного развития, и могут развиваться как у женского, так и мужского пола.
Истинные пороки возникают вследствие хромосомных заболеваний и генетических аномалий. Также немаловажную роль играет неблагоприятное воздействие. Например, курение или алкоголь. Все аномалии подразделяются на следующие группы:
- аномалии размеров;
- нарушения формы;
- врожденные физические пороки.
В норме человек имеет две грудные железы, размещенные симметрично. По разным причинам могут развиться такие пороки, как:
- Амастия – для данного заболевания характерно отсутствие одного либо обоих сосков.
- Ателия – на полноценно сформированной груди полностью отсутствуют соски.
 Вместе с тем могут отсутствовать и сами железы.
Вместе с тем могут отсутствовать и сами железы. - Полителия – порок является полной противоположностью ателии, у ребенка присутствуют лишние соски.
- Полимастия – недуг характеризуется образованием лишних молочных желез. Зачастую они локализуются под основными, но также могут располагаться на спине, руках, подмышками и прочих нетипичных местах. Они могут быть как несформированными, так и полноценно развитыми. Данное состояние особенно опасно и требует тщательного врачебного контроля. Подобные аномалии подвержены развитию различных патологий, в том числе, и злокачественных новообразований.
- Мономастия – для данной патологии характерно одностороннее размещение молочной железы и соска.
Не менее обширна классификация аномалий расположения и внешних параметров. Если железы располагаются в атипичном месте, данное состояние носит название эктопии. Довольно частое явление, встречающееся как среди женщин, так и мужчин – это асимметрия. В большинстве случаев она несущественна и увидеть ее невооруженным взглядом достаточно сложно.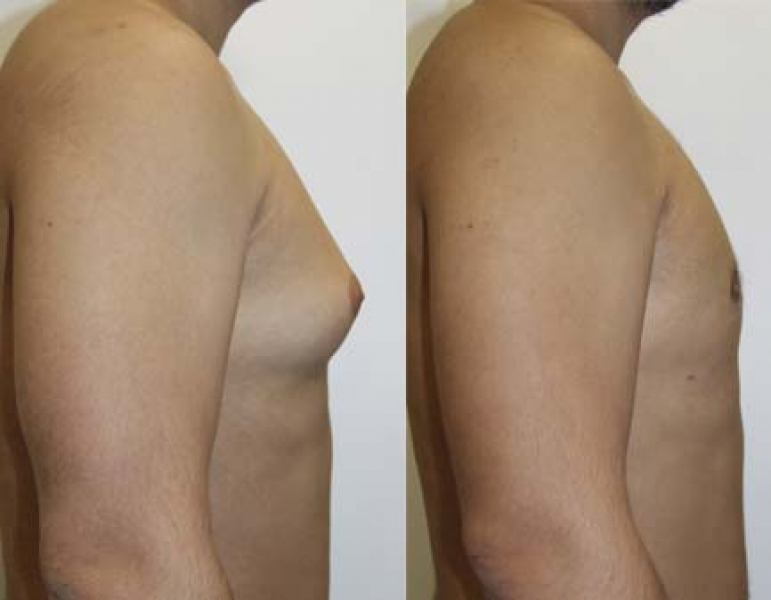
У пациенток, больных микромастией, грудь имеет небольшой размер и не соответствует пропорциям тела. Если грудь не полностью сформировалась, могут отмечаться пороки развития сосково-ареолярного аппарата. Макромастия наоборот характеризуется существенным увеличением желез.
К наиболее распространенным врожденным порокам сосково-ареолярного аппарата относятся излишне расширенные границы ареолы, а также чрезмерное выступание или втяжение сосков.
Диагностика и лечение в клинике профессора Ноа
Зачастую врожденные пороки легко диагностируются, так как дефекты имеют характерную клиническую картину. Но в ряде случаев обнаружить их можно только по завершении полового созревания. Для постановки правильного диагноза необходимо проконсультироваться с эндокринологом и маммологом, а также пройти КТ и УЗИ. В ходе осмотра доктором устанавливается полноценность органов, а также определяется наличие сопутствующих заболеваний.
Профессор Ноа, глава клиники, для устранения пороков развития прибегает к пластической хирургии. Показаниями для проведения операции являются:
- нарушения функций железы;
- сильные болевые ощущения и дискомфорт;
- патологические явления;
- выраженные визуальные дефекты.
С целью лечения макро- или микромастии прибегают к коррекции эндокринных нарушений. Данный метод доказал свою эффективность при лечении пороков в детском возрасте. Для того, чтобы скорректировать проблему в зрелом возрасте, проводится пластическая операция.
Мастоптоз также лечится посредством хирургического вмешательства. В редких случаях прибегают к ношению свободных бюстгальтеров, изготовленных по заказу. Но если опущение груди сильно выражено, устранить проблему можно только посредством мастопексии или эндопротезирования.
При диагностированной мономастии прибегают к воссозданию недостающей железы посредством реконструктивной хирургии TRAM-лоскутом или установки эндопротеза. С целью иссечения лишних молочных желез проводится мастэктомия, предполагающая их иссечение. Если диагностирована гипоплазия или аплазия, выполняется увеличение груди с использованием современных имплантатов.
С целью иссечения лишних молочных желез проводится мастэктомия, предполагающая их иссечение. Если диагностирована гипоплазия или аплазия, выполняется увеличение груди с использованием современных имплантатов.
В клинике доктора Ноа проводятся малоинвазивные операции, позволяющие устранить основной косметический и/или функциональный дефект. Благодаря современному оборудованию и инновационным технологиям сокращается продолжительность реабилитационного периода, а также сводится на нет риск побочных эффектов и осложнений.
УЗИ молочных желез в Москве
УЗИ молочных желез — информативный и безопасный метод диагностики, с помощью которого можно точно оценить состояние желез, обнаружить доброкачественные и злокачественные образования, уточнить диагноз. Это доступное по цене исследование безвредно и не несет лучевой нагрузки. Оно имеет большое значение в ранней диагностике заболеваний и нередко применяется в профилактических целях. На УЗИ может направить маммолог, онколог, эндокринолог, гинеколог.
Показания к исследованию
Ультразвуковое исследование молочных желез рекомендуется сделать следующих симптомах и жалобах:
- боли, покалывания в груди;
- отечность и краснота кожи молочных желез;
- пальпируемые образования, опухоли;
- симптомы воспаления, повышение температуры тела или местной температуры, подозрение на закупорку протоков при лактации;
- изменение контуров, формы, размеров сосков, не связанные с грудным вскармливанием;
- шелушение кожи груди;
- выделения из сосков не в период лактации и беременности;
- увеличение подмышечных, под- и надключичных лимфатических узлов;
- гормональные нарушения, установленные гинекологом;
- перед приемом противозачаточных таблеток и других гормональных препаратов;
- асимметрия молочных желез, появившаяся впервые;
-
перенесенные травмы, с целью оценки последствий.

Обследование молочных желез (УЗИ) потребуется при подборе оральных контрацептивов, гормональной внутриматочной спирали, вагинального контрацептивного кольца, пластыря. Также во многих случаях целесообразно пройти процедуру на этапе планирования беременности.
Поводом к обследованию могут выступать неудовлетворительные результаты рентгенографии молочных желез. В плановом порядке ультразвуковое исследование проводится для контроля пункционной биопсии, в дополнение к другим методам диагностики у женщин в период климакса, перед выполнением пластической операции, а также после нее для контроля результатов и состояния имплантатов.
Пройденный курс лечения также может потребовать повторного обследования. Иногда необходимо сделать процедуру несколько раз в процессе длительной терапии. Особенно это относится к ситуациям, когда показан прием гормональных препаратов. Врач оценит реакцию тканей железы на медикаментозное лечение, сможет скорректировать схему для повышения эффективности и сокращения сроков выздоровления.
При отсутствии жалоб проходить УЗИ необходимо пациенткам возрастом 25–39 лет один раз в два года, старше 40 — ежегодно. УЗИ молочных желез после 40 лет важно проводить регулярно с целью профилактики онкологических заболеваний. Гормональные изменения, связанные с возрастными процессами, повышают риск появления новообразований.
Подготовка и правильное планирование
Исследования молочных желез необходимо проходить в определенные дни менструального цикла. Это объясняется тем, что ткани изменяются в соответствии с изменениями гормонального фона и фазами цикла. Наиболее точные и достоверные результаты удается увидеть в состоянии так называемого гормонального покоя, то есть в первой половине цикла. В среднем он составляет 28 дней, поэтому благоприятное время — 4–14 дни от первого дня менструации. Лучше делать УЗИ на 5-8 сутки. В это время протоки молочных желез сужены. Если имеют место небольшие (до 5 мм) опухоли и узлы, врач увидит нехарактерные для этого периода расширения.
Во втором периоде обнаружить изменения при малых опухолях намного сложнее, поскольку протоки расширены физиологично.
Женщины, у которых отсутствуют естественные менструации, в том числе вступившие в период менопаузы и принимающие гормональные контрацептивы, могут пройти УЗИ в любой день.
Порядок проведения
Пациентка раздевается до пояса и ложится на кушетку, заводит руку за голову. Врач наносит на кожу груди специальный гель для улучшения проводимости ультразвуковых волн и облегчения скольжения, после чего приступает к обследованию — водит по коже датчиком. Затем процедуру повторяют со второй молочной железой. На мониторе аппарата выводится изображение тканей органа. Процедура безболезненна, занимает не более 20–25 минут.
Что покажет УЗИ молочных желез
Сделать УЗИ молочных желез можно в качестве первичной диагностики и для уточнения уже предполагаемого диагноза. Метод основывается на способности высокочастотных ультразвуковых волн с различной скоростью отражаться от тканей с разной плотностью.
Под контролем УЗИ специалист может взять пункцию из подозрительных новообразований для дальнейшего изучения материала в лаборатории. Это позволяет обеспечить точность манипуляций и повышает безопасность инвазивных методов.
Анализ полученных данных осуществляется врачом-диагностом. Заключение выдается на руки спустя 10–15 минут после обследования.
С помощью ультразвуковой диагностики можно обнаружить следующие заболевания:
- воспалительные заболевания — мастит, абсцессы, лактостаз у кормящих женщин, мастопатии различного происхождения и типа — фиброзно-кистозные, диффузные и пр.;
- врожденные аномалии молочной железы;
- рак;
- кисты и доброкачественные опухоли;
-
кальцинаты.

Для оценки кровотока в тканях молочных желез используется доплерография. Данные, полученные в результате биопсии под контролем УЗ-аппарата, могут сказать о природе и характере образований в молочных железах.
Кому противопоказано
УЗИ практически не имеет противопоказаний. Однако важно отметить, что информативность обследования груди таким способом у женщин молодого возраста выше, поскольку ткани молочных желез с возрастом становятся более рыхлыми. Поэтому после 40 лет УЗИ в большинстве случаев сочетается с рентген-диагностикой (маммографией).
Ограничением проведения процедуры могут стать повреждения и травмы кожи груди. Лактация, беременность не являются противопоказаниями, в этом случае обследование безвредно.
Преимущества УЗИ
Доступная цена УЗИ молочных желез — не единственное преимущество этого обследования. Любой метод диагностики имеет свои показания, и важно ориентироваться на мнение врача. Есть несколько причин, по которым он порекомендует пройти ультразвуковое исследование:
Есть несколько причин, по которым он порекомендует пройти ультразвуковое исследование:
- информативность и точность;
- безопасность, отсутствие вреда для здоровья;
- не инвазивность, безболезненность;
- минимальное количество противопоказаний.
С помощью УЗИ врач оценит молочные железы, а также состояние и структуру лимфоузлов.
Преимущества УЗИ в клинике «Семейный доктор»
Мы предлагаем своим пациентам диагностические услуги высокого качества. Дорожим вашим временем — обследование проводится строго по записи, вы можете записаться на процедуру в любое удобное время. Мы работаем в выходные и праздничные дни.
В своей работе мы используем современный ультразвуковой сканер. Это гарантирует высокую точность и достоверность результатов, а также полную безопасность для здоровья.
Клиника «Семейный доктор» предлагает пройти ультразвуковое исследование или выполнить пункцию молочных желез под контролем УЗИ. Высококвалифицированные специалисты выполнят диагностику быстро и точно, вы получите результаты на руки в короткие сроки.
Высококвалифицированные специалисты выполнят диагностику быстро и точно, вы получите результаты на руки в короткие сроки.Записаться к врачу и уточнить стоимость УЗИ молочных желез вы можете по телефону в Москве +7 (495)775 75 66, через форму онлайн-записи и в регистратуре клиники.
Стоимость
врач-онколог, хирург, колопроктолог, врач уз-диагностики
врач ультразвуковой диагностики
врач ультразвуковой диагностики, врач функциональной диагностики
врач-хирург, онколог, врач ультразвуковой диагностики
врач ультразвуковой диагностики
врач ультразвуковой диагностики, врач-гастроэнтеролог
врач ультразвуковой диагностики
врач ультразвуковой диагностики
врач ультразвуковой диагностики
врач ультразвуковой диагностики
врач ультразвуковой диагностики, врач-рентгенолог
Аномалии развития женских половых органов
Пороки развития внутренних половых органов — врождённые нарушения формы и структуры матки и влагалища. Пороки развития женских половых органов составляют 4% среди всех врождённых аномалий развития. Их выявляют у 3,2% женщин репродуктивного возраста. Пороки развития мочеполовой системы занимают 4-е место (9,7%) в структуре всех аномалий развития современного человека.
Пороки развития женских половых органов составляют 4% среди всех врождённых аномалий развития. Их выявляют у 3,2% женщин репродуктивного возраста. Пороки развития мочеполовой системы занимают 4-е место (9,7%) в структуре всех аномалий развития современного человека.
К группе риска по рождению девочек с пороками развития относятся женщины, имеющие профессиональные вредности и вредные привычки (алкоголизм, курение), перенесшие в сроки беременности от 8 до 16 недели вирусные инфекции. До настоящего времени не установлено точно, что именно лежит в основе возникновения пороков развития матки и влагалища. Однако несомненна роль наследственных факторов, биологической неполноценности клеток, формирующих половые органы, воздействия вредных физических, химических и биологических агентов. Возникновение различных форм пороков развития матки и влагалища зависит от патологического влияния тератогенных факторов или реализации наследственной предрасположенности в процессе эмбриогенеза.
В пубертатном возрасте у пациенток с аплазией влагалища, матки, атрезией гимена, аплазией всего или части влагалища при функционирующей матке наблюдаются первичная аменорея (отсутствие менструаций) и (или) болевой синдром. У девушек с аплазией влагалища и матки характерной жалобой бывает отсутствие менструаций, в дальнейшем ― невозможность половой жизни. При таких видах пороков, как полное удвоение матки и влагалища, двурогая матка, внутриматочная перегородка (полная или неполная), клинические проявления заболевания могут отсутствовать, либо пациентки предъявляют жалобы на болезненные менструации.
Хирургическое лечение.
У больных с аплазией влагалища и матки применяют хирургический кольпопоэз. В современных условиях «золотым стандартом» хирургического кольпопоэза у больных с аплазией влагалища и матки считают кольпопоэз из тазовой брюшины с лапароскопическим ассистированием. Отдалённые результаты показали, что практически все пациентки удовлетворены половой жизнью. При гинекологическом осмотре видимая граница между преддверием влагалища и созданным неовлагалищем отсутствует, длина (11–12 см), растяжимость и ёмкость влагалища вполне достаточны.
При гинекологическом осмотре видимая граница между преддверием влагалища и созданным неовлагалищем отсутствует, длина (11–12 см), растяжимость и ёмкость влагалища вполне достаточны.
Внутриматочная перегородка в несколько раз увеличивает вероятность невынашивания беременности и нарушает контрактильную способность миометрия при завершении родов через естественные родовые пути. Наиболее точным методом диагностики внутриматочной перегородки является магнитно-резонансная томография малого таза. Окончательный диагноз выставляется на диагностической гистероскопии, она сразу может быть переведена в лечебную гистерорезектоскопию.
Гистероскопическая диагностика затруднена при локализации перегородки до внутреннего зева, когда определяется одна полость и одно устье маточной трубы. Данный тип трудно дифференцировать от двурогой матки, так как гистероскопическая картина их идентична, поэтому диагностическая гистероскопия должна сочетаться с лапароскопией.
Для рассечения внутриматочной перегородки в нашей клинике используется биполярная петля гистерорезектоскопа.
В сравнении с традиционным хирургическим лечением, гистерорезектоскопия обладает рядом преимуществ, таких как: меньшая травматичность, более высокая экономичность (в частности, благодаря значительному снижению послеоперационного койко-дня), уменьшение длительности вмешательства. Это делает ее применение в хирургии внутриматочной перегородки очень перспективным, позволяет избежать радикальных операций, позволяет сохранить репродуктивный орган – матку, что на сегодняшний день является важной психологической и медицинской проблемой.
хирургия трубной груди в Мюнхене
Коррекция груди – мой выбор?
Ощущать себя «не такой, как все» особенно тяжело в период полового созревания и взросления. Психологическое давление, которое испытывают пациентки, связано с тубулярной деформацией молочных желез или их выраженной асимметрией. У молодых пациенток возможность проведения оперативной коррекции рекомендуется рассматривать сразу после завершения роста груди, чтобы как можно быстрее избавить их от психологической нагрузки.
У молодых пациенток возможность проведения оперативной коррекции рекомендуется рассматривать сразу после завершения роста груди, чтобы как можно быстрее избавить их от психологической нагрузки.
Перед операцией
В течение 14 дней перед операцией не принимайте обезболивающие средства, содержащие ацетилсалициловую кислоту (напр. аспирин). Данные медикаменты препятствуют механизму свёртываемости крови и могут привести к возникновению вторичного кровотечения. Употребление никотина и алкоголя перед операцией должно быть сведено к минимуму. По возможности за три-четыре недели до операции откажитесь от курения.
Форма анестезии и пребывание в клинике
Операция проводится под общим наркозом, в амбулаторных условиях или с госпитализацией на одну ночь. Необходимое предоперационное обследование вы можете заранее пройти у вашего лечащего врача или у терапевта в нашей клинике.Операция
При тубулярной деформации молочных желез операция является единственной возможностью восстановить их естественную форму. При этом нередко требуется одновременное проведение нескольких видов коррекции; в большинстве случаев используется комбинация различных хирургических методов.
При этом нередко требуется одновременное проведение нескольких видов коррекции; в большинстве случаев используется комбинация различных хирургических методов.- Коррекция перерастянутой ареолы
- Формоизменение и расширение деформированной и недостаточно развитой железистой ткани (при помощи имплантата или без него)
- Дополнительная трансплантация собственной жировой ткани для заполнения дефектов объёма
- Коррекция кожного покрова
- Реконструкция естественной складки под молочной железой
Реконструкция естественной складки под молочной железой
Послеоперационный период
После коррекции груди в течение четырёх-шести недель необходимо носить индивидуально подобранный поддерживающий бюстгальтер, в некоторых случаях в комбинации с так называемым «штутгартским поясом». Концы резорбируемого шовного материала удаляются через неделю после операции. Затем необходим уход за рубцами при помощи специальных мазей и силиконового пластыря. Амбулаторный контроль обычно проводится через три-шесть недель, а затем через шесть месяцев.
Амбулаторный контроль обычно проводится через три-шесть недель, а затем через шесть месяцев.
Какие осложнения могут возникнуть?
Риск, связанный с проведением коррекции груди, сравнительно невысок. Тем не менее, несмотря на всю осторожность и тщательность, как и при любом другом хирургическом вмешательстве, после операции или во время её проведения в единичных случаях возникают осложнения. Так, могут появиться отёки и гематомы, которые обычно проходят самопроизвольно. Возможные инфекции, как правило, поддаются лечению антибиотиками, лишь в исключительных случаях требуется оперативное лечение. К возможным осложнениям также относится формирование широкого или деформированного рубца вокруг соска, в данных случаях может быть проведена небольшая повторная коррекция с применением местной анестезии.
Мастит, липома, внутрипротоковая папиллома, гинекомастия
Цель этой статьи кратко ознакомить читателя с некоторыми заболеваниями молочных желез, которые часто диагностируются и переживаются пациентами. Главный мотив описания тех или иных заболеваний — это вооружить пациента первичной информации о болезни, очертить границы где и когда она может возникнуть, как протекать, а главное как ее диагностировать и лечить. Мы стремимся научить пациента прислушиваться к своему здоровью, беречь его и вовремя обращаться к врачу, и вместе с тем, не паниковать и не отчаиваться, а имея базовую информацию, формировать у себя полезную привычку сотрудничать с врачом в лечении и профилкатикы заболеваний.
Главный мотив описания тех или иных заболеваний — это вооружить пациента первичной информации о болезни, очертить границы где и когда она может возникнуть, как протекать, а главное как ее диагностировать и лечить. Мы стремимся научить пациента прислушиваться к своему здоровью, беречь его и вовремя обращаться к врачу, и вместе с тем, не паниковать и не отчаиваться, а имея базовую информацию, формировать у себя полезную привычку сотрудничать с врачом в лечении и профилкатикы заболеваний.
Мастит
Это воспаление в молочной железе, которое развивается из-за активности микроорганизмов — стафилококков или стрептококков. Факторами, способствующими появлению и развитию инфекции, является пониженный иммунитет, хронические заболевания, несоблюдение правил личной гигиены, трещины в сосках или аномалии их развития, неправильное сцеживания молока, лактостаз, переохлаждения, неправильно подобранное белье.
Различают две формы мастита: лактационный и нелактационный мастит.
Лактационный мастит возникает в случаях:
- большого количества грудного молока
- аномального строения сосков и связанных с этим трудности при кормлении;
- нарушение техники кормления ребенка.
Причинами появления нелактационный мастита считается стойкое нарушение гормонального фона и травмы груди.
Мастит необходимо лечить сразу, при появлении первых симптомов, поскольку заболевание имеет достаточно стремительный характер развития. По характеру течения болезни, мастит может быть серозным, инфильтративным или гнойным. Сначала развивается серозный мастит, при отсутствии лечения перетекает в инфильтративный, а затем — в гнойный. В тяжелых случаях, при отсутствии лечения, не исключен развитие сепсиса или гангренозного развитие мастита.
Симптомы мастита
- сильная боль, ощущение распирания в груди;
- отек молочной железы с одной или двух сторон;
- появление уплотнений, набухание сосков, гнойные или кровянистые выделения;
- покраснение кожи;
- повышение температуры, общая слабость, тошнота, головокружение
- проблемы с оттоком молока
- увеличение подмышечных лимфатических узлов, боль при пальпации.

Поставить диагноз мастит может только врач-маммолог при осмотре и после подтверждающих результатов лабораторных исследований и УЗИ молочных желез.
Лечение мастита на ранних стадиях медикаментозное и направлено на устранение бактерий, вызвавших заболевание. В случае развития гнойного мастита необходимо хирургическое вмешательство.
Липома
Липома — доброкачественное новообразование, возникающее в подкожных жировых клетках. На ощупь липома полукруглая, мягкая и подвижная, может быть разного размера. Липомы растут медленно и долго не вызывают неудобств. Обычно, липомы не вызывают болевых ощущений. Если такие ощущения есть, это может означать, что липома выросла до больших размеров, она давит на окружающие ткани, сосуды или нервные окончания и препятствует их нормальному функционированию.
Факторы риска, которые могут привести к появлению липомы:
- ожирение
- высокий уровень холестерина
- диабет
- нарушения обмена веществ
- непереносимость глюкозы
- заболевания печени
- возраст от 40 лет
Диагностика липомы
Диагностировать липому может врач хирург после визуального осмотра и пальпации места новообразования. По рекомендации врача может потребоваться УЗИ мягких тканей, маммография или биопсия с цитологическим или гистологическим исследованием.
По рекомендации врача может потребоваться УЗИ мягких тканей, маммография или биопсия с цитологическим или гистологическим исследованием.
Лечение липомы
Единственный эффективный метод лечения липомы — ее удаление хирургическим путем. Удаление проходит в амбулаторных условиях под действием местной анестезии. Показания к удалению липомы:
- быстрый рост образования
- давление липомы на окружающие ткани
- болевые ощущения
- значительный косметический дефект
Благодаря современным способам удаления липомы — радиоволнами или лазером — удается минимизировать кровопотерю во время операции, избежать гематом, и значительно сократить послеоперационный период.
Внутрипротоковая папиллома молочной железы
Также относится к доброкачественным новообразованиям, которое располагается в зоне молочных протоков. Она имеет вид нароста размером от нескольких миллиметров до 5-7 см. Папилломы могут быть единичными или множественными, развиваться в одной или в обеих молочных железах.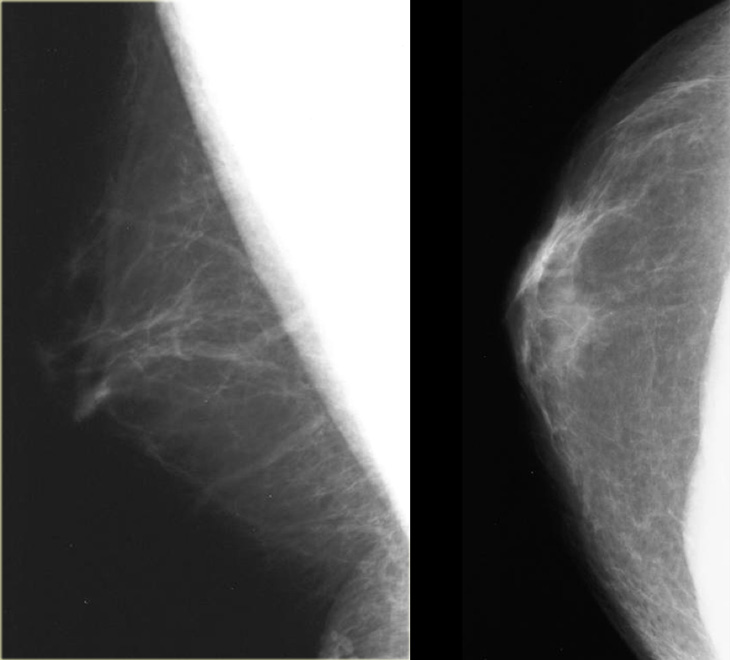
Причиной развития внутрипротоковая папилломы является нарушение гормонального фона, который могут спровоцировать эндокринные заболевания, стрессы, ожирение, аборты и другое.
Внутрипротоковые папилломы чаще всего развиваются на фоне узловых мастопатий. Протоки молочной железы расширяются, превращаясь в круглые кисты, в которых постепенно разрастаются папилломы. Кровеносные сосуды в области таких папиллом очень ломкие, что и вызывает частые кровоизлияния при любом травмировании молочных желез. Нормальная деятельность клеток нарушена, ткани отмирают, часто развивается некроз.
Основным симптомом заболевания является характерны постоянные выделения из соска — разные по консистенции: прозрачные или кровянистые.
Диагностика внутрипротоковой папилломы:
- осмотр врача-маммолога
- ультразвуковое исследование
- лабораторные исследования выделений из сосков
Дуктография — контрастная рентгенография, дающая возможность выявлять мельчайшие новообразования, их локализацию и оценивать их злокачественность или доброкачественность, а также объем необходимого оперативного вмешательства.
Для удаления внутрипротоковая папилломы проводится операция секторальной резекции — папилломатозные образования удаляется вместе с окружающими тканями. Удаленный материал отправляется на гистологический анализ для исключения выявления изменений злокачественного характера.
Гинекомастия
Проявляется увеличением грудных желез у мужчин вследствие разрастания жировой или железистой ткани. Причиной возникновения гинекомастии является изменения гормонального фона, который протекает с преобладанием женских половых гормонов над мужскими в организме мужчины. Кроме природных гормональных изменений в период полового созревания, факторами, способствующими возникновению патологии могут быть:
- употребление стероидных препаратов
- заболевания эндокринной системы
- почечная и печеночная недостаточность
- гипертиреоз
- опухолевые заболевания
Симптомы гинекомастии
- визуальное увеличение грудной железы
- боль и чувство напряжения в грудных железах
- изменение цвета кожного покрова
- выделения из соска
Диагностика гинекомастии
- обследование грудных желез, половых органов и периферических лимфатических узлов
- обследование щитовидной железы
- лабораторные исследования — анализ крови, определение показателей функции печени и почек, общий тестостерон, онкомаркеры при подозрении на злокачественную опухоль
- УЗИ обеих молочных желез и яичек
- КТ или МРТ
- биопсия молочной железы — при подозрении на рак
Гинекомастия лечится хирургически. Во время оперативного вмешательства удаляется избыточная ткань, методом липосакции удаляется жировая ткань. Для восстановления нормального вида молочной железы применяется пластическая хирургия (маммопластика), что позволяет сохранить внешний вид груди и лишает пациента психологического дискомфорта.
Во время оперативного вмешательства удаляется избыточная ткань, методом липосакции удаляется жировая ткань. Для восстановления нормального вида молочной железы применяется пластическая хирургия (маммопластика), что позволяет сохранить внешний вид груди и лишает пациента психологического дискомфорта.
причины, симптомы, лечение – статьи о здоровье
Оглавление
Аномальные маточные кровотечения (АМК) представляют собой патологические изменения менструальной функции. Функциональные изменения могут возникать на различных уровнях: в гипофизе и гипоталамусе, надпочечниках, яичниках, щитовидной железе и коре головного мозга.
Выделяют следующие виды нарушений:
- Полименорея. Для этой патологии характерны короткие перерывы между циклами, которые приводят к частому возникновению менструальных кровотечений. Они опасны тем, что провоцируют анемию, которая развивается в кратчайшие сроки
- Метроррагия.
 Такие кровотечения возникают в промежутках между менструациями. Метроррагия также опасна развитием анемии
Такие кровотечения возникают в промежутках между менструациями. Метроррагия также опасна развитием анемии - Меноррагия. Для этой патологии характерна выраженная потеря крови во время менструаций, нередко превышающих по своей длительности физиологическую норму
- Менометроррагия. Такие маточные кровотечения являются продолжительными и нерегулярными
Выявлены и такие формы АМК:
- Ювенильного периода. Они фиксируются у пациенток в возрасте от 12 до 17 лет
- Репродуктивного периода. Их отмечают у женщин от 18 до 45 лет
- Пременопаузального периода. Фиксируются у пациенток в возрасте от 46 до 55 лет
Особого внимания заслуживают кровотечения во время беременности и родов. Возникающая в первые месяцы вынашивания плода патология зачастую является признаком его внематочного расположения или угрозы самопроизвольного аборта. При таких состояниях женщины жалуются на боли в нижней части живота. Если АМК началось у беременной, следует незамедлительно воспользоваться медицинской помощью. Если начать лечение вовремя, можно спасти плод и сохранить репродуктивную функцию женщины.
Если АМК началось у беременной, следует незамедлительно воспользоваться медицинской помощью. Если начать лечение вовремя, можно спасти плод и сохранить репродуктивную функцию женщины.
Важно! Особенно опасными являются кровотечения, которые развиваются в 3 триместре. Патологическое состояние может возникнуть на фоне разрыва маточных стенок, предлежания плаценты или ее отслойки. Женщине в таком случае необходимо вызвать скорую медицинскую помощь.
В некоторых случаях АМК возникают и в родах. К их причинам относят отслойку плаценты и ее предлежание, нарушение свертываемости крови, застревание последа и низкую сократительную функцию матки.
Причины возникновения
Врачами выделяются сегодня следующие причины маточных кровотечений:
- Патологии яичников. К ним относят недостаточность лютеиновой фазы, синдромы поликистозных и резистентных яичников, кисты, гормонопродуцирующие опухоли и др.
- Заболевания матки.
 Аномальные кровотечения могут возникать на фоне миомы, эндометриоза, аденомиоза, полипов эндометрия и гиперплазии
Аномальные кровотечения могут возникать на фоне миомы, эндометриоза, аденомиоза, полипов эндометрия и гиперплазии - Патологии гипофиза. К ним относят гипофизарный гипогонадизм и акромегалию
- Заболевания щитовидной железы. Спровоцировать кровотечения могут гипо- и гипертиреозы
- Патологии надпочечников. К часто встречающимся относят синдром Кушинга и врожденную гиперплазию коры
- Заболевания свертывающей системы крови: гемофилия и др.
- Хронические патологии других органов: пиелонефрит, цирроз печени и др.
Также к причинам возникновения таких кровотечений относят прием ряда лекарственных препаратов и дефицит или избыток массы тела.
Важно! Лечение кровотечений у женщин должно начинаться уже после первого их проявления. В противном случае могут развиться серьезные осложнения. Важно своевременно обратиться к гинекологу. Только опытный специалист не просто выявит причину патологии, но и устранит ее проявления, проведет терапию основного заболевания. При необходимости к лечению кровотечений из матки врач привлечет своих коллег: терапевта, эндокринолога, уролога и др.
При необходимости к лечению кровотечений из матки врач привлечет своих коллег: терапевта, эндокринолога, уролога и др.
Симптомы
От стандартной менструации патологическое состояние отличается тем, что во время него существенно увеличивается объем выделяющейся крови. Обычно он повышается в 2 и более раз. При этом женщина вынуждена изменять свой образ жизни и часто менять используемые гигиенические средства.
Увеличивается и длительность кровотечения. Обычно менструация длится 3-7 дней. АМК могут продолжаться намного дольше. Для патологического состояния характерна и нерегулярность выделений, а также их появление после полового акта, в возрасте, когда менструации уже прекратились (в том числе достаточно давно).
Выделяют и особенности АМК в зависимости от их вида.
Для кровотечений ювенильного периода характерны выделения из половых путей, которые сопровождаются болевым синдромом и имеют длительность до 1,5 месяца. Такая патология становится причиной развития анемии, провоцирующей сухость кожи, периодические головокружения, бледность и общую ослабленность.
Такая патология становится причиной развития анемии, провоцирующей сухость кожи, периодические головокружения, бледность и общую ослабленность.
Для АМК репродуктивного периода характерны нарушения цикла. Кровотечения возникают на фоне задержки менструации до 6-8 недель или в процессе нее, могут длиться до 4-8 недель и также приводят к анемии, ослабляющей организм пациентки.
Для АМК пременопаузального периода характерны общая слабость, головная боль, раздражительность и снижение работоспособности. Также женщины жалуются на приливы жара, ночную потливость, покраснение лица, нагрубание молочных желез, непереносимость резких запахов и громких звуков, тревожность, апатию.
Методы терапии
Лечение кровотечений во многом зависит от их причин и вида.
Ювенильные АМК требуют проведения медикаментозной терапии, которая сводится к назначению лекарственных кровоостанавливающих средств, а также утеротоников. При необходимости рекомендуются определенные гормональные препараты. Длительность курса лечения определяется исключительно врачом в зависимости от возраста пациентки, особенностей ее развития и образа жизни. Если развивается анемия, она также корректируется. В качестве общеукрепляющего средства назначаются витаминные комплексы. Если лекарственные препараты не дают выраженного эффекта, гинеколог может порекомендовать диагностическое выскабливание полости матки. Предотвратить развитие кровотечений в некоторых случаях позволяет нормализация веса. Поэтому некоторым пациенткам дополнительно назначается специальная диета. Она дает возможности для устранения избыточной массы тела или ее набора.
При необходимости рекомендуются определенные гормональные препараты. Длительность курса лечения определяется исключительно врачом в зависимости от возраста пациентки, особенностей ее развития и образа жизни. Если развивается анемия, она также корректируется. В качестве общеукрепляющего средства назначаются витаминные комплексы. Если лекарственные препараты не дают выраженного эффекта, гинеколог может порекомендовать диагностическое выскабливание полости матки. Предотвратить развитие кровотечений в некоторых случаях позволяет нормализация веса. Поэтому некоторым пациенткам дополнительно назначается специальная диета. Она дает возможности для устранения избыточной массы тела или ее набора.
АМК, возникающие в репродуктивном возрасте, лечатся путем назначения кровоостанавливающих препаратов и средств, сокращающих матку. Также могут назначаться гормоны. Такая терапия подбирается с учетом наличия нарушений функции яичников, состояния эндометрия и данных об уровне эстрогенов в крови.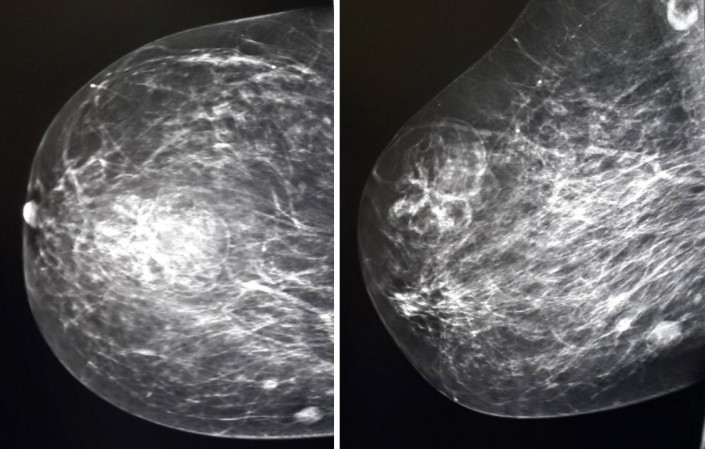 Для коррекции анемии рекомендуют препараты железа. Также может проводиться и диагностическое выскабливание полости матки, обеспечивающее остановку кровотечения и позволяющее получить необходимые данные о текущем строении эндометрия.
Для коррекции анемии рекомендуют препараты железа. Также может проводиться и диагностическое выскабливание полости матки, обеспечивающее остановку кровотечения и позволяющее получить необходимые данные о текущем строении эндометрия.
АМК в пременопаузальном периоде лечатся путем раздельного выскабливания полости матки. Могут применяться и другие современные методики. Также назначаются препараты для остановки кровотечения и гормональные средства. Так как зачастую патология сочетается с климактерическим синдромом, пациентке рекомендуют седативные и другие составы для нормализации функционирования центральной нервной системы.
Важно! Любые препараты назначаются исключительно врачом и принимаются только под его контролем. Во время лечения кровотечения у взрослых женщин и молодых девушек обязательными являются регулярные консультации с гинекологом. Только опытный специалист заранее определит:
- Общее состояние пациентки
- Наличие у нее сопутствующих заболеваний
- Индивидуальные особенности
Квалифицированный врач расскажет о возможных побочных эффектах и постарается подобрать препараты, которые создают минимальные риски возникновения таких эффектов.
Благодаря этому будут обеспечены:
- Нормализация цикла (если женщина находится в репродуктивном возрасте)
- Профилактика рецидивов
- Улучшение общего самочувствия пациентки
- Реализация нарушенной репродуктивной функции и восстановление фертильности при бесплодии (если это необходимо)
- Устранение рисков развития осложнений
Преимущества лечения в МЕДСИ
- Опытные гинекологи. Наши врачи обладают необходимыми навыками и знаниями для терапии пациенток вне зависимости от их возраста и иных индивидуальных особенностей. Гинекологи применяют как стандартные, так и современные методики лечения, что позволяет успешно комбинировать их для достижения выраженного эффекта в кратчайшие сроки
- Новейшие методы диагностики. Перед началом лечения маточных кровотечений проводится комплексное обследование пациентки, включающее лабораторные и инструментальные исследования
- Уникальные методы терапии.
 Даже в сложных случаях они позволяют избежать необходимости проведения оперативного вмешательства. При этом достигается выраженный оздоровительный эффект. При необходимости к лечению кровотечений подключаются не только гинекологи, но и другие узкие специалисты. Это позволяет добиться быстрого результата
Даже в сложных случаях они позволяют избежать необходимости проведения оперативного вмешательства. При этом достигается выраженный оздоровительный эффект. При необходимости к лечению кровотечений подключаются не только гинекологи, но и другие узкие специалисты. Это позволяет добиться быстрого результата - Комфортное обслуживание в клинике. Мы обеспечили отсутствие очередей и возможности для записи на прием в удобное время. Каждая консультация комфортна для пациентки и проводится с особым вниманием к ней врача
Если вы планируете пройти лечение кровотечений в МЕДСИ в Санкт-Петербурге, позвоните нам по номеру +7 (812) 336-33-33. Специалист ответит на возникшие вопросы и запишет на прием к гинекологу на удобное время.
Коррекция формы груди. Подтяжка груди. Коррекция ареол и сосков.
Какой должна быть женская грудь в идеале? Если не концентрироваться на конкретном размере и форме, наверное, достаточно будет сказать, что бюсту положено быть упругим и пропорциональным и находиться строго «по месту прописки».
К сожалению, в силу различных причин, таких как наследственность, гравитация, кормление ребенка, гормональные расстройства, потеря веса и возрастные изменения, грудь женщины может преждевременно потерять форму и опуститься, став для своей хозяйки источником постоянного недовольства и комплексов.
Подарить таким пациенткам уверенность в себе способна пластическая операция по подтяжке груди – мастопексия.
1Операция по коррекции груди
2Операция по коррекции груди
3Операция по коррекции груди
Показания и противопоказания к мастопексии
В отличие от увеличивающей маммопластики, классическая подтяжка молочных желез проводится без имплантов. Процедура позволяет избавиться от провисания мягких тканей и восстановить (создать) эстетичную форму груди.
Основным показанием к проведению данного хирургического вмешательства является выраженное опущение (птоз) молочных желез – состояние, при котором соски находятся аномально низко. Степень мастоптоза принято оценивать по положению соска по отношению к складке под грудью (субмаммарной складке).
Степень мастоптоза принято оценивать по положению соска по отношению к складке под грудью (субмаммарной складке).
Существует 3 степени птоза молочных желез:
1 степень характеризуется слабым опущением железы, сосок располагается на линии субмаммарной складки;
2 степень – сосок находится под складкой, но выше большей части тканей железы;
3 степень – сосок на уровне нижнего полюса железы и смотрит вниз.
Псевдоптоз молочных желез – сосок находится над складкой, хотя сама молочная железа опущена.
Также основанием для проведения подтяжки грудных желез могут быть:
- заметная деформация груди;
- провисания кожи, потеря упругости;
- потеря объема;
- асимметрия молочных желез;
- наличие стрий (растяжек) на коже груди;
- неэстетично растянутые ареолы и т.д.
Стать препятствием к коррекции груди могут следующие болезни и состояния:
- опухолевые процессы;
- тяжелые хронические заболевания;
- кожные болезни;
- инфекции;
- психические расстройства;
- заболевания крови;
- беременность / планирующаяся беременность и др.

Как проходит операция по подтяжке груди
Мастопексия выполняется под общей анестезией и длится от 1,5 до 2,5 часов, в зависимости от сложности вмешательства.
Оперирующий врач делает разрез и иссекает излишки кожи, после чего заново формирует железу, аккуратно перераспределяя жировую и железистую ткань, затем перемещает сосок в намеченное место.
Оптимальный способ выполнения подтяжки молочных желез избирается в зависимости от ожидаемого результата и исходных данных пациентки.
Периареолярная подтяжка груди проводится через разрез по краю ареолы. Такой метод применим в случае коррекции слабо выраженного мастоптоза или при псевдоптозе.
Подтяжка через вертикальный доступ оптимальна при устранении птоза средней степени выраженности. В данном случае хирург рассекает кожу вокруг соска, а затем ведет разрез вниз до субмаммарной складки.
Подтяжка через «якорный» доступ великолепно зарекомендовала себя при коррекции выраженного птоза 3 степени, а также в случаях, когда необходимо подтянуть грудь значительного объема. Разрез начинается вокруг соска, спускается вертикально, затем проходит под молочной железой.
Разрез начинается вокруг соска, спускается вертикально, затем проходит под молочной железой.
Фото до подтяжки груди:
1Пластика груди: ДО
2Пластика груди: ДО
3Пластика груди: ДО
Фото после проведенной подтяжки груди:
1Пластика груди: ПОСЛЕ
2Пластика груди: ПОСЛЕ
3Пластика груди: ПОСЛЕ
Мастопексию можно сочетать с другими видами маммопластики, например, с эндопротезированием, если пациентка хочет сделать грудь пышнее, или с редукционной пластикой – в случае коррекции формы бюста, отличающегося избытком кожи, железистой и жировой ткани.
Помимо оперативной мастопексии, существуют малоинвазивные методики коррекции формы груди: нитевая подтяжка груди, лигатурная подтяжка груди и др. Они не подразумевают использования общего наркоза, не требуют долгой реабилитации, не оставляют рубцов. Стоимость подтяжки груди в таком случае также будет гораздо ниже. Однако и эффект от данных процедур не сравним с тем, что дает операция.
После мастопексии
Первые послеоперационные сутки пациентку, как правило, оставляют в стационаре, а затем выписывают домой.
Спустя 10-12 дней необходимо приехать в клинику для снятия швов.
Месяц или чуть долее придется носить белье из специального трикотажа и следовать всем предписаниям лечащего врача, включая отказ от вредных привычек и соблюдение диеты.
Необходимо избегать физических нагрузок и перегрева. Единственная допустимая поза для сна – на спине.
Результат подтяжки будет заметен сразу. А через полгода можно ожидать превращения послеоперационных рубцов в тонкие бледные полоски.
Фото до подтяжки груди
1ДО проведения якорной подтяжки груди
2ДО проведения якорной подтяжки груди
3ДО проведения якорной подтяжки груди
Фото после проведенной подтяжки груди:
1ПОСЛЕ проведения якорной подтяжки груди
2ПОСЛЕ проведения якорной подтяжки груди
3ПОСЛЕ проведения якорной подтяжки груди
Коррекция ареол и сосков
Операцию по подтяжке груди часто выполняют с одновременным исправлением формы груди и коррекцией сосково-ареолярного комплекса.
Однако нередко коррекцию ареол и сосков проводят как самостоятельную операцию. Эта процедура дает женщине возможность быстро и эффективно избавиться от досаждавших ей всю жизнь несовершенств (аномалии развития сосков, неаккуратный вид ареол, чрезмерная или отсутствующая пигментация этой зоны и т.д.).
Показания к коррекции формы сосков и ареол:
• западение или уплощение соска;
• чрезмерная выпуклость соска;
• недоразвитие или отсутствие соска;
• нарушение симметрии ареол и сосков;
• неэстетичный вид ареолы (несоразмерно большой или маленький пигментный круг, неоднородная или темная окраска).
Манипуляции с сосково-ареолярным комплексом могут быть проведены под местным или комбинированным наркозом (если не запланировано симультанное вмешательство, включающее эндопротезирование или подтяжку груди). Операция в среднем занимает около 1 часа.
Важно! Поскольку не все методики гарантируют в дальнейшем беспрепятственное грудное вскармливание, необходимо тщательно и всесторонне обсудить этот вопрос с хирургом, оценить риски.
Перечислим наиболее востребованные операции по коррекции ареол и сосков:
Коррекция формы сосков (уменьшение сосков). В процессе операции лишние ткани соска иссекаются, затем на сосок накладывается косметический шов.
Коррекция втянутых сосков. Оперирующий врач делает разрез в области основания соска, отделяет структуры, тянущие его внутрь, затем закрепляет сосок в надлежащем положении, исключая его повторное западение.
Уменьшение ареол сосков. Хирург иссекает избыток кожи по краю околососкового кружка, формирует границы новой ареолы, затем накладывает внутренний и внешний (косметический) швы. Окружность ареолы может быть сокращена на 3-4 см.
Увеличение ареол сосков. Это эстетическая манипуляция, применяемая при коррекции невыраженных, отсутствующих или слабопигментированных ареол, а также при их асимметрии. В заранее размеченный участок кожи вводят пигмент, имитирующий натуральную окраску ареол.
После операции пациентка также некоторое время находится в стационаре, затем отпускается домой. Для скорейшей реабилитации и закрепления результата следует носить поддерживающее белье из специального трикотажа и соблюдать предписания доктора.
Для скорейшей реабилитации и закрепления результата следует носить поддерживающее белье из специального трикотажа и соблюдать предписания доктора.
Подтяжка груди с коррекцией ареол и сосков. Фото до и после операции.
1Фото до подтяжки груди с коррекцией ареол и сосков
2Фото после подтяжки груди с коррекцией ареол и сосков
3Фото после подтяжки груди с коррекцией ареол и сосков
Если вы мечтаете что-то улучшить в своей внешности, например, прибегнуть к подтяжке груди или к коррекции сосково-ареолярной области, принимайте решение осознанно! Изучите профессиональные медицинские статьи и отзывы о подтяжке груди, побывайте в понравившихся вам клиниках, лично проконсультируйтесь с докторами. Ваше решение о пластике груди должно быть взвешенным!
Обязательно посетите многопрофильную клинику «МедикСити». Наши пластические хирурги имеют впечатляющий практический опыт и владеют всеми классическими и инновационными методиками коррекции груди!
Врожденные аномалии молочной железы
Semin Plast Surg. 2013 февраль; 27(1): 36–41.
2013 февраль; 27(1): 36–41.
Луиза кавете-Laberge
1 Отдел пластической хирургии, Университет Монреаля, Монреаль, Канада
Daniel Borsuk
1 Отделение пластической хирургии Монреальского университета, Монреаль, Канада
1 Отделение пластической хирургии Монреальского университета, Монреаль, Канада
Адрес для корреспонденции Луиза Кауэтт-Лаберж, доктор медицинских наук, FRCSC Отделение пластической хирургии, университет Монреаля, CHU Ste-Justine, 3175 Cote Ste-Catherine O., местный 7907, Монреаль, Канада, h4T 1C5, [email protected]Эта статья была процитирована другими статьями в PMC.Abstract
Синдром Поланда представляет собой сочетание деформации грудной клетки и отсутствия или гипоплазии грудных мышц и молочной железы, связанное с укорочением и брахисиндактилией верхней конечности. Клиническая картина широко варьируется; следовательно, реконструктивные процедуры должны быть адаптированы к деформации, начиная от стабилизации или увеличения грудной стенки, динамического переноса мышц, изменения положения соска и ареолы и увеличения груди с использованием протеза или переноса аутологичной ткани. Другие врожденные аномалии молочной железы включают избыточные соски и ареолы (полителия) и груди (полимастия), которые обычно можно обнаружить на эмбриональном грудном гребне. Отсутствие соска, ареолы (ателии) или ткани молочной железы (амастия) встречается реже.
Другие врожденные аномалии молочной железы включают избыточные соски и ареолы (полителия) и груди (полимастия), которые обычно можно обнаружить на эмбриональном грудном гребне. Отсутствие соска, ареолы (ателии) или ткани молочной железы (амастия) встречается реже.
Ключевые слова: Синдром Поланда, молочная железа, грудная мышца, полителия, полимастия, ателия, амастия
Синдром Поланда
Синдром Поланда назван в честь Альфреда Поланда, описавшего это состояние в 1841 году.Два предыдущих описания отсутствия грудной мышцы были зарегистрированы в 1826 и 1839 годах без связанной с этим деформации кисти. Синдром Поланда представляет собой сочетание аномалий грудной клетки и верхних конечностей, обычно односторонних, хотя сообщалось о нескольких двусторонних случаях. Чаще встречается у мужчин и справа. Распространенность, приблизительно 1 на 20 000–30 000 рождений, 1 считается недооцененной. Причина синдрома до сих пор остается спорной, но многие авторы поддерживают гипотезу об аномальном развитии сосудистой сети плода в области, вызывающей наблюдаемые дефекты. 2 Другие синдромы (Мебиуса, Клиппеля-Фейля, деформации Шпренгеля) могут быть связаны. Большинство случаев носят спорадический характер, хотя есть сообщения о генетической передаче.
2 Другие синдромы (Мебиуса, Клиппеля-Фейля, деформации Шпренгеля) могут быть связаны. Большинство случаев носят спорадический характер, хотя есть сообщения о генетической передаче.
Синдром включает деформацию или отсутствие ребер, частичное или полное отсутствие грудных мышц, особенно грудино-реберной головки большой грудной мышцы, что приводит к отсутствию передней подмышечной складки. Иногда можно обнаружить перепонку подмышечной впадины с аномальной фиброзной полосой от грудной клетки до плечевой кости.В большинстве случаев отмечается гипоплазия или отсутствие молочной железы, ареолы и подкожной клетчатки. Верхняя конечность часто укорочена при брахисиндактилии кисти. 3 На ипсилатеральной стороне могут поражаться и другие мышцы, в том числе передняя зубчатая мышца и широчайшая мышца спины. 4 Реконструктивные варианты многочисленны в зависимости от представления и потребностей пациента (). Необходимо провести тщательный анализ дефекта: отсутствие или деформация ребер, полное или частичное отсутствие грудной мышцы (), наличие передней подмышечной складки, перепонки подмышечной впадины (), размер и расположение сосково-ареолярного комплекса. (NAC) и ткань молочной железы.Плечо и лопатка могут иметь значительную степень асимметрии (возвышение), а гемиторакс на пораженной стороне часто уже. Следует тщательно исследовать ипсилатеральную широчайшую мышцу спины, поскольку она также может отсутствовать. В этом случае при планировании хирургического вмешательства необходимо учитывать свободную трансплантацию мышц. Аномалии сосудистой анатомии могут осложнить трансплантацию свободной ткани.
(NAC) и ткань молочной железы.Плечо и лопатка могут иметь значительную степень асимметрии (возвышение), а гемиторакс на пораженной стороне часто уже. Следует тщательно исследовать ипсилатеральную широчайшую мышцу спины, поскольку она также может отсутствовать. В этом случае при планировании хирургического вмешательства необходимо учитывать свободную трансплантацию мышц. Аномалии сосудистой анатомии могут осложнить трансплантацию свободной ткани.
( A ) Синдром Поланда с полным отсутствием грудной мышцы и ткани молочной железы.Обратите внимание на расположенный сверху и гипоплазированный сосок и ареолу (перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, eds. Эстетическая и реконструктивная хирургия груди. Филадельфия, Пенсильвания. : Saunders Elsevier; 2010: 601–629). ( B ) Синдром Поланда с подмышечной перемычкой, отсутствием грудино-реберной грудной мышцы и гипоплазией молочной железы.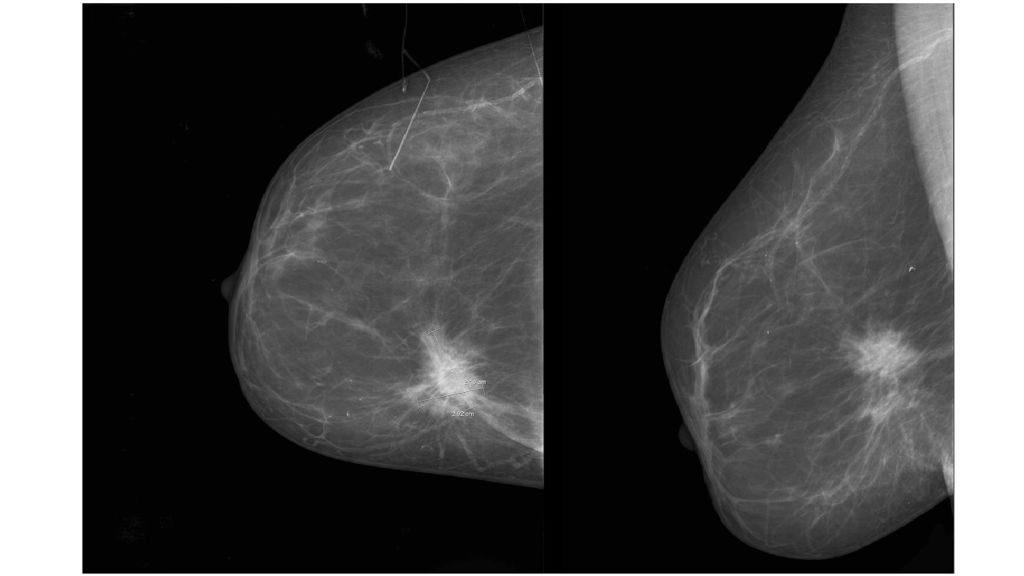 (Перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков.В: Холл Финдли Э., Эванс GRD, ред. Эстетическая и реконструктивная хирургия груди. Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601-629.)
(Перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков.В: Холл Финдли Э., Эванс GRD, ред. Эстетическая и реконструктивная хирургия груди. Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601-629.)
Таблица 1
Реконструктивные варианты в Польше Синдром
| TORAX | Нестабильный, большой бондный дефект | костных трансплантатов (разделенные ребра) | |
| стабильный, но плоский | Маскировка в соответствии с необходимостью реконструкции мышц и/или груди: Протез Пересадка мягких тканей | ||
| Грудная мышца | Полное отсутствие | Динамическая пересадка мышц (широчайшей мышцы спины) Дополнительные мягкие ткани в подключичной области: 9007 мышечно-кожный лоскут: 9007 лоскут FAT GRAFT Пользовательские протезы | |
| Partial Absence Axillary Fold отсутствует | DORSIC MUSI $ поперечный GRACILIS Другое MeOsunзов | ||
| Частичное отсутствие Asialy Fold Transe | Увеличение мягких тканей: Мышечные лоскуты Myocut Aneous Lifs Perforator Lifs жирные трансплантаты Простезиз | ||
| расширение тканей к снижению NAC до Увеличение груди | |||
| NAC: адекватное расположение | Нет расширения, если не нужно для большого количества Увеличение | ||
| Наличие ткани молочной железы / Маленькая контралатеральная грудь | Грудь Протез | Грудь Протез нагрузки на 30066 | Грудь Протез нагрузки на транспонировании Латиссимув Дорси MeoCuning Black Возможна Латиссимувая Дорси MeoCuning Closs или другой захороненный свободный докладчик |
| Отсутствуют ткани молочной железы / Большой контралатеральной груди / | Расширение ткани и одно из следующих: Предпочтительнее: аутологичное Увеличение: Pedicled Tram Hold Free Tram Hold MS-Tram Hold Diep Black SGAP CLASH IGAP BLASH Альтернатива: Грудь Протез |
Грудная стена Реконструкция
Целью реконструкции грудной клетки является обеспечение стабильной костной платформы.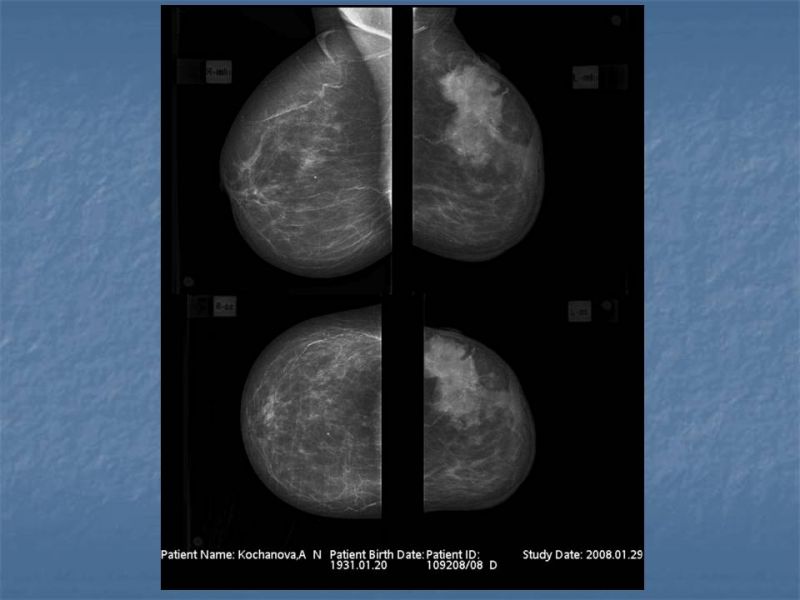 У немногих пациентов имеется значительный дефект грудной клетки. 3 Если дефект большой и грудная стенка нестабильна, для перекрытия разрыва вставляют расщепленные реберные трансплантаты. Передний кожный лоскут может быть спаян с плеврой; во время рассечения требуется осторожность, чтобы избежать непреднамеренного проникновения в грудную клетку. 5 В большинстве случаев уплощение ребер или дефекты одного промежутка не требуют костных трансплантатов. Камуфляж можно получить с помощью протеза, изготовленного по индивидуальному заказу, 6 , особенно в тех случаях, когда для воссоздания передней подмышечной складки необходима пересадка мышц и обеспечивается хорошее покрытие протеза.Установка протеза под кожный лоскут с небольшим количеством подкожной клетчатки имеет неестественный вид и более высокую частоту осложнений 7 , таких как смещение, поздняя серома, дискомфорт и экструзия. Восстановление контура грудной клетки возможно также с помощью деэпителизированных кожно-жировых лоскутов или липофилинга настоящее время.
У немногих пациентов имеется значительный дефект грудной клетки. 3 Если дефект большой и грудная стенка нестабильна, для перекрытия разрыва вставляют расщепленные реберные трансплантаты. Передний кожный лоскут может быть спаян с плеврой; во время рассечения требуется осторожность, чтобы избежать непреднамеренного проникновения в грудную клетку. 5 В большинстве случаев уплощение ребер или дефекты одного промежутка не требуют костных трансплантатов. Камуфляж можно получить с помощью протеза, изготовленного по индивидуальному заказу, 6 , особенно в тех случаях, когда для воссоздания передней подмышечной складки необходима пересадка мышц и обеспечивается хорошее покрытие протеза.Установка протеза под кожный лоскут с небольшим количеством подкожной клетчатки имеет неестественный вид и более высокую частоту осложнений 7 , таких как смещение, поздняя серома, дискомфорт и экструзия. Восстановление контура грудной клетки возможно также с помощью деэпителизированных кожно-жировых лоскутов или липофилинга настоящее время. Реберные хрящи часто более заметны на пораженной стороне, но изменение формы требуется редко, особенно у женщин; при увеличении груди деформация становится менее заметной.
Реберные хрящи часто более заметны на пораженной стороне, но изменение формы требуется редко, особенно у женщин; при увеличении груди деформация становится менее заметной.
Реконструкция грудной мышцы
Решение о пересадке функционирующей мышцы для замены отсутствующей грудной мышцы зависит от наличия или отсутствия передней подмышечной складки. При наличии верхней части грудной мышцы и подмышечной складки необходима только аугментация мягких тканей, которая может быть обеспечена мышечным, мышечно-кожным, кожным или перфораторным лоскутом, липофилингом или протезом, в зависимости от качества лежащий кожный лоскут и количество присутствующей ткани молочной железы. 8 , 9 , 10 , 11 . 3
При отсутствии подмышечной складки необходима динамическая пересадка мышц (). Предпочтительным донором является ипсилатеральная широчайшая мышца спины. Его перемещают в виде лоскута на ножке по торакодорсальным сосудам и нерву на переднюю часть грудной клетки и повторно вставляют на плечевую кость (1). Деформация донорского участка минимальна, так как задняя подмышечная складка сохранена () с сухожилием большой круглой мышцы. Срединно-латеральный грудной разрез (1) используется для забора широчайшей мышцы и поднятия переднего кожного лоскута для прикрепления мышцы. Еще один короткий разрез делается на внутренней стороне руки, чтобы снова прикрепить сухожилие к плечевой кости с помощью костного фиксатора. Широчайшая мышца крупнее и тоньше грудной мышцы, поэтому она сложена сама по себе, чтобы обеспечить больший объем, особенно в подключичной области и латерально на уровне подмышечной складки.Ohjimi 12 также предлагает скручивание широчайших мышц для увеличения передней подмышечной складки. В случаях выраженной депрессии в подключичной области вместе с мышцей можно переместить деэпителизированный кожный валик для увеличения толщины (12). Рука остается приведенной в течение 6 недель после операции. Сообщалось о более коротких разрезах при эндоскопической хирургии, 13 , но это делает процедуру более сложной с технической точки зрения.
Деформация донорского участка минимальна, так как задняя подмышечная складка сохранена () с сухожилием большой круглой мышцы. Срединно-латеральный грудной разрез (1) используется для забора широчайшей мышцы и поднятия переднего кожного лоскута для прикрепления мышцы. Еще один короткий разрез делается на внутренней стороне руки, чтобы снова прикрепить сухожилие к плечевой кости с помощью костного фиксатора. Широчайшая мышца крупнее и тоньше грудной мышцы, поэтому она сложена сама по себе, чтобы обеспечить больший объем, особенно в подключичной области и латерально на уровне подмышечной складки.Ohjimi 12 также предлагает скручивание широчайших мышц для увеличения передней подмышечной складки. В случаях выраженной депрессии в подключичной области вместе с мышцей можно переместить деэпителизированный кожный валик для увеличения толщины (12). Рука остается приведенной в течение 6 недель после операции. Сообщалось о более коротких разрезах при эндоскопической хирургии, 13 , но это делает процедуру более сложной с технической точки зрения. Трансплантация свободных иннервируемых мышц необходима в случаях отсутствия ипсилатеральной широчайшей мышцы.Альтернативой являются контралатеральный лоскут широчайшей мышцы или свободный поперечный кожно-мышечный тонкий лоскут, 14 , который может увеличить объем мягких тканей.
Трансплантация свободных иннервируемых мышц необходима в случаях отсутствия ипсилатеральной широчайшей мышцы.Альтернативой являются контралатеральный лоскут широчайшей мышцы или свободный поперечный кожно-мышечный тонкий лоскут, 14 , который может увеличить объем мягких тканей.
( A ) Синдром Поланда с минимальной мускулатурой в подключичной области, отсутствием передней подмышечной складки и гипоплазией молочной железы в адекватном месте (Перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, редакторы Эстетическая и реконструктивная хирургия груди.Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601–629). ( B ) Через два года после пересадки мышц и увеличения груди с помощью подмышечного грудного имплантата, вставленного во время пересадки мышц, обратите внимание на шрам на проксимальной части руки для повторного прикрепления сухожилия к плечевой кости.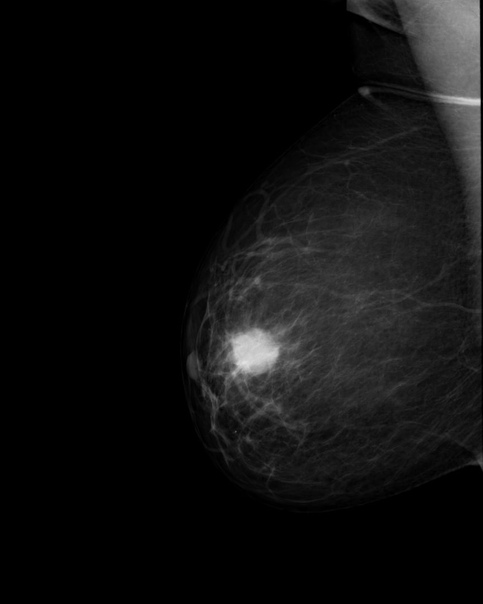 ( C ) Минимальная деформация спины после переноса широчайшей мышцы (круглый пронатор остается для задней подмышечной складки) (Перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков.В: Холл Финдли Э., Эванс GRD, ред. Эстетическая и реконструктивная хирургия груди. Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601–629). ( D ) Срединно-грудной рубец через 2 месяца после переноса широчайшей мышцы (перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, eds. Эстетическая и реконструктивная хирургия груди , Филадельфия, Пенсильвания: Saunders Elsevier, 2010: 601–629).
( C ) Минимальная деформация спины после переноса широчайшей мышцы (круглый пронатор остается для задней подмышечной складки) (Перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков.В: Холл Финдли Э., Эванс GRD, ред. Эстетическая и реконструктивная хирургия груди. Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601–629). ( D ) Срединно-грудной рубец через 2 месяца после переноса широчайшей мышцы (перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, eds. Эстетическая и реконструктивная хирургия груди , Филадельфия, Пенсильвания: Saunders Elsevier, 2010: 601–629).
( A ) Синдром Поланда с отсутствием грудных мышц и недостаточностью мягких тканей в подключичной области, хорошо развитой грудью (обратите внимание на боковую и верхнюю проекции груди из-за отсутствия нижележащей грудной мышцы) (Перепечатано с разрешения Caouette-Laberge L. , Бортолуцци П.Коррекция асимметрии груди у подростков. В: Холл Финдли Э., Эванс GRD, ред. Эстетическая и реконструктивная хирургия груди. Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601–629). ( B ) Трансплантация мышечно-кожной широчайшей мышцы с введением деэпителизированного островка кожи в подключичной области. ( C ) Послеоперационный период в покое (перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, eds. Эстетическая и реконструктивная хирургия груди.Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601–629). ( D ) Послеоперационный снимок с мышечным сокращением, показывающий скрытую мягкую ткань в подключичной области (перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, eds. Aesthetic and Реконструктивная хирургия груди, Филадельфия, Пенсильвания: Saunders Elsevier, 2010: 601–629).
, Бортолуцци П.Коррекция асимметрии груди у подростков. В: Холл Финдли Э., Эванс GRD, ред. Эстетическая и реконструктивная хирургия груди. Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601–629). ( B ) Трансплантация мышечно-кожной широчайшей мышцы с введением деэпителизированного островка кожи в подключичной области. ( C ) Послеоперационный период в покое (перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, eds. Эстетическая и реконструктивная хирургия груди.Филадельфия, Пенсильвания: Saunders Elsevier; 2010: 601–629). ( D ) Послеоперационный снимок с мышечным сокращением, показывающий скрытую мягкую ткань в подключичной области (перепечатано с разрешения Caouette-Laberge L, Bortoluzzi P. Коррекция асимметрии груди у подростков. В: Hall Findley E, Evans GRD, eds. Aesthetic and Реконструктивная хирургия груди, Филадельфия, Пенсильвания: Saunders Elsevier, 2010: 601–629).
Перемещение ареолы соска
Если комплекс ареолы соска (NAC) расположен слишком высоко, необходимо расширение ткани, чтобы опустить его до нужного уровня.Это также обеспечивает пространство для вторичного увеличения груди. Расширитель ткани можно вводить рано, до созревания контралатеральной груди, и медленно надувать в течение нескольких лет 4 , 5 или откладывать до окончательной реконструкции. Его можно поместить над или под широчайшей мышцей 4 во время транспозиции мышцы в зависимости от количества покрывающих мягких тканей. Важно зашить мышечный карман вокруг имплантата, чтобы предотвратить его миграцию во время расширения.Когда планируется аутологичная реконструкция молочной железы в расширенном кармане, требуется значительное перерастяжение, чтобы допустить послеоперационный отек перенесенной ткани и избежать компартмент-синдрома внутри капсулы расширителя. Обычно мы используем один и тот же срединно-латеральный грудной разрез для транспозиции мышц, установки расширителя или окончательного увеличения груди с помощью протеза или свободного лоскута, за исключением случаев, когда микроваскулярный анастомоз требует обнажения внутренних сосудов молочной железы. Образовавшийся рубец скрывается под рукой в состоянии покоя и хорошо переносится.Тем не менее, предоперационная маркировка подгрудной складки необходима для направления диссекции и обеспечения правильного расположения ткани на передней грудной стенке. 15
Образовавшийся рубец скрывается под рукой в состоянии покоя и хорошо переносится.Тем не менее, предоперационная маркировка подгрудной складки необходима для направления диссекции и обеспечения правильного расположения ткани на передней грудной стенке. 15
Реконструкция груди
Окончательное увеличение груди проводится после завершения роста нормальной груди. Увеличение с помощью протеза может обеспечить хорошую симметрию в тех случаях, когда на пораженной стороне уже есть ткань молочной железы и когда нормальная грудь мала и не опущена. Если расположение NAC является адекватным, протез может быть вставлен во время переноса мышцы, как правило, под мышцу, если вышележащая грудь мала.Карман закрывается, чтобы удерживать имплантат в нужном месте и предотвращать смещение вверх в подключичной области. Если рост контралатеральной груди не завершен, можно использовать постоянный экспандер/имплантат 16 для регулировки объема во время окончательного роста.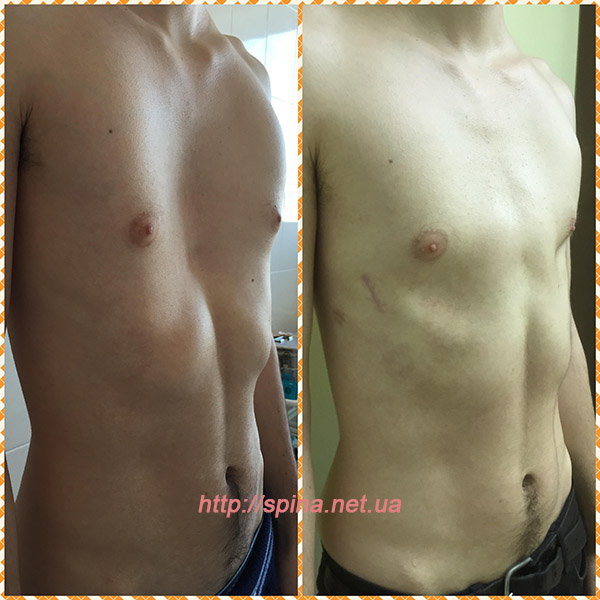 17 Аутологичное увеличение груди небольшого размера также можно получить с помощью закопанного кожно-мышечного лоскута широчайшей мышцы спины, закопанного свободного поперечного кожно-мышечного лоскута 14 или пересадки жировой ткани. 8 , 9 Аутологичная аугментация полезна в случаях полного отсутствия груди и когда нормальная контралатеральная грудь имеет большой размер, для получения лучшей симметрии и прогрессирующего птоза с возрастом. 15 Расширитель ткани вводится во время транспозиции мышцы, а перерастяжение достигается перед переносом аутологичной ткани. Доступны различные варианты 18 , 19 : кожно-мышечный лоскут на ножке или свободный лоскут из поперечной прямой мышцы живота (TRAM) или лоскут из глубокой нижней эпигастральной перфорации (DIEP) или свободный кожно-кожный или перфорантный лоскут из нижней или верхней ягодичной мышцы или перфорантный лоскут (IGAP/SGAP).
17 Аутологичное увеличение груди небольшого размера также можно получить с помощью закопанного кожно-мышечного лоскута широчайшей мышцы спины, закопанного свободного поперечного кожно-мышечного лоскута 14 или пересадки жировой ткани. 8 , 9 Аутологичная аугментация полезна в случаях полного отсутствия груди и когда нормальная контралатеральная грудь имеет большой размер, для получения лучшей симметрии и прогрессирующего птоза с возрастом. 15 Расширитель ткани вводится во время транспозиции мышцы, а перерастяжение достигается перед переносом аутологичной ткани. Доступны различные варианты 18 , 19 : кожно-мышечный лоскут на ножке или свободный лоскут из поперечной прямой мышцы живота (TRAM) или лоскут из глубокой нижней эпигастральной перфорации (DIEP) или свободный кожно-кожный или перфорантный лоскут из нижней или верхней ягодичной мышцы или перфорантный лоскут (IGAP/SGAP). Мы отдаем предпочтение нижнему ягодичному лоскуту из-за большого количества жировой ткани, которую можно собрать, и легко скрываемого рубца, особенно у подростков, у которых мало жировой ткани на брюшной стенке. Предоперационная оценка сосудистой сети является обязательной, поскольку аномалии встречаются часто. Когда торакодорсальные сосуды обеспечивают кровоснабжение транспозированной широчайшей мышцы спины, предпочтительными сосудами-реципиентами являются внутренние грудные сосуды.
Мы отдаем предпочтение нижнему ягодичному лоскуту из-за большого количества жировой ткани, которую можно собрать, и легко скрываемого рубца, особенно у подростков, у которых мало жировой ткани на брюшной стенке. Предоперационная оценка сосудистой сети является обязательной, поскольку аномалии встречаются часто. Когда торакодорсальные сосуды обеспечивают кровоснабжение транспозированной широчайшей мышцы спины, предпочтительными сосудами-реципиентами являются внутренние грудные сосуды.
Полителия (сверхштатные соски)
Полителия, наличие сверхштатных сосков (СНС), важно для врачей, чтобы отметить у новорожденного из-за преобладания роста и изменения с повышением уровня гормонов. В SNN могут развиваться те же патологии, что и в нормальной груди, включая неоплазию молочной железы. Хотя большинство SNN развиваются по эмбриональной молочной линии, они также могут появляться на спине, плече, бедре, лице или вульве (4). 22
( A ) Polythelia нештатный сосок ниже подгрудной складки. ( B ) Полимастия при выраженной гипоплазии левой грудной клетки, сколиозе и деформации Шпренгеля. ( C ) Иссечение сосково-ареолярного комплекса добавочной груди. ( D ) Добавочная ткань молочной железы сохранена и мобилизована на задней ножке. ( E ) Добавочная ткань молочной железы транспонируется сверху и фиксируется на грудной клетке для улучшения поддержки остаточной груди. ( F ) Результат после транспозиции верхней части груди книзу и медиально на верхнелатеральной ножке, остаточный рубец расположен в подгрудной складке.
( B ) Полимастия при выраженной гипоплазии левой грудной клетки, сколиозе и деформации Шпренгеля. ( C ) Иссечение сосково-ареолярного комплекса добавочной груди. ( D ) Добавочная ткань молочной железы сохранена и мобилизована на задней ножке. ( E ) Добавочная ткань молочной железы транспонируется сверху и фиксируется на грудной клетке для улучшения поддержки остаточной груди. ( F ) Результат после транспозиции верхней части груди книзу и медиально на верхнелатеральной ножке, остаточный рубец расположен в подгрудной складке.
Сообщаемая заболеваемость SNN варьирует от 5,6% до 0,22% среди белого европейского населения. 23 Хотя имеется мало данных, подтверждающих связь SNN с другими врожденными аномалиями или синдромами, они часто являются семейными. Корреляции с полом нет, и у SNN нет предпочтения правой или левой стороне; однако двусторонние SNN встречаются реже. 22
Управление SNN традиционно осуществлялось под наблюдением. Изменения пигментного поражения следует лечить так же, как и любой меланоцитарный невус, с ранним иссечением и гистопатологической оценкой. Онколог должен оценить рост сосков, который происходит не в детстве, не в период полового созревания и не во время беременности.
Изменения пигментного поражения следует лечить так же, как и любой меланоцитарный невус, с ранним иссечением и гистопатологической оценкой. Онколог должен оценить рост сосков, который происходит не в детстве, не в период полового созревания и не во время беременности.
Полимастия
Полимастия встречается даже реже, чем полителия, и также встречается по эмбриональной молочной линии. Как и полителия, она обычно спорадическая, но может иметь семейное наследование. 24 В отличие от полителии, полимастия может быть связана с другими врожденными аномалиями, особенно грудными и почечными.
Лечение полимастии варьируется и зависит от размера и расположения дополнительной молочной железы и соска. Простая мастэктомия является вариантом выбора у пациенток с третьим отчетливым бугорком молочной железы; тем не менее, по возможности следует предотвращать разрыв подгрудной складки и оболочки мягких тканей оставшейся груди. В тех случаях, когда добавочная грудь прилегает к нативной груди, щадящие ткани методы с деэпителизацией кожи и иссечением добавочного соска обычно могут восстановить нормальный вид и расположение бугорка (1).
Корректирующая операция при полимастии должна проводиться после завершения развития груди и достижения окончательных объемов ткани молочной железы. Часто бывает трудно предсказать форму и положение добавочного холмика груди и соска, и раннее удаление может в конечном итоге поставить под угрозу конечный результат.
Athelia/Amastia
Отсутствие сосков и/или железистой ткани молочной железы встречается редко. 25 , 26 По словам Lin и Nguyen, существуют разные проявления амастии, и каждое из них может быть связано с различными основными патологиями.Эктодермальные дефекты могут вызывать двустороннее отсутствие молочных желез у мужчин и женщин и связаны с нарушением развития эктодермального слоя и его придатков. Двусторонняя амастия может быть изолированным явлением или сочетаться с другими аномалиями неба и верхних конечностей. Односторонняя амастия может быть вариантом синдрома Поланда и требует соответствующего лечения.
Лечение амастии и ателии может следовать принципам постонкологической реконструкции молочной железы с особым вниманием к расположению подгрудной складки и соска. Расширение тканей с помощью аутологичных и/или протезных методов реконструкции молочной железы доступно и должно выбираться в зависимости от предпочтений пациента и хирурга. Аутологичная реконструкция с использованием тканей брюшной, спинной или ягодичной области может быть выбрана в зависимости от телосложения и предпочтений пациента. Однако в педиатрической популяции пересадка ягодичной ткани может быть предпочтительнее из-за общей доступности мягких тканей и менее заметных рубцов. 20 , 21 Ослабление брюшной стенки и частое отсутствие адекватных мягких тканей делают брюшную полость менее привлекательным донорским местом у подростков и молодых людей по сравнению с более зрелыми взрослыми с раком молочной железы.Реконструкция протеза с помощью тканевых расширителей и постоянных имплантатов следует тем же принципам, что и реконструкция у взрослых, и может применяться по усмотрению хирурга.
Расширение тканей с помощью аутологичных и/или протезных методов реконструкции молочной железы доступно и должно выбираться в зависимости от предпочтений пациента и хирурга. Аутологичная реконструкция с использованием тканей брюшной, спинной или ягодичной области может быть выбрана в зависимости от телосложения и предпочтений пациента. Однако в педиатрической популяции пересадка ягодичной ткани может быть предпочтительнее из-за общей доступности мягких тканей и менее заметных рубцов. 20 , 21 Ослабление брюшной стенки и частое отсутствие адекватных мягких тканей делают брюшную полость менее привлекательным донорским местом у подростков и молодых людей по сравнению с более зрелыми взрослыми с раком молочной железы.Реконструкция протеза с помощью тканевых расширителей и постоянных имплантатов следует тем же принципам, что и реконструкция у взрослых, и может применяться по усмотрению хирурга.
Ссылки
1. Baban A, Torre M, Bianca S. et al.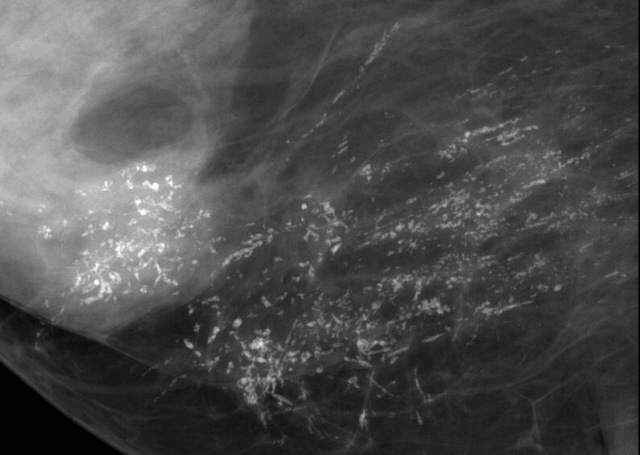 Синдром Поланда с двусторонними признаками: описание случая с обзором литературы. Am J Med Genet A. 2009;149A(7):1597–1602. [PubMed] [Google Scholar]2. Бавинк Дж. Н., Уивер Д. Д. Последовательность нарушения кровоснабжения подключичной артерии: гипотеза сосудистой этиологии аномалий Поланда, Клиппеля-Фейля и Мёбиуса.Am J Med Genet. 1986; 23(4):903–918. [PubMed] [Google Scholar]3. Shamberger RC Welch K J Upton J III Хирургическое лечение деформации грудной клетки при синдроме Поланда J Pediatr Surg 1989248760–765., обсуждение 766 [PubMed] [Google Scholar]4. Argenta LC, VanderKolk C, Friedman RJ, Marks M. Уточнения в реконструкции врожденных деформаций груди. Plast Reconstr Surg. 1985;76(1):73–82. [PubMed] [Google Scholar]5. Фатх Ф. Вена, Германия: Springer-Verlag; 2011. Хирургия синдрома Поланда; стр.247–256. [Google Академия]6. Saour S, Shaaban H, McPhail J, McArthur P. Индивидуальный силиконовый протез для реконструкции дефектов грудной клетки: техника изготовления и окончательный результат.
Синдром Поланда с двусторонними признаками: описание случая с обзором литературы. Am J Med Genet A. 2009;149A(7):1597–1602. [PubMed] [Google Scholar]2. Бавинк Дж. Н., Уивер Д. Д. Последовательность нарушения кровоснабжения подключичной артерии: гипотеза сосудистой этиологии аномалий Поланда, Клиппеля-Фейля и Мёбиуса.Am J Med Genet. 1986; 23(4):903–918. [PubMed] [Google Scholar]3. Shamberger RC Welch K J Upton J III Хирургическое лечение деформации грудной клетки при синдроме Поланда J Pediatr Surg 1989248760–765., обсуждение 766 [PubMed] [Google Scholar]4. Argenta LC, VanderKolk C, Friedman RJ, Marks M. Уточнения в реконструкции врожденных деформаций груди. Plast Reconstr Surg. 1985;76(1):73–82. [PubMed] [Google Scholar]5. Фатх Ф. Вена, Германия: Springer-Verlag; 2011. Хирургия синдрома Поланда; стр.247–256. [Google Академия]6. Saour S, Shaaban H, McPhail J, McArthur P. Индивидуальный силиконовый протез для реконструкции дефектов грудной клетки: техника изготовления и окончательный результат. J Plast Reconstr Aestet Surg. 2008;61:1205–1209. [PubMed] [Google Scholar]7. Сейфер А.Е., Фокс Дж.П., Гамильтон С.Г. Синдром Поланда: оценка и лечение грудной стенки у 63 пациентов. Plast Reconstr Surg. 2010;126(3):902–911. [PubMed] [Google Scholar]8. Делэй Э., Синна Р., Чекаруа К., Делапорт Т., Гарсон С., Туссун Г.Липомоделирование синдрома Поланда: новое лечение деформации грудной клетки. Эстетик Пласт Хирург. 2010;34(2):218–225. [PubMed] [Google Scholar]9. Pinsolle V, Chichery A, Grolleau JL, Chavoin JP. Аутологичная инъекция жира при синдроме Поланда. J Plast Reconstr Aestet Surg. 2008;61(7):784–791. [PubMed] [Google Scholar] 10. Ляо Х.Т., Ченг М.Х., Улусал Б.Г., Вэй Ф.К. Глубокий нижний эпигастральный перфорантный лоскут для успешной одновременной реконструкции груди и грудной стенки у пациента с аномалией Поланда.Энн Пласт Сург. 2005;55(4):422–426. [PubMed] [Google Scholar] 11. Гравванис А., Ло С., Ширли Р. Эстетическая реставрация синдрома Поланда у пациента мужского пола с использованием свободного переднебокового перфораторного лоскута бедра в качестве аутологичного наполнителя.
J Plast Reconstr Aestet Surg. 2008;61:1205–1209. [PubMed] [Google Scholar]7. Сейфер А.Е., Фокс Дж.П., Гамильтон С.Г. Синдром Поланда: оценка и лечение грудной стенки у 63 пациентов. Plast Reconstr Surg. 2010;126(3):902–911. [PubMed] [Google Scholar]8. Делэй Э., Синна Р., Чекаруа К., Делапорт Т., Гарсон С., Туссун Г.Липомоделирование синдрома Поланда: новое лечение деформации грудной клетки. Эстетик Пласт Хирург. 2010;34(2):218–225. [PubMed] [Google Scholar]9. Pinsolle V, Chichery A, Grolleau JL, Chavoin JP. Аутологичная инъекция жира при синдроме Поланда. J Plast Reconstr Aestet Surg. 2008;61(7):784–791. [PubMed] [Google Scholar] 10. Ляо Х.Т., Ченг М.Х., Улусал Б.Г., Вэй Ф.К. Глубокий нижний эпигастральный перфорантный лоскут для успешной одновременной реконструкции груди и грудной стенки у пациента с аномалией Поланда.Энн Пласт Сург. 2005;55(4):422–426. [PubMed] [Google Scholar] 11. Гравванис А., Ло С., Ширли Р. Эстетическая реставрация синдрома Поланда у пациента мужского пола с использованием свободного переднебокового перфораторного лоскута бедра в качестве аутологичного наполнителя. Микрохирургия. 2009;29(6):490–494. [PubMed] [Google Scholar] 12. Ohjimi Y, Shioya N, Ohjimi H, Kamiishi H. Коррекция деформации грудной клетки с использованием широчайших мышц спины с помощью процедуры оборота. Эстетик Пласт Хирург. 1989;13(3):199–202. [PubMed] [Google Scholar] 13. Гравванис А И, Панайоту П Н, Цуцос Д А.Синдром Поланда у пациентки, реконструированной эндоскопически ассистированной техникой. Акта Чир Пласт. 2007;49(2):37–39. [PubMed] [Google Scholar] 14. Шоллер Т. Вин, Германия: Springler-Verlag; 2011. Специальный микрососудистый лоскут при синдроме Поланда, ТМГ лоскут; стр. 257–261. [Google Академия] 15. Caouette-Laberge L, Bortoluzzi P. Philadelphia, PA: Saunders Elsevier; 2010. Коррекция асимметрии груди у подростков; стр. 601–629. [Google Академия] 16. Беккер Х. Реконструкция груди с использованием надувного грудного имплантата со съемным резервуаром.Plast Reconstr Surg. 1984;73(4):678–683. [PubMed] [Google Scholar] 17. Kneafsey B, Crawford DS, Khoo C TK, Saad M N. Коррекция аномалий развития молочной железы с помощью постоянного расширителя/имплантата.
Микрохирургия. 2009;29(6):490–494. [PubMed] [Google Scholar] 12. Ohjimi Y, Shioya N, Ohjimi H, Kamiishi H. Коррекция деформации грудной клетки с использованием широчайших мышц спины с помощью процедуры оборота. Эстетик Пласт Хирург. 1989;13(3):199–202. [PubMed] [Google Scholar] 13. Гравванис А И, Панайоту П Н, Цуцос Д А.Синдром Поланда у пациентки, реконструированной эндоскопически ассистированной техникой. Акта Чир Пласт. 2007;49(2):37–39. [PubMed] [Google Scholar] 14. Шоллер Т. Вин, Германия: Springler-Verlag; 2011. Специальный микрососудистый лоскут при синдроме Поланда, ТМГ лоскут; стр. 257–261. [Google Академия] 15. Caouette-Laberge L, Bortoluzzi P. Philadelphia, PA: Saunders Elsevier; 2010. Коррекция асимметрии груди у подростков; стр. 601–629. [Google Академия] 16. Беккер Х. Реконструкция груди с использованием надувного грудного имплантата со съемным резервуаром.Plast Reconstr Surg. 1984;73(4):678–683. [PubMed] [Google Scholar] 17. Kneafsey B, Crawford DS, Khoo C TK, Saad M N. Коррекция аномалий развития молочной железы с помощью постоянного расширителя/имплантата. Бр Дж Пласт Хирург. 1996;49(5):302–306. [PubMed] [Google Scholar] 18. Лонгакер М.Т., Глат П.М., Колен Л.Б., Зиберт Дж.В. Реконструкция асимметрии груди при деформации грудной клетки Поланда с использованием свободных микрососудистых лоскутов. Plast Reconstr Surg. 1997;99(2):429–436. [PubMed] [Google Scholar] 19. Гаутам А.К., Аллен Р.Дж. мл., ЛоТемпио М.М.и др. Реконструкция врожденной деформации груди с использованием перфораторных лоскутов. Энн Пласт Сург. 2007;58(4):353–358. [PubMed] [Google Scholar] 20. Дюпере С., Бержерон Л., Бортолуцци П., Дель-Дука Т., Кауэтт-Лаберж Л. Заболеваемость нижнего ягодичного мышечно-кожного лоскута на донорском участке для реконструкции молочной железы у подростков. Энн Пласт Сург. 2007;59(6):617–620. [PubMed] [Google Scholar] 21. Godbout E, Farmer L, Bortoluzzi P, Caouette Laberge L. Болезненность донорского участка лоскута IGAP для реконструкции груди у подростков.Может J Plast Surg. 2013;21(1):19–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]22.
Бр Дж Пласт Хирург. 1996;49(5):302–306. [PubMed] [Google Scholar] 18. Лонгакер М.Т., Глат П.М., Колен Л.Б., Зиберт Дж.В. Реконструкция асимметрии груди при деформации грудной клетки Поланда с использованием свободных микрососудистых лоскутов. Plast Reconstr Surg. 1997;99(2):429–436. [PubMed] [Google Scholar] 19. Гаутам А.К., Аллен Р.Дж. мл., ЛоТемпио М.М.и др. Реконструкция врожденной деформации груди с использованием перфораторных лоскутов. Энн Пласт Сург. 2007;58(4):353–358. [PubMed] [Google Scholar] 20. Дюпере С., Бержерон Л., Бортолуцци П., Дель-Дука Т., Кауэтт-Лаберж Л. Заболеваемость нижнего ягодичного мышечно-кожного лоскута на донорском участке для реконструкции молочной железы у подростков. Энн Пласт Сург. 2007;59(6):617–620. [PubMed] [Google Scholar] 21. Godbout E, Farmer L, Bortoluzzi P, Caouette Laberge L. Болезненность донорского участка лоскута IGAP для реконструкции груди у подростков.Может J Plast Surg. 2013;21(1):19–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]22.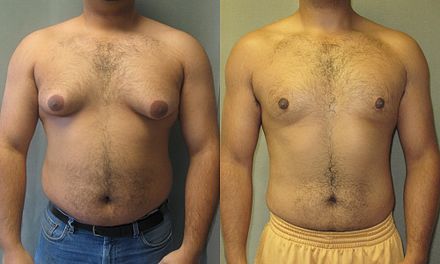 Шмидт Х. Нештатные соски: распространенность, размер, пол и склонность к бокам — проспективное клиническое исследование. Eur J Педиатр. 1998;157(10):821–823. [PubMed] [Google Scholar] 23. Mimouni F, Merlob P, Reisner SH. Возникновение нештатных сосков у новорожденных. Am J Dis Чайлд. 1983;137(10):952–953. [PubMed] [Google Scholar] 24. Кейси Х.Д., Часан П.Е., Чик Л.Р. Семейная полителия без сопутствующих аномалий. Энн Пласт Сург.1996;36(1):101–104. [PubMed] [Google Scholar] 25. Spear S L Pelletiere C V Lee E S Grotting J C Передняя грудная гипоплазия: отдельная сущность от синдрома Поланда Plast Reconstr Surg 2004113169–77., обсуждение 78–79 [PubMed] [Google Scholar]26. Лин К.Ю., Нгуен Д.Б., Уильямс Р.М. Повторное рассмотрение полного отсутствия груди. Plast Reconstr Surg. 2000;106(1):98–101. [PubMed] [Google Scholar]
Шмидт Х. Нештатные соски: распространенность, размер, пол и склонность к бокам — проспективное клиническое исследование. Eur J Педиатр. 1998;157(10):821–823. [PubMed] [Google Scholar] 23. Mimouni F, Merlob P, Reisner SH. Возникновение нештатных сосков у новорожденных. Am J Dis Чайлд. 1983;137(10):952–953. [PubMed] [Google Scholar] 24. Кейси Х.Д., Часан П.Е., Чик Л.Р. Семейная полителия без сопутствующих аномалий. Энн Пласт Сург.1996;36(1):101–104. [PubMed] [Google Scholar] 25. Spear S L Pelletiere C V Lee E S Grotting J C Передняя грудная гипоплазия: отдельная сущность от синдрома Поланда Plast Reconstr Surg 2004113169–77., обсуждение 78–79 [PubMed] [Google Scholar]26. Лин К.Ю., Нгуен Д.Б., Уильямс Р.М. Повторное рассмотрение полного отсутствия груди. Plast Reconstr Surg. 2000;106(1):98–101. [PubMed] [Google Scholar]Врожденные аномалии развития груди
Действия
‘) var buybox = документ. querySelector(«[data-id=id_»+ метка времени +»]»).parentNode ;[].slice.call(buybox.querySelectorAll(«.вариант-покупки»)).forEach(initCollapsibles) функция initCollapsibles(подписка, индекс) {
var toggle = подписка.querySelector(«.цена-варианта-покупки»)
подписка.classList.remove(«расширенный»)
var form = подписка.querySelector(«.форма-варианта-покупки») если (форма) {
var formAction = форма.получить атрибут («действие»)
form.setAttribute(«действие», formAction.replace(«/checkout», «/cart»))
document.querySelector(«#ecommerce-scripts»).addEventListener(«load», bindModal(form, formAction, timestamp, index), false)
} var priceInfo = подписка.querySelector(«.Информация о цене»)
var PurchaseOption = toggle.
querySelector(«[data-id=id_»+ метка времени +»]»).parentNode ;[].slice.call(buybox.querySelectorAll(«.вариант-покупки»)).forEach(initCollapsibles) функция initCollapsibles(подписка, индекс) {
var toggle = подписка.querySelector(«.цена-варианта-покупки»)
подписка.classList.remove(«расширенный»)
var form = подписка.querySelector(«.форма-варианта-покупки») если (форма) {
var formAction = форма.получить атрибут («действие»)
form.setAttribute(«действие», formAction.replace(«/checkout», «/cart»))
document.querySelector(«#ecommerce-scripts»).addEventListener(«load», bindModal(form, formAction, timestamp, index), false)
} var priceInfo = подписка.querySelector(«.Информация о цене»)
var PurchaseOption = toggle. parentElement если (переключить && форма && priceInfo) {
переключать.setAttribute(«роль», «кнопка»)
toggle.setAttribute(«tabindex», «0») toggle.addEventListener («щелчок», функция (событие) {
var expand = toggle.getAttribute(«aria-expanded») === «true» || ложный
toggle.setAttribute(«aria-expanded», !expanded)
form.hidden = расширенный
если (! расширено) {
покупкаВариант.classList.add («расширенный»)
} еще {
покупкаOption.classList.remove(«расширенный»)
}
priceInfo.hidden = расширенный
}, ложный)
}
} функция bindModal (форма, formAction, метка времени, индекс) {
var weHasBrowserSupport = window.
parentElement если (переключить && форма && priceInfo) {
переключать.setAttribute(«роль», «кнопка»)
toggle.setAttribute(«tabindex», «0») toggle.addEventListener («щелчок», функция (событие) {
var expand = toggle.getAttribute(«aria-expanded») === «true» || ложный
toggle.setAttribute(«aria-expanded», !expanded)
form.hidden = расширенный
если (! расширено) {
покупкаВариант.classList.add («расширенный»)
} еще {
покупкаOption.classList.remove(«расширенный»)
}
priceInfo.hidden = расширенный
}, ложный)
}
} функция bindModal (форма, formAction, метка времени, индекс) {
var weHasBrowserSupport = window. fetch && Array.from функция возврата () {
var Buybox = EcommScripts ? EcommScripts.Ящик для покупок: ноль
var Modal = EcommScripts ? EcommScripts.Modal : ноль if (weHasBrowserSupport && Buybox && Modal) {
var modalID = «ecomm-modal_» + метка времени + «_» + индекс var modal = новый модальный (modalID)
modal.domEl.addEventListener («закрыть», закрыть)
функция закрыть () {
форма.querySelector(«кнопка[тип=отправить]»).фокус()
} форма.setAttribute(
«действие»,
formAction.replace(«/checkout», «/cart?messageOnly=1»)
) form.
fetch && Array.from функция возврата () {
var Buybox = EcommScripts ? EcommScripts.Ящик для покупок: ноль
var Modal = EcommScripts ? EcommScripts.Modal : ноль if (weHasBrowserSupport && Buybox && Modal) {
var modalID = «ecomm-modal_» + метка времени + «_» + индекс var modal = новый модальный (modalID)
modal.domEl.addEventListener («закрыть», закрыть)
функция закрыть () {
форма.querySelector(«кнопка[тип=отправить]»).фокус()
} форма.setAttribute(
«действие»,
formAction.replace(«/checkout», «/cart?messageOnly=1»)
) form. addEventListener(
«Отправить»,
Buybox.interceptFormSubmit(
Буйбокс.fetchFormAction(окно.fetch),
Buybox.triggerModalAfterAddToCartSuccess(модальный),
консоль.лог,
),
ложный
) document.body.appendChild(modal.domEl)
}
}
} функция initKeyControls() {
документ.addEventListener(«keydown», функция (событие) {
if (document.activeElement.classList.contains(«цена-варианта-покупки») && (event.code === «Пробел» || event.code === «Enter»)) {
если (document.activeElement) {
событие.
addEventListener(
«Отправить»,
Buybox.interceptFormSubmit(
Буйбокс.fetchFormAction(окно.fetch),
Buybox.triggerModalAfterAddToCartSuccess(модальный),
консоль.лог,
),
ложный
) document.body.appendChild(modal.domEl)
}
}
} функция initKeyControls() {
документ.addEventListener(«keydown», функция (событие) {
if (document.activeElement.classList.contains(«цена-варианта-покупки») && (event.code === «Пробел» || event.code === «Enter»)) {
если (document.activeElement) {
событие. preventDefault()
документ.activeElement.click()
}
}
}, ложный)
} функция InitialStateOpen() {
var buyboxWidth = buybox.смещениеШирина
;[].slice.call(buybox.querySelectorAll(«.опция покупки»)).forEach(функция (опция, индекс) {
var toggle = option.querySelector(«.цена-варианта-покупки»)
var form = option.querySelector(«.форма-варианта-покупки»)
var priceInfo = option.querySelector(«.Информация о цене»)
если (buyboxWidth > 480) {
переключить.щелчок()
} еще {
если (индекс === 0) {
переключать.щелчок()
} еще {
toggle.
preventDefault()
документ.activeElement.click()
}
}
}, ложный)
} функция InitialStateOpen() {
var buyboxWidth = buybox.смещениеШирина
;[].slice.call(buybox.querySelectorAll(«.опция покупки»)).forEach(функция (опция, индекс) {
var toggle = option.querySelector(«.цена-варианта-покупки»)
var form = option.querySelector(«.форма-варианта-покупки»)
var priceInfo = option.querySelector(«.Информация о цене»)
если (buyboxWidth > 480) {
переключить.щелчок()
} еще {
если (индекс === 0) {
переключать.щелчок()
} еще {
toggle.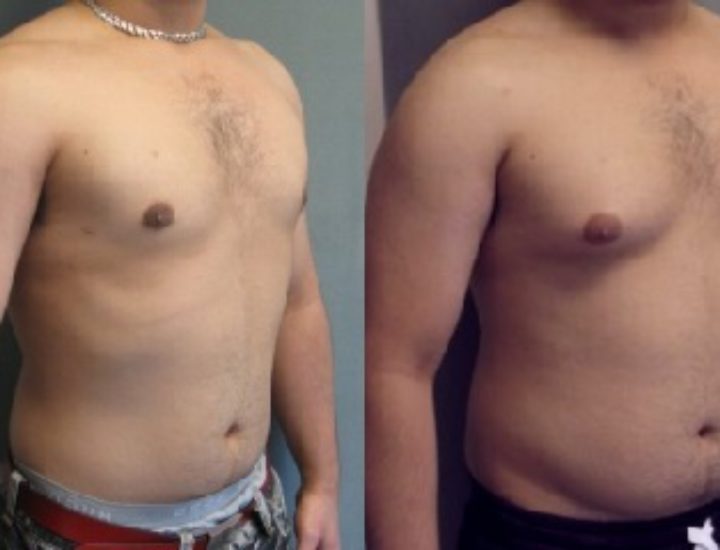 setAttribute («ария-расширенная», «ложь»)
form.hidden = «скрытый»
priceInfo.hidden = «скрытый»
}
}
})
} начальное состояниеОткрыть() если (window.buyboxInitialized) вернуть
window.buyboxInitialized = истина initKeyControls()
})()
setAttribute («ария-расширенная», «ложь»)
form.hidden = «скрытый»
priceInfo.hidden = «скрытый»
}
}
})
} начальное состояниеОткрыть() если (window.buyboxInitialized) вернуть
window.buyboxInitialized = истина initKeyControls()
})()Молочная железа — обзор
16.2.1 Введение
Молочные железы расположены в два ряда и идентифицируются по соскам (рис. 16.1). У собаки их обычно пять с каждой стороны: две грудные, одна брюшная и две паховые. Иногда есть четыре железы, а затем обычно отсутствует брюшная железа.
Иногда имеется более пяти желез с каждой стороны. Молочная ткань у взрослой собаки разделена неравномерно. Хвостовые железы крупнее, и ткань двух наиболее каудальных желез обычно сплошная.
У кошки по четыре железы с каждой стороны, с четкими границами и меньшей разницей в размерах, чем у собаки. 1, 2
Интерпретация аномалий молочных желез требует знакомства с лимфодренажем (рис. 16.2). Три каудальные железы, а у некоторых собак также каудальная грудная («вторая») железа впадают в поверхностный паховый лимфатический узел на той же (гомолатеральной) стороне (иногда называемый супрамаммарным узлом). Одновременно может быть соединение с лимфатическим узлом на противоположной (гетеролатеральной) стороне.От поверхностного пахового узла (узлов) имеется дренаж к узлам, расположенным краниальнее тазового канала (глубокий паховый узел, крестцовые узлы, подчревные узлы), а оттуда к лимфатическим узлам в брюшной полости.
Две черепные железы (когда всего четыре) или три черепные железы (когда всего пять) впадают в главный подмышечный лимфатический узел и в добавочный подмышечный узел. У некоторых собак краниальная паховая («четвертая») железа впадает в подмышечный лимфатический узел (узлы). Из этих лимфатических узлов, а у некоторых собак, вероятно, также непосредственно из трех черепных желез имеется дренаж в стернальный лимфатический узел, а иногда даже в предлопаточный лимфатический узел. 1-3
Из этих лимфатических узлов, а у некоторых собак, вероятно, также непосредственно из трех черепных желез имеется дренаж в стернальный лимфатический узел, а иногда даже в предлопаточный лимфатический узел. 1-3
Что касается кровоснабжения, то между краниальными и каудальными железами могут существовать венозные связи через краниальные и каудальные надчревные вены.
В ходе эстрального цикла, особенно у собак, наблюдается явное влияние на развитие и активность ткани молочной железы. Длительное время, в течение которого гормоны (особенно прогестерон) могут оказывать влияние, может привести к заметному увеличению объема, благодаря чему примерно через восемь-двенадцать недель после начала течки также может быть секреция.Это физиологическое явление, которое иногда вызывает проблемы у владельца, особенно с изменением поведения, которое происходит в то же время (псевдобеременность).
У кошек развитие молочной железы также стимулируется во время лютеиновой фазы, но, в отличие от собак, желтое тело развивается только после спаривания, независимо от того, является ли спаривание фертильным. Таким образом, у кошек увеличение молочных желез происходит только после спаривания. 4
Таким образом, у кошек увеличение молочных желез происходит только после спаривания. 4
Препараты с прогестиновым действием могут способствовать развитию и активности ткани молочной железы как у собак, так и у кошек.
Послеродовые подмышечные массы — фотовикторина
Am Fam Physician. 2000 1 мая; 61(9):2799-2800.
Случай 1: 23-летняя чернокожая женщина (вторая беременность, пара 2) поступила через две недели после родов с безболезненной опухолью левой подмышечной впадины. В ее истории болезни была отмечена серповидноклеточная анемия. Ее беременность протекала без особенностей, что привело к спонтанным вагинальным родам здорового ребенка. Ее непосредственное послеродовое течение было ничем не примечательным, и в настоящее время она кормила грудью.Она отрицала лихорадку. При физикальном обследовании в левой подмышечной впадине была отмечена подвижная безболезненная припухлость размером 3 × 4 см (см. рис. 1). Признаков местной, регионарной или системной инфекции не было.
Рисунок 1.
Случай 2: 22-летняя белая женщина (1 беременность, para 1) обратилась через три дня после самопроизвольных вагинальных родов с безболезненным отеком правой подмышечной впадины. У нее была ничем не примечательная история болезни, и ее дородовое течение было ничем не примечательным. Она отрицала какую-либо лихорадку или признаки системной инфекции.При физикальном обследовании в правой подмышечной впадине отмечена подвижная безболезненная припухлость размером 3 х 3 см (см. рис. 2). Небольшое количество мутной жидкости выделялось через центральную точку внутри опухоли.
Рисунок 2.
Вопрос
Учитывая анамнез и результаты медицинского осмотра каждой из этих женщин, какой из следующих диагнозов является правильным?
A. Добавочная ткань молочной железы.
B. Гидраденит гнойный.
C. Липома.
D.
Увеличенная киста сальной железы.
E. Подмышечная лимфаденопатия.
Обсуждение
Ответ A: добавочная ткань молочной железы. При структурных аномалиях или анатомических вариантах молочной железы наличие добавочного соска встречается чаще, чем наличие избыточной ткани молочной железы с ассоциированным сосково-ареолярным отростком или без него. Добавочная ткань молочной железы чаще встречается у женщин (от 2 до 6 процентов), чем у мужчин (1 процент).1 Заболеваемость также различается среди этнических групп; добавочная ткань молочной железы чаще встречается у азиатских женщин, чем у чернокожих или белых женщин.2
Гнойный гидраденит представляет собой инфекцию апокриновых желез, чаще всего подмышечных и паховых. Дренаж и рубцевание являются обычными последствиями, и процесс часто бывает двусторонним.
Липомы являются распространенными подкожными жировыми опухолями. Часто их трудно увидеть, но легко прощупать. Большинство из них протекают бессимптомно и при физикальном обследовании проявляются в виде эластичных подвижных образований, чаще всего на туловище, шее и верхних конечностях.
Сальные кисты реже обнаруживаются в подмышечных впадинах, чаще всего на волосистой части головы, лице и туловище. Часто видна центральная точка. Быстрый рост обычно связан с инфекцией и представляет собой воспаленную болезненную массу.
Подмышечная лимфаденопатия чаще всего сопровождает инфекционный процесс. Ни у одного из пациентов не было анамнеза, соответствующего инфекции. Большой размер этих образований также был бы необычным для аденопатии.
Эмбриологически развитие молочных желез происходит на четвертой и пятой неделе беременности в примитивных галактических полосах, простирающихся от подмышечной впадины до паха.По мере развития беременности галактическая полоса увеличивается, образуя грудной гребень, а остальная часть примитивной галактической полосы регрессирует. Если регресс неполный или остаточные клетки остаются вдоль молочной линии, существует вероятность образования дополнительных сосков и/или ткани молочной железы.3
Добавочные соски часто упускают из виду как родинки или невусы на передней грудной стенке. Пациенты с добавочной подмышечной тканью молочной железы часто предъявляют жалобы на боль или припухлость в вовлеченной подмышечной впадине.Подмышечная ткань молочной железы также может подвергаться ежемесячным предменструальным изменениям. Симптомы могут обостряться также во время беременности и кормления грудью.4
Пациенты с добавочной подмышечной тканью молочной железы часто предъявляют жалобы на боль или припухлость в вовлеченной подмышечной впадине.Подмышечная ткань молочной железы также может подвергаться ежемесячным предменструальным изменениям. Симптомы могут обостряться также во время беременности и кормления грудью.4
Клинически эктопическая ткань молочной железы имеет такое же количество доброкачественных и раковых изменений, что и нормальная ткань молочной железы, и ее следует лечить соответствующим образом. В то время как большинство пациентов можно лечить консервативно, хирургическое иссечение является вариантом для тех пациентов с постоянной болью или опухолью, или для тех, кто желает иссечения по косметическим причинам.
Abstract
Самки 129: Stat1-null мышей (129S6/SvEvTac- Stat1 tm1Rds гомозиготных) однозначно развиваются эстроген-рецептор (ER)-положительные опухоли молочной железы.Здесь мы сообщаем, что молочные железы (MG) этих мышей имеют измененный рост и развитие с аномальными конечными зачатками наряду с дефектным морфогенезом ветвления и удлинением протоков. Мы также обнаружили, что 129: Stat1-null жировая ткань молочной железы (MFP) не поддерживает рост эпителия 129S6/SvEv дикого типа и Stat1-null . Эти аномалии частично устраняются повышенным уровнем прогестерона и пролактина в сыворотке, тогда как трансплантация костного мозга дикого типа мышам 129: Stat1-null не устраняет дефекты развития MG.Среда, кондиционированная 129: Stat1-null очищенными от эпителия MFP, не стимулирует пролиферацию эпителия, тогда как она стимулируется средой, кондиционированной очищенными от эпителия MFP либо самок дикого типа, либо 129: Stat1-null самок с повышенным уровнем прогестерона и пролактин. Микрочипы и мультиплексные анализы цитокинов показывают, что MG мышей 129: Stat1-null имеет более низкие уровни факторов роста, которые участвуют в нормальном росте и развитии MG. Трансплантированные опухоли 129: Stat1-null и их изолированные клетки также растут медленнее в 129: Stat1-null MG по сравнению с реципиентным MG дикого типа.
Мы также обнаружили, что 129: Stat1-null жировая ткань молочной железы (MFP) не поддерживает рост эпителия 129S6/SvEv дикого типа и Stat1-null . Эти аномалии частично устраняются повышенным уровнем прогестерона и пролактина в сыворотке, тогда как трансплантация костного мозга дикого типа мышам 129: Stat1-null не устраняет дефекты развития MG.Среда, кондиционированная 129: Stat1-null очищенными от эпителия MFP, не стимулирует пролиферацию эпителия, тогда как она стимулируется средой, кондиционированной очищенными от эпителия MFP либо самок дикого типа, либо 129: Stat1-null самок с повышенным уровнем прогестерона и пролактин. Микрочипы и мультиплексные анализы цитокинов показывают, что MG мышей 129: Stat1-null имеет более низкие уровни факторов роста, которые участвуют в нормальном росте и развитии MG. Трансплантированные опухоли 129: Stat1-null и их изолированные клетки также растут медленнее в 129: Stat1-null MG по сравнению с реципиентным MG дикого типа. Эти исследования демонстрируют, что рост нормального и неопластического 129: Stat1-null эпителия зависит от гормональной среды и от факторов стромы молочной железы, таких как цитокины. Хотя индивидуальные или комбинированные эффекты этих факторов еще предстоит выяснить, наши данные подтверждают роль STAT1 в поддержании подавляющего опухоль микроокружения MG.
Эти исследования демонстрируют, что рост нормального и неопластического 129: Stat1-null эпителия зависит от гормональной среды и от факторов стромы молочной железы, таких как цитокины. Хотя индивидуальные или комбинированные эффекты этих факторов еще предстоит выяснить, наши данные подтверждают роль STAT1 в поддержании подавляющего опухоль микроокружения MG.
Образец цитирования: Chen JQ, Mori H, Cardiff RD, Trott JF, Hovey RC, Hubbard NE, et al. (2015) Аномальное развитие молочных желез у мышей 129: STAT1-Null зависит от стромы.ПЛОС ОДИН 10(6): e0129895. https://doi.org/10.1371/journal.pone.0129895
Академический редактор: Tiffany Seagroves, Центр медицинских наук Университета Теннесси, США
Получено: 3 октября 2014 г.; Принято: 14 мая 2015 г.; Опубликовано: 15 июня 2015 г.
Авторские права: © 2015 Chen et al. Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Регистрационный номер NCBI GEO GSE63025 (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?token=wxgrwsogvpkpnuz&acc=GSE63025).
Финансирование: Это исследование было поддержано грантами U01 CA141541 и U01 CA141582 (RC, AB, RS) от Консорциума мышиных моделей рака человека Национального института рака и гранта W81XWH-10-1- Программы медицинских исследований под руководством Конгресса. 0855 (правый и радиоуправляемый). Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Микроокружение стромы молочной железы (МГ) представляет собой сложную смесь клеток, тканей и молекул, необходимую для нормального роста и развития железистого эпителия [1–3]. Развитие МГ также стимулируется гормонами, воздействующими на эпителий и окружающую строму [4, 5]. Путь Janus Kinase (JAK)-Signal Transducer and Activator of Transcription (STAT) играет центральную роль в этом развитии как первичный промежуточный продукт для индуцированной факторами роста, цитокинами и гормонами передачи сигналов [6, 7].Среди различных молекул STAT STAT5a и STAT5b играют центральную роль в развитии MG и лактации [8, 9]. Напротив, эпителиальный STAT3 играет решающую роль во время инволюции [10], в то время как STAT6 участвует в индуцированном гестацией росте MG [11]. С другой стороны, STAT1, по-видимому, функционирует только в MG нерожавших и постлактационных самок мышей [6].
Развитие МГ также стимулируется гормонами, воздействующими на эпителий и окружающую строму [4, 5]. Путь Janus Kinase (JAK)-Signal Transducer and Activator of Transcription (STAT) играет центральную роль в этом развитии как первичный промежуточный продукт для индуцированной факторами роста, цитокинами и гормонами передачи сигналов [6, 7].Среди различных молекул STAT STAT5a и STAT5b играют центральную роль в развитии MG и лактации [8, 9]. Напротив, эпителиальный STAT3 играет решающую роль во время инволюции [10], в то время как STAT6 участвует в индуцированном гестацией росте MG [11]. С другой стороны, STAT1, по-видимому, функционирует только в MG нерожавших и постлактационных самок мышей [6].
Функциональный анализ STAT3, STAT5 и STAT6 в MG был проведен на ряде моделей генетически модифицированных мышей [6].Хотя было разработано несколько моделей функции STAT1, они были сосредоточены в первую очередь на передаче и транскрипции сигнала интерферона-γ (IFNγ). Исследования развития MG у мышей в отсутствие STAT1, либо посредством нокаута зародышевой линии [12], либо соматического нокаута, обусловленного эпителием молочных желез [13], не выявили аномалий ветвления или удлинения протоков. Однако эти исследования не рассматривали онтогенез развития МГ, лактацию и инволюцию. Кроме того, конечные точки развития не были основной целью тех анализов, которые были сосредоточены на онкогенезе [6].
Однако эти исследования не рассматривали онтогенез развития МГ, лактацию и инволюцию. Кроме того, конечные точки развития не были основной целью тех анализов, которые были сосредоточены на онкогенезе [6].
Исследования онкогенеза молочной железы у самок мышей с нокаутом Stat1 ( Stat1-null ) описывают потенциальную роль STAT1 в качестве супрессора опухолей. Действительно, четыре отдельные группы показали, что мыши Stat1-null имеют повышенную восприимчивость к опухолям молочных желез в различных контекстах [12-15]. Две лаборатории использовали мышей C.129S6(Cg)- Stat1 tm1Dlv , несущих нулевой аллель Stat1 , подвергнутых обратному скрещиванию со штаммом Balb/c, чтобы продемонстрировать, что STAT1 действует как супрессор опухоли молочной железы [15, 16].В этих исследованиях образование опухолей индуцировали либо дополнительным онкогеном, либо повторным скрещиванием [15, 16]. Кловер и др. разработали целевой нокаут эпителия молочной железы Stat1 , который они скрестили с FVB:cNeu, чтобы продемонстрировать супрессию внутренней опухоли эпителиальных клеток с помощью STAT1 [13].
Гомозиготные самки мышей 129S6/SvEvTac- Stat1 tm1Rds , использованные в настоящем документе (129: Stat1-null в дальнейшем) [17], спонтанно развивают отличительные сублюминальные опухоли молочной железы человека, позитивные по эстрогеновому рецептору (ER). рак молочной железы [12].Эти спонтанные опухоли возникают поздно (латентность в возрасте 18–20 месяцев), пенетрантны примерно на 50% и имеют постоянный и уникальный фенотип, отличающийся от гистопатологических паттернов, наблюдаемых в других моделях нокаута опухолевых супрессоров [18]. Потенциальный механизм наблюдаемого повышенного риска карциномы MG может быть связан с изменениями основного MG во время развития и старения. Мы предположили, что MG этих мышей претерпевает измененное развитие, которое отражает измененное микроокружение стромы. С этой целью мы инициировали тщательное исследование развития MG и вклада стромального микроокружения у 129: Stat1-null самок.Экспериментальная диссекция и рекомбинация различных элементов MG и жирового тела молочной железы (MFP) продемонстрировали сильное влияние среды хозяина и менее выраженный эпителиальный дефект в морфогенезе ветвления. Потеря STAT1 влияла как на системные, так и на местные факторы хозяина, которые способствовали эпителиальным аномалиям.
Потеря STAT1 влияла как на системные, так и на местные факторы хозяина, которые способствовали эпителиальным аномалиям.
Учитывая, что многие мышиные модели онкогенеза молочных желез обнаруживают аномальное развитие MG в раннем возрасте [19], результаты этого исследования дают ключ к пониманию роли генов-кандидатов во время опухолевой прогрессии [19, 20].
Материалы и методы
Модель мыши
129S6/SvEvTac- Stat1 tm1Rds (129: Stat1-null ) мыши [17, 21, 22] были предоставлены лабораторией Шрайбера (RDS), а дикий тип (WT) 1 (129SvEv WT) мышей приобретали у Taconic Farms (Hudson, NY). Все операции проводились под нембуталовым наркозом (60 мг/кг) с последующей послеоперационной анальгезией (бупринекс; 0,05 мг/кг). Всех мышей подвергали эвтаназии с использованием передозировки нембутала (120 мг/кг) перед сбором и фиксацией тканей.
Гистопатология и подготовка цельного препарата
Ткани фиксировали в 10% нейтральном забуференном формалине при комнатной температуре в течение 24 часов, затем помещали в 70% этанол до обработки, которая обычно не превышает 24 часов. Автопроцессор Tissue-Tek VIP (Sakura, Torrance, CA) использовали для обработки тканей, которые затем заливали в Paraplast (температура плавления 56–60°C), делали срезы размером 4 мкм и помещали на предметные стекла. Срезы окрашивали гематоксилином и эозином (H&E) для патологического анализа.Для приготовления цельного препарата MG MFP препарировали, помещали на предметное стекло и фиксировали в 10% нейтральном забуференном формалине. Далее ткани обрабатывали в кассете для тканей, начиная с 70% спирта в течение 2 часов, затем переносили в 100% спирт еще на 2 часа. Затем железы обезжиривали, используя три смены ксилола (30 мин, 1 ч, 1 ч), а затем повторно гидратировали с помощью спирта в определенной последовательности. После промывания в проточной водопроводной воде в течение 30 мин ткани окрашивали гематоксилином в течение 2 мин. Железы обесцвечивали 1% раствором HCl в течение 15 минут, затем помещали под проточную водопроводную воду примерно на 30 минут, 70% спирт на 1 час, 100% спирт на 1 час и, наконец, ксилол на 1 час.
Автопроцессор Tissue-Tek VIP (Sakura, Torrance, CA) использовали для обработки тканей, которые затем заливали в Paraplast (температура плавления 56–60°C), делали срезы размером 4 мкм и помещали на предметные стекла. Срезы окрашивали гематоксилином и эозином (H&E) для патологического анализа.Для приготовления цельного препарата MG MFP препарировали, помещали на предметное стекло и фиксировали в 10% нейтральном забуференном формалине. Далее ткани обрабатывали в кассете для тканей, начиная с 70% спирта в течение 2 часов, затем переносили в 100% спирт еще на 2 часа. Затем железы обезжиривали, используя три смены ксилола (30 мин, 1 ч, 1 ч), а затем повторно гидратировали с помощью спирта в определенной последовательности. После промывания в проточной водопроводной воде в течение 30 мин ткани окрашивали гематоксилином в течение 2 мин. Железы обесцвечивали 1% раствором HCl в течение 15 минут, затем помещали под проточную водопроводную воду примерно на 30 минут, 70% спирт на 1 час, 100% спирт на 1 час и, наконец, ксилол на 1 час.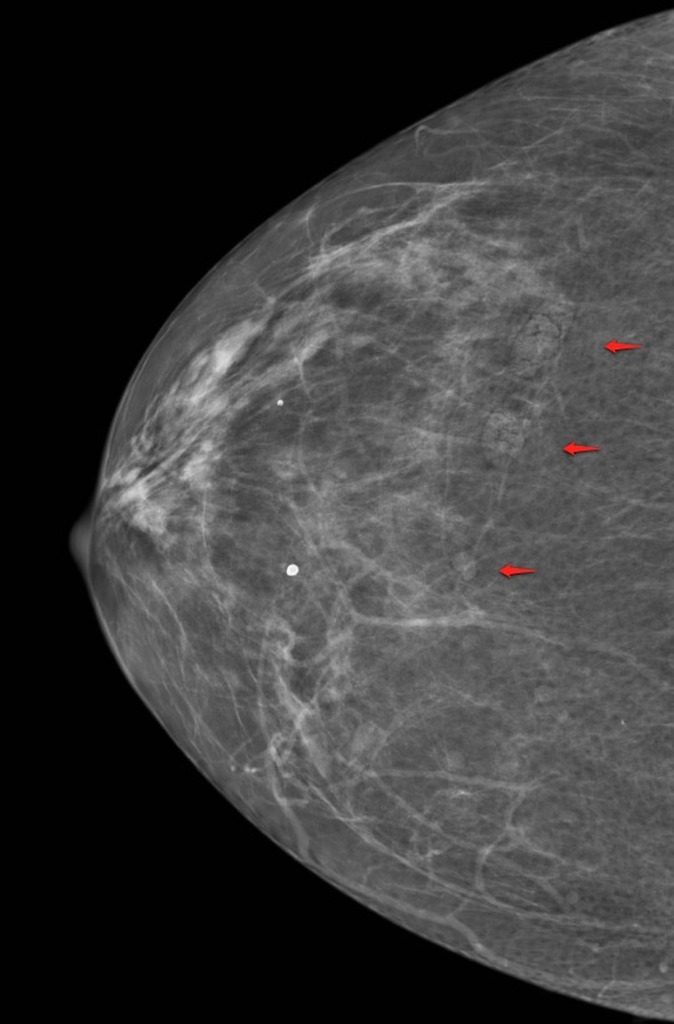 Затем целые препараты погружали в метилсалицилат для хранения.
Затем целые препараты погружали в метилсалицилат для хранения.
Морфологические анализы
Структурные различия в концевых зачатках (TEB) были визуализированы с использованием описанного ранее метода визуализации на основе лазерного сканирования [23]. Вкратце, МГ из 129 WT и 129: Stat1-null наносили на предметные стекла, фиксировали 4% параформальдегидом в фосфатно-солевом буфере (PBS) в течение 15 минут, а затем дополнительно фиксировали в течение ночи в растворе Карнуа (75% этанол, 25 мин). % уксусная кислота).Ткани окрашивали раствором карминовых квасцов в течение ночи с последующим обесцвечиванием кислым EtOH (70% EtOH, 0,6 М HCl) в течение ~ 2 ч, пока целые препараты не показали хороший контраст. Целые препараты обезвоживали (каждое по 30 минут для 80%, 90%, 95% и 100% EtOH) и обезжиривали в ксилоле в течение ночи перед заливкой с помощью Permount (Electron Microscopy Sciences). Чтобы получить трехмерное изображение TEB, целые препараты оценивали с помощью лазерного сканирования аутофлуоресценции / флуоресцентной визуализации тканей (LS-TAFI) с LSM 710 (Carl Zeiss Microscopy, Ltd), настроенным на «главный дихроичный светоделитель» (MBS).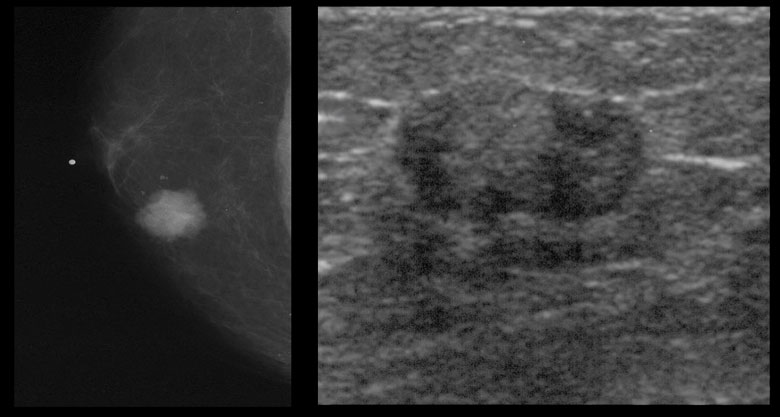 ; 488/561 нм) и «диапазон обнаружения» (от 495 до 553 нм для МБС 488 нм; от 568 до 728 нм для МБС 561 нм).Отсканированные изображения были проанализированы с помощью IMARIS (Bitplane, South Windsor, CT) для количественного определения каждого параметра, указанного на рис. 1. Общая длина протока и точки ветвления были измерены на изображениях цельных препаратов MG, окрашенных либо гематоксилином, либо кармином. Для измерения общей длины воздуховода изображения в оттенках серого были инвертированы и проанализированы с помощью программного обеспечения для обработки изображений IMARIS (Bitplane) с использованием функции отслеживания нити.
; 488/561 нм) и «диапазон обнаружения» (от 495 до 553 нм для МБС 488 нм; от 568 до 728 нм для МБС 561 нм).Отсканированные изображения были проанализированы с помощью IMARIS (Bitplane, South Windsor, CT) для количественного определения каждого параметра, указанного на рис. 1. Общая длина протока и точки ветвления были измерены на изображениях цельных препаратов MG, окрашенных либо гематоксилином, либо кармином. Для измерения общей длины воздуховода изображения в оттенках серого были инвертированы и проанализированы с помощью программного обеспечения для обработки изображений IMARIS (Bitplane) с использованием функции отслеживания нити.
Рис. 1. Шесть недель 129: Stat1-null молочные железы имеют больше и больше TEB.
Окрашенные гематоксилином цельные изображения паховых молочных желез 6-недельных мышей 129SvEv WT и 129: Stat1-null ( Stat1-null ) (A).Вставки иллюстрируют изменения в TEB между 129SvEv WT и Stat1-нулевыми мышами . Масштабная линейка 2 мм. Трехмерная визуализация TEB из цельного препарата MG 6-недельных мышей 129SvEv WT и 129: Stat1-null с использованием автофлуоресценции с лазерной сканирующей конфокальной микроскопией (B). Показаны трехмерные изображения поверхности (Ba, Bb) и ортогональные сечения плоскостей XY, XZ и YZ (Bc, Bd). Панели слева (Ba, Bc) от 129SvEv WT MG, а справа (Bb, Bd) от 129: Stat1-null .Красный сигнал (ядра; кармин) и зеленый сигнал (клетка; аутофлуоресценция) указаны на изображениях. Шкала бара составляет 50 мкм. На схеме (Be) указаны точки измерения для сравнения параметров на трехмерных изображениях ТЭБ. Самый широкий диаметр ТЭБ равен X (длина головки ТЭБ). Толщина ТЭБ на кончике равна Y (толщина слоя клеток тела). X’ (длина шейки ТЭБ) измерялась в точке, равной 2xY от кончика (Bf). ТЭБ определяли количественно, когда X > 100 мкм. Все данные являются средними ± SEM (n = 5). * Р = 0,0128. 129: Stat1-null железы TEB (KO) больше по размеру, измеренному по толщине слоя тела (Bg, **P = 0.
Трехмерная визуализация TEB из цельного препарата MG 6-недельных мышей 129SvEv WT и 129: Stat1-null с использованием автофлуоресценции с лазерной сканирующей конфокальной микроскопией (B). Показаны трехмерные изображения поверхности (Ba, Bb) и ортогональные сечения плоскостей XY, XZ и YZ (Bc, Bd). Панели слева (Ba, Bc) от 129SvEv WT MG, а справа (Bb, Bd) от 129: Stat1-null .Красный сигнал (ядра; кармин) и зеленый сигнал (клетка; аутофлуоресценция) указаны на изображениях. Шкала бара составляет 50 мкм. На схеме (Be) указаны точки измерения для сравнения параметров на трехмерных изображениях ТЭБ. Самый широкий диаметр ТЭБ равен X (длина головки ТЭБ). Толщина ТЭБ на кончике равна Y (толщина слоя клеток тела). X’ (длина шейки ТЭБ) измерялась в точке, равной 2xY от кончика (Bf). ТЭБ определяли количественно, когда X > 100 мкм. Все данные являются средними ± SEM (n = 5). * Р = 0,0128. 129: Stat1-null железы TEB (KO) больше по размеру, измеренному по толщине слоя тела (Bg, **P = 0. 0058) размер головы (h, **P = 0,0025) и размер шеи (I, **P = 0,0050). n = 8. Однако различия в отношении (X/X’) недостоверны (Bj).
0058) размер головы (h, **P = 0,0025) и размер шеи (I, **P = 0,0050). n = 8. Однако различия в отношении (X/X’) недостоверны (Bj).
https://doi.org/10.1371/journal.pone.0129895.g001
Анализ микрочипов
Анализ микрочипов (инвентарный номер GSE63025) соответствует 6 критическим элементам минимальной информации об эксперименте с микрочипами (http://www.mged.org/Workgroups/MIAME/miame.html). Тотальную клеточную РНК выделяли из быстрозамороженных MG с использованием реагента TRIzol (Life Technologies) и модифицированного протокола, который включает вторую экстракцию кислым фенолом/хлороформом/изоамиловым спиртом (25:24:1, pH 4.3). Общее количество и качество РНК оценивали на спектрофотометре NanoDrop (Thermo Scientific, Waltham, MA) и биоанализаторе Agilent 2100 (Agilent Technologies, Санта-Клара, Калифорния) соответственно. Профилирование экспрессии генов на микрочипах (в общем ресурсе геномики Комплексного онкологического центра Калифорнийского университета в Дэвисе) выполняли путем анализа всего транскрипта на массивах Affymetrix GeneChip Mouse Gene 1. 0 Sense Target (ST), которые охватывают в общей сложности 26 166 транскриптов RefSeq из 21 041 отдельного гена. .Вкратце, биотинилированные мишени смысловой цепи ДНК получали из 100 нг тотальной РНК с использованием наборов для мечения терминалов Ambion WT Expression и Affymetrix GeneChip WT в соответствии с протоколами производителей. Все последующие процедуры обработки микрочипов, включая гибридизацию, промывку, окрашивание и сканирование массивов, выполнялись в соответствии со стандартными протоколами Affymetrix. Анализ данных микрочипов выполняли с помощью программного обеспечения GeneSpring GX (Agilent Technologies). Значения интенсивности зонда микрочипа (файлы CEL) были скорректированы по фону, суммированы и нормализованы с использованием алгоритма Robust Multi-array Average (RMA16) [24] и отфильтрованы по необработанным значениям интенсивности для наборов зондов, которые превышают пороговое значение> 38.Был проведен сравнительный анализ для выявления генов, которые по-разному экспрессировались (≥1,5 раза) между паховыми MFP мышей 129: Stat1-null и 129SvEv WT.
0 Sense Target (ST), которые охватывают в общей сложности 26 166 транскриптов RefSeq из 21 041 отдельного гена. .Вкратце, биотинилированные мишени смысловой цепи ДНК получали из 100 нг тотальной РНК с использованием наборов для мечения терминалов Ambion WT Expression и Affymetrix GeneChip WT в соответствии с протоколами производителей. Все последующие процедуры обработки микрочипов, включая гибридизацию, промывку, окрашивание и сканирование массивов, выполнялись в соответствии со стандартными протоколами Affymetrix. Анализ данных микрочипов выполняли с помощью программного обеспечения GeneSpring GX (Agilent Technologies). Значения интенсивности зонда микрочипа (файлы CEL) были скорректированы по фону, суммированы и нормализованы с использованием алгоритма Robust Multi-array Average (RMA16) [24] и отфильтрованы по необработанным значениям интенсивности для наборов зондов, которые превышают пороговое значение> 38.Был проведен сравнительный анализ для выявления генов, которые по-разному экспрессировались (≥1,5 раза) между паховыми MFP мышей 129: Stat1-null и 129SvEv WT.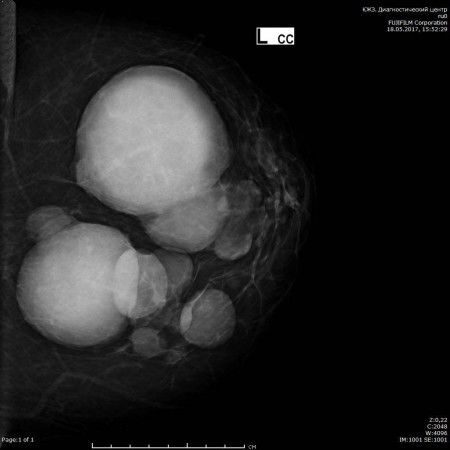 Биологическая интерпретация полученного списка генов была выполнена с использованием инструментов функциональной аннотации и кластеризации, доступных в Базе данных для аннотации, визуализации и комплексного обнаружения (DAVID) Bioinformatics Resources 6.7 [25]. Вкратце, они определяют функциональные отношения между генами с каппа-статистикой [26], новым алгоритмом агломерации для организации их в биологические модули, а затем для расчета показателей обогащения на основе точного теста Фишера [25].
Биологическая интерпретация полученного списка генов была выполнена с использованием инструментов функциональной аннотации и кластеризации, доступных в Базе данных для аннотации, визуализации и комплексного обнаружения (DAVID) Bioinformatics Resources 6.7 [25]. Вкратце, они определяют функциональные отношения между генами с каппа-статистикой [26], новым алгоритмом агломерации для организации их в биологические модули, а затем для расчета показателей обогащения на основе точного теста Фишера [25].
Тепловая карта
Тепловая карта была выполнена с помощью Heat map Builder [27]. 50 генов с 2-кратной разницей в экспрессии, которые были либо «высокие в 129SvEv WT», либо «высокие в Stat1-null », как было измерено с помощью микрочипа, были нанесены на карту и отмечены цветом с диапазонами, указанными на рисунке. Профиль белков цитокинов также подвергали тепловой карте для сравнения уровней каждого цитокина.
Трансплантация эпителиальной ткани молочной железы
Чтобы обеспечить места для трансплантации хозяина, паховые MFP трехнедельных мышей 129SvEv WT и самок мышей 129: Stat1-null были «очищены» от эпителиальной ткани, как описано [28]. Эксплантаты эпителий-содержащих МГ (кусочки 1–2 мм) от донорских мышей 129SvEv WT или 129: Stat1-null вырезали из паховой МГ (между соском и лимфатическим узлом) и трансплантировали в очищенные от эпителия жировые тела молочных желез. (ECFP) мышей-хозяев (левый ECFP получил ткань 129: Stat1 -null, а правый ECFP получил ткань 129SvEv WT).
Эксплантаты эпителий-содержащих МГ (кусочки 1–2 мм) от донорских мышей 129SvEv WT или 129: Stat1-null вырезали из паховой МГ (между соском и лимфатическим узлом) и трансплантировали в очищенные от эпителия жировые тела молочных желез. (ECFP) мышей-хозяев (левый ECFP получил ткань 129: Stat1 -null, а правый ECFP получил ткань 129SvEv WT).
Гормональное лечение
Мышам ежедневно вводили подкожно прогестерон (P, 0,5 мг, Acros Organics, Нью-Джерси) и/или домперидон (DOM, 1.0 мг/кг, Sigma Chemical Co, Сент-Луис, Миссури; для индукции гиперпролактинемии) или эстроген (Э, 1 мкг, 17β-эстрадиол, Sigma) в течение 14 дней. И P, и E суспендировали в стерильном кунжутном масле, а DOM растворяли в стерильном солевом растворе (pH 3,0). Контрольным животным вводили кунжутное масло и физиологический раствор. Все животные получали одинаковое количество кунжутного масла и физиологического раствора каждые 24 часа в течение 14 дней.
Пересадка костного мозга
Трехнедельных мышей-реципиентов (129SvEv WT или 129: Stat1-null ) облучали дозой 1000 рад в облучателе компонентов крови модели 143–68 (J. Л. Шепард, Сан-Фернандо, Калифорния). Костный мозг собирали из рассеченных бедренных и большеберцовых костей необлученных мышей-доноров, которым вводили летальную дозу нембутала (120 мг/кг). Костный мозг помещали в культуральные пробирки объемом 14 мл, содержащие 5 мл сбалансированного солевого раствора Хенкса (HBSS) на льду, с использованием иглы 18 калибра и шприца объемом 3 мл. Сырой костный мозг центрифугировали, затем ресуспендировали в 1 мл лизирующего буфера ACK (хлорид аммония-калия) (Gibco, Гранд-Айленд, Нью-Йорк) в течение ~ 1 мин. Образцы одного и того же генотипа донора (129SvEv WT или 129: Stat1-null ) объединяли, ресуспендировали в 3 мл HBSS и фильтровали через фильтр 35 мкм (BD Biosciences, Сан-Хосе, Калифорния).Жизнеспособные клетки подсчитывали с помощью окраски трипановым синим. Клетки костного мозга ресуспендировали в стерильном PBS (2×10 6 клеток/100 мкл) для инъекций облученным реципиентам. Реципиентам вводили через хвостовую вену 200 мкл препарата костного мозга от мышей WT или 129: Stat1-null .
Л. Шепард, Сан-Фернандо, Калифорния). Костный мозг собирали из рассеченных бедренных и большеберцовых костей необлученных мышей-доноров, которым вводили летальную дозу нембутала (120 мг/кг). Костный мозг помещали в культуральные пробирки объемом 14 мл, содержащие 5 мл сбалансированного солевого раствора Хенкса (HBSS) на льду, с использованием иглы 18 калибра и шприца объемом 3 мл. Сырой костный мозг центрифугировали, затем ресуспендировали в 1 мл лизирующего буфера ACK (хлорид аммония-калия) (Gibco, Гранд-Айленд, Нью-Йорк) в течение ~ 1 мин. Образцы одного и того же генотипа донора (129SvEv WT или 129: Stat1-null ) объединяли, ресуспендировали в 3 мл HBSS и фильтровали через фильтр 35 мкм (BD Biosciences, Сан-Хосе, Калифорния).Жизнеспособные клетки подсчитывали с помощью окраски трипановым синим. Клетки костного мозга ресуспендировали в стерильном PBS (2×10 6 клеток/100 мкл) для инъекций облученным реципиентам. Реципиентам вводили через хвостовую вену 200 мкл препарата костного мозга от мышей WT или 129: Stat1-null . После инъекции мышам-реципиентам давали Сульфатрим перорально в активной дозе от 8 до 24 мг/кг/сут в течение 10 дней. Эрадикация костного мозга и «забор» были задокументированы с помощью количественной ПЦР гДНК (подробности о материалах и методах см. в тексте S1) из периферической крови, которая показала, что у всех выживших животных было полное приживление донорского мозга без остаточного костного мозга хозяина (данные не показаны). .
После инъекции мышам-реципиентам давали Сульфатрим перорально в активной дозе от 8 до 24 мг/кг/сут в течение 10 дней. Эрадикация костного мозга и «забор» были задокументированы с помощью количественной ПЦР гДНК (подробности о материалах и методах см. в тексте S1) из периферической крови, которая показала, что у всех выживших животных было полное приживление донорского мозга без остаточного костного мозга хозяина (данные не показаны). .
Иммуногистохимия (ИГХ)
Извлечение антигена выполняли в течение 45 минут с использованием цитратного буфера при pH 6,0 в камере для снятия маскировки (Biocare Medical, Concord, CA) при 125°C и 15 фунтов на кв. дюйм. Предметные стекла блокировали нормальной козьей сывороткой, затем инкубировали с кроличьим моноклональным анти-CD3 (1:1000; клон [Sp7], каталожный номер Ab16669, номер партии GR125527-1, Abcam, Кембридж, Массачусетс) в течение ночи при комнатной температуре во влажной камере. , а затем биотинилированные козьи антикроличьи вторичные антитела (1:1000). Набор Vectatain ABC Kit Elite Kit и набор субстрата диаминобензидин-пероксидазы (Vector Labs, Burlingame, CA) использовали для амплификации и визуализации сигнала соответственно. Селезенка и тимус мыши использовались в качестве положительных контролей для окрашивания CD3.
Набор Vectatain ABC Kit Elite Kit и набор субстрата диаминобензидин-пероксидазы (Vector Labs, Burlingame, CA) использовали для амплификации и визуализации сигнала соответственно. Селезенка и тимус мыши использовались в качестве положительных контролей для окрашивания CD3.
Биопсия опухоли и трансплантация клеток
Для изучения роста опухоли биопсии (кусочки 1–2 мм) первичных опухолей от 129: мышей Stat1-null были трансплантированы в интактную паховую MG 6–8-недельных мышей 129SvEv WT или 129: Stat1-null мышей. .После трансплантации мышей пальпировали два раза в неделю для наблюдения за появлением опухоли. Для трансплантации линии клеток опухоли молочной железы 129: Stat1-null использовали клетки SSM2 [12] (далее обозначаемые как SSM2 UCD ). Клетки SSM2 UCD выращивали в соответствующих культуральных средах с добавлением 10% эмбриональной бычьей сыворотки [12]. Почти конфлюэнтные (80%) культуры трипсинизировали, промывали 3 раза PBS и подсчитывали.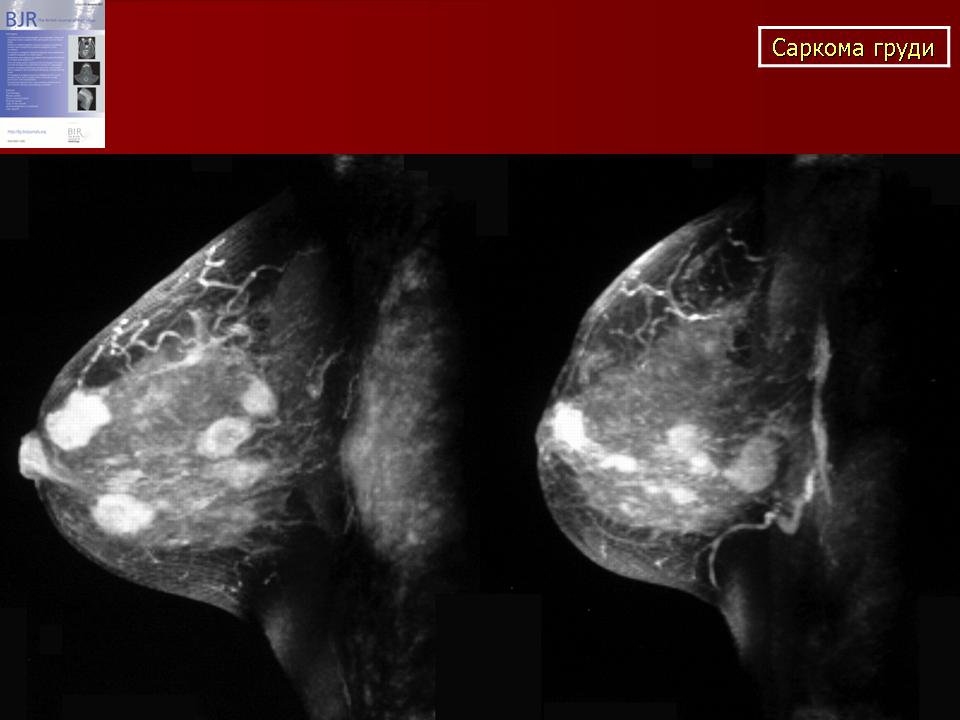 Клетки хранили в жидком азоте до использования и имели относительно небольшое количество пассажей (12–27).Болюс ранее культивированных клеток (3 x 10 4 ) вводили в неочищенную паховую MG 6-8-недельных мышей 129SvEv WT или 129: Stat1-null . Через две недели после инъекции опухоли удаляли и обрабатывали для гистологии и ИГХ.
Клетки хранили в жидком азоте до использования и имели относительно небольшое количество пассажей (12–27).Болюс ранее культивированных клеток (3 x 10 4 ) вводили в неочищенную паховую MG 6-8-недельных мышей 129SvEv WT или 129: Stat1-null . Через две недели после инъекции опухоли удаляли и обрабатывали для гистологии и ИГХ.
Приготовление кондиционированной среды
129SvEv WT и 129: Stat1-null паховые MG были очищены в возрасте 3 недель, как описано выше. В возрасте 10 недель кондиционированную среду (CM) готовили из ECFP этих мышей, разрезая их на фрагменты (~8 мм 3 ) и инкубируя их в бессывороточной среде Игла, модифицированной Дульбекко (DMEM) (7.5 мг ткани/мл) в течение 48 ч при 37°C. Базальную среду готовили путем инкубации бессывороточной среды DMEM в течение 48 ч при 37°C в отсутствие ECFP. И СМ, и базальную среду впоследствии фильтровали (0,22 мкм) и либо сразу использовали в экспериментах, либо хранили при -20°С. Некоторое количество CM и базальной среды концентрировали с использованием центрифужных фильтров (Amicon ultra, Millipore, Billerica, MA) для экспериментов по анализу цитокинов/хемокинов на мышах или для хранения при -80°C.
Некоторое количество CM и базальной среды концентрировали с использованием центрифужных фильтров (Amicon ultra, Millipore, Billerica, MA) для экспериментов по анализу цитокинов/хемокинов на мышах или для хранения при -80°C.
клеток Comma-1D поддерживали в питательной среде (DMEM/F12, 2% фетальной бычьей сыворотки, 10 мкг/мл бычьего инсулина, 5 нг/мл рекомбинантного эпидермального фактора роста человека, пенициллин/стрептомицин).Клетки (3000/лунку) высевали в 96-луночные планшеты за 24 ч до начала анализа роста (день 0). Стандартную кривую строили путем посева известных количеств клеток (0–50 000 на лунку) перед количественным определением конечного количества клеток в день 0 с использованием анализа с метиленовым синим [29]. После промывки PBS среду меняли на базальную среду или CM в день 0, с другой заменой среды на день 2. Затем клетки фиксировали в 10% формалине, окрашивали в течение 35 мин 1% метиленовым синим, промывали 0,01 М боратом. буфер (pH 8.5), а синюю окраску элюировали из клеток смесью 1:1 95% этанола и 0,1 М HCl. Планшеты считывали при 665 нм. Пустые лунки не содержали клеток, но подвергались полному процессу фиксации и окрашивания, и их среднее поглощение вычиталось из всех лунок.
Планшеты считывали при 665 нм. Пустые лунки не содержали клеток, но подвергались полному процессу фиксации и окрашивания, и их среднее поглощение вычиталось из всех лунок.
Мультиплексный анализ цитокинов/хемокинов
Набор Milliplex MAP 32-analyte для анализа мышиных цитокинов/хемокинов (EMD Millipore) использовали для одновременного измерения 32 цитокинов и хемокинов в каждом образце.Система MAP основана на уникальных популяциях из 100 различных, индивидуально идентифицируемых наборов микробусин, соединенных с антителом, специфичным к цитокину или хемокину, которое захватывает соответствующий аналит в образце до обнаружения с использованием второго биотинилированного антитела, специфичного к каждому соответствующему аналиту [30]. ]. Мультиплексные анализы проводились в соответствии с инструкциями производителя. Данные для каждого из аналитов собирали в виде средней интенсивности флуоресценции (MFI), которую использовали для расчета концентраций аналита в пг/мл с использованием пакета программного обеспечения BioPlex Manager 5. 0 (Bio-Rad), как описано ранее [31].
0 (Bio-Rad), как описано ранее [31].
Статистический анализ
Попарные сравнения между средними значениями или средними наименьшими квадратами были проанализированы с помощью t-критерия Стьюдента. Средние параметры длины протока и точек разветвления статистически сравнивали с использованием программного обеспечения GraphPad Prism (GraphPad Software, Inc., Ла-Хойя, Калифорния). Для исследований пролиферации клеток COMMA 1D статистическую значимость проверяли с помощью двухстороннего дисперсионного анализа.
Заявление об этике
Мыши содержались и содержались в животноводческом комплексе Калифорнийского университета в Дэвисе, и с ними обращались в строгом соответствии с рекомендациями, описанными Международной ассоциацией по оценке и аккредитации по уходу за лабораторными животными и Институциональным комитетом по уходу и использованию животных Калифорнийского университета в Дэвисе, одобренным протоколом. (протокол № 17604 и 16642).
Результаты
129:
Stat1-null Мыши демонстрируют аномальный рост и развитие молочной железы 129: Stat1-null самки способны выкармливать детенышей, которые хорошо развиваются и имеют нормальный вид молока в своих непрозрачных желудках. Целые препараты MG от беременных и кормящих самок были в целом нормальными, тогда как MG от послеродовых самок не имели очевидных структурных аномалий или аномалий развития (S1 Fig). Напротив, нерожавшие мыши 129: Stat1-null имели задержку и аномальный рост и развитие MG по сравнению с мышами 129SvEv WT.Полные препараты MG от 129: Stat1-нулевых мышей в возрасте 6 недель имели более крупные и обильные TEB, чем 129SvEv WT (рис. 1A), и демонстрировали большую вариабельность удлинения протоков, в диапазоне от довольно низкорослых (не показано) до нормальное удлинение (рис. 1А). LS-TAFI [23] показал, что область шеи TEB от 129: Stat1-нулевых мышей была окружена протяженной зоной дезорганизованных мелких стромальных клеток, которые отсутствовали вблизи TEB от мышей 129SvEv WT (рис. 1B). .Количественный анализ трехмерных реконструкций подтвердил, что TEB у мышей 129: Stat1-null были более многочисленными (рис. 1B и 1F) и крупнее, чем у мышей 129SvEv WT, и имели более длинные области шеи (рис.
Целые препараты MG от беременных и кормящих самок были в целом нормальными, тогда как MG от послеродовых самок не имели очевидных структурных аномалий или аномалий развития (S1 Fig). Напротив, нерожавшие мыши 129: Stat1-null имели задержку и аномальный рост и развитие MG по сравнению с мышами 129SvEv WT.Полные препараты MG от 129: Stat1-нулевых мышей в возрасте 6 недель имели более крупные и обильные TEB, чем 129SvEv WT (рис. 1A), и демонстрировали большую вариабельность удлинения протоков, в диапазоне от довольно низкорослых (не показано) до нормальное удлинение (рис. 1А). LS-TAFI [23] показал, что область шеи TEB от 129: Stat1-нулевых мышей была окружена протяженной зоной дезорганизованных мелких стромальных клеток, которые отсутствовали вблизи TEB от мышей 129SvEv WT (рис. 1B). .Количественный анализ трехмерных реконструкций подтвердил, что TEB у мышей 129: Stat1-null были более многочисленными (рис. 1B и 1F) и крупнее, чем у мышей 129SvEv WT, и имели более длинные области шеи (рис. 1B, 1G, 1H и 1I). .
1B, 1G, 1H и 1I). .
В цельных препаратах молочной железы мышей в возрасте 12 недель было замечено, что все 129: Stat1-null MG расширялись до своих нативных MFP, но, по-видимому, отставали от таковых у своих собратьев 129SvEv WT и редко достигали конца жировая прослойка (S2 рис.).MG 129SvEv WT, по-видимому, имеет более высокую плотность отростков протоков и большее количество ветвлений, чем MG 129: Stat1-null (рис. 2A), и поэтому мы проверили эту гипотезу с помощью количественного анализа изображений. Это выявило более короткую общую длину сети протоков у 129: Stat1-null MG (P = 0,0003), но не было существенных различий в частоте точек ветвления в развивающихся 129SvEv WT и 129: Stat1-null MG ( рис. 2В и 1С).
Рис. 2. 129: Stat1-null имеют уменьшенную длину протока.
Сравнение желез 129SvEv WT и 129: Stat1-null ( Stat1-null ) показало, что железы Stat1-null имели меньшее удлинение протоков.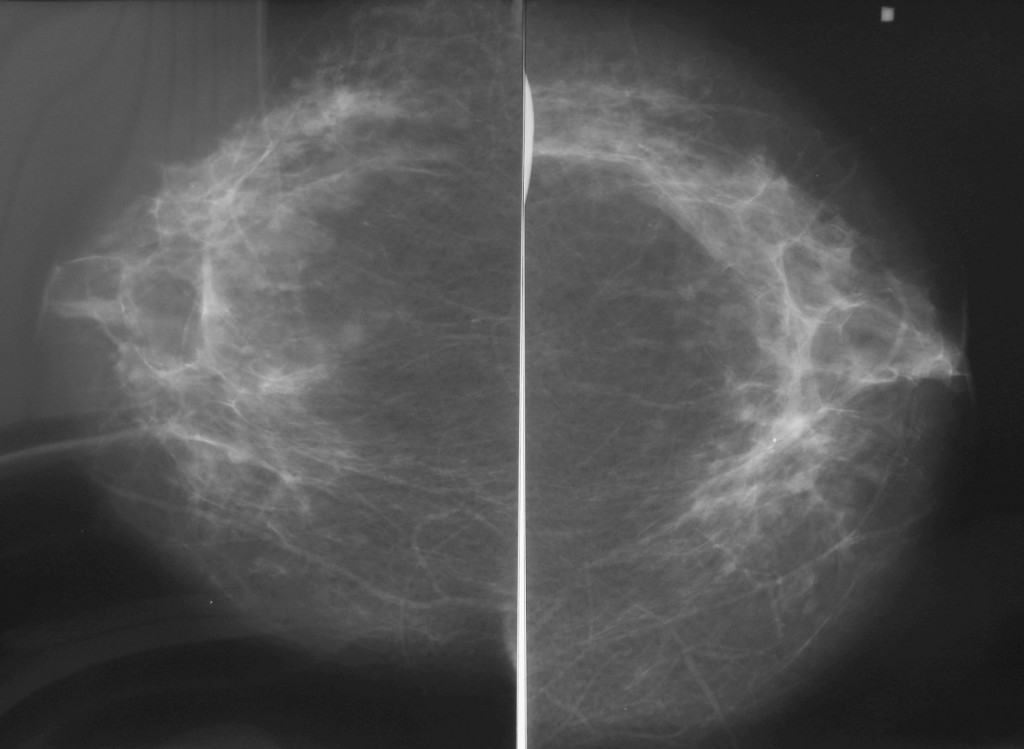 (A) Цельные изображения паховой молочной железы из (a) 129SvEv WT и (b) Stat1-null (см. S2 Fig для изображений цельных препаратов молочной железы с низким увеличением). Масштабная линейка 2 мм. (B) Общая длина протоков и точки ветвления были измерены на фотоизображениях цельных препаратов молочных желез, окрашенных либо гематоксилином, либо карминовым красным.Для измерения общей длины протоков изображения были проанализированы с помощью программного обеспечения для визуализации IMARIS с использованием функции отслеживания нитей. Точки ветвления подсчитывали вручную на протоках в пределах 2 мм от концевых почек. (C) Количественный анализ общей длины протоков (слева) и количества ветвей (справа) показывает, что железы Stat1-null (KO) имеют значительно (***P = 0,0003) более короткую общую длину протоков. Количество точек ветвления в пределах 2 мм концов протоков существенно не различалось между железами 129SvEv WT и Stat1-null .Данные средние ± SEM (n = 6).
(A) Цельные изображения паховой молочной железы из (a) 129SvEv WT и (b) Stat1-null (см. S2 Fig для изображений цельных препаратов молочной железы с низким увеличением). Масштабная линейка 2 мм. (B) Общая длина протоков и точки ветвления были измерены на фотоизображениях цельных препаратов молочных желез, окрашенных либо гематоксилином, либо карминовым красным.Для измерения общей длины протоков изображения были проанализированы с помощью программного обеспечения для визуализации IMARIS с использованием функции отслеживания нитей. Точки ветвления подсчитывали вручную на протоках в пределах 2 мм от концевых почек. (C) Количественный анализ общей длины протоков (слева) и количества ветвей (справа) показывает, что железы Stat1-null (KO) имеют значительно (***P = 0,0003) более короткую общую длину протоков. Количество точек ветвления в пределах 2 мм концов протоков существенно не различалось между железами 129SvEv WT и Stat1-null .Данные средние ± SEM (n = 6).
https://doi.org/10.1371/journal.pone.0129895.g002
Образцы сыворотки из выбранных когорт были проанализированы Центральной лабораторией мышиных гормонов Университета Вандербильта на уровни E, P, пролактина (PRL) и инсулина. Различия между 129SvEv WT и 129: Stat1-null не были статистически значимыми (S3 Fig). Вскрытие не выявило существенных макроскопических или микроскопических различий между развивающимся 129SvEv WT и гипофизом, яичниками и маткой самок 129: Stat1-null (данные не показаны).Цикл эструса каждой мыши оценивали путем изучения гистологии влагалища, но он не имел явного влияния на развитие молочной железы.
129:
Stat1-Null Жировая ткань молочной железы не поддерживает эпителиальный рост без экзогенных гормонов Гетерологичная трансплантация использовалась для определения влияния внутренних факторов эпителиальных клеток на рост и развитие по сравнению с микроокружением хозяина, включая MFP, костный мозг и эндокринные/паракринные компартменты. Одновременная контрольная аутологичная и перекрестная «реципрокная» трансплантация 129SvEv WT и эпителия молочной железы 129: Stat1-null в 129SvEv WT (рис. 3A для экспериментального дизайна) и ECFP 129: Stat1-null хозяина были выполнены с каждой реципиентной мышью, принимающей оба 129SvEv WT и 129: Stat1-нулевой эпителий .
Одновременная контрольная аутологичная и перекрестная «реципрокная» трансплантация 129SvEv WT и эпителия молочной железы 129: Stat1-null в 129SvEv WT (рис. 3A для экспериментального дизайна) и ECFP 129: Stat1-null хозяина были выполнены с каждой реципиентной мышью, принимающей оба 129SvEv WT и 129: Stat1-нулевой эпителий .
Рис. 3. 129: Stat1-null жировые отложения молочных желез препятствуют росту эпителиального трансплантата, который восстанавливается экзогенными гормонами.
Схема, изображающая протоколы трансплантации между железами 129SvEv WT и Stat1-null и лечение гормонами (A).Паховые молочные железы 3-недельных самок-хозяев очищали от эндогенного эпителия, в то время как эпителий донорских молочных желез 129SvEv WT и 129: Stat1-null ( Stat1-null ) трансплантировали в каждую очищенную от эпителия жировую ткань в мышей-хозяев через 1 неделю после операции по клирингу. Мышам-хозяевам ежедневно вводили PDOM в возрасте от 5 до 7 недель. Окрашенные гематоксилином цельные изображения реципрокно трансплантированных молочных желез с гормональной терапией или без нее (B). Молочные железы у мышей-хозяев 129SvEv WT (а, в, д, ж) и Stat1-null (б, г, е, з) с донорским эпителием от 129SvEv WT (а, б, в, г) и Stat1- показаны нулевые мыши (e, f, g, h).Молочные железы мышей, получавших PDOM (c, d, g, h). Белые звездочки в b и f указывают приблизительное расположение мест трансплантации. Количественный анализ протоковой сети (С). На левом графике показана общая длина протоков молочных желез в каждом эксперименте (WT против KO для каждого лечения). Данные средние ± SEM, **P = 0,0026, ***P = 0,0005. График правой панели представляет собой анализ количества точек ветвления. **Р<0,01, ***Р<0,001.
Окрашенные гематоксилином цельные изображения реципрокно трансплантированных молочных желез с гормональной терапией или без нее (B). Молочные железы у мышей-хозяев 129SvEv WT (а, в, д, ж) и Stat1-null (б, г, е, з) с донорским эпителием от 129SvEv WT (а, б, в, г) и Stat1- показаны нулевые мыши (e, f, g, h).Молочные железы мышей, получавших PDOM (c, d, g, h). Белые звездочки в b и f указывают приблизительное расположение мест трансплантации. Количественный анализ протоковой сети (С). На левом графике показана общая длина протоков молочных желез в каждом эксперименте (WT против KO для каждого лечения). Данные средние ± SEM, **P = 0,0026, ***P = 0,0005. График правой панели представляет собой анализ количества точек ветвления. **Р<0,01, ***Р<0,001.
https://дои.org/10.1371/journal.pone.0129895.g003
Эпителиальные трансплантаты исследовали на предмет разрастания протоков через 4 недели после трансплантации с использованием цельных препаратов, окрашенных гематоксилином (рис. 3В). Показатели «принятия» (успешных трансплантаций) и статистические сравнения между группами записываются в таблицы S1 и S2 соответственно. Трансплантаты донора 129SvEv WT и эпителия донора 129: Stat1-null врастали в MFP молочной железы при трансплантации хозяину 129SvEv WT (панели a и e на рис. 3B). Тем не менее, у хозяина 129: Stat1-null наблюдалось меньше дублей (таблица S1) и меньший рост трансплантированного эпителия донора 129: Stat1-null по сравнению с трансплантированным эпителием донора 129SvEv WT (сравните панели b и f на рис. 3Б).Интересно, что эпителиальные трансплантаты 129: Stat1-null демонстрировали одинаковую общую длину протоков и значительно большее разветвление (P = 0,0157) в жировых телах одинакового размера в 129SvEv WT ECFP по сравнению с аутохтонными трансплантатами WT (рис. 3C). Это открытие изначально предполагало, что эпителий 129: Stat1-null не обязательно имеет внутренний дефект. Однако более поздние исследования с использованием различных экспериментальных переменных подтверждают наличие внутреннего дефекта эпителия.
3В). Показатели «принятия» (успешных трансплантаций) и статистические сравнения между группами записываются в таблицы S1 и S2 соответственно. Трансплантаты донора 129SvEv WT и эпителия донора 129: Stat1-null врастали в MFP молочной железы при трансплантации хозяину 129SvEv WT (панели a и e на рис. 3B). Тем не менее, у хозяина 129: Stat1-null наблюдалось меньше дублей (таблица S1) и меньший рост трансплантированного эпителия донора 129: Stat1-null по сравнению с трансплантированным эпителием донора 129SvEv WT (сравните панели b и f на рис. 3Б).Интересно, что эпителиальные трансплантаты 129: Stat1-null демонстрировали одинаковую общую длину протоков и значительно большее разветвление (P = 0,0157) в жировых телах одинакового размера в 129SvEv WT ECFP по сравнению с аутохтонными трансплантатами WT (рис. 3C). Это открытие изначально предполагало, что эпителий 129: Stat1-null не обязательно имеет внутренний дефект. Однако более поздние исследования с использованием различных экспериментальных переменных подтверждают наличие внутреннего дефекта эпителия.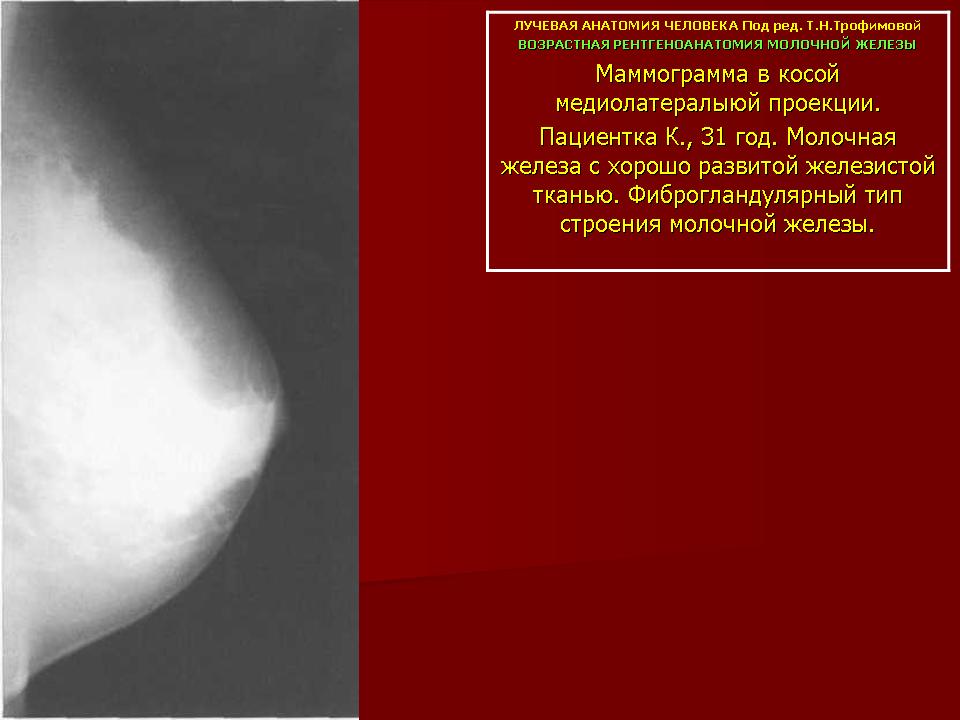
Учитывая, что рост и развитие нативного MG у 129: Stat1-null самок, по-видимому, были спасены во время беременности, и существует заметная кооперативность между действиями P и PRL во время роста MG [32], способность P плюс Исследовали DOM (PDOM) для восстановления нарушенного роста трансплантатов 129: Stat1-null эпителия.Экзогенные E, P, DOM или PDOM вводили ежедневно в течение двух недель 129SvEv WT и мышам-хозяевам 129: Stat1-null , несущим контралатеральные трансплантаты 129SvEv WT и 129: Stat1-null эпителия молочной железы.
Экзогенная PDOM стимулировала рост донорского эпителия MG как у 129SvEv WT, так и у хозяев 129: Stat1-null (панели c, d, g, h на рис. 3B). Эффект E был аналогичен эффекту, индуцированному PDOM, тогда как не было никакого эффекта, когда мышей-хозяев лечили только P или DOM (S4 Fig).Параметры роста (общая длина протоков и точки ветвления) были улучшены в большинстве трансплантатов, обработанных PDOM (рис. 3C). Ветвление оставалось ниже в эпителии 129: Stat1-null , трансплантированном либо в 129: Stat1-null , либо в MFP 129SvEv WT, даже после того, как обработка PDOM стимулировала рост. Этот результат указывает на то, что 129: Stat1-null эпителий молочной железы действительно имеет внутренний, хотя и незначительный, но статистически значимый дефект в морфогенезе ветвления (Fig 3C). Результаты лечения PDOM подтверждают, расширяют и усиливают предыдущие наблюдения о том, что беременность восстанавливает фенотип молочной железы в нативной железе (рис. S1).
3C). Ветвление оставалось ниже в эпителии 129: Stat1-null , трансплантированном либо в 129: Stat1-null , либо в MFP 129SvEv WT, даже после того, как обработка PDOM стимулировала рост. Этот результат указывает на то, что 129: Stat1-null эпителий молочной железы действительно имеет внутренний, хотя и незначительный, но статистически значимый дефект в морфогенезе ветвления (Fig 3C). Результаты лечения PDOM подтверждают, расширяют и усиливают предыдущие наблюдения о том, что беременность восстанавливает фенотип молочной железы в нативной железе (рис. S1).
129:
Stat1-null Профиль микроматрицы MG отличается от дикого типа Анализ микрочипов выявил значительные (≥1,5-кратные) различия в экспрессии мРНК для различных генов в MG либо от 129SvEv WT (рис. 4A), либо от мышей 129: Stat1-null (рис. 4B), что также может быть представлено тепловой карты. Как и ожидалось, гены, связанные с функцией STAT1 (например, IDO1, Indo1), имели значительно более низкую экспрессию в MG от мышей 129: Stat1-null . Экспрессия генов ассоциированных с эозинофилами рибонуклеаз ( Ear ) ( Ear1 , Ear2 , Ear10 , Ear11 ) была значительно выше у 129: Stat1-null MGs 33] также значительно различались между 129SvEv WT и 129: Stat1-null .Экспрессия мРНК кальцитонин-ассоциированного пептида ( Calca ) была наиболее высокой в железах 129: Stat1-null наряду с другими генами, связанными с путями восстановления-окисления, что предполагает метаболический дефицит или нарушение регуляции. Для дальнейшего изучения того, какие биологические события участвуют в железах 129: Stat1-null , был проведен функциональный кластерный анализ DAVID (рис. 4C). Списки генов из этого анализа также выявили участие активности, связанной с иммунными клетками, у мышей 129: Stat1-null (иммунный ответ, активация лейкоцитов, развитие иммунной системы, воспалительный ответ и т. д.) согласуется с предыдущими исследованиями, демонстрирующими иммунодефицитность мышей 129: Stat1-null [34–36].
Экспрессия генов ассоциированных с эозинофилами рибонуклеаз ( Ear ) ( Ear1 , Ear2 , Ear10 , Ear11 ) была значительно выше у 129: Stat1-null MGs 33] также значительно различались между 129SvEv WT и 129: Stat1-null .Экспрессия мРНК кальцитонин-ассоциированного пептида ( Calca ) была наиболее высокой в железах 129: Stat1-null наряду с другими генами, связанными с путями восстановления-окисления, что предполагает метаболический дефицит или нарушение регуляции. Для дальнейшего изучения того, какие биологические события участвуют в железах 129: Stat1-null , был проведен функциональный кластерный анализ DAVID (рис. 4C). Списки генов из этого анализа также выявили участие активности, связанной с иммунными клетками, у мышей 129: Stat1-null (иммунный ответ, активация лейкоцитов, развитие иммунной системы, воспалительный ответ и т. д.) согласуется с предыдущими исследованиями, демонстрирующими иммунодефицитность мышей 129: Stat1-null [34–36]. Как и ожидалось, мРНК Stat1 была заметно снижена, в то время как экспрессия различных других генов Stat и Jak была дифференциально изменена вверх и вниз, когда 129: Stat1-null MG сравнивали с 129SvEv WT (S5 Fig. ).
Как и ожидалось, мРНК Stat1 была заметно снижена, в то время как экспрессия различных других генов Stat и Jak была дифференциально изменена вверх и вниз, когда 129: Stat1-null MG сравнивали с 129SvEv WT (S5 Fig. ).
Рис. 4. 129: Stat1-null Профили микрочипа экспрессии молочной железы указывают на снижение активности STAT1-связанных путей с повышением активности генов эозинофилов.
Микрочипы экспрессии генов были выполнены с использованием РНК, выделенной из 129SvEv WT и 129: Stat1-null ( Stat1-null ) молочных желез (MG). На тепловых картах указаны 50 генов > в 2 раза выше в (A) 129SvEv WT MG и (B) Stat1-null MG (WT против Stat1-null ). Функциональная кластеризация DAVID (C) показала повышенную представленность процессов, связанных с иммунными клетками (иммунный ответ, активация лейкоцитов, иммунная система и развитие, воспалительная реакция и т. д.), что согласуется с процессами, на которые, как известно, влияет потеря STAT1.
https://doi.org/10.1371/journal.pone.0129895.g004
Пересаженный костный мозг дикого типа не спасает 129:
Stat1-null Эпителиальный рост У мышей 129: Stat1-null иммунологически нарушены известные дефекты естественных киллеров (NK) и макрофагов [34–36]. Известно, что клетки, происходящие из костного мозга, включая иммунные клетки и особенно моноциты/макрофаги, способствуют развитию миастении [37].Чтобы определить, можно ли отнести дефект хозяина 129: Stat1-null к клеткам, происходящим из костного мозга, были выполнены одновременные реципрокные трансплантации костного мозга и MG (рис. 5). Вкратце, у летально облученных мышей 129: Stat1-null воссоздали костный мозг мышей 129: Stat1-null (контроль) или 129SvEv WT, а затем использовали в качестве реципиентов трансплантата для контралатеральных 129: Stat1-null и 129SvEv. Эпителиальные трансплантаты MG WT. Аналогично, облученных мышей 129SvEv WT восстанавливали костным мозгом либо 129SvEv WT (контроль), либо 129: Stat1-null , а затем служили реципиентами для одновременных 129: Stat1-null и 129SvEv WT эпителиальных трансплантатов MG.
Рис. 5. Пересадка костного мозга не изменяет 129: Stat1-нулевой эпителиальный отросток.
Окрашенные гематоксилином цельные препараты паховой молочной железы от мышей 129SvEv WT и 129: Stat1-null ( Stat1-null ). Вкратце, смертельно облученные 129SvEv WT (A, B, C, D) и Stat1-null (E, F, G, H) были восстановлены костным мозгом (BoMa) из 129SvEv WT (A, B) или Stat1- null (C, D) и были реципиентами трансплантата эпителия молочной железы 129SvEv WT (B, D, F, H) и Stat1-null (A, C, E, G).У хозяев Stat1-null наблюдается ограниченный рост трансплантата молочной железы, который не улучшился после трансплантации костного мозга 129SvEv WT. Кроме того, не наблюдалось изменений в росте молочной железы у хозяев 129SvEv WT, которым трансплантировали костный мозг Stat1-null .
https://doi.org/10.1371/journal.pone.0129895.g005
У всех выживших животных было полное приживление донорского костного мозга без остаточного костного мозга хозяина (данные не показаны). Хозяева 129: Stat1-null показали ограниченный рост трансплантированного эпителия молочной железы, который не улучшился при трансплантации костного мозга 129SvEv WT.Кроме того, не было зарегистрировано никаких изменений в росте MG у хозяев 129SvEv WT, которым трансплантировали костный мозг 129: Stat1-null (рис. 5). В совокупности эти эксперименты показали, что фенотип молочной железы не может быть восстановлен или создан с использованием только пересаженного костного мозга.
Хозяева 129: Stat1-null показали ограниченный рост трансплантированного эпителия молочной железы, который не улучшился при трансплантации костного мозга 129SvEv WT.Кроме того, не было зарегистрировано никаких изменений в росте MG у хозяев 129SvEv WT, которым трансплантировали костный мозг 129: Stat1-null (рис. 5). В совокупности эти эксперименты показали, что фенотип молочной железы не может быть восстановлен или создан с использованием только пересаженного костного мозга.
Рост неопластических трансплантатов нарушен в 129:
Stat1-null Хосты Ранее было показано, что STAT1 действует как супрессор опухоли [12–16, 38]. Учитывая наши данные, указывающие на то, что STAT1 функционирует в микроокружении MG для регуляции роста нормального эпителия, мы провели эксперименты для оценки влияния этого микроокружения на рост опухолевых клеток.Три различные первичные опухоли MG, возникшие у мышей 129: Stat1-null , трансплантировали билатерально в паховые MFP мышей 129SvEv WT и 129: Stat1-null мышей-реципиентов.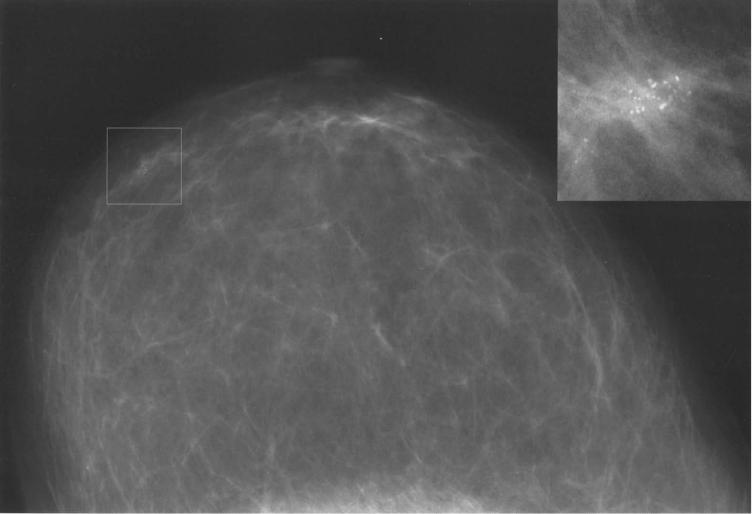 Через семь недель после трансплантации объем образовавшихся опухолей MG у хозяев 129SvEv WT был почти в 10 раз больше, чем у опухолей, выращенных у 129: Stat1-null хозяев (рис. 6). Таким образом, локальная или системная среда 129: Stat1-null плохо поддерживает рост трансплантированных первичных опухолевых клеток и позволяет предположить, что супрессорное действие STAT1 на опухоль в микроокружении/хозяине не является функциональным или эффективным.
Через семь недель после трансплантации объем образовавшихся опухолей MG у хозяев 129SvEv WT был почти в 10 раз больше, чем у опухолей, выращенных у 129: Stat1-null хозяев (рис. 6). Таким образом, локальная или системная среда 129: Stat1-null плохо поддерживает рост трансплантированных первичных опухолевых клеток и позволяет предположить, что супрессорное действие STAT1 на опухоль в микроокружении/хозяине не является функциональным или эффективным.
Рис. 6. 129:S tat1-null жировые отложения плохо поддерживают рост трансплантированных опухолей.
Изменения объема опухоли в молочных железах мышей-хозяев 129SvEv WT или 129: Stat1-null ( Stat1-null ) с течением времени. Эксплантаты трех первичных опухолей молочной железы от мышей Stat1-null трансплантировали в паховые молочные железы пяти хозяев 129SvEv WT или Stat1-null . Опухоли измеряли штангенциркулем два раза в неделю в течение 7 недель. Объемы опухолей у мышей 129SvEv WT увеличивались в 10 раз быстрее, чем у хозяев с нулевым Stat1 . Данные средние ± SEM (n = 5), ***P<0,001. Каждая горизонтальная черная полоса представляет собой среднее значение объемов опухоли.
Данные средние ± SEM (n = 5), ***P<0,001. Каждая горизонтальная черная полоса представляет собой среднее значение объемов опухоли.
https://doi.org/10.1371/journal.pone.0129895.g006
Для дальнейшего определения различий в реакции хозяина на эпителий молочной железы, 129: Stat1-null эпителиальная опухолевая клеточная линия SSM2 UCD [39] которые были трансплантированы в MFP 129SvEv WT и 129: Stat1-null с интактными железами, исследовали с помощью гистологии и иммуногистохимии (рис. 7).Опухоли SSM2 UCD , трансплантированные в 129: Stat1-null MG, показали последовательный и характерный гранулоцитарный инфильтрат с редкими CD3+ клетками и другими рассеянными мононуклеарными клетками (рис. 7H). Напротив, трансплантаты в 129SvEv WT MG характеризовались мононуклеарными, преимущественно CD3+ лимфоцитарными инфильтратами с относительно редкими гранулоцитами (рис. 7G). Тем не менее, 129: хозяева Stat1-null , которые были предварительно обработаны в течение двух недель PDOM, а затем немедленно имплантированы клетками SSM2 UCD , показали промежуточный ответ с мононуклеарным инфильтратом хозяина с большим количеством CD3+ клеток и снижением гранулоцитов (рис. 7I).Эти реакции хозяина на трансплантированные опухоли согласуются с известным иммунологическим дисбалансом у мышей 129: Stat1-null [22] и анализом экспрессии соответствующих интактных жировых комков молочной железы, которые показывают повышенные уровни РНК, родственной гранулоцитам (рис. 4).
7I).Эти реакции хозяина на трансплантированные опухоли согласуются с известным иммунологическим дисбалансом у мышей 129: Stat1-null [22] и анализом экспрессии соответствующих интактных жировых комков молочной железы, которые показывают повышенные уровни РНК, родственной гранулоцитам (рис. 4).
Рис. 7. Различные реакции хозяина между 129: Stat1-null и 129SvEv WT на трансплантированные опухолевые клетки.
Линия опухолевых клеток SSM2 UCD , полученная из опухоли молочной железы 129: Stat1-null ( Stat1-null ), была трансплантирована в интактные молочные железы 6-недельного 129SvEv WT (A, D, G ), Stat1-null молочных желез (B, E, H) и молочные железы Stat1-null мышей, получавших PDOM (C, F, I).Опухоли SSM2 собирали и обрабатывали для гистопатологического анализа через две недели после трансплантации. Верхние 3 панели (A, B, C) показывают низкое увеличение трансплантатов, окрашенных H и E, через 2 недели; средние 3 панели (D, E, F) показывают окрашивание анти-CD3.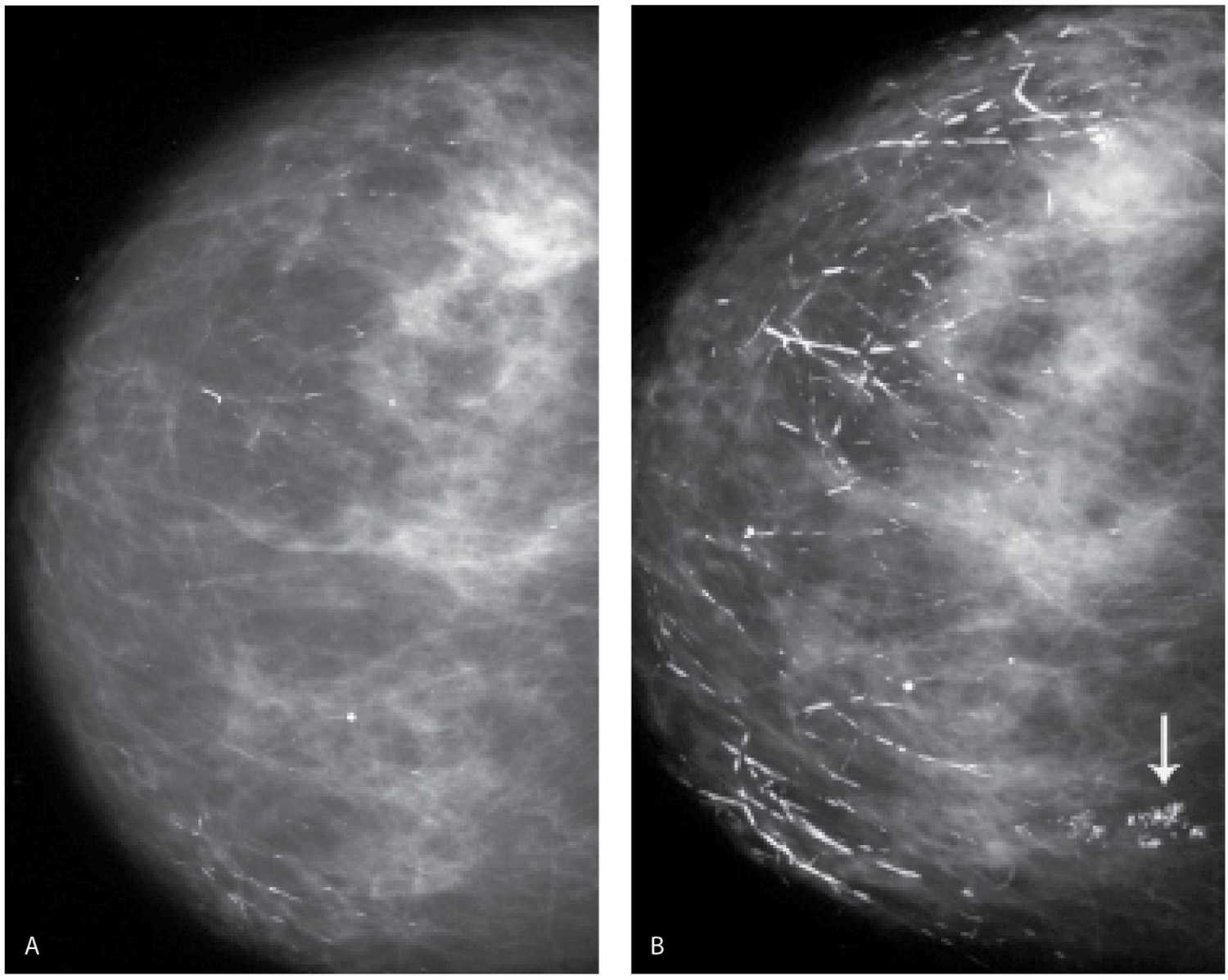 Обратите внимание, что наиболее интенсивное и широко распространенное окрашивание CD3+ обнаруживается вокруг и внутри опухолевых клеток SSM2 у хозяина 129SvEv WT. Нижние 3 панели (G, H, I) представляют собой окрашенные H и E области A, B и C с большим увеличением соответственно. На G стрелки указывают на моноциты, указывающие на общий мононуклеарный ответ в 129SvEv WT.На H стрелки указывают на гранулоциты и предполагают, что опухоли SSM2 имеют общий гранулоцитарный ответ хозяина в Stat1-null . В I присутствие моноцитов (стрелка) и гранулоцитов (стрелка) предполагает промежуточный иммунный ответ у Stat1-null хозяев, обработанных гормоном (PDOM).
Обратите внимание, что наиболее интенсивное и широко распространенное окрашивание CD3+ обнаруживается вокруг и внутри опухолевых клеток SSM2 у хозяина 129SvEv WT. Нижние 3 панели (G, H, I) представляют собой окрашенные H и E области A, B и C с большим увеличением соответственно. На G стрелки указывают на моноциты, указывающие на общий мононуклеарный ответ в 129SvEv WT.На H стрелки указывают на гранулоциты и предполагают, что опухоли SSM2 имеют общий гранулоцитарный ответ хозяина в Stat1-null . В I присутствие моноцитов (стрелка) и гранулоцитов (стрелка) предполагает промежуточный иммунный ответ у Stat1-null хозяев, обработанных гормоном (PDOM).
https://doi.org/10.1371/journal.pone.0129895.g007
129:
Stat1-null Жировые прокладки молочной железы с дефицитом фактора роста Трансплантация опухолевого и нормального эпителия молочной железы хозяевам 129: Stat1-null привела к замедлению роста клеток по сравнению с таковым у хозяина 129SvEv WT, что позволяет предположить, что микроокружение 129: Stat1-null может быть дефицитным по одному или нескольким Факторы, регулирующие рост.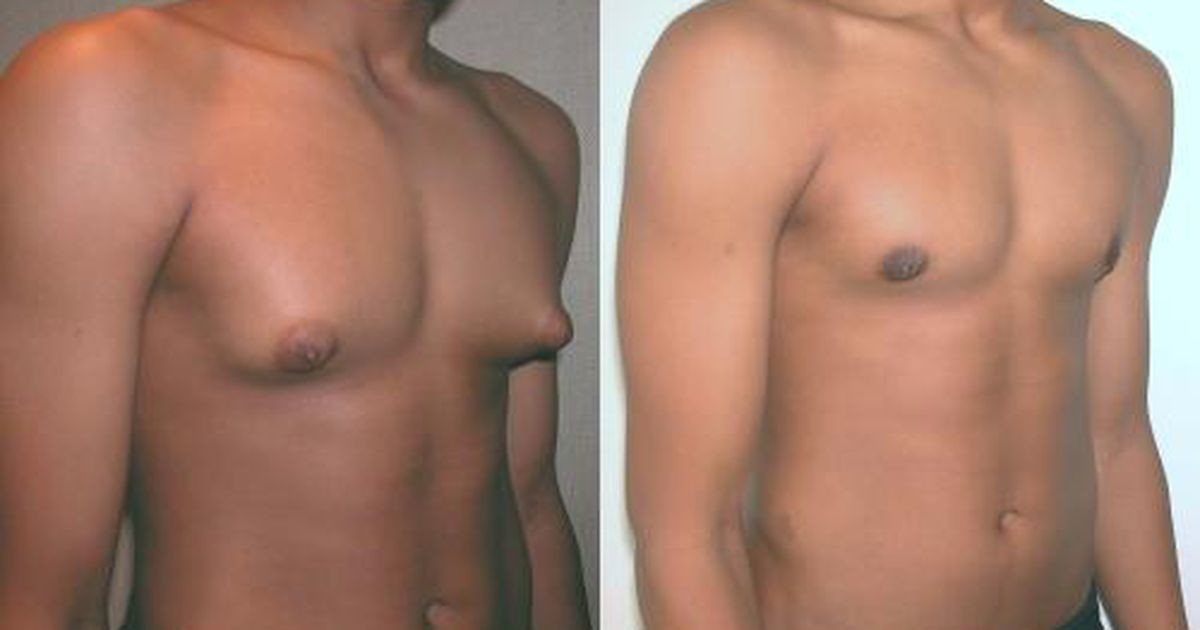 Сначала мы определили реакцию роста клеток SSM2 UCD и клеток COMMA-1D (фенотипически нормальная линия эпителиальных клеток молочной железы BALB/c [40]) на CM, приготовленные с использованием ECFP из 129SvEv WT control, 129: Stat1-null , и «спасли» 129: Stat1-null мышей, получавших PDOM.
Сначала мы определили реакцию роста клеток SSM2 UCD и клеток COMMA-1D (фенотипически нормальная линия эпителиальных клеток молочной железы BALB/c [40]) на CM, приготовленные с использованием ECFP из 129SvEv WT control, 129: Stat1-null , и «спасли» 129: Stat1-null мышей, получавших PDOM.
Клетки SSM2 UCD , выращенные в 129SvEv WT CM, оценивали с помощью иммунофлуоресценции на Ki67 (рис. 8A), которая выявила более высокую скорость роста по сравнению с клетками, выращенными в 129: Stat1-null CM или базальной среде (рис. 8B).Клетки SSM2 UCD , культивированные в 129: Stat1-null CM, демонстрировали меньшую сплоченность по сравнению с клетками, культивируемыми с CM, полученными из MG мышей 129SvEv WT (рис. 8C и 8D, объединены). Кластеры клеток SSM2 UCD были более обширными при культивировании в 129SvEv WT по сравнению с 129: Stat1-null CM с различиями в межклеточных соединениях (окрашивание ZO1), фокальных адгезиях (окрашивание винкулином) и организации актинового цитоскелета ( фиг. 8С и 8D).
8С и 8D).
Рис. 8. Stat1-null Среда, кондиционированная жировой тканью, плохо поддерживает пролиферацию линии опухолевых клеток.
Пролиферация клеток SSM2 UCD , обработанных CM из очищенных от эпителия жировых подушечек (ECFP) мышей 129SvEv WT и 129: Stat1-null ( Stat1-null ), демонстрируется с помощью окрашивания Ki67 (A). Иммунофлуоресцентное окрашивание на Ki67 (красный) и DAPI (синий) показывает пропорцию роста клеток SSM2 UCD , культивируемых в кондиционированных средах (CM) из 129SvEv WT ECFP (a, WT), CM из Stat1-null ECFP (b, КО) или базальные среды (в, БМ). Процент Ki67-положительных клеток был выше в 129SvEv WT CM, чем в Stat1-null CM или BM (B).Данные средние ± SEM (n = 3). *Р<0,05, **Р<0,01. Иммунофлуоресценция на ZO1 (зеленый), VINC (красный), ACTIN (белый) и DAPI (синий) в клетках SSM2 UCD , культивированных в CM из 129SvEv WT (C) или CM из Stat1-null ECFP (D), показывает изменения в цитологическом распределении структурных белков. Масштабная линейка = 50 мкм.
Масштабная линейка = 50 мкм.
https://doi.org/10.1371/journal.pone.0129895.g008
Клетки COMMA-1D показали минимальный рост в 129: Stat1-null CM по сравнению с их ростом в бессывороточных базальных средах (рис. 9A). .Напротив, CM из ECFP 129SvEv WT стимулировал рост клеток COMMA-1D [41] с 24-часовым временем удвоения 2 дня (рис. 9A). Интересно, что CM из 129: Stat1-null ECFP, предварительно обработанных PDOM, стимулировал рост клеток COMMA-1D в степени, сходной с их реакцией на 129SvEv WT CM (фиг. 9A).
Рис. 9. 129: Stat1-null Среда, кондиционированная жировой тканью, ингибирует рост нормального эпителия.
Пролиферация клеток OMMA-1D с течением времени (A). Клетки выращивали в среде, кондиционированной свободными от эпителия жировыми подушечками (ECFP), взятыми либо у мышей 129SvEv WT, 129: Stat1-null ( Stat1-null ), либо у обработанных PDOM мышей Stat1-null , либо в других базовых средах. (БМ) на 4 д.Пролиферацию клеток измеряли с помощью окрашивания метиленовым синим на 2-й и 4-й день. Данные представляют собой среднее значение ± стандартная ошибка среднего (n = 6 лунок на обработку). Для 129SvEv WT против Stat1-null ***P<0,001 (день 2), **P<0,01 (день 4). Для 129SvEv WT против Stat1-null (PDOM) **P<0,01 (день 2). Для Stat1-null по сравнению с Stat1-null (PDOM) *P<0,05 (день 2) и **P<0,01 (день 4). Данные являются репрезентативными для 4 отдельных экспериментов. Среду, кондиционированную ECFP от мышей 129SvEv WT или Stat1-нулевых мышей , использовали для оценки цитокинов с помощью анализа Milliplex (B).На тепловой карте показаны уровни цитокинов CM, полученного с помощью ECFP от мышей 129SvEv WT, Stat1-null или Stat1-null , получавших PDOM. Stat1-null интактные жировые тела молочной железы (MFP) имеют более низкие уровни экспрессии цитокинов, чем MFP 129SvEv WT, интактные железе (C). Тепловые карты результатов мультиплексного анализа цитокинов/хемокинов показывают различия в уровнях экспрессии цитокинов между 129SvEv WT и MFP Stat1-null с интактными железами.
(БМ) на 4 д.Пролиферацию клеток измеряли с помощью окрашивания метиленовым синим на 2-й и 4-й день. Данные представляют собой среднее значение ± стандартная ошибка среднего (n = 6 лунок на обработку). Для 129SvEv WT против Stat1-null ***P<0,001 (день 2), **P<0,01 (день 4). Для 129SvEv WT против Stat1-null (PDOM) **P<0,01 (день 2). Для Stat1-null по сравнению с Stat1-null (PDOM) *P<0,05 (день 2) и **P<0,01 (день 4). Данные являются репрезентативными для 4 отдельных экспериментов. Среду, кондиционированную ECFP от мышей 129SvEv WT или Stat1-нулевых мышей , использовали для оценки цитокинов с помощью анализа Milliplex (B).На тепловой карте показаны уровни цитокинов CM, полученного с помощью ECFP от мышей 129SvEv WT, Stat1-null или Stat1-null , получавших PDOM. Stat1-null интактные жировые тела молочной железы (MFP) имеют более низкие уровни экспрессии цитокинов, чем MFP 129SvEv WT, интактные железе (C). Тепловые карты результатов мультиплексного анализа цитокинов/хемокинов показывают различия в уровнях экспрессии цитокинов между 129SvEv WT и MFP Stat1-null с интактными железами.
https://дои.org/10.1371/journal.pone.0129895.g009
Профили кондиционированных сред указывают на пониженные уровни цитокинов в
Stat1-null жировой ткани молочной железы Бесклеточный CM стимулировал дифференциальный рост и морфологические фенотипы эпителиальных клеток, указывая на роль диффундирующих молекул, таких как хемокины/цитокины, из MFP. Профили экспрессии генов из интактных MFP, наряду с результатами мультиплексного анализа белков ECFP CM, показали снижение уровней многих цитокинов в MFP 129: Stat1-null по сравнению с MFP 129SvEv WT, включая G-CSF, IL- 6, MSP1, KC и MIP2 (фиг. 9B).Уровни других цитокинов в 129: Stat1-null CM, таких как CCL11 (эотаксин), были аналогичны уровням в 129SvEv WT CM. Следует отметить, что среда, кондиционированная ECFP от мышей, получавших PDOM, демонстрировала профили цитокинов, намного более близкие к профилям 129SvEv WT, чем 129: Stat1-null CM. Примечательно, что наблюдалась более чем 50-кратная разница в CCL4 (MIP-1β) между Stat1-null CM и предварительно обработанным PDOM 129: Stat1-null CM или 129SvEv WT CM (рис. 9B). Эти результаты показывают, что микроокружение ECFP у мышей 129: Stat1-null дефицитно по большому количеству молекул, регулирующих рост, которые восстанавливаются в ответ на PDOM.
9B). Эти результаты показывают, что микроокружение ECFP у мышей 129: Stat1-null дефицитно по большому количеству молекул, регулирующих рост, которые восстанавливаются в ответ на PDOM.
Обсуждение
Наши исследования документируют ряд аномалий развития MG у нерожавших мышей 129: Stat1-null , в том числе замедленное удлинение протоков и дефектный морфогенез ветвления, которые могут быть устранены с помощью беременности и лактации. Эти структурные аномалии сопровождаются аномальными увеличенными конечными зачатками с дезорганизованными скоплениями клеток в окружающей строме. Впоследствии у 129: мышей Stat1-null были обнаружены низкие уровни цитокинов, что, вероятно, объясняет неспособность MFP поддерживать рост первичных и трансплантированных эпителиальных нормальных и опухолевых клеток молочной железы.Дефицит, ограничивающий рост, в 129: Stat1-null MFP может быть частично преодолен с помощью беременности или экзогенной PDOM, которая восстанавливает профиль цитокинов в MFP и обращает вспять дефекты роста и развития эпителия. Однако потеря STAT1 также связана с незначительной, но статистически значимой, резистентной к PDOM аномалией в морфогенезе ветвления, которая предполагает автономный дефект эпителиальных клеток. Эти явления подчеркивают множественные потенциальные роли STAT1 в регуляции сложного взаимодействия между эндокринной и стромальной средами. при разработке МГ.
Однако потеря STAT1 также связана с незначительной, но статистически значимой, резистентной к PDOM аномалией в морфогенезе ветвления, которая предполагает автономный дефект эпителиальных клеток. Эти явления подчеркивают множественные потенциальные роли STAT1 в регуляции сложного взаимодействия между эндокринной и стромальной средами. при разработке МГ.
Сравнение развития MG у самок 129SvEv WT и 129: Stat1-null также выявляет четкие морфологические различия между генотипами. Трехмерный структурный анализ целых препаратов от шестинедельных мышей документально подтверждает, что у мышей 129: Stat1-null TEB крупнее, а соседние стромальные «сопровождающие клетки» широко рассредоточены. Присутствие этих больших TEB, окруженных рассеянными мелкими стромальными клетками, указывает на то, что сигналы, необходимые для организации и координации сложных взаимодействий между стромой и эпителием во время расширения протоков, могут быть слабыми или отсутствовать у нулевых мышей.
MG зрелых девственных самок 129: Stat1-null также недоразвиты с редуцированным ветвлением протоков, которое сохраняется после достижения половой зрелости. Однако самки 129: Stat1-null могут успешно выкармливать детенышей со структурно нормальными и функциональными MG во время лактации, указывая на то, что фенотипическая аномалия обратима при гормональной стимуляции.
Учитывая глобальную роль JAK-STAT [33] в МГ нерожавших самок и во время инволюции после отъема [42], несколько удивительно, что в предыдущих исследованиях не проводился подробный анализ развития МГ, а было решено в первую очередь сосредоточиться на онкогенез [12–15].На это несоответствие также указали Харичаран и Ли [6]. Ни Рейвен и др. ни Чан и др. специально представлены данные о неопухолевых МГ Stat1-null [12, 14]. При оценке цельных препаратов MG от 50-дневных нерожавших самок Schneckenleithner et al. описали «… повышенную плотность структур протоков, но без различий в формировании концевых протоков» и показали нормальную гистологию при регрессирующем Balb/c MG дикого типа [15]. Напротив, Klover et al. не сообщили о значительных различиях в MG их эпителиально-специфических FVB: Stat1-null мышей, что подразумевает отсутствие внутренних клеточных аномалий [13].Однако изображение, представленное Klover et al. в качестве доказательства их заявления о том, что «полное отсутствие экспрессии STAT1 наблюдается у мышей Stat1fl/fl NIC», было проиллюстрировано на рис. 4 на «показан не содержащий опухоль эпителий от мышей с опухолью в возрасте примерно 1 года». Изображенный эпителий был идентифицирован нашими опытными патологоанатомами как гиперпластический и, возможно, неопластический. Дальнейшие доказательства были основаны на нокауте WAP-Cre, который сам по себе требует беременности для активации промотора, что, как показано в текущей статье, стирает фенотип Stat1-null MG.
Напротив, Klover et al. не сообщили о значительных различиях в MG их эпителиально-специфических FVB: Stat1-null мышей, что подразумевает отсутствие внутренних клеточных аномалий [13].Однако изображение, представленное Klover et al. в качестве доказательства их заявления о том, что «полное отсутствие экспрессии STAT1 наблюдается у мышей Stat1fl/fl NIC», было проиллюстрировано на рис. 4 на «показан не содержащий опухоль эпителий от мышей с опухолью в возрасте примерно 1 года». Изображенный эпителий был идентифицирован нашими опытными патологоанатомами как гиперпластический и, возможно, неопластический. Дальнейшие доказательства были основаны на нокауте WAP-Cre, который сам по себе требует беременности для активации промотора, что, как показано в текущей статье, стирает фенотип Stat1-null MG.
Различия между нашими настоящими выводами и двумя последними отчетами могут быть связаны с различиями в конструкциях, штаммах и генетическом фоне моделей мышей или другими факторами [43]. Критическая роль STAT1 в передаче сигнала во многих системах органов [33] побудила нас провести более детальное исследование развития MG у 129: Stat1-null самок.
Критическая роль STAT1 в передаче сигнала во многих системах органов [33] побудила нас провести более детальное исследование развития MG у 129: Stat1-null самок.
STAT1 отвечает за передачу сигналов IFNγ [6], а также опосредует передачу сигналов PRL [44–46]. STAT 1, 3 и 5 активируются различными внеклеточными стимулами, включая факторы роста, гормоны и цитокины [6, 42].Эмпирически беременность спасла морфологический фенотип 129: Stat1-null MG, а экзогенная PDOM увеличила рост нулевого эпителия у хозяев 129: Stat1-null до степени, приближающейся к таковой, зарегистрированной у хозяев 129SvEv WT. Примечательно, что для полного восстановления роста и развития MG требовалось сочетание гормонов яичников (P) и гипофиза (PRL), что не могло быть реализовано с помощью отдельных гормонов (S1 Fig). Однако эпителий 129: Stat1-null по-прежнему демонстрировал статистически значимо сниженное разветвление протоков даже после гормональной стимуляции и роста у хозяина 129SvEv WT (рис. 3).Это открытие указывает на то, что в то время как гормоны могут стимулировать эпителий 129: Stat1-null , последующие аномалии ветвления являются частично автономными эпителиально-клеточными.
3).Это открытие указывает на то, что в то время как гормоны могут стимулировать эпителий 129: Stat1-null , последующие аномалии ветвления являются частично автономными эпителиально-клеточными.
показали, что как 129SvEv WT, так и эпителий 129: Stat1-null могут расти у хозяев 129SvEv WT, тогда как сингенные хозяева 129: Stat1-null не поддерживают одинаковый уровень роста и дифференцировки эпителиального генотипа . Мыши с дефицитом STAT1 являются иммунодефицитными и восприимчивы к инфекциям Listeria и плазмодия [17, 21, 22] и использовались для изучения иммунного редактирования во время онкогенеза [22, 35], что повышает вероятность снижения роста MG у 129: Stat1-null самок отражали системные изменения в клетках, связанных с костным мозгом.
Иммунные клетки, происходящие из костного мозга, особенно моноциты/макрофаги, важны для удлинения молочных протоков на терминальном конце зачатка [37, 47]. Однако реципрокная трансплантация костного мозга показала, что нарушение развития МГ у нерожавших мышей 129: Stat1-null не зависит от самих иммунных клеток, а скорее отражает дефект рекрутирования этих клеток измененным микроокружением. Эпителиальный ответ на эти стромальные аномалии также не ограничивается «нормальными» 129: Stat1-null эпителиальными клетками, учитывая, что 129: Stat1-null неопластические клетки трансплантированы как в 129SvEv WT, так и в 129: Stat1 — null количество хостов росло более быстрыми темпами в хостах 129SvEv WT.Примечательно, что ранний ответ хозяина 129: Stat1 — null на опухолевые клетки был характерно гранулоцитарным, в то время как ранний ответ хозяина в 129SvEv WT был мононуклеарным и в нем преобладали CD3+ T-клетки. Такие наблюдения согласуются с известными иммунологическими дефицитами у 129: Stat1 — нулевых мышей , имеющих дефекты в функции NK-клеток и макрофагов [35, 36], и дополнительно подтверждают, что микроокружение MG изменяется между WT и 129: Stat1-нулевые мыши .
Однако реципрокная трансплантация костного мозга показала, что нарушение развития МГ у нерожавших мышей 129: Stat1-null не зависит от самих иммунных клеток, а скорее отражает дефект рекрутирования этих клеток измененным микроокружением. Эпителиальный ответ на эти стромальные аномалии также не ограничивается «нормальными» 129: Stat1-null эпителиальными клетками, учитывая, что 129: Stat1-null неопластические клетки трансплантированы как в 129SvEv WT, так и в 129: Stat1 — null количество хостов росло более быстрыми темпами в хостах 129SvEv WT.Примечательно, что ранний ответ хозяина 129: Stat1 — null на опухолевые клетки был характерно гранулоцитарным, в то время как ранний ответ хозяина в 129SvEv WT был мононуклеарным и в нем преобладали CD3+ T-клетки. Такие наблюдения согласуются с известными иммунологическими дефицитами у 129: Stat1 — нулевых мышей , имеющих дефекты в функции NK-клеток и макрофагов [35, 36], и дополнительно подтверждают, что микроокружение MG изменяется между WT и 129: Stat1-нулевые мыши .
Биологическая сложность взаимодействий JAK-STAT также должна влиять на интерпретацию онкогенеза у нерожавших и рожавших самок 129: Stat1-null по сравнению с другими моделями STAT1. У самок 129: Stat1-null развиваются опухоли молочной железы, имеющие уникальную гистологическую сигнатуру ER+, рецептор прогестерона (PR)+, отличную от других моделей [12, 38]. Предыдущие исследования онкогенеза молочной железы у мышей Stat1-null на других линиях мышей [13–15] и с использованием различных молекулярных конструкций [48] индуцировали опухоли либо путем скрещивания мышей с трансгенными мышами cNeu, предрасположенными к опухолям [13–15], либо с помощью беременность [15].Напротив, опухоли развиваются спонтанно у 129: Stat1-нулевых нерожавших самок [12].
Используя трансплантаты нормального эпителия молочной железы в сочетании с паритетной индукцией онкогенеза в модели Balb/c, Schneckenleithner et al. предположили, что иммунный ответ и внутренние клеточные факторы важны во время онкогенеза, вызванного потерей STAT1 [15].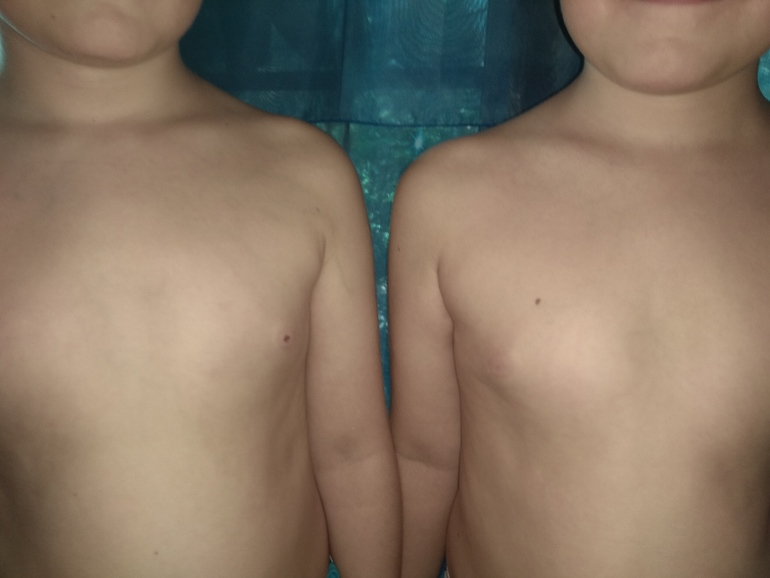 Наши данные согласуются с этими общими выводами. Однако гистопатология спонтанных зависимых от яичников опухолей в 129: Stat1-null MG гомогенна с уникальным цитологическим ER+ фенотипом [12].Напротив, «спонтанные» предраковые поражения (обозначаемые как «MIN») и опухоли в модели Balb/c, индуцированной паритетом, описываются как гетерогенные [15]. К сожалению, в описаниях этих поражений использовались человеческие классификации, которые трудно перевести в традиционные или современные классификации опухолей молочной железы у мышей [49–51]. Изучение изображений в Schneckenleithner et al. публикация предполагает, что гетерогенные опухоли несут признаки, согласующиеся с теми, которые ранее были зарегистрированы у животных, инфицированных вирусом опухоли молочной железы мыши (MMTV) [49, 52, 53], и описаны у генетически модифицированных мышей с нарушением пути Wnt [54].Поскольку у повторнородящих мышей WT Balb/c, использованных в этих исследованиях, также развились опухоли молочных желез, возможно, что колония экспрессирует MMTV, вызывающий узелковый вирус (NIV), обнаруженный в колониях C3Hf и некоторых колониях BALB/c [53].
Наши данные согласуются с этими общими выводами. Однако гистопатология спонтанных зависимых от яичников опухолей в 129: Stat1-null MG гомогенна с уникальным цитологическим ER+ фенотипом [12].Напротив, «спонтанные» предраковые поражения (обозначаемые как «MIN») и опухоли в модели Balb/c, индуцированной паритетом, описываются как гетерогенные [15]. К сожалению, в описаниях этих поражений использовались человеческие классификации, которые трудно перевести в традиционные или современные классификации опухолей молочной железы у мышей [49–51]. Изучение изображений в Schneckenleithner et al. публикация предполагает, что гетерогенные опухоли несут признаки, согласующиеся с теми, которые ранее были зарегистрированы у животных, инфицированных вирусом опухоли молочной железы мыши (MMTV) [49, 52, 53], и описаны у генетически модифицированных мышей с нарушением пути Wnt [54].Поскольку у повторнородящих мышей WT Balb/c, использованных в этих исследованиях, также развились опухоли молочных желез, возможно, что колония экспрессирует MMTV, вызывающий узелковый вирус (NIV), обнаруженный в колониях C3Hf и некоторых колониях BALB/c [53]. еще больше запутывают сравнения между различными моделями Stat1 -null.
еще больше запутывают сравнения между различными моделями Stat1 -null.
Профилирование цитокинов в трех типах бесклеточной среды, кондиционированной культивируемыми эксплантами MFP, выявило глобальное и глубокое снижение цитокинов в 129: Stat1 — null CM.Примечательно, что профили экспрессии цитокинов из интактных 129: Stat1 — нулевых MG были сравнимы с профилями CM, приготовленными с использованием только ECFP. Следует отметить, что цитокины эотаксин (CCL11), CSF и MIP-1α (CCL3) связаны с функциями эозинофилов или макрофагов, что согласуется с краткосрочными (14 дней) иммунологическими реакциями в трансплантатах 129: Stat1 — null опухоли в 129SvEv WT и 129: Stat1-null хозяев.
Мы и другие ранее показали, что диффундирующие ненасыщенные жирные кислоты являются основным компонентом митогенной способности КМ, полученных с использованием эксплантов МФП [41, 55].Это соображение поднимает вопрос о том, модифицируется ли метаболическая способность 129: Stat1-null MFP и влияет ли на это свойство измененный профиль цитокинов микроокружения. Безусловно, STAT1 имеет решающее значение для функции адипоцитов, где он опосредует регулируемый IFNγ липолиз в адипоцитах [56] и влияние простагландинов на их дифференцировку [57]. В то же время мы обнаружили, что как цитокиновый профиль, так и митогенная способность CM могут быть восстановлены экзогенным PDOM.Мы [32, 58] и другие [59] подчеркнули возможность конвергенции передачи сигналов P и PRL в MG, где P сам по себе может стимулировать развитие протоков в MG [60, 61], вероятно, за счет синергизма с IGF-1. 62]. В том же духе мы показали, что P и PRL синергически стимулируют пролиферацию эпителия молочных протоков мышей независимо от E [32]. Кроме того, известно, что и P, и PRL передают сигналы через STAT1 [46, 63], и как P, так и PRL могут влиять на активность жировой ткани и ее локальную продукцию цитокинов [64-66].Таким образом, развивающаяся гипотеза состоит в том, что у первородящих 129: Stat1-null MFP отсутствуют диффундирующие молекулы, такие как цитокины и/или жирные кислоты, которые необходимы для поддержания нормального роста и развития молочных желез, и что они локально опосредованы эндокринными сигналами во время протоков.
Безусловно, STAT1 имеет решающее значение для функции адипоцитов, где он опосредует регулируемый IFNγ липолиз в адипоцитах [56] и влияние простагландинов на их дифференцировку [57]. В то же время мы обнаружили, что как цитокиновый профиль, так и митогенная способность CM могут быть восстановлены экзогенным PDOM.Мы [32, 58] и другие [59] подчеркнули возможность конвергенции передачи сигналов P и PRL в MG, где P сам по себе может стимулировать развитие протоков в MG [60, 61], вероятно, за счет синергизма с IGF-1. 62]. В том же духе мы показали, что P и PRL синергически стимулируют пролиферацию эпителия молочных протоков мышей независимо от E [32]. Кроме того, известно, что и P, и PRL передают сигналы через STAT1 [46, 63], и как P, так и PRL могут влиять на активность жировой ткани и ее локальную продукцию цитокинов [64-66].Таким образом, развивающаяся гипотеза состоит в том, что у первородящих 129: Stat1-null MFP отсутствуют диффундирующие молекулы, такие как цитокины и/или жирные кислоты, которые необходимы для поддержания нормального роста и развития молочных желез, и что они локально опосредованы эндокринными сигналами во время протоков. удлинение. Необходимы дальнейшие исследования, чтобы проанализировать эту сложную гормональную, тканевую, клеточную и молекулярную среду, и они выходят за рамки данной статьи.
удлинение. Необходимы дальнейшие исследования, чтобы проанализировать эту сложную гормональную, тканевую, клеточную и молекулярную среду, и они выходят за рамки данной статьи.
Наконец, все эти факторы необходимо учитывать в любом исследовании онкогенеза у мышей с дефицитом STAT1, где наши данные показывают, что аберрантное развитие MG, направляемое микроокружением 129: Stat1-null , приводит к увеличению инициации опухоли.Поскольку у мышей 129: Stat1-null моделируется неопластическое развитие ER-положительных опухолей молочной железы в более позднем возрасте, эта модель требует дальнейшего внимания. Основная проблема будет заключаться в том, чтобы определить, как возникает неопластическая клетка и как она продолжает расти в относительно неблагоприятной для роста микросреде. На этой стадии маловероятно, что простая клеточно-автономная избыточная экспрессия генов, стимулирующих рост, может в достаточной степени объяснить неопластическую прогрессию.Загадка, которую еще предстоит решить, заключается в том, какие взаимодействия опухолевых клеток и микроокружения хозяина играют роль во время инициации опухоли по сравнению с ее прогрессированием.
Благодарности
Авторы выражают благодарность Чарльзу Л. Вилкерсону за техническую помощь в операциях на животных и трансплантации; Джудит Э. Уоллс по гистологии и иммуногистохимии; Жаклин Дитер и доктору Николь Баумгарт за помощь в проведении экспериментов по пересадке костного мозга; а также Райану Дэвису и Стефани Лю (общий ресурс Центра комплексной геномики UCD, отделение патологии и лабораторной медицины) за их экспертную техническую помощь в исследованиях микрочипов.
Авторские взносы
Идея и разработка экспериментов: JQC HM RDC RCH ADB. Выполнял эксперименты: JQC HM JFT JAE CGT BJW IHK RKR. Проанализированы данные: JQC HM RDC JFT RCH NEH JAE CGT BJW IHK RKR ADB. Предоставленные реагенты/материалы/инструменты для анализа: HM JFT RCH JAE CGT BJW IHK RKR SRC RDS. Написал статью: JQC HM RDC JFT RCH NEH CGT BJW IHK RKR SRC RDS ADB.
Каталожные номера
- 1.
Hovey RC, Aimo L. Разнообразная и активная роль адипоцитов в процессе роста и функционирования молочной железы.
 J Биол. неоплазия молочной железы. 2010;15(3):279–90. Эпублик 19.08.2010. пмид: 20717712; Центральный PMCID в PubMed: PMC2941079.
J Биол. неоплазия молочной железы. 2010;15(3):279–90. Эпублик 19.08.2010. пмид: 20717712; Центральный PMCID в PubMed: PMC2941079. - 2. Щедин П., Хови Р.С. От редакции: Строма молочной железы в нормальном развитии и функционировании. J Биол. неоплазия молочной железы. 2010;15(3):275–7. Эпублик 2010/09/09. пмид: 20824491; Центральный PMCID в PubMed: PMC2941044.
- 3. Невилл М.С., Медина Д., Монкс Дж., Хови Р.С. Жировой слой молочной железы. J Биол. неоплазия молочной железы. 1998;3(2):109–16. Эпублик 20 мая 2000 г.пмид:10819521.
- 4. Брукс КЛ. Молекулярные механизмы пролактина и его рецептора. Endocr Rev. 2012;33(4):504–25. Эпб 2012/05/12. doi: er.2011-1040 [pii] pmid:22577091; Центральный PMCID в PubMed: PMC3410225.
- 5.
Игначак А., Кастельник М., Слива Т., Корбут Р.А., Райда К., Гузик Т.Дж. Пролактин — не только лактотрофин. «Новый» взгляд на «старый» гормон. J Physiol Pharmacol. 2012;63(5):435–43. Эпублик 2012/12/06.
 пмид: 23211297.
пмид: 23211297. - 6. Харичаран С, Ли Ю.Передача сигналов STAT в дифференцировке молочной железы, выживании клеток и онкогенезе. Мол Селл Эндокринол. 2014;382(1):560–9. Эпб 2013/04/02. [пий]. пмид: 23541951; Центральный PMCID в PubMed: PMC3748257.
- 7. Хьюз К., Уотсон С.Дж. Спектр функций STAT в развитии молочной железы. ЯКСТАТ. 2012;1(3):151–8. Эпублик от 01.07.2012. [пий]. пмид: 24058764; Центральный PMCID в PubMed: PMC3670238.
- 8. Лю С., Робинсон Г.В., Вагнер К.У., Гарретт Л., Уиншоу-Борис А., Хеннигхаузен Л.Stat5a необходим для развития молочной железы и лактогенеза у взрослых. Гены Дев. 1997;11(2):179–86. Эпублик 15 января 1997 г. пмид:01.
- 9.
Теглунд С., Маккей С., Шутц Э., ван Дерсен Дж. М., Стравоподис Д., Ван Д. и другие. Белки Stat5a и Stat5b играют существенную и несущественную или избыточную роль в ответах цитокинов. Клетка. 1998;93(5):841–50. Эпб 1998/06/18. doi: S0092-8674(00)81444-0 [pii].
 пмид:9630227.
пмид:9630227. - 10. Чепмен Р.С., Лоуренко П.С., Тоннер Э., Флинт Д.Дж., Селберт С., Такеда К. и др.Подавление эпителиального апоптоза и замедленная инволюция молочной железы у мышей с условным нокаутом Stat3. Гены Дев. 1999;13(19):2604–16. Эпб 1999/10/16. пмид:10521404; Центральный PMCID в PubMed: PMC317074.
- 11. Khaled WT, Read EK, Nicholson SE, Baxter FO, Brennan AJ, Came PJ и др. Сигнальный путь IL-4/IL-13/Stat6 способствует развитию просветных эпителиальных клеток молочной железы. Разработка. 2007;134(15):2739–50. Эпб 2007/07/06. doi: dev.003194 [pii]10.1242/dev.003194.пмид: 17611223.
- 12. Чан С.Р., Верми В., Луо Дж., Лучини Л., Рикерт С., Фаулер А.М. и др. У мышей с дефицитом STAT1 спонтанно развиваются рецепторы эстрогена альфа-положительные люминальные карциномы молочной железы. Рак молочной железы Res. 2012;14(1):R16. Эпб 2012/01/24. doi: bcr3100 [pii] pmid:22264274; Центральный PMCID в PubMed: PMC3496133.
- 13.
 Klover PJ, Muller WJ, Robinson GW, Pfeiffer RM, Yamaji D, Hennighausen L. Потеря STAT1 из эпителия молочной железы мыши приводит к увеличению опухолевой нагрузки, вызванной Neu.Неоплазия. 2010;12(11):899–905. Эпублик 16.11.2010. 21076615; Центральный PMCID в PubMed: PMC2978912. пмид:21076615
Klover PJ, Muller WJ, Robinson GW, Pfeiffer RM, Yamaji D, Hennighausen L. Потеря STAT1 из эпителия молочной железы мыши приводит к увеличению опухолевой нагрузки, вызванной Neu.Неоплазия. 2010;12(11):899–905. Эпублик 16.11.2010. 21076615; Центральный PMCID в PubMed: PMC2978912. пмид:21076615 - 14. Raven JF, Williams V, Wang S, Tremblay ML, Muller WJ, Durbin JE, et al. Stat1 является супрессором ErbB2/Neu-опосредованной клеточной трансформации и образования опухоли молочной железы мыши. Клеточный цикл. 2011;10(5):794–804. Эпб 2011/02/12. doi: 14956 [pii]. пмид: 21311224.
- 15. Schneckenleithner C, Bago-Horvath Z, Dolznig H, Neugebauer N, Kollmann K, Kolbe T, et al.Торможение онкогенеза молочной железы: потеря STAT1 предрасполагает к интраэпителиальным неоплазиям. Онкотаргет. 2011;2(12):1043–54. Эпублик 22 декабря 2011 г. doi: 371 [pii]. пмид: 22185785; Центральный PMCID в PubMed: PMC3282066.
- 16.
Коромилас А.Е., Сексл В.
 Опухолесупрессорная функция STAT1 при раке молочной железы. ЯКСТАТ. 2013;2(2):e23353. Эпб 2013/09/24. [пий]. пмид: 24058806; Центральный PMCID в PubMed: PMC3710319.
Опухолесупрессорная функция STAT1 при раке молочной железы. ЯКСТАТ. 2013;2(2):e23353. Эпб 2013/09/24. [пий]. пмид: 24058806; Центральный PMCID в PubMed: PMC3710319. - 17. Мераз М.А., Уайт Дж.М., Шихан К.С., Бах Э.А., Родиг С.Дж., Диге А.С. и др.Направленное разрушение гена Stat1 у мышей обнаруживает неожиданную физиологическую специфичность сигнального пути JAK-STAT. Клетка. 1996;84(3):431–42. Эпб 1996/02/09. doi: S0092-8674(00)81288-X [pii]. пмид:8608597.
- 18. Боровский АД. Выбор мышиной модели: экспериментальная биология в контексте — полезность и ограничения мышиных моделей рака молочной железы. Колд Спринг Харб Перспект Биол. 2011;3(9):a009670. Эпб 2011/06/08. [pii]cshperspect.a009670 [pii]. пмид: 21646376; Центральный PMCID в PubMed: PMC3181037.
- 19.
Кардифф Р.Д., Моганаки Д., Дженсен Р.А. Генетически сконструированные мышиные модели внутриэпителиальной неоплазии молочных желез. J Биол. неоплазия молочной железы. 2000;5(4):421–37.
 пмид: 14973386.
пмид: 14973386. - 20. Кардифф Р.Д., Анвер М.Р., Бойвин Г.П., Бозенберг М.В., Маронпот Р.Р., Молиноло А.А. и соавт. Предрак у мышей: животные модели, используемые для понимания, предотвращения и лечения предраковых состояний человека. Токсикол патол. 2006;34(6):699–707. пмид: 17074738.
- 21. Фортин А., Абель Л., Казанова Дж. Л., Грос П.Генетика хозяина микобактериальных заболеваний у мышей и людей: перспективные генетические исследования БЦЖ-оза и туберкулеза. Annu Rev Genomics Hum Genet. 2007; 8: 163–92. Эпублик от 12 мая 2007 г. пмид: 17492906.
- 22. Веселый МД, Шрайбер РД. Иммуноредактирование рака: антигены, механизмы и значение для иммунотерапии рака. Энн Н.Ю. Академия наук. 2013; 1284:1–5. Эпб 2013/05/09. пмид: 23651186; Центральный PMCID в PubMed: PMC3648872.
- 23.
Мори Х., Боровски А.Д., Бхат Р., Гаджар С.М., Сейки М., Бисселл М.Дж.Лазерное сканирование на основе аутофлуоресценции / флуоресцентной визуализации тканей (LS-TAFI), новый метод анализа микроанатомии цельных тканей.
 Ам Джей Патол. 2012;180(6):2249–56. Эпублик 2012/05/01. [пий]. пмид: 22542846; Центральный PMCID в PubMed: PMC3378916.
Ам Джей Патол. 2012;180(6):2249–56. Эпублик 2012/05/01. [пий]. пмид: 22542846; Центральный PMCID в PubMed: PMC3378916. - 24. Ирисарри Р.А., Хоббс Б., Коллин Ф., Бизер-Барклай Ю.Д., Антонеллис К.Дж., Шерф У. и соавт. Исследование, нормализация и обобщение данных уровня зонда массива олигонуклеотидов высокой плотности. Биостатистика. 2003;4(2):249–64. Эпублик 20 августа 2003 г.[пий]. пмид:12925520.
- 25. Huang da W, Sherman BT, Tan Q, Collins JR, Alvord WG, Roayaei J, et al. Инструмент функциональной классификации генов DAVID: новый алгоритм, ориентированный на биологические модули, для функционального анализа больших списков генов. Геном биол. 2007;8(9):R183. Эпб 2007/09/06. doi: gb-2007-8-9-r183 [pii] pmid:17784955; Центральный PMCID в PubMed: PMC2375021.
- 26.
Бирт Т., Бишоп Дж., Карлин Дж.Б. Предвзятость, распространенность и каппа. Дж. Клин Эпидемиол. 1993;46(5):423–9.Эпб 1993/05/01. doi: 0895-4356(93)
-V [pii]. пмид:8501467.

- 27. Кинг Дж.Ю., Феррара Р., Табибиазар Р., Спин Дж.М., Чен М.М., Кучинский А. и соавт. Анализ путей коронарного атеросклероза. Физиол Геномика. 2005;23(1):103–18. Эпублик 2005/06/09. doi: 00101.2005 [pii] pmid: 15942018.
- 28. Деом К.Б., Фолкин Л.Дж. мл., Берн Х.А., Блэр П.Б. Развитие опухолей молочной железы из гиперпластических альвеолярных узелков, трансплантированных в жировые отложения молочной железы без желез самок мышей C3H.Рак рез. 1959; 19 (5): 515–20. Эпб 1959/06/01. пмид:13663040.
- 29. Оливер М.Х., Харрисон Н.К., Бишоп Дж.Е., Коул П.Дж., Лоран Г.Дж. Быстрый и удобный анализ для подсчета клеток, культивируемых в микролуночных планшетах: приложение для оценки факторов роста. Дж. Клеточные науки. 1989; 92 (часть 3): 513–8. Эпб 1989/03/01. пмид: 2592453.
- 30.
Кришхан В.В., Хан И.Х., Люцив П.А. Мультиплексные иммуноанализы с микрошариками с помощью проточной цитометрии для молекулярного профилирования: основные концепции и приложения протеомики.
 Критический обзор биотехнологий. 2009;29(1):29–43. Эпублик от 12.06.2009. пмид: 19514901.
Критический обзор биотехнологий. 2009;29(1):29–43. Эпублик от 12.06.2009. пмид: 19514901. - 31. Равиндран Р., Кришнан В.В., Ханум А., Люцив П.А., Хан И.Х. Поисковое исследование профилей иммуномодуляторов и антител в плазме у больных туберкулезом. Клин Вакцина Иммунол. 2013;20(8):1283–90. Эпб 2013/06/14. doi: CVI.00213-13 [pii] pmid:23761664; Центральный PMCID в PubMed: PMC3754529.
- 32. Hovey RC, Trott JF, Ginsburg E, Goldhar A, Sasaki MM, Fountain SJ и др. Транскрипционная и пространственно-временная регуляция мРНК рецептора пролактина и взаимодействие с функцией рецептора прогестерона во время роста протоковой ветви молочной железы.Дев Дин. 2001;222(2):192–205. Эпублик 23.10.2001. [pii] 10.1002 / dvdy.1179. пмид: 11668597.
- 33.
Satoh J, Tabunoki H. Всесторонний профиль генов-мишеней STAT1 на основе ChIP-Seq предполагает сложность механизмов регуляции генов, опосредованных STAT1. Джин Регул Сист Био. 2013;7:41–56. Эпб 2013/05/07.
 [пий]. пмид: 23645984; Центральный PMCID в PubMed: PMC3623615.
[пий]. пмид: 23645984; Центральный PMCID в PubMed: PMC3623615. - 34. Ли С.Х., Карреро Дж.А., Уппалури Р., Уайт Дж.М., Аршамбо Дж.М., Лай К.С. и др. Идентификация инициирующих событий ответов против Listeria с использованием мышей с условной потерей субъединицы 1 рецептора IFN-gamma (IFNGR1).Дж Иммунол. 2013;191(8):4223–34. Эпб 2013/09/21. doi: jimmunol.1300910 [pii]pmid:24048899; Центральный PMCID в PubMed: PMC3874833.
- 35. О’Салливан Т., Саддави-Конефка Р., Верми В., Кобель С.М., Артур С., Уайт Дж.М. и др. Иммуноредактирование рака врожденной иммунной системой при отсутствии адаптивного иммунитета. J Эксперт Мед. 2012; 209(10):1869–82. Эпб 2012/08/29. doi: jem.20112738 [pii] pmid:22927549; Центральный PMCID в PubMed: PMC3457735.
- 36.
Спат Г.Ф., Шлезингер П., Шрайбер Р., Беверли С.М.Новая роль Stat1 в подкислении фагосом и естественной устойчивости хозяина к внутриклеточной инфекции Leishmania major. PLoS Патог. 2009;5(4):e1000381.
 Эпублик 22.04.2009. пмид: 19381261; Центральный PMCID в PubMed: PMC2663844.
Эпублик 22.04.2009. пмид: 19381261; Центральный PMCID в PubMed: PMC2663844. - 37. Куссенс Л.М., Поллард Дж.В. Лейкоциты в развитии молочной железы и раке. Колд Спринг Харб Перспект Биол. 2011;3(3). Эпб 2010/12/03. [pii]cshperspect.a003285 [pii]. пмид: 21123394; Центральный PMCID в PubMed: PMC3039933.
- 38. Чан С.Р., Рикерт К.Г., Верми В., Шихан К.С., Артур С., Аллен Дж.А. и др.Нарушенный контроль STAT1-SOCS1 над JAK2 способствует выживанию клеток-предшественников просвета молочной железы и управляет онкогенезом ER-альфа. Смерть клеток 2013;21:234–46. Эпб 2013/09/17. [пий]. пмид: 24037089.
- 39. Кардифф Р.Д., Хаббард Н.Е., Энгельберг Дж.А., Манн Р.Дж., Миллер С.Х., Уоллс Дж.Е. и др. Количественная оценка морфологических и антигенных вариаций, вызванных фиксатором, при раке молочной железы у мышей и человека. Лаборатория Инвест. 2013;93(4):480–97. Эпублик 13.02.2013. doi: labinvest201310 [pii] pmid: 23399853.
- 40.Danielson KG, Oborn CJ, Durban EM, Butel JS, Medina D.
 Эпителиальная линия клеток молочной железы мыши, демонстрирующая нормальный морфогенез in vivo и функциональную дифференцировку in vitro. Proc Natl Acad Sci U S A. 1984;81(12):3756–60. Эпб 1984/06/01. пмид: 6587390; Центральный PMCID в PubMed: PMC345298.
Эпителиальная линия клеток молочной железы мыши, демонстрирующая нормальный морфогенез in vivo и функциональную дифференцировку in vitro. Proc Natl Acad Sci U S A. 1984;81(12):3756–60. Эпб 1984/06/01. пмид: 6587390; Центральный PMCID в PubMed: PMC345298. - 41. Hovey RC, MacKenzie DD, McFadden TB. Пролиферация эпителиальных клеток молочной железы мыши в ответ на специфические митогены модулируется жировой тканью молочной железы in vitro. In Vitro Cell Dev Biol Anim.1998;34(5):385–92. Эпб 1998/06/25. пмид:9639101.
- 42. Филп Дж. А., Бердон Т. Г., Уотсон С. Дж. Дифференциальная активация STAT 3 и 5 во время развития молочной железы. ФЭБС лат. 1996;396(1):77–80. Эпублик 28.10.1996. doi: 0014-5793(96)01069-1 [pii]. пмид:80.
- 43.
Дурбин Дж. Э., Хакенмиллер Р., Саймон М. С., Леви Д. Э. Направленное разрушение гена Stat1 мыши приводит к нарушению врожденного иммунитета к вирусным заболеваниям. Клетка. 1996;84(3):443–50. Эпб 1996/02/09.
 doi: S0092-8674(00)81289-1 [pii].пмид:8608598.
doi: S0092-8674(00)81289-1 [pii].пмид:8608598. - 44. DaSilva L, Rui H, Erwin RA, Howard OM, Kirken RA, Malabarba MG, et al. Пролактин рекрутирует STAT1, STAT3 и STAT5 независимо от консервативных рецепторных тирозинов TYR402, TYR479, TYR515 и TYR580. Мол Селл Эндокринол. 1996;117(2):131–40. Эпубликовано 25 марта 1996 г. doi: 0303720795037381 [pii]. пмид:8737372.
- 45. Дэвид М., Петрикоин Э.Ф. 3-й, Игараши К., Фельдман Г.М., Финблум Д.С., Ларнер А.С. Пролактин активирует регулируемый интерфероном фактор транскрипции p91 и киназу Jak2 путем фосфорилирования тирозина.Proc Natl Acad Sci U S A. 1994;91(15):7174–8. Эпб 1994/07/19. пмид:7518927; Центральный PMCID в PubMed: PMC44361.
- 46.
Wang Y, O’Neal KD, Yu-Lee L. Множественные цитоплазматические остатки рецептора пролактина (PRL) и Stat1 опосредуют передачу сигналов PRL к промотору регуляторного фактора-1 интерферона. Мол Эндокринол. 1997;11(9):1353–64. Эпб 1997/08/01. пмид:9259325.

- 47. Ингман В.В., Вайкофф Дж., Гуон-Эванс В., Кондилис Дж., Поллард Дж.В. Макрофаги способствуют фибриллогенезу коллагена вокруг концевых зачатков развивающейся молочной железы.Дев Дин. 2006;235(12):3222–9. Эпублик 10.10.2006. пмид:17029292.
- 48. Бейли С.Г., Крэгг М.С., Таунсенд П.А. Роль STAT1 в молочной железе. ЯКСТАТ. 2012;1(3):197–9. Эпублик от 01.07.2012. [пий]. пмид: 24058771; Центральный PMCID в PubMed: PMC3670245.
- 49. Данн ТБ. Морфология опухолей молочной железы у мышей. В: Homburger F, редактор. Физиопатология рака. Нью-Йорк: Пол Б. Хобер, Inc.; 1958. с. 38–84.
- 50. Рудманн Д., Кардифф Р., Шуинар Л., Гудман Д., Каттлер К., Марксфельд Х. и др.Пролиферативные и непролиферативные поражения молочной железы, Зимбаловой, препуциальной и клиторальной желез крыс и мышей. Токсикол патол. 2012;40(6 Приложение):7С–39С. Эпублик 01.11.2012. doi: 40/6_suppl/7S [pii] pmid:22949413.
- 51.
Сасс Б.
 , Данн Т.Б. Классификация опухолей молочной железы у мышей в различных группах Данна, включая недавно зарегистрированные типы. J Natl Cancer Inst. 1979; 62 (5): 1287–93. пмид:286104.
, Данн Т.Б. Классификация опухолей молочной железы у мышей в различных группах Данна, включая недавно зарегистрированные типы. J Natl Cancer Inst. 1979; 62 (5): 1287–93. пмид:286104. - 52. Puma JP, Fanning TG, Young LJ, Cardiff RD. Идентификация уникального вируса опухоли молочной железы мыши в линии мышей BALB/cNIV.Дж Вирол. 1982;43(1):158–65. пмид:6286994
- 53. Янг Л.Дж., ДеОме К.Б., Блэр П.Б., Пителька Д.Р., Кардифф Р.Д. Развитие и характеристика линии мышей BALB/cNIV. Рак рез. 1984;44(10):4333–6. пмид:6088036
- 54. Рознер А., Миёси К., Ландесман-Боллаг Э., Сюй Х., Селдин Д.К., Мозер А.Р. и др. Патология пути: гистологические различия между трансгенными опухолями молочной железы пути ErbB/Ras и Wnt. Ам Джей Патол. 2002;161(3):1087–97. Эпб 2002/09/06. doi: S0002-9440(10)64269-1 [pii]pmid:12213737; Центральный PMCID в PubMed: PMC1867237.
- 55.
Бек Дж. К., Хосик Х. Л., Уоткинс Б. А. Рост эпителия из преднеопластического нароста молочной железы в ответ на жировую ткань молочной железы.
 In Vitro Cell Dev Biol. 1989;25(5):409–18. Эпб 1989/05/01. пмид: 2732196.
In Vitro Cell Dev Biol. 1989;25(5):409–18. Эпб 1989/05/01. пмид: 2732196. - 56.
Xu D, Yin C, Wang S, Xiao Y. JAK-STAT в метаболизме липидов адипоцитов. ЯКСТАТ. 2013;2(4):e27203. Эпб 2014/02/06. [пий]. пмид: 24498541; Центральный PMCID в PubMed: PMC3
8.
- 57. Аннамалай Д., Клипстоун Н.А. Простагландин F2альфа ингибирует адипогенез через аутокринно-опосредованный интерлейкин-11/гликопротеин 130/STAT1-зависимый сигнальный каскад.Джей Селл Биохим. 2014;115(7):1308–21. Эпб 2014/02/13. пмид: 24519625.
- 58. Morabito JE, Trott JF, Korz DM, Fairfield HE, Buck SH, Hovey RC. 5′-дистальный палиндром внутри длинного терминального повтора вируса опухоли молочной железы мыши рекрутирует специфический для молочной железы комплекс и необходим для синергетического ответа на прогестерон плюс пролактин. Дж Мол Эндокринол. 2008;41(2):75–90. Эпублик 2008/06/06. doi: JME-08-0027 [pii] pmid: 18524869.
- 59.
Ли Х.Дж., Орманди К.
 Дж.Взаимодействие между прогестероном и пролактином в развитии молочной железы и последствия для рака молочной железы. Мол Селл Эндокринол. 2012;357(1–2):101–7. Эпб 2011/09/29. [пий]. пмид: 21945475.
Дж.Взаимодействие между прогестероном и пролактином в развитии молочной железы и последствия для рака молочной железы. Мол Селл Эндокринол. 2012;357(1–2):101–7. Эпб 2011/09/29. [пий]. пмид: 21945475. - 60. Aupperlee MD, Leipprandt JR, Bennett JM, Schwartz RC, Haslam SZ. Амфирегулин опосредует индуцированное прогестероном развитие молочных протоков в период полового созревания. Рак молочной железы Res. 2013;15(3):R44. Эпб 2013/05/28. [пий]. пмид: 23705924; Центральный PMCID в PubMed: PMC3738150.
- 61. Скарда Ю., Фремрова В., Безечны И.Только прогестерон отвечает за стимуляцию роста протоков и альвеолярных структур молочных желез у мышей. Эндокринол Эксп. 1989;23(1):17–28. Эпб 1989/03/01. пмид: 2714223.
- 62.
Руан В., Монако М.Э., Клейнберг Д.Л. Прогестерон стимулирует морфогенез протоков молочной железы путем синергизма с действием инсулиноподобного фактора роста-I и усиления его действия. Эндокринология. 2005;146(3):1170–8. Эпублик 18 декабря 2004 г.
 doi: en.2004-1360 [pii] pmid:15604210.
doi: en.2004-1360 [pii] pmid:15604210. - 63. Ричер Дж.К., Ланге К.А., Мэннинг Н.Г., Оуэн Г., Пауэлл Р., Хорвиц К.Б.Конвергенция прогестерона с фактором роста и передачей сигналов цитокинов при раке молочной железы. Рецепторы прогестерона регулируют преобразователи сигналов и активаторы экспрессии и активности транскрипции. Дж. Биол. Хим. 1998;273(47):31317–26. Эпублик 13 ноября 1998 г. пмид:9813040.
- 64. Brandebourg T, Hugo E, Ben-Jonathan N. Пролактин адипоцитов: регуляция высвобождения и предполагаемые функции. Сахарный диабет Ожирение Metab. 2007;9(4):464–76. Эпублик 2007/06/26. doi: DOM671 [pii] pmid: 17587388.
- 65.Карре Н., Бинар Н. Пролактин и жировая ткань. Биохимия. 2014;97:16–21. Эпублик 15.10.2013. [пий]. пмид: 24120689.
- 66.
Мантовани Г., Маччо А., Лай П., Масса Э., Гиани М., Сантона М.С. Участие цитокинов в раковой анорексии/кахексии: роль ацетата мегестрола и ацетата медроксипрогестерона в подавлении цитокинов и улучшении клинических симптомов.
 Критический преподобный Онког. 1998;9(2):99–106. Эпублик 11 февраля 1999 г. пмид:9973244.
Критический преподобный Онког. 1998;9(2):99–106. Эпублик 11 февраля 1999 г. пмид:9973244.
Беременность перепрограммирует эпигеном эпителиальных клеток молочной железы и блокирует развитие предраковых поражений
Характеристика индуцированного беременностью эпигенома молочной железы регионы переходят в активное регуляторное состояние после беременности
12 .Чтобы проверить эту гипотезу, мы картировали глобальную экспрессию генов (РНК-seq) выделенных FACS люминальных MEC у первородящих (до беременности) и рожавших (после беременности = 21 день беременности, 20 дней лактации, 60 дней после родов). инволюция лактации) самок мышей Balb/c, а также МЭК, полученных от самок мышей во время воздействия гормонов беременности (ГПБ). Для первой и второй временных точек EPH нерожавших или рожавших самок мышей лечили гормонами эстрогена и прогестерона с медленным высвобождением для краткосрочного воздействия (6 и 12 дней) (дополнительная рис. 1а). Эта процедура обеспечивает точное время воздействия гормона беременности на нерожавших и рожавших самок мышей и способствует гистологическим и эпигенетическим модификациям молочных желез, которые очень напоминают таковые у мышей, подвергшихся воздействию гормонов беременности после зачатия 12,24 .
1а). Эта процедура обеспечивает точное время воздействия гормона беременности на нерожавших и рожавших самок мышей и способствует гистологическим и эпигенетическим модификациям молочных желез, которые очень напоминают таковые у мышей, подвергшихся воздействию гормонов беременности после зачатия 12,24 . Неконтролируемый глобальный анализ экспрессии генов люминальных МЭК до и после беременности продемонстрировал в целом сходные программы транскрипции, предполагая, что цикл беременности не изменяет идентичность эпителия во время тканевого гомеостаза (рис.1а, б). Целенаправленный анализ генов, коррелирующих со статусом паритета MEC 25 , подтвердил активацию 38% генов, индуцированных паритетом, в просветных MEC после беременности (дополнительная рис. 1b). Люминальные MEC, собранные на ранних стадиях второго EPH (D6), сгруппированы вместе с MEC, собранными в более поздний момент времени во время первого EPH (D12), что позволяет предположить, что MEC после беременности активируют транскрипцию, индуцированную беременностью, раньше в ответ на повторное введение. воздействие сигналов беременности (рис. 1а, б).
воздействие сигналов беременности (рис. 1а, б).
a Тепловая карта распределения данных экспрессии генов, собранных из выделенных FACS люминальных MEC, полученных от самок мышей на нескольких стадиях развития. b Анализ основных компонентов наборов данных экспрессии генов из выделенных с помощью FACS люминальных MEC, полученных от самок мышей на нескольких стадиях развития. c Диаграмма Венна, демонстрирующая количество общих и эксклюзивных пиков h4K27ac ChIP-seq MEC, выделенных с помощью FACS, от самок мышей до беременности (синий кружок) и самок мышей после беременности (оранжевый кружок). d Отслеживание браузера генома, показывающее распределение пиков h4K27ac в различных циклах беременности для локуса Frzb. e Экспрессия генов, связанных с элементами, индуцированными четностью (PIE), согласно Log2FoldChange (дифференциальная экспрессия) в люминальных MEC, полученных от самок мышей во время первого и второго воздействия гормонов беременности (EPH). Прямоугольники указывают гены, активизировавшиеся во время второго воздействия гормонов беременности (Log2FoldChange > 2, красный). f , g Гистологические изображения, окрашенные H&E, и количественный анализ протоков молочных желез, трансплантированных CD1d+ MaSCs до беременности ( f , левая панель) или после беременности CD1d+ MaSCs ( g , правая панель), собранных на 6-й день воздействия гормона беременности (EPH). n = 3 молочных желез, которым вводили CD1d+ MaSCs до беременности, и n = 3 молочных железах, которым вводили CD1d+ MaSCs после беременности. * р = 0,04. Масштаб: 200 мкм. h , i Репрезентативные изображения и количественная оценка ветвления культуры органоидов молочной железы, полученных из MEC до и после беременности (мыши Balb/C), выращенных либо на основных средах, либо на полных средах (содержащих эстроген (E2), прогестерон (P4 ) и пролактин (Prol) n = 3 независимых биологических повтора.
Прямоугольники указывают гены, активизировавшиеся во время второго воздействия гормонов беременности (Log2FoldChange > 2, красный). f , g Гистологические изображения, окрашенные H&E, и количественный анализ протоков молочных желез, трансплантированных CD1d+ MaSCs до беременности ( f , левая панель) или после беременности CD1d+ MaSCs ( g , правая панель), собранных на 6-й день воздействия гормона беременности (EPH). n = 3 молочных желез, которым вводили CD1d+ MaSCs до беременности, и n = 3 молочных железах, которым вводили CD1d+ MaSCs после беременности. * р = 0,04. Масштаб: 200 мкм. h , i Репрезентативные изображения и количественная оценка ветвления культуры органоидов молочной железы, полученных из MEC до и после беременности (мыши Balb/C), выращенных либо на основных средах, либо на полных средах (содержащих эстроген (E2), прогестерон (P4 ) и пролактин (Prol) n = 3 независимых биологических повтора.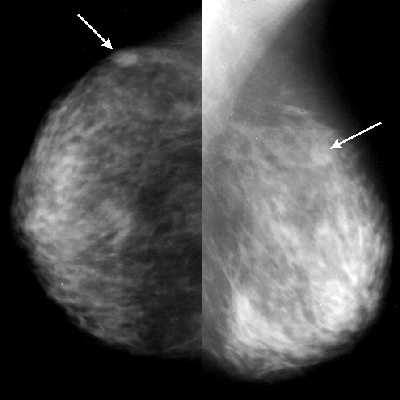 * p = 0,02 и ** p = 0,003. Масштаб: 200 мкм. j Иммунофлуоресцентные изображения культуры органоидов молочной железы, полученных из MEC до и после беременности, выращенных либо на основных средах, либо на полных средах, с визуализацией KRT8 (синий), KRT5 (красный) и CSN2 (зеленый). Масштаб: 100 мкм. Для всего анализа планки погрешностей указывают на стандартную ошибку среднего значения по образцам одной и той же экспериментальной группы. Значения p определяли с использованием теста Стьюдента t .
* p = 0,02 и ** p = 0,003. Масштаб: 200 мкм. j Иммунофлуоресцентные изображения культуры органоидов молочной железы, полученных из MEC до и после беременности, выращенных либо на основных средах, либо на полных средах, с визуализацией KRT8 (синий), KRT5 (красный) и CSN2 (зеленый). Масштаб: 100 мкм. Для всего анализа планки погрешностей указывают на стандартную ошибку среднего значения по образцам одной и той же экспериментальной группы. Значения p определяли с использованием теста Стьюдента t .
Чтобы определить, была ли эта реакция на повторное воздействие сигналов беременности связана с эпигенетическими изменениями, мы профилировали активную гистоновую метку h4K27ac в той же когорте люминальных МЭК, подвергнутых РНК-сек.Общий анализ пиков показал, что беременность значительно расширила активный регуляторный ландшафт люминальных МЭК, при этом МЭК после беременности показали приблизительно 10-кратное увеличение пиков h4K27ac ( n = 207 585), в отличие от МЭК до беременности ( n = 19 985) (рис.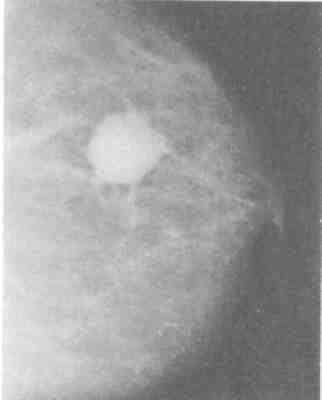 1с). Регуляторные области, исключающие MEC после беременности, показали 38-кратное усиление пиков h4K27ac в генных областях ( n = 145,917) и 53-кратное усиление в межгенных областях ( n = 45,174) по сравнению с теми же областями в MEC до беременности, предполагая, что изменения, вызванные беременностью, могут расширить спектр энхансеров MEC (дополнительная рис.1с). Генный онтологический анализ (термины GO) показал, что эксклюзивные области h4K27ac до беременности были расположены рядом с генами, кодирующими функции белка, связанные с миелоидной дифференцировкой, межклеточными соединениями и морфогенезом эпителиальных клеток, в то время как пики h4K27ac, эксклюзивные для MEC после беременности, были обогащены путями. участвует в регуляции метилирования гистона h4-K27, транскрипции в ответ на УФ-индуцированное повреждение ДНК и регуляции глюконеогенеза (дополнительная рис. 1d, e). Эти наблюдения позволяют предположить, что MEC до и после беременности могут регулировать различные молекулярные пути во время гомеостаза ткани молочной железы.
1с). Регуляторные области, исключающие MEC после беременности, показали 38-кратное усиление пиков h4K27ac в генных областях ( n = 145,917) и 53-кратное усиление в межгенных областях ( n = 45,174) по сравнению с теми же областями в MEC до беременности, предполагая, что изменения, вызванные беременностью, могут расширить спектр энхансеров MEC (дополнительная рис.1с). Генный онтологический анализ (термины GO) показал, что эксклюзивные области h4K27ac до беременности были расположены рядом с генами, кодирующими функции белка, связанные с миелоидной дифференцировкой, межклеточными соединениями и морфогенезом эпителиальных клеток, в то время как пики h4K27ac, эксклюзивные для MEC после беременности, были обогащены путями. участвует в регуляции метилирования гистона h4-K27, транскрипции в ответ на УФ-индуцированное повреждение ДНК и регуляции глюконеогенеза (дополнительная рис. 1d, e). Эти наблюдения позволяют предположить, что MEC до и после беременности могут регулировать различные молекулярные пути во время гомеостаза ткани молочной железы. Изменения ландшафта h4K27ac также были обнаружены в люминальных MEC во время беременности, что указывает на то, что сигналы беременности являются ключевыми индукторами этих энхансерных изменений, которые, как показывает наш анализ, стабильно сохраняются при последующих беременностях (рис. 1d и дополнительный рис. 1f)
Изменения ландшафта h4K27ac также были обнаружены в люминальных MEC во время беременности, что указывает на то, что сигналы беременности являются ключевыми индукторами этих энхансерных изменений, которые, как показывает наш анализ, стабильно сохраняются при последующих беременностях (рис. 1d и дополнительный рис. 1f)
отношения между пиками h4K27ac после беременности и их ролью в регуляции генов, опосредованной энхансером, мы использовали алгоритм ROSE для объединения близлежащих пиков, расположенных в генных и межгенных областях, и для определения областей-кандидатов-энхансеров/суперэнхансеров.Пики h4K27ac, эксклюзивные для MEC до беременности, определяют ~ 5000 энхансеров/суперэнхансеров, в отличие от ~ 60 000 энхансеров/суперэнхансеров, определяемых пиками h4K27ac, эксклюзивными для MEC после беременности (элементы, индуцированные паритетом, PIE), что согласуется с увеличением активной активности во время беременности. пейзаж усилителя (дополнительный рисунок 1g). Дальнейший анализ показал, что большинство PIE имеют метку h4K27ac в MEC, собранных как из первого, так и из второго EPH ( n = 2263), однако больше PIE (в 2 раза) были активны только во время второго EPH, что позволяет предположить, что такие элементы играют роль во время повторного воздействия гормонов беременности (дополнительный рис. 1ч).
1ч).
Кроме того, мы идентифицировали ~ 15 тыс. генов, связанных с PIE, которые мы использовали для понимания эффектов EPH и реактивации генов люминальных MEC. Более 600 генов, связанных с PIE, активировались в 16 раз или более в люминальных MEC, полученных от мышей во время второго EPH (Log2FoldChange > 4, красная рамка), по сравнению с клетками, собранными у мышей, подвергшихся воздействию во время первого EPH (рис. 1e). Эти активированные гены PIE были обогащены функциями, участвующими в производстве молока 26 , таким образом подтверждая, что индуцированный беременностью ландшафт энхансеров связан с активацией программ, связанных с беременностью, в ответ на повторное воздействие гормонов беременности.
Наш анализ всех МЭК просвета не исключает возможности того, что менее дифференцированные стволовые клетки молочной железы (MaSCs) и клетки-предшественники могут быть вовлечены в эпигенетическую память о беременности. Переходы во время циклов беременности могут также приводить к изменениям в микроокружении молочных желез, включая автономные и неавтономные регуляторные сигналы клеток для поддержания ответа МЭК на последовательные сигналы беременности.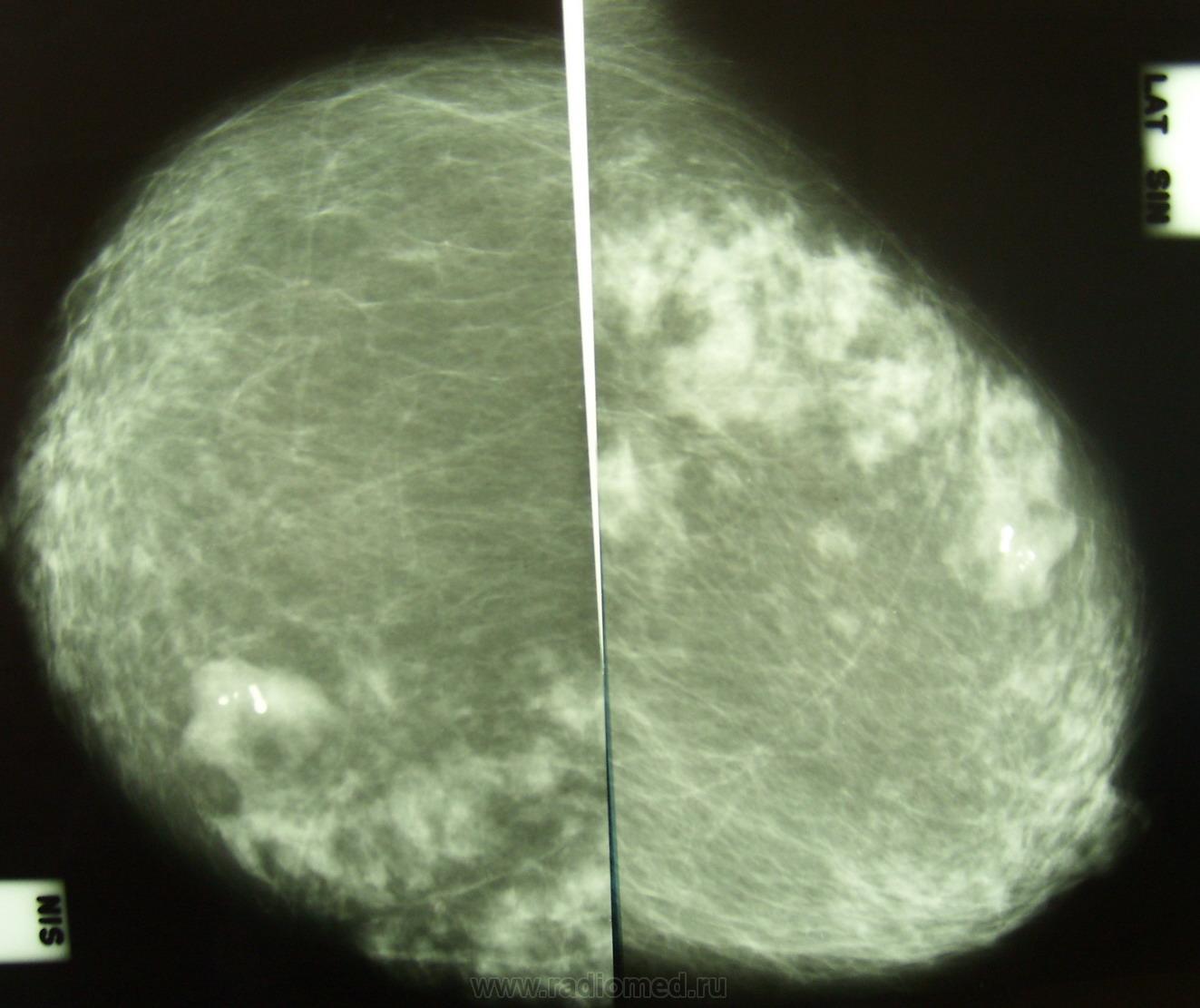 Чтобы проанализировать роль микроокружения в реакции MEC после беременности на гормоны беременности, мы использовали анализы трансплантации жировой ткани молочной железы.Очищенные жировые подушки от препубертатных, девственных самок мышей были трансплантированы либо до, либо после беременности CD1d+ MaSCs, которые обладают повышенной активностью восстановления молочной железы в трансплантатах жировых подушек 27 . Самки мышей-реципиентов (через 2 месяца после трансплантации) подвергались воздействию гормонов беременности в течение 6 дней с последующим гистологическим анализом их молочных желез (дополнительный рисунок 2a). Анализ диссоциированной и проточной цитометрии ткани молочной железы, трансплантированной MaSC до или после беременности, показал сопоставимые соотношения люминальных и миоэпителиальных клеток после приживления ткани, что позволяет предположить, что беременность не влияла на коммитацию клонов и дифференцировку трансплантированных MEC (дополнительная рис.2б).
Чтобы проанализировать роль микроокружения в реакции MEC после беременности на гормоны беременности, мы использовали анализы трансплантации жировой ткани молочной железы.Очищенные жировые подушки от препубертатных, девственных самок мышей были трансплантированы либо до, либо после беременности CD1d+ MaSCs, которые обладают повышенной активностью восстановления молочной железы в трансплантатах жировых подушек 27 . Самки мышей-реципиентов (через 2 месяца после трансплантации) подвергались воздействию гормонов беременности в течение 6 дней с последующим гистологическим анализом их молочных желез (дополнительный рисунок 2a). Анализ диссоциированной и проточной цитометрии ткани молочной железы, трансплантированной MaSC до или после беременности, показал сопоставимые соотношения люминальных и миоэпителиальных клеток после приживления ткани, что позволяет предположить, что беременность не влияла на коммитацию клонов и дифференцировку трансплантированных MEC (дополнительная рис.2б).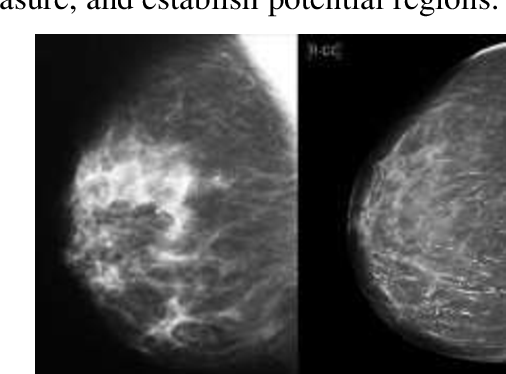 Гистология трансплантированных желез мышей во время ЭПГ показала, что трансплантация CD1d+ MaSC после беременности приводила к увеличению протоковых структур в 1,4 раза больше (668 ± 32), чем в железах, трансплантированных CD1d + MaSC до беременности (467 ± 18). — МЭК беременности сохраняют свою способность более устойчиво реагировать на сигналы беременности даже после трансплантации жировой ткани (рис. 1f, g).
Гистология трансплантированных желез мышей во время ЭПГ показала, что трансплантация CD1d+ MaSC после беременности приводила к увеличению протоковых структур в 1,4 раза больше (668 ± 32), чем в железах, трансплантированных CD1d + MaSC до беременности (467 ± 18). — МЭК беременности сохраняют свою способность более устойчиво реагировать на сигналы беременности даже после трансплантации жировой ткани (рис. 1f, g).
Усиление морфогенеза ветвления в ответ на повторное воздействие гормонов беременности также было воспроизведено в культурах молочных желез мышей in vitro.Органоиды молочной железы после беременности, культивированные с гормонами эстрогена, прогестерона и пролактина (полная среда), показали в 2,3 раза большее количество ветвящихся органоидов по сравнению с культурами до беременности (рис. 1h, i). Кроме того, дополнительный анализ продемонстрировал увеличение уровней мРНК Csn2 (в 10 раз) и повышение уровней белка CSN2 (примерно в 4 раза) в органоидах после беременности, культивируемых с гормонами беременности, по сравнению с органоидами, выращенными до беременности в тех же гормональных условиях. Инжир.1j, дополнительный рисунок 2c – d и дополнительная таблица 1). Учитывая, что Csn2 был среди генов, повышенных во время второй EPH (рис. 1e), наши результаты подтверждают, что клеточно-автономные сигналы контролируют фенотипические и молекулярные изменения в ответ на повторное воздействие гормонов беременности.
Инжир.1j, дополнительный рисунок 2c – d и дополнительная таблица 1). Учитывая, что Csn2 был среди генов, повышенных во время второй EPH (рис. 1e), наши результаты подтверждают, что клеточно-автономные сигналы контролируют фенотипические и молекулярные изменения в ответ на повторное воздействие гормонов беременности.
Беременность снижает частоту опухолей молочных желез в мышиных моделях онкогенеза молочных желез 17,20,21,22 . В некоторых из этих исследований использовались промоторы, специфичные для молочной железы, такие как MMTV и WAP-CRE, для управления экспрессией онкогена и развитием опухоли.Однако эти промоторы усиливаются сигналами, присутствующими во время беременности и лактации 28,29,30 , что потенциально маскирует эпигеномные и транскриптомные изменения, связанные с ранним онкогенезом и защитой, вызванной беременностью. Чтобы преодолеть эту проблему, мы использовали модель мыши со сверхэкспрессией cMYC с использованием промотора CAG, который не зависит от сигналов беременности/лактации, под контролем DOX (CAGMYC, дополнительная рис. 3a).
3a).
Нерожавшие самки мышей CAGMYC умерли после более чем 8 дней лечения DOX, что согласуется с тем, что длительная сверхэкспрессия cMYC вредна для здоровья животных 31 .Таким образом, для исследования онкогенеза, вызванного cMYC, у живых здоровых животных мы проанализировали молочные железы самок мышей CAGMYC через 2 (DD2) или 5 дней (DD5) лечения DOX. Лечение DOX индуцировало значительные гистопатологические изменения в молочной железе, включая уплощение структур протоков и умеренную (DD2) до тяжелой, диффузную (DD5) эпителиальную гиперплазию с атипией, изменения, часто наблюдаемые при предраковых поражениях молочной железы у мышей 32 (рис. 2а, правые панели). Ни одно из этих изменений не наблюдалось у контрольных трансгенных мышей, получавших только CAG (фиг.2а, левая панель). Анализ состава цитокератина у самок мышей CAGMYC выявил прогрессирующую экспансию клеток, экспрессирующих цитокератин 8 (KRT8), что является отличительной чертой просветоподобных клеток 33 , в ходе лечения DOX (рис. 2b). Этот фенотип сопровождался прогрессирующим истончением базальноподобных клеток (цитокератин 5, KRT5), часто наблюдаемым при гиперплазии ткани молочной железы (рис. 2б).
2b). Этот фенотип сопровождался прогрессирующим истончением базальноподобных клеток (цитокератин 5, KRT5), часто наблюдаемым при гиперплазии ткани молочной железы (рис. 2б).
a Окрашенные H&E изображения молочной железы только нерожавших мышей CAG и самок мышей CAGMYC, не получавших DOX (ND) и получавших DOX в течение 2 дней (DD2) и 5 дней (DD5). Масштаб: 200 мкм. b Иммунофлуоресцентные изображения молочных желез нерожавших самок мышей CAGMYC, не получавших ДОКС (ND) и получавших ДОКС в течение 2 (DD2) и 5 дней (DD5), визуализирующие DAPI (синий), KRT8 (зеленый), KRT5 (пурпурный) и cMYC (желтый). Масштаб: 100 мкм. c Анализ GSEA транскрипционных программ, обогащенных общим количеством MEC CAGMYC, полученных от нерожавших самок мышей, получавших DOX в течение 2 дней (DD2) и 5 дней (DD5).Нормализованная оценка обогащения NES.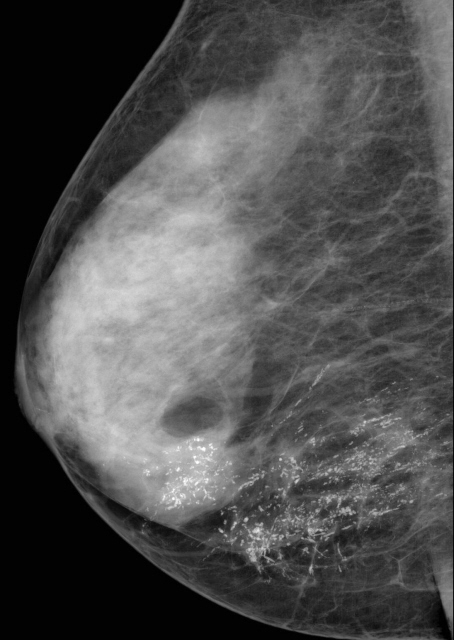 d Анализ основных компонентов уровней экспрессии генов из общих MEC CAGMYC, полученных от нерожавших самок мышей, получавших DOX, по сравнению с общедоступными наборами данных по экспрессии генов, полученными с использованием опухолевой ткани из моделей трансгенных мышей онкогенеза молочной железы. e Иммунофлюоресцентные изображения молочных желез нерожавших самок мышей CAGMYC, получавших DOX в течение 5 дней (DD5), визуализирующие DAPI (синий), ERα (пурпурный) и cMYC (желтый).Масштаб: 200 мкм. f График плотности, показывающий пиковую интенсивность h4K27ac при определяемых вычислением ДНК-связывающих мотивах e-box в MEC, полученных от нерожавших самок CAGMYC, получавших DOX в течение 2 дней (DD2) и 5 дней (DD5). g Отслеживание браузера генома, показывающее распределение пиков h4K27ac для геномных локусов Tbx3 и Repp5 в MEC WT и DD2 CAGMYC.
d Анализ основных компонентов уровней экспрессии генов из общих MEC CAGMYC, полученных от нерожавших самок мышей, получавших DOX, по сравнению с общедоступными наборами данных по экспрессии генов, полученными с использованием опухолевой ткани из моделей трансгенных мышей онкогенеза молочной железы. e Иммунофлюоресцентные изображения молочных желез нерожавших самок мышей CAGMYC, получавших DOX в течение 5 дней (DD5), визуализирующие DAPI (синий), ERα (пурпурный) и cMYC (желтый).Масштаб: 200 мкм. f График плотности, показывающий пиковую интенсивность h4K27ac при определяемых вычислением ДНК-связывающих мотивах e-box в MEC, полученных от нерожавших самок CAGMYC, получавших DOX в течение 2 дней (DD2) и 5 дней (DD5). g Отслеживание браузера генома, показывающее распределение пиков h4K27ac для геномных локусов Tbx3 и Repp5 в MEC WT и DD2 CAGMYC.
Учитывая, что опухоли молочной железы, вызванные cMYC, могут проявлять патологическую и транскрипционную гетерогенность, мы спросили, какие транскриптомные изменения были вызваны сверхэкспрессией cMYC во время установления предраковых поражений..jpg) Всего MEC CAGMYC выделяли из нерожавших мышей во время устойчивой сверхэкспрессии cMYC (DD2 и DD5) и анализировали с использованием секвенирования РНК. В MEC DD2 мы наблюдали обогащение путей, связанных с клеточным метаболизмом, таких как митохондриальная функция и сплайсинг генов, в отличие от путей, усиленно регулируемых в MEC DD5, которые связаны с контролем процессов клеточной коммуникации (рис. 2c). Эти результаты свидетельствуют о прогрессивном изменении программ транскрипции при сверхэкспрессии cMYC , что связано с начальными стадиями онкогенеза в молочных железах.Мы также использовали транскриптомный подход для классификации предраковых поражений CAGMYC в соответствии с классическими моделями онкогенеза молочной железы 34 . Мы обнаружили, что профили транскрипции MEC CAGMYC тесно сгруппированы с профилями люминоподобных опухолей молочной железы, включая модели MMTV-PyMT и MMTV-Myc (рис. 2d и дополнительная рис. 3b). Окрашивание тканей антителами против рецептора эстрогена альфа (ERα), маркера распространенных подтипов люминальных опухолей, продемонстрировало, что CAGMYC MEC включает злокачественные поражения с положительным окрашиванием ядер рецептора ERα, что подтверждает их люминоподобную классификацию (рис.
Всего MEC CAGMYC выделяли из нерожавших мышей во время устойчивой сверхэкспрессии cMYC (DD2 и DD5) и анализировали с использованием секвенирования РНК. В MEC DD2 мы наблюдали обогащение путей, связанных с клеточным метаболизмом, таких как митохондриальная функция и сплайсинг генов, в отличие от путей, усиленно регулируемых в MEC DD5, которые связаны с контролем процессов клеточной коммуникации (рис. 2c). Эти результаты свидетельствуют о прогрессивном изменении программ транскрипции при сверхэкспрессии cMYC , что связано с начальными стадиями онкогенеза в молочных железах.Мы также использовали транскриптомный подход для классификации предраковых поражений CAGMYC в соответствии с классическими моделями онкогенеза молочной железы 34 . Мы обнаружили, что профили транскрипции MEC CAGMYC тесно сгруппированы с профилями люминоподобных опухолей молочной железы, включая модели MMTV-PyMT и MMTV-Myc (рис. 2d и дополнительная рис. 3b). Окрашивание тканей антителами против рецептора эстрогена альфа (ERα), маркера распространенных подтипов люминальных опухолей, продемонстрировало, что CAGMYC MEC включает злокачественные поражения с положительным окрашиванием ядер рецептора ERα, что подтверждает их люминоподобную классификацию (рис. 2e и дополнительный рисунок 3c).
2e и дополнительный рисунок 3c).
Чтобы исследовать влияние кратковременной сверхэкспрессии cMYC на эпигеном MEC, мы нанесли на карту ландшафт активных энхансеров (h4K27ac ChIP-seq) всех MEC CAGMYC. Многие пики h4K27ac, присутствующие в MEC DD5 CAGMYC (96%), также присутствовали в MEC DD2 CAGMYC, что позволяет предположить, что развитие предраковых поражений молочных желез в значительной степени зависит от программ, активированных во время первоначального ответа на сверхэкспрессию cMYC (дополнительная рис.3г, д).
Делеция cMYC у мышей нарушила протоковый альвеолярный генез в период полового созревания и беременности, что указывает на его потребность в нормальном развитии молочной железы 35 . Таким образом, мы спросили, активирует ли сверхэкспрессия cMYC определенный набор регуляторных областей в MEC, подвергающихся предраковому развитию. Мы сосредоточились на усилении h4K27ac в областях генома, распознаваемых cMYC (e-boxes) 36 в ответ на сверхэкспрессию cMYC .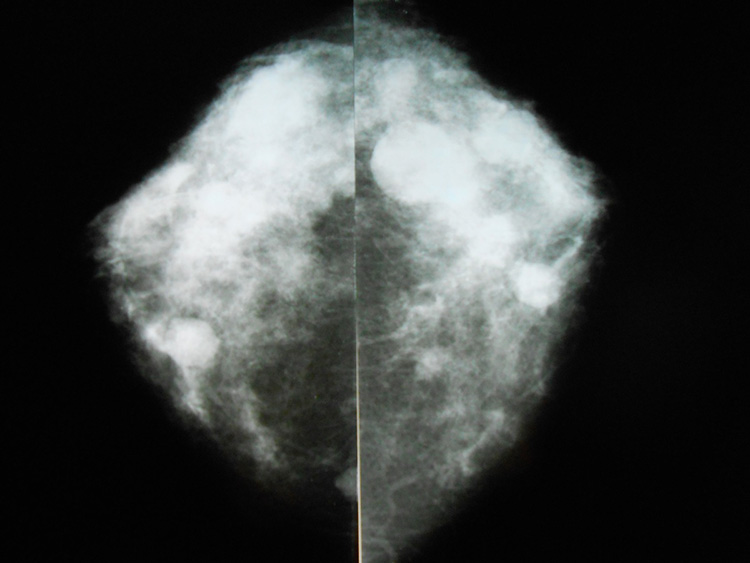 Примерно 4500 пиков h4K27ac были обнаружены в е-боксах в MEC дикого типа (WT), нетрансгенных MEC и в MEC CAGMYC, что позволяет предположить, что набор цис-регуляторных элементов активируется в MEC независимо от сверхэкспрессии cMYC (дополнительная рис. .3е). Напротив, мы обнаружили определенный набор e-боксов, которые приобрели пиковую интенсивность h4K27ac в ответ на сверхэкспрессию cMYC (рис. 2f). Треки браузера генома иллюстрируют повышенные уровни h4K27ac в MEC после индукции сверхэкспрессии cMYC в нижестоящих мишенях cMYC Tbx3 и Reep5, оба из которых участвуют в онкогенезе молочной железы 37,38 (рис. 2g). Таким образом, кратковременная сверхэкспрессия cMYC активирует специфические эпигеномные и транскрипционные сети и вызывает изменения морфологии ткани, напоминающие таковые при онкогенезе молочной железы мышей.
Примерно 4500 пиков h4K27ac были обнаружены в е-боксах в MEC дикого типа (WT), нетрансгенных MEC и в MEC CAGMYC, что позволяет предположить, что набор цис-регуляторных элементов активируется в MEC независимо от сверхэкспрессии cMYC (дополнительная рис. .3е). Напротив, мы обнаружили определенный набор e-боксов, которые приобрели пиковую интенсивность h4K27ac в ответ на сверхэкспрессию cMYC (рис. 2f). Треки браузера генома иллюстрируют повышенные уровни h4K27ac в MEC после индукции сверхэкспрессии cMYC в нижестоящих мишенях cMYC Tbx3 и Reep5, оба из которых участвуют в онкогенезе молочной железы 37,38 (рис. 2g). Таким образом, кратковременная сверхэкспрессия cMYC активирует специфические эпигеномные и транскрипционные сети и вызывает изменения морфологии ткани, напоминающие таковые при онкогенезе молочной железы мышей.
Влияние сверхэкспрессии
cMYC на MEC после беременности Чтобы исследовать влияние сверхэкспрессии cMYC на MEC после беременности, мы лечили родивших самок мышей CAGMYC с помощью DOX в течение 5 дней (дополнительная рис. 4a). Гистологический анализ показал, что в молочных железах нерожавших самок мышей содержание протоков в 3 раза выше, чем в молочных железах рожавших самок мышей CAGMYC, которые практически не страдали от сверхэкспрессии cMYC (рис.3а, б). В соответствии с этим, молочные железы рожавших самок мышей CAGMYC показали морфологию ткани и количество протоков (276 ± 42), аналогичные таковым у контрольной группы, получавшей DOX и получавшей только CAG (382 ± 4), подтверждая, что молочные железы после беременности сохранили в основном нормальный фенотип в ответ на сверхэкспрессию cMYC (дополнительная рис. 4b, c). Эти фенотипические различия не были вызваны неэффективной индукцией трансгена, поскольку MEC CAGMYC до и после беременности экспрессировали сопоставимые уровни мРНК cMYC и белков (рис.3c и дополнительный рисунок 4d).
4a). Гистологический анализ показал, что в молочных железах нерожавших самок мышей содержание протоков в 3 раза выше, чем в молочных железах рожавших самок мышей CAGMYC, которые практически не страдали от сверхэкспрессии cMYC (рис.3а, б). В соответствии с этим, молочные железы рожавших самок мышей CAGMYC показали морфологию ткани и количество протоков (276 ± 42), аналогичные таковым у контрольной группы, получавшей DOX и получавшей только CAG (382 ± 4), подтверждая, что молочные железы после беременности сохранили в основном нормальный фенотип в ответ на сверхэкспрессию cMYC (дополнительная рис. 4b, c). Эти фенотипические различия не были вызваны неэффективной индукцией трансгена, поскольку MEC CAGMYC до и после беременности экспрессировали сопоставимые уровни мРНК cMYC и белков (рис.3c и дополнительный рисунок 4d).
a , b Окрашенные H&E изображения и количественный анализ протоков молочных желез, взятых у нерожавших (правая панель) и рожавших (левая панель) самок мышей CAGMYC, получавших DOX в течение 5 дней (DD5). Масштаб: 200 мкм. n = 7 молочных желез до беременности (левая полоса) и n = 6 молочных желез после беременности (правая полоса). Столбцы указывают среднее количество каналов.* р = 0,0001. c Вестерн-блоттинг белка cMYC (62 кДа) в суммарных MEC CAGMYC до и после беременности, с обработкой DOX и без нее (5 дней). GAPDH (146 кДа) использовали в качестве эндогенного контроля. MM = молекулярный маркер. d , e Изображения молочных желез, окрашенных H&E, и количественный анализ протоков нерожавших контрольных мышей, получавших только CAG, которым трансплантировали CAGMYC CD1d+ MaSC до и/или после беременности и лечили DOX в течение 5 дней. Масштаб: 200 мкм. n = 4 молочных желез, которым вводили CD1d+ MaSCs до беременности, и n = 4 молочных железах, которым вводили CD1d+ MaSCs после беременности.Столбцы указывают среднее количество полных протоков (слева) и аномальных протоков (справа). нс незначительный. * р = 0,003.
Масштаб: 200 мкм. n = 7 молочных желез до беременности (левая полоса) и n = 6 молочных желез после беременности (правая полоса). Столбцы указывают среднее количество каналов.* р = 0,0001. c Вестерн-блоттинг белка cMYC (62 кДа) в суммарных MEC CAGMYC до и после беременности, с обработкой DOX и без нее (5 дней). GAPDH (146 кДа) использовали в качестве эндогенного контроля. MM = молекулярный маркер. d , e Изображения молочных желез, окрашенных H&E, и количественный анализ протоков нерожавших контрольных мышей, получавших только CAG, которым трансплантировали CAGMYC CD1d+ MaSC до и/или после беременности и лечили DOX в течение 5 дней. Масштаб: 200 мкм. n = 4 молочных желез, которым вводили CD1d+ MaSCs до беременности, и n = 4 молочных железах, которым вводили CD1d+ MaSCs после беременности.Столбцы указывают среднее количество полных протоков (слева) и аномальных протоков (справа). нс незначительный. * р = 0,003. f Иммунофлюоресцентные изображения молочных желез нерожавших контрольных мышей, получавших только CAG, которым трансплантировали CAGMYC MaSC до и после беременности и которым вводили DOX в течение 5 дней, визуализируя DAPI (синий), KRT8 (зеленый), KRT5 (пурпурный) и cMYC (желтый). Масштаб: 100 мкм. г Окрашенные H&E изображения молочных желез нерожавших контрольных мышей, получавших только CAG, которым трансплантировали CAGMYC CD1d+ MaSC до и/или после беременности и лечили DOX в течение 30 дней.Масштаб: 500 мкм. n = 4 молочных желез, которым вводили CD1d+ MaSCs до беременности, и n = 4 молочных железах, которым вводили CD1d+ MaSCs после беременности. h – j Репрезентативные изображения, количественная оценка ветвления и количественная оценка размера культуры органоидов молочной железы CAGMYC MEC до и после беременности, выращенных на основных средах, с DOX или без него (0,5 мкг/мл). Масштаб: 200 мкм. n = 2 независимых биологических повтора и три технических повтора на эксперимент.
f Иммунофлюоресцентные изображения молочных желез нерожавших контрольных мышей, получавших только CAG, которым трансплантировали CAGMYC MaSC до и после беременности и которым вводили DOX в течение 5 дней, визуализируя DAPI (синий), KRT8 (зеленый), KRT5 (пурпурный) и cMYC (желтый). Масштаб: 100 мкм. г Окрашенные H&E изображения молочных желез нерожавших контрольных мышей, получавших только CAG, которым трансплантировали CAGMYC CD1d+ MaSC до и/или после беременности и лечили DOX в течение 30 дней.Масштаб: 500 мкм. n = 4 молочных желез, которым вводили CD1d+ MaSCs до беременности, и n = 4 молочных железах, которым вводили CD1d+ MaSCs после беременности. h – j Репрезентативные изображения, количественная оценка ветвления и количественная оценка размера культуры органоидов молочной железы CAGMYC MEC до и после беременности, выращенных на основных средах, с DOX или без него (0,5 мкг/мл). Масштаб: 200 мкм. n = 2 независимых биологических повтора и три технических повтора на эксперимент. i * p < 0,00001. j n = 100 органоидов, * p < 0,00001. Для всего анализа планки погрешностей указывают на стандартную ошибку среднего значения по образцам одной и той же экспериментальной группы. Значения p определяли с использованием теста Стьюдента t .
i * p < 0,00001. j n = 100 органоидов, * p < 0,00001. Для всего анализа планки погрешностей указывают на стандартную ошибку среднего значения по образцам одной и той же экспериментальной группы. Значения p определяли с использованием теста Стьюдента t .
Чтобы выяснить, была ли резистентность к развитию предраковых поражений обусловлена клеточно-автономными или неавтономными механизмами, мы трансплантировали CAGMYC CD1d+ MaSC до и после беременности в жировые ткани нерожавших самок мышей, получавших только CAG, а затем Лечение DOX (дополнительный рис.4д). В ответ на сверхэкспрессию cMYC жировые ткани молочных желез, трансплантированные с помощью MEC CAGMYC до беременности, продемонстрировали тяжелую сложную эпителиальную гиперплазию с атипией и аномальной морфологией протоков, в отличие от жировых тканей, трансплантированных с помощью MEC CAGMYC после беременности, которые отображали в основном нормальную ткань.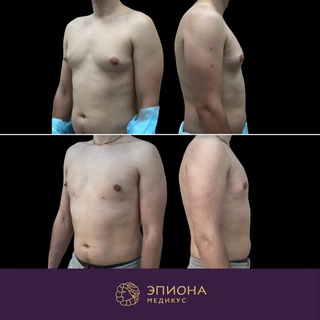 гистология и отсутствие аномальных структур протоков (рис. 3d, e). Не было никаких существенных различий в общем количестве протоков или уровнях белка cMYC в железах, трансплантированных до беременности (217 ± 49 протоков) или после беременности (140 ± 9 протоков) CAGMYC MEC, что позволяет предположить, что отсутствие аномальных кластеры протоков в состоянии после беременности не были артефактом, связанным с трансплантацией клеток cMYC со сверхэкспрессией (фиг.3д, е). Продление сверхэкспрессии cMYC до 30 дней (DD30) также не индуцировало развития предраковых поражений в молочных железах, трансплантированных с помощью CAGMYC CD1d+ MaSC после беременности, в отличие от желез, трансплантированных с CAGMYC CD1d+ MaSC до беременности, которые прогрессировали из эпителиальной гиперплазии. к недифференцированным карциномным поражениям (рис. 3g). В совокупности эти результаты согласуются с тем, что сверхэкспрессия cMYC менее эффективна в управлении злокачественной трансформацией MEC после беременности.
гистология и отсутствие аномальных структур протоков (рис. 3d, e). Не было никаких существенных различий в общем количестве протоков или уровнях белка cMYC в железах, трансплантированных до беременности (217 ± 49 протоков) или после беременности (140 ± 9 протоков) CAGMYC MEC, что позволяет предположить, что отсутствие аномальных кластеры протоков в состоянии после беременности не были артефактом, связанным с трансплантацией клеток cMYC со сверхэкспрессией (фиг.3д, е). Продление сверхэкспрессии cMYC до 30 дней (DD30) также не индуцировало развития предраковых поражений в молочных железах, трансплантированных с помощью CAGMYC CD1d+ MaSC после беременности, в отличие от желез, трансплантированных с CAGMYC CD1d+ MaSC до беременности, которые прогрессировали из эпителиальной гиперплазии. к недифференцированным карциномным поражениям (рис. 3g). В совокупности эти результаты согласуются с тем, что сверхэкспрессия cMYC менее эффективна в управлении злокачественной трансформацией MEC после беременности.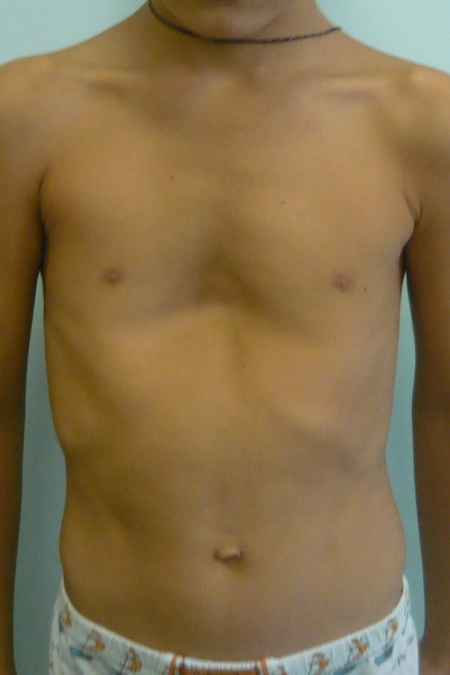
Чтобы выяснить, будет ли сохраняться клеточно-автономный фенотип CAGMYC MEC после беременности с уменьшенной гиперплазией в условиях роста in vitro, мы использовали культуры молочных органоидов. Анализ культур органоидов CAGMYC до и после беременности, подвергшихся воздействию повышающихся концентраций DOX, продемонстрировал аналогичную индукцию уровней белка cMYC (дополнительная рис. 4f, g). Морфологический анализ необработанных культур органоидов показал, что культуры органоидов CAGMYC до и после беременности демонстрируют схожую морфологию, при этом органоиды до беременности демонстрируют более высокую частоту нормального ветвления (39 органоидов, 35% от общего числа органоидов), чем органоиды после беременности (10). органоиды, 8% от общего числа органоидов), возможно, из-за различий в адаптации клеточных культур (рис.3h — левая панель, дополнительный рис. 4h).
Обработка DOX культур органоидов привела к аномальному разветвлению органоидов CAGMYC до беременности, отмеченному повышенной плотностью клеток в центре органоидов, фенотип в 7,9 раза (DD1) и 3,1 раза (DD2), уменьшенный в пост- органоиды CAGMYC беременности (рис. 3h, i). Органоиды CAGMYC до беременности также были в 2,9 раза больше, чем органоиды CAGMYC после беременности (рис. 3j), что еще раз подтверждает, что клеточно-автономные сигналы, присутствующие в MEC CAGMYC после беременности, влияют на развитие предраковых фенотипов в ответ на сверхэкспрессию cMYC . .
3h, i). Органоиды CAGMYC до беременности также были в 2,9 раза больше, чем органоиды CAGMYC после беременности (рис. 3j), что еще раз подтверждает, что клеточно-автономные сигналы, присутствующие в MEC CAGMYC после беременности, влияют на развитие предраковых фенотипов в ответ на сверхэкспрессию cMYC . .
MEC после беременности имеют ограниченный ответ на сверхэкспрессию
cMYC — беременность CAGMYC MEC (дополнительный рисунок 5a). Сверхэкспрессия cMYC не изменяет транскрипцию, специфичную для клона, поскольку люминальные и миоэпителиальные клетки после беременности группируются вместе с их аналогами до беременности (рис.4а). Анализ факторов, связанных с четностью (дополнительная рис. 1b), показал, что 19% и 23% этих генных сигнатур остаются активными в люминальных и миоэпителиальных CAGMYC MEC после беременности, соответственно, что позволяет предположить, что сигнатуры транскрипции, связанные с беременностью, существенно не изменяются под действием Сверхэкспрессия cMYC (дополнительный рисунок 5b, c). Рис. 4: МЭК после беременности имеют ограниченный ответ на сверхэкспрессию cMYC .
Рис. 4: МЭК после беременности имеют ограниченный ответ на сверхэкспрессию cMYC . a Иерархическая кластеризация экспрессии генов обработанных DOX (DD5), FACS-изолированных, CAGMYC MEC до и после беременности. b Анализ GSEA генных сетей со сниженной экспрессией в обработанных DOX, изолированных FACS, CAGMYC MEC до и после беременности. Нормализованная оценка обогащения NES. c , d Усредненная интенсивность h4K27ac в ( c ) промоторных областях или ( d ) элементах, индуцированных паритетом (PIE) изолированных с помощью FACS, WT и CAGMYC MEC, изолированных до и после беременности (DD5). Столбики погрешностей представляют изменение интенсивности h4K27ac в анализируемых областях. Центральная линия представляет собой медиану набора данных.Границы прямоугольника представляют собой 25-й (нижняя граница) и 75-й процентиль (верхняя граница). Усы представляют минимум и максимум данных, не являющихся выбросами. e График плотности, показывающий определенные с помощью вычислений мотивы связывания ДНК e-box с высокой пиковой интенсивностью ATAC-seq в CAGMYC до беременности (DD5) по сравнению с пиковой интенсивностью ATAC-seq в том же сайте связывания ДНК e-box в CAGMYC после беременности МЭК (DD5). f Анализ обогащения пиков cMYC Cut&Run, демонстрирующий обогащение пиков (красный) или обеднение (синий) в MEC CAGMYC после беременности (DD5). p Значение = 0,05 или ниже. г Отслеживание браузера генома, показывающее занятость cMYC в CAGMYC MEC, обработанных DOX, до и после беременности. ч Вестерн-блот белков cMYC, p300 и ацетил-p300 в органоидных культурах, полученных из MEC CAGMYC до и после беременности, с обработкой DOX и без нее (2 дня). Уровни белка винкулина использовали в качестве эндогенного контроля. MM = молекулярный маркер. i Количество разветвленных органоидов из культур органоидов CAGMYC MECs до и после беременности, выращенных на основных средах и DOX (2 дня, 0.
e График плотности, показывающий определенные с помощью вычислений мотивы связывания ДНК e-box с высокой пиковой интенсивностью ATAC-seq в CAGMYC до беременности (DD5) по сравнению с пиковой интенсивностью ATAC-seq в том же сайте связывания ДНК e-box в CAGMYC после беременности МЭК (DD5). f Анализ обогащения пиков cMYC Cut&Run, демонстрирующий обогащение пиков (красный) или обеднение (синий) в MEC CAGMYC после беременности (DD5). p Значение = 0,05 или ниже. г Отслеживание браузера генома, показывающее занятость cMYC в CAGMYC MEC, обработанных DOX, до и после беременности. ч Вестерн-блот белков cMYC, p300 и ацетил-p300 в органоидных культурах, полученных из MEC CAGMYC до и после беременности, с обработкой DOX и без нее (2 дня). Уровни белка винкулина использовали в качестве эндогенного контроля. MM = молекулярный маркер. i Количество разветвленных органоидов из культур органоидов CAGMYC MECs до и после беременности, выращенных на основных средах и DOX (2 дня, 0. 5 мкг/мл), с ингибиторами гистон-ацетилтрансферазы и без них (HATi = HAT Inhibitor II 10 мкМ и PU139 20 мкМ). n = 30 органоидов, * p = 0,0001; нс = отсутствие статистически значимых различий. j Количественная оценка размера органоидов молочной железы CAGMYC до и после беременности, выращенных на основных средах и DOX (5 дней, 0,5 мг/мл), с ингибитором cMYC и без него (cMYCi = ингибитор cMyc (10058-F4) 10 мкМ) . n = 30 органоидов, * p = 0,0006; ** р = 0.002. Для всех анализов планки погрешностей указывают стандартную ошибку среднего значения по образцам одной и той же экспериментальной группы. Значения p определяли с использованием теста Стьюдента t .
5 мкг/мл), с ингибиторами гистон-ацетилтрансферазы и без них (HATi = HAT Inhibitor II 10 мкМ и PU139 20 мкМ). n = 30 органоидов, * p = 0,0001; нс = отсутствие статистически значимых различий. j Количественная оценка размера органоидов молочной железы CAGMYC до и после беременности, выращенных на основных средах и DOX (5 дней, 0,5 мг/мл), с ингибитором cMYC и без него (cMYCi = ингибитор cMyc (10058-F4) 10 мкМ) . n = 30 органоидов, * p = 0,0006; ** р = 0.002. Для всех анализов планки погрешностей указывают стандартную ошибку среднего значения по образцам одной и той же экспериментальной группы. Значения p определяли с использованием теста Стьюдента t .
Непредвзятый дифференциальный анализ экспрессии генов продемонстрировал снижение экспрессии генов-мишеней cMYC и генов, связанных с реакцией на эстроген в MEC CAGMYC после беременности (рис. 4b). Сравнение уровней экспрессии cMYC-ассоциированных генов в люминальных MEC CAGMYC с уровнями в WT, нетрансгенных люминальных MEC, выявило повышенные уровни мРНК в MEC CAGMYC как до, так и после беременности (Log2FoldChange >1), демонстрируя, что cMYC сверхэкспрессия была успешно индуцирована в обоих условиях (дополнительная рис. 5г, левая панель). Однако уровни экспрессии генов, индуцированной cMYC, были примерно в 2 раза выше в MEC CAGMYC до беременности по сравнению с MEC CAGMYC после беременности (дополнительный рисунок 5d), подтверждая, что сверхэкспрессия cMYC менее эффективна при активации программ транскрипции. в МЭК, подвергшихся полному циклу беременности.
5г, левая панель). Однако уровни экспрессии генов, индуцированной cMYC, были примерно в 2 раза выше в MEC CAGMYC до беременности по сравнению с MEC CAGMYC после беременности (дополнительный рисунок 5d), подтверждая, что сверхэкспрессия cMYC менее эффективна при активации программ транскрипции. в МЭК, подвергшихся полному циклу беременности.
Затем мы сравнили эффекты сверхэкспрессии cMYC на активный (h4K27ac) регуляторный ландшафт всех CAGMYC MEC до и после беременности. Сверхэкспрессия cMYC индуцировала 6-кратное увеличение интенсивности сигнала h4K27ac в промоторных областях в MEC CAGMYC до беременности по сравнению с промоторными областями в MEC WT до беременности (рис. 4c). И наоборот, эффект сверхэкспрессии cMYC на промоторные области был не таким сильным в MEC CAGMYC после беременности, которые демонстрировали в 3 раза меньшую интенсивность сигнала h4K27ac по сравнению с MEC CAGMYC до беременности (рис. 4c). Этот дифференциальный ответ на сверхэкспрессию cMYC также отражался на общем количестве обнаруженных пиков h4K27ac, при этом 26% ( n = 890) соответствовали промоторным областям до беременности по сравнению с 6% ( n = 295) промоторных областей в MEC CAGMYC после беременности (дополнительная рис. 5д). И наоборот, больший процент пиков h4K27ac из MEC CAGMYC после беременности, картированных в генных областях (80%), по сравнению с MEC CAGMYC до беременности (60%), согласуется с индуцированной беременностью экспансией предполагаемых цис-регуляторных областей в MEC. рис. 1), который не был существенно изменен сверхэкспрессией cMYC (дополнительный рисунок 5e). Анализ уровней интенсивности h4K27ac при PIE продемонстрировал сохранение высоких уровней h4K27ac, индуцированных паритетом, в MEC CAGMYC после беременности, что указывает на то, что сверхэкспрессия cMYC не нарушала эпигеномные сигнатуры, индуцированные беременностью (рис.4г).
5д). И наоборот, больший процент пиков h4K27ac из MEC CAGMYC после беременности, картированных в генных областях (80%), по сравнению с MEC CAGMYC до беременности (60%), согласуется с индуцированной беременностью экспансией предполагаемых цис-регуляторных областей в MEC. рис. 1), который не был существенно изменен сверхэкспрессией cMYC (дополнительный рисунок 5e). Анализ уровней интенсивности h4K27ac при PIE продемонстрировал сохранение высоких уровней h4K27ac, индуцированных паритетом, в MEC CAGMYC после беременности, что указывает на то, что сверхэкспрессия cMYC не нарушала эпигеномные сигнатуры, индуцированные беременностью (рис.4г).
Затем мы спросили, будут ли сигналы h4K27ac дифференциально обогащены мотивами ДНК e-box в CAGMYC MEC до и после беременности. MEC CAGMYC после беременности демонстрировали более слабую пиковую интенсивность h4K27ac в электронных блоках (~ 4000 областей) в ответ на сверхэкспрессию cMYC по сравнению с MEC CAGMYC до беременности (дополнительный рисунок 5f). В соответствии с этим анализ доступности хроматина (ATAC-seq) продемонстрировал снижение доступного хроматина в областях e-box в MEC CAGMYC после беременности (рис.4д). Дополнительный анализ доступности хроматина выявил дискретное количество энхансерных областей, исключительных для MEC CAGMYC после беременности ( n = 3248 пиков ATAC-seq), которые были связаны с биологическими процессами, контролируемыми сигналами беременности (дополнительный рисунок 5g, h), далее подтверждая, что транскриптом и эпигеном CAGMYC MECs после беременности существенно не изменяются сверхэкспрессией cMYC .
В соответствии с этим анализ доступности хроматина (ATAC-seq) продемонстрировал снижение доступного хроматина в областях e-box в MEC CAGMYC после беременности (рис.4д). Дополнительный анализ доступности хроматина выявил дискретное количество энхансерных областей, исключительных для MEC CAGMYC после беременности ( n = 3248 пиков ATAC-seq), которые были связаны с биологическими процессами, контролируемыми сигналами беременности (дополнительный рисунок 5g, h), далее подтверждая, что транскриптом и эпигеном CAGMYC MECs после беременности существенно не изменяются сверхэкспрессией cMYC .
Чтобы сравнить изменения уровней h4K27ac с занятостью ДНК cMYC, мы проанализировали ген Epha2, который кодирует киназу рецептора тирозина, экспрессируемую в опухолях молочной железы 39 , и обнаружили, что он демонстрирует снижение интенсивности h4K27ac в ответ на сверхэкспрессию cMYC в MEC CAGMYC после беременности (дополнительный рис.6а). ChIP-qPCR генов Epha2 и Tbx3 (дополнительный рисунок 3f) выявил примерно в 3 раза более высокую занятость ДНК cMYC в CAGMYC MEC до беременности, что еще раз подтверждает, что cMYC менее эффективно связывается с хроматином в этих областях генома после беременности.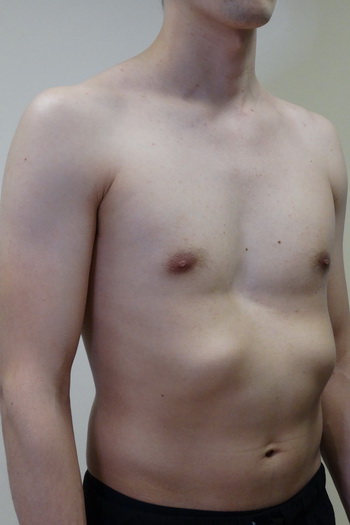 CAGMYC MEC (дополнительная таблица 2 и дополнительный рис. 6b, c).
CAGMYC MEC (дополнительная таблица 2 и дополнительный рис. 6b, c).
Для анализа полногеномного распределения занятости cMYC-хроматина в MEC CAGMYC до и после беременности мы использовали расщепление под мишенями и высвобождение с использованием нуклеазы (Cut&Run).Непредвзятый анализ ДНК-мотивов фактора транскрипции (TF) выявил обогащение мотивов e-box в пределах пиков хроматина, ко-иммунопреципитированных с cMYC, что свидетельствует о соответствии между наблюдаемыми областями занятости cMYC-хроматина (пики cMYC) и мотивами ДНК, распознаваемыми cMYC ( Дополнительная таблица 3). Дифференциальный анализ пиков Cut&Run выявил примерно 3-кратное снижение пиков cMYC в MEC CAGMYC после беременности ( n = 337 областей) по сравнению с пиками, обнаруженными в MEC CAGMYC до беременности ( n = 1127 областей), подтверждая, что Сверхэкспрессия cMYC менее эффективна в изменении эпигенома CAGMYC MEC после беременности (рис.4е). Анализ GO пиков cMYC, обогащенных MEC CAGMYC до беременности, продемонстрировал связь с путями, которые регулируют активность рецептора инсулина, процесс, регулируемый cMYC во время клеточной злокачественной трансформации 40 (дополнительная рис. 6d). Пики cMYC, обогащенные MEC CAGMYC после беременности, были связаны с генами, которые способствуют снижению онкогенеза и аутофагии 41 (дополнительные рис. 6e, f и рис. 4g). Анализ экспрессии генов, связанных с аутофагией и старением, побочным продуктом процессов аутофагии 42 , подтвердил их активацию в MEC CAGMYC после беременности (дополнительная рис.6г, з). В частности, мы обнаружили повышенные уровни мРНК гена-супрессора опухоли Ecrg4, фактора, подавляющего активность в ткани рака молочной железы 43 , в MEC CAGMYC после беременности (~6 Log2FoldChange), а также подавление мРНК Bcl2L12 и Tbx3, факторов, низкая экспрессия которых коррелирует с состоянием, подобным старению 44,45 .
Дальнейший анализ, чтобы определить, приводит ли сверхэкспрессия cMYC к фенотипу, подобному старению, продемонстрировал, что DOX-обработанные органоиды CAGMYC после беременности экспрессируют сниженные уровни белка STAT3, подавление которого вызывает преждевременное старение 46 , и повышенные уровни белка р53, главного регулятора старения 47 (дополнительная рис.6и). Мы также обнаружили снижение уровней белков р300 и ацетил р300, особенно в органоидах, полученных из МЭК CAGMYC после беременности, гистон-ацетилтрансферазы, ответственной за катализ h4K27ac, и экспрессируемых на низких уровнях в стареющих клетках 48 , что указывает на то, что паритет может повышать чувствительность МЭК к cMYC-индуцированное состояние предстарения (рис. 4h).
Расширение ландшафта h4K27ac, вызванное беременностью, контролирует развитие тканей в ответ на сигналы беременности, а также может играть роль в регуляции аутофагии и старения, таким образом, вмешиваясь в фенотипы cMYC , управляемые сверхэкспрессией, связанные со злокачественной трансформацией MEC.Более того, недавно было показано, что нокдаун остаточных уровней p300 в стареющих клетках подавляет экспрессию связанных со старением генов, тем самым возвращая их старческое состояние 49 . Чтобы проверить идею о том, что MEC CAGMYC после беременности могут автономно противостоять возмущению онкогенных программ, управляемых cMYC, в зависимости от p300 / старения, мы обрабатывали культуры органоидов CAGMYC низкомолекулярными ингибиторами, которые блокируют p300-гистон ацетилтрансферазу. Обработка органоидов ингибиторами PU139 и HATi приводила к 2.6-кратное и 2,4-кратное увеличение аномального ветвления в культурах органоидов CAGMYC после беременности, что позволяет предположить, что ингибирование p300 усиливало неблагоприятные фенотипические изменения в ответ на сверхэкспрессию cMYC (рис. 4i и дополнительная рис. 6j). Эти изменения не зависели от блокирования активности cMYC, учитывая, что органоиды CAGMYC до беременности оставались в 2,9 раза больше, чем органоиды, полученные из MEC CAGMYC после беременности, после лечения ингибитором cMYC (cMYCi) (рис. 4j и дополнительная рис.6k), тем самым подтверждая, что специфические возмущения CAGMYC MEC после беременности могут возвращать их способность реагировать на сверхэкспрессию cMYC и участвовать в злокачественной трансформации.
Дополнительный ниппель | ДермНет NZ
Автор: Кевин Женг, студент-медик Оклендского университета, Новая Зеландия; Главный редактор: д-р Аманда Окли, дерматолог, Гамильтон, Новая Зеландия, август 2015 г.
.Что такое нештатная соска?
Нештатный сосок — это незначительный порок развития ткани молочной железы, приводящий к образованию лишнего соска(ов) и/или ассоциированной ткани.Он также известен как добавочный сосок, эктопический сосок или дополнительный сосок.
Дополнительный сосок отличается от:
- Полителия, которая представляет собой наличие дополнительных сосков без добавочной железистой ткани
- Дополнительные или дополнительные груди, которые могут иметь или не иметь сосков.
Дополнительные соски являются врожденными и обычно безвредны. Однако они подвержены влиянию гормонов и восприимчивы к другим болезненным процессам.
Кто получает сверхштатную соску?
Дополнительные соски или молочные железы встречаются у 6% населения.Они представляют собой либо изолированные находки, либо признаки генетических синдромов. К ним относятся:
Были некоторые сообщения о повышенном риске аномалий мочевыводящих путей у пациентов с нештатными сосками, хотя это оспаривается.
Большинство изолированных случаев нештатных сосков являются спорадическими, однако примерно в 6% зарегистрированных случаев они являются семейными. Они демонстрируют аутосомно-доминантный тип наследования с неполной пенетрантностью.
Эмбриогенез сверхштатного соска
Сверхштатный сосок формируется на ранней стадии развития эмбриона.
Неделя 4
Молочные гребни формируются из утолщающихся полосок эктодермы — это «молочные линии», идущие от подмышечной впадины к паху.
Неделя 6
Зачатки молочных желез развиваются в результате разрастания эпидермиса с гребней.
8-я неделя
Отсутствие регрессии молочных желез приводит к образованию дополнительного соска.
Дополнительные соски обычно встречаются в любом месте вдоль двух вертикальных молочных путей, которые берут начало в подмышечной впадине, спускаются через область, где обычно располагаются соски, и заканчиваются в паху.Около 5% сверхкомплектных сосков формируются вне молочных линий на коже шеи, спины, вульвы или бедра.
Каковы клинические признаки нештатного соска?
Нештатный сосок присутствует при рождении. Часто он похож на врожденный органоидный или меланоцитарный невус. Большинство сверхштатных сосков намного меньше нормальных ареолы и соска. Они могут быть одиночными или множественными, возникающими на одной или обеих сосковых линиях.
Они могут быть розовыми или коричневыми, и по крайней мере центральный сосок возвышается над поверхностью кожи.Может быть центральная ямочка. В период полового созревания на дополнительных сосках могут появиться заметные волосы.
Если дополнительный сосок содержит железистую ткань, он может увеличиваться в период полового созревания, набухать и становиться болезненным перед менструацией, а также подвергаться лактации.
Дополнительный ниппель
Просмотреть больше изображений нештатной соски …
Как диагностируется нештатная соска?
Инструментом клинической классификации является внештатная классификация сосков Kajava (1915).
- Полный дополнительный сосок – сосок, ареола и железистая ткань молочной железы
- Дополнительный сосок – Сосок и железистая ткань (без ареолы)
- Дополнительный сосок – ареола и железистая ткань (без соска)
- Только аберрантная железистая ткань
- Дополнительный сосок – сосок, ареола и псевдомамма (жировая ткань, замещающая железистую ткань)
- Дополнительный ниппель – только ниппель (наиболее распространенный дополнительный ниппель)
- Дополнительный сосок – только ареолы (polythelia areolaris)
- Только пучок волос (polythelia pilosa)
Гистология дает окончательный диагноз, так как напоминает нормальный сосок:
- Утолщение эпидермиса
- Легкий папилломатоз и базальная гиперпигментация
- Сально-волосяные структуры
- Гладкая мускулатура
- Грудные протоки
- Иногда наличие подлежащей ткани молочной железы
Как лечить лишнюю соску?
Обычно лечение не требуется.

 Вместе с тем могут отсутствовать и сами железы.
Вместе с тем могут отсутствовать и сами железы.

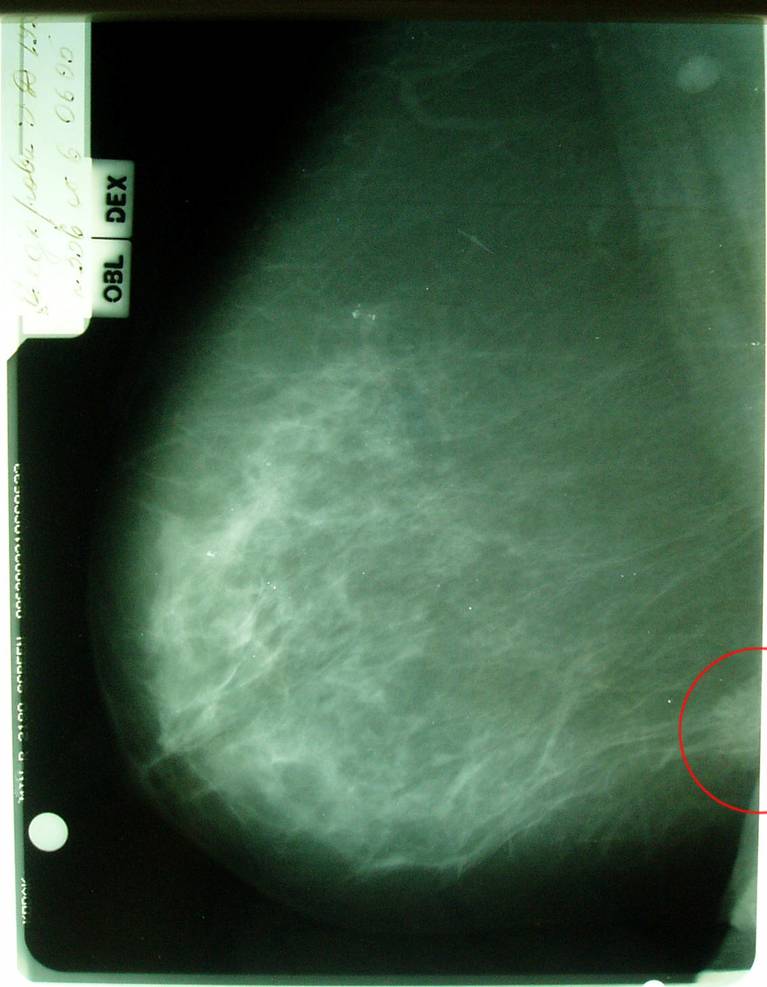
 Такие кровотечения возникают в промежутках между менструациями. Метроррагия также опасна развитием анемии
Такие кровотечения возникают в промежутках между менструациями. Метроррагия также опасна развитием анемии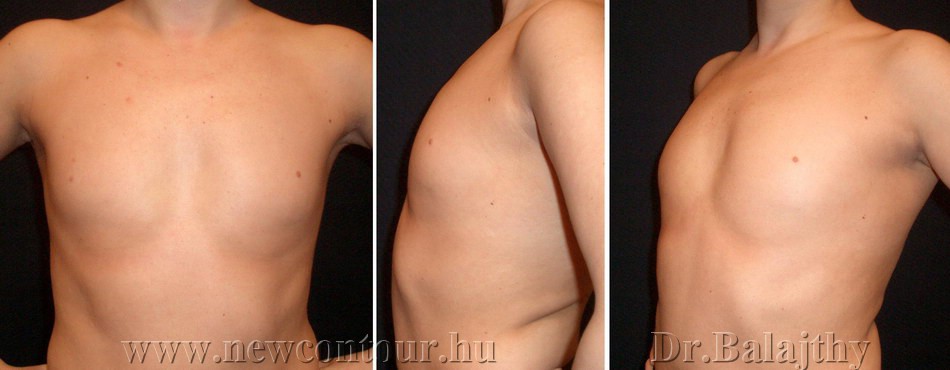 Аномальные кровотечения могут возникать на фоне миомы, эндометриоза, аденомиоза, полипов эндометрия и гиперплазии
Аномальные кровотечения могут возникать на фоне миомы, эндометриоза, аденомиоза, полипов эндометрия и гиперплазии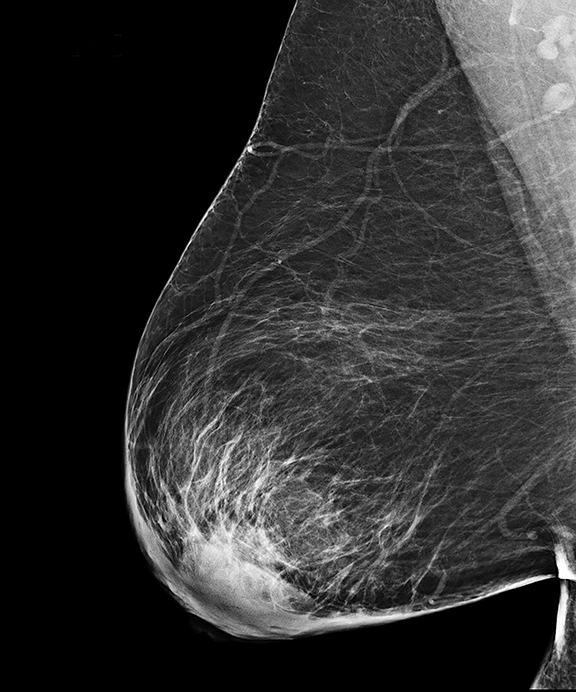 Даже в сложных случаях они позволяют избежать необходимости проведения оперативного вмешательства. При этом достигается выраженный оздоровительный эффект. При необходимости к лечению кровотечений подключаются не только гинекологи, но и другие узкие специалисты. Это позволяет добиться быстрого результата
Даже в сложных случаях они позволяют избежать необходимости проведения оперативного вмешательства. При этом достигается выраженный оздоровительный эффект. При необходимости к лечению кровотечений подключаются не только гинекологи, но и другие узкие специалисты. Это позволяет добиться быстрого результата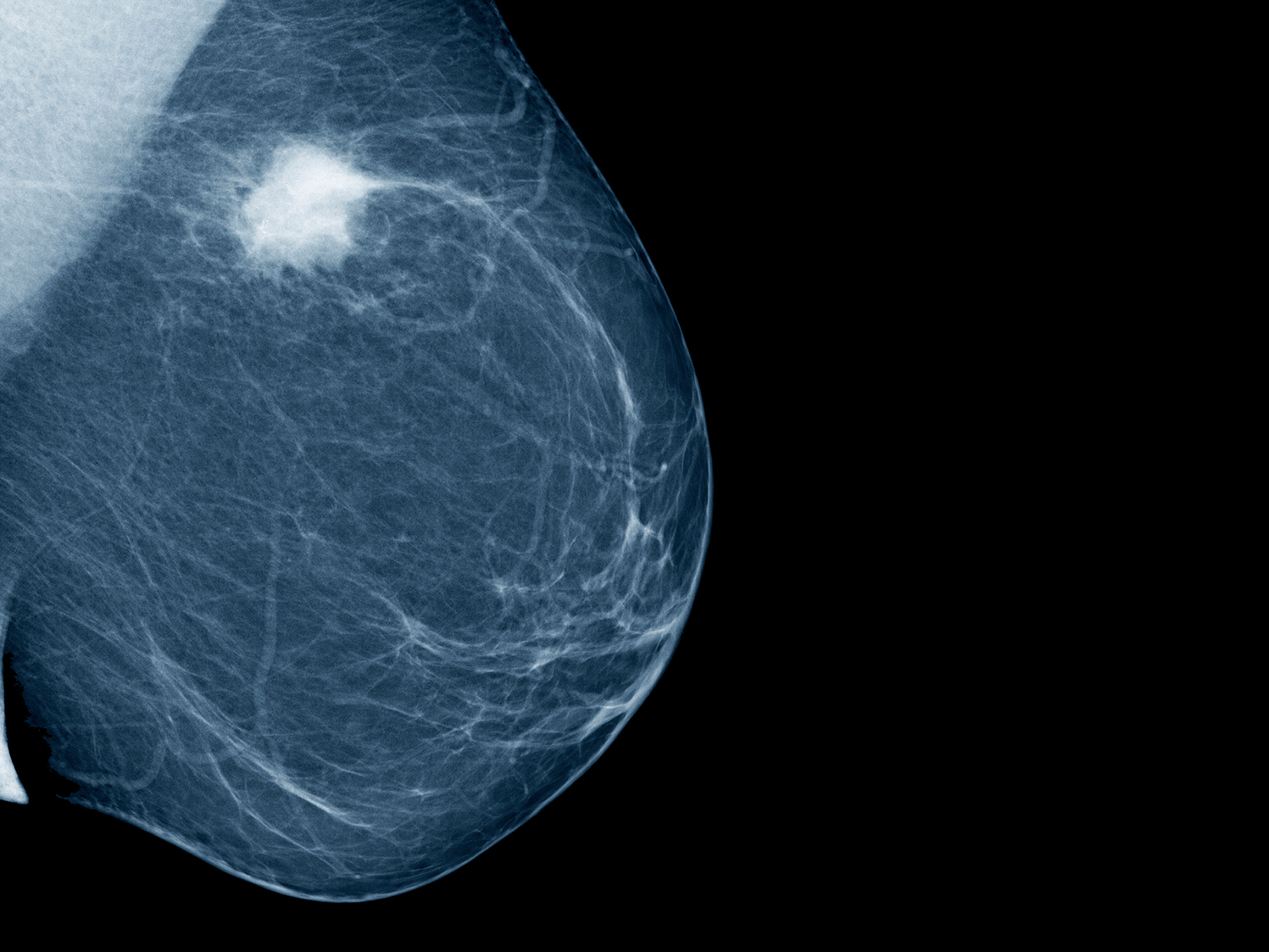
 Увеличенная киста сальной железы.
Увеличенная киста сальной железы. J Биол. неоплазия молочной железы. 2010;15(3):279–90. Эпублик 19.08.2010. пмид: 20717712; Центральный PMCID в PubMed: PMC2941079.
J Биол. неоплазия молочной железы. 2010;15(3):279–90. Эпублик 19.08.2010. пмид: 20717712; Центральный PMCID в PubMed: PMC2941079. пмид: 23211297.
пмид: 23211297. пмид:9630227.
пмид:9630227.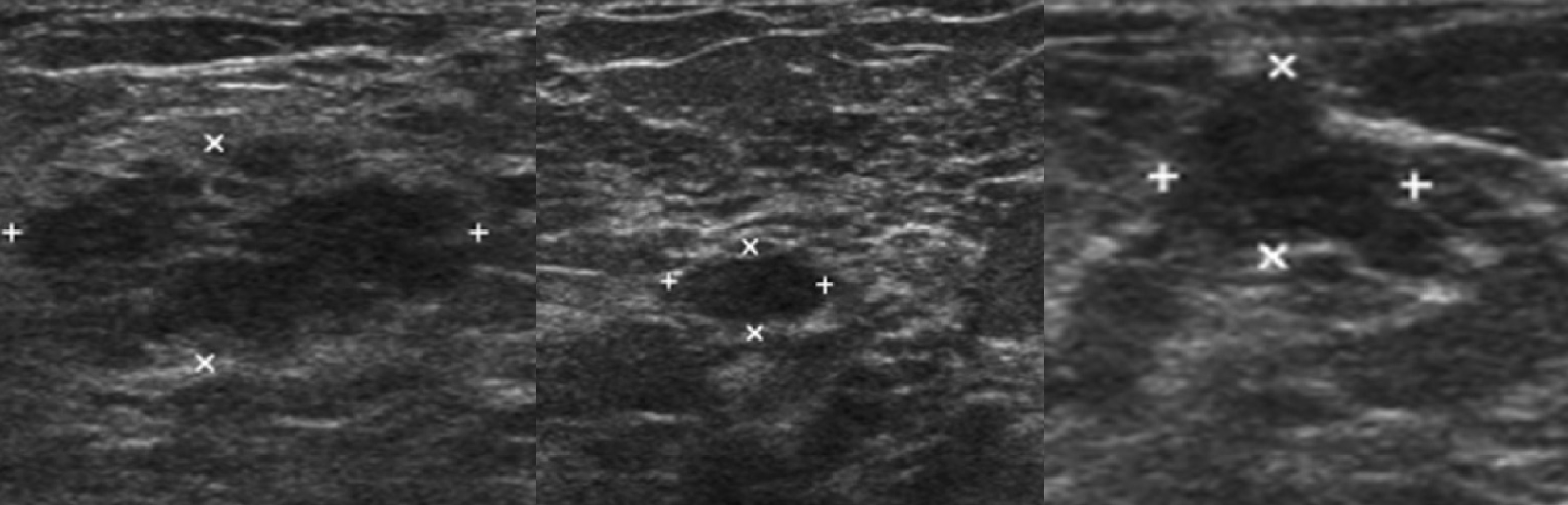 Klover PJ, Muller WJ, Robinson GW, Pfeiffer RM, Yamaji D, Hennighausen L. Потеря STAT1 из эпителия молочной железы мыши приводит к увеличению опухолевой нагрузки, вызванной Neu.Неоплазия. 2010;12(11):899–905. Эпублик 16.11.2010. 21076615; Центральный PMCID в PubMed: PMC2978912. пмид:21076615
Klover PJ, Muller WJ, Robinson GW, Pfeiffer RM, Yamaji D, Hennighausen L. Потеря STAT1 из эпителия молочной железы мыши приводит к увеличению опухолевой нагрузки, вызванной Neu.Неоплазия. 2010;12(11):899–905. Эпублик 16.11.2010. 21076615; Центральный PMCID в PubMed: PMC2978912. пмид:21076615 Опухолесупрессорная функция STAT1 при раке молочной железы. ЯКСТАТ. 2013;2(2):e23353. Эпб 2013/09/24. [пий]. пмид: 24058806; Центральный PMCID в PubMed: PMC3710319.
Опухолесупрессорная функция STAT1 при раке молочной железы. ЯКСТАТ. 2013;2(2):e23353. Эпб 2013/09/24. [пий]. пмид: 24058806; Центральный PMCID в PubMed: PMC3710319. пмид: 14973386.
пмид: 14973386.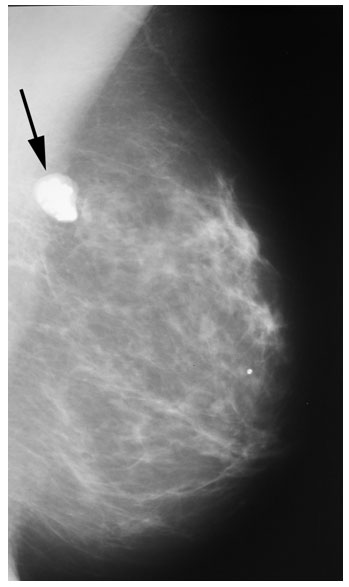 Ам Джей Патол. 2012;180(6):2249–56. Эпублик 2012/05/01. [пий]. пмид: 22542846; Центральный PMCID в PubMed: PMC3378916.
Ам Джей Патол. 2012;180(6):2249–56. Эпублик 2012/05/01. [пий]. пмид: 22542846; Центральный PMCID в PubMed: PMC3378916.
 [пий]. пмид: 23645984; Центральный PMCID в PubMed: PMC3623615.
[пий]. пмид: 23645984; Центральный PMCID в PubMed: PMC3623615. Эпублик 22.04.2009. пмид: 19381261; Центральный PMCID в PubMed: PMC2663844.
Эпублик 22.04.2009. пмид: 19381261; Центральный PMCID в PubMed: PMC2663844. Эпителиальная линия клеток молочной железы мыши, демонстрирующая нормальный морфогенез in vivo и функциональную дифференцировку in vitro. Proc Natl Acad Sci U S A. 1984;81(12):3756–60. Эпб 1984/06/01. пмид: 6587390; Центральный PMCID в PubMed: PMC345298.
Эпителиальная линия клеток молочной железы мыши, демонстрирующая нормальный морфогенез in vivo и функциональную дифференцировку in vitro. Proc Natl Acad Sci U S A. 1984;81(12):3756–60. Эпб 1984/06/01. пмид: 6587390; Центральный PMCID в PubMed: PMC345298. doi: S0092-8674(00)81289-1 [pii].пмид:8608598.
doi: S0092-8674(00)81289-1 [pii].пмид:8608598.
 , Данн Т.Б. Классификация опухолей молочной железы у мышей в различных группах Данна, включая недавно зарегистрированные типы. J Natl Cancer Inst. 1979; 62 (5): 1287–93. пмид:286104.
, Данн Т.Б. Классификация опухолей молочной железы у мышей в различных группах Данна, включая недавно зарегистрированные типы. J Natl Cancer Inst. 1979; 62 (5): 1287–93. пмид:286104. In Vitro Cell Dev Biol. 1989;25(5):409–18. Эпб 1989/05/01. пмид: 2732196.
In Vitro Cell Dev Biol. 1989;25(5):409–18. Эпб 1989/05/01. пмид: 2732196.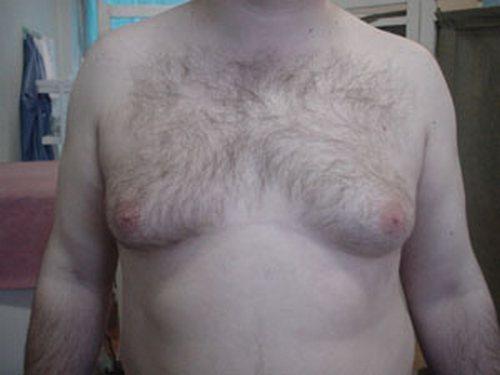 Дж.Взаимодействие между прогестероном и пролактином в развитии молочной железы и последствия для рака молочной железы. Мол Селл Эндокринол. 2012;357(1–2):101–7. Эпб 2011/09/29. [пий]. пмид: 21945475.
Дж.Взаимодействие между прогестероном и пролактином в развитии молочной железы и последствия для рака молочной железы. Мол Селл Эндокринол. 2012;357(1–2):101–7. Эпб 2011/09/29. [пий]. пмид: 21945475. doi: en.2004-1360 [pii] pmid:15604210.
doi: en.2004-1360 [pii] pmid:15604210. Критический преподобный Онког. 1998;9(2):99–106. Эпублик 11 февраля 1999 г. пмид:9973244.
Критический преподобный Онког. 1998;9(2):99–106. Эпублик 11 февраля 1999 г. пмид:9973244.